‘户太十一号’是西安市研究所采用沙地葡萄×河岸葡萄新选育的定位于酿酒兼染色品种,具有户太系列抗逆性强的优点[1]。‘户太十一号’葡萄酒经酒精发酵后品质不佳,通常会进行苹果酸-乳酸发酵(malolactic fermentation,MLF)[2],通过将苹果酸转化为乳酸,从而使葡萄酒口感更柔和[3-6],抑制微生物繁殖,增加葡萄酒稳定性[7-8]。
酒酒球菌(Oenococcus oeni)是用于MLF的乳酸菌(lactic acid bacteria,LAB)[9],而植物乳杆菌(Lactiplantibacillus plantarum)也能启动MLF,具有酿酒潜力,开始广泛用于MLF[10]。研究表明,葡萄酒经过植物乳杆菌发酵后,酯类物质的含量显著提高,且由于植物乳杆菌的代谢更复杂,增加了葡萄酒中游离挥发物的含量,可以保证更好地修饰葡萄酒的香气[11-12],使葡萄酒感官属性发生改变[13-14],从而进一步影响葡萄酒的风味[15]。葡萄酒通过MLF产生了乙酸酯、高级醇、脂肪酸和羰基化合物等多种挥发性香气成分,提高了葡萄酒果香和花香等系列香气表现[16-17]。研究发现,乳酸菌能够代谢乙醛增加聚合类花色苷含量,一定程度提高葡萄酒的颜色表现[5]。除此之外,大部分红葡萄酒均通过MLF提升葡萄酒的品质[18]。可见,两种不同类型的乳酸菌具有不同的应用潜力,对进一步挖掘本土酿酒菌株优势,提高‘户太十一号’葡萄酒酿酒品质有潜在应用价值。
本研究以‘户太十一号’葡萄品种为原料,采用植物乳杆菌(XJ25、XJA2)和酒酒球菌(SD-2a、144-46、PreAc450)进行苹果酸-乳酸发酵,对其发酵过程中L-苹果酸含量的变化及葡萄酒基础理化指标、颜色、酚类物质、挥发性风味物质及感官品质进行分析,并对其主要挥发性风味化合物进行主成分分析(principal component analysis,PCA)。以期探究提高‘户太十一号’葡萄酒品质,为新品种葡萄酒酿酒工艺的开发奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
供试酒样:‘户太十一号’原料(百粒质量206.64 g,可溶性固形物22.33%),经破碎后葡萄汁(出汁率77%,总糖221.85 g/L,总酸4.83 g/L,pH=3.81),酒精发酵(发酵温度25 ℃、时间为7 d)后用于MLF(酒精发酵结束未添加SO2,添加1 g/L的L(+)-酒石酸),最终供试酒样(pH=3.7,还原糖1.47 g/L,总酸5.74 g/L,挥发酸0.35 g/L,酒精度14.2%)能够进行后续MLF。
植物乳杆菌(Lactiplantibacillus plantarum)XJ25和XJA2:分离自新疆产区的赤霞珠葡萄酒[19]。酒酒球菌(Oenococcus oeni)SD-2a和144-46:分别分离自山东和宁夏产区的赤霞珠葡萄酒[20]。商业菌种酒酒球菌PreAc 450(对照菌):法国Laffort公司。
1.1.2 试剂
儿茶素、咖啡酸、槲皮素、没食子酸、4-甲基-2-戊醇(均为色谱纯):上海阿拉丁生化科技股份有限公司;吐温80、磷酸钾、柠檬酸氢二铵(均为分析纯):四川西陇化工有限公司;维生素B6、甲基纤维素、福林酚、对二甲氨基肉桂醛(p-dimethylaminocinnamaldehyde,p-DMACA)(均为分析纯):北京索莱宝科技有限公司。
1.1.3 培养基
酸性番茄培养基(acid tomato juice medium,ATB):酵母提取物5 g/L,蛋白胨10 g/L,MgSO4·7H2O 0.2 g/L,盐酸半胱氨酸0.5 g/L,MnSO4·4H2O 0.05 g/L,番茄汁(1∶4,V/V),调节pH 4.6。
MRS培养基:蛋白胨10 g/L,牛肉膏10 g/L,酵母提取物5 g/L,D-葡萄糖20 g/L,吐温80 1 mL,磷酸氢二钾2 g/L,柠檬酸氢二铵2 g/L,乙酸钠5 g/L,MgSO4·7H2O 0.2 g/L,MnSO2·4H2O 0.05 g/L,调节pH 6.0。
MLO-I液体培养基:MRS培养基50 g/L,D-葡萄糖20 g/L,D-果糖40g/L,L-苹果酸4g/L,0.1%吐温80,维生素B60.1mg/L,用1 mol/L的HCl调节pH值至4.6,添加体积分数5%的乙醇。
MLO-II液体培养基:在MLO-I培养基的基础上调pH至3.5,添加体积分数11%的乙醇。
培养基均在121 ℃高压蒸汽灭菌锅中灭菌15 min。
1.2 仪器与设备
UV-2450紫外分光光度计:日本岛津公司;Eppendorf Centrifuge 5417R1离心机:德国Eppendorf公司;120150-T230L气相色谱-质谱(gas chromatography-mass spectrometer,GC-MS)联用仪:美国菲尼根公司;Y1503031305葡萄酒全自动分析仪:西班牙BIOSYSTEMS公司。
1.3 方法
1.3.1 苹果酸-乳酸发酵葡萄酒样品的制备
植物乳杆菌和酒酒球菌菌株分别置于50mLMRS、50mL ATB液体培养基离心管中,37 ℃和26 ℃分别培养8 h和48 h至静止,20 ℃、8 000 r/min离心5 min,去除上清液,生理盐水洗涤2次,后将菌株进一步的预适应培养,转入20 ℃、MLO-I培养基中培养48 h,后转入MLO-II培养基中培养24 h。将预适应后的菌株于4 ℃、8 000 r/min离心5 min,用生理盐水洗涤2次。分别将6株菌株以4%的接种量(约107 CFU/mL)接入含250 mL葡萄酒的厌氧发酵瓶(330 mL,插入换气和取样的1 mL针管制成发酵装置)中,在20 ℃下进行厌氧发酵,发酵实验设置3个平行。以‘户太十一号’原酒作为对照(CK),并设置未接种处理组(SMLF)排除其他干扰,以接种不同乳酸菌的葡萄酒样品为处理组。每隔24 h检测苹果酸含量。本次发酵持续时间为7 d,以L-苹果酸含量低于0.1 g/L视为发酵结束,结束后于-4 ℃留存各发酵酒样,用于进一步分析。
1.3.2 L-苹果酸检测
在葡萄酒全自动分析仪上使用Biosystems试剂盒测量L-苹果酸含量。取0.6 mL葡萄酒,与等体积的无菌水混合,在金属浴中加热至80 ℃保持15 min,以灭活酶活性。然后将混合物12 000 r/min离心2 min,取上清液上机检测。
1.3.3 葡萄酒理化指标测定
pH、还原糖、总酸、挥发酸的测定:参考GB/T 15038—2006《葡萄酒、果酒通用分析方法》的斐林试剂法;总酸(以酒石酸计)、挥发酸含量的测定:酸碱滴定法;酒精度的测定:酒精计法;pH值的测定:采用pH计。
1.3.4 葡萄酒颜色及酚类物质的测定
颜色参数:CIELAB颜色空间法[21],0.45 μm尼龙膜过滤酒样,测定颜色参数明亮度L*值、红蓝色调a*值、黄绿色调b*值,计算色差(ΔE)、色度c*值及色调角h*值[21]。
总黄酮醇和酒石酸酯的测定:参考CLIFF M A等[22]方法并进行适当修改。取0.5 mL酒样用体积分数10%乙醇溶液稀释至5 mL后取稀释液0.25 mL,加入0.25 mL 0.1%HCl和4.55 mL 2%HCl。混匀并静置15 min后分别于波长320 nm和360 nm处测定样品吸光度值,分别以咖啡酸和槲皮素质量浓度(x)为自变量,以吸光度值(y)为因变量,获得总酒石酸酯标准曲线回归方程(y=0.001 2x+0.000 2,相关系数R2=0.999 2)和总黄酮醇标准曲线回归方程(y=0.000 2x+0.001 4,相关系数R2=0.999 2)计算含量,结果分别以咖啡酸和槲皮素计。
总酚:采用Folin-Ciocalten法测定[23],以没食子酸质量浓度(x)为自变量,以吸光度值(y)为因变量,获得标准曲线回归方程y=0.110 9x+0.011 4,相关系数R2=0.999 1,总酚含量结果以没食子酸计,计算公式如下:
式中:X为样品中总酚质量浓度,mg/L;ρ为没食子酸质量浓度,μg/L;10为酒样定容体积,mL;DF为酒样稀释倍数;V为酒样体积,mL。
总花色苷:采用pH示差法[14]测定,结果以二甲花翠素-3-O-葡萄糖苷计。
总单宁:采用甲基纤维法测定[24]。以儿茶素质量浓度(x)为自变量,吸光度值(y)为因变量,获得标准曲线回归方程y=0.012 2x-0.001 7,相关系数R2=0.999 8,总单宁含量结果以儿茶素计,计算公式如下:
A=A处理-A空白
X=A×DF
式中:X为样品中总单宁质量浓度,mg/L;A为儿茶素质量浓度,μg/L;DF为酒样稀释倍数。
总黄烷醇:采用p-DMACA法测定,并参考IVANOVA V等[25]的方法修改。取1 mL酒样用蒸馏水稀释至10 mL,取稀释液1 mL,加入7 mL蒸馏水和3 mL 1%的DMACA-甲醇溶液,混匀静置10 min后于波长640 nm条件下测定样品吸光度值。以儿茶素质量浓度(x)为自变量,以吸光度值(y)为因变量,获得标准曲线回归方程为(y=0.004 9x+0.038,相关系数R2=0.999 1)计算黄烷醇含量,结果以儿茶素计。
1.3.5 挥发性风味化合物的测定
挥发性风味化合物采用顶空固相微萃取-气相色谱-质谱联用(head space-solid phase microextraction-gas chromatography-massspectrometry,HS-SPME-GC-MS)测定[26-27]。
固相微萃取(solid-phase microextraction,SPME):15 mL的样品瓶中依次加入5 mL葡萄酒、1.0 g的NaCl和10 μL的4-甲基-2-戊醇(1.001 8 g/L)。在400 r/min、40 ℃条件下持续搅拌和加热混合物30 min后进行顶空萃取,将预处理好的样品插入顶空,在磁力搅拌器搅拌加热下提取30 min,随后将萃取头注入气相色谱进样器解吸8 min。
定性和定量:对比保留时间、保留指数,查询美国国家标准技术研究所(national institute of standards and technology,NIST)2020谱库对挥发性化合物进行定性。定量分析采用内标-标准曲线法,内标物为4-甲基-2-戊醇,将各挥发性物质成分标准品配为混标并绘制标准曲线,对于没有标准品的化合物,用结构相似的标准曲线计算,计算公式如下:
C=kx+b
式中:C为香气物质的质量浓度,μg/L;x为标准品峰面积与内标物面积的比值。
气味活性值(odor activity values,OAV)计算公式如下:
式中:C为酒样中该香气物质质量浓度,μg/L,t为该化合物的气味阈值,μg/L。
1.3.6 感官品评
感官分析采用定量描述分析(quantitative descriptive analysis,QDA)法[28]。品酒小组由13名经过培训的专业成员组成,包括7名男性和6名女性,年龄在20岁~25岁之间。酒样随机分配3位数的编码,向品鉴成员提供了14种味觉描述符和7种气味描述符,创建0~9的线性评分表,其中“0”表示完全没有,“9”表示最强。
1.3.7 数据处理与统计分析
采用Excel 365进行数据处理,SPSS 18.0对数据进行单因素方差分析,利用Duncan检验对数据进行差异显著性分析(P<0.05,差异显著)。采用Origin 2021、GraphPad Prism 9.0作图。
2 结果与分析
2.1 发酵过程中L-苹果酸含量的变化
由图1可知,当发酵时间为0~48 h,苹果酸含量快速下降,当发酵时间>48 h,苹果酸含量呈平稳下降趋势,当发酵结束时,所选酒样苹果酸含量均<0.1 g/L,均完成MLF。因此,所选菌株均能够完全代谢‘户太十一号’葡萄酒中的L-苹果酸完成MLF。
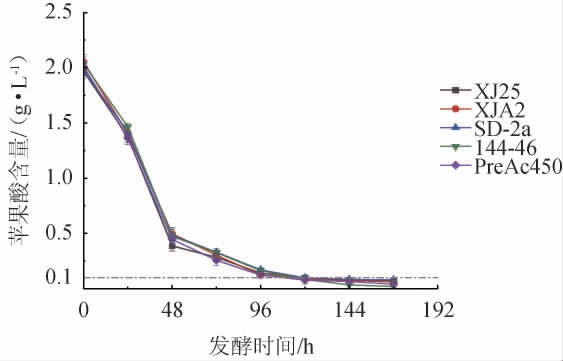
图1 植物乳杆菌和酒酒球菌在苹果酸-乳酸发酵过程中L-苹果酸的变化
Fig.1 Changes of L-malic acid contents during the malic-lactic fermentation with Lactiplantibacillus plantarum and Oenococcus oeni
2.2 MLF对葡萄酒理化指标的影响
‘户太十一号’酒样MLF前后理化指标检测结果见表1。
表1 酒样苹果酸-乳酸发酵前后基本理化指标检测结果
Table 1 Determination results of basic physicochemical indexes in'Hu Tai No.11' wine samples before and after malic-lactic fermentation
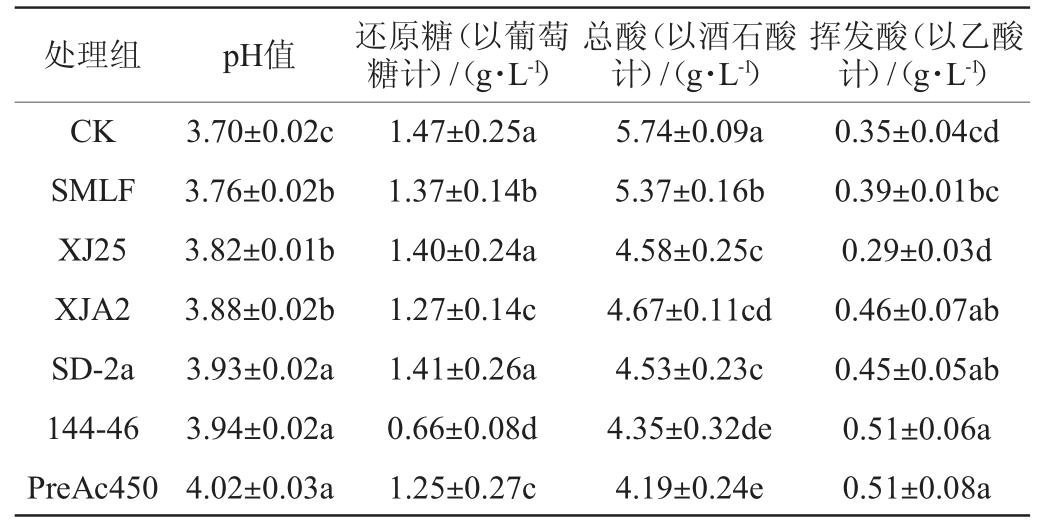
注:同列不同字母表示差异显著(P<0.05)。
处理组 pH值 还原糖(以葡萄糖计)/(g·L-1)总酸(以酒石酸计)/(g·L-1)挥发酸(以乙酸计)/(g·L-1)CK SMLF XJ25 XJA2 SD-2a 144-46 PreAc450 3.70±0.02c 3.76±0.02b 3.82±0.01b 3.88±0.02b 3.93±0.02a 3.94±0.02a 4.02±0.03a 1.47±0.25a 1.37±0.14b 1.40±0.24a 1.27±0.14c 1.41±0.26a 0.66±0.08d 1.25±0.27c 5.74±0.09a 5.37±0.16b 4.58±0.25c 4.67±0.11cd 4.53±0.23c 4.35±0.32de 4.19±0.24e 0.35±0.04cd 0.39±0.01bc 0.29±0.03d 0.46±0.07ab 0.45±0.05ab 0.51±0.06a 0.51±0.08a
由表1可知,与CK和SMLF相比,所选菌株发酵可以提高葡萄酒的pH值,显著降低葡萄酒的总酸含量(P<0.05),其中,发酵结束时,菌株144-46发酵酒样的还原糖含量最低(0.66 g/L);除菌株XJ25外,其他菌株发酵酒样挥发酸都有一定升高,但6株菌株发酵后的葡萄酒的挥发酸含量均远低于国家标准GB/T 15037—2006《葡萄酒》的要求(1.2 g/L)。
2.3 MLF对葡萄酒颜色的影响
颜色对葡萄酒的外观起重要作用[29]。L*值代表明亮度,a*值代表红蓝色调,b*值代表黄绿色调,c*值代表色度,h*值代表色调角,ΔE代表酒样与CK的色彩差异,当ΔE>3时,酒样颜色差异较大[30]。由表2可知,酒酒球菌MLF后葡萄酒的L*值高于植物乳杆菌。MLF后葡萄酒的a*值和c*值均呈降低趋势,而植物乳杆菌发酵后酒样的a*值和c*值降低幅度相对较小,最大程度保留了‘户太十一号’葡萄酒的红色调和色度。与CK相比,菌株XJ25的b*值下降幅度最大(P<0.05),葡萄酒黄色调最弱,这是葡萄酒颜色提升的标志。而酒样SMLF的葡萄酒b*值显著提高(P<0.05),偏向于黄色调,降低了葡萄酒的颜色表现[31]。与酒酒球菌相比,植物乳杆菌发酵后的葡萄酒ΔE均<3,表明葡萄酒颜色与‘户太十一号’原酒的颜色整体相似。综上所述,与酒酒球菌相比,植物乳杆菌尤其是菌株XJ25发酵对‘户太十一号’葡萄酒的颜色表现有更加积极的影响。
表2 “户太十一号”苹果酸-乳酸发酵前后酒样的颜色参数
Table 2 Changes of color parameters of 'Hu Tai No.11' wine samples before and after malic-lactic fermentation
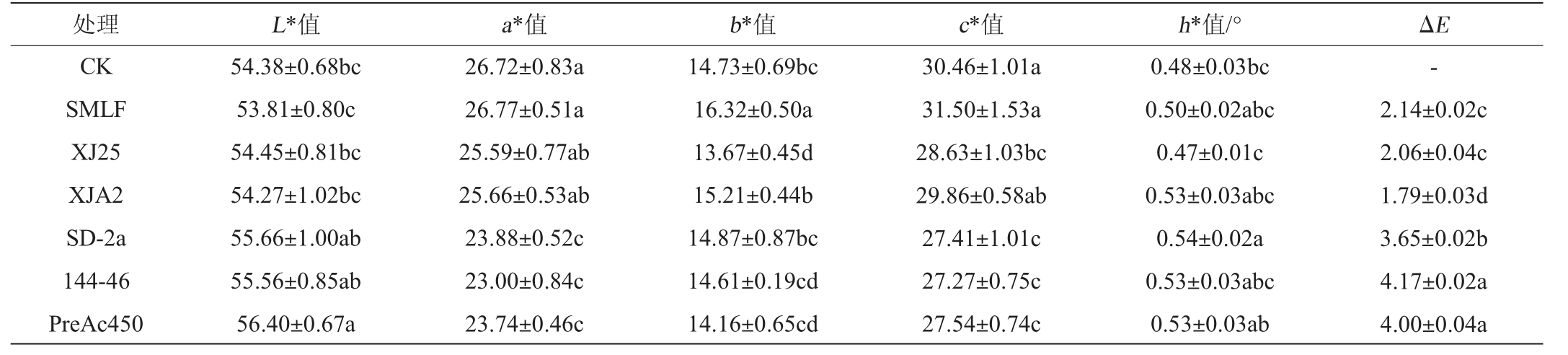
注:同列不同小写字母表示差异显著(P<0.05);“-”代表以CK酒样为参照。
处理 L*值 a*值 b*值 c*值 h*值/° ΔE CK SMLF XJ25 XJA2 SD-2a 144-46 PreAc450 54.38±0.68bc 53.81±0.80c 54.45±0.81bc 54.27±1.02bc 55.66±1.00ab 55.56±0.85ab 56.40±0.67a 26.72±0.83a 26.77±0.51a 25.59±0.77ab 25.66±0.53ab 23.88±0.52c 23.00±0.84c 23.74±0.46c 14.73±0.69bc 16.32±0.50a 13.67±0.45d 15.21±0.44b 14.87±0.87bc 14.61±0.19cd 14.16±0.65cd 30.46±1.01a 31.50±1.53a 28.63±1.03bc 29.86±0.58ab 27.41±1.01c 27.27±0.75c 27.54±0.74c 0.48±0.03bc 0.50±0.02abc 0.47±0.01c 0.53±0.03abc 0.54±0.02a 0.53±0.03abc 0.53±0.03ab-2.14±0.02c 2.06±0.04c 1.79±0.03d 3.65±0.02b 4.17±0.02a 4.00±0.04a
2.4 MLF对‘户太十一号’葡萄酒酚类物质的影响
酒样MLF前后酚类物质含量变化见图2。单宁的存在赋予葡萄酒聚合感和单宁质感,而黄烷醇通过不同的聚合度影响葡萄酒的涩味呈现[6,32]。葡萄酒中总黄酮醇和总酒石酸酯作为共色素,能够促进葡萄酒的颜色稳定性[33],花色苷是红葡萄酒中主要的呈色物质[34]。
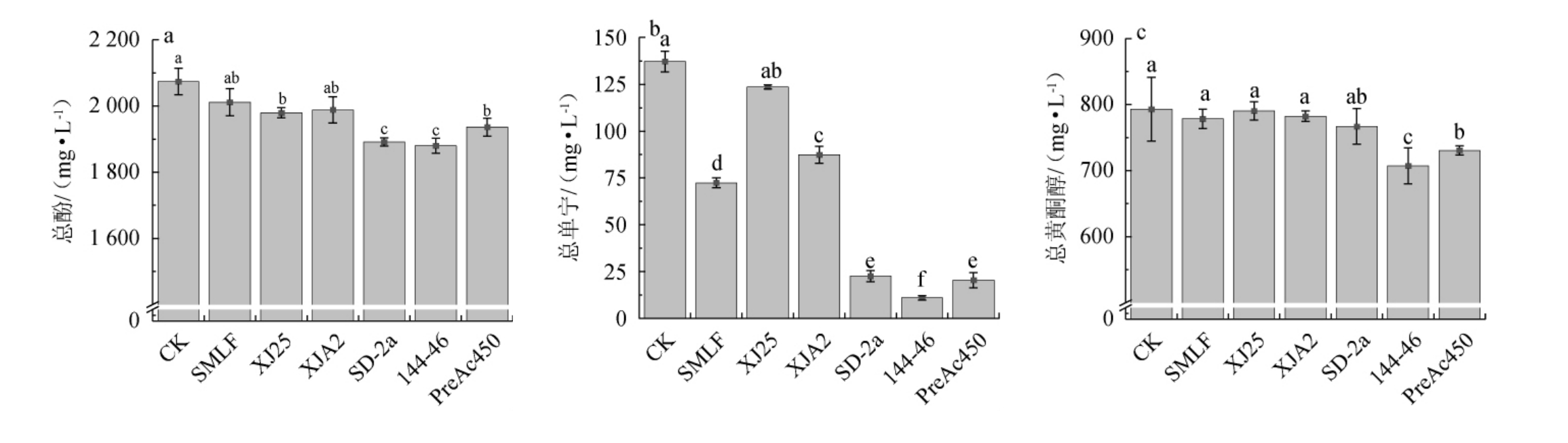
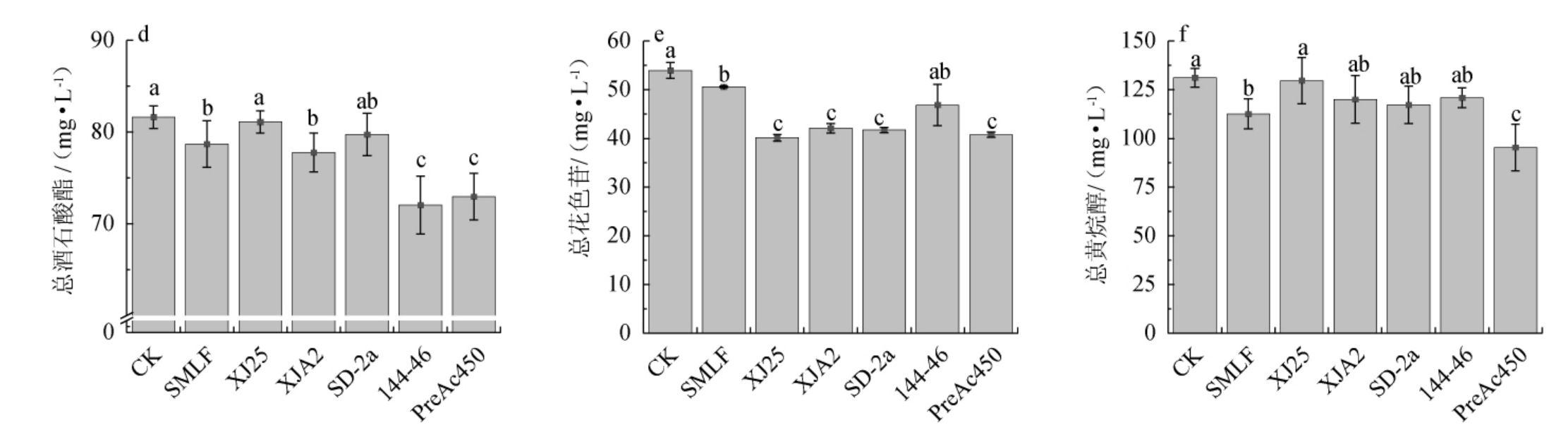
图2 酒样苹果酸-乳酸发酵前后酚类物质含量变化
Fig.2 Changes in phenolics contents in 'Hu Tai No.11' wine samples before and after malic-lactic fermentation
由图2(a)和(b)可知,植物乳杆菌MLF后葡萄酒样品中总酚和总单宁的含量高于酒酒球菌,其中,菌株XJ25发酵后含量分别为1 979.41 mg/L和123.61 mg/L。
由图2(c)和(d)可知,菌株XJ25、XJA2发酵酒样总黄酮醇及总酒石酸酯含量分别为790.50 mg/L和81.11 mg/L,显著高于菌株144-46、PreAc450(P<0.05),保持了‘户太十一号’葡萄酒的颜色稳定性。
由图2(e)可知,菌株144-46发酵的酒样总花色苷显著高于菌株MLF处理组(P<0.05),因此,有利于发酵后‘户太十一号’葡萄酒的颜色表现。
由图2(f)可知,除菌株PreAc450外,其余菌株MLF后酒中的总黄烷醇含量与CK无显著差异(P>0.05)。因此,所选菌株XJ25和144-46更有利于维持‘户太十一号’葡萄酒的色泽。
2.5 MLF对‘户太十一号’葡萄酒挥发性风味物质的影响
不同酒样挥发性风味物质含量检测结果见表3。由表3可知,不同酒样中共检出59种挥发性风味化合物,其中酯类18种,高级醇17种,脂肪酸9种,醛酮6种,萜烯类物质8种和1种酚类物质。
表3 不同酒样挥发性风味物质含量检测结果
Table 3 Determination results of volatile flavor substances contents in different 'Hu Tai No.11' wine samples

香气物质 气味描述[35,41-47] 阈值/(μg·L-1)[36-37,41,44-53] OAV 质量浓度/(mg·L-1)CK SMLF XJ25 XJA2 SD-2a 144-46 PreAc450酯类乙酸乙酯乙酸己酯乙酸异丁酯乙酸香叶酯2-甲基丁酸乙酯3-甲基丁酸乙酯2-甲基丙酸乙酯己酸乙酯2-羟基丙酸乙酯辛酸乙酯癸酸乙酯十二烯酸乙酯棕榈酸乙酯壬酸乙酯丁二酸二乙酯辛酸甲酯水杨酸甲酯己酸异戊酯小计高级醇类异丁醇异戊醇1-戊醇菠萝、茴香、香脂苹果、樱桃、梨生青味、水果味水果味Nd水果味Nd草莓、苹果、香蕉Nd甜味、花香、果香果味、脂肪Nd甜味、黄油、脂肪水果、玫瑰,蜡味水果味柑橘味冬青叶味果香、绿色植物7 500 670 6 000 150 Nd 0.1 Nd 14 Nd 580 200 Nd 1 500 1 200 200 200 40 1 400 320>1.0>1.0>1.0>1.0 Nd>1.0 Nd>1.0 Nd>1.0>1.0 Nd>1.0>1.0>1.0>1.0>1.0>0.1 115.58±13.38b 0.83±0.10a 6.24±0.60a 1.43±0.10ab 124.48±13.11ab 0.33±0.02bc 5.16±1.46a 1.13±0.27c----0.20±0.20a 21.15±1.89a 22.14±2.67c 62.03±2.61ab 80.68±10.22bc 18.89±0.67a 34.84±4.03ab 2.32±0.08a 6.74±0.28c 0.74±0.01a 1.56±0.01a 1.25±0.04a 376.61±36.88ab 0.37±0.08a 12.99±1.14b 31.71±3.97c 39.70±6.24d 51.48±1.70e 12.79±1.67b 32.2±2.73b 1.64±0.29b 10.3±0.01ab 0.66±0.06b 0.82±0.08b 1.15±0.32ab 326.92±33.15b杂醇味甜味、酒精、指甲油香酯、苦杏仁40 000 30 000 64 000<0.1>0.1>1.0 0.74±0.03b 12.78±1.19ab 67.63±3.32a 146.39±15.21ab 0.48±0.02b 6.45±0.63a 1.37±0.09abc 0.75±0.81a 0.06±0.05a 0.45±0.04a 16.26±1.44ab 59.99±11.45b 54.49±4.20bc 78.42±7.03bcd 15.59±0.19ab 36.92±0.33ab 0.23±0.00c 9.82±1.84b 0.09±0.01c 0.91±0.12b 0.13±0.01c 428.79±43.43ab 130.45±17.93ab 0.31±0.08bc 5.47±1.92a 1.26±0.08bc 0.11±0.12ab 0.04±0.02ab 0.54±0.47a 12.61±2.47b 48.09±6.69b 39.73±7.79d 68.07±5.73cd 13.04±1.46b 31.32±7.09b 1.36±0.43b 9.48±0.97b 0.67±0.07b 0.84±0.12b 1.00±0.10b 364.38±53.70ab 142.43±25.37ab 0.32±0.21bc 5.92±1.10a 1.48±0.10a 0.32±0.29ab-0.42±0.15a 15.96±3.46ab 55.13±7.78b 69.20±6.09a 95.09±6.79a 15.92±2.24ab 34.88±7.00ab 0.27±0.04c 9.30±1.96b 0.11±0.03c 0.99±0.19b 0.13±0.02c 447.87±52.34a 147.94±8.06ab 0.26±0.03c 6.29±0.32a 1.37±0.03abc 0.20±0.26ab 0.03±0.03ab 0.51±0.28a 15.04±0.02b 88.26±3.05a 48.65±0.89cd 66.19±3.10d 14.81±1.80ab 35.95±3.18ab 0.21±0.05c 10.41±1.91a 0.08±0.00c 0.96±0.07b 0.12±0.01c 437.28±23.07a 156.36±20.27a 0.32±0.09bc 6.92±0.47a 1.43±0.12ab 0.73±0.55ab 0.01±0.01b 0.56±0.32a 15.74±2.77ab 52.88±2.17b 59.43±13.4abc 89.10±8.81ab 16.16±3.08ab 43.98±7.86a 0.24±0.04c 11.04±1.72a 0.09±0.01c 1.03±0.06b 0.12±0.02c 456.14±61.74a 0.82±0.03ab 12.4±0.67b 40.81±4.20cd 0.92±0.06a 14.15±0.47a 50.04±4.47b 0.79±0.03ab 12.33±0.89b 36.07±4.22d 0.80±0.06ab 12.48±0.79b 48.09±2.97b 0.85±0.06ab 13.34±1.05ab 45.20±0.59bc 0.92±0.12a 14.26±0.70a 47.86±3.32b
续表
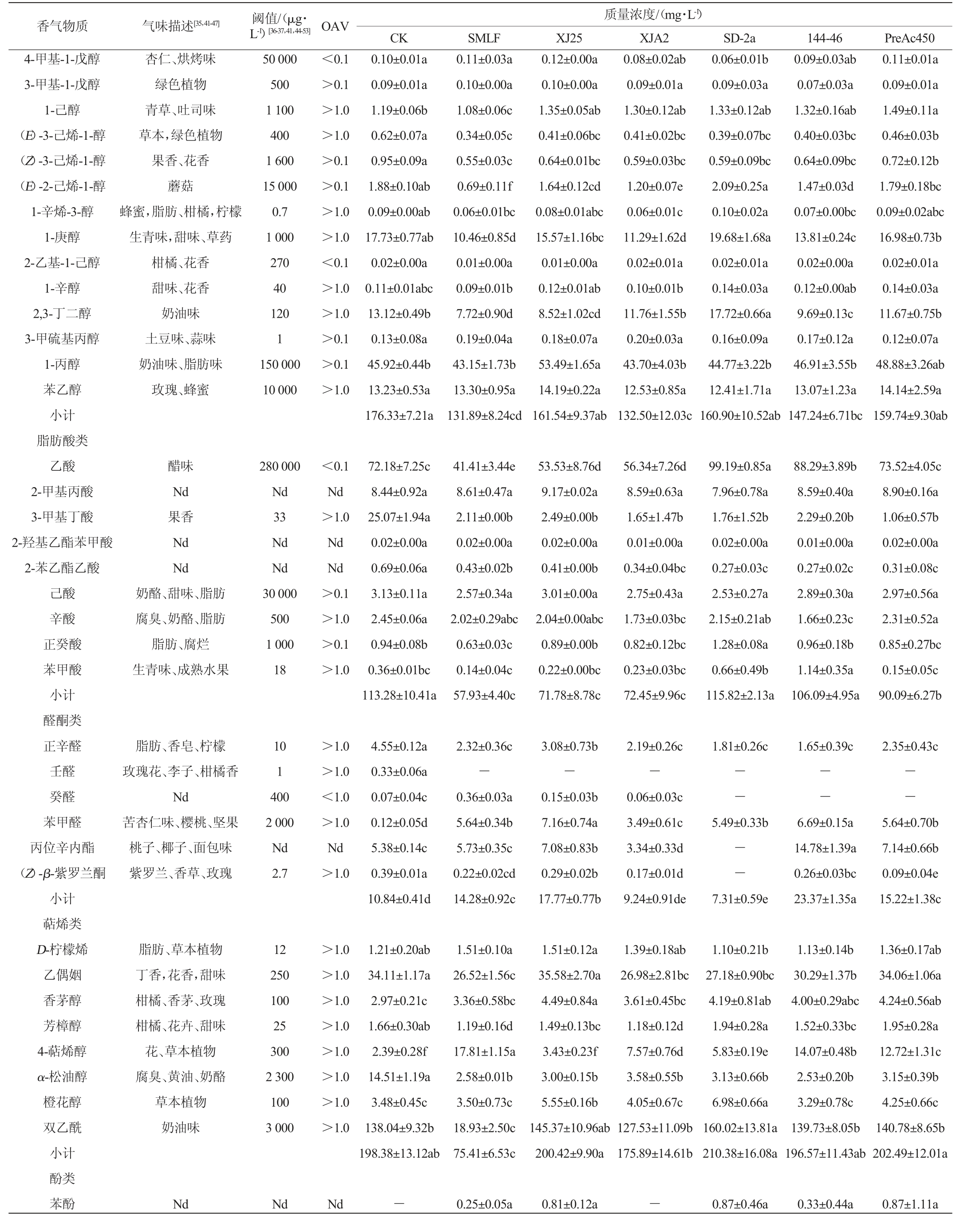
注:“Nd”表示未查阅到相关资料;“-”表示未检出该化合物;同一行不同小写字母表示具有显著性差异(P<0.05)。
香气物质 气味描述[35,41-47] 阈值/(μg·L-1)[36-37,41,44-53] OAV 质量浓度/(mg·L-1)CK SMLF XJ25 XJA2 SD-2a 144-46 PreAc450 4-甲基-1-戊醇3-甲基-1-戊醇1-己醇(E)-3-己烯-1-醇(Z)-3-己烯-1-醇(E)-2-己烯-1-醇1-辛烯-3-醇1-庚醇2-乙基-1-己醇1-辛醇2,3-丁二醇3-甲硫基丙醇1-丙醇苯乙醇小计脂肪酸类乙酸2-甲基丙酸3-甲基丁酸2-羟基乙酯苯甲酸2-苯乙酯乙酸己酸辛酸正癸酸苯甲酸小计醛酮类正辛醛壬醛癸醛苯甲醛丙位辛内酯(Z)-β-紫罗兰酮小计萜烯类D-柠檬烯乙偶姻香茅醇芳樟醇4-萜烯醇α-松油醇橙花醇双乙酰小计酚类苯酚杏仁、烘烤味绿色植物青草、吐司味草本,绿色植物果香、花香蘑菇蜂蜜,脂肪、柑橘,柠檬生青味,甜味、草药柑橘、花香甜味、花香奶油味土豆味、蒜味奶油味、脂肪味玫瑰、蜂蜜50 000 500 1 100 400 1 600 15 000 0.7 1 000 270 40 120 1 150 000 10 000<0.1>0.1>1.0>1.0>0.1>0.1>1.0>1.0<0.1>1.0>1.0>0.1>0.1>1.0 0.10±0.01a 0.09±0.01a 1.19±0.06b 0.62±0.07a 0.95±0.09a 1.88±0.10ab 0.09±0.00ab 17.73±0.77ab 0.02±0.00a 0.11±0.01abc 13.12±0.49b 0.13±0.08a 45.92±0.44b 13.23±0.53a 176.33±7.21a 0.11±0.03a 0.10±0.00a 1.08±0.06c 0.34±0.05c 0.55±0.03c 0.69±0.11f 0.06±0.01bc 10.46±0.85d 0.01±0.00a 0.09±0.01b 7.72±0.90d 0.19±0.04a 43.15±1.73b 13.30±0.95a 131.89±8.24cd醋味Nd果香Nd Nd奶酪、甜味、脂肪腐臭、奶酪、脂肪脂肪、腐烂生青味、成熟水果280 000 Nd 33 Nd Nd 30 000 500 1 000 18<0.1 Nd>1.0 Nd Nd>0.1>1.0>0.1>1.0 72.18±7.25c 8.44±0.92a 25.07±1.94a 0.02±0.00a 0.69±0.06a 3.13±0.11a 2.45±0.06a 0.94±0.08b 0.36±0.01bc 113.28±10.41a 0.12±0.00a 0.10±0.00a 1.35±0.05ab 0.41±0.06bc 0.64±0.01bc 1.64±0.12cd 0.08±0.01abc 15.57±1.16bc 0.01±0.00a 0.12±0.01ab 8.52±1.02cd 0.18±0.07a 53.49±1.65a 14.19±0.22a 161.54±9.37ab 0.08±0.02ab 0.09±0.01a 1.30±0.12ab 0.41±0.02bc 0.59±0.03bc 1.20±0.07e 0.06±0.01c 11.29±1.62d 0.02±0.01a 0.10±0.01b 11.76±1.55b 0.20±0.03a 43.70±4.03b 12.53±0.85a 132.50±12.03c 0.06±0.01b 0.09±0.03a 1.33±0.12ab 0.39±0.07bc 0.59±0.09bc 2.09±0.25a 0.10±0.02a 19.68±1.68a 0.02±0.01a 0.14±0.03a 17.72±0.66a 0.16±0.09a 44.77±3.22b 12.41±1.71a 160.90±10.52ab 0.09±0.03ab 0.07±0.03a 1.32±0.16ab 0.40±0.03bc 0.64±0.09bc 1.47±0.03d 0.07±0.00bc 13.81±0.24c 0.02±0.00a 0.12±0.00ab 9.69±0.13c 0.17±0.12a 46.91±3.55b 13.07±1.23a 147.24±6.71bc 0.11±0.01a 0.09±0.01a 1.49±0.11a 0.46±0.03b 0.72±0.12b 1.79±0.18bc 0.09±0.02abc 16.98±0.73b 0.02±0.01a 0.14±0.03a 11.67±0.75b 0.12±0.07a 48.88±3.26ab 14.14±2.59a 159.74±9.30ab 41.41±3.44e 8.61±0.47a 2.11±0.00b 0.02±0.00a 0.43±0.02b 2.57±0.34a 2.02±0.29abc 0.63±0.03c 0.14±0.04c 57.93±4.40c脂肪、香皂、柠檬玫瑰花、李子、柑橘香Nd苦杏仁味、樱桃、坚果桃子、椰子、面包味紫罗兰、香草、玫瑰10 1 400 2 000 Nd 2.7>1.0>1.0<1.0>1.0 Nd>1.0 4.55±0.12a 0.33±0.06a 0.07±0.04c 0.12±0.05d 5.38±0.14c 0.39±0.01a 10.84±0.41d 53.53±8.76d 9.17±0.02a 2.49±0.00b 0.02±0.00a 0.41±0.00b 3.01±0.00a 2.04±0.00abc 0.89±0.00b 0.22±0.00bc 71.78±8.78c 56.34±7.26d 8.59±0.63a 1.65±1.47b 0.01±0.00a 0.34±0.04bc 2.75±0.43a 1.73±0.03bc 0.82±0.12bc 0.23±0.03bc 72.45±9.96c 99.19±0.85a 7.96±0.78a 1.76±1.52b 0.02±0.00a 0.27±0.03c 2.53±0.27a 2.15±0.21ab 1.28±0.08a 0.66±0.49b 115.82±2.13a 88.29±3.89b 8.59±0.40a 2.29±0.20b 0.01±0.00a 0.27±0.02c 2.89±0.30a 1.66±0.23c 0.96±0.18b 1.14±0.35a 106.09±4.95a 73.52±4.05c 8.90±0.16a 1.06±0.57b 0.02±0.00a 0.31±0.08c 2.97±0.56a 2.31±0.52a 0.85±0.27bc 0.15±0.05c 90.09±6.27b 2.32±0.36c-0.36±0.03a 5.64±0.34b 5.73±0.35c 0.22±0.02cd 14.28±0.92c脂肪、草本植物丁香,花香,甜味柑橘、香茅、玫瑰柑橘、花卉、甜味花、草本植物腐臭、黄油、奶酪草本植物奶油味12 250 100 25 300 2 300 100 3 000>1.0>1.0>1.0>1.0>1.0>1.0>1.0>1.0 1.21±0.20ab 34.11±1.17a 2.97±0.21c 1.66±0.30ab 2.39±0.28f 14.51±1.19a 3.48±0.45c 138.04±9.32b 198.38±13.12ab 3.08±0.73b-0.15±0.03b 7.16±0.74a 7.08±0.83b 0.29±0.02b 17.77±0.77b 2.19±0.26c-0.06±0.03c 3.49±0.61c 3.34±0.33d 0.17±0.01d 9.24±0.91de 1.81±0.26c 1.65±0.39c 2.35±0.43c------5.49±0.33b--7.31±0.59e 6.69±0.15a 14.78±1.39a 0.26±0.03bc 23.37±1.35a 5.64±0.70b 7.14±0.66b 0.09±0.04e 15.22±1.38c 1.51±0.10a 26.52±1.56c 3.36±0.58bc 1.19±0.16d 17.81±1.15a 2.58±0.01b 3.50±0.73c 18.93±2.50c 75.41±6.53c Nd Nd Nd-1.51±0.12a 35.58±2.70a 4.49±0.84a 1.49±0.13bc 3.43±0.23f 3.00±0.15b 5.55±0.16b 145.37±10.96ab 200.42±9.90a 1.39±0.18ab 26.98±2.81bc 3.61±0.45bc 1.18±0.12d 7.57±0.76d 3.58±0.55b 4.05±0.67c 127.53±11.09b 175.89±14.61b 1.10±0.21b 27.18±0.90bc 4.19±0.81ab 1.94±0.28a 5.83±0.19e 3.13±0.66b 6.98±0.66a 160.02±13.81a 210.38±16.08a 1.13±0.14b 30.29±1.37b 4.00±0.29abc 1.52±0.33bc 14.07±0.48b 2.53±0.20b 3.29±0.78c 139.73±8.05b 196.57±11.43ab 1.36±0.17ab 34.06±1.06a 4.24±0.56ab 1.95±0.28a 12.72±1.31c 3.15±0.39b 4.25±0.66c 140.78±8.65b 202.49±12.01a 0.25±0.05a 0.81±0.12a-0.87±0.46a 0.33±0.44a 0.87±1.11a
酯类物质主要从浸渍过程中提取[35-36]。MLF后葡萄酒中酯类物质总含量与原酒CK并无显著性差异,但酒酒球菌发酵后酯类物质浓度一定程度高于植物乳杆菌。乙酸乙酯作为葡萄酒主要的香气成分,通过MLF后含量得到一定程度提高,其中菌株PreAc450发酵酒样显著(P<0.05),乙酸乙酯含量的提高增强了葡萄酒果香和香辛料香气表现[37]。2-甲基丁酸乙酯和3-甲基丁酸乙酯属于葡萄酒中支链脂肪酸乙酯,含量随着葡萄酒陈酿过程而增加,而葡萄酒经MLF后检测出该香气物质,可见MLF一定程度增强了葡萄酒的果香香气的表现[38]。
高级醇是葡萄酒发酵过程中的次级代谢物[39]。由表3可知,葡萄酒经菌株XJ25、SD-2a和PreAc450苹果酸-乳酸发酵后的高级醇含量与CK无显著差异(P>0.05),保留了葡萄酒香气的复杂性[40]。与CK相比,除菌株SD-2a和PreAc450外,其余菌株MLF后显著降低了(E)-2-己烯-1-醇的含量(P<0.05),这与WANG S Y等[11]的研究结果一致。与CK相比,菌株XJ25和PreAc450 发酵葡萄酒样中异丁醇和1-丙醇的含量显著提高(P<0.05),增加了葡萄酒的花香、奶油和化学药剂的气味[41]。
与CK相比,除菌株SD-2a外,MLF后的葡萄酒脂肪酸含量显著降低(P<0.05),可能是由于活性脂肪酸缩合成酮类[11,42]。相较于CK,植物乳杆菌发酵后的葡萄酒样中乙酸含量显著降低(P<0.05),保证了葡萄酒的质量。醛酮物质主要赋予葡萄酒花香,其中,菌株XJ25、PreAc 450和144-46显著提高了醛酮物质的含量(P<0.05),其中菌株144-46提升幅度最大,是CK的1.16倍。苯甲醛具有苦杏仁味、樱桃和坚果香,MLF可以显著增加其含量(P<0.05)。MLF后β-紫罗兰酮含量显著降低(P<0.05),但菌株XJ25MLF后葡萄酒样品中(Z)-β-紫罗兰酮的含量显著高于酒酒球菌SD-2a和PreAc450发酵葡萄酒(P<0.05),这也与WANG S Y等[11]的研究结果相符。
萜烯类物质在糖苷酶作用下转变为游离态化合物,赋予葡萄酒花香[40-42]。菌株XJ25和PreAc450发酵后葡萄酒中D-柠檬烯、双乙酰和乙偶姻与CK相比无显著性差异(P>0.05),但显著提高了香茅醇含量(P<0.05);此外,菌株XJ25和SD-2a显著提高了葡萄酒中橙花醇的含量(P<0.05);与植物乳杆菌相比,所选酒酒球菌发酵后显著提高葡萄酒中4-萜烯醇的含量(P<0.05);菌株SD-2a发酵后显著提高葡萄酒中双乙酰的含量(P<0.05),这可能由于柠檬酸裂解酶将葡萄酒中的柠檬酸转化为双乙酰[39,43]的原因。可见,通过MLF可显著影响‘户太十一号’葡萄酒萜烯类香气成分,增强了葡萄酒果香、花香和奶油类等香气表现[36,41]。综上可知,菌株XJ25在维持较高的酯类挥发性化合物的同时,降低了挥发性脂肪酸类物质,同时醛酮和萜烯类物质含量更高,提高了‘户太十一号’葡萄酒的香气表现。
2.6 MLF对‘户太十一号’葡萄酒的感官品质影响
由图3可知,‘户太十一号’葡萄酒经MLF后植物类香气强度降低,而果香、花香和香辛料等香气强度上升。植物乳杆菌发酵后葡萄酒的浓郁度和复杂性较好,其原因可能是具有较高的单宁、黄烷醇,其中菌株XJ25发酵后葡萄酒花香浓郁,且具有香辛料的香气,葡萄酒香气更复杂,酒体具有良好的协调性和余味。酒酒球菌144-46和SD-2a的果香丰富,但菌株SD-2a发酵酒样的香气有一定缺陷。可知,菌株XJ25具发酵酒样感官品质较好。
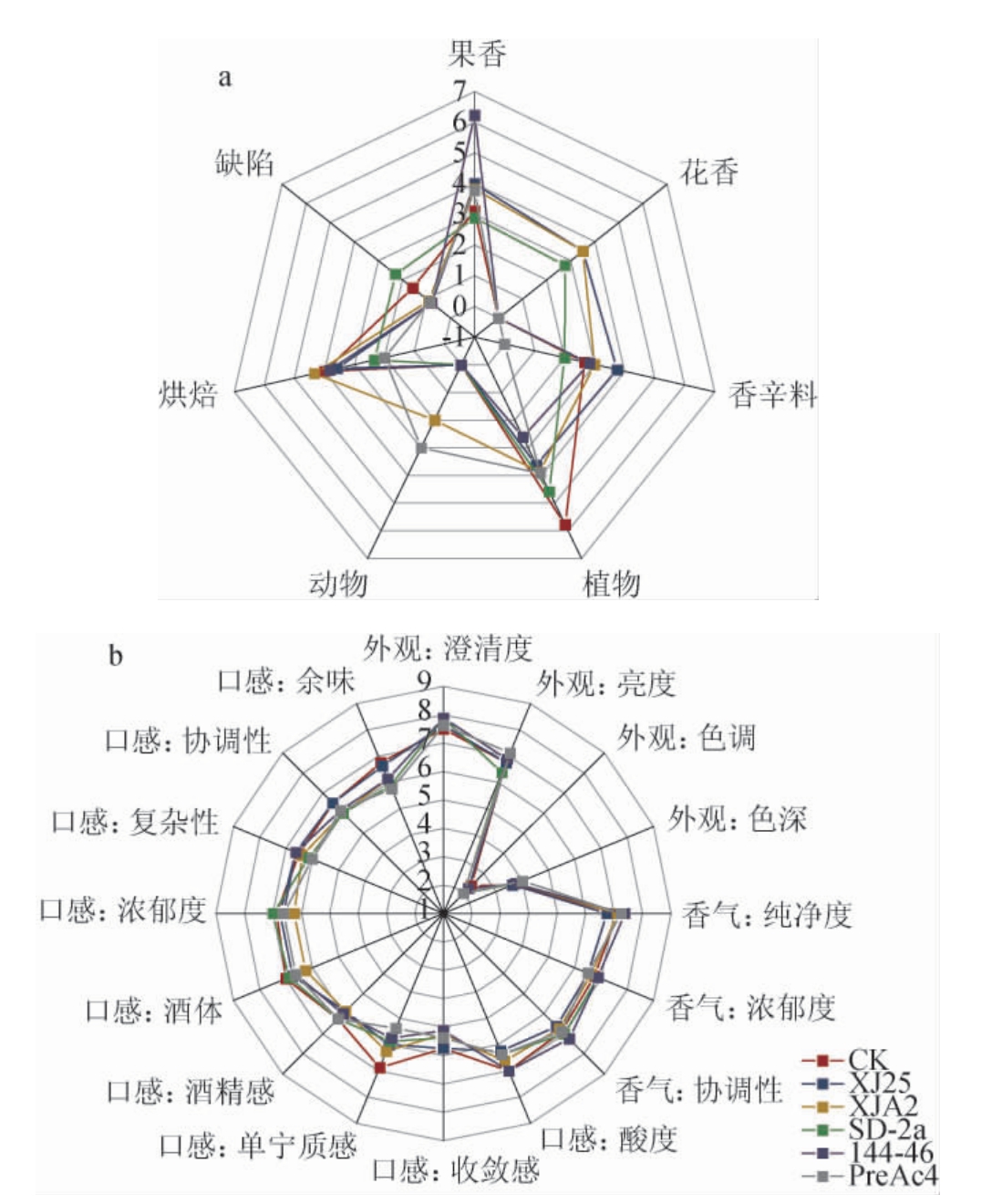
图3 不同葡萄酒样苹果酸-乳酸发酵前后的香气类型(a)和感官评价(b)雷达图
Fig.3 Aroma type (a) and sensory evaluation (b) radar charts of different 'Hu Tai No.11' wine before and after malic-lactic fermentation
2.7 主要挥发性风味化合物主成分分析
为进一步区别各发酵酒样香气的差异,以香气活力值(OAV)为依据,对具有显著贡献(OAV>1.0)的挥发性化合物及酒样进行主成分分析(PCA),结果见图4。由图4(a)可知,PC1和PC2方差贡献率分别为38.4%和27.8%,累计方差贡献率为66.2%。结果表明,大多数挥发性化合物位于PC1正向端。由图4(b)可知,不同菌株MLF后的酒样与CK和SMLF的空间距离较远,菌株144-46与XJ25发酵的酒样空间距离分布较近。其中,CK位于PC1的正向端和PC2的负向端,菌株SMLF和XJA2发酵的酒样与D-柠檬烯和癸醛空间分布较近,菌株144-46发酵的酒样位于PC1的负向端和PC2的正向端,与苯甲醛、丁二酸二乙酯、棕榈酸乙酯和3-甲基丁酸乙酯分布相近。相比之下,菌株XJ25、SD-2a和PreAc450酒样在PC1和PC2的正向端,与多数香气物质分布相近,因此葡萄酒的香气复杂性更高。基于主要挥发性风味化合物,PCA可以有效区分不同酒样。综上分析,MLF有利于改善‘户太十一号’葡萄酒的香气品质,其中菌株XJ25的表现更好。
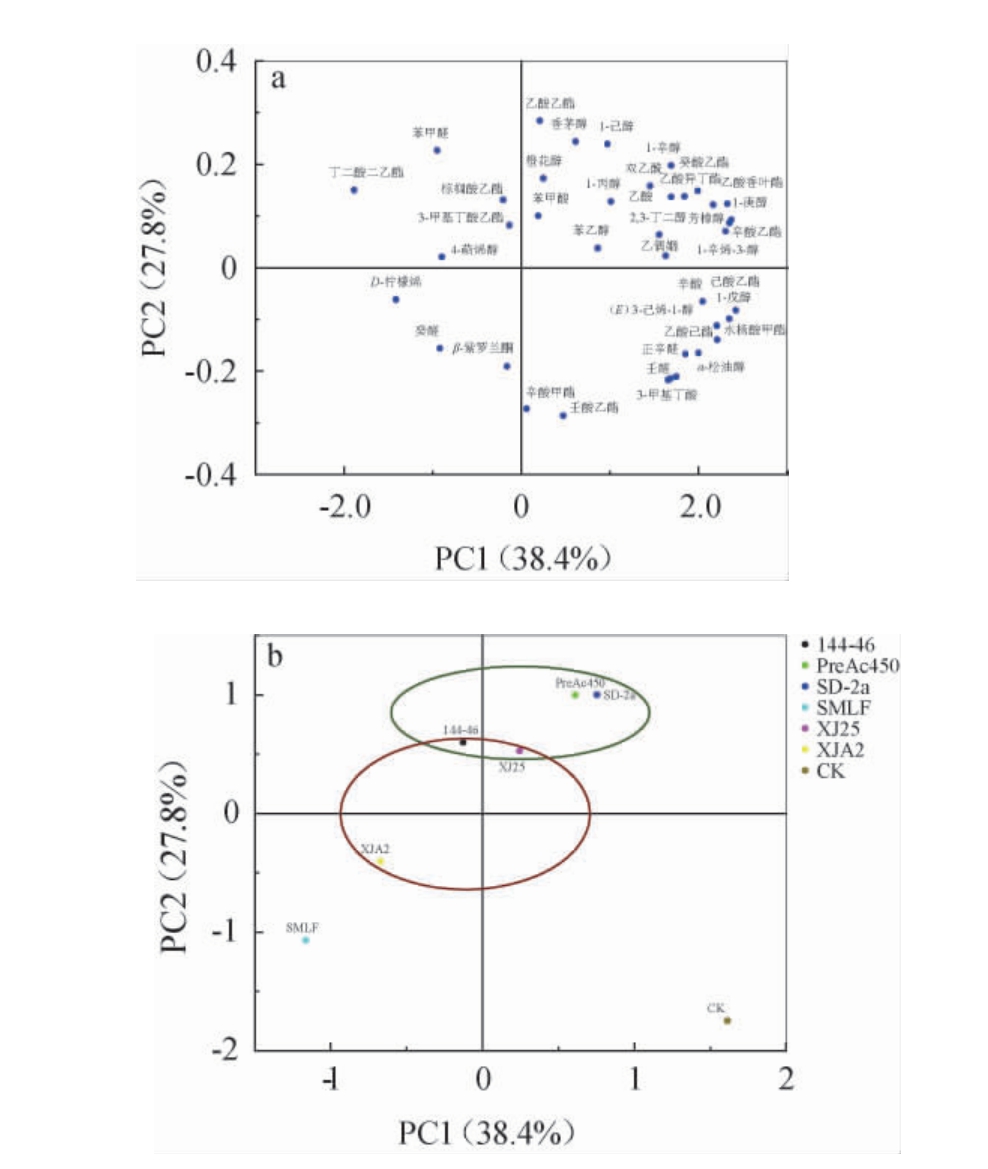
图4 不同挥发性风味化合物及酒样在前2个主成分上的香气得分图(a)和荷载图(b)
Fig.4 Aroma scores chart (a) and loadings chart (b) of different volatile flavor compounds and wine samples on the first two principal components
3 结论
本试验所选5株乳酸菌均能代谢L-苹果酸(含量<0.1 g/L)完成MLF;菌株XJ25发酵后最大程度保留了总单宁、总黄酮醇和总酒石酸酯等酚类物质的含量,其含量分别为123.61 mg/L、790.50 mg/L、81.11 mg/L;颜色差异小(ΔE<3),提高了‘户太十一号’葡萄酒的整体颜色表现和稳定性;其可显著提高醛酮类物质及香茅醇、橙花醇等萜烯类物质含量(P<0.05),含量分别达到17.77 mg/L,4.49 mg/L和5.55 mg/L;酒样花香浓郁,酒体具有良好的协调性和余味。通过PCA可以有效区分不同酒样,其中,菌株XJ25更有利于改善‘户太十一号’葡萄酒的香气品质。综合考虑,菌株XJ25对葡萄酒品质有更加积极的影响,有利于‘户太十一号’葡萄酒品质的提升。
[1]范国元,刘秀海,唐园园,等.户太系列葡萄品种在吐鲁番地区的引种表现[J].西北园艺(果树),2023(2):47-51.
[2]SUMBY K M, GRBIN P R, JIRANEK V.Implications of new research and technologies for malolactic fermentation in wine[J].Appl Microbiol Biot,2014,98(19):8111-8132.
[3]KRIEGER-WEBER S,HERAS J M,SUAREZ C.Lactobacillus plantarum,a new biological tool to control malolactic fermentation:A review and an outlook[J].Beverages,2020,6(2):23.
[4]MATTHEWS A,GRIMALDI A,WALKER M,et al.Lactic acid bacteria as a potential source of enzymes for Use in vinification[J].Appl Environ Microbiol,2004,70(10):5715-5731.
[5]WANG S Y,LI S Y,ZHAO H F,et al.Acetaldehyde released by Lactobacillus plantarum enhances accumulation of pyranoanthocyanins in wine during malolactic fermentation[J].Food Res Int,2018,108:254-263.
[6]WOJDYŁO A, SAMOTICHA J, CHMIELEWSKA J.The influence of different strains of Oenococcus oeni malolactic bacteria on profile of organic acids and phenolic compounds of red wine cultivars Rondo and Regent growing in a cold region[J].J Food Sci,2020,85(4):1070-1081.
[7]PRIOR K J,BAUER F F,DIVOL B.The utilisation of nitrogenous compounds by commercial non-Saccharomyces yeasts associated with wine[J].Food Microbiol,2019,79:75-84.
[8]STYGER G,PRIOR B,BAUER F F.Wine flavor and aroma[J].J Ind Microbiol Biot,2011,38(9):1145-1159.
[9]POZO-BAYÓN M A,G-ALEGRÍA E,POLO M C,et al.Wine volatile and amino acid composition after malolactic fermentation:effect of Oenococcus oeni and Lactobacillus plantarum starter cultures[J].J Agr Food Chem,2005,53(22):8729-8735.
[10]OLGUÍN N T,VALDÉS L H D,DELFEDERICO L,et al.Relative expression of stress-related genes during acclimation at low temperature of psychrotrophic Oenococcus oeni strains from Patagonian wine[J].World J Microb Biot,2019,35(1):5.
[11]WANG S Y,ZHU H Z,LAN Y B,et al.Modifications of phenolic compounds,biogenic amines,and volatile compounds in Cabernet Gernishct wine through malolactic fermentation by Lactobacillus plantarum and Oenococcus oeni[J].Fermentation,2020,6(1):15.
[12]IORIZZO M, TESTA B, LOMBARDI S J, et al.Selection and technological potential of Lactobacillus plantarum bacteria suitable for wine malolactic fermentation and grape aroma release[J].LWT-Food Sci Technol,2016,73:557-566.
[13]GUTIÉRREZ-ESCOBAR R, ALIAÑO-GONZÁLEZ M J, CANTOSVILLAR E.Wine polyphenol content and its influence on wine quality and properties:A review[J].Molecules,2021,26(3):718.
[14]DEVI A,KONERIRA AIYAPPAA A,WATERHOUSE A L.Adsorption and biotransformation of anthocyanin glucosides and quercetin glycosides by Oenococcus oeni and Lactobacillus plantarum in model wine solution[J].J Sci Food Agr,2020,100(5):2110-2120.
[15]LI Y H,WANG Y,FAN L L,et al.Assessment of β-D-glucosidase activity and bgl gene expression of Oenococcus oeni SD-2a[J].Plos One,2020,15(10):0240484.
[16]BARTOWSKY E, RESEARCH W. Oenococcus oeni and malolactic fermentation-moving into the molecular arena[J].Aust J Grape Wine Res,2010,11(2):174-187.
[17]SIEBERT T E,SMYTH H E,CAPONE D L,et al.Stable isotope dilution analysis of wine fermentation products by HS-SPME-GC-MS[J].Anal Bioanal Chem,2005,381(4):937-947.
[18]TOIT M D, ENGELBRECHT L, LERM E, et al. Lactobacillus: The next generation of malolactic fermentation starter cultures-an overview[J].Food Bioproc Tech,2011,4(6):876-906.
[19]卜潇,薛雪,程静,等.葡萄酒中植物乳杆菌苹果酸-乳酸发酵潜能评价[J].中国农业科学,2017,50(5):959-968.
[20]ZHAO H Y,LIU L X,PENG S,et al.Heterologous expression of argininosuccinate synthase from Oenococcus oeni enhances the acid resistance of Lactobacillus plantarum[J].Front Microbiol,2019,10:1393.
[21]李运奎,韩富亮,张予林,等.基于CIELAB色空间的红葡萄酒颜色直观表征[J].农业机械学报,2017,48(6):296-301.
[22]CLIFF M A,KING M C,SCHLOSSER J.Anthocyanin,phenolic composition, colour measurement and sensory analysis of BC commercial red wines[J].Food Res Int,2007,40(1):92-100.
[23]鲁榕榕,马腾臻,张波,等.不同澄清剂对起泡葡萄酒原酒的澄清作用及对香气品质的影响[J].食品科学,2018,39(12):146-153.
[24]WILHELMY C,PAVEZ C,BORDEU E,et al.A Review of tannin determination methods using spectrophotometric detection in red wines and their ability to predict astringency[J].S Afr J Enol Viticult,2021,42(1):1-9.
[25]IVANOVA V, STEFOVA M, VOJNOSKI B, et al.Identification of polyphenolic compounds in red and white grape varieties grown in R.Macedonia and changes of their content during ripening[J].Food Res Int,2011,44(9):2851-2860.
[26]GUO L X,LUO Y M,ZHOU Y,et al.Exploring microbial dynamics associated with flavours production during highland barley wine fermentation[J].Food Res Int,2020,130:108971.
[27]LI W,YAO H,CHEN K,et al.Effect of foliar application of fulvic acid antitranspirant on sugar accumulation,phenolic profiles and aroma qualities of Cabernet Sauvignon and Riesling grapes and wines[J].Food Chem,2021,351:129308.
[28]DI VAIO C,MARALLO N,DI LORENZO R,et al.Anti-transpirant effects on vine physiology, berry and wine composition of cv.Aglianico(Vitis vinifera L.)grown in South Italy[J].Agronomy,2019,9(5):244.
[29]BURNS T R, OSBORNE J P.Loss of Pinot Noir wine color and polymeric pigment after malolactic fermentation and potential causes[J].Am J Enol Viticult,2015,66(2):130-137.
[30]肖亚冬,李大婧,刘春泉,等.β-隐黄质及其异构体检测方法的研究[J].现代食品科技,2016,32(2):330-335,157.
[31]唐柯,张小倩,李记明,等.基于超高效液相色谱串联三重四级杆质谱的不同产区赤霞珠葡萄酒花色苷特征性研究[J].食品与发酵工业,2019,45(5):208-212.
[32]凌梦琪,邹文文,吴广枫,等.发酵后混酿调控‘赤霞珠’葡萄酒的香气和色泽[J].现代食品科技,2021,37(4):234-241.
[33]HERNÁNDEZ T,ESTRELLA I,PÉREZ-GORDO M,et al.Contribution of malolactic fermentation by Oenococcus oeni and Lactobacillus plantarum to the changes in the nonanthocyanin polyphenolic composition of red wine[J].J Agr Food Chem,2007,55(13):5260-5266.
[34]王晓月,张珊珊,张欣珂,等.发酵前添加黄酮醇类辅色素对‘赤霞珠’干红葡萄酒颜色品质及多酚组成的影响[J].食品科学,2020,41(18):188-195.
[35]SWIEGERS J H,BARTOWSKY E J,HENSCHKE P A,et al.Yeast and bacterial modulation of wine aroma and flavour[J].Aust J Grape Wine Res,2005,11(2):139-173.
[36]CAI J,ZHU B Q,WANG Y H,et al.Influence of pre-fermentation cold maceration treatment on aroma compounds of Cabernet Sauvignon wines fermented in different industrial scale fermenters[J].Food Chem,2014,154:217-229.
[37]WU Y S,DUAN S Y,ZHAO L P,et al.Aroma characterization based on aromatic series analysis in table grapes[J].Sci Rep,2016,6(1):31116.
[38]徐超,胡文效,陈明光,等.葡萄酒发酵香气物质调控研究进展[J].中外葡萄与葡萄酒,2024(1):81-93.
[39]BELDA I,RUIZ J,ESTEBAN-FERNÁNDEZ A,et al.Microbial contribution to wine aroma and its intended use for wine quality improvement[J].Molecules,2017,22(2):189.
[40]SWIEGERS J H,PRETORIUS I S.Yeast modulation of wine flavor[J].Adv Appl Microbiol,2005,57:131-175.
[41]DIEZ-OZAETA I, LAVILLA M, AMÁRITA F.Wine aroma profile modification by Oenococcus oeni strains from Rioja Alavesa region:selection of potential malolactic starters[J].Int J Food Microbiol,2021,356:109324.
[42]BAKKER J,CLARKE R J.Wine:flavour chemistry[M].New York:Wiley,2011:112-136.
[43]CARPENA M,FRAGA-CORRAL M,OTERO P,et al.Secondary aroma:influence of wine microorganisms in their aroma profile[J].Foods,2021,10(1):51.
[44]李爱华,王凌云,粟俊,等.混合酵母发酵对刺葡萄酒香气成分气味活性的调整作用[J].食品科学,2020,41(6):72-78.
[45]夏鸿川,张众,孙丽君,等.混菌发酵对贺兰山东麓‘赤霞珠’干红葡萄酒香气的影响[J].食品科学,2022,43(14):165-175.
[46]王倩倩,覃杰,马得草,等.优选发酵毕赤酵母与酿酒酵母混合发酵增香酿造爱格丽干白葡萄酒[J].中国农业科学,2018,51(11):2178-2192.
[47]李媛媛,李德美,张亚东,等.赤霞珠干红葡萄酒在不同子产区香气特征的差异[J].食品与发酵工业,2020,46(6):256-262,268.
[48]PERESTRELO R,SILVA C,CÂMARA J S.Madeira wine volatile profile.A platform to establish madeira wine aroma descriptors[J].Molecules,2019,24(17):3028.
[49]张娟,张海军.发酵结束后浸渍时间对葡萄酒香气成分及感官品质的影响[J].中国酿造,2022,41(3):174-179.
[50]GUTH H.Quantitation and sensory studies of character impact odorants of different white wine varieties[J].J Agr Food Chem, 1997, 45(8):3027-3032.
[51]蔡建.发酵前处理工艺对天山北麓‘赤霞珠’葡萄酒香气改良研究[D].北京:中国农业大学,2014.
[52]CRANDLES M,REYNOLDS A G,KHAIRALLAH R,et al.The effect of yeast strain on odor active compounds in Riesling and Vidal Blanc icewines[J].LWT-Food Sci Technol,2015,64(1):243-258.
[53]WANG X C,LI A H,DIZY M,et al.Evaluation of aroma enhancement for"Ecolly"dry white wines by mixed inoculation of selected Rhodotorula mucilaginosa and Saccharomyces cerevisiae[J].Food Chem,2017,228:550-559.