调味属于特殊的生产工艺,是酿酒厂日常所采用的加工方式,目的是使终产品含有特定的物质或香气,能弥补基础酒中存在的缺陷,让产品风格更加突出[1-2]。天龙泉糯米调味酒是以糯米为原料,经蒸煮、摊凉后加入根霉进行糖化,待糖化结束按一定比例加入高酒精度的米香型白酒终止糖化,再经陈酿、压榨等工序制成。糯米调味酒已广泛应用于该厂的复合米香型白酒类产品的调味,其酒体透明呈橙黄色,香气馥郁,富含氨基酸及多种对人体有益的微量元素[3]。对酒类酿造而言,氨基酸不仅是风味物质前驱体,也是影响酒体口感的关键因素[4]。目前国内外关于氨基酸测定的方法较多,如分光光度法、氨基酸专用自动分析仪、液相色谱法、液相色谱-质谱联用法等[5]。其中,分光光度法操作简单,但线性范围小、衍生时间长、只能测定单一氨基酸[6];氨基酸自动分析仪法灵敏、检测样品用量少,但设备专一性强、应用成本高[7];液相色谱-串联质谱法可分析较为复杂的样品且准确度高,但仪器昂贵、运行成本高[8]。液相色谱法通常将氨基酸衍生成紫外吸收的衍生物,在特定的紫外波长下检测,其稳定性和准确性较好,成本适中,较易在企业推广[3]。液相色谱法可分为柱前衍生、柱后衍生两种;相对于柱后衍生,柱前衍生操作简单、无需专门的衍生设备且费用低,是目前应用较为广泛的检测方法[3]。常用的柱前衍生试剂有邻苯二甲醛、丹磺酰氯、6-氨基喹啉基-N-羟基-琥珀酰亚氨基甲酸酯、异硫氰酸苯酯等[9-11],而异硫氰酸苯酯能与一级、二级氨基反应,生产的衍生物稳定,在紫外检测器有较高灵敏度、干扰小,已被广泛用于食品氨基酸含量测定[12-13]。Atlantis®T3色谱柱是一种新兴的通用型硅胶基质反相C18柱,可在较宽的pH范围内适用,在食品行业中的应用越来越广泛。本研究拟利用该色谱柱,使用异硫氰酸苯酯(phenyl isothiocyanate,PITC)作为柱前衍生试剂开发经济且检测成本低的氨基酸高效液相色谱法,并定量测定天龙泉糯米调味酒中18种氨基酸含量,以期为酿酒企业提供氨基酸检测的实用的方法,提升工厂的精细化生产的品控能力。
1 材料与方法
1.1 材料与试剂
18种氨基酸(天冬氨酸、谷氨酸、丝氨酸、甘氨酸、组氨酸、精氨酸、γ-氨基丁酸、苏氨酸、丙氨酸、脯氨酸、酪氨酸、缬氨酸、甲硫氨酸、异亮氨酸、亮氨酸、苯丙氨酸、色氨酸、赖氨酸)标准品、异硫氰酸苯酯、三乙胺、冰乙酸、乙腈(均为色谱纯):上海麦克林生化科技公司;正己烷(分析纯):天津市富宇精细化工有限公司;无水乙酸钠(色谱纯):天津市科密欧化学试剂有限公司;浓盐酸(分析纯):天津市大茂化学试剂厂;天龙泉糯米调味酒(酒精度22.64%vol,总糖含量265 g/L):广西天龙泉酒业有限公司。
1.2 仪器与设备
Alliance 2695高效液相色谱(high performance liquid chromatography,HPLC)仪[配备2695分离单元、2996二极管阵列检测器(photo-diode array,PDA)、Empower工作站]、Waters-Atlantis®T3色谱柱(4.6 mm×250 mm,5 μm):美国Waters仪器公司;ME204E电子分析天平:梅特勒-托利多仪器(上海)有限公司;DK-98-II恒温水浴锅:天津市泰斯特仪器有限公司;Milli-Q去离子水发生器、0.22 μm聚醚砜针头滤膜:美国Millipore公司;XW-80A旋涡混合器:常州万科仪器有限公司。
1.3 实验方法
1.3.1 溶液配制
(1)衍生试剂:吸取0.12 mL异硫氰酸苯酯溶液置于10 mL容量瓶中,用乙腈溶液定容得异硫氰酸苯酯-乙腈溶液;吸取1.4 mL三乙胺溶液置于10 mL容量瓶中,用乙腈定容得三乙胺-乙腈溶液。
(2)氨基酸单标标准母液配制:称取18种氨基酸标准品分别置于4 mL的EP试管中用2 mL 0.1 mol/L的盐酸溶液溶解,配制得到不同浓度的单标母液。
(3)色谱优化氨基酸混合标准液的配制:用移液枪分别适量吸取各氨基酸的单标母液置于同一10 mL容量瓶中,用0.1 mol/L盐酸溶液定容,配制得到质量浓度为80 mg/L的混合标准溶液,待衍生后用于色谱条件的优化。
(4)定量用混和标准液的配制:适量吸取1.3.1中18种氨基酸的单标母液置于同一10mL容量瓶,混匀,配制得到含质量浓度为1 000 mg/L的丝氨酸、精氨酸、苏氨酸,200 mg/L的天冬氨酸、谷氨酸、组氨酸、γ-氨基丁酸、酪氨酸、亮氨酸、苯丙氨酸、甘氨酸、脯氨酸、丙氨酸、缬氨酸的混合标准中间液;准确吸取混合标准中间液0.1 mL、0.2 mL、0.4 mL、0.8 mL、1.6 mL、3.2 mL置于10 mL容量瓶,用0.1 mol/L的盐酸溶液稀释定容,浓度由低到高依次配制得到1~6浓度梯度的定量混合标准溶液。
(5)样品溶液制备:准确吸取糯米调味酒样品20 mL置于50 mL离心管中,经8 000 r/min离心5 min,取1 mL上清液置于10 mL容量瓶中,用水定容,待测。
1.3.2 样品衍生及净化萃取
吸取需衍生的样液500 μL置于5 mL的EP管中,加入异硫氰酸苯酯-乙腈溶液250 μL和三乙胺-乙腈溶液250 μL混合均匀,于室温放置1 h后加入50 μL 20%乙酸溶液均匀混合。在衍生后的样液中加入1 mL正己烷,用涡旋混合器振荡1 min,静置分层后弃去上层,重复净化萃取3次,吸取下层溶液经0.22 μm有机系滤膜过滤,置于样品瓶中,进行测定。
1.3.3 分析检测色谱条件及优化
Waters-Atlantis®T3色谱柱(4.6 mm×250 mm,5 μm);流动相A:乙腈-水溶液(8∶2,V∶V);流动相B:0.019 mol/L乙酸钠溶液(pH=6.2);梯度洗脱,柱温28 ℃,流速1 mL/min,进样量5 μL;采用二极管阵列检测器进行检测。利用色谱优化用氨基酸混合标准液,调整洗脱梯度,优化过程典型梯度见表1。采用最后优化确定的梯度4进行后续的定性、定量和样品的分析检测。
表1 流动相梯度洗脱程序
Table 1 Gradient elution procedure of mobile phase
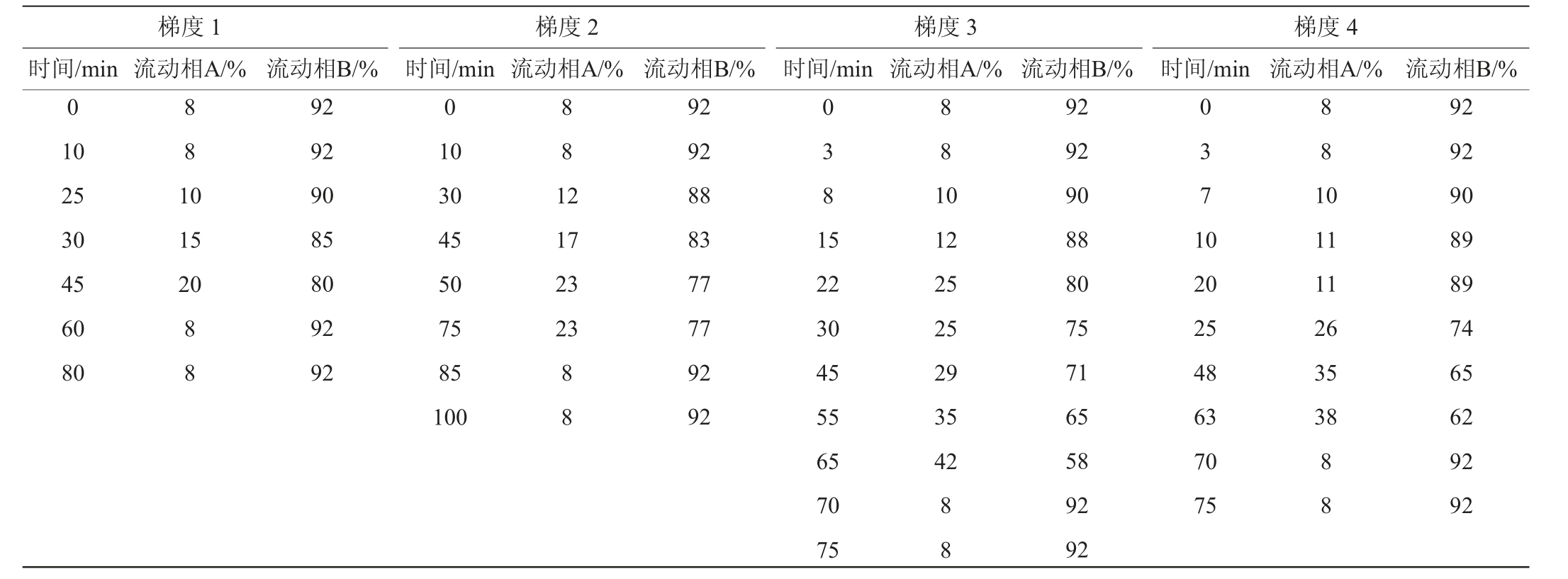
梯度1流动相A/% 时间/min时间/min梯度2流动相A/% 时间/min梯度3流动相A/% 时间/min梯度4流动相A/% 流动相B/%0 8 8 1 0流动相B/% 流动相B/% 流动相B/%92 92 90 85 80 92 92 0 10 25 30 45 60 80 8 8 1 2 15 20 8 8 10 30 45 50 75 85 100 17 23 23 8 8 92 92 88 83 77 77 92 92 0 3 8 1 5 8 8 1 0 0 3 7 1 0 8 8 1 0 22 30 45 55 65 70 75 12 25 25 29 35 42 11 11 26 35 38 8 8 92 92 90 88 80 75 71 65 58 92 92 20 25 48 63 70 75 8 8 92 92 90 89 89 74 65 62 92 92
定性定量方法:适量吸取1.3.1单标母液分别置于10 mL容量瓶,配制得到浓度为50 mg/L的18种氨基酸单标定性溶液,用于确定各氨基酸保留时间及峰形。根据各氨基酸标准品色谱峰的保留时间定性,外标法定量。定量标准曲线建立:以质量浓度(X,mg/L)为横坐标,峰面积(Y,AU)为纵坐标绘制定量标准工作曲线,并求出回归方程和相关系数。将样品中氨基酸的峰面积带入回归方程,即可得到各氨基酸所对应的含量。
1.3.4 方法学考察[14-16]
(1)检出限、定量限
将1.3.1标准曲线最低浓度的混合标准溶液采用逐级稀释、进样,按3倍信噪比(S/N)对应的待测物浓度确定出检测方法的检出限(limit of detection,LOD),按10倍信噪比对应的待测物浓度确定出检测方法的定量限(limit of quantification,LOQ)。
(2)重复性试验
将1.3.1中梯度6混合标准溶液,用最优色谱条件平行测定6次18种氨基酸的峰面积,计算相对标准偏差(relative standard deviation,RSD)。
(3)精密度试验
依次适量吸取1.3.1配制的18种氨基酸单标母液,配制得到质量浓度为5 mg/L的氨基酸混合标准溶液,并加入6份酒样,于优化色谱条件下测定,记录18种氨基酸的峰面积,计算RSD。
(4)加标回收率
适量吸取1.3.1配制的18种氨基酸单标母液,分别配制得到质量浓度为10 mg/L、15 mg/L、20 mg/L的氨基酸混合标准溶液,在0.5 mL已知浓度的糯米调味酒样品中分别加入10 mg/L、15 mg/L、20 mg/L的氨基酸混合标准溶液,平行测定3次计算平均加标回收率及其相对标准偏差。
1.3.5 数据处理
使用Microsoft Excel 2019、Adobe IIIustrator 2021软件对数据进行处理,样品数据以“平均值±标准偏差”形式表示。
2 结果与分析
2.1 定量波长的选择
采用光电二级管阵列检测器对18种氨基酸混合标准溶液进行全波长扫描(200~400 nm),得到各氨基酸的最大吸收波长分别为丙氨酸243 nm、酪氨酸248 nm、天冬氨酸246 nm、谷氨酸245 nm、甘氨酸245 nm、组氨酸245 nm、异亮氨酸248 nm、亮氨酸248 nm、赖氨酸247 nm、甲硫氨酸248 nm、苯丙氨酸248 nm、脯氨酸249 nm、丝氨酸245 nm、苏氨酸245 nm、色氨酸227 nm、缬氨酸248 nm、γ-氨基丁酸、精氨酸242 nm。为简化定量过程,同时保证各测定组分的响应度,选择245 nm作为检测波长。
2.2 洗脱条件优化
各洗脱条件的分离效果见图1。由图1可知,采用洗脱梯度1时,组氨酸和精氨酸色谱峰重合(峰5),丙氨酸(峰9)之后的氨基酸出峰时间过于集中,造成对应的色谱峰未完全分离。采用洗脱梯度2时,组氨酸和精氨酸(峰5)色谱峰仅见峰尖分离;且该洗脱条件下存在3组完全重合色谱峰,分别是苏氨酸与脯氨酸(峰8)、异亮氨酸和亮氨酸(峰14)、苯丙氨酸、色氨酸及赖氨酸(峰15)。采用洗脱梯度3时,组氨酸与精氨酸色谱峰能完全分离(分离度>1.5),异亮氨酸、亮氨酸、苯丙氨酸、色氨酸及赖氨酸的分离效果也有所改善,但精氨酸(峰6)与γ-氨基丁酸(峰7)色谱峰仍无法分离,苏氨酸与脯氨酸(峰8)色谱峰仍重合。采用洗脱梯度4时,18种氨基酸于52 min之内全部出峰且分离效果、峰形均较好,因此,后续实验以该洗脱梯度进行。

图1 不同洗脱梯度条件下18种氨基酸混合标准溶液的HPLC图
Fig.1 HPLC diagram of 18 amino acids mixed standard solutions under different elution gradients
1.天冬氨酸;2.谷氨酸;3.丝氨酸;4甘氨酸;5.组氨酸;6.精氨酸;7.γ-氨基丁酸;8.苏氨酸;9.丙氨酸;10.脯氨酸;11.酪氨酸;12.缬氨酸;13.甲硫氨酸;14.异亮氨酸;15.亮氨酸;16.苯丙氨酸;17.色氨酸;18.赖氨酸。图A、B、C、D的洗脱条件分别对应洗脱梯度条件1、2、3、4。
2.3 氨基酸定性及定量标准曲线建立
于最优色谱条件下测定18种氨基酸单标溶液进行定性以及由低到高依次测定6个浓度梯度的混合标准溶液。18种氨基酸对应的保留时间、线性回归方程、线性范围、相关系数、检出限、定量限结果见表2。由表2可知,各氨基酸在一定线性范围内相关系数(R)为0.990 8~0.999 9。
表2 18种氨基酸的保留时间、线性回归方程及线性范围、相关系数、检出限及定量限
Table 2 Retention time, linear regression equation, linear range, correlation coefficient, detection limit and quantification limit of 18 amino acids
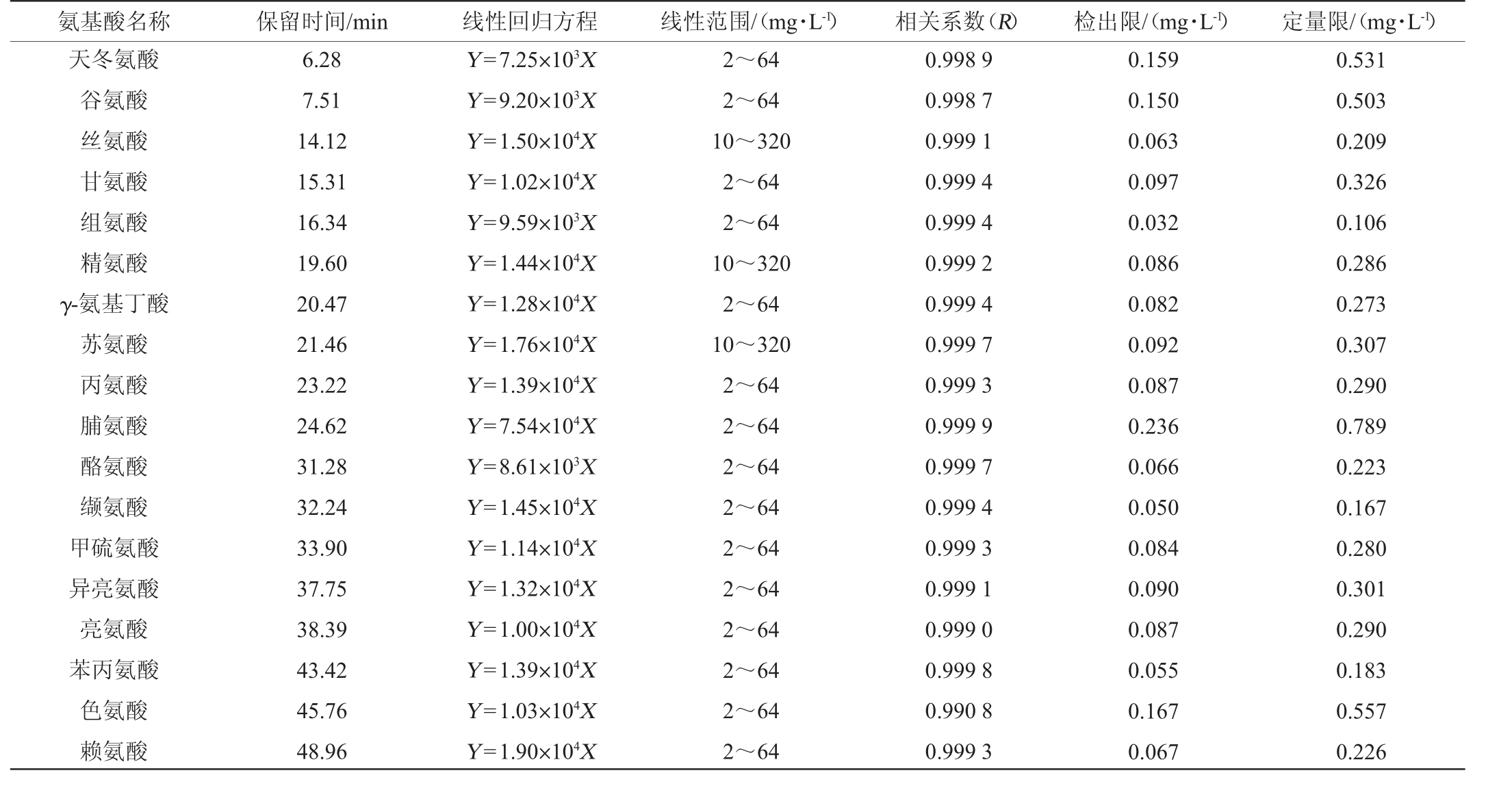
氨基酸名称 保留时间/min 线性回归方程 线性范围/(mg·L-1)相关系数(R)检出限/(mg·L-1)定量限/(mg·L-1)天冬氨酸谷氨酸丝氨酸甘氨酸组氨酸精氨酸γ-氨基丁酸苏氨酸丙氨酸脯氨酸酪氨酸缬氨酸甲硫氨酸异亮氨酸亮氨酸苯丙氨酸色氨酸赖氨酸6.28 7.51 14.12 15.31 16.34 19.60 20.47 21.46 23.22 24.62 31.28 32.24 33.90 37.75 38.39 43.42 45.76 48.96 Y=7.25×103X Y=9.20×103X Y=1.50×104X Y=1.02×104X Y=9.59×103X Y=1.44×104X Y=1.28×104X Y=1.76×104X Y=1.39×104X Y=7.54×104X Y=8.61×103X Y=1.45×104X Y=1.14×104X Y=1.32×104X Y=1.00×104X Y=1.39×104X Y=1.03×104X Y=1.90×104X 2~64 2~64 10~320 2~64 2~64 10~320 2~64 10~320 2~64 2~64 2~64 2~64 2~64 2~64 2~64 2~64 2~64 2~64 0.998 9 0.998 7 0.999 1 0.999 4 0.999 4 0.999 2 0.999 4 0.999 7 0.999 3 0.999 9 0.999 7 0.999 4 0.999 3 0.999 1 0.999 0 0.999 8 0.990 8 0.999 3 0.159 0.150 0.063 0.097 0.032 0.086 0.082 0.092 0.087 0.236 0.066 0.050 0.084 0.090 0.087 0.055 0.167 0.067 0.531 0.503 0.209 0.326 0.106 0.286 0.273 0.307 0.290 0.789 0.223 0.167 0.280 0.301 0.290 0.183 0.557 0.226
2.4 方法学考察
2.4.1 检出限及定量限
于最优色谱条件下测定不同稀释倍数的混合标准溶液,结果见表2。测得方法检出限为0.032~0.236 mg/L,定量限为0.106~0.789 mg/L。
2.4.2 重复性试验
于最优色谱条件下,连续进样6次测定1.3.4氨基酸混合标准液浓度梯度6,记录峰面积,结果见表3。由表3可知,18种氨基酸峰面积测定结果RSD为1.14%~3.93%,表明该方法的重复性较好。
表3 18种氨基酸重复性试验结果
Table 3 Repeatability test results of 18 amino acids

氨基酸名称 平均值 RSD/%天冬氨酸谷氨酸丝氨酸甘氨酸组氨酸精氨酸γ-氨基丁酸苏氨酸丙氨酸脯氨酸酪氨酸缬氨酸甲硫氨酸异亮氨酸亮氨酸苯丙氨酸色氨酸赖氨酸峰面积测定值1 2 3 4 5 6 460 268 597 824 4 789 160 699 381 628 722 4 654 481 875 243 5 959 686 876 282 5 068 166 587 299 981 436 786 303 786 806 650 991 663 041 701 916 1 081 292 450 539 608 582 4 867 491 728 578 605 061 4 528 199 890 248 6 071 174 870 974 5 248 404 581 718 973 483 780 215 784 465 654 669 670 124 732 773 1 020 674 468 555 604 539 4 464 651 685 368 623 080 4 679 031 863 038 6 178 436 870 161 5 108 495 590 548 996 869 759 918 767 237 669 541 667 134 707 208 1 089 377 467 928 600 453 44 963 441 719 083 641 782 4 827 136 859 482 6 096 139 895 505 5 393 244 600 146 946 645 780 543 735 797 672 117 651 069 734 383 1 080 059 449 706 558 755 4 463 441 698 740 639 671 4 697 083 897 146 5 810 702 868 000 5 327 817 601 625 922 295 782 533 726 673 692 518 697 882 729 823 1 085 969 471 542 568 527 4 738 811 702 737 659 459 4 989 375 841 861 5 920 728 877 005 5 194 643 593 608 969 310 792 085 726 673 659 871 672 124 702 596 1 089 354 461 423 589 780 4 636 740 705 647 632962 4 729 217 871 169 6 006 144 876 321 522 346 592 490 965 006 780 266 760 556 666 617 670 229 718 116 1 074 454 2.06 3.52 3.93 2.20 2.92 3.36 2.36 2.22 1.14 2.39 1.28 2.75 1.39 3.25 2.26 2.30 2.19 2.47
2.4.3 精密度试验结果
于优化色谱条件下,平行测定6份添加质量浓度为5 mg/L混合标准溶液的酒样,记录18种氨基酸的峰面积,结果见表4。由表4可知,18种氨基酸峰面积测定结果RSD为1.05%~4.39%,表明该方法精密度较好。
表4 18种氨基酸精密度试验结果
Table 4 Precision test results of 18 amino acids
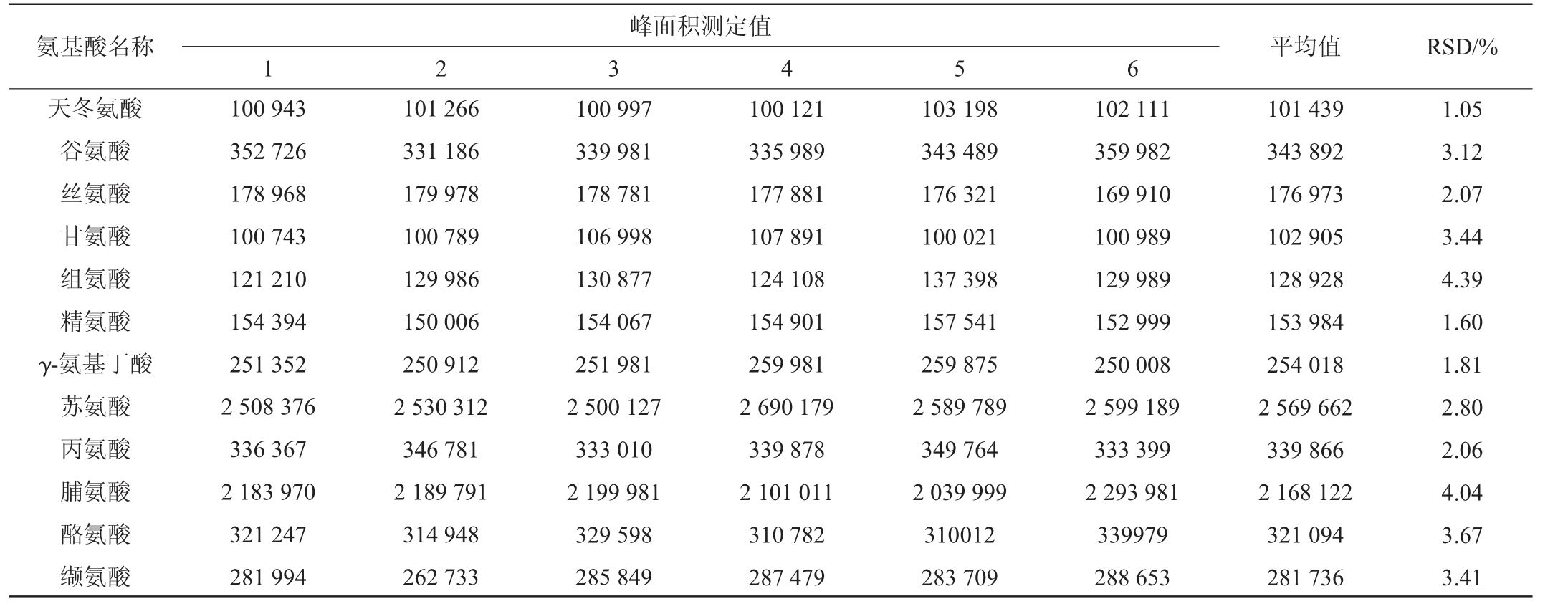
氨基酸名称 平均值 RSD/%天冬氨酸谷氨酸丝氨酸甘氨酸组氨酸精氨酸γ-氨基丁酸苏氨酸丙氨酸脯氨酸酪氨酸缬氨酸峰面积测定值1 2 3 4 5 6 100 943 352 726 178 968 100 743 121 210 154 394 251 352 2 508 376 336 367 2 183 970 321 247 281 994 101 266 331 186 179 978 100 789 129 986 150 006 250 912 2 530 312 346 781 2 189 791 314 948 262 733 100 997 339 981 178 781 106 998 130 877 154 067 251 981 2 500 127 333 010 2 199 981 329 598 285 849 100 121 335 989 177 881 107 891 124 108 154 901 259 981 2 690 179 339 878 2 101 011 310 782 287 479 103 198 343 489 176 321 100 021 137 398 157 541 259 875 2 589 789 349 764 2 039 999 310012 283 709 102 111 359 982 169 910 100 989 129 989 152 999 250 008 2 599 189 333 399 2 293 981 339979 288 653 101 439 343 892 176 973 102 905 128 928 153 984 254 018 2 569 662 339 866 2 168 122 321 094 281 736 1.05 3.12 2.07 3.44 4.39 1.60 1.81 2.80 2.06 4.04 3.67 3.41
续表
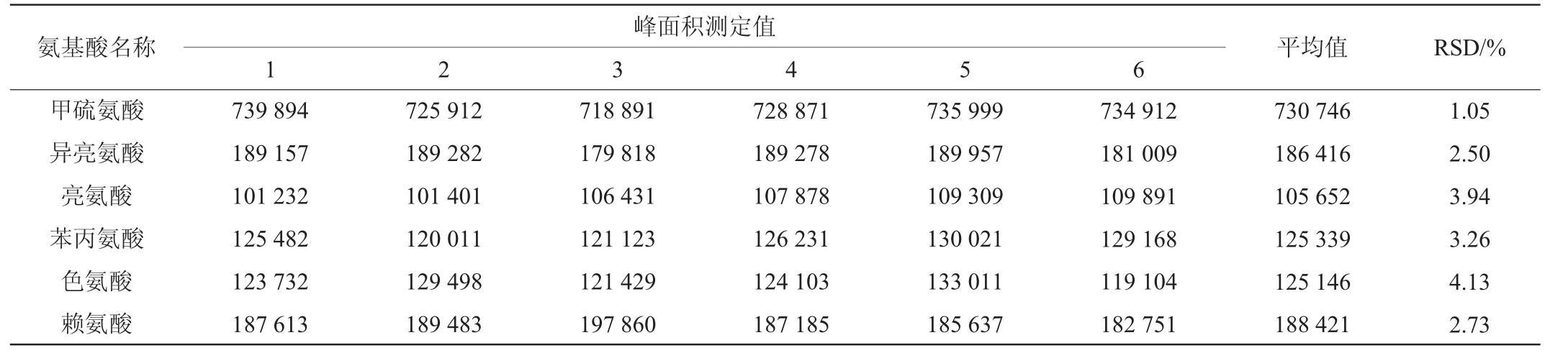
氨基酸名称 平均值 RSD/%甲硫氨酸异亮氨酸亮氨酸苯丙氨酸色氨酸赖氨酸峰面积测定值1 2 3 4 5 6 739 894 189 157 101 232 125 482 123 732 187 613 725 912 189 282 101 401 120 011 129 498 189 483 718 891 179 818 106 431 121 123 121 429 197 860 728 871 189 278 107 878 126 231 124 103 187 185 735 999 189 957 109 309 130 021 133 011 185 637 734 912 181 009 109 891 129 168 119 104 182 751 730 746 186 416 105 652 125 339 125 146 188 421 1.05 2.50 3.94 3.26 4.13 2.73
2.4.4 加标回收率试验结果
于优化色谱条件下,测定3份加入质量浓度为10 mg/L、15 mg/L、20 mg/L的氨基酸混合标准溶液的调味酒样品,结果见表5。由表5可知,18种氨基酸平均加标回收率为92.38%~104.86%,RSD为1.09%~4.45%,表明该方法准确度高。
表5 18种氨基酸加标回收率试验结果
Table 5 Recovery rate test results of 18 amino acids
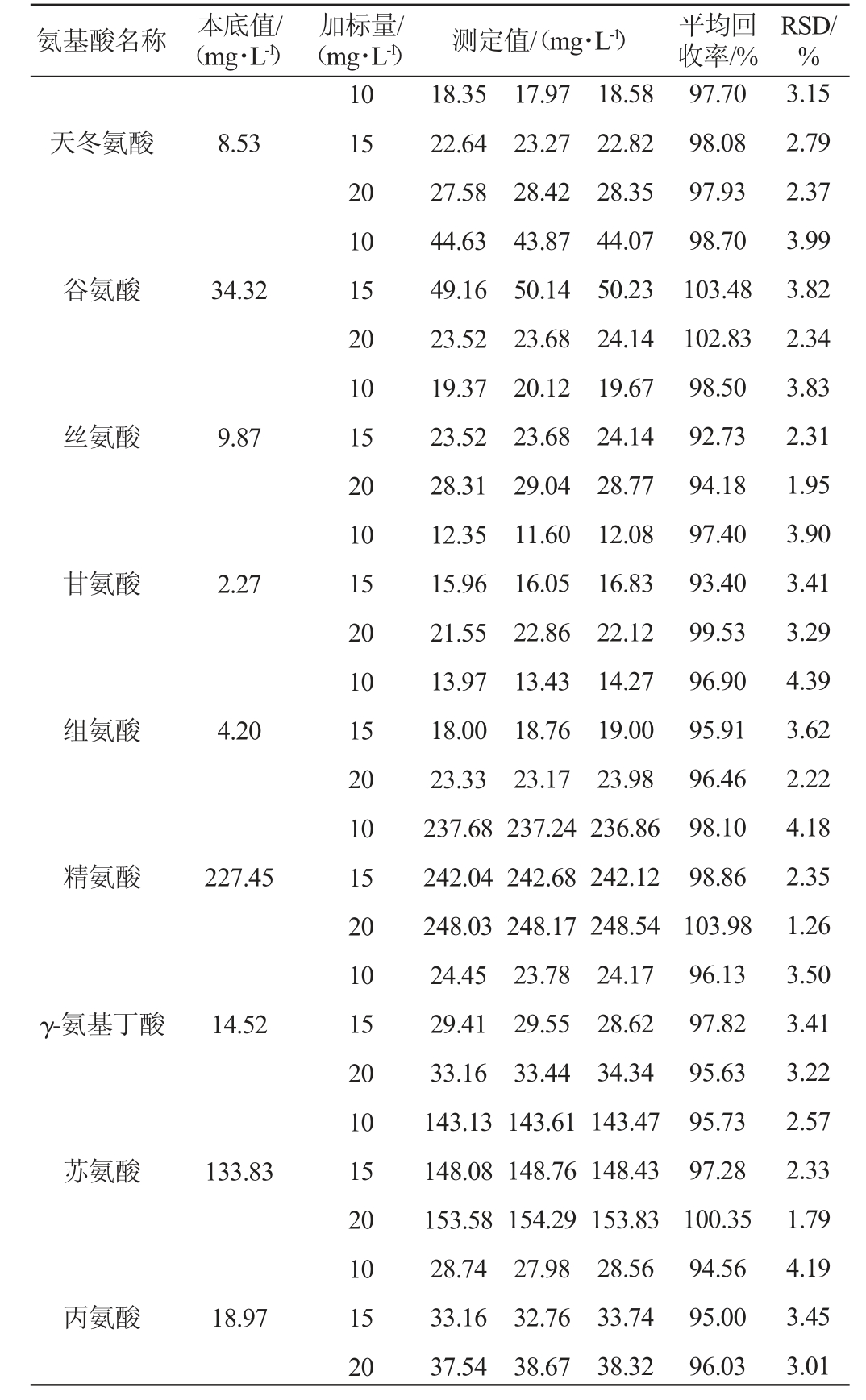
氨基酸名称 本底值/(mg·L-1)(mg·L-1)测定值/(mg·L-1)平均回收率/%加标量/RSD/%天冬氨酸8.53谷氨酸34.32丝氨酸9.87甘氨酸2.27组氨酸4.20精氨酸227.45 γ-氨基丁酸14.52苏氨酸133.83丙氨酸18.97 10 15 20 10 15 20 10 15 20 10 15 20 10 15 20 10 15 20 10 15 20 10 15 20 10 15 20 18.35 22.64 27.58 44.63 49.16 23.52 19.37 23.52 28.31 12.35 15.96 21.55 13.97 18.00 23.33 237.68 242.04 248.03 24.45 29.41 33.16 143.13 148.08 153.58 28.74 33.16 37.54 17.97 23.27 28.42 43.87 50.14 23.68 20.12 23.68 29.04 11.60 16.05 22.86 13.43 18.76 23.17 237.24 242.68 248.17 23.78 29.55 33.44 143.61 148.76 154.29 27.98 32.76 38.67 18.58 22.82 28.35 44.07 50.23 24.14 19.67 24.14 28.77 12.08 16.83 22.12 14.27 19.00 23.98 236.86 242.12 248.54 24.17 28.62 34.34 143.47 148.43 153.83 28.56 33.74 38.32 97.70 98.08 97.93 98.70 103.48 102.83 98.50 92.73 94.18 97.40 93.40 99.53 96.90 95.91 96.46 98.10 98.86 103.98 96.13 97.82 95.63 95.73 97.28 100.35 94.56 95.00 96.03 3.15 2.79 2.37 3.99 3.82 2.34 3.83 2.31 1.95 3.90 3.41 3.29 4.39 3.62 2.22 4.18 2.35 1.26 3.50 3.41 3.22 2.57 2.33 1.79 4.19 3.45 3.01
续表
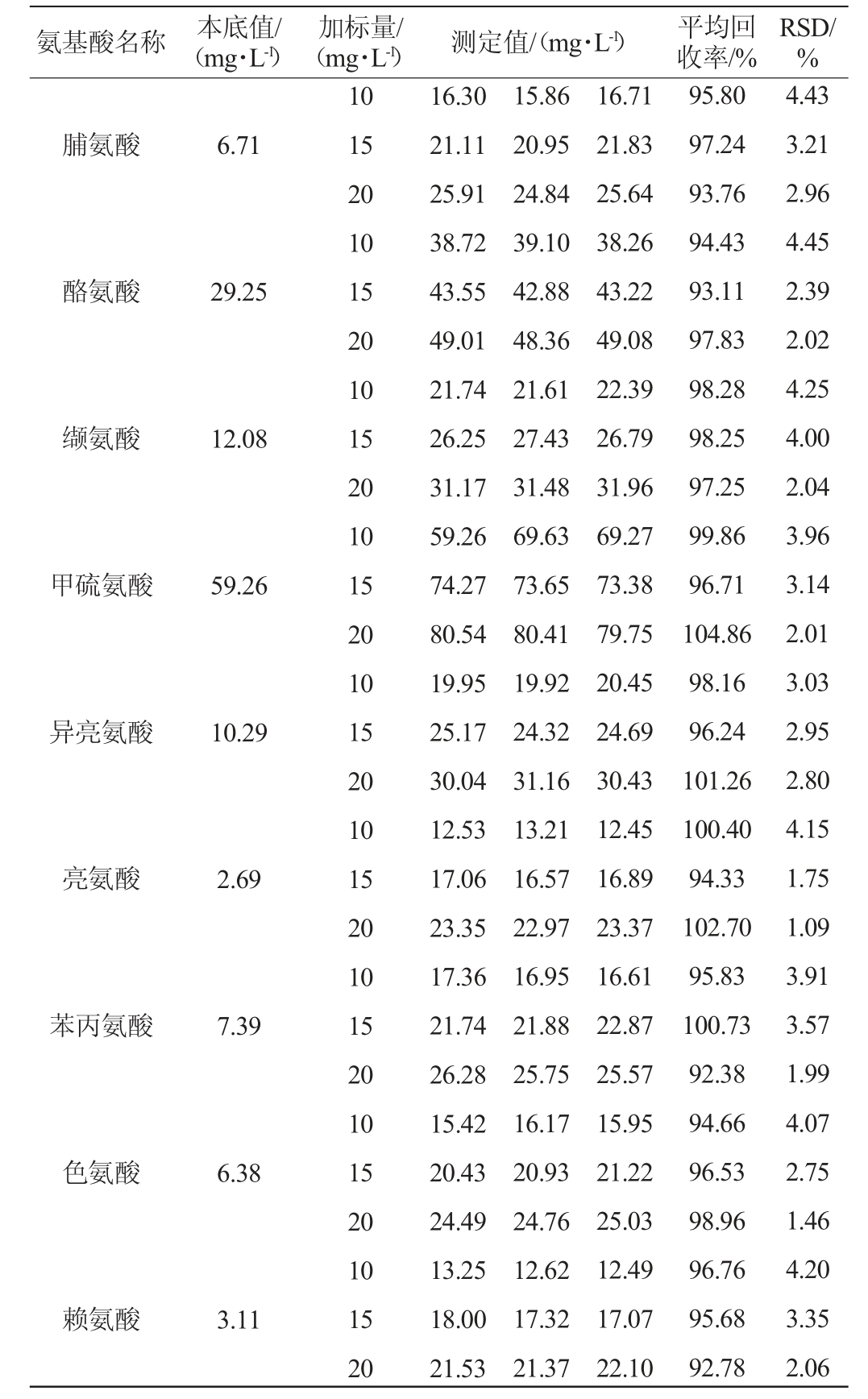
氨基酸名称 本底值/(mg·L-1)(mg·L-1)测定值/(mg·L-1)平均回收率/%加标量/RSD/%脯氨酸6.71酪氨酸29.25缬氨酸12.08甲硫氨酸59.26异亮氨酸10.29亮氨酸2.69苯丙氨酸7.39色氨酸6.38赖氨酸3.11 10 15 20 10 15 20 10 15 20 10 15 20 10 15 20 10 15 20 10 15 20 10 15 20 10 15 20 16.30 21.11 25.91 38.72 43.55 49.01 21.74 26.25 31.17 59.26 74.27 80.54 19.95 25.17 30.04 12.53 17.06 23.35 17.36 21.74 26.28 15.42 20.43 24.49 13.25 18.00 21.53 15.86 20.95 24.84 39.10 42.88 48.36 21.61 27.43 31.48 69.63 73.65 80.41 19.92 24.32 31.16 13.21 16.57 22.97 16.95 21.88 25.75 16.17 20.93 24.76 12.62 17.32 21.37 16.71 21.83 25.64 38.26 43.22 49.08 22.39 26.79 31.96 69.27 73.38 79.75 20.45 24.69 30.43 12.45 16.89 23.37 16.61 22.87 25.57 15.95 21.22 25.03 12.49 17.07 22.10 95.80 97.24 93.76 94.43 93.11 97.83 98.28 98.25 97.25 99.86 96.71 104.86 98.16 96.24 101.26 100.40 94.33 102.70 95.83 100.73 92.38 94.66 96.53 98.96 96.76 95.68 92.78 4.43 3.21 2.96 4.45 2.39 2.02 4.25 4.00 2.04 3.96 3.14 2.01 3.03 2.95 2.80 4.15 1.75 1.09 3.91 3.57 1.99 4.07 2.75 1.46 4.20 3.35 2.06
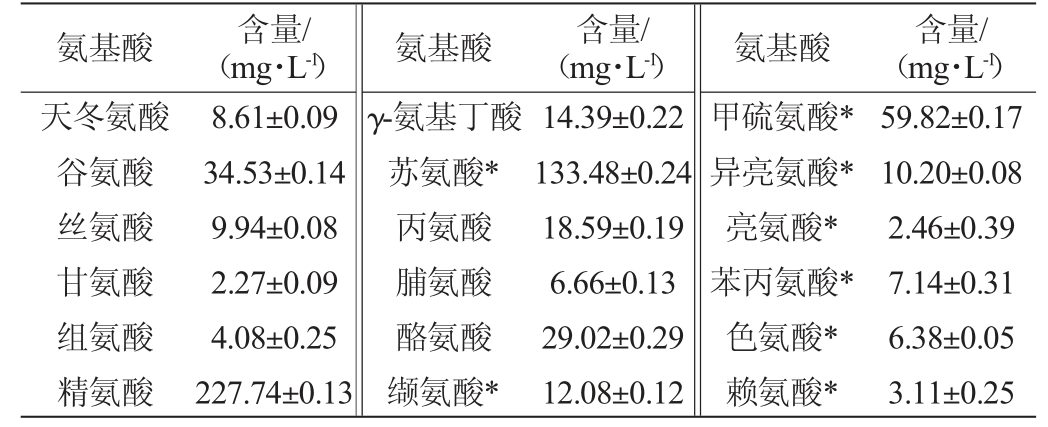
2.5 样品中氨基酸含量测定结果
酒样中氨基酸含量与其生产工艺、原料等因素有关[17-19],糯米调味酒的工艺是以糯米为原料,经24~48 h糖化后加入高度米香型白酒终止糖化,因而其氨基酸的分布明显有别于常规的糯米酒氨基酸分布。鲜、甜、苦、鲜四类氨基酸会对酒体的口感产生显著的影响[20-22]。于优化色谱条件下,试验测定同一批次天龙泉糯米调味酒酒样的氨基酸含量,结果见表6。由表6可知,天龙泉糯米调味酒中含量最高的氨基酸为精氨酸(苦味氨基酸),含量为227.74 mg/L,占氨基酸总含量的38.5%,适量的苦味氨基酸会赋予酒体舒适清爽的口感[23-25];鲜味氨基酸天冬氨酸、谷氨酸与甜味氨基酸丙氨酸、甘氨酸、脯氨酸、丝氨酸、苏氨酸被统称为优味氨基酸,对黄酒的风味起正面贡献[26],优味氨基酸在天龙泉糯米调味酒中占总氨基酸含量的36.24%。值得一提的是,脯氨酸可通过影响酒精代谢从而减轻过量饮酒对人体健康造成的伤害[23]。此外,天龙泉糯米调味酒检测到了全部8种人体必需氨基酸,其中苏氨酸含量最高为133.48 mg/L,占总氨基酸的22.6%。
表6 天龙泉糯米调味酒中18种氨基酸含量
Table 6 Contents of 18 amino acids of Tianlongquan seasoning glutinous rice wine
注:“*”为人体必需氨基酸。
氨基酸 含量/(mg·L-1)氨基酸 含量/(mg·L-1)氨基酸 含量/(mg·L-1)天冬氨酸谷氨酸丝氨酸甘氨酸组氨酸精氨酸8.61±0.09 34.53±0.14 9.94±0.08 2.27±0.09 4.08±0.25 227.74±0.13 γ-氨基丁酸苏氨酸*丙氨酸脯氨酸酪氨酸缬氨酸*14.39±0.22 133.48±0.24 18.59±0.19 6.66±0.13 29.02±0.29 12.08±0.12甲硫氨酸*异亮氨酸*亮氨酸*苯丙氨酸*色氨酸*赖氨酸*59.82±0.17 10.20±0.08 2.46±0.39 7.14±0.31 6.38±0.05 3.11±0.25
3 结论
本试验建立定量测定天龙泉糯米调味酒中18种氨基酸含量的柱前衍生-高效液相色谱法,通过优化洗脱条件实现了所测氨基酸色谱峰较好的分离,并进行了对应的方法学考查。该方法操作简单、检测效率高、精密度好,将18种氨基酸有效分离的时间是49 min,平均加标回收率范围为92.38%~104.86%,加标回收率结果相对标准偏差(RSD)≤4.45%,方法精密度及重复性试验结果RSD<5%,适用于天龙泉糯米调味酒及相关产品的测定。从调味酒氨基酸测定结果可知,其含有人体必需氨基酸和酒类风味优化等多种氨基酸。本方法为工厂监控糯米调味酒中关键氨基酸含量以及优化产品品质提供了有效的检测手段,而该方法的开发是基于目前企业配备较为普遍的Waters-Atlantis®T3色谱柱进行的,因而具有显著的推广性和实用性。
[1]王丽,王凡,唐平,等.不同调味酒对酱香型白酒感官特征的作用[J].食品与发酵工业,2021,47(23):125-133.
[2]刘发洋,李璐,游奇,等.基于OAV分析多粮浓香型调味酒陈酿过程中风味物质的变化[J].中国酿造,2023,42(5):237-242.
[3]GUO J B,LU A C,SUN Y N,et al.Purification and identification of antioxidant and angiotensin converting enzyme-inhibitory peptides from Guangdong glutinous rice wine[J].LWT-Food Sci Technol,2022,169:113953.
[4]CHEN T, QI X P, CHEN M J, et al.Discrimination of Chinese yellow wine from different origins based on flavor fingerprint[J].Acta Chromatogr,2020,32(2):139-144.
[5]卢兰香,郑红,武传香,等.AQC柱前衍生/UPLC-MS/MS测定蜂蜜中的内源性氨基酸和牛磺酸成分[J].分析测试学报,2022,41(12):1738-1745.
[6]DAGDEVIREN S,ALTUNAY N,SAYMAN Y,et al.A new method of UA-CPE coupled with spectrophotometry for the faster and cost-effective detection of proline in fruit juice,honey,and wine[J].Food Chem,2018,255:31-40.
[7]ZHANG K Z,PAN Y F,ZOU W,et al.Nutritive assessment of amino acids for three Chinese Zajius produced from hull-less barley[J].J I Brewing,2017,123(4):587-593.
[8]尹艳艳,杨军林,田栋伟,等.超高效液相色谱-高分辨质谱法同时测定白酒中19种氨基酸[J].分析测试学报,2023,42(3):330-336.
[9]KLIKAROVA J, CESLOVA L, FISHCHER J.Rapid analysis of phenyl isothiocyanate derivatives of amino acids present in Czech meads[J].J Chromatogr A,2021,1644:462134.
[10]GONG J Y,HUANG J,XIAO G N,et al.Determination of γ-aminobutyric acid in Chinese rice wines and its evolution during fermentation[J].J I Brewing,2017,123(3):417-422.
[11]ZHANG H J,WANG Y,FENG X J,et al.The analysis of changes in nutritional components and flavor characteristics of Wazu rice wine during fermentation process[J].Food Anal Method,2022,15(4):1132-1142.
[12]芮鸿飞,张晓瑜,刘兴泉,等.PITC柱前衍生-反相高效液相色谱法测定黄酒中游离氨基酸和生物胺[J].食品科学,2016,37(8):159-163.
[13]NUNEZ L,SERRATOSA M P,GODOY A,et al.Comparison of physicochemical properties,amino acids,mineral elements,total phenolic compounds,and antioxidant capacity of Cuban fruit and rice wines[J].Food Sci Nutr,2021,9(7):3673-3682.
[14]LIU T B,LI B B,ZHOU Y F,et al.HPLC determination of γ-aminobutyric acid in Chinese rice wine using pre-column derivatization[J].J I Brewing,2015,121(1):163-166.
[15]李湘楠,梅涌现,张晓晴,等.超高效液相色谱法测定不同品种桃果酒中8种生物胺含量[J].食品安全质量检测学报,2022,13(12):3937-3944.
[16]王燕,李德美,孙智文,等.高效液相色谱法同时测定贺兰山东麓干红葡萄酒中的七种酚类物质[J].食品与发酵工业,2021,47(10):246-250.
[17]WANG J, YUAN C J, GAO X, et al.Characterization of key aroma compounds in Huangjiu from northern China by sensory-directed flavor analysis[J].Food Res Int,2020,134:109238.
[18]朱长满.煎酒对客家黄酒品质及其抗氧化活性的影响[D].广州:仲恺农业工程学院,2019.
[19]沈棚,薛红玮.陈酿时间对黄酒中挥发性风味物质和氨基酸含量的影响研究[J].中国酿造,2023,42(1):142-146.
[20]高云超,宫晓波,杨春英,等.广东河源客家黄酒氨基酸分析[J].食品安全质量检测学报,2020,11(24):9503-9515.
[21]沈棚,薛红玮.陈酿时间对黄酒中挥发性风味物质和氨基酸含量的影响研究[J].中国酿造,2023,42(1):142-146.
[22]SHEN F,NIU X Y,YANG D T,et al.Determination of amino acids in Chinese rice wine by fourier transform near-infrared spectroscopy[J].J Agr Food Chem,2010,58(17):9809-9816.
[23]陈文颖,周世水,闫统帅,等.基于GC/HPLC检测和苦味评定解析黄酒苦味[J].中国酿造,2022,41(7):191-197.
[24]YU H Y,GUO W,XIE J R, et al.Evaluation of taste characteristics of Chinese rice wine by quantitative description analysis,dynamic description sensory and electronic tongue[J].J Food Meas Charact,2023,17(1):824-835.
[25]张洋洋,张伟国,徐建中,等.米酒液态发酵过程中理化指标和风味物质变化规律[J].东北农业大学学报,2020,51(12):79-89.
[26]YU H Y,WANG X Y,XIE J R,et al.Isolation and identification of bittertasting peptides in Shaoxing rice wine using ultra-performance liquid chromatography quadrupole time-of-flight mass spectrometry combined with taste orientation strategy[J].J Chromatogr A,2022,1676:463193.