古语有云:曲为酒之骨、好曲产好酒[1]。大曲主要以小麦为原料(大麦、豌豆等为辅料),经过润麦、破碎、加水拌料、制坯等工艺流程而获得,其可自然网罗和富集空气、原料、器具、水和房屋等环境中的野生菌,从而选育出优势菌属(细菌、酵母、霉菌等),并在曲坯内生长繁殖[2]。大曲是白酒生产酿造过程中的糖化剂、发酵剂、生香剂,其质量直接影响白酒品质及出酒率。本文将针对强化大曲风味物质及常见的功能微生物,重点综述细菌、酵母菌、霉菌以及特定微生物菌群对强化大曲中关键风味物质的影响,同时简要介绍目前对风味物质检测手段的研究进展,为风味物质的特征及强化大曲的制备及应用提供科学参考。
1 大曲概述
大曲主要是通过人工控温、控湿的条件下培育而成,依据发酵顶温的不同,可将大曲分为高温大曲(发酵最高温度60~70 ℃,郎酒、茅台酒等)、中温大曲(发酵最高温度50~60 ℃,泸州老窖、五粮液等)以及低温大曲(发酵最高温度40~50 ℃,汾酒等),还可根据风味特征、香型、制曲工艺以及功能特性等来区分,各种分类方法之间有密切的关联,具体分类见图1[3]。
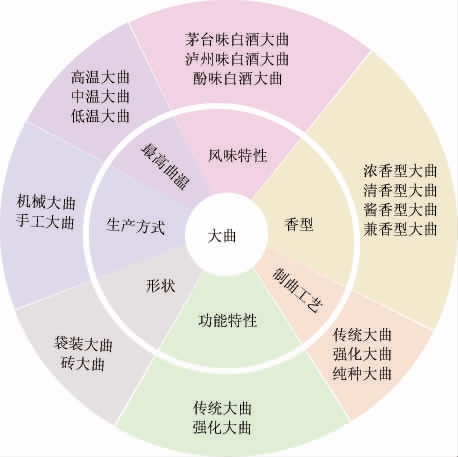
图1 大曲的分类
Fig.1 Classification of Daqu
2 大曲中产香功能微生物
细菌作为白酒酿造过程中最重要的微生物,对提高白酒的风味和品质起着重要作用,一直是研究的重点和热点[4]。酵母作为一类酿酒微生物,不仅是白酒固态发酵过程中的主导力量,而且产香性能对不同香型的白酒品质和特征至关重要[5]。霉菌在大曲发酵过程中产生蛋白酶、脂肪酶、糖化酶、纤维素酶等丰富多样的酶系统,具有酒化、酯化等能力。同时,霉菌的菌丝体有利于大曲内部水分的挥发和物质的利用,对大曲的发酵有着至关重要的作用[6]。然而,在大曲自然富集和接种微生物时,除了产生的有益菌外,不可避免地会混入对酿造白酒有害的微生物,这会影响原酒的品质和安全性。为了解决这个问题,通过针对大曲的特点和相应的缺陷进行针对性的发掘,筛选并接种大量功能微生物,提高大曲的微生物种类及性能、增加风味物质的含量,以达到改善大曲质量的目的,从而提高原酒的产量和品质。
目前,通过筛选功能菌株与制备强化大曲已成为改善和提升白酒质量的首选策略。在Web of Science数据库中,使用“Daqu”关键词检索,并按年份统计文章数量。基于这些文章,使用VOSviewer进行关键词共现网络分析发现,截至2023年12月,在数据库网站中共检索到相关SCI论文441篇,总体上每年文章数量呈递增趋势(图2A),其中近5年所发表文章占66.67%,尤其2022年和2023年文章发表数都达到83篇。此外,论文关键词的共现网络分析结果发现,除检索文献所采用的关键词及其同义词外,出现频次较多的关键词分别为微生物、菌株、代谢物、挥发性化合物、微生物演替、风味物质等(图2B),这一结果表明目前关于大曲的大部分研究主要集中在微生物及风味物质上。
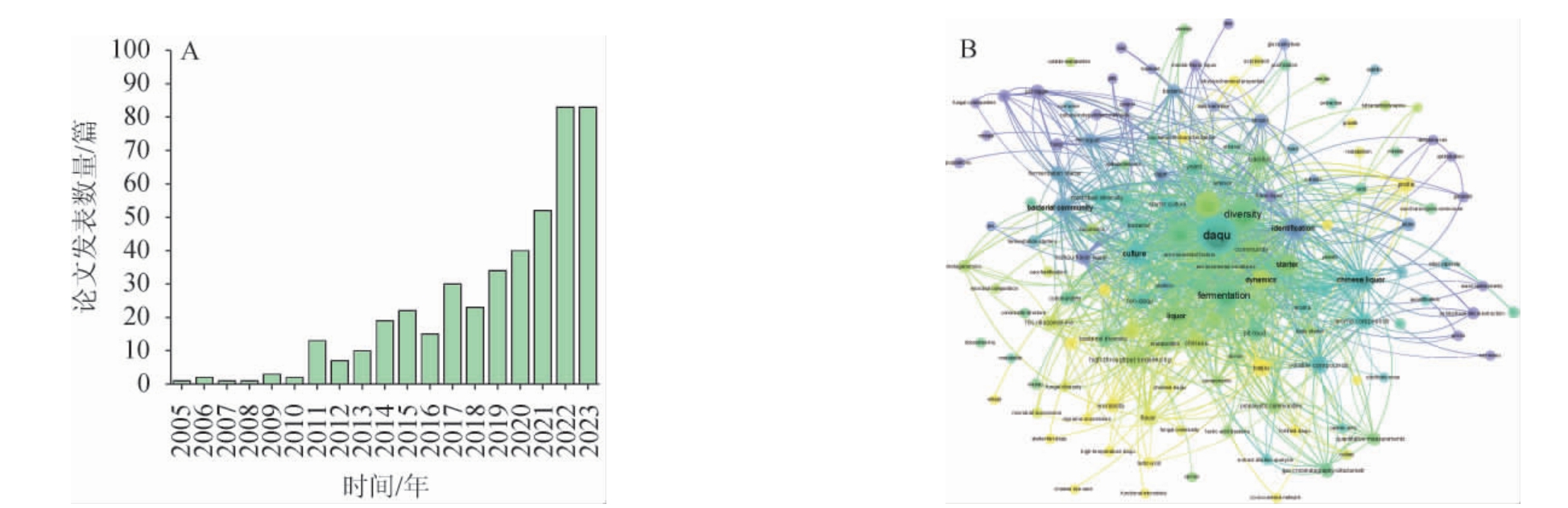
图2 大曲相关SCI论文统计分析结果
Fig.2 Statistical analysis results of the SCI papers related to Daqu
A:各年份发表文章数量;B:关键词共现网络分析。
综合分析关于大曲产香微生物的相关研究发现,从大曲中分离的功能菌株在提升醇类、酯类、酸类、醛酮类等风味物质含量方面展现出良好的应用潜力,特别是芽孢杆菌属(Bacillus)、红曲霉属(Monascus)、乳酸菌以及酿酒酵母(Saccharomyces cerevisiae)等功能菌(表1)。
表1 白酒大曲中功能微生物的分离、鉴定及功能特性
Table 1 Isolation, identification and functional characteristics of functional microorganisms in Baijiu Daqu
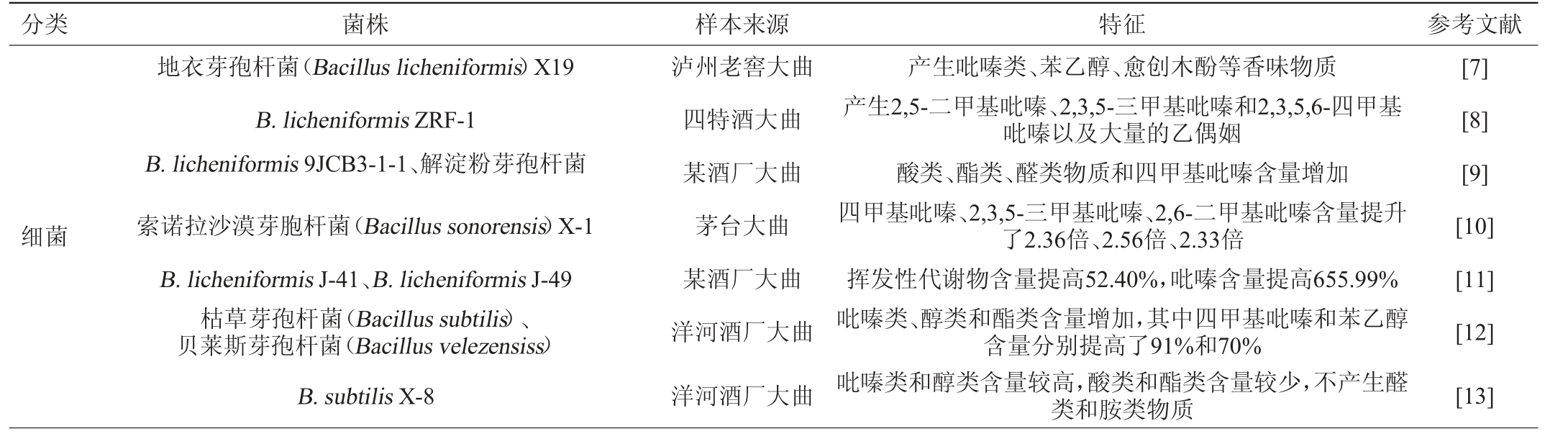
分类 菌株 样本来源 特征 参考文献细菌地衣芽孢杆菌(Bacillus licheniformis)X19 B.licheniformis ZRF-1 B.licheniformis 9JCB3-1-1、解淀粉芽孢杆菌索诺拉沙漠芽胞杆菌(Bacillus sonorensis)X-1 B.licheniformis J-41、B.licheniformis J-49枯草芽孢杆菌(Bacillus subtilis)、贝莱斯芽孢杆菌(Bacillus velezensiss)B.subtilis X-8泸州老窖大曲四特酒大曲某酒厂大曲茅台大曲某酒厂大曲洋河酒厂大曲洋河酒厂大曲产生吡嗪类、苯乙醇、愈创木酚等香味物质产生2,5-二甲基吡嗪、2,3,5-三甲基吡嗪和2,3,5,6-四甲基吡嗪以及大量的乙偶姻酸类、酯类、醛类物质和四甲基吡嗪含量增加四甲基吡嗪、2,3,5-三甲基吡嗪、2,6-二甲基吡嗪含量提升了2.36倍、2.56倍、2.33倍挥发性代谢物含量提高52.40%,吡嗪含量提高655.99%吡嗪类、醇类和酯类含量增加,其中四甲基吡嗪和苯乙醇含量分别提高了91%和70%吡嗪类和醇类含量较高,酸类和酯类含量较少,不产生醛类和胺类物质[7][8][9][10][11][12][13]
续表

分类 菌株 样本来源 特征 参考文献B.subtilis YHB0165、B.subtilis YHB0169蜡样芽孢杆菌(Bacillus cereus)XB-1 B.cereus YB-16 B.cereus wsp-2-2巨大芽孢杆菌(Bacillus megatherium)YHB0170 B.subtilis B.lincheniformis FBKL1.0199 B.lincheniformis X19植物乳杆菌(Lactobacillus plantarum)E2、L.plantarum E11、戊糖片球菌(Pediococcus pentosaceus)E48酿酒酵母(Saccharomyces cerevisiae)J14 S.cerevisiae 95-2 S.cerevisiae YE006 S.cerevisiae Y19异常威克汉姆酵母(Wickerhamomyces anomalus)Y10、W.anomalus Y12扣囊复膜孢酵母(Scchromycopsis fibuliger)Y3、W.anomalus Y5某酒厂大曲泸州老窖大曲泸州老窖大曲某酒厂大曲某酱酒厂大曲某酒厂大曲珍酒酿酒大曲泸州老窖大曲汾酒大曲某酒厂大曲某酒厂大曲某酒厂大曲劲牌大曲某酒厂大曲[14][15][16][17][18][19][20][21][22][23][24][25][26][27]国台酒大曲酵母S.fibulige JM-3长孢洛德酵母(Lodderomyces elongisporus)FBKL2.0073 S.fibuligera FBKL2.0071、伯顿生丝毕赤酵母(Hyphopichia burtonii)FBKL2.0082 W.anomalus J3异常毕赤酵母(Picha anomala)Ac-47、P.anomala Ac-19库德里阿兹氏毕赤酵母(Pichia kudriavzevii)FJQC-XJ-4假丝酵母(Candida pseudohumilis)3-13 P.kudriavzevii Y1511 W.anomalus Y3604、W.anomalus YF1503[28]某酒厂大曲某酒厂大曲茅台大曲泸州老窖大曲某酒厂大曲汾酒大曲五粮液大曲古井贡大曲牛栏山大曲黑曲霉(Aspergillus niger)B[29][30][31][21][32][33][34][35]某酒厂大曲米曲霉(Aspergillus oryzae)Q2、A.oryzae Q11、A.niger Q19、A.niger Q70、米根霉(Rhizopus oryzae)Q48[36]牛栏山大曲霉菌阿姆斯特丹散囊菌(Eurotium cristatus)FBKL3.0120[37]茅台大曲红曲霉(Monascus sp.)C21嗜热红曲霉(Thermophilic monascus)MH-WLY Monascus sp.ZHX9红色红曲霉(Monascus ruber)Hm M.rubber M1、紫红曲霉(Monascus aurantiacus)M2[38]郎酒大曲泸州老窖大曲金种子大曲某酒厂大曲汾酒大曲高产四甲基吡嗪己酸乙酯和丙醇含量高高产己酸乙酯且少产正丙醇高产4-乙基愈创木酚高产四甲基吡嗪、乙酸挥发性风味物质组含量提高高产四甲基吡嗪、乙缩醛、4-羟基-2-丁酮吡嗪类、苯乙醇、愈创木酚等含量增加提高乙酸乙酯、乳酸乙酯、川芎嗪和4-乙基-2-甲氧基苯酚含量具有合成苯甲乙硫醇能力具有产酸、产酯能力高产乙醇含量正丙醇含量降低29.9%,乙酸乙酯含量升高28.8%具较高产乙酸乙酯能力菌株Y3产香气物质为β-苯乙醇、异戊醇、异戊酸和丁酸乙酯;菌株Y5产香气物质为β-苯乙醇、4-乙烯基愈创木酚和异戊酸挥发性风味物质主要为苯乙醇、4-乙基愈创木酚、乙酸、异戊酸多元醇的总量为9.870 g/L高产酯类和醇类等,低产醛、酮、酚和烷类等高产吡嗪类、苯乙醇、愈创木酚等高产乙酸乙酯和乙酸β-苯乙醇、苯乙酸乙酯、乙酸异戊酯、乙酸乙酯和异丁醇含量分别提高12.83%、47.79%、3.66%、8.22%、29.06%高产苯乙醇、异戊醇、2-苯乙酰酯、己酸乙酯、橙花叔醇、芳樟醇、金合欢烯等高产β-苯乙醇菌株Y3604可提高酯类、乙酸乙酯和己酸乙酯含量,降低高级醇类的含量;菌株YF150降低高级醇类的含量高产酚类(2-甲氧基苯酚、4-乙烯基愈创木酚)、醇类(乙醇、仲丁醇)和呋喃类(2-戊基呋喃、2,3-二氢苯并呋喃、3-羟基-2-丁酮);其中2-甲氧基苯酚、4-乙烯基愈创木酚和仲丁醇的含量最高,依次为17.21%、14.88%、5.63%菌株Q2和Q11代谢物中1-辛烯-3-醇含量较高,菌株Q19代谢物中苯乙醇含量较高,菌株Q48和Q70代谢物中十六酸乙酯和亚油酸乙酯等高沸点酯类化合物含量较高挥发性物质以高级醇、酮和呋喃类为主,其中L-芳樟醇、1-辛烯-3-醇、3-辛酮、2-戊基呋喃含量分别为16.37%、41.23%、6.95%、6.75%高产β-苯乙醇、乙醛、乙酸、糠醛、丁二酸二乙酯、癸酸乙酯、丁二醇、戊酸、辛酸、3-羟基丁酮等高产2,3,5-三甲基吡嗪、2,3,5,6-四甲基吡嗪、苯乙醛、苯甲醇、苯乙醇等高产苯乙醇、己酸乙酯、乙偶姻、3-羟基丁酸乙酯乙酸乙酯和乳酸乙酯所占比例较高提高乙酸乙酯和乳酸乙酯、3-羟基2-丁酮含量[39][40][41][42][43]
在白酒固态发酵过程中,产风味物质的微生物不仅具备适应低pH和高乙醇发酵环境的能力,而且还能高效利用糖类物质以及产生所需的酶。此外,在发酵过程中应用性状良好的本地微生物是提高白酒质量和安全性的有力途径。因此,在实验室中获得菌株,并制备强化大曲可用来评估其在模拟白酒发酵中的作用。同时,使用可控制的微生物群落进行白酒发酵对最终产品的一致性质量控制非常重要。由此可见,提供潜在的候选菌株是构建强化大曲微生物群落的第一步,这将有助于控制发酵过程和白酒质量。
2.1 细菌
在世界酿酒系统中,中国是极少数采用细菌作为发酵剂的国家,其中芽孢杆菌在白酒酿造过程中分布广泛,具有丰富的多样性(如B.subtilis、B.licheniformis、B.amyloliquefaciens等),其可分泌多种酶(如淀粉酶、蛋白酶、脂肪酶等)[44],在微生物组的调控和风味化合物的产生中起着重要作用。大量研究发现,芽孢杆菌是代谢吡嗪类物质的主要微生物,吡嗪类物质在白酒特定风味形成中发挥着重要的作用[45],其中2,5-二甲基吡嗪、2,3,5-三甲基吡嗪和2,3,5,6-四甲基吡嗪等均具有抗氧化功能[46],尤其四甲基吡嗪是中药川穹的主要成分,具有抑制肿瘤、治疗糖尿病等功能[47]。目前,研究主要集中在利用功能菌制备强化大曲提高吡嗪类物质产量,如梁慧珍等[10]从高温大曲中筛选得到高产吡嗪类菌株B.sonorensis X-1,其发酵制备的大曲中2,6-二甲基吡嗪、2,3,5-三甲基吡嗪、四甲基吡嗪的含量分别是对照组的2.33倍、2.56倍、2.36倍。TANG Q X等[11]从来自飞行一个月的神舟十一号飞船大曲粉中获得两株B.licheniformis J-41和B.licheniformis J-49,并将其用于制备强化大曲。研究发现,相较于普通大曲,强化大曲的挥发性代谢物含量提高52.40%,吡嗪类物质含量提高655.99%;同时通过研究接种量对挥发物含量影响、芽孢杆菌对菌群结构影响、代谢产物与群落功能的相关性等多个维度揭示了两株芽孢杆菌对大曲属性的影响,为利用功能菌增强目标产物奠定了基础。HE G Q等[12]将贝莱斯芽孢杆菌和枯草芽孢杆菌应用于强化大曲,结果发现吡嗪类、醇类和酯类物质含量分别由189.02 μg/kg、170.52 μg/kg、2 635.69 μg/kg提升到283.19 μg/kg、257.45 μg/kg、3 132.86 μg/kg,其中四甲基吡嗪和苯乙醇含量分别提高了91%和70%。徐岩等[48]研究证明,四甲基吡嗪是由葡萄糖等物质经过枯草芽孢杆菌代谢产生乙偶姻,并与胞外氨反应生成的。四甲基吡嗪具有烘烤的香气,可改善白酒风味,但其在白酒中相对含量较少,因此获得高产吡嗪类物质的芽孢杆菌至关重要。此外,芽孢杆菌还可增加其他风味代谢物如醇、酯、醛类等,XU B Y等[49]向大曲中接种地衣芽孢杆菌和枯草芽孢杆菌,发现强化大曲的风味物质总含量高于普通大曲,其中丙烯酸异戊酯、3-甲基-1-丁醇等风味成分显著增加,苯乙醇和苯乙醛的含量较普通大曲提高了19.5%和31.2%。赵长青等[16]从泸州老窖大曲中分离得到B.cereus YB-16,该菌可形成较多己酸乙酯和较少正丙醇,其对白酒酿造中的特征物质形成具有重要影响。由此可见,芽孢杆菌在提升吡嗪、醇、酯、醛类等挥发性物质含量方面具有广阔应用前景。
乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)和明串珠菌属(Leuconostoc)都属于乳酸菌,大曲中的乳酸菌含量是衡量大曲品质的关键指标,乳酸菌的代谢产物乳酸是形成白酒中乳酸乙酯及其他风味成分的重要前体物质[50],如果大曲中的乳酸含量过高,会导致酒醅酸度过大,对正常的发酵和升温产生负面影响,对酒体造成严重影响[51]。HUANG X N等[22]从清香型大曲中分离得到11种乳酸菌,并将耐受性较好的L.plantarum E2和L.plantarum E11、P.pentosaceus E48分别用于固态发酵,结果发现,菌株E11可显著提高大曲中的苯甲醛、苯乙醛、十六烷酸乙酯、3-甲基丁酸乙酯、3-甲基-1-丁醇含量,菌株E2和E48可提升大曲中的亚油酸乙酯含量,3株菌均可提升大曲中的乙酸乙酯、乳酸乙酯、四甲基吡嗪和4-乙基-2-甲氧基苯酚含量,乙酸乙酯、乳酸乙酯、四甲基吡嗪和4-乙基-2-甲氧基苯酚是清香型白酒的特征风味物质,同时四甲基吡嗪和4-乙基-2-甲氧基苯酚含有保健作用的生物活性成分。总体而言,菌株E2、E11和E48具有应用到大规模生产中的潜力。大量研究表明,乳酸菌不仅是大曲微生物区系的优势菌株,而且与多种菌株之间存在相关性。YANG L等[52]研究发现,乳酸菌与芽孢杆菌、糖多孢菌(Saccharopolyspora)和高温放线菌(Thermoactinomyces)呈负相关,与伊萨酵母菌(Issatchenkia)、念珠菌(Candida)、醋杆菌(Acetobacter)、葡萄糖酸菌(Gluconobacter)呈正相关,此外,乳酸菌还参与了大曲中多糖和氨基酸代谢,醛类、呋喃类、吡嗪类、高级醇类和含氮风味物质的生成,同时促进发酵过程中的美拉德反应,这一结果与LIU J等[53]的研究结果一致。因此,乳酸菌对大曲微生物群落结构的演变和风味物质的积累至关重要,可作为后续研究的重点微生物。
2.2 酵母菌
酵母菌是负责大曲固态发酵的主要微生物,有助于产生乙醇以及一系列挥发性风味化合物,包括酯类、酮类、酚类和烯烃类等。其中酵母菌主要以酿酒酵母、复膜孢酵母属、毕赤酵母属等较为常见。随着研究的深入,多株具有产香的酵母菌株陆续被分离鉴定,培养条件也被优化。ZHANG G H等[23]从来自不同酒厂的大曲样品中获得一株以L-半胱氨酸和苯甲醛为前体底物,通过生化反应合成苯甲乙硫醇的S.cerevisiae J14,这是首次从白酒发酵系统中获得可产苯甲乙硫醇的酵母菌。大量研究表明,苯甲乙硫醇具有独特的香气特征,可以增强白酒的整体香气,但浓度过高或不协调会导致白酒异味。胡志平等[24]采用气相色谱对发酵产物追踪,发现S.cerevisiae 95-2具有提高产酸、产酯能力。PU S C等[25]从安徽某酒厂大曲中分离获得16株酵母菌,其中S.cerevisiae YE006发酵产乙醇的能力最强。虽然酿酒酵母具有较强的产乙醇能力,但酿酒酵母随着发酵体系中温度的上升活性会越来越低甚至逐渐死亡[54-55]。近年来,有研究发现,复膜孢酵母属和毕赤酵母属等可在生物酶的作用下合成酯类、高级醇类等香气化合物,增加风味复杂性,从而改善产品的最终风味[56]。如卢延想等[28]从国酒大曲中获得产香较好的S.fibuliger Y3,菌株Y3固态发酵产物主要为β-苯乙醇、异戊醇、异戊酸和丁酸乙酯,其中异戊醇口感微甜,对白酒起到助香作用,丁酸乙酯属于白酒四大酯之一,是构成白酒独特风格的重要物质。刘茗铭[29]研究发现,S.fibulige JM-3的固态发酵产物苯乙醇、4-乙基愈创木酚、乙酸、异戊酸等物质含量都较为丰富。张学林等[33]筛选到一株产β-苯乙醇的P.kudriavzevii,该菌株使白酒中的β-苯乙醇(15.11 mg/L)、苯乙酸乙酯(5.35 mg/L)、乙酸异戊酯(23.76 mg/L)、乙酸乙酯(4.99 mg/L)和异丁醇(1.22 mg/L)含量分别提高12.83%、47.79%、3.66%、8.22%、29.06%,促进了白酒香气成分的生成,改善了原酒的品质。
相对于单一菌株,使用复配菌株在一定程度上可提高菌株的性能。张春林等[57]利用从浓香型大曲中获得的汉逊酵母(Ogataea polymorpha)JM-1和JM-2、S.cerevisiae JM-3、P.kudriavzevii JM-4进行复配实验发现,强化大曲样品中2-甲基-1-丙醇、1-己醇、戊四醇、丁醇、丙醇、乙酸甲酯、乙酸丙酯、甲酸乙酯的含量明显高于普通大曲,其总酯含量达到224.29 mg/100 mL。PU S C等[25]从浓香型大曲样品中共分离出16株酵母菌,首先对每种酵母的发酵能力及其挥发性化合物的产生进行了初步评估,研究表明S.cerevisiae YE006的发酵产乙醇能力最强,但产生挥发性化合物的能力相对较弱,而W.anomalus YE010则相反;然而,将这两种酵母菌(YE006和YE010)按2%的接种量、1∶2(V/V)的比例混合添加后,获得了最大的发酵、糖化、液化和酯化能力以及高含量的挥发性化合物。以上研究为通过生物强化来保证大曲质量、提高浓香型白酒的一致性和风味提供了可靠的途径。由此可见,酿酒酵母、扣囊腹膜孢酵母、毕赤酵母等菌属的一些菌株及复配构建的菌群对保持白酒的一致性和提高白酒风味至关重要,具有广阔的应用前景。
2.3 霉菌
霉菌是大曲中数量以及种类最多的一类微生物,其中,以曲霉(Aspergillus)最多,其次是红曲霉(Monascus)、根霉(Rhizopus)、毛霉(Mucor)、犁头霉(Absidia)等。霉菌是固态发酵中主要的糖化动力,此外还具有产香功能,参与到生成多种高级醇、醛、酮、酯等风味物质的发酵过程中,促进白酒风味的形成,提升白酒品质。鲁珍等[36]采用传统分离霉菌的方法从高温大曲中获得一株产香黑曲霉,该菌对固态发酵产物贡献香味成分最多的物质是酚类(2-甲氧基苯酚、4-乙烯基愈创木酚)、醇类(乙醇、仲丁醇)和呋喃类(2-戊基呋喃、2,3-二氢苯并呋喃、3-羟基-2-丁酮);其中,2-甲氧基苯酚(17.21%)和4-乙烯基愈创木酚(14.88%)的含量最高。研究发现,这两种物质具有烟熏风味,是酱香型白酒中主要的酚类物质来源,同时具有抗氧化活性[58]。王晓丹等[38]从茅台大曲中分离筛选获得阿姆斯特丹散囊菌,通过固相微萃取-气质联用技术检测发现,挥发性香味物质以高级醇、酮和呋喃类为主,其中1-辛烯-3-醇(41.23%)、L-芳樟醇(16.37%)、3-辛酮(6.95%)和2-戊基呋喃(6.75%)的相对含量较高,这四种物质都具有浓烈花香味或果香味。蒋英丽等[39]利用平板涂布法从郎酒大曲中分离获得六株霉菌,利用气相色谱对香气成分分析发现,红曲霉属、木霉属(Trichoderma)、地霉属(Geotrichum)、根霉属(Rhizopus)能为酱香型白酒独特风味的形成提供果香。
红曲霉可以利用乳酸形成己酸乙酯,达到增己降乳的目的,还能通过代谢产生高级脂肪酸(油酸、亚油酸、硬脂酸等)和氨基酸(谷氨酸、丙氨酸、酪氨酸等),为香味物质(醛、酮、吡嗪等)的形成提供前体物;同时由于红曲霉的生长较为缓慢,在大曲菌系中的竞争优势较弱,不利于形成优势菌种[41]。因此,通过分离纯化等方式获得具有特殊产物的纯种红曲霉菌株用于强化制曲具有重要的作用,程伟等[41]从金种子浓香型大曲中分离获得Monascus sp.ZHX9,其在温度35 ℃、pH为4.5、酒精度为6%vol的培养基中发酵得到的种子液中可挥发性香气成分主要有醇类(70.6%)、醛酮类(15.68%)、酯类(7.09%)、吡嗪类(1.22%)等,其中苯乙醇、乙偶姻、3-羟基丁酸乙酯、己酸乙酯、2-甲基吡嗪类均具有令人愉悦的香气。郭晋田[42]采用传统微生物分离手段从山西红心大曲内分离出一株产酯化酶活性较高的红曲霉,该菌具有明显的玫瑰葡萄香气,使酒样的香气更加醇厚协调。刘新宇[43]从清香型大曲中分离筛选得到M.rubber M1和M.aurantiacus M2,将其在温度35 ℃、pH 6.5、酒精度为10%vol的条件下固态发酵8 d,利用气相色谱分析发现红曲霉提高了乙酸乙酯和乳酸乙酯的含量,值得注意的是,菌株M1和M2显著提高了醋嗡(3-羟基-2-丁酮)的含量,醋嗡是整个代谢体系中较为重要的中间产物,具有令人愉快的气味,红曲霉在汾酒的酿造过程中扮演了多重角色。这些研究为红曲霉的强化制曲和白酒酿造等领域的生产应用等提供了参考。
2.4 微生物群落
在白酒酿造过程中,大曲中的各种微生物对酿造原料进行转化,同时微生物之间的代谢活动以及相互作用是酿酒的关键,它们增殖并取代了原有的大曲微生物群落,在这一置换过程中,发酵系统逐渐富集代谢产物,同时积累各种风味物质及其前体物,最后,随酿造过程迁移至白酒中,为白酒增加风味体系[59]。因此,大曲中微生物群落结构的组成同样对白酒质量有着重要的影响,深入了解微生物群落的演替以及微生物之间的相互作用机理有助于调控大曲,以及提升白酒的质量。
HE G Q等[60]采用外源接种Bacillus velezensis和Bacillus subtilis制备强化大曲,两株菌的接种量为1%,结果表明,风味代谢物与微生物群落之间存在很强的相关性,辛酸乙酯、己酸乙酯、己酸己酯、己醇和己酸是浓香型白酒中重要的风味化合物,它们与己酸菌、梭菌和芽孢杆菌呈正相关,在这些化合物中,酯类也与曲霉和念珠菌呈正相关;此外,乳杆菌与乳酸和乳酸乙酯之间存在正相关关系,布勒掷孢酵母属(Bullera)和Thermomyces与乙酸苯乙酯和苯乙醇呈显著正相关;同时也发现强化大曲的添加改变了微生物种间相互作用的多样性和复杂性,芽孢杆菌作为主要的外源干扰物,在添加后与拟无枝酸菌属(Amycolatopsis)、中间根瘤菌属(Mesorhizobium)和甲基杆菌属(Methylobacterium)呈正相关。虽然这些属在白酒酿造过程中的作用尚不清楚,但在其他领域受到广泛关注。强化大曲改变了白酒酿造过程中风味代谢产物和微生物的分布,同时酿酒微生态系统的微生物群结构向有利于生产优质浓香型白酒的方向进化。HE M W等[59]研究浓香型大曲微生物在风味形成中的作用时发现,酯类物质与曲霉的生成密切相关,此外,值得注意的是,通过α-多样性指数的相关结果发现,大曲中风味物质种类越多,大曲的微生物丰富度也越高;随着大曲生产温度的降低,微生物逐渐积累,此时保存了一些耐热微生物,如高温放线菌属、热子囊菌属(Thermoascus)和嗜热真菌属(Thermomyces),提高了微生物群落的丰富度。DENG Y K等[61]研究发现,热子囊菌属是整个发酵过程中的主要真菌属,其相对丰度与乙醇和油酸乙酯含量呈正相关,同时,在发酵中后期,芽孢杆菌是主要的细菌,2,3-丁二醇含量的变化与芽孢杆菌丰度的变化呈正相关。这些发现通过探究代谢产物的变化来反映发酵过程中微生物的变化,可以实现大曲优质菌株的快速检测,有助于控制大曲制作过程中的微生物,获得更稳定的白酒产品。不动杆菌迄今为止,只有少数研究报道了大曲中微生物群落的具体功能,如YANG Y等[50]以泸州老窖大曲为研究对象,发现乳酸菌(主要是魏斯氏菌、乳酸杆菌(Lactobacillales)和链球菌(Pediococcus))、毛霉菌(主要是分枝横梗霉(Lichtheimia))、散囊菌等(主要是曲霉、罗山松菌(Rasamsonia)、丝衣霉菌(Byssochlamys))是中温大曲中潜在的优势群体,依次负责生产分解酶和风味前体化合物;其中只有细菌可能参与丁烷-2,3-二醇(如魏斯氏菌属、乳杆菌属、葡萄球菌属(Staphylococcus))和丁酸甲酯(高温放线菌属)的代谢,只有真菌有可能参与愈创木酚(丝衣霉属)和4-乙烯基愈创木酚(曲霉属)的生物合成,该研究对阐明微生物的不同代谢作用以及大曲部分功能的形成机制具有一定的作用。ZHU Q等[62]研究发现,酱香型大曲的核心功能群落(core functional community,CFC)能产生丰富的酶和香气,CFC主要由7个细菌属和4个真菌属构成(Acinetobacter(不动杆菌属)、Kroppenstedtia(克罗彭斯特菌属)、Ochrobactrum(苍白杆菌属)、Thermoactinomyces、Bacillus、Brevibacterium、Saccharopolyspora、Aspergillus、Byssochlamys、Thermoascus、Thermomyces);不动杆菌属和糖多孢菌属与大多数代谢物呈较强的正相关,尤其是2-呋喃甲醛、苯甲醛、乙酸、2-呋喃甲醇、苯乙醛、3-甲基丁醛等;细菌属在代谢标志物的显著变化中发挥了重要作用,相反,真菌属与风味呈负相关,其中红曲霉属和红曲霉属与三甲基吡嗪和四甲基吡嗪呈负相关。在大曲发酵过程中,微生物之间的相互作用影响了微生物群落结构的演替,改变了发酵系统的生态条件。因此,了解微生物群落的演替和微生物之间的相互作用将有助于调节和提高大曲和白酒的品质。
3 大曲风味物质的检测方法
近年来,为了充分了解大曲风味物质的组成,尽快实现大曲增香、提高白酒品质的目的,多样化的方法被投入到大曲曲香物质的检测中。赵东等[63]首次利用顶空固相微萃取气质联用(headspace solid phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)仪检测出大曲中68种挥发性物质,并发现成品曲中很多化合物与白酒中相同,说明大曲挥发性化合物在白酒酿造过程中有重要作用。自此研究人员开始利用HS-SPME-GC-MS技术对大曲挥发性化合物进行解析。陈勇等[64]利用HS-SPME-GCMS技术从泸州老窖中高温大曲中共检出34种挥发性化合物。姚霞等[65]利用同样的技术在中高温大曲中检测出46种挥发性化合物,其中酯类物质(十四酸乙酯、苯乙酸乙酯、癸酸乙酯、亚油酸乙酯、9-十六碳烯酸乙酯等)和吡嗪类物质(2,5-二甲基吡嗪、2,3,5-三甲基吡嗪、2,3,5,6-四甲基吡嗪等)相对含量较高。HS-SPME-GC-MS具有进样量少、操作简单和特异性好等优点。随着检测技术的发展,多次顶空固相微萃取(multiple headspace solid phase microextraction,MHS-SPME)已成功应用于面粉、奶酪、蘑菇、番茄等挥发性化合物的定量分析,该技术是在HS-SPME的基础上发展的定量分析方法,使用这种方法可以克服基质效应,准确定量复杂液体或固体样品中的微量组分[66-67]。LI H D等[68]首次将MHS-SPME结合直接-气相色谱-嗅觉法(direct-gas chromatography-olfaction,DI-GC-O)应用于古井贡大曲挥发物分析的研究,结果共检测出36种酯类化合物、22种醇类化合物、14种醛类化合物、7种酮类化合物、4种内酯类化合物、8种酚类和呋喃类化合物、12种含氮化合物、9种萜烯类化合物、3种含硫类化合物和9种其他化合物。其中愈创木酚、4-乙基-2-甲氧基苯酚、2-乙基-3,5-二甲基吡嗪、呋喃醇、2,3,5-三甲基吡嗪等是大曲香气的重要成分。气相色谱-嗅闻-质谱(gas chromatography-olfactometry-mass spectrometry,GC-O-MS)是一种可快速获得物质香气强度值的技术,其在GC-MS的基础上新加入了一个嗅觉闻香装置。ZHANG C L等[69]利用频率检测法和香气提取稀释分析法这两种气相-嗅闻法技术对泸州老窖大曲的香气进行分析,发现主要与己醛(青草香)、苯乙醛和4-乙基愈创木酚(丁香花、烟熏香)有关,ZHENG J等[70]研究发现,五粮液包包曲发酵过程中的芳香活性化合物为苯乙醇、4-乙烯基愈创木酚(烟熏香)等,发酵第21天和第27天最重要的挥发性化合物是(E,E)-2,4-己二烯醛、(E,E)-2,4-壬二烯醛、乙酸和丁酸。目前已从大曲中检测到456种风味物质,其中酯类最多(20.6%),其次为醇(13.6%)、醛(9.4%)、酸(9%)、吡嗪类(7.9%)、酮类(7.5%)、脂肪烃(5.5%)等,其他杂环类、呋喃类、含氮类、酚类、醚类、含硫类、芳香烃、萜烯类、内酯类和缩羰基类含量相对较少[71]。虽然大量的风味物质已被检测到,但目前对风味物质的研究主要集中在产香微生物分析上,未来可结合芳香萃取物稀释分析、外标标准曲线法、内标标准曲线法或稳定同位素稀释法等多种定量方法进行风味物质检测。
4 结语与展望
大曲作为糖化发酵剂,其对白酒的风味和品质有重要影响,其中微生物种类和数量决定着白酒的酒质、出酒率和风味成分。从大曲中定向获得功能微生物制作强化大曲具有广阔的应用前景,已受到广泛关注。具有产特定风味的芽孢杆菌属、乳酸菌属、酿酒酵母属、复膜孢酵母属、毕赤酵母属、红曲霉属等已陆续被发现,并展现出良好的应用潜力。然而,到目前为止,已获取的功能菌种资源仍较为有限,对相关菌株的生理特征、降解代谢途径、基因组与功能基因信息、发酵工艺中常规微生物组之间的协同互作关系以及其在白酒酿造过程中发挥功能的影响因素等方面的研究较少,这在很大程度上限制了功能微生物的创新和发展。综合以上分析,未来可从三个方面进一步深入的开展产风味物质微生物和微生物组的相关研究:通过利用单细胞高通量分选等新技术,克服强化功能菌株的难培养性,挖掘和获取新型的用于强化大曲的菌株,建立具有产特定风味物质的微生物菌种资源与基因信息库,深入阐明功能菌株的作用机制、条件以及代谢调节等功能,为提高大曲、白酒的品质提供重要的菌种资源和理论基础;利用微生物分析技术和代谢组学,通过分析大曲发酵过程的微生物群落结构、演替规律和代谢特征,阐明核心菌群以及影响核心菌群的关键因素,从群落组成、群落调控、代谢物调控等方面对合成菌群进行调控,为实现白酒质量的控制和标准化工程提供重要理论和技术支撑;在深入研究和应用强化大曲用于酿造工艺的过程中,以基于风味导向为研究策略,系统分析添加强化大曲后对后期入池发酵过程的影响,评价其对白酒风味品质的提升。建立制曲过程与发酵过程的关联,实现酿造过程中产酒量及风味品质的提升。
[1]韩培杰.中国白酒大曲微生物多样性研究[D].福州:福建农林大学,2023.
[2]WANG L.Research trends in Jiang-flavor Baijiu fermentation:From fermentation microecology to environmental ecology[J].J Food Sci,2022.87(4):1362-1374.
[3]黄平,王子豪,郑佳,等.浓香型白酒大曲微生物群落结构研究进展[J].微生物学通报,2023,50(7):3170-3186.
[4]DU H,MEI J,XING M Y,et al.The effects of dynamic bacterial succession on the flavor metabolites during Baijiu fermentation[J].Food Res Int,2021,140:109860.
[5]WANG S L,WU Q,YAO N,et al.Construction of synthetic microbiota for reproducible flavor compound metabolism in Chinese light-aroma-type liquor produced by solid-state fermentation[J].Appl Environ Microbiol,2019,85(10):03090-18.
[6]唐佳代,刘力萍,龙亚飞,等.不同感官特性酱香大曲细菌群落结构与理化特性研究[J].中国酿造,2022,41(1):138-142.
[7]明红梅,郭志,周健,等.浓香型大曲中产香微生物的筛选及鉴定[J].现代食品科技,2015,31(4):186-191.
[8]游勇,吴晓玉,廖家富,等.特香型白酒大曲中一株耐热产淀粉酶地衣芽孢杆菌的分离和鉴定[J].酿酒科技,2022(3):17-24.
[9]陈家晖.内源性芽孢杆菌的生物强化对大曲的理化特性和微生物群落的影响[D].武汉:武汉轻工大学,2022.
[10]梁慧珍,卢延想,刘正,等.高温大曲中高产吡嗪类物质芽孢杆菌的筛选与应用[J].中国酿造,2022,41(1):116-122.
[11]TANG Q X, CHEN X R, HUANG J, et al.Mechanism of enhancing pyrazines in Daqu via inoculating Bacillus licheniformis with strains specificity[J].Foods,2023,12(2):304.
[12]HE G Q,DONG Y,HUANG J,et al.Alteration of microbial community for improving flavor character of Daqu by inoculation with Bacillus velezensis and Bacillus subtilis[J].LWT-Food Sci Tehcnol,2019,111:1-8.
[13]陈桂芳,王晓慧,赵琦,等.洋河浓香型大曲产香细菌的筛选、鉴定及香气成分分析[J].酿酒科技,2022(5):30-34.
[14]ZHANG Y, XU J, DING F, et al.Multidimensional profiling indicates the shifts and functionality of wheat-origin microbiota during high-temperature Daqu incubation[J].Food Res Int,2022,156:111191.
[15]ZHAO C Q,YAN X L,YANG S T,et al.Screening of Bacillus strains from Luzhou-flavor liquor making for high-yield ethyl hexanoate and low-yield propanol[J].LWT-Food Sci Technol,2017,77:60-66.
[16]赵长青,徐莎,杨阳,等.浓香型白酒酿造大曲及糟醅中功能芽孢杆菌的筛选[J].食品工业科技,2017,38(7):151-155.
[17]王成俊,李玲珊,范梅,等.酱香型大曲中产4-乙基愈创木酚芽孢杆菌的筛选、鉴定及特性研究[J].酿酒科技,2023(4):45-52.
[18]ZHANG Y D,XU J G,DING F,et al.Multidimensional profiling indicates the shifts and functionality of wheat-origin microbiota during hightemperature Daqu incubation[J].Food Res Int,2022,156:111191.
[19]周习,云岭,邱声强,等.产酱香芽孢杆菌在酱香大曲中的生产应用研究[J].酿酒科技,2022(3):89-92,96.
[20]王晓丹,雷安亮,王婧,等.产四甲基吡嗪地衣芽孢杆菌的应用[J].中国酿造,2017,36(2):35-38.
[21]明红梅,郭志,周健,等.浓香型大曲中产香微生物的筛选及鉴定[J].现代食品科技,2015,31(4):186-191.
[22]HUANG X N, FAN Y, MENG J, et al.Laboratory-scale fermentation and multidimensional screening of lactic acid bacteria from Daqu[J].Food Biosci,2021,40(6):100853.
[23]ZHANG G H,XIAO P,XU Y Q,et al.Isolation and characterization of yeast with benzenemethanethiol synthesis ability isolated from Baijiu Daqu[J].Foods,2023,12(13):2464.
[24]胡志平,梁振荣,柯锋,等.米香型白酒酒曲的研究与应用[J].轻工科技,2015,31(11):9-11.
[25]PU S C,ZHANG Y,LU N,et al.Yeasts from Chinese strong flavour Daqu samples: isolation and evaluation of their potential for fortified Daqu production[J].AMB Express,2021,11(1):176.
[26]林斌,唐洁,江威,等.低产正丙醇酵母菌的筛选及其在清香型白酒中的应用[J].中国酿造,2023,42(4):131-136.
[27]刘薇,栾春光,王德良,等.高产酯酵母的筛选、鉴定及其发酵特性研究[J].食品与发酵工业,2021,47(23):311-318.
[28]卢延想,梁慧珍,陈鹏,等.高温大曲中产香酵母的筛选及特征香气分析[J].食品研究与开发,2021,42(11):167-174.
[29]刘茗铭.高温大曲中产香功能微生物的筛选及其应用研究[D].自贡:四川轻化工大学,2019.
[30]白小燕,邱树毅,雷安亮,等.酱香白酒酿造过程中产多元醇功能酵母的筛选[J].中国酿造,2017,36(5):58-62.
[31]王晓丹,陈美竹,班世栋,等.茅台大曲中酵母的分离、鉴定及其功能初探[J].食品科学,2017,38(4):51-57.
[32]王旭亮,王异静,王德良,等.清香型白酒优质产酯酵母菌筛选[J].酿酒,2012,39(4):28-33.
[33]张学林,季斌,许玲,等.清香型大曲中产β-苯乙醇酵母的分离、鉴定及在白酒酿造中的应用[J].中国酿造,2022,41(1):123-127.
[34]张建敏,杨康卓,刘芳,等.一株产香假丝酵母的筛选及其特征代谢风味物质分析[J].酿酒科技,2020(12):34-37,43.
[35]许岱,范光森,富志磊,等.一株高产β-苯乙醇酵母菌的筛选、鉴定及其发酵条件优化[J].食品工业科技,2017,38(5):151-158.
[36]鲁珍,王红照,李恩中,等.高温大曲中霉菌的筛选及其挥发性产物分析[J].酿酒科技,2019(7):50-55.
[37]柳旭,张倩,周森,等.清香型大曲中高糖化力霉菌的筛选、鉴定及其挥发性风味物质分析[J].中国酿造,2023,42(6):72-78.
[38]王晓丹,徐佳,周鸿翔,等.酱香型大曲中分离到的阿姆斯特丹散囊菌产酶产香特性[J].食品科学,2016,37(11):154-159.
[39]蒋英丽,卓毓崇,聂正东,等.高温大曲中产果香霉菌的分离及研究[J].酿酒科技,2015(2):21-24.
[40]周健,姚霞,崔小亮,等.一株嗜热红曲霉的分子鉴定及其风味物质初步分析[J].中国调味品,2016,41(2):1-5,25.
[41]程伟,潘天全,张杰,等.一株紫色红曲霉菌的筛选鉴定及其应用性能分析[J].酿酒,2021,48(1):67-75.
[42]郭晋田.基于风味和产酶性能的高产酯化酶红曲霉Hm的分离鉴定及应用研究[D].晋中:山西农业大学,2020.
[43]刘新宇.红曲霉的分离纯化及在清香型白酒中的应用[D].太原:山西师范大学,2014.
[44]黄锶钘,王玉荣,贺子豪,等.高温大曲中芽孢杆菌菌群多样性解析及其分离株鉴定[J].中国酿造,2024,43(3):79-83.
[45]姚霞,明红梅,周健,等.十个浓香型大曲挥发性风味物质的主成分分析[J].食品研究与开发,2015,36(14):15-20.
[46]吴建峰.白酒中四甲基吡嗪全程代谢机理研究[D].无锡:江南大学,2013.
[47]郭学武,范恩帝,马冰涛,等.中国白酒中微量成分研究进展[J].食品科学,2020,41(11):267-276.
[48]徐岩,吴群,范文来,等.中国白酒中四甲基吡嗪的微生物产生途径的发现与证实[J].酿酒科技,2011(7):37-40.
[49]XU B Y,XU S S,CAI J,et al.Analysis of the microbial community and the metabolic profile in medium-temperature Daqu after inoculation with Bacillus licheniformis and Bacillus velezensis[J].LWT-Food Sci Technol,2022,160:113214.
[50]YANG Y,WANG S T,LU Z M,et al.Metagenomics unveils microbial roles involved in metabolic network of flavor development in mediumtemperature Daqu starter[J].Food Res Int,2021,140:110037.
[51]ZHENG X W, YAN Z, NOUT M J, et al.Microbiota dynamics related to environmental conditions during the fermentative production of Fen-Daqu,a Chinese industrial fermentation starter[J].Int J Food Microbiol,2014.182-183:57-62.
[52]YANG L,CHEN J,LI Z,et al.Effect of lactic acid bacteria on the structure and potential function of the microbial community of Nongxiangxing Daqu[J].Biotechnol Lett,2023,45(9):1183-1197.
[53]LIU J,WU Q,WANG P,et al.Synergistic effect in core microbiota associated with sulfur metabolism in spontaneous Chinese liquor fermentation[J].Appl Environ Microbiol,2017,83(24):e01475-17.
[54]王灏,王航,孟春,等.基因组改组技术选育耐高温、耐高乙醇酿酒酵母菌株的研究[J].微生物学通报,2007(4):705-708.
[55]路玲玲,檀建新,张伟,等.酵母细胞膜系统对高温和高酒精浓度的适应性[J].河北农业大学学报,2003(S1):163-166.
[56]JIANG X,LU Y,LIU S Q.Effects of different yeasts on physicochemical and oenological properties of red dragon fruit wine fermented with Saccharomyces cerevisiae,Torulaspora delbrueckii and Lachancea thermotolerans[J].Microorganisms,2020,8(3):315.
[57]张春林,敖宗华,炊伟强,等.顶空固相微萃取-气质联用快速测定大曲中的挥发性风味成分[J].食品科学,2011,32(10):137-140.
[58]黄蕴利,黄永光,郭旭,等.白酒中的主要生物活性功能成分研究进展[J].食品工业科技,2016,37(15):375-379.
[59]HE M W, JIN Y, ZHOU R Q, et al.Dynamic succession of microbial community in Nongxiangxing daqu and microbial roles involved in flavor formation[J].Food Res Int,2022.159:111559.
[60]HE G Q,HUANG J,WU C D,et al.Bioturbation effect of fortified Daqu on microbial community and flavor metabolite in Chinese strong-flavor liquor brewing microecosystem[J].Food Res Int, 2020, 129: 108851.
[61]DENGYK,HUANGD,HANB L,et al.Correlation:between autochthonous microbial diversity and volatile metabolites during the fermentation of Nongxiang Daqu[J].Front Microbiol,2021,12:688981.
[62]ZHU Q,CHEN L,PENG Z,et al.Analysis of environmental driving factors on core functional community during Daqu fermentation[J].Food Res Int,2022,157:111286.
[63]赵东,李扬华,向双全,等.顶空固相微萃取气相色谱质谱法测定曲药中的香味成分[J].酿酒科技,2006(5):92-94.
[64]陈勇,陈泽军,周瑞平,等.顶空固相微萃取-气相色谱-质谱法测定大曲中的挥发性组分[J].中国调味品,2013,38(2):70-75.
[65]姚霞,明红梅,周健,等.十个浓香型大曲挥发性风味物质的主成分分析[J].食品研究与开发,2015,36(14):15-20.
[66]陈璐,王松,孙金沅,等.多次顶空固相微萃取方法的原理及应用[J].精细化工,2019,36(10):1989-1994.
[67]王松,陈璐,刘国英,等.多次顶空固相微萃取在大曲挥发性化合物定量中的应用[J].精细化工,2020,37(2):346-355,390.
[68]LI H D,LIU S Y,LIU Y B, et al.Functional microorganisms in Baijiu Daqu: Research progress and fortification strategy for application[J].Front Microbiol,2023,14:1119675.
[69]ZHANG C L,AO Z H,CHUI W Q,et al.Characterization of the aromaactive compounds in Daqu: a tradition Chinese liquor starter[J].Eur Food Res Technol,2012,234(1):69-76.
[70]ZHENG J, ZHAO D, PENG Z, et al.Variation of aroma profile in fermentation process of Wuliangye baobaoqu starter[J].Food Res Int,2018,114:64-71.
[71]何佳欢.中温大曲曲香物质分析及重构研究[D].无锡:江南大学,2022.