浓香型白酒是中国白酒主要香型之一[1],窖泥对浓香型白酒风格的形成起决定性作用。部分窖泥在长期使用期间会出现退化现象,致使酒质下降[2-3]。窖泥酸化即pH降低是窖泥退化主要表征之一[4],退化窖泥pH一般低于4.5[5-6],将pH提高至5.0~7.5有助于提高窖泥品质[7]。目前,主要采用化学方法调节pH,在培养人工窖泥时加入氢氧化钠溶液或者碳酸钠溶液的方式,但这种方式无法持续维持窖泥正常pH。因此,寻求一种能够持续调节窖泥pH、且提高窖泥质量的有效方法成为本领域亟待解决的技术问题。
接种功能微生物是有效的窖泥修复方法之一。早期研究重点集中在产有机酸微生物的研究,吴玉轩[8]将分离得到的高产己酸菌株克氏梭菌(Clostridium kluyveri)btq-7应用于人工有机窖泥,明显提高了窖泥质量,原酒中己酸乙酯显著提高。近年来随着窖泥酸化、pH降低的问题越来越引发关注,研究人员开始研究窖泥pH的微生物调控,郑慧珍[9]利用Petrimonas sulfuriphila LBM11005与己酸菌Caproicibacterium sp.LBM19010的共培养实验发现,P.sulfuriphila在窖泥生境中具有维持发酵体系pH稳态的生态学功能;李斯琳等[10]将克氏梭菌(Clostridium celerecrecns)制成养护液喷洒于窖池中,窖池pH升高2.0左右,有效改善窖池pH下降的问题,提升了基酒质量;白霞等[11]从窖泥中分离筛选出的4株酸性脲酶产生菌可以不同程度提高模拟窖泥pH值及主要挥发性风味物质含量。目前,鲜见关于接种微生物对窖泥中微生物群落结构影响的研究报道。
项目研究团队首次以优质窖泥为菌源筛选出一株寡养单胞菌属微生物Stenotrophomonas terrae,该菌可将液体培养基的pH从4.0提升至7.0[12]。研究表明,寡养单胞菌属多为环境有益菌,部分菌株在植物生长调节、生物毒素降解、土壤重金属修复领域,具有良好的应用研发前景[13]。本研究将Stenotrophomonas terrae接种于退化窖泥,以正常窖泥及退化窖泥为对照,将不同窖泥进行模拟发酵实验,对发酵结束后的窖泥、糟醅、酒样理化指标及细菌菌群进行检测,并对不同窖泥样品细菌菌群进行主坐标分析(principal coordinates analysis,PCoA)及相关性网络分析,以期通过功能微生物改善窖泥微生物群落结构,开发退化窖泥的微生物修复技术,为解决窖泥退化的技术难题提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
窖泥、糟醅(入窖粮糟)样品:采集自四川省某优质浓香型白酒企业。
窖泥:选择3口出现窖泥退化的窖池,采集退化窖泥(D)共2.4 kg,选择3口正常窖池采集正常窖泥(N)共1.2 kg;退化窖泥和正常窖泥分别混合均匀后放入无菌密封袋,放置于4 ℃保存。
Stenotrophomonas terrae(保藏号为CCTCC NO:M 20221907):由四川省食品发酵工业研究院有限公司选育,保藏于中国武汉大学的中国典型培养物保藏中心。
1.1.2 试剂
硫酸亚铁、磷酸二氢钾、氯化钾、硫酸镁、四水合酒石酸钾钠、氯化铵、氢氧化钠、乙酸钠、氯化钠、乙酸乙酯、己酸乙酯(均为分析纯):国药集团化学试剂有限公司;重铬酸钾、浓硫酸、盐酸(均为分析纯):成都市科隆化学品有限公司;丁酸、己酸(均为色谱纯):上海阿拉丁生化科技股份有限公司;蛋白胨(生化试剂):青岛高科技工业园海博生物技术有限公司;土壤铵态氮含量检测试剂盒:北京索莱宝科技有限公司PowerSoil脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:美国MOBIO公司;NadPrep文库构建试剂盒:纳昂达(南京)生物科技有限公司。
1.1.3 培养基
液体富集培养基:蛋白胨5g/L,KCl0.3g/L,K2HPO4·3H2O 0.25 g/L,NaCl 0.25 g/L,MgSO4·7H2O 0.5 g/L,FeSO4·7H2O 0.01 g/L,pH 7.0,121 ℃高压蒸汽灭菌15 min。
1.2 仪器与设备
PHSJ-4FpH计:上海仪电科学仪器股份有限公司;5810R台式离心机:德国Eppendorf公司;SPX-250B-ZII恒温培养箱:上海博迅医疗生物仪器股份有限公司;6890气相色谱:美国Agilent公司;BPZ-6123鼓风干燥箱:上海一恒科学仪器有限公司;9700型聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司;ChemiDoc XRS凝胶成像系统:美国Bio-Rad公司;Compact M电泳仪:德国Analytik Jena公司;Illumina Miseq测序仪:美国Illumina公司。
1.3 方法
1.3.1 菌株Stenotrophomonas terrae种子液的制备及窖泥的模拟发酵
Stenotrophomonas terrae种子液制备:将Stenotrophomonas terrae甘油管于室温融化,接种于液体富集培养基中,30 ℃条件下,静置培养48 h,制得菌悬液;菌悬液按10%(V/V)的比例接种至液体富集培养基中,在30 ℃条件下,静置培养7 d,制得S.terrae种子液。
将S.terrae种子液按2%接种量接种至退化窖泥样品D(标记为R),以退化窖泥D、正常窖泥N为对照,分别将3种窖泥样品均匀涂抹于发酵容器(不锈钢圆桶)底部,再装满入窖糟醅,用塑料薄膜密封,在25 ℃条件下发酵60 d,发酵完成后对窖泥、糟醅及酒液进行取样,测定窖泥样品的pH、铵态氮、产酸能力、感官评分、细菌群落结构;糟醅样品的水分、酸度、残余淀粉;酒样的总酸、总酯、己酸乙酯含量。
1.3.2 理化指标分析检测
糟醅水分、酸度、残余淀粉、窖泥pH的测定:参考《酿酒分析与检测》[14]。
窖泥产酸能力测定、感官评价:参考沈毅等[15]的方法。
窖泥铵态氮测定:采用靛酚蓝比色法,具体步骤参考北京索莱宝科技有限公司提供的《土壤铵态氮检测说明书》进行。
酒样的总酸、总酯、己酸乙酯含量的测定:参考GB/T 10781.1—2021《白酒质量要求·第1部分:浓香型白酒》[16]。
1.3.3 DNA提取及高通量测序
采用PowerSoil DNA提取试剂盒提取发酵结束后的窖泥样品DNA,采用引物338F(5'-ACTCCTACGGGAGGCAGCA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对细菌16S rDNA的V3~V4可变区进行聚合酶链式反应(PCR)扩增。PCR扩增体系(20 μL):引物338F(5 μmol/L)0.8 μL,引物806R(5 μmol/L)0.8 μL,Pro Taq聚合酶10 μL,模板DNA 10 ng,双蒸水(ddH2O)补足20 μL。PCR扩增程序为:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s),最后72 ℃延伸10 min。PCR扩增产物经2%琼脂糖凝胶电泳检测。
Illumina Miseq高通量测序:将检测合格的PCR扩增产物使用建库试剂盒构建文库,经Illumina Miseq测序仪上机测序,委托上海美吉生物医药科技有限公司完成。
1.3.4 生物信息学分析
所有的数据分析均在美吉生物云平台(https://cloud.majorbio.com)上进行,按照97%相似性对非重复序列进行操作分类单元(operational taxonomic units,OTU)聚类,在聚类过程中去除嵌合体,得到OTU的代表序列。采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,比对数据库Silva(Release138 http://www.arbsilva.de)在各个分类学水平统计各样本的群落物种组成;采用mothur软件(http://www.mothur.org/wiki/Calculators)计算Alpha多样性指数,并采用One-way ANOVA检验进行Alpha多样性的组间差异分析;使用基于Bray-Curtis距离算法的主坐标分析(PCoA)检验样本间微生物群落结构的相似性,并结合PERMANOVA非参数检验分析样本组间微生物群落结构差异是否显著;根据得到的群落丰度数据,通过WelchT检验,分析不同组微生物群落表现出的丰度差异;在丰度排名前200的OTU水平水平上,基于Spearman相关系数绝对值≥0.75,P≤0.01构建微生物相关性网络图。
1.3.5 数据处理
窖泥、糟醅、酒样理化数据采用Origin 2022软件分析,微生物多样性数据通过美集生信云平台以及Gephi 0.10软件进行分析及可视化处理。
2 结果与分析
2.1 窖泥理化指标分析结果
窖泥理化指标检测结果见表1。pH是窖泥质量评价的一项重要指标,也是窖泥退化的重要表征指标,退化窖泥通常由于对酸的缓冲能力降低呈现出低pH[17]。相对于退化窖泥D的pH(4.27),修复窖泥样品R显著提升至4.82(P<0.05);产酸能力是间接反映窖泥中产有机酸微生物活跃程度的指标,有机酸是白酒中重要的呈味物质和香气前体[18]。相对于退化窖泥D的产酸能力(43.50 mg/g),修复窖泥样品R显著提升至185.83 mg/g(P<0.05);铵态氮含量与窖泥pH呈正相关且随窖泥老熟呈上升趋势[19-20],相对于退化窖泥D的铵态氮含量(64.50 mg/100 g),修复窖泥R显著提升至98.33 mg/100 g(P<0.05);修复后窖泥的感官评分由5.32分显著提高至6.10分(P<0.05)。然而,与正常窖泥N的pH、产酸能力、铵态氮含量、感官评分相比,窖泥样品R理化指标差异显著(P<0.05),尽管窖泥样品R理化指标与正常窖泥N有一定差距,但相对于退化窖泥D有了较大提升。
表1 窖泥样品理化指标分析结果
Table 1 Analysis results of physicochemical indexes of pit mud samples
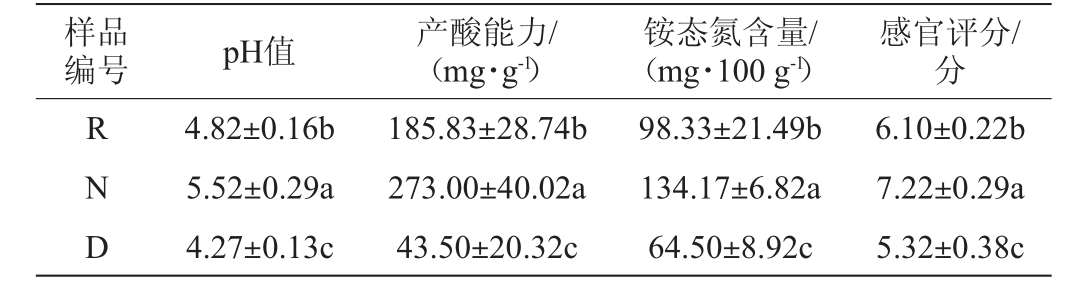
注:同列不同字母表示差异显著(P<0.05)。下同。
样品编号 pH值 产酸能力/(mg·g-1)铵态氮含量/(mg·100 g-1)感官评分/分RND 4.82±0.16b 5.52±0.29a 4.27±0.13c 185.83±28.74b 273.00±40.02a 43.50±20.32c 98.33±21.49b 134.17±6.82a 64.50±8.92c 6.10±0.22b 7.22±0.29a 5.32±0.38c
2.2 糟醅理化指标检测结果
糟醅理化指标检测结果见表2。由表2可知,修复窖泥R、退化窖泥D、正常窖泥N三个窖泥样品对应糟醅的水分、残余淀粉含量无显著差异(P>0.05);不同窖泥发酵后的糟醅酸度有一定差异,修复窖泥R糟醅酸度为3.27 mmol/10 g,显著低于退化窖泥D糟醅(4.38 mmol/10 g)(P<0.05),与正常窖泥N糟醅差异不显著(P>0.05)。从糟醅水分和残余淀粉含量可以看出退化窖泥中微生物仍在参与代谢活动,但退化窖泥发酵的糟醅酸度偏高,可能由于微生物的种类及代谢途径发生了较大变化。
表2 糟醅理化指标分析结果
Table 2 Analysis results of physicochemical indexes of fermented grains
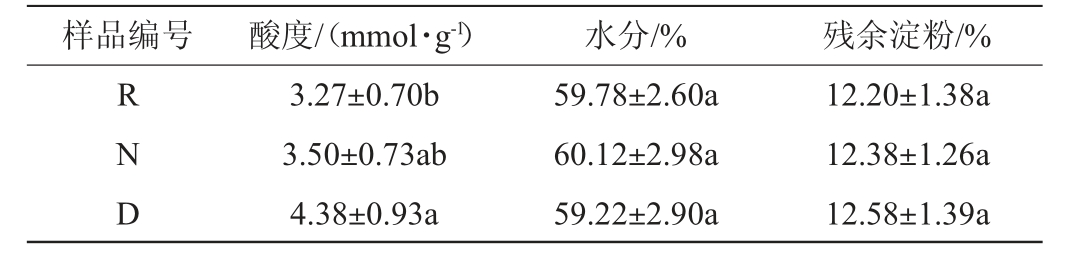
样品编号 酸度/(mmol·g-1)水分/% 残余淀粉/%RND 3.27±0.70b 3.50±0.73ab 4.38±0.93a 59.78±2.60a 60.12±2.98a 59.22±2.90a 12.20±1.38a 12.38±1.26a 12.58±1.39a
2.3 酒样理化检测结果
酒样理化指标检测结果见表3。由表3可知,修复窖泥R酒样总酯及己酸乙酯含量较退化窖泥D酒样显著提升(P<0.05),分别从0.78g/L和0.23g/L提升至1.00g/L和0.56g/L,修复窖泥R酒样总酸为0.33 g/L,显著低于退化窖泥D酒样总酸含量(0.49 g/L)(P<0.05),略高于正常窖泥N酒样总酸含量(0.27 g/L)(P>0.05)。综合糟醅理化指标检测结果,退化窖泥中微生物生长代谢消耗的淀粉大部分向酸类物质转化,而窖泥经S.terrae修复后,总酯、己酸乙酯含量都有显著提升,总酸含量显著降低。
表3 酒样理化指标检测结果
Table 3 Analysis results of physicochemical indexes of Baijiu samples
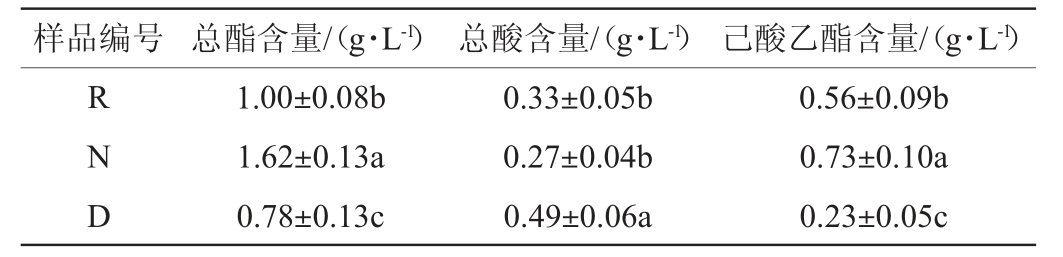
样品编号 总酯含量/(g·L-1)总酸含量/(g·L-1)己酸乙酯含量/(g·L-1)RND 1.00±0.08b 1.62±0.13a 0.78±0.13c 0.33±0.05b 0.27±0.04b 0.49±0.06a 0.56±0.09b 0.73±0.10a 0.23±0.05c
2.4 窖泥细菌菌群多样性分析结果
2.4.1 Alpha多样性分析结果
不同窖泥样品中细菌α多样性分析结果见表4。Chao1指数和Ace指数反映群落丰富度,与群落丰富度呈正相关[21]。由表4可知,修复窖泥样品R和正常窖泥样品N的Chao1指数及Ace指数均极显著高于退化窖泥D(P<0.01),但样品N与R差异不显著(P>0.05),说明退化窖泥中微生物数量低于正常窖泥,S.terrae的添加提升了退化窖泥中微生物量,达到了正常窖泥水平;Shannon指数和Simpson指数反映群落物种的多样性[22],Simpson指数与群落物种的多样性呈负相关,Shannon指数与群落物种的多样性呈正相关[23],修复窖泥R和正常窖泥N的Simpson指数极显著低于退化窖泥D(P<0.01),而修复窖泥R和正常窖泥N的Shannon指数极显著高于退化窖泥D(P<0.01),说添加S.terrae后,提升了窖泥微生物群落物种多样性。
表4 窖泥细菌菌群的Alpha多样性分析结果
Table 4 Results of Alpha diversity analysis of bacterial community in pit mud
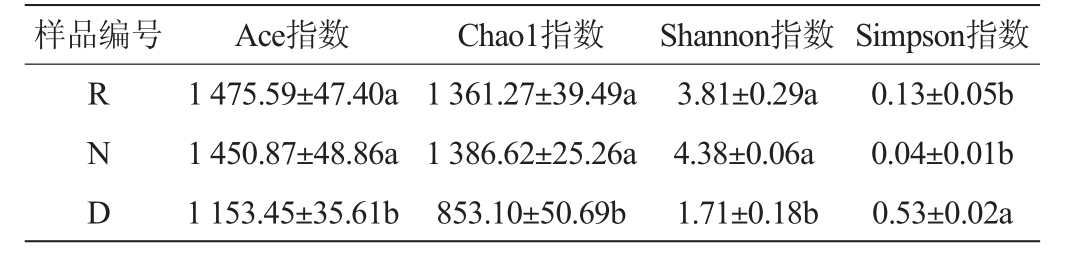
样品编号 Ace指数 Chao1指数 Shannon指数Simpson指数RND 1 475.59±47.40a 1 450.87±48.86a 1 153.45±35.61b 1 361.27±39.49a 1 386.62±25.26a 853.10±50.69b 3.81±0.29a 4.38±0.06a 1.71±0.18b 0.13±0.05b 0.04±0.01b 0.53±0.02a
2.4.2 窖泥细菌落结构分析
对窖泥中检测到的OTU进行物种注释,保留相对丰度排名前20的物种,基于门和属水平窖泥细菌菌群的相对丰度见图1。
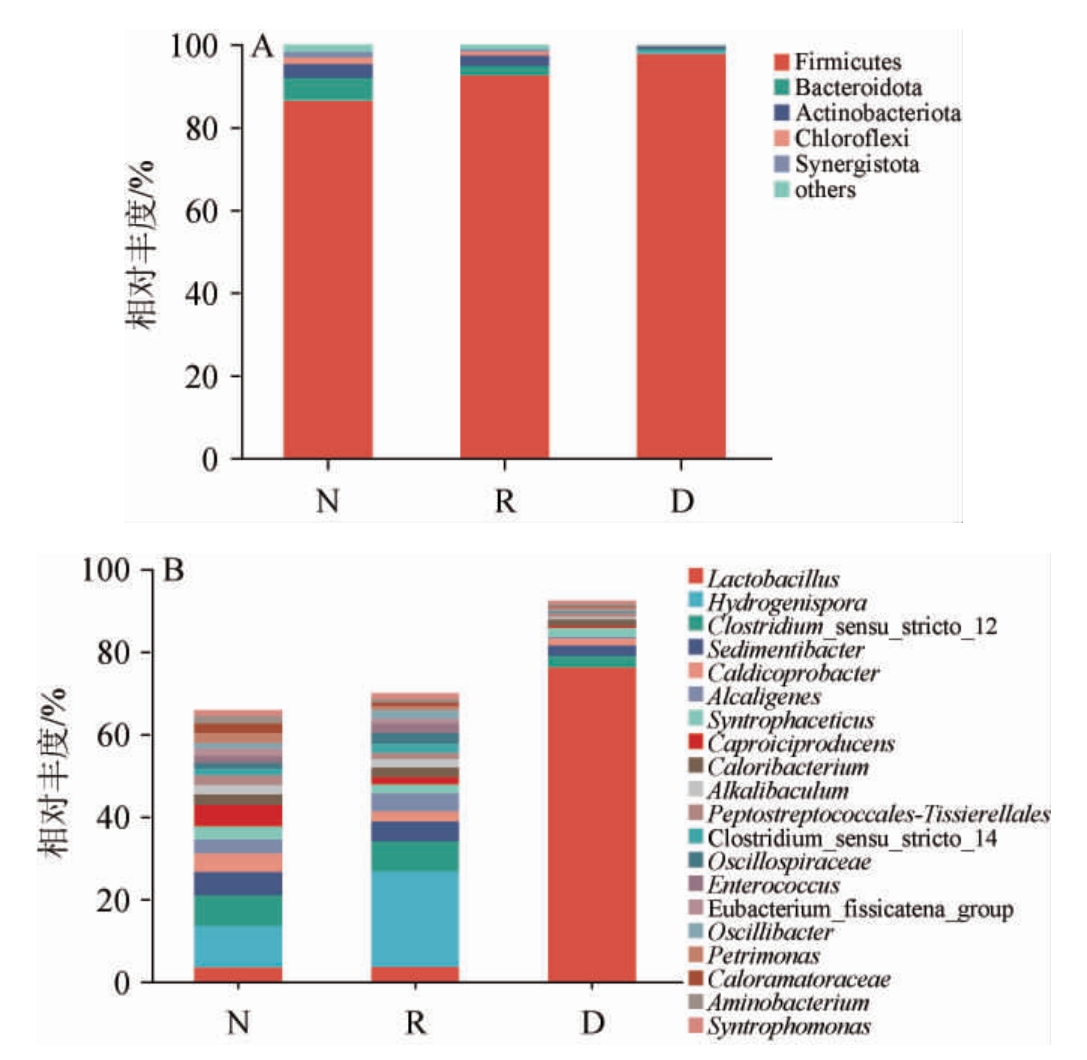
图1 基于门(A)和属(B)水平窖泥细菌菌群的相对丰度
Fig.1 Relative abundance of bacterial flora in pit mud based on phylum (A) and genus (B) levels
由图1A可知,窖泥样品N、R、D中共检出厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)、放线菌门(Actinobacteriota)、绿弯菌门(Chloroflexi)、互养菌门(Synergistota)5个菌门。其中,厚壁菌门(Firmicutes)相对丰度最高,在窖泥样品N、R、D中分别为86.48%、92.63%、97.81%。正常窖泥N中,其他优势菌门(相对丰度≥1%)为拟杆菌门(Bacteroidota)(1.28%)、放线菌门(Actinobacteriota)(3.44%)、绿弯菌门(Chloroflexi)(1.60%)、互养菌门(Synergistota)(1.28%);修复窖泥R中,其他优势菌门(相对丰度≥1%)为放线菌门(Actinobacteriota)(2.56%)和拟杆菌门(Bacteroidota)(2.24%);退化窖泥除厚壁菌门外无其他优势菌门。
由图1B可知,属水平上,窖泥样品N、R、D的优势菌属(相对丰度≥1%)分别为20种、17种、6种,退化窖泥D中优势菌属种类明显低于正常窖泥N和修复窖泥R。退化窖泥D中乳酸杆菌属(Lactobacillus)占绝对优势,相对丰度为76.32%,与窖泥α多样性分析结果一致,退化窖泥中细菌群落失衡。Lactobacillus与pH呈极显著负相关,可能是导致窖泥酸化的主要原因[24],Lactobacillus高相对丰度标志着窖泥出现退化现象[25],退化窖泥D中其他相对丰度较高的细菌包括Clostridium_sensu_stricto_12(2.75%)、Sedimentibacter(2.53%)、Syntrophaceticus(2.24%)、Caldicoprobacter(1.76%)等。正常窖泥N中的Lactobacillus占3.06%,与文献[26]报道的4.06%相近,退化窖泥经S.terrae修复后,修复窖泥R中的Lactobacillus相对丰度降为3.75%,同时氢孢菌属(Hydrogenispora)成为相对丰度最高的优势菌属,在正常窖泥N和修复窖泥R中相对丰度分别为10.05%、23.11%。此外,修复窖泥R中Clostridium_sensu_stricto_12、Sedimentibacter及Caproiciproducens等优质窖泥中常见微生物相对丰度分别提高至7.24%、4.86%、1.83%[27],与正常窖泥N更接近。说明S.terrae对抑制Lactobacillus的生长,提升其他有益微生物有一定作用。
2.4.3 物种差异分析结果
基于属水平退化窖泥D和修复窖泥R的细菌菌群差异分析结果见图2。由图2可知,退化窖泥样品中添加Stenotrophomonas terrae后,Lactobacillus相对丰度极显著降低(P<0.01),而Hydrogenispora、Clostridium_sensu_stricto_12、Clostridium_sensu_stricto_14、Clostridium_sensu_stricto_18、Alkalibaculum、Caproiciproducens相对丰度极显著提高(P<0.01),Syntrophomonas、Eubacterium_fissicatena_group相对丰度显著提高(P<0.05)。研究表明,Hydrogenispora与pH值呈正相关,是窖底泥优势微生物[28],Clostridium_sensu_stricto_12、Clostridium_sensu_stricto_14、Clostridium_sensu_stricto_18、Caproiciproducens、Alkalibaculum是窖泥中常见的产丁酸、己酸微生物,Syntrophomonas在老窖泥中相对丰度显著高于新窖泥,有作为窖泥老熟指示微生物的潜质[29],Eubacterium_fissicatena_group可利用葡萄糖产生乙酸、丁酸,对己酸前体的合成具有重要作用[30],以上这些微生物丰度的提高,间接反映了窖泥微生物结构以及正常功能的恢复。
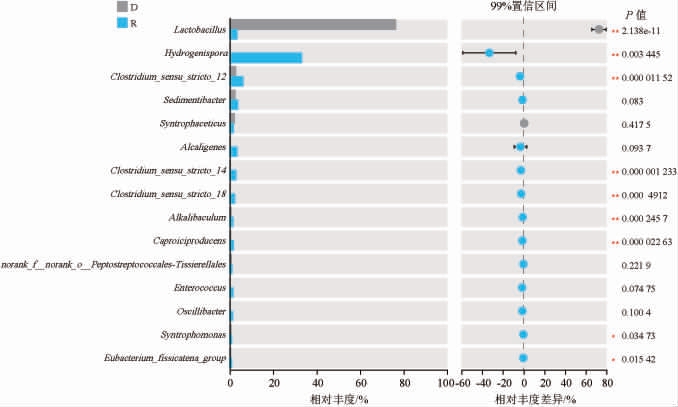
图2 基于属水平退化窖泥D和修复窖泥R的细菌菌群差异分析结果
Fig.2 Difference analysis results of bacterial flora in degraded pit mud D and restored pit mud R based on genus level
“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01)。
2.4.3 主坐标分析结果
基于属水平窖泥细菌菌群主坐标分析(PCoA)结果见图3。
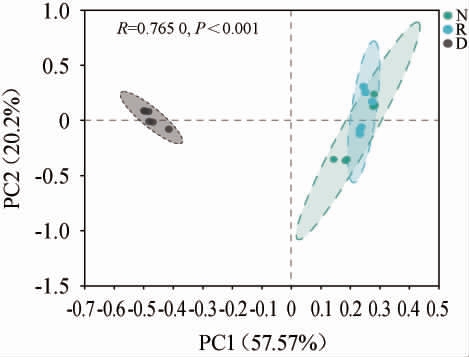
图3 基于属水平窖泥细菌群主坐标分析结果
Fig.3 Principal coordinate analysis results of bacterial flora based on genus level
由图3可知,PCoA1方差贡献率为57.57%、PCoA2方差贡献率为20.20%,累计方差贡献率为77.77%。窖泥样品D距离窖泥样品R和N较远,窖泥样品R和N距离较近,所在区域有重叠。说明退化窖泥经过接种S.terrae修复后,细菌群落结构发生了显著改变,与正常窖泥细菌群落结构相似。
2.4.4 相关性网络分析结果
基于OTU水平进行相关性网络分析,构建微生物相关性网络图见图4。由图4可知,退化窖泥D微生物网络有177个节点,967条边;修复窖泥R微生物网络有187个节点,1 282条边。说明修复窖泥R较退化窖泥D的微生物网络的复杂度更高[31],修复窖泥R微生物网络平均度、图密度、平均类聚数分别为13.711、0.074、0.635;退化窖泥D微生物网络平均度、图密度、平均类聚数分别为10.814、0.061、0.572,修复窖泥R微生物网络具有较高的平均度、图密度和平均类聚数,也验证修复窖泥R较退化窖泥D的微生物网络的复杂度更高这一结果[32-33]。微生物网络的复杂性对维持微生态系统稳定性具有重要作用[34],且研究表明网络稳定性与网络节点、边数具有显著正相关,有助于抵御外界环境变化[35]。修复窖泥R具有较低的模块化系数,表明微生物间连通性增强[36-37],连通性增强有助于提升微生物生态网络稳定性[38]。退化窖泥D微生物网络包括590条正相关的边,占61.01%,377条负相关的边,占38.99%;修复窖泥R微生物网络包括1 023条正相关的边,占79.80%,259条负相关的边,占20.20%。说明S.terrae提高了窖泥微生物之间的正相关性,即加强了窖泥微生物间的协同作用[39]。
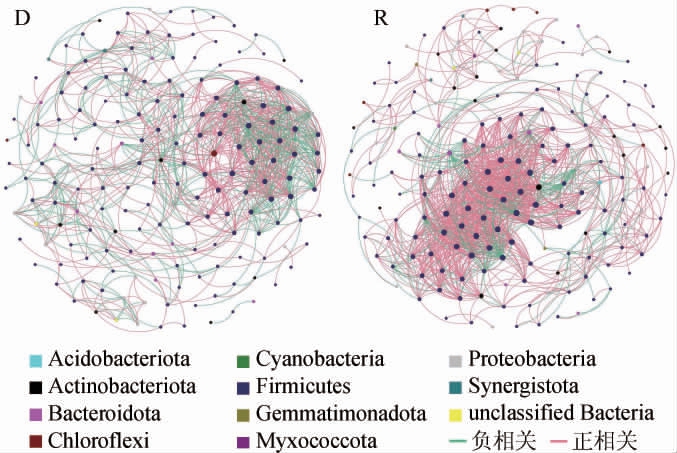
图4 窖泥微生物相关性网络图
Fig.4 Correlation network diagram of microorganism in pit mud
以门水平对节点进行着色。绿色边代表正相关,红色边代表负相关。
3 结论
本研究利用菌株S.terrae对退化窖泥进行修复,结果表明,与退化窖泥相比,修复窖泥的pH、产酸能力、铵态氮含量、感官评分分别显著提升至4.82、185.83 mg/g、98.33 mg/100 g、6.10分(P<0.05),修复窖泥对应糟醅的酸度显著降低至3.27(P<0.05),而对应酒样总酯、己酸乙酯显著提升至1.00 g/L、0.56 g/L(P<0.05),总酸由0.49 g/L显著降低至0.27 g/L(P<0.05)。细菌群落结构分析表明,S.terrae的添加增加了窖泥的物种丰富度和多样性,使修复后的窖泥菌群结构更接近于正常窖泥,其中Lactobacillus相对丰度极显著降低(P<0.01),Hydrogenispora、Clostridium_sensu_stricto_12、Alkalibaculum、Caproiciproducens等功能微生物相对丰度极显著提高(P<0.01)。相关性网络分析结果表明,窖泥经S.terrae修复后,提高了细菌群落的复杂性,增强了窖泥细菌微生物间的协同作用,微生物生态网络稳定性进一步提高。综上所述,S.terrae是一株具有窖泥修复潜能的菌种,本研究为解决窖泥退化的技术难题提供一定的理论依据。
[1]胡景辉,陈禹锜,薛新新,等.浓香型白酒发展概述[J].中国酿造,2022,41(6):24-30.
[2]海超.窖泥老化原因浅析及预防措施探讨[J].食品与发酵科技,2022,58(1):136-139.
[3]黄润娜,侯建光,崔璐芸,等.陶融型白酒正常和退化窖泥细菌群落多样性解析及其理化影响因素[J].中国酿造,2022,41(8):25-31.
[4]任海伟,李志娟,刘美琪,等.基于高通量测序技术分析不同窖龄窖泥真菌群落多样性与空间异质性[J].食品科学,2024,45(2):178-187.
[5]刘念,王超凯,潘建军,等.浓香型白酒窖池价值评估体系研究(二)——窖池价值的评估方法[J].食品与发酵科技,2022,58(1):1-6.
[6]李觅,郭杰,常少健,等.利用快速评价方法评价不同年份窖泥质量[J].酿酒科技,2018(12):23-26,32.
[7]张会敏,孟雅静,王艳丽,等.浓香型白酒窖池分层分位点池底窖泥pH值、主要有机酸与钙、镁离子之间的相关性分析[J].食品科学,2020,41(19):90-97.
[8]吴玉轩.浓香型白酒窖泥己酸菌丰度分析与应用研究[D].济南:齐鲁工业大学,2023.
[9]郑慧珍.浓香型白酒窖泥优势微生物Petrimonas sulfuriphila的分离及其功能解析[D].无锡:江南大学,2022.
[10]李斯琳,夏威汉,陈周,等.一株可调节浓香窖泥pH的克氏梭菌对基酒质量影响[J].酿酒,2023,50(4):68-71.
[11]白霞,屈云,林东,等.窖池中酸性脲酶产生菌的分离鉴定及其对模拟窖泥pH值和风味物质的影响[J].食品与发酵工业,2024,50(12):275-283.
[12]陈园,王超凯,李觅,等.窖泥产氨菌的分离筛选与发酵培养基的优化[J].食品与发酵科技,2023,59(2):43-49.
[13]邓阳,姜竹鸣,张玉琴.寡养单胞菌属细菌的研究进展[J].生物资源,2021,43(1):1-9.
[14]王福荣.酿酒分析与检测[M].北京:化学工业出版社,2021:24-33.
[15]沈毅,王西,彭奎,等.不同品质窖泥表征指标与微生物群落相关性研究[J].食品与发酵科技,2022,58(2):9-14,30.
[16]国家市场监督管理总局,国家标准化管理委员会.GB/T 10781.1—2021白酒质量要求第1部分:浓香型白酒[S].北京:中国标准出版社,2021.
[17]刘义会,谢军,李觅,等.窖泥的酸碱缓冲容量研究[J].食品与发酵科技,2021,57(1):95-98.
[18]王西,张亚东,李觅,等.营养条件对窖泥功能菌液微生物群落结构及产酸影响研究[J].食品与发酵科技,2022,58(6):101-104,120.
[19]刘治国,方超,张晓元,等.浓香型白酒窖泥理化因子、微生物群落、感官质量以及相关性研究进展[J].食品科学,2023,44(21):351-358.
[20]胡晓龙,付丹阳,王永亮,等.浓香型白酒窖池空间位置及窖龄对窖泥原核微生物群落的影响[J].中国酿造,2023,42(3):65-71.
[21]陈磊,戴亦军.基于Illumina MiSeq高通量测序技术分析丹阳黄酒酒曲中微生物菌群多样性[J].中国酿造,2024,43(6):141-145.
[22]熊香元,张立钊,陈力力,等.米粉发酵过程中乳酸菌多样性及功能分析[J].食品科学,2020,41(18):85-91.
[23]毛凤娇,黄均,周荣清,等.人工窖泥微生物群落对浓香型白酒发酵过程风味代谢物形成的影响[J].食品科学,2024,45(4):125-134.
[24]游玲,简晓平,范方勇,等.宜宾浓香型白酒产区窖泥生态监测[J].生物技术通报,2023,39(7):254-265.
[25]肖琴,何平,周瑞平,等.不同窖龄及位置浓香型白酒窖泥微生物群落多样性与理化因子的比较分析[J].食品科学,2023,44(20):165-174.
[26]钱玮,陆震鸣,柴丽娟,等.泸型酒酒醅与窖泥中梭菌群落结构、演替和功能差异[J].生物工程学报,2020,36(6):1190-1197.
[27]辜杨.中国浓香型白酒酿造窖泥微生物多样性研究[D].无锡:江南大学,2021.
[28]曾波,邹永芳,饶家权,等.浓香型白酒窖底泥和窖壁泥细菌群落结构差异性分析[J].食品科学,2023,44(18):223-230.
[29]张会敏,王艳丽,孟雅静,等.浓香型白酒发酵新老窖泥理化因子和原核微生物群落结构差异分析[J].食品科学,2020,41(6):207-214.
[30]吴浪涛,丁文骏,谢专,等.不同时期窖泥理化因子、风味物质和细菌组成的相关性[J].微生物学通报,2022,49(3):1030-1047.
[31]江其朋,余佳敏,王金峰,等.土壤理化性质驱动烤烟根际细菌群落的组配及其共现性网络互作[J].微生物学报,2023,63(3):1168-1184.
[32]巩文峰,魏丽萍,杜娟,等.西藏青稞根际细菌群落结构及多样性[J].微生物学报,2023,63(10):4034-4050.
[33]ZHENG H P,YANG T J,BAO Y Z,et al.Network analysis and subsequent culturing reveal keystone taxa involved in microbial litter decomposition dynamics[J].Soil Biol Biochem,2021,157:108230.
[34]HUANG L J,PAN G H,FENG Y F,et al.Microbial network signatures of early colonizers in infants with eczema[J].Imeta,2023,2(2):e90.
[35]梁其云.海洋滑动菌在沉积物富集培养过程中参与微生物群落演替的贡献研究[D].济南:山东大学,2023.
[36]宋雪苗,马世源,李子健,等.苹果内生菌Torulaspora delbrueckii强化对苹果醋风味物质合成的影响[J].食品科学,2023,44(20):330-342.
[37]PHILIPPOT L, GRIFFITHS B S, LANGENHEDER S.Microbial community resilience across ecosystems and multiple disturbances[J].Microbiol Mol Biol R,2021,85(2):10.1128/MMBR.00026-20.
[38]LI C C, JIN L, ZHANG C, et al.Destabilized microbial networks with distinct performances of abundant and rare biospheres in maintaining networks under increasing salinity stress[J].Imeta,2023,2(1):e79.
[39]林少华,陈存坤,张慧杰,等.基于下一代测序分析3种不同保鲜处理的香椿在贮藏期间微生物多样性变化[J].食品研究与开发,2019,40(14):42-50.