灵芝(Ganoderma lucidum)是一种宝贵的天然药物资源,具有抗癌、免疫调节、抗氧化[1]、抗炎、抗过敏、神经保护、肝保护、降血糖、降血压、抗菌、抗病毒和抗疟疾[2]等多种功效。几个世纪以来,灵芝在亚洲国家一直被用作一种传统药物预防和治疗各种疾病。灵芝三萜、灵芝多糖和肽聚糖是灵芝所含的主要活性成分[3-4],灵芝三萜类化合物具有强烈的药理活性,它具有抑制胆固醇吸收、抗氧化、抗癌、抗炎、抗糖尿病和肝保护活性等功能[5-8]。灵芝的栽培通常采用棉籽壳、玉米粉、椴木等作为原料,但一方面由于原料价格不断上涨,导致生产成本提高,产品利润下降,另一方面由于人们生态环境保护意识提高,也急需寻找传统基质椴木的替代原料。因此,以废弃有机质作为替代原料对于促进灵芝栽培意义重大,相关研究人员就此开展大量研究工作,目前用于灵芝栽培的替代基质主要有各种废弃生物质残渣,如入侵植物金合欢[9]、甘蔗渣[10]、秸秆与稻壳[11]、大豆秸杆和玉米秸秆[12]、桑枝[13]等。
我国是中成药生产大国,每年产生的中药渣数量高达3.4×107 t,除了少量用于堆肥以外,大多直接焚烧处置[14],这不仅可能带来二次污染,也造成资源浪费。鉴于此,也有研究人员尝试采用连花清瘟胶囊、参松养心胶囊、芪苈强心胶囊[15]、川芎[16]、黄芪[17]、解毒散结胶囊[18]、感冒清颗粒[19]药渣以及西洋参[20]提取残渣作为基质用于灵芝发酵,目前灵芝发酵中药渣后的产物主要有两方面的用途:①考虑到发酵产物中含有大量具有药效的活性成分,将其应用于医药领域或饲料领域;②利用灵芝发酵产漆酶的特性,将发酵产物用于环境工程领域(土壤修复或废水处理)。但是,中药渣种类繁多,不同种类中药渣的成分差异很大,因此需要根据中药渣的具体成分优化其发酵基质配方和发酵工艺条件。考虑到三七渣中富含淀粉、蛋白质、多糖等营养成分,适合作为发酵基质使用。本研究团队开展了以三七渣为基质固态发酵生产灵芝三萜的研究工作,前期已完成培养基制备条件优化工作[21]。考虑到创造一个良好的外部发酵环境不仅有利于发酵体系中的益生菌群的生长和繁殖,而且对有害菌群的生长和繁殖起到抑制作用,从而使整个发酵体系向朝着有利的方向进行[22]。因此,本研究通过单因素试验考察发酵温度、接种量、发酵时间对固态发酵三七渣生产灵芝三萜的影响,并采用响应面法对其发酵工艺条件进行优化,旨在提高灵芝三萜的产量,降低生产成本。
1 材料与方法
1.1 材料与试剂
1.1.1 材料和菌株
三七渣:取自成都市某中成药厂,经晾晒、烘干、粉碎、过筛后置于干燥器中备用,其主要成分为真蛋白含量9.97%,粗蛋白含量12.28%,粗纤维含量27.45%,还原糖含量2.19%,总糖含量48.87%,淀粉含量30.35%[23]。
灵芝(川芝6号)(国品认菌2007045,川审菌2004007):四川省农业科学院土壤肥料研究所微生物室。
1.1.2 化学试剂
香草醛、齐墩果酸、高氯酸、冰乙酸、磷酸氢二钾、硫酸镁(均为分析纯):成都市科龙化工试剂厂。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:200 g土豆,20 g/L葡萄糖,3 g/L酵母粉,2 g/L蛋白胨,20 g/L琼脂粉,1 g/L KH2PO4,0.6 g/L MgSO4,1 000 mL蒸馏水。
121 ℃灭菌20 min。
种子培养基:20 g土豆,2.0 g/L葡萄糖,0.3 g/L酵母粉,0.2 g/L蛋白胨,0.1 g/L KH2PO4,0.06 g/L MgSO4,1 00 mL蒸馏水。121 ℃灭菌20 min。
三七渣固体培养基:10.0 g过60目筛的三七渣,2.47 g酵母浸出粉,0.145 g磷酸二氢钾,培养基初始含水量为65.47%,pH自然。121 ℃灭菌30 min。
1.2 仪器与设备
PYX-250H-C恒温恒湿培养箱:广东韶关科力实验仪器有限公司;THZ-92A气浴恒温振荡器:上海博迅医疗生物仪器股份有限公司;BSA224S电子分析天平:赛多利斯科学仪器(北京)有限公司;WFJ 7200分光光度计:尤尼柯仪器有限公司;LPDADZX-50KB高压灭菌锅:上海申安医疗器械厂。
1.3 实验方法
1.3.1 灵芝菌种扩大培养
将斜面灵芝菌种接入PDA培养基中,于28 ℃下恒温静置培养7~8 d,用于菌种的扩大培养。
1.3.2 种子液的制备
用打孔器在PDA培养基的边缘打取0.25 cm2的灵芝菌丝块,接入装液量为100 mL/250 mL种子培养基中,在28 ℃、150 r/min条件下振荡培养4 d,得到灵芝种子液。
1.3.3 发酵工艺条件优化
(1)单因素试验
三七渣固体培养基中接入10%灵芝种子液在28 ℃条件下固态发酵14 d,待发酵结束后将发酵培养物烘干(60 ℃、72 h)后测定灵芝三萜的含量。分别考察发酵温度(22 ℃、25 ℃、28 ℃、31 ℃、34 ℃、37 ℃)、接种量(2.5%、5.0%、7.5%、10.0%、12.5%、15.0%)、发酵时间(8 d、10 d、12 d、14 d、16 d、18 d、20 d)3个因素对固态发酵灵芝三萜含量的影响。所有试验重复3个平行。
(2)响应面试验
在单因素试验的基础上,以发酵温度(A)、接种量(B)及发酵时间(C)为自变量,以灵芝三萜含量(Y)为响应值,进行Box-Behnken响应面试验优化发酵工艺条件。Box-Behnken试验设计因素与水平见表1。
表1 发酵工艺优化Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experiments for fermentation process optimization

-1水平0 1因素A 发酵温度/℃B 接种量/%C 发酵时间/d 25 5 14 28 10 16 31 15 18
1.3.4 灵芝三萜含量的测定
灵芝三萜含量的测定采用分光光度法[21]。以吸光度值(Y)为纵坐标,以齐墩果酸质量浓度(X)为横坐标制作齐墩果酸标准曲线,得到标准曲线回归方程为Y=47.82X-0.677 1,相关系数R2=0.991 5。按照标准曲线回归方程计算样品中灵芝三萜含量。
2 结果与分析
2.1 发酵工艺优化单因素试验
2.1.1 发酵温度对灵芝三萜含量的影响
由于在微生物的生长代谢过程中,构成细胞的基础物质如蛋白质、核糖核酸以及微生物生长所需的酶对温度敏感,过高或过低的温度会影响次级代谢产物的合成[22]。将接种灵芝种子液的三七渣培养基分别置于不同温度(22 ℃、25 ℃、28 ℃、31 ℃、34 ℃、37 ℃)条件下培养,考察不同培养温度对灵芝三萜含量的影响,结果见图1。
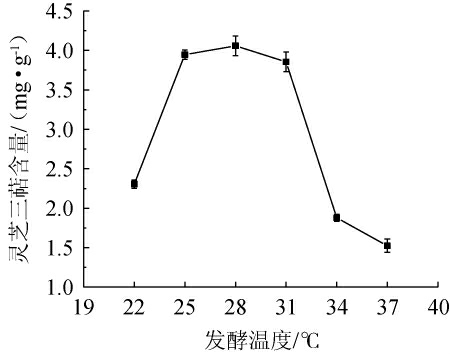
图1 发酵温度对灵芝三萜含量的影响
Fig.1 Effect of fermentation temperature on Ganoderma lucidum triterpenes content
由图1可知,当发酵温度在22~28 ℃范围内升高,灵芝三萜含量随之逐渐升高;当发酵温度为28 ℃时,灵芝三萜含量最高,为4.06 mg/g;当发酵温度>28 ℃之后,灵芝三萜含量有所下降。发酵温度过高会使灵芝生长迟缓,菌丝体的生长和萌发滞后;而温度过低则使菌体的新陈代谢受到影响[22]。祝铁钢等[24]研究表明,灵芝三萜的最佳发酵温度为26 ℃。而林威[25]研究发现,以麦麸+玉米粉+豆粉混合物为基质,固态发酵产灵芝三萜的最适温度为30 ℃。因此,最适发酵温度为28 ℃。
2.1.2 接种量对固态发酵的影响
接种量的大小会直接影响灵芝三萜的产量:一方面接种量过大,易造成营养物质消耗过快,影响代谢产物的生产;另一方面接种量过小,造成微生物生长缓慢,时间加长,容易受到其他微生物的影响[26]。分别接种不同比例(2.5%、5.0%、7.5%、10.0%、12.5%、15.0%)的灵芝种子液进行固态发酵,考察不同接种量对灵芝三萜含量的影响,结果见图2。
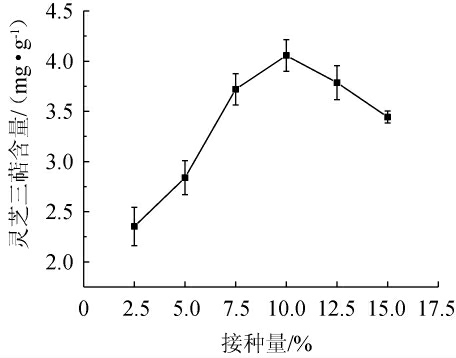
图2 接种量对灵芝三萜含量的影响
Fig.2 Effect of inoculum on Ganoderma lucidum triterpenes content
由图2可知,当接种量在2.5%~10.0%范围内变化时,灵芝三萜含量随着接种量增加而增大,当接种量为10.0%时,灵芝三萜含量最高,为4.06 mg/g;当接种量>10.0%之后,灵芝三萜含量又逐渐下降,特别是接种量达到20.0%时,灵芝三萜含量下降很快,甚至远低于接种量为5.0%时的含量。发酵初期培养基中的营养物质消耗过快,使后期所需的营养物质匮乏,致使灵芝菌提前进入衰亡期,出现菌体自溶的现象,此外,大量的代谢产物也可能会产生反馈抑制作用[27]。此外,在实际应用中,适宜的接种量不但可以缩短发酵的时间,节约生产成本,还能减少染菌的机会。因此,最适接种量为10.0%。
2.1.3 发酵时间对固态发酵的影响
选取最佳的固态发酵终点,不仅影响微生物自身的生长,还影响目标产物所带来的经济效益,所以在实际生产中必须考虑发酵的时间和目标产品产出,这样既使目标产品的产量得到提高[28],又能使成本降低。本研究从发酵第8天起,每隔2 d取样测定发酵培养物中灵芝三萜的含量,以考察发酵时间对发酵培养物中灵芝三萜含量的影响,结果见图3。
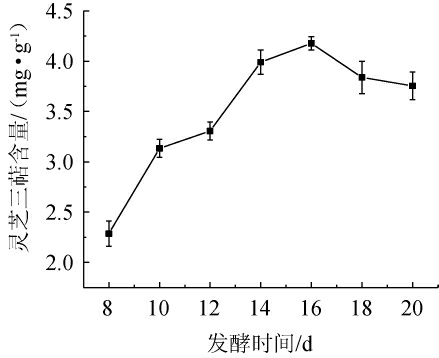
图3 发酵时间对灵芝三萜含量的影响
Fig.3 Effect of fermentation time on Ganoderma lucidum triterpenes content
由图3可知,随着发酵时间在8~16 d范围内的延长,灵芝三萜含量随之逐渐增加;当发酵时间为16 d时,灵芝三萜含量最高,为4.18 mg/g;当发酵时间>16 d之后,灵芝三萜含量有所下降。由此可见,发酵时间太短不利于三七渣中营养物质的充分利用,使固态发酵的效果不理想;发酵时间过长则会使灵芝菌进入内源呼吸期,产生自溶的现象,进而使灵芝三萜的含量下降。此外,延长发酵周期还会增加生产成本。因此,最适发酵时间为16 d。
2.2 发酵工艺优化响应面试验
2.2.1 Box-Behnken试验设计与结果
在单因素试验的基础上,以灵芝三萜含量(Y)为响应值,发酵温度(A)、接种量(B)、发酵时间(C)为自变量,采用响应面法优化发酵条件,Box-Behnken试验设计及结果见表2,方差分析结果见表3。
表2 发酵工艺优化Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken experiments for fermentation process optimization
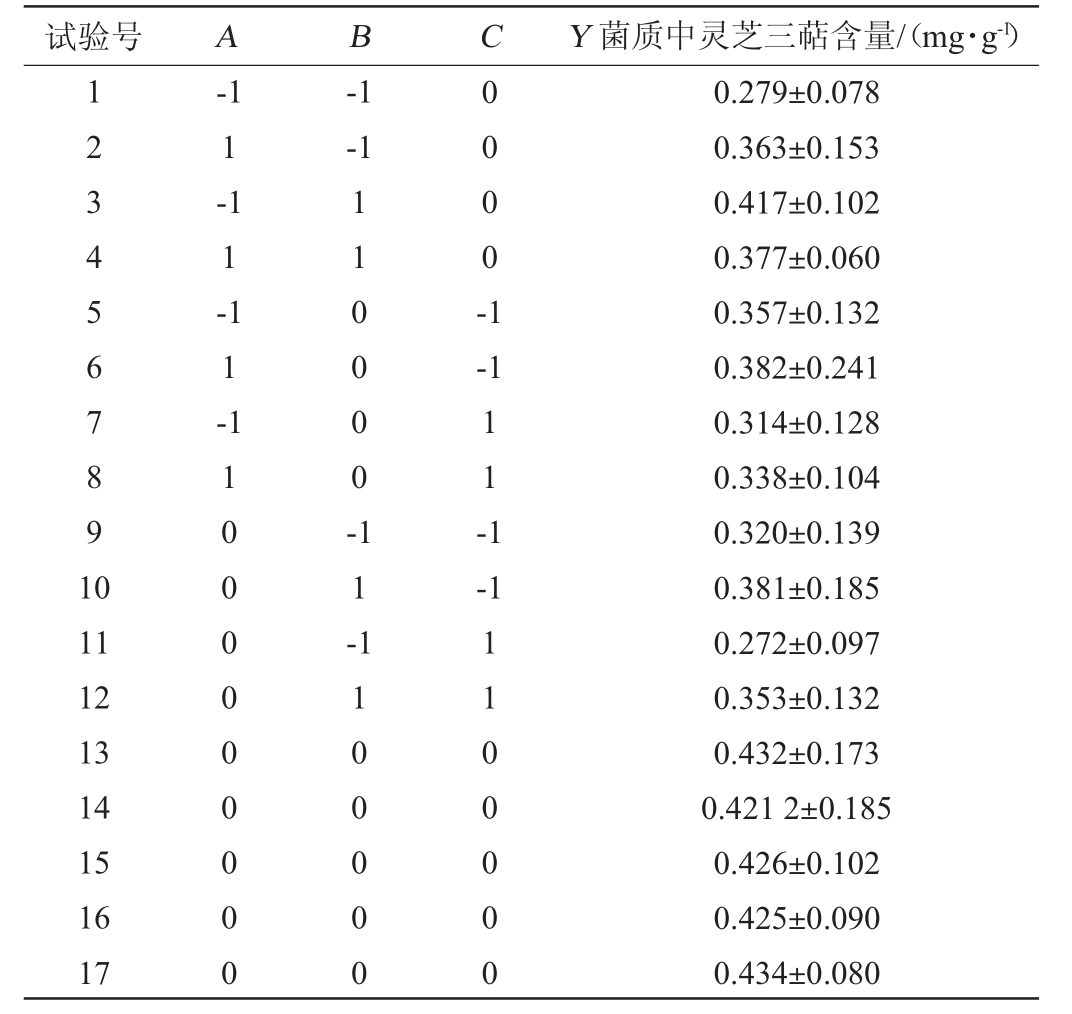
试验号 A Y 菌质中灵芝三萜含量/(mg·g-1)1234567891 0-1 1-1 1-1 1-1 B C-1-1 110000-0000-1-1 11-1-1 11 12 13 14 15 16 17 1000000000 1 1-1100000 1100000 0.279±0.078 0.363±0.153 0.417±0.102 0.377±0.060 0.357±0.132 0.382±0.241 0.314±0.128 0.338±0.104 0.320±0.139 0.381±0.185 0.272±0.097 0.353±0.132 0.432±0.173 0.421 2±0.185 0.426±0.102 0.425±0.090 0.434±0.080
表3 回归模型方差分析
Table 3 Variance analysis of regression model
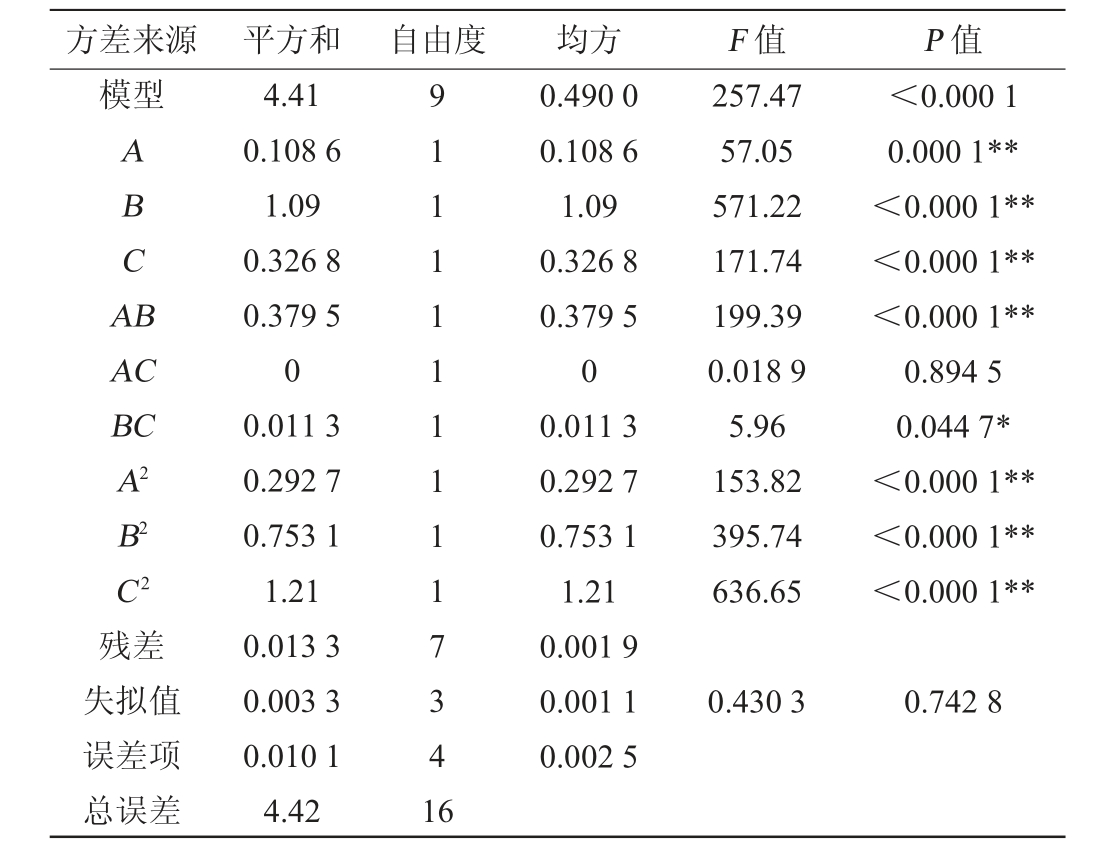
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著(P<0.05)。
方差来源 平方和 自由度 均方 F 值 P 值模型ABCA B AC BC A2 B2 C2残差失拟值误差项总误差4.41 0.108 6 1.09 0.326 8 0.379 5 0 0.011 3 0.292 7 0.753 1 1.21 0.013 3 0.003 3 0.010 1 4.42 91111111117341 6 0.490 0 0.108 6 1.09 0.326 8 0.379 5 0 0.011 3 0.292 7 0.753 1 1.21 0.001 9 0.001 1 0.002 5 257.47 57.05 571.22 171.74 199.39 0.018 9 5.96 153.82 395.74 636.65<0.000 1 0.000 1**<0.000 1**<0.000 1**<0.000 1**0.894 5 0.044 7*<0.000 1**<0.000 1**<0.000 1**0.430 3 0.742 8
利用Design Expert 8.0.6软件对表3中进行多元回归拟合,得到灵芝三萜含量(Y)对发酵温度(A)、接种量(B)及发酵时间(C)的多元二次回归方程:
Y=4.28+0.116 5A+0.368 6B-0.202 1C-0.308 0AB-0.003 0AC+0.053 3BC-0.263 7A2-0.422 9B2-0.536 4C2
由表3可知,该回归模型极其显著(P<0.000 1),而失拟项不显著(P>0.05),决定系数R2=0.997 0,说明灵芝三萜含量的实测值与预测值之间的拟合度较好;校正决定系数R2Adj=0.993 1,说明该模型可以解释大约99.31%的灵芝三萜含量响应值的变化。由此可见,该二次回归模型可以用来分析与预测该发酵体系中灵芝三萜含量的实际情况。由P值可知,一次项A、B、C,交互项AB,二次项A2、B2、C2对灵芝三萜含量的影响极显著(P<0.01);交互项BC对灵芝三萜含量的影响显著(P<0.05)。由F值可知,对于灵芝三萜含量的影响程度大小顺序依次为:接种量(B)>发酵时间(C)>发酵温度(A)。
2.2.2 影响因素的交互作用分析
各影响因素间的交互作用对灵芝三萜含量影响的响应面及等高线能够直接反映出两个因素之间的交互作用是否显著。如果两个因素之间的交互作用显著,则响应面陡峭,等高线是椭圆形;如果两个因素之间的交互作用不显著,则响应面平缓,等高线是圆形[29]。发酵温度、接种量及发酵时间之间两两交互作用对灵芝三萜含量影响的响应面及等高线见图4。
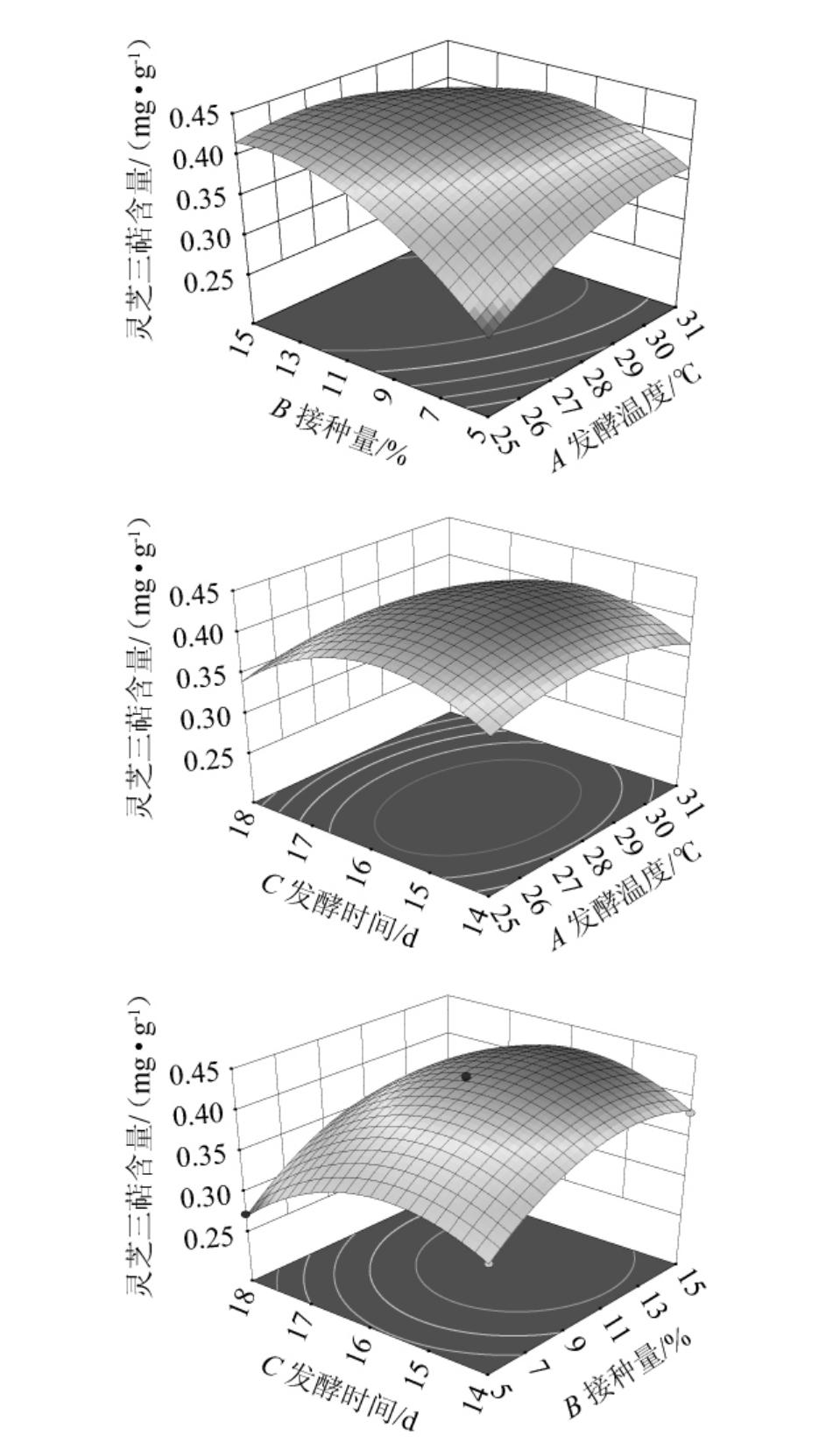
图4 发酵温度、发酵时间和接种量间交互作用对灵芝三萜含量影响的响应面及等高线
Fig.4 Response surface plots and contour lines of effects of interaction between fermentation temperature, time and inoculum on Ganoderma triterpenes content
由图4a可知,发酵温度与接种量交互作用极显著(P<0.01),在发酵温度和接种量很小的时候,灵芝三萜含量很低。随着发酵温度升高和接种量的增大,灵芝三萜含量开始增加,但当发酵温度和接种量达到一定值后灵芝三萜含量又有所下降。由图4b可知,发酵温度(A)和发酵时间(C)之间交互作用不显著(P>0.05),在发酵温度较低和发酵时间较短的时候,灵芝三萜含量都很低。随着发酵温度升高和发酵时间延长,灵芝三萜含量开始增加,但当发酵温度和发酵时间到一定值后灵芝三萜含量又有所下降。由图4c可知,接种量(B)和发酵时间(C)之间交互作用显著(P<0.05),当接种量(B)和发酵时间(C)都处于低水平时,灵芝三萜的含量也较低,随着接种量的增加和发酵时间的延长,灵芝三萜含量开始增加,但当接种量和发酵时间增加到一定值后灵芝三萜含量又有所下降。这与表4方差分析结果一致。
2.2.3 最佳发酵工艺验证试验
通过Design Expert 8.0.6软件对该多元回归模型方程求偏导与解逆矩阵,求得最佳发酵工艺条件为:发酵温度为29.5 ℃,接种量为11.2%,发酵时间为15.6 d。在此条件下,灵芝三萜含量预测值为4.32 mg/g。为了方便实际操作,将最佳发酵工艺条件调整为发酵温度为30 ℃,接种量为11%,发酵时间为16 d。在此优化条件下进行3次平行验证试验,灵芝三萜含量实际值为(4.110±0.186)mg/g,与预测值相差不大,比优化前(3.67 mg/g)[21]提高了12.0%。
3 结论
本研究在单因素试验基础上,通过响应面分析法优化了固态发酵三七渣生产灵芝三萜的发酵工艺条件为:发酵温度为30 ℃,接种量为11%,发酵时间为16 d。在此优化条件下,发酵培养物中灵芝三萜含量为(4.110±0.186)mg/g,比优化前提高了12.0%。
[1]BASNET B B, LIU L, BAO L, et al.Current and future perspective on antimicrobial and anti-parasitic activities of Ganoderma sp.:an update[J].Mycology,2017,8(2):111-124.
[2]JONATHAN S G, AWOTONA F E.Studies on antimicrobial potentials of three Ganoderma species[J].Afr J Biomed Res,2010,13(2):131-139.
[3]ISAKA M,CHINTHANOM P,KONGTHONG S,et al.Lanostane triterpenes from cultures of the Basidiomycete Ganoderma orbiforme BCC 22324[J].Phytochemistry,2013,87:133-139.
[4]MARTÍNEZ-MONTEMAYOR M M,LING T T,SUÁREZ-ARROYO I J,et al.Identification of biologically active Ganoderma lucidum compounds and synthesis of improved derivatives that confer anti-cancer activities in vitro[J].Front Pharmacol,2019,10:115-131.
[5]SEWERYN E,ZIAŁA A,GAMIAN A.Properties of Ganoderma lucidum triterpenes[J].Adv in Hyg Exp Med,2019,73:345-352.
[6]CAO L P,JIN H L,LIANG Q,et al.A new anti-tumor cytotoxic triterpene from Ganoderma lucidum[J].Nat Prod Res,2022,36(16):4125-4131.
[7]WANG C F,LIU X M,LIAN C L,et al.Triterpenes and aromatic meroterpenoids with antioxidant activity and neuroprotective effects from Ganoderma lucidum[J].Molecules,2019,24(23):4353-4363.
[8]HU Z P,DU R P,XIU L,et al.Protective effect of triterpenes of Ganoder-ma lucidum on lipopolysaccharide-induced inflammatory responses and acute liver injury[J].Cytokine,2020,127:154917.
[9]ROTHMANN C,ROTHMANN L,VILJOEN B,et al.Application of solidstate fermentation using mushrooms for the production of animal feed[J].J Basic Microb,2023,63(10):1153-1164.
[10]TORRES-FARRADÁ G, MANZANO A M, RAMOS-LEAL M, et al.Biodegradation and detoxification ofdyesand industrial effluents by Ganoderma weberianum B-18 immobilized in a lab-scale packed-bed bioreactor[J].Bioremediat J,2018,22(1-2):20-27.
[11]POSTEMSKY P D,DELMASTRO S E,CURVETTO N R.Effect of edible oils and Cu(II)on the biodegradation of rice by-products by Ganoderma lucidum mushroom[J].Int Biodeter Biodegr,2014,93:25-32.
[12]李林,郭红艳,孙晓杰,等.利用大豆秸杆和玉米秸秆栽培灵芝[J].食用菌学报,2021,28(4):15-19.
[13]张波,谭伟,李小林,等.桑枝栽培灵芝研究现状、问题及其对策[J].中国农学通报,2021,37(4):74-78.
[14]杨冰,丁斐,李伟东,等.中药渣综合利用研究进展及生态化综合利用模式[J].中草药,2017,48(2):377-383.
[15]刘代缓,韩颜超,时登龙,等.3种中药渣栽培5种食药用菌利用潜力研究[J].时珍国医国药,2023,34(10):2483-2485.
[16]蔡良,欧阳冬青,施华蓉,等.不同中药配方颗粒药渣栽培灵芝研究[J].福建农业科技,2020(9):39-44.
[17]杨英歌,李荣,宋凯,等.灵芝-黄芪药渣固体双向发酵工艺优化及菌质多糖对肠癌HCT116的抑制作用研究[J].中国食品添加剂,2023,34(11):110-118.
[18]王锐丽,吴燕,陈颐辉,等.灵芝固态发酵中药渣产漆酶及其对偶氮染料的脱色[J].信阳师范学院学报(自然科学版),2023,36(4):580-587.
[19]张庆明,徐云燕,陈美惠,等.灵芝菌固体发酵感冒清热颗粒药渣的主要活性物质变化研究[J].东南国防医药,2019,21(6):616-620.
[20]HSU B Y,CHEN C H,LU T J,et al.Bioconversion of ginsenosides in american ginseng extraction residue by fermentation with Ganoderma lucidum improves insulin-like glucose uptake in 3T3-L1 adipocytes[J].Fermentation,2021,7(4):297.
[21]谭显东,陈楠,王浪,等.响应面法优化灵芝发酵三七渣产灵芝三萜工艺[J].中国酿造,2021,40(6):147-151.
[22]陈洪章,徐建.现代固态发酵原理及应用[M].北京:化学工业出版社,2004:45.
[23]胡伟,谭显东,黄凡,等.三七渣固态发酵所产淀粉酶的酶学特性研究[J].中国粮油学报,2014,29(5):110-114.
[24]祝铁钢,孙金旭,朱会霞,等.灵芝酸发酵条件优化[J].食品研究和开发,2015,36(21):161-163.
[25]林威.灵芝菌质发酵工艺及其抗氧化性研究[D].福州:福建师范大学,2022.
[26]LEE B K, PIAO H Y, CHUNG W J.Production of red pigments by Monascus purpureus in solid-state culture[J].Biotechnol Bioproc E,2002,7:21-25.
[27]谭显东,卢上飞,胡伟,等.三七渣固态发酵生产灵芝菌质的工艺优化[J].食品工业科技,2020,41(18):130-134.
[28]吴振强.固态发酵技术与应用[M].北京:化学工业出版社,2006:17.
[29]FERREIRA S L C,BRUNS R E,DA SILVA E G P,et al.Statistical designs and response surface techniques for the optimization of chromatographic systems[J].J Chromatogr A,2007,1158(1-2):2-14.