蜂蜜中含有多酚、类黄酮化合物等生物活性物质,具有抗糖尿病、抗癌、抗氧化等有益功效[1]。我国蜂蜜产量、出口量连续多年位居世界榜首,但深加工水平相对落后[2-3]。QB/T 5475—2020《蜂蜜酒》中规定蜂蜜酒是以蜂蜜、水为原料酿制而成的饮料酒。FU Y等[4]研究表明,蜂蜜稀释液经发酵后总酚、总黄酮含量分别增加13.14 mg没食子酸当量(gallic acid equivalent,GAE)/L、5.79 mg芦丁当量(rutin equivalent,RE)/L。KAWA-RYGIELSKA J等[5]研究表明,添加红葡萄籽的蜂蜜稀释液经发酵后抗氧化活性有所提升,其中1,1二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)自由基清除率、Fe2+还原力分别是发酵前的3倍、11倍、3倍,这为蜂蜜酒的深入研发提供了有利的理论支撑。
我国对蜂蜜酒的研究主要集中在发酵工艺优化、酵母筛选等方面[6-7]。酵母决定了蜂蜜酒最终的风味特征,高质量的酵母能够促进有益风味物质的生成,同时减少或抑制不良风味成分的产生[8]。我国大多利用单菌进行蜂蜜酒发酵,但单菌发酵会导致酒体的风味单一,缺乏复杂度和层次感[9]。而混菌发酵能延缓酒体的褪色程度,降低发酵酒中的乙酸和生物胺水平,提高甘油、酯类、挥发性酚类等特殊风味物质的含量,改善酒体品质,丰富酒体风味[10-12]。目前,鲜有混合酵母菌发酵制备蜂蜜酒品质分析的研究报道。
为了选出适合蜂蜜酒发酵的酵母组合,本研究分别将2株产酒酿酒酵母(Saccharomyces cerevisiae)(XQ2-2、T5)与2株产香酿酒酵母(T3、T4)两两复配用于蜂蜜酒发酵,对蜂蜜酒理化指标、感官品质进行分析,并采用顶空固相微萃取-气相色谱-质谱联用技术(headspace solidphase microextraction-gas chromatography-mass spectrometer,HS-SPME-GCMS)分析其挥发性风味物质,探究不同酵母组合发酵对蜂蜜酒品质的影响,以期提高我国蜂蜜酒的质量,促进蜂蜜酒在国内的消费,提高蜂农收入。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与酵母菌
蜂蜜:屏山县绿源蜂业有限公司;4株酿酒酵母(Saccharomyces cerevisiae)XQ2-2、T3、T4、T5:本实验室保藏;安琪葡萄酒·果酒专用酵母(PT):安琪酵母股份有限公司。
1.1.2 试剂
酵母浸粉、蛋白胨:北京奥博星生物技术有限责任公司;酚酞、NaOH、H2SO4、NaCl、无水葡萄糖:成都市科隆化学品有限公司;(NH4)2HPO4:广东光华科技股份有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS):飞净生物科技有限公司;乙酸戊酯:上海麦克林生化科技有限公司。所用试剂均为分析纯或生化试剂。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基:2%蛋白胨、1%酵母浸粉、2%无水葡萄糖,121 ℃灭菌20 min。
蜂蜜发酵液:用水将蜂蜜稀释至糖度为23°Bx,并加入0.8 g/L的(NH4)2HPO4,70 ℃加热10 min灭菌,冷却至室温备用。
1.2 仪器与设备
UV1800PC紫外可见分光光度计:上海菁华科技仪器有限公司;WAY.2S糖度计:邦西仪器科技(上海)有限公司;WAS110酒精折光仪:四川东华计量检测技术有限公司;ZWYR-D2403恒温培养振荡器:上海智城分析仪器制造有限公司;BSC-250恒温恒湿箱:上海博迅实业有限公司医疗设备厂;SW-CJ-2FD洁净工作台:苏州安泰空气技术有限公司;GI54DS立式自动压力蒸汽灭菌器:致微(厦门)仪器有限公司;FA2204N电子天平:上海菁海仪器有限公司;BHS-4数显恒温四孔水浴锅:宁波市鄞州群安实验仪器有限公司;7890A-5975B气相色谱-质谱联用仪、DB-WAX毛细管色谱柱(60 mm×250 μm×0.25 μm):美国安捷伦科技有限公司。
1.3 方法
1.3.1 产酒精、产香酵母筛选
产香酵母筛选:采用嗅闻法[13]初步判断各菌株产酯生香的能力。
产酒精酵母筛选:以菌株接种量为1×106 CFU/mL接种至蜂蜜发酵液中,于20 ℃恒温培养箱中培养,以CO2损失质量<0.25 g/(150 mL·d)作为发酵终点,发酵结束后测量发酵液的酒精度,以酒精度高低判断各菌株产酒精的能力[13]。分别各选取两株产香及产酒精能力强的菌株作为后续复配菌株。
1.3.2 酵母复配对蜂蜜酒品质的影响
将产酒酵母(XQ2-2、T5)与产香酵母(T3、T4)两两配对获得酵母组合:XQ2-2/T3、XQ2-2/T4、T5/T3、T5/T4,按1×106 CFU/mL接种量将不同酵母组合(1∶1)接入蜂蜜发酵液(装液量150 mL/250 mL)中,以PT酵母作为对照组。发酵液转移至20 ℃恒温培养箱中,发酵30 d,然后对酒样进行离心(5 000 r/min、10 min),取上清液用于理化指标检测、感官评价及风味物质分析。
1.3.3 分析检测
糖度的测定:手持糖度计;酒精度的测定:酒精折光仪;还原糖、挥发酸、总酸的测定:参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》;总酯的测定:参照GB/T 10345—2022《白酒分析方法》。
1.3.4 感官评价
选取10位经过感官培训的专业品评人员组成评定小组,对发酵完成后的蜂蜜酒酒样从外观、色泽、香气、口感、风格5个方面进行感官评价,根据QB/T 5475—2020《蜂蜜酒》制定蜂蜜酒感官评价标准,具体见表1。
表1 蜂蜜酒感官评价标准
Table 1 Sensory evaluation standards of mead
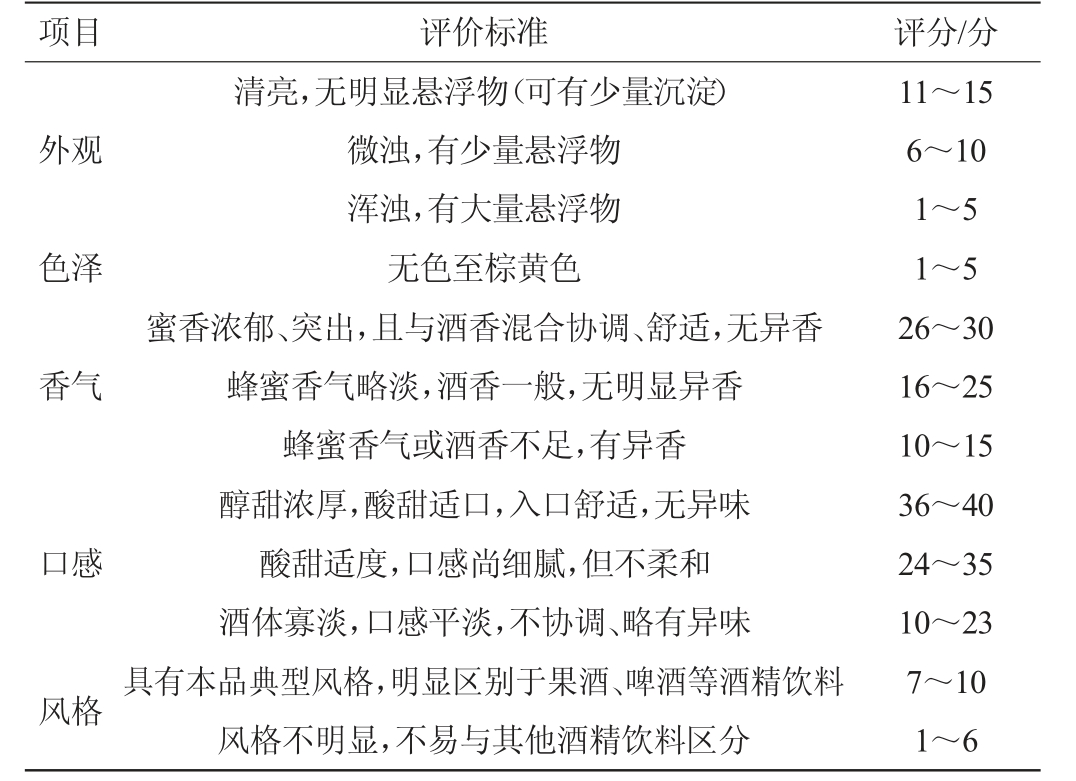
项目 评价标准 评分/分外观色泽香气口感风格清亮,无明显悬浮物(可有少量沉淀)微浊,有少量悬浮物浑浊,有大量悬浮物无色至棕黄色蜜香浓郁、突出,且与酒香混合协调、舒适,无异香蜂蜜香气略淡,酒香一般,无明显异香蜂蜜香气或酒香不足,有异香醇甜浓厚,酸甜适口,入口舒适,无异味酸甜适度,口感尚细腻,但不柔和酒体寡淡,口感平淡,不协调、略有异味具有本品典型风格,明显区别于果酒、啤酒等酒精饮料风格不明显,不易与其他酒精饮料区分11~15 6~10 1~5 1~5 26~30 16~25 10~15 36~40 24~35 10~23 7~10 1~6
1.3.5 挥发性风味物质分析
采用HS-SPME-GC-MS对蜂蜜酒中挥发性成分进行分析。
前处理方法:取8 mL蜂蜜酒样置于顶空瓶中,加入2 g NaCl、20 μL内标物乙酸戊酯(5.475 mg/L);45 ℃平衡10 min;然后将萃取针推出,于液面上方萃取45 min。
气相色谱条件:DB-WAX毛细管色谱柱(60mm×250μm×0.25 μm);不分流进样;进样口温度为230 ℃;升温程序为40 ℃保持0 min,然后以1 ℃/min升温至45 ℃,保持2 min,以3 ℃/min升温至84 ℃,保持2 min,以3 ℃/min升温至120 ℃,保持3 min,以3 ℃/min升温至200 ℃,保持0 min,以5 ℃/min升温至230 ℃,保持2 min;总运行时间71.667 min;载气为高纯氦气(He),流速为1 mL/min。
质谱条件:采用电子电离(electron ionization,EI)源,电子能量70 eV,质量扫描范围20~500 u,离子源温度230 ℃,四级杆温度150 ℃,接口温度230 ℃,溶剂延迟3 min。
定性定量分析:通过计算机检索各组分并与美国国家标准技术研究所(national institute of standards and technology,NIST)数据库对比鉴定进行定性分析,根据内标法进行定量分析。
气味活力值(odor activity value,OAV)用于估计各种香气化合物对酒体气味的贡献程度。OAV≥1的化合物被认为是酒体风味的主要贡献者[14]。其计算公式为:OAV=化合物浓度/化合物阈值[15]。
1.3.6 数据处理
利用Excel 2019软件进行数据的基本处理,用SPSS 27.0分析软件进行方差分析,用Origin 2022软件绘图。
2 结果与分析
2.1 酵母菌株产香及产酒精能力的测定
酵母菌株产香及产酒精能力的测定结果见表2。
表2 酵母菌株产香及产酒精能力的测定
Table 2 Determination of aroma and alcohol production capacity of yeast strains

注:“++++”表示香气程度9~10分;“+++”表示香气程度6~8分;“++表示香气程度”3~5分;“+”表示香气程度1~2分;“-”表示香气程度0分。
菌株编号XQ2-2 T3 T4 T5项目产香能力酒精度/%vol++13.0+++12.4++++12.5+13.0
由表2可知,菌株T4的香气程度高,产香能力最强,其次为菌株T3,而菌株XQ2-2和T5产香能力较弱。因此,选择菌株T3、T4作为产香酵母菌株。菌株XQ2-2和T5发酵液酒精度最高,均为13%vol,菌株T3、T4发酵液中酒精度较低,分别为12.4%vol、12.5%vol。因此,选择菌株XQ2-2和T5菌株作为产酒精酵母。
2.2 酵母复配对蜂蜜酒理化指标的影响
2.2.1 酵母复配对蜂蜜酒还原糖、糖度及酒精度的影响
酵母复配对蜂蜜酒还原糖、糖度及酒精度的影响见图1。
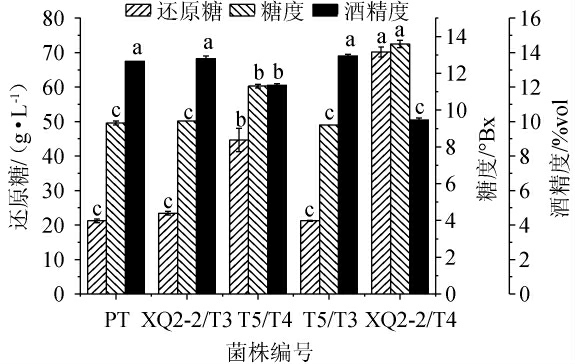
图1 酵母复配对蜂蜜酒还原糖、糖度及酒精度的影响
Fig.1 Effects of multi-yeast fermentation on reducing sugar, sugar and alcohol content of mead
不同小写字母表示同一指标在不同发酵组之间差异显著(P<0.05)。下同。
由图1可知,菌株PT、XQ2-2/T3、T5/T3发酵酒样的还原糖含量(分别为21.23 g/L、23.42 g/L、21.23 g/L)不显著(P>0.05)、糖度(分别为9.3°Bx、9.4°Bx、9.2°Bx)不显著(P>0.05),但均显著低于其他两组酒样(P<0.05),而酒精度(分别为13.5%vol、13.7%vol、13.8%vol)不显著(P>0.05),但均显著高于其他两组酒样(P<0.05)。在还原糖含量相同的情况下,酒精度越高说明该酵母组合的产酒精能力越强[16]。其中,菌株XQ2-2/T3、XQ2-2/T4发酵酒样中的酒精度高于菌株PT酒样,说明这两组酵母复配组合的产酒精能力强于商业酵母PT。结果表明,合理的酵母复配可以提高发酵能力,提高酒精产量,其中菌株XQ2-2/T3发酵酒样剩余还原糖含量比菌株XQ2-2/T4发酵酒样高2.19 g/L,而酒精度仅比菌株XQ2-2/T4发酵酒样低0.1%vol,说明该复配组合对还原糖的利用率更高,更有利于还原糖向乙醇的转化,是最利于蜂蜜酒积累乙醇的酵母复配组合。
2.2.2 酵母复配对蜂蜜酒挥发酸、总酸及总酯的影响
酵母复配对蜂蜜酒挥发酸、总酸及总酯的影响见图2。
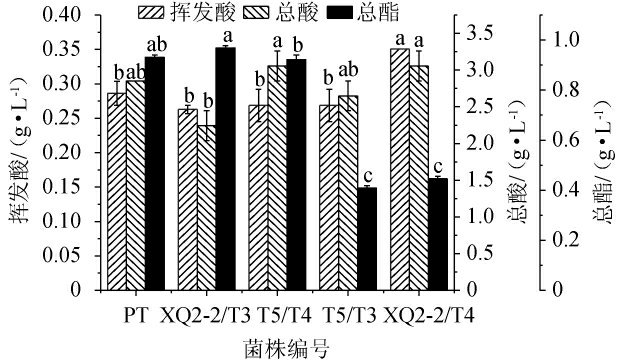
图2 酵母复配对蜂蜜酒挥发酸、总酸及总酯的影响
Fig.2 Effect of multi-yeast fermentation on volatile acids, total acids and total esters of mead
挥发酸是评价蜂蜜酒质量的一项重要指标,高挥发酸会给酒体带来难闻的醋味[17]。在轻工业行业标准QB/T 5475—2020《蜂蜜酒》中规定,蜂蜜酒(发酵型)的挥发酸含量不得超过1.2 g/L。由图2可知,各发酵酒样挥发酸含量范围为0.26~0.35 g/L,均满足行业标准。除菌株XQ2-2/T4发酵酒样挥发酸含量稍高外(P<0.05),其余发酵酒样间无显著差异(P>0.05)。其中菌株XQ2-2/T3发酵酒样挥发酸含量最低,为0.26 g/L。低挥发酸含量不会给酒体带来异味,能够保持酒体风味平衡。
酒体中适量的酸可以改善酒体的适口性、稳定性、抑菌性及酒体的颜色。一般来说,酒体总酸低,则酒体圆润、柔和,总酸高,则酒体瘦弱、粗糙[16]。由图2可知,所有酒样的总酸含量为2.24~3.06 g/L,且含有菌株T3发酵酒样中的总酸较低于其余发酵酒样,说明菌株T3的产酸能力较弱。其中,菌株XQ2-2/T3发酵酒样的总酸最低,为2.24 g/L,表明该复配组合在蜂蜜酒发酵过程中产生的酸性物质最少,不会给酒体带来刺激、粗糙的口感。
酯类是蜂蜜酒中的重要呈香物质,是影响蜂蜜酒香气的关键因素之一[16]。菌株XQ2-2/T3、PT发酵酒样总酯含量差异不显著(P>0.05),且菌株XQ2-2/T3发酵酒样的总酯含量(0.97 g/L)显著高于其余复配菌株组合(P<0.05)。菌株T5/T3、XQ2-2/T4发酵酒样的总酯含量显著低于其余发酵酒样(P<0.05),说明这两组复配组合不利于蜂蜜酒中总酯的积累,这可能与组合中两株酵母的酯类代谢途径相互抑制有关[18]。菌株XQ2-2/T3复配组合能够提高酒体的总酯含量,丰富蜂蜜酒风味,是适用于蜂蜜酒发酵的酵母复配组合。
2.3 酵母复配发酵对蜂蜜酒挥发性风味物质的影响
利用不同酵母复配组合进行蜂蜜酒发酵,采用HSSPME-GC-MS技术对发酵液中的挥发性风味物质进行分析,并计算OAV,结果见表3。
表3 不同处理组蜂蜜酒挥发性风味物质GC-MS检测结果
Table 3 Results of volatile flavor substances in mead of different treatment groups detected by GC-MS
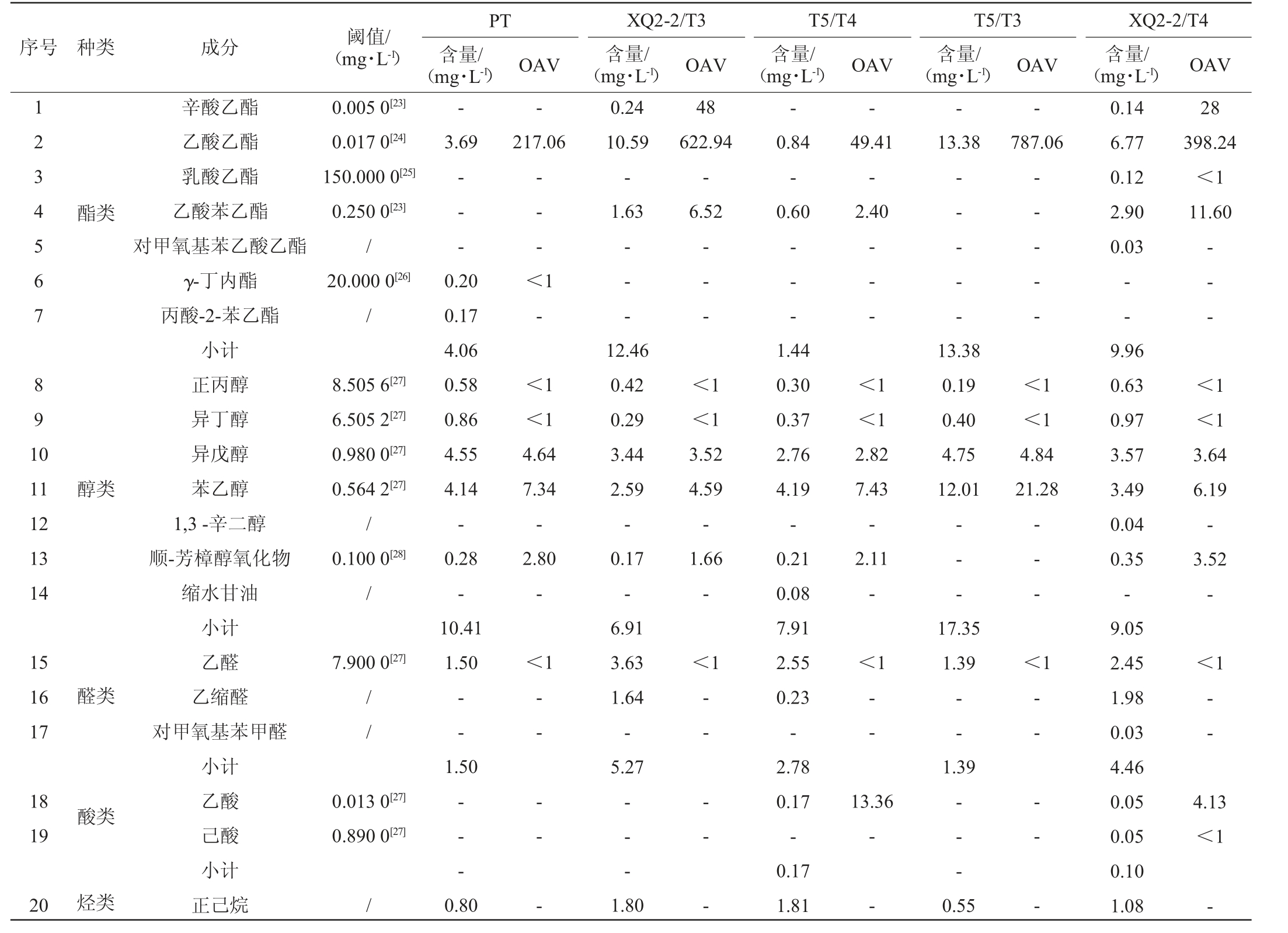
序号 种类 成分 阈值/(mg·L-1)PT含量/(mg·L-1)T5/T3含量/(mg·L-1)XQ2-2/T3含量/(mg·L-1)T5/T4含量/(mg·L-1)XQ2-2/T4 1 2 3 4 5 6 7 8 9 1 0-OAV OAV OAV OAV 0.005 0[23]0.017 0[24]150.000 0[25]0.250 0[23]/20.000 0[26]/0.24 10.59-1.63---含量/(mg·L-1)OAV-217.06 3.69酯类-- --8.505 6[27]6.505 2[27]0.980 0[27]0.564 2[27]/0.100 0[28]/-- -48 622.94-6.52-0.84-0.60 49.41-2.40 13.38 787.06 28 398.24<1 11.60-- - <1-- --- - <1-- - - -0.14 6.77 0.12 2.90 0.03--<1 12.46 0.42 0.29 3.44 2.59-0.17-6.91 3.63 1.64-5.27-- - <1 11 12 13 14醇类<1<1 4.64 7.34-2.80-15 16 17 7.900 0[27]0.20 0.17 4.06 0.58 0.86 4.55 4.14-0.28-10.41 1.50<1醛类//--辛酸乙酯乙酸乙酯乳酸乙酯乙酸苯乙酯对甲氧基苯乙酸乙酯γ-丁内酯丙酸-2-苯乙酯小计正丙醇异丁醇异戊醇苯乙醇1,3-辛二醇顺-芳樟醇氧化物缩水甘油小计乙醛乙缩醛对甲氧基苯甲醛小计乙酸己酸小计正己烷1.50 18 19酸类0.013 0[27]0.890 0[27]-- -20烃类/0.80-- - - --- --- - - - <1-- - <1<1 3.52 4.59-1.66-<1 2.82 7.43-2.11-13.38 0.19 0.40 4.75 12.01<1 4.84 21.28-- -<1 3.64 6.19-3.52-<1 17.35 1.39-- -<<1——--1.39 13.36-- -1-- - - -9.96 0.63 0.97 3.57 3.49 0.04 0.35-9.05 2.45 1.98 0.03 4.46 0.05 0.05 0.10 1.08 4.13<1 1.80-- - - -1.44 0.30 0.37 2.76 4.19-0.21 0.08 7.91 2.55 0.23-2.78 0.17-0.17 1.81--0.55-
由表3可知,从不同酒样中共检出20种挥发性风味物质,其中,酯类7种、醇类7种、醛类3种、酸类2种、烃类1种,酯类和醇类是蜂蜜酒中的主要香气成分。菌株PT、XQ2-2/T3、T5/T4、T5/T3、XQ2-2/T4发酵酒样中分别检测出10种、11种、12种、7种、17种挥发性风味物质,结果表明,不同酵母复配组合对蜂蜜酒中风味物质种类的影响非常大。除菌株T5/T3发酵酒样的风味物质种类少于单菌PT发酵酒样外,其余发酵酒样的风味物质种类均高于单菌PT发酵酒样,说明合理的酵母复配可以提高蜂蜜酒中风味物质的丰富度,提高蜂蜜酒品质。
菌株PT、XQ2-2/T3、T5/T4、T5/T3、XQ2-2/T4发酵酒样中酯类风味物质总量分别为4.06 mg/L、12.46 mg/L、1.44 mg/L、13.38 mg/L、9.96 mg/L。5组酒样中共有酯类物质为乙酸乙酯,其含量在酯类物质中占比最高,均占酒样中酯类物质的58.33%以上,赋予酒体酒香、果香等特征风味。辛酸乙酯仅在菌株XQ2-2/T3、XQ2-2/T4发酵酒样中检测出,表现为水果香、百合花香、甜香等特征风味[19]。乙酸苯乙酯仅在菌株XQ2-2/T3、T5/T4、XQ2-2/T4发酵酒样中检测出,赋予酒体玫瑰花香、茉莉花香及蜜味香气[20]。这3种酯类物质共同构成了蜂蜜酒的主体香气成分。菌株PT发酵酒样独有的酯类物质为γ-丁内酯,菌株XQ2-2/T4发酵酒样中还检测出了乳酸乙酯和对甲氧基苯乙酸乙酯,但这些酯类物质的含量非常低,不会对酒体风味产生影响。结果表明,酵母复配会改变蜂蜜酒中酯类物质的种类和含量,能够作为增加蜂蜜酒风味的有效手段。
菌株PT、XQ2-2/T3、T5/T4、T5/T3、XQ2-2/T4发酵酒样中醇类风味物质总量分别为10.41 mg/L、6.91 mg/L、7.91 mg/L、17.35 mg/L、9.05 mg/L。5组发酵酒样中共有醇类物质为正丙醇、异丁醇、异戊醇、苯乙醇,这些醇类物质均属于高级醇[21]。其中异戊醇、苯乙醇是蜂蜜酒风味的主要贡献者,其含量占醇类物质(乙醇除外)的71.87%~96.60%。高级醇作为脂肪醇具有毒性,过量的高级醇不仅会破坏酒体的口味,导致酒体辛辣苦涩,还容易上头,引起宿醉[22]。菌株XQ2-2/T3发酵酒样的高级醇类物质含量最低,为6.74 mg/L,该含量水平避免了酒体出现令人不快的苦味。
菌株PT、XQ2-2/T3、T5/T4、T5/T3、XQ2-2/T4发酵酒样中醛类风味物质总量分别为1.50 mg/L、5.27 mg/L、2.78 mg/L、1.39 mg/L、4.46 mg/L。5组发酵酒样共有醛类物质为乙醛。菌株XQ2-2/T3、T5/T4、XQ2-2/T4发酵酒样中检测到了乙缩醛,菌株XQ2-2/T4发酵酒样还检测到了对甲氧基苯甲醛。乙缩醛是由乙醛转化而来,菌株PT、T5/T3发酵酒样中并未检测到乙缩醛,这可能与酒样中乙醛含量过低有关。菌株XQ2-2/T3发酵酒样醛类物质含量最高,说明该复配组合有利于更多醛类香气的形成。
菌株PT、XQ2-2/T3、T5/T4、T5/T3、XQ2-2/T4发酵酒样中其他类(酸类、烃类)风味物质总量分别为0.80 mg/L、1.80 mg/L、1.98 mg/L、0.55 mg/L、1.18 mg/L。这些风味物质含量虽然较少,但也是蜂蜜酒中不可或缺的风味成分。
菌株PT发酵酒样中有4种物质的OAV≥1,分别为乙酸乙酯、异戊醇、苯乙醇、顺-芳樟醇氧化物。菌株XQ2-2/T3发酵酒样中有6种物质的OAV≥1,分别为辛酸乙酯、乙酸乙酯、乙酸苯乙酯、异戊醇、苯乙醇、顺-芳樟醇氧化物。菌株T5/T4发酵酒样中有6种物质的OAV≥1,分别为乙酸乙酯、乙酸苯乙酯、异戊醇、苯乙醇、顺-芳樟醇氧化物、乙酸。菌株T5/T3发酵酒样中有3种物质的OAV≥1,分别为乙酸乙酯、异戊醇、苯乙醇。菌株XQ2-2/T4发酵酒样中有7种物质的OAV≥1,分别为辛酸乙酯、乙酸乙酯、乙酸苯乙酯、异戊醇、苯乙醇、顺-芳樟醇氧化物、乙酸。5组酒样中共有的OAV≥1的风味物质分别为乙酸乙酯、异戊醇、苯乙醇。表明这3种物质能够在蜂蜜酒的酿造过程中稳定生成,可能是蜂蜜酒中特有的风味物质。4组酵母复配酒样的乙酸乙酯、异戊醇、苯乙醇的平均含量分别为7.90 mg/L、3.63 mg/L、3.57 mg/L,与单菌PT发酵酒样相比,乙酸乙酯含量增加114%,异戊醇、苯乙醇含量之和增幅5.7%,说明酵母复配可以在大幅提升蜂蜜酒乙酸乙酯含量的情况下,仅增加少量的高级醇含量,既丰富了蜂蜜酒的风味,又不会因高级醇含量过高而给酒体带来苦味。结果表明,酵母复配是增加酒体风味物质种类及含量的有效方法。其中,菌株XQ2-2/T3发酵酒样的酯类、醛类风味物质含量较高,高级醇含量最低,说明该复配组合能给酒体带来丰富的酯香、醛香和最低的苦味,是提高蜂蜜酒品质的最佳酵母复配组合。
2.4 酵母复配发酵对酒样感官品质的影响
对不同处理组酒样进行感官评价,结果见图3。
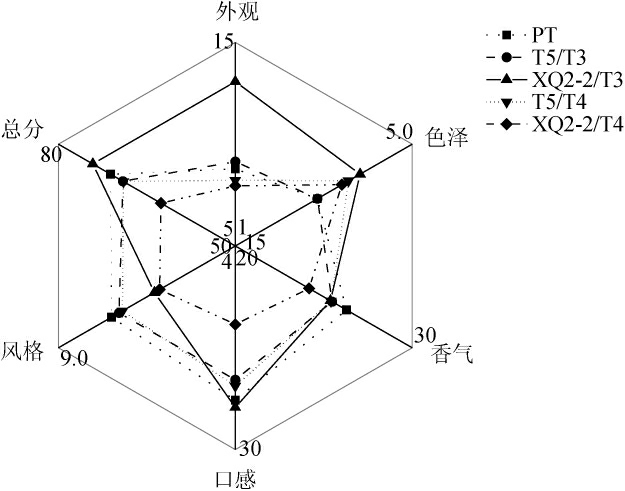
图3 不同处理组蜂蜜酒酒样感官评价雷达图
Fig.3 Radar maps of sensory evaluation of mead samples with different treatment groups
由图3可知,菌株XQ2-2/T4发酵酒样外观、色泽、香气、口感、风格方面感官评分均较低,该发酵酒样有微量沉淀,酸、酯、醇、糖搭配不协调,口感甜而腻。菌株T5/T3、T5/T4、PT发酵酒样在外观、色泽、香气、口感、风格方面差异不大,口感酸甜适度,具有蜂蜜酒的典型风格,无明显缺陷。菌株XQ2-2/T3发酵酒样在外观、色泽、口感方面得分最高,分别为13.07分、3.82分、27.93分,其总分为74.18分。澄清度是影响蜂蜜酒外观特性的重要因素,如果出现沉淀,会严重影响人们的购买欲[29]。菌株XQ2-2/T3发酵酒样外观清亮无沉淀,颜色金黄,明显优于其他组合酒样,这可能与酵母种类及酒体总酸低等因素有关[30]。
综上,菌株XQ2-2/T3发酵酒样口感酸甜适度,风味协调,外观清亮,感官评分较高,因此菌株XQ2-2/T3复配组合最适用于蜂蜜酒的酿造。
3 结论
该研究分别将2株产酒酿酒酵母(XQ2-2、T5)与2株产香酿酒酵母(T3、T4)两两复配用于蜂蜜酒发酵,并对发酵酒样的品质进行分析。结果表明,菌株XQ2-2/T3为酿制蜂蜜酒的最佳酵母复配组合,其糖度、还原糖、挥发酸、总酸、酒精度及总酯含量分别为9.4°Bx、23.42 g/L、0.26 g/L、2.24 g/L、13.7%vol、0.97 g/L,感官评分为74.18分。HS-SPME-GC-MS表明,菌株XQ2-2/T3蜂蜜酒共检出11种挥发性风味物质,其中,酯类3种、醇类5种、醛类2种、烃类1种,相对含量分别为47.13%、26.13%、19.93%、6.81%,各香气成分间搭配协调,共同构成了蜂蜜酒的独特风味,得到的酒体颜色金黄,清澈透明,蜜香及果香浓郁,具有蜂蜜酒的典型风格。该研究丰富了酿造蜂蜜酒的酵母种类,并验证了通过酵母复配进行蜂蜜酒发酵的可行性,为提升蜂蜜酒品质,促进蜂蜜酒的消费提供了理论依据。
[1]CIANCIOSI D, FORBES-HERNÁNDEZ T, AFRIN S, et al.Phenolic compounds in honey and their associated health benefits: A review[J].Molecules,2018,23(9):2322.
[2]李瑞珍,方兵兵,刘世丽.世界蜂蜜生产、贸易与消费发展态势分析[J].中国食物与营养,2021,27(8):15-20.
[3]赵彤,王宣,吴黎明,等.发酵蜂产品研究进展[J].食品工业科技,2022,43(14):461-466.
[4]FU Y,SHI X H,LI F R,et al.Fermentation of mead using Saccharomyces cerevisiae and Lactobacillus paracasei:Strain growth,aroma components and antioxidant capacity[J].Food Biosci,2023,52:102402.
[5]KAWA-RYGIELSKA J,ADAMENKO K,KUCHARSKA A Z,et al.Fruit and herbal meads-Chemical composition and antioxidant properties[J].Food Chem,2019,283:19-27.
[6]郭楠楠,王璇,李晓,等.响应面法优化五味子蜂蜜酒发酵工艺[J].中国酿造,2023,42(2):182-188.
[7]杜刚,詹梦涛,马坚司毅,等.蜂蜜中酵母菌的分离鉴定及蜂蜜酒的研制[J].中国酿造,2020,39(7):78-82.
[8]PRESTIANNI R,MATRAXIA M,NASELLI V,et al.Use of sequentially inoculation of Saccharomyces cerevisiae and Hanseniaspora uvarum strains isolated from honey by-products to improve and stabilize the quality of mead produced in Sicily[J].Food Microbiol,2022,107:104064.
[9]WANG Y,QI X Y,FU Y,et al.Effects of Torulaspora delbrueckii co-fermented with Saccharomyces cerevisiae on physicochemical and aromatic profiles of blueberry fermented beverage[J].Food Chem, 2023, 409:135284.
[10]张文文,白梦洋,吴祖芳,等.果酒酵母菌混合发酵的研究进展[J].食品科学,2018,39(19):252-259.
[11]LIU W, JI R, AIMAIER A, et al.Adjustment of impact phenolic compounds, antioxidant activity and aroma profile in Cabernet Sauvignon wine by mixed fermentation of Pichia kudriavzevii and Saccharomyces cerevisiae[J].Food Chem,2023,18:100685.
[12]ZHANG B Q,LIU H,XUE J,et al.Use of Torulaspora delbrueckii and Hanseniaspora vineae co-fermentation with Saccharomyces cerevisiae to improve aroma profiles and safety quality of Petit Manseng wines[J].LWT-Food Sci Technol,2022,161:113360.
[13]田景芝.蜂蜜酒酵母菌株的筛选及发酵工艺的研究[D].福州:福建农林大学,2013.
[14]TAN F,WANG P,ZHAN P,et al.Characterization of key aroma compounds in flat peach juice based on gas chromatography-mass spectrometry-olfactometry(GC-MS-O),odor activity value(OAV),aroma recombination,and omission experiments[J].Food Chem,2022,366:130604.
[15]YE Y H, ZHENG S Y, WANG Y X.Analysis of aroma components changes in Gannan navel orange at different growth stages by HS-SPMEGC-MS,OAV,and multivariate analysis[J].Food Res Int, 2024, 175:113622.
[16]曾智娟,邓杰,任志强,等.不同酵母菌发酵对生姜梨酒品质的影响[J].食品与发酵工业,2020,46(1):229-236.
[17]JU Y L XU X L,YU Y K,et al.Effects of winemaking techniques on the phenolics, organic acids, and volatile compounds of Muscat wines[J].Food Biosci,2023,54:102937.
[18]LUCIO O, PARDO I, HERAS J M, et al.Influence of yeast strains on managing wine acidity using Lactobacillus plantarum[J].Food Control,2018,92:471-478.
[19]RAO W J, LI X, OUYANG L H, et al.Characterization of key aroma compounds in rice flavor Baijiu from different rice raw materials by gas chromatography-ion mobility spectrometry and gas chromatography-olfactometry-quadrupole time of flight mass spectrometry[J].Food Biosci,2023,56:103370.
[20]HAO J,XU H N,YAN P F,et al.Effect of ultrasound-assisted fermentation on physicochemical properties and volatile flavor compounds of Chinese rice wine[J].Food Physics,2023,1:100006.
[21]LUO Y,KONG L H,XUE R Q,et al.Bitterness in alcoholic beverages:The profiles of perception,constituents,and contributors[J].Trends Food Sci Technol,2020,96:222-232.
[22]李健俊,屈春云,刘功良,等.饮料酒中高级醇的危害及其调控研究进展[J].食品与发酵工业,2023,49(14):321-329.
[23]李红玉,贺艳楠,李毅丽.混菌发酵对两个品种葡萄酒香气的影响[J].中外葡萄与葡萄酒,2023(6):99-106.
[24]张娟,田旭,贾毅男,等.发酵后排籽浸渍对西拉干红葡萄酒香气成分及感官品质的影响[J].中国酿造,2023,42(7):221-227.
[25]李慧颖,郑福静,张煜,等.外源多酚对赤霞珠干红葡萄酒发酵挥发性物质稳定与呈香的基质效应[J].中国食品学报,2024,24(4):370-380.
[26]聂庆庆,徐岩,范文来.固相萃取结合气相色谱-质谱技术定量白酒中的γ-内酯[J].食品与发酵工业,2012,38(4):159-164.
[27]佟恩杰,李小燕,赵凯,等.酿酒酵母对无醇啤酒酿造特性及风味的影响[J].中国酿造,2023,42(10):32-38.
[28]陈国和,胡腾飞,王乐涯,等.基于HS-SPME-GC-O-MS结合OAV鉴定槟榔香六堡茶关键香气物质[J/OL].食品与发酵工业,1-9[2024-04-28].https://doi.org/10.13995/j.cnki.11-1802/ts.037083.
[29]MIERCZYNSKA-VASILEV A,SMITH P A.Current state of knowledge and challenges in wine clarification:Knowledge and challenges in wine clarification[J].Aust J Grape Wine Res,2015,21(1):615-626.
[30]李阳,吴昊,杨洪岩.发酵酒澄清方法的研究进展[J].酿酒科技,2018(3):80-86.