果胶是一种天然复杂的糖类聚合物,其组成有同质多糖和杂多糖两种类型,多存在于植物细胞壁和细胞内层,初生细胞壁中纤维素、半纤维素和果胶分别占30%、30%和35%左右[1]。果胶酶(pectinases)是能降解果胶物质的一类酶的总称[2-3],占到全球食品酶制剂的25%,根据其作用机理可分为3大类:聚半乳糖醛酸酶(polygalacturonase,PG)、果胶酯酶(pectinestease,PE)、果胶裂解酶(pectinlyases,PL)[2,4-6]。果胶酶在食品、医药、纺织、造纸、动物饲料生产以及废水处理等领域都有广泛应用,是生物技术领域最具商业价值的酶之一[7-9]。国内果胶酶需求量很大,根据果胶酶的最适作用pH来划分,果胶酶可分为酸性果胶酶和碱性果胶酶两大类[10]。碱性果胶酶是在碱性条件下具有较高活性的果胶酶,主要应用于纺织业的脱胶、速溶茶和咖啡的加工、造纸业的酶法脱胶以及环境治理等行业中[11-14];酸性果胶酶是在酸性条件下具有较高活性的果胶酶,广泛地应用于食品工业中,特别是在果蔬汁和果酒的生产中具有良好的应用效果[15-17],目前工业上使用较好的商品化果胶酶主要是酸性果胶酶。
麻纤维是天然纤维的重要来源之一,具有抑菌等多种活性,是不可或缺的功能纤维,广泛应用于纺织、轨道交通、航空航天及医疗等领域[18-19]。麻纤维用于纺织原料,需适当去除韧皮里的半纤维素、果胶和木质素[20-21]。目前,工业上大多采用化学脱胶法,其成本高、能耗大、严重污染环境,而且纤维制成率低、品质较差[22]。生物脱胶可节省大量化工原料和能源,极大减轻脱胶废水造成的环境污染,能获得更优质的纤维[23]。王楚元等[24]对比了果胶酶、木聚糖酶、果胶酶/木聚糖酶复合脱胶的应用效果,结果表明,相对于传统碱法脱胶,生物酶复合脱胶法不仅具有节能环保、作用条件温和的优势,同时能更好地保留苎麻固有特性,提高精干麻品质。王慧慧等[25]选用2株芽孢杆菌建立了复合微生物脱胶技术,发现通过复合微生物协同作用,丰富脱胶过程中关键酶系,提高了苎麻纤维胶质去除率,缩短了脱胶时间。
本课题以从克氏原螯虾肠道分离到的一株产果胶酶类芽孢杆菌(Paenibacillus sp.)C21为研究对象,利用单因素和正交试验设计优化菌株的产酶条件,并在最适培养条件下对苎麻纤维进行微生物脱胶试验,为苎麻纤维生物脱胶工业化应用提供指导。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与试剂
类芽孢杆菌(Paenibacillus sp.)C21:实验室从克氏原螯虾肠道分离;果胶:生工生物工程(上海)股份有限公司;蛋白胨、琼脂粉(均为生化试剂):英国OXOID公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、酒石酸钾钠、葡萄糖、牛肉膏、硫酸铵、NaNO3、K2HPO4、KH2PO4、NaCl(均为分析纯):国药集团(上海)化学试剂有限公司。
1.1.2 培养基
种子培养基:葡萄糖10.0 g/L,牛肉膏3.0 g/L,蛋白胨10.0 g/L,NaCl 5.0 g/L,1×105 Pa灭菌20 min。发酵培养基:葡萄糖10.0 g/L,蛋白胨5.0 g/L,KH2PO4 3.0 g/L,K2HPO4 9.0 g/L,1×105 Pa灭菌20 min。
1.2 仪器与设备
TS-1112B型双层恒温振荡培养箱:常州市国旺仪器制造有限公司;SPX-250B-Z型恒温培养箱:上海博讯实业有限公司医疗设备厂;HH-S2型恒温水浴锅:常州中捷试验仪器制造有限公司;UV2150型紫外可见分光光度计:尤尼柯(上海)仪器有限公司;BXM-30R型高压蒸汽灭菌锅:上海博迅医疗生物仪器股份有限公司;JJ-CJ-2FD型无菌操作台:苏州市金净净化设备科技有限公司。
1.3 试验方法
1.3.1 菌种的培养及粗酶液的制备
甘油菌先在平板上活化,挑取单菌落接种至种子培养基,培养至对数期后转接到发酵培养基。发酵液转移到离心管中,10 000 r/min离心10 min,上清液即为粗酶液。
1.3.2 菌株C21产果胶酶条件优化单因素试验
在发酵培养基的基础上,分别研究碳源种类(淀粉、葡萄糖、蔗糖、果糖、麦芽糖)(添加量为10 g/L)、氮源种类(硫酸铵、牛肉膏、硝酸钠、蛋白胨、酵母粉)(添加量为5 g/L)、葡萄糖添加量(4 g/L、6 g/L、8 g/L、10 g/L、12 g/L)、蛋白胨添加量(1 g/L、3 g/L、5 g/L、7 g/L、9 g/L)、接种量(1%、2%、3%、4%、5%)、发酵温度(25 ℃、30 ℃、35 ℃、40 ℃、45 ℃),发酵时间(12 h、24 h、36 h、48 h、60 h)和初始pH值(6、7、8、9、10)对菌株C21产果胶酶的影响。
1.3.3 菌株C21产果胶酶条件优化正交试验
在单因素试验优化基础上,选择初始pH值(A)、发酵温度(B)、接种量(C)和发酵时间(D)4个因素设计4因素3水平正交试验,以果胶酶酶活力为评价指标确定最优产酶条件,试验因素与水平见表1。
表1 产果胶酶条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal tests for pectinase production conditions optimization

水平 A 初始pH值 B 发酵温度/℃ C 发酵时间/h D 接种量/%1 2 3 7 8 9 32 35 38 12 24 36 2 3 4
1.3.4 苎麻纤维的生物脱胶
取5 g苎麻,置于装有97 mL水的250 mL锥形瓶中,液面覆盖苎麻,接入3 mL培养16 h的细菌菌悬液(菌体生长已进入对数期,达到1.0×109 CFU/mL)。脱胶初始pH 9.0,于32 ℃、180 r/min脱胶36 h,脱胶结束后,将苎麻样品冲洗干净,置于称量瓶中烘至质量恒定后于电子分析天平称质量,设置3个平行,取平均值,计算苎麻纤维质量损失率。
1.3.5 测定方法
(1)果胶酶活力的测定
采用DNS法,将0.5 mL10g/L的果胶溶液加入比色管中,于50 ℃水浴锅恒温预热5 min,随后加入1.5 mL的粗酶液(发酵液10 000 r/min离心10 min,取上清即得到待测粗酶液),混合均匀,在50 ℃水浴反应30 min。之后,取出比色管,加入3 mL DNS溶液,沸水浴5 min,迅速冷却。最后,将溶液定容至25 mL,并在波长540 nm处测量OD540nm值。以煮沸10 min的发酵酶液作为空白对照,每个水平设定3个平行,取平均值。
果胶酶酶活定义:在50 ℃的条件下,1 mL酶液1 min分解果胶产生1 μg半乳糖醛酸所需的酶量为一个酶活力单位,U/mL。酶活计算公式如下:
式中:C为半乳糖醛的含量,mg/mL;N为酶液的稀释倍数;1 000为mmol与μmol的倍数转换;T为反应时间,min;V为酶液体体积,mL。
(2)苎麻纤维质量损失率的测定
采用质量差法进行测试,质量损失率计算公式如下:
式中:G1为苎麻纤维处理前干质量,g;G2为苎麻纤维处理后干质量,g。
1.3.6 数据分析
单因素试验以及正交试验均设3个重复,酶活测定结果采用3组平行样的酶活平均值,采用SigmaPlot 10.0软件进行数据分析和作图。
2 结果与分析
2.1 培养基组成对菌株C21发酵产果胶酶的影响
2.1.1 碳源种类及最适碳源添加量对菌株C21发酵产果胶酶的影响
分别采用淀粉、葡萄糖、蔗糖、果糖和麦芽糖作为培养基唯一碳源,添加量为10 g/L,其他组分与发酵培养基成分相同。考察不同碳源对菌株C21产果胶酶的影响,结果见图1。由图1可知,以果糖和麦芽糖为碳源的发酵液果胶酶活力较低,而葡萄糖作为碳源可以明显提高菌株C21产果胶酶的活性,高于其他碳源的酶活力,说明该菌最适碳源为葡萄糖,其次为淀粉和蔗糖。因此,选择最适碳源为葡萄糖。考察葡萄糖添加量对酶活的影响,结果见图2。由图2可知,随着葡萄糖添加量的增加,酶活力先上升后下降,当葡萄糖添加量为8 g/L时,果胶酶酶活最高达到185.39 U/mL。因此,选择葡萄糖作为碳源,添加量为8 g/L。
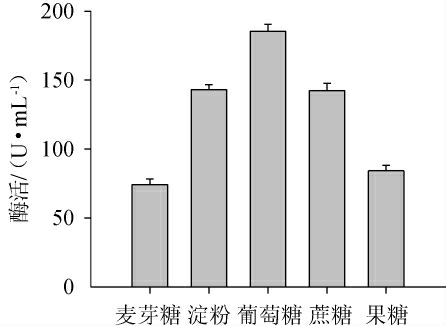
图1 碳源种类对菌株C21产果胶酶的影响
Fig.1 Effects of carbon source types on pectinase production of strain C21
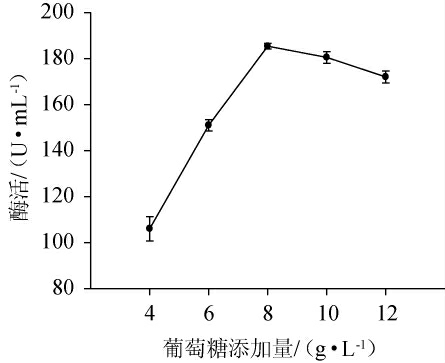
图2 葡萄糖添加量对菌株C21产果胶酶的影响
Fig.2 Effects of glucose addition on pectinase production of strain C21
2.1.2 氮源种类及最适氮源添加量对菌株C21发酵产果胶酶的影响
分别采用硫酸铵、酵母粉、蛋白胨、牛肉膏、硝酸钠为单一氮源,添加量为5 g/L,其他组份与发酵培养基成分相同。考察不同氮源对菌株C21产果胶酶的影响,结果见图3。由图3可知,在只改变氮源的情况下,相比于其他氮源,蛋白胨作为唯一氮源产果胶酶活力最高,其次依次为牛肉膏、硝酸钠和酵母粉,而硫酸铵作为氮源的发酵液酶活最低,仅为25.40 U/mL。结合工业经济考虑,蛋白胨廉价易得且产酶活力高。因此,选择最适氮源为蛋白胨。考察不同蛋白胨添加量对果胶酶活的影响,结果见图4。由图4可知,随着蛋白胨添加量的增加,果胶酶活呈先上升后下降的趋势,当蛋白胨添加量为5 g/L时,果胶酶活力最高,为180.84 U/mL。因此,选择5 g/L蛋白胨作为氮源。
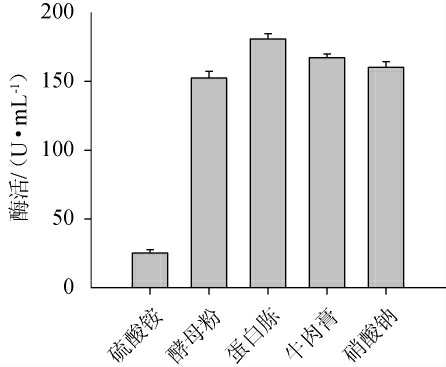
图3 氮源种类对菌株C21产果胶酶的影响
Fig.3 Effects of nitrogen source types on pectinase production of strain C21
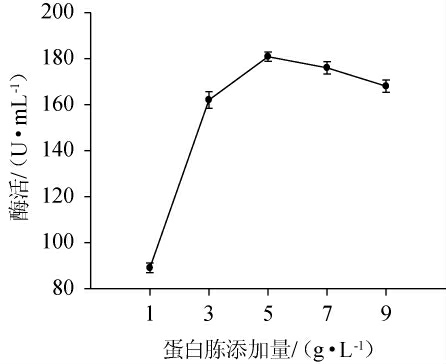
图4 蛋白胨添加量对菌株C21产果胶酶的影响
Fig.4 Effects of peptone addition on pectinase production of strain C21
2.2 培养条件对菌株C21发酵产果胶酶的影响
2.2.1 接种量对菌株C21发酵产果胶酶的影响
接种量对菌株C21产果胶酶的影响见图5。
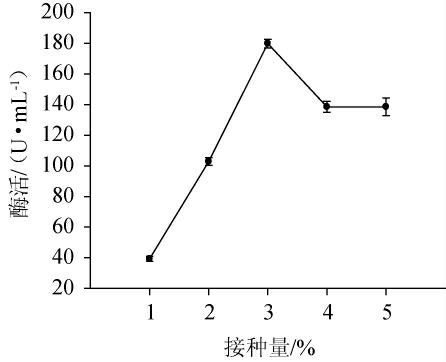
图5 接种量对菌株C21产果胶酶的影响
Fig.5 Effects of inoculum on pectinase production of strain C21
由图5可知,在接种量1%~5%时,果胶酶活呈先上升后下降再保持平稳的趋势,一个可能的原因是接种量较小时,菌体增长的数量较少,导致酶活力较低,而接种量较大时,大量菌体的增长繁殖加速消耗了培养基内的营养物质,引起溶氧以及营养不足,最终影响了果胶酶的合成。在接种量为3%时,产果胶酶酶活最高为179.78 U/mL。因此,最佳接种量为3%。
2.2.2 发酵时间对菌株C21发酵产果胶酶的影响
发酵时间对菌株C21产果胶酶的影响见图6。由图6可知,在发酵时间为12~60h范围内,酶活力呈先上升后下降的趋势。在发酵时间24 h时,表现出最高酶活,为185.21 U/mL,此后延长发酵时间酶活力下降,可能的原因是进入稳定期后,菌体产酶速率下降,部分酶失活导致的。因此,最佳发酵时间为24 h。
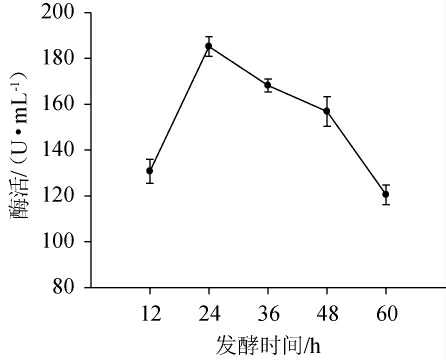
图6 发酵时间对菌株C21产果胶酶的影响
Fig.6 Effects of fermentation time on pectinase production of strain C21
2.2.3 发酵温度对菌株C21发酵产果胶酶的影响
发酵温度对菌株C21产果胶酶的影响见图7。由图7可知,当发酵温度在25~45 ℃的范围内果胶酶活力呈先上升后下降的趋势,在培养温度为35 ℃时,果胶酶活力达到顶峰为198.05 U/mL。过低和过高的温度都不利于细菌的生长繁殖,影响产物的合成速率,导致较低的果胶酶活力,因此,确定该菌株的最适发酵温度为35 ℃。
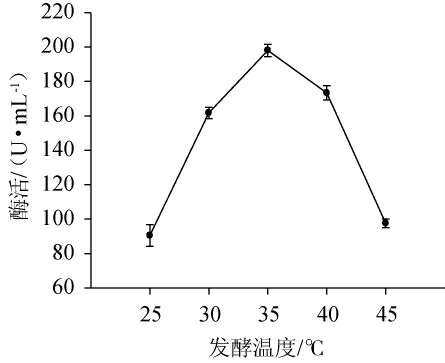
图7 发酵温度对菌株C21产果胶酶的影响
Fig.7 Effects of fermentation temperature on pectinase production of strain C21
2.2.4 初始pH对菌株C21发酵产果胶酶的影响
初始pH对菌株C21产果胶酶的影响见图8。由图8可知,随着初始pH值在6~10范围内的升高,果胶酶活力呈现先升高后降低的趋势。在pH值6的环境下果胶酶酶活很低,仅为101.58 U/mL,pH 6~8范围内酶活快速升高,菌株C21在pH 8时产果胶酶活力达到顶峰为189.76 U/mL。pH值超过8后酶活开始缓慢下降,可能是由于该菌株喜好偏碱性环境,所产果胶酶为碱性果胶酶。因此,确定该菌株的最优初始pH值为8。
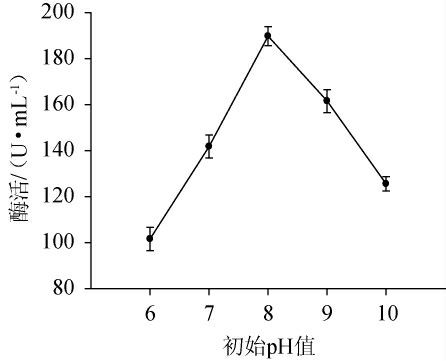
图8 初始pH对菌株C21产果胶酶的影响
Fig.8 Effects of initial pH on pectinase production of strain C21
2.3 菌株C21产酶条件优化正交试验
在单因素试验的基础上,以初始pH值(A)、发酵温度(B)、发酵时间(C)、接种量(D)为考察因素,以菌株产果胶酶酶活(Y)为评价指标进行正交试验,结果与分析见表2。正交试验结果方差分析见表3。
表2 产果胶酶条件优化正交试验结果与分析
Table 2 Results and analysis of orthogonal tests on pectinase production conditions optimization
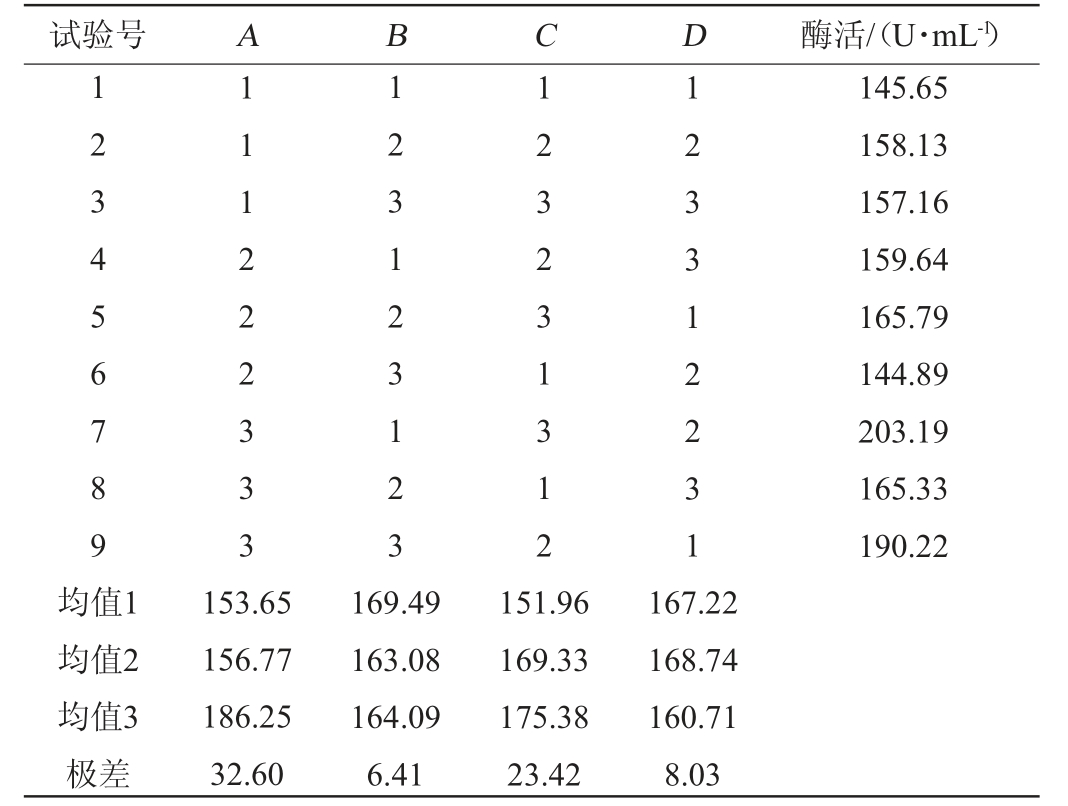
试验号 A B C D 酶活/(U·mL-1)1234 5678 9 11122233 3 123123123 123231312 123 312231 145.65 158.13 157.16 159.64 165.79 144.89 203.19 165.33 190.22均值1均值2均值3极差153.65 156.77 186.25 32.60 169.49 163.08 164.09 6.41 151.96 169.33 175.38 23.42 167.22 168.74 160.71 8.03
表3 正交试验结果方差分析
Table 3 Variance analysis of orthogonal tests results

注:“*”表示对结果影响显著(P<0.05)。
因素 偏差平方和 自由度 F 比 临界值 显著性初始pH值发酵温度发酵时间接种量误差1 941.213 71.297 887.088 109.108 71.30 2 2 2 2 2 27.227 1.000 12.442 1.530 19.000 19.000 19.000 19.000*
从表2可知,对菌株C21产果胶酶影响因素的主次顺序为A>C>D>B,即初始pH值对酶活的影响最大,其次是发酵时间,最后是接种量和发酵温度,由极差分析可知,最佳产酶条件组合为A3B1C3D2,与试验组9的条件一致,因此,确定最优发酵条件为发酵初始pH值9,发酵温度32 ℃,接种量3%,发酵时间36 h。在该条件下,进行3次平行验证试验,结果表明,果胶酶活达到206.37 U/mL。由表3可知,在正交试验的4个因素中,只有初始pH值对产果胶酶影响达到显著水平(P<0.05)。
2.4 菌株C21生物脱胶研究
苎麻等麻类作物的韧皮中除纤维素外,还含有大量的键合型胶质,由果胶和半纤维素等组成,脱胶是获取麻纤维的唯一途径,脱胶难的问题制约了麻类产业的可持续发展。本研究利用菌株C21对苎麻进行36 h的连续脱胶试验,检测苎麻纤维质量损失率。脱胶试验后,与对照相比,试验组苎麻纤维表现为更加细腻,颜色较白,对苎麻反复水洗并烘干称质量,苎麻纤维质量损失率为30.4%,表明菌株C21有较好的苎麻脱胶效果,具有应用到苎麻脱胶工业的潜力。
3 结论
对一株从克氏原螯虾肠道筛选到的类芽孢杆菌C21进行液体发酵,在单因素试验基础上,采用正交试验对其发酵产酶条件进行优化。结果表明,菌株C21最适发酵产果胶酶条件为:葡萄糖8 g/L、蛋白胨5 g/L、接种量3%、初始pH 9、温度32 ℃、发酵时间36 h。在此条件下,果胶酶活力可达206.37 U/mL。在最优发酵条件下,利用菌株C21对苎麻进行36 h的生物脱胶试验,苎麻纤维质量损失率为30.4%,具有一定的开发潜力。
[1]刘均珠,黄玉婷,梁丽陈,等.产果胶酶菌株的筛选鉴定及产酶条件初步优化[J].饲料研究,2022,45(11):71-75.
[2]李碧婵,肖国利,黄星星,等.一株产果胶酶芦苇内生真菌的分离、鉴定及酶学性质研究[J].中国酿造,2021,40(6):92-96.
[3]HAILE S, AYELE A.Pectinase from microorganisms and its industrial applications[J].Sci World J,2022,2022:1-15.
[4]罗雯,徐珂盼,王怡,等.果胶酶生产菌株的筛选、发酵优化及其酶学性质研究[J].食品科技,2022,47(4):6-13.
[5]SHARMA N,RATHORE M,SHARMA M.Microbial pectinase:Sources,characterization and applications[J].Rev Environ Sci Biot,2013,12(5):45-60.
[6]JALIL M T M,IBRAHIM D.Partial purification and characterisation of pectinase produced by Aspergillus niger LFP-1 grown on pomelo peels as a substrate[J].Tropical Life Sci Res,2021,32(1):1-22.
[7]何海燕,何丽妃,罗艳妹,等.沙福芽孢杆菌g7-7碱性果胶酶纯化及酶学性质研究[J].饲料研究,2021,44(9):80-83.
[8]MOHARRAM A M, ZOHRI A A, HESHAM A E, et al.Production of cold-active pectinases by three novel Cladosporium species isolated from egypt and application of the most active enzyme[J].Sci Rep,2022,12(1):15599.
[9]THITE V S, NERURKAR A S, BAXI N N.Optimization of concurrent production of xylanolytic and pectinolytic enzymes by Bacillus safensis m35 and Bacillus altitudinis j208 using agro-industrial biomass through response surface methodology[J].Sci Rep,2020,10(1):3824.
[10]池彬彬,倪莹,陈慧英,等.1株产果胶酶中度嗜盐菌(Aspergillus aculeatus glut-01)的鉴定及产酶条件优化[J].江苏农业科学,2022,50(2):239-246.
[11]罗凤香,刘海燕,周衡书,等.复合酶降低苎麻机织物刺痒感工艺研究[J].湖南工程学院学报(自然科学版),2022,32(2):77-82.
[12]焦伟航,金海燕,李闯,等.工业大麻纤维复合酶脱胶工艺研究[J].毛纺科技,2022,50(1):57-61.
[13]陈嘉川,贾倩倩,李凤凤,等.生物酶在制浆造纸过程中的应用及研究进展[J].中华纸业,2021,42(12):9-16.
[14]ZHANG G,LI S G,XU Y B,et al.Production of alkaline pectinase: A case study investigating the use of tobacco stalk with the newly isolated strain Bacillus tequilensis CAS-MEI-2-33[J].BMC Biotechnol, 2019,19(1):45.
[15]朱虹溪,姚启禛,胡春秀,等.产酸性果胶酶菌株的筛选及固体发酵工艺条件和酶水解特性的研究[J].轻工科技,2019,35(9):4-7.
[16]ALQAHTANI Y S,MORE S S,KEERTHANAR,et al.Production and purification of pectinase from Bacillus subtilis 15a-b92 and its biotechnological applications[J].Molecules,2022,27(13):4195.
[17]HAILE S, MASI C, TAFESSE M.Isolation and characterization of pectinase-producing bacteria (Serratiamarcescens) from avocado peel waste for juice clarification[J].BMC Microbiol,2022,22(1):145.
[18]陈佳月,樊武厚,田睿,等.苎麻纤维的碱性复合生物酶脱胶工艺研究[J].纺织科技进展,2021,240(1):9-12.
[19]HASAN R, AKTAR N, KABIR SMT, et al.Pectinolytic bacterial consortia reduce jute retting period and improve fibre quality[J].Sci Rep,2020,10(1):5174.
[20]冯湘沅,成莉凤,曾洁,等.DCE01菌株大麻韧皮脱胶过程中有机酸的变化规律[J].中国麻业科学,2017,39(4):183-188.
[21]RAHMAN M S,CHOI Y S,KIM Y K,et al.Production of novel polygalacturonase from Bacillus paralicheniformis CBS32 and application to depolymerization of ramie fiber[J].Polymers,2019,11(9):1525.
[22]刘嘉乐,孙宇峰,王伟东.汉麻生物脱胶技术研究进展[J].中国麻业科学,2021,43(2):97-103.
[23]杨琦,成莉凤,冯湘沅,等.近三年麻纤维生物脱胶技术研究进展[J].中国麻业科学,2022,44(4):245-252.
[24]王楚元,段旬妍,余圆圆,等.苎麻的果胶酶/木聚糖酶复合生物酶脱胶[J].印染,2023,49(3):9-12,41.
[25]王慧慧,张非,舒潼,等.两株芽孢杆菌在苎麻纤维复合脱胶中的应用[J].微生物学通报,2021,48(8):2512-2523.