氨基甲酸乙酯(ethyl carbamate,EC),又名尿烷、胺甲酸乙酯等,是由氨基甲酸形成的一种酯类化合物,是一种在食品发酵过程中自然产生的副产物,常见于酸奶、乳酪、酱油和各种酒类中[1]。早在1943年,Nettleship就证实了氨基甲酸乙酯会导致皮肤癌、淋巴癌和肝癌等疾病,是一种多位点致癌物[2],尤其在酒精存在时,其致癌的风险将会进一步增加[3]。1987年,国际癌症研究机构(international agency for research on cancer,IARC)将氨基甲酸乙酯列为2B类致癌物。2007年,该机构重新对氨基甲酸乙酯的危害性进行评估,并将其归为2A类致癌物[4],足见其对人体的危害性。食品添加剂法规委员会(Codex Committee on Food Additive,CCFA)研究指出[5],饮用酒精饮料是人体摄入EC的主要方式之一。
白酒作为我国特有的蒸馏酒,具有非常大的消费市场,数据显示,在2022年全国酿酒产业销售额占比中,白酒占比77%,销售额更是惊人的达到了6 626.5亿元[6]。随着消费市场的不断升级以及消费者对食品安全、饮酒健康危害意识的不断提高,消费者也越来越注重白酒的品质,白酒中EC对人类健康产生的负面影响成为一个不可忽略的问题,同时也是阻碍和制约白酒行业健康发展和国际化进程的一个重要因素。本文从EC的生成与毒性机制、影响因素、检测方法、白酒中EC含量现状、国际标准以及控制策略方面出发并结合中国白酒的实际情况进行系统综述,以期为白酒生产企业在生产过程中控制进行理论指导,同时为白酒从业者更加科学认识EC提供参考。
1 氨基甲酸乙酯的生成与毒性机制
1.1 氨基甲酸乙酯的前体物质与生成反应
在酒精饮料中有5种前体物质可以与乙醇反应生成EC,它们分别是尿素、氨甲酰磷酸、瓜氨酸、焦碳酸二乙酯、氰化物,而在白酒酿造过程中主要是由尿素、瓜氨酸和氰化物与乙醇反应生成[7]。
1.1.1 尿素与乙醇反应生成氨基甲酸乙酯
白酒酿造过程中EC的生成与尿素的存在密切关联。尿素与乙醇的化学反应式如下:H2NCONH2+C2H5OH→H2NCO2C2H5+NH3。尿素的来源主要有两方面,一方面是农业活动中的氮肥使用,在原料的种植过程中施用的氮肥(尿素)在原料中逐渐积累,或者在添加其他发酵辅料时引入尿素[8-9];另一方面是酵母细胞的生物合成过程,在发酵过程中酵母细胞通过自身代谢途径将某些氨基酸(如精氨酸)转化为尿素[10]。在细胞中尿素的生成和转运途径如图1所示[11]。通常,酵母细胞会利用尿素水解酶将尿素分解成二氧化碳和氨[12],然而在发酵介质中如果存在酵母更偏好的氮源,尿素水解酶的活性会受到抑制,这是因为酵母细胞在氮源选择上受到氮代谢物阻遏效应(nitrogen catabolite repression,NCR)的调控,优先消耗更优质的氮源[13],这种调控机制导致细胞内产生的尿素不能被及时分解,而是通过尿素渗透酶的作用被输送到细胞外的发酵液中[14],进而与乙醇反应形成EC。
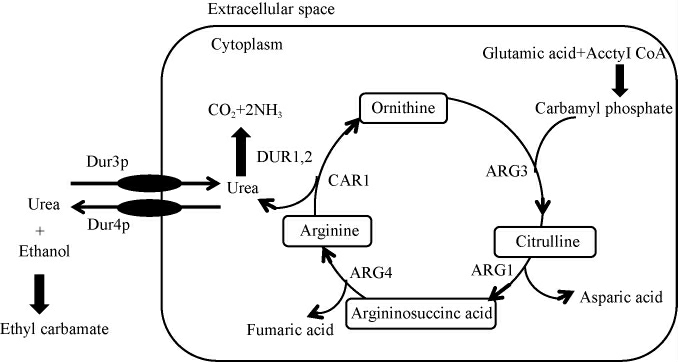
图1 尿素生成和转运途径
Fig.1 Urea production and transport pathways
1.1.2 氰化物与乙醇反应生成氨基甲酸乙酯
在蒸馏酒的生产中,尤其是威士忌和中国白酒,氰化物与乙醇反应生成EC的过程已得到确认[15-16]。氰化物存在多种形式,如氰酸、氢氰酸和含氰基的化合物等,这些化合物均可与乙醇生成EC[4]。氰化物的来源主要是两个方面,一是由发酵原料中的生氰糖苷分解产生[17],这种物质在全球约2 000种植物中存在,通过酶解或酸解变为氰醇,然后进一步在热或碱性条件下生成氰化物[18];二是在酒的发酵与蒸馏过程中,尿素分解产生氰化物。有研究表明,不同类型的高粱在白酒酿造中对氰苷的含量有影响,其中糯高粱含量较低[19]。EC在蒸馏过程中不易挥发,但其前体氰酸和氢氰酸易挥发,可能在气相状态与乙醇反应形成EC。有实验研究显示,白酒蒸馏时EC的浓度会呈现先增后减再增的变化规律,前期的增加可能是由于发酵产生的EC被蒸汽带出,而后期的增加则可能是由于氰化物与乙醇的反应[20-21]。
1.1.3 瓜氨酸与乙醇反应生成氨基甲酸乙酯
近年来,有研究者提出在白酒发酵过程中瓜氨酸与乙醇反应可以生成EC,这是因为在发酵后期,微生物会进行苹果酸-乳酸发酵(malo-lactic fermentation,MLF),在苹果酸-乳酸菌发酵过程中乳酸菌主要是对糟醅中剩余的精氨酸进行发酵降解产生瓜氨酸[22]。在白酒的酿造过程中,由瓜氨酸与乙醇反应生成的EC含量较低,但是有研究者在对浓香型白酒主要的酿酒原料研究时发现高粱中瓜氨酸的含量较高,为82.5 mg/kg,大约是其余所测定酿酒原料(大米、糯米、玉米、小麦)的2倍[23]。张庄英[24]在对白酒贮存过程中生成EC的主要前体的验证实验结果表明,白酒贮存过程中生成EC的主要前体物质是氰化物,瓜氨酸与EC的生成也有一定的关系。
1.1.4 其他物质与乙醇反应生成氨基甲酸乙酯
在饮料酒中,氨甲酰磷酸、焦碳酸二乙酯等也可以与乙醇反应生成EC。OUGH C S[25]于20世纪70年代初期证明,氨甲酰磷酸和乙醇反应形成EC,但在饮料酒中由于其与乙醇反应生成EC的含量较低,因此不作为主要的研究对象。焦炭酸二乙酯最早是添加在葡萄酒中,用来杀死细菌和酵母细胞而广泛使用,后由研究者发现其可以与乙醇反应生成具有致癌作用的EC[26],因此在后来的葡萄酒生产中被禁止使用。
1.2 氨基甲酸乙酯的毒性机制与风险评估
自EC在1943年被识别为可能致癌物以来[27],学术界对其健康影响的研究不断深入。研究揭示,EC在体内主要通过细胞色素P450系列的作用代谢[28-30],影响其毒性的表现。EC的代谢途径分为三种:①是排泄途径:约5%的EC通过尿液和粪便排出体外。剩余的绝大多数通过肝脏的酯酶分解为无毒的乙酸、氨和其他分解产物[11];②是氧化途径:接近0.5%的EC经细胞色素P450氧化,转化为若干中间代谢物,这些代谢物可进一步转化为环氧乙烯基甲酸甲酯。该环氧化物有能力与脱氧核糖核酸(deoxyribonucleic acid,DNA)结合,导致DNA双链损伤,从而增加癌症的风险[31];③是次要代谢途径:极小量的EC也可能通过P450转化为N-羟基氨基-甲酸乙酯,这种物质会引发与Cu2+相关的DNA损伤,影响特定碱基,诱发基因突变或缺失[32]。
啮齿类动物实验证实了EC的致癌性[33],表明EC摄入量与内脏肿瘤风险增加相关。人类风险评估表明,EC的摄入浓度超过30 μg/L可能显著增加癌症风险[34]。虽然食品添加剂联合专家委员会(Joint Expert Committee for Food Ad ditives,JECFA)2005年的安全评估认为日常摄入量低于安全阈值,但该评估未包括酒精饮料中的EC。进一步研究建议,每日摄入20~80 ng/(kg·bw·d)的EC范围被认为相对安全,假设人的终身癌症风险为10-6[35]。然而,在饮酒人群中,EC的健康风险依旧引起关注[36]。
2 氨基甲酸乙酯生成的影响因素
2.1 酿酒原料
产品质量受原料品质的直接影响,尤其是在白酒生产中,原料的产地和种类差异会导致最终产品中EC含量的变化。这一现象主要与原料中瓜氨酸、氰化物和尿素等EC前体物质的含量有关。研究显示,不同的高粱原料在固态发酵过程中对EC生成的贡献各异,通过挑选低前体含量的高粱品种,可以有效减少白酒中EC的生成[37]。例如,仇钰莹[23]研究指出,与其他原料相比,高粱中的瓜氨酸含量较高,约为其他原料的两倍。周韩玲等[38]研究发现,高粱中蜀黍氰苷的含量与其分解产生的氰化物量成正比,而这些氰化物是浓香型白酒中EC的主要前体物。实验结果表明,浓香型白酒中的EC主要在储存过程中形成。因此,从生产角度出发,使用低蜀黍氰苷含量的高粱作为原料,能显著减少白酒中的EC含量。
2.2 发酵条件
在白酒发酵过程中,EC的生成受多种因素影响,包括原料中的前体成分、发酵的温度和pH值、添加的营养物质以及发酵使用的微生物种类[39-40]。低温下发酵的初始阶段,EC生成较缓慢,而随着发酵进程中温度的提升,EC的形成速度会增加。研究指出,发酵温度每上升10 ℃,EC形成的速率可翻倍[21]。此外,ARENA M E等[41]研究发现,不同的pH值会影响精氨酸和瓜氨酸的代谢,这也间接影响了EC的生成。
2.3 贮存条件
白酒在蒸馏完成后都需要进行贮存一定的时间后方可进行勾兑出售,而且我国素来都有“酒越陈越香”的说法,白酒在贮存过程中,其贮存条件的好坏也影响着酒体中EC含量。研究发现,白酒在储存初期并不会立即产生大量的EC,但是EC的水平会随着储存条件和时间的推移而变化[42]。贮存期间,EC浓度受温度和氧气接触量等因素的影响,温度越高,EC的浓度越可能增加。具体来说,在30 ℃的条件下储存的白酒,其EC含量可能是15 ℃时的1.5~2.0倍[43]。王金龙等[44]使用超高效液相色谱和高分辨质谱技术研究了EC在不同储存条件下的变化,结果显示,在20 ℃或更低温度下,以及避光条件下使用陶瓷容器储存,有助于降低EC的含量。
3 EC的检测方法
3.1 液态白酒样品中氨基甲酸乙酯的检测方法
准确定量白酒中EC含量是开展研究的前提,如何高效准确的检测白酒中EC的含量成为研究者们不断探索的目标。目前,在白酒行业中检测EC的方法中应用较多是气相色谱-质谱法(gas chromatography-mass spectrometry,GCMS)和高效液相色谱法(high performance liquid chromatography,HPLC),如表1所示[45]。
表1 白酒中氨基甲酸乙酯的不同检测方法比较
Table 1 Comparison of different detection methods of ethyl carbamate in Baijiu

检测方法 预处理 优点 缺点 检测限/(μg·L-1)GC-MS GC-MS GC-MS HPLC-FLD液液萃取固相萃取顶空固相微萃取衍生化成本低,回收率高步骤简化,溶剂用量少自动化高,无需有机溶剂预处理简单,操作方便过程较繁琐,有机溶剂毒性大自动化较低稳定性差衍生条件不易把控1.0~1.2 1.0~1.2 1.0~1.2 4.2
在酒类中检测EC的常用技术是气相色谱-质谱联用(GC-MS),广泛应用于行业标准和政府监管。样品的前处理对检测至关重要,它直接影响分析的成本、效率和可操作性。目前,用于检测酒精饮料中微量成分的常见样本处理方法包括液-液提取、固相提取和固相微提取等。中国目前对于出口酒的EC残留检测所采用的前处理技术是液-液提取法,但这种方法操作繁琐、耗时且重现性较低,不适合快速和大规模检测[46]。而在检测酒精饮料中的EC方面,有研究者也采用高效液相色谱法(HPLC)。如高年发等[47]通过HPLC-荧光检测器(fluorescence detector,FLD)技术检测白兰地中的EC,方法是将500 μL的样品与100 μL的9-羟基吨溶液和50 μL的1.5 mol/L HCl混合,在黑暗中反应生成荧光物质,以234 nm波长激发、600 nm波长检测,反应时间5 min。该方法的日内相对标准偏差(relative standard deviation,RSD)为0.37%,日间RSD为3.06%,回收率在93.0%至107%之间。与GC-MS相比,HPLC方法更为简便、快速且经济,适合于白酒中EC含量的测定。
3.2 固态酒醅中氨基甲酸乙酯的检测方法
白酒发酵相关的固态酒醅检测方法研究相对较少,为深入探究EC形成机理及白酒中EC有效控制技术,研究酒醅中EC有效检测方法具有重大意义。由于酒醅基质复杂,在对酒醅中EC检测时所采用的前处理方法是影响检测准确性的关键因素。常瑞红等[48]在用气相色谱-质谱联用法检测酒醅中氨基甲酸乙酯的方法研究时以乙醇溶液为萃取剂,经活性炭净化后直接进样的方式建立酒醅中EC检测方法,该方法准确快速、操作简便且适宜生产企业对酒醅的检测方法。梁晨[49]用水作为提取溶剂,加EC-D5内标和NaCl后经超声溶解,再经离心后提取上清液,经硅藻土柱吸附、除杂、洗脱、氮吹后用GC-MS检测。曾婷婷等[50]用二氯甲烷作为提取酒醅中的EC,再用乙腈和正己烷进行涡旋后离心,将正己烷弃之并重复一次,在乙腈相中加入0.05 g N-丙基-乙二胺(primary secondary amine,PSA)填料,涡旋混匀1 min,过0.45 μm有机相滤膜,待测,结果显示该处理方法也满足实验要求。范文来等[51]在研究酒糟发酵过程中氨基甲酸乙酯和尿素的关系时,采用了超声波辅助萃取和顶空固相微萃取(headspace solid phase microextraction,HS-SPME)技术来测定酒糟中的EC含量。
4 白酒中氨基甲酸乙酯含量现状及标准
基于饮料酒中EC对人们的危害性,2002年联合国粮农组织对EC在食品当中做了限量标准,其含量不得超过20 μg/L[52]。该限量值是对各类食品的笼统规定,缺乏针对性。因此世界各国对饮料酒中的EC含量进行了监测,首先对饮料酒中EC含量作出限量标准的是加拿大政府,随后其他欧美国家也制定了饮料酒中EC的最高限定标准,如表2所示[53]。
表2 不同国家和组织对酒精饮料中氨基甲酸乙酯含量的限定
Table 2 Limits of ethyl carbamate contents in alcoholic beverages in different countries and organizations
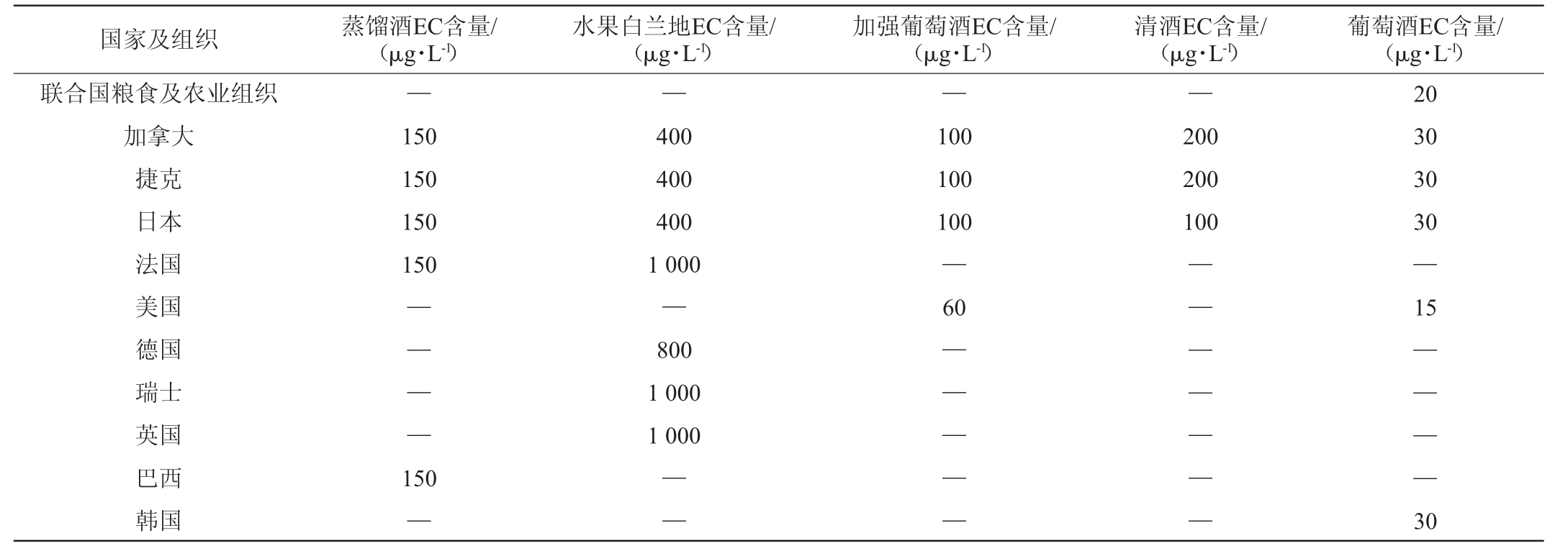
注:“—”表示目前为止没有规定。
国家及组织 蒸馏酒EC含量/(μg·L-1)水果白兰地EC含量/(μg·L-1)加强葡萄酒EC含量/(μg·L-1)清酒EC含量/(μg·L-1)葡萄酒EC含量/(μg·L-1)联合国粮食及农业组织加拿大捷克日本法国美国德国瑞士英国巴西韩国——150 150 150 150——400 400 400 1 000—800 1 000 1 000 150—————100 100 100—60 200 200 100 20 30 30 30—15——————30
对白酒中EC含量和不同香型白酒中EC含量进行了调查,结果如表3所示。我国白酒中EC含量检出率较高,虽然大部分低于国际上蒸馏酒中EC的限量标准,但我国也有不少白酒中EC含量高于国际标准,对消费者潜在的危害性较高[54]。范文来等[55]探究了不同香型的白酒中氨基甲酸乙酯(EC)的水平,发现EC的平均质量浓度在44.48~214 μg/L之间。其中,清香型、酱香型、药香型和特香型的白酒显示出较低的EC含量,而浓香型、芝麻香型、凤香型等则含量较多。姚晓洁等[56]检测了河南省不同地市1 882批次白酒中的EC,检出率为52.3%,最高质量浓度为1 680 μg/L,平均值为49.9 μg/L。其中有7.6%的样品超过了国际上通用的蒸馏酒中EC的限量标准,即150 μg/L。他们也分析了不同香型白酒的EC含量,发现酱香型、董香型、陶香型、凤香型和浓香型的含量普遍较高。尽管中国是白酒消费大国,但国内尚未对白酒中的EC含量设定具体限量标准,只是在20世纪末对出口酒的EC含量设立了统一标准。国内的EC检测主要参考的是GB 5009.223—2014《食品安全国家标准食品中氨基甲酸乙酯的测定》。随着中国人民生活水平的提升和酒饮料消费量的增长,制定EC的限量标准变得越来越迫切。
表3 国内外部分饮料酒中氨基甲酸乙酯的污染水平
Table 3 Pollution levels of ethyl carbamate in some domestic and foreign alcoholic beverages
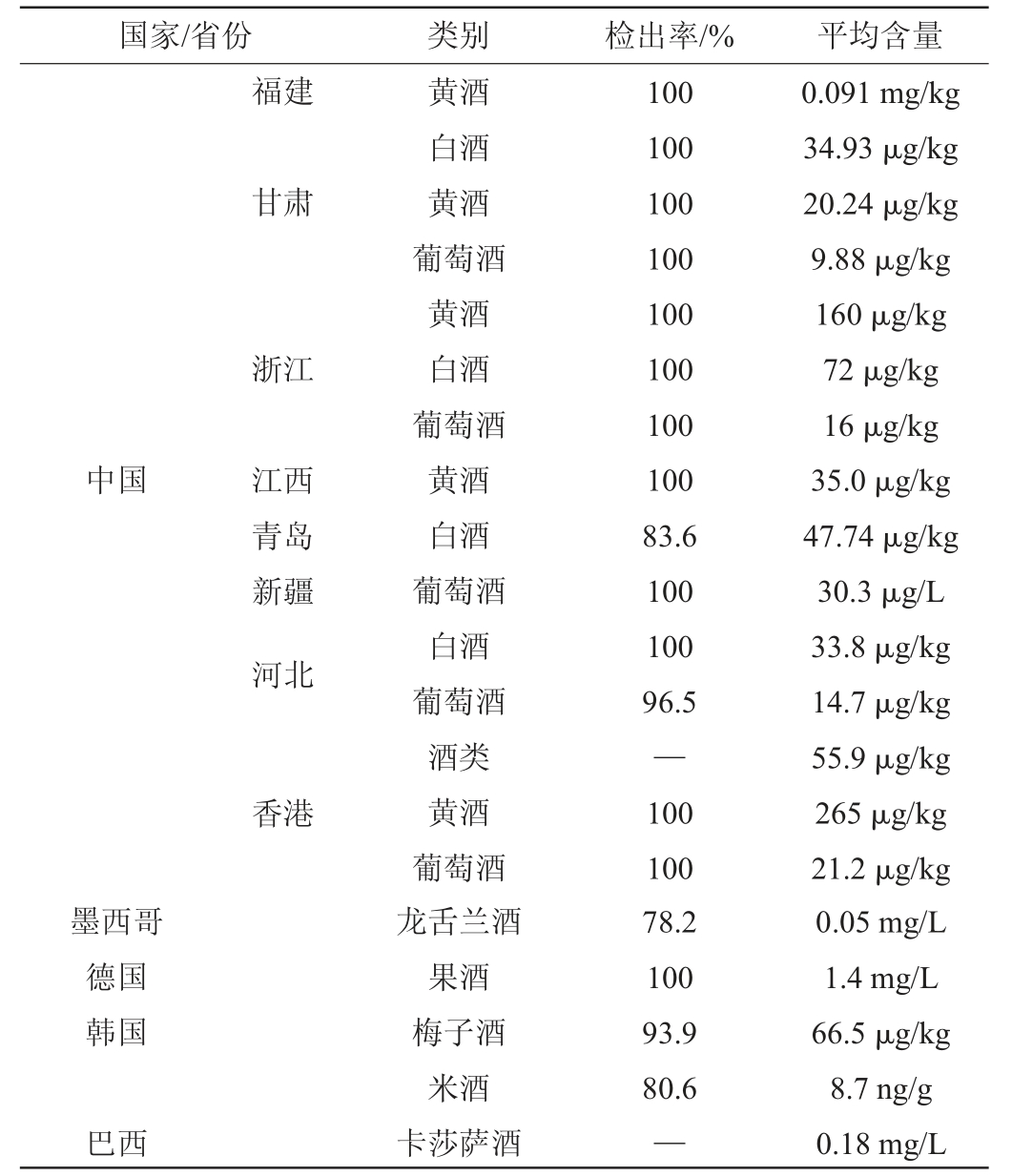
注:“—”表示文献未涉及。
国家/省份 类别 检出率/% 平均含量福建甘肃浙江中国 江西青岛新疆河北香港墨西哥德国韩国巴西黄酒白酒黄酒葡萄酒黄酒白酒葡萄酒黄酒白酒葡萄酒白酒葡萄酒酒类黄酒葡萄酒龙舌兰酒果酒梅子酒米酒卡莎萨酒100 100 100 100 100 100 100 100 83.6 100 100 96.5—100 100 78.2 100 93.9 80.6—0.091 mg/kg 34.93 μg/kg 20.24 μg/kg 9.88 μg/kg 160 μg/kg 72 μg/kg 16 μg/kg 35.0 μg/kg 47.74 μg/kg 30.3 μg/L 33.8 μg/kg 14.7 μg/kg 55.9 μg/kg 265 μg/kg 21.2 μg/kg 0.05 mg/L 1.4 mg/L 66.5 μg/kg 8.7 ng/g 0.18 mg/L
5 氨基甲酸乙酯的生成调控
5.1 优化生产工艺
尿素作为生成EC的主要前体物质,应首先优选酿酒原料,控制酿酒原料中尿素的带入。研究表明不同产区的不同品种的酿酒原料对EC的生成有所不同[37],而且对酿酒原料的精加工可以降低尿素的含量,从而降低EC的生成,因此,挑选对EC生成较低的酿酒原料对其再进一步的洗涤、粉碎等精加工处理[57]。另外,作为生成EC的另一个主要前体物质氰化物,可以通过减少光照、缩短贮藏时间、降低加工和贮存的温度等条件的优化来减少EC的生成[58]。国外在对降低蒸馏酒中EC含量所采用的方法是进行二次或多次的蒸馏来降低EC的含量,而作为我国传统的蒸馏酒白酒都是采用一次蒸馏的方式。有研究者对我国白酒进行二次蒸馏实验表明,二次蒸馏虽然可以有效的降低酒体中EC含量,但会降低酒体中的香味,影响白酒的品质[59]。
5.2 筛选优良菌种
在发酵过程中酿酒酵母产生尿素和瓜氨酸主要是代谢精氨酸,而精氨酸酶作为形成尿素的一个关键酶,主要由精氨酸酶的编码基因CAR1编码[9],且不同的酿酒酵母产尿素的能力也不相同,从而导致EC含量不同,基于酿酒酵母对尿素代谢的充分了解,利用基因工程技术改造酿酒酵母,减少尿素的生成。吴殿辉[60]研究发现,黄酒酿造中使用的酵母通过CAR1基因的作用能够分解精氨酸产生尿素,进而导致氨基甲酸乙酯(EC)含量升高。为了减少EC的生成,研究者尝试通过敲除酵母的CAR1基因来减少尿素的产生;赵然然[61]通过同源重组技术成功敲除了酵母的CAR1基因,创造出了低尿素产生的酵母工程菌,这种菌在发酵后的酒液中EC含量减少了大约38%。然而,这种方法主要适用于单一酵母菌种的发酵过程,而不适合中国白酒多菌种混合发酵的情况,因此,对单一菌种的改造并不能有效控制EC及其前体物质的积累;CUI K X等[62]研究发现,使用球形赖氨酸芽孢杆菌(Lysinibacillus sphaericus)MT33在白酒发酵过程中可以降低尿素和EC的含量,具体来说,尿素和EC含量分别降低了28.15%和41.77%,而EC的浓度在白酒中降低了63.32%;WANG C等[63]通过对大曲中分离出的酿酒酵母进行一系列胁迫实验,发现在特定条件下,可以通过调节精氨酸酶和尿素羧化酶的转录水平来降低精氨酸的消耗和尿素的产生,从而减少EC的含量,这为控制白酒中EC含量提供了新的策略。这些研究表明,通过基因工程技术改造酵母菌,降低发酵过程中尿素及其他前体物质的生成,对于控制白酒中EC含量和提升食品安全性有着重要意义。
5.3 添加酶类降解
酶法降解酒体中的EC主要是通过添加酸性脲酶降解在发酵过程中的尿素,将尿素分解为CO2、水和NH3。目前,此方法多应用于黄酒等发酵酒的尿素分解,在白酒中的应用较少。研究表明,通过混合使用产脲酶的微生物或其提取的粗酶液与酒糟,可以减少发酵过程中尿素的浓度,进而有效抑制氨基甲酸乙酯(EC)的形成[64]。方芳等[65]研究发现,在酒糟中引入罗伊氏乳杆菌(Lactobacillus reuteri)或其粗酶液能显著降低尿素水平,这种处理能够减少最终酒中EC含量高达39.1%。这些方法为控制和减少白酒中EC含量提供了有效途径。白酒的发酵方式、发酵体系与黄酒等发酵酒类都有着较大的不同,因此,对于脲酶在白酒中的应用还需要进一步的探究。另外,酸性脲酶作为一种金属酶类,金属的残留会影响白酒的安全性,还需进一步研究,且脲酶价格昂贵,目前我国脲酶严重依赖进口,国内没有完整的生产体系。
6 氨基甲酸乙酯的定向去除
白酒中EC的定向去除有狭义和广义之分,狭义定向去除是指针对白酒中EC具有严格的特异性去除功能,对白酒中其他风味物质成分几乎不产生影响;而广义定向去除则是指针对白酒中EC具有较强的特异性去除功能,能够去除酒中绝大部分的EC,同时对酒中风味物质产生少许影响。根据定向去除原理可分为物理方法和生物化学方法。
6.1 物理方法
运用物理吸附或者吸附加过滤技术定向去除酒体中的EC也是一种有效且常见的方法,常见的吸附介质有活性炭、硅胶、硅藻土、壳聚糖和聚乙烯吡咯烷酮等,在酒类饮料中,应用范围最广泛的吸附介质为硅藻土和活性炭。曹甜等[66-67]研究发现,利用碱对硅藻土进行改性,研究其对黄酒中EC的吸附性能,结果表明,经过碱处理后的硅藻土对黄酒中EC的去除率较高,且处理后的酒体风味与原酒相差很小。徐岩[68]首次采用苯乙烯基大孔树脂,建立了柱式连续吸附减除黄酒中高浓度EC的技术方案,利用自行设计试制的500 L级柱式连续吸附中试装置,对EC含量在1 000 μg/L以上的5 t陈年黄酒基酒样品进行应用试验,发现样品中的EC浓度降低超过了50%。有研究者用活性炭吸附白酒中的EC,由于活性炭吸附剂对EC的吸附均为非特征吸附,白酒中的微量风味成分会与EC一起被吸附掉,对白酒品质产生影响较大[3]。由于黄酒对风味的要求不高,因此,对酒中EC的去除应用也较多,而白酒对风味要求较高,且风味的损失对白酒的品质影响较大,用物理的方法来定向去除白酒中EC的含量研究将是未来重点研究的方向。
6.2 生物化学方法
除上述控制措施外,在酒体中添加只针对EC降解的酶类可以对酒体中的EC进行直接降解去除。此方法不仅可以不受生成EC前体物的限制,而且也不受生产工艺的影响,用该方法降低酒体中EC的含量是未来降低酒体中EC含量的热点研究方向。在酒体中添加EC水解酶可以直接将EC水解成氨、乙醇和二氧化碳。随后,研究人员从青霉菌、柠檬酸杆菌、红酵母菌等菌株中不断分离出了EC降解酶[69-71]。陈启和等[72]利用酒酒球菌(Oenococcus oeni)产生EC水解酶的特性,将其应用到黄酒发酵过程中,结果显示酒酒球菌可以有效降解黄酒在发酵过程中产生EC的含量;李京京等[70]纯化了赖氨酸芽孢杆菌(Lysinibacillus fusiformis)中产生的EC水解酶,获得的纯酶可耐受高浓度的酒精。刘晓慧[73]通过对微生物产生的EC水解酶的筛选实验,获得了可以适应工业应用条件的EC水解酶,其对酸、乙醇和底物亲和力等方面都有较高的耐受性。目前,针对EC水解酶类的研究表明,利用天然微生物代谢获得的EC水解酶的酶活力整体偏低,水解EC的效果也因酒种类的不同而具有较大的差异性。白酒普遍具有高酸、高乙醇含量的特点,这不仅要求EC水解酶的酶活力需要达标之外,而且对其耐酸性和耐乙醇性也有较高要求,因此EC水解酶在白酒中的应用目前仍需要进一步的探索。
7 总结与展望
随着白酒在全球市场的日益火热,我国作为白酒的生产大国,进一步明确在白酒中EC的形成原因、机理以及控制措施,制定白酒中EC的限量标准就变得至关重要,利用必要的技术手段和安全指标为消费者提供健康安全的酒类产品,对于推动我国白酒行业健康发展有着重要的意义。另一方面,对酒体中的EC含量进行定向去除的研究,逐步完善白酒中对EC的风险评估方式,并通过研究EC和其他有害物质间的相互作用,进行较为科学可信的风险评估,从而是我国白酒产品在能带给广大消费者饮用安全的同时也能使享用者更加深体会白酒的价值内涵,从而推动白酒行业更良好的可持续发展。
[1]洪冰,胡婷婷,郑婷婷,等.氨基甲酸乙酯的研究进展[J].农产品加工,2018(19):65-68.
[2]范文来,徐岩.白酒功能因子与品质安全问题[J].酿酒科技,2012(3):17-22.
[3]PARK S R,HA S D,YOON J H,et al.Exposure to ethyl carbamate in alcohol-drinking and nondrinking adults and its reduction by simple charcoal filtration[J].Food Control,2009,20(10):946-952.
[4]王欢,胡峰,胡建锋,等.白酒中氨基甲酸乙酯的研究进展[J].酿酒科技,2014(9):88-91,95.
[5]World Health Organization.Joint FAO/WHO food standards programme codex committee on methods of analysis and sampling[R].Budapest:WHO,2014.
[6]筱鹂.2022中国酒业数据出炉[J].酿酒科技,2023(4):104.
[7]李加友,陆筑凤,吴丹,等.发酵食品中氨基甲酸乙酯的形成与控制[J].食品科技,2013,38(6):310-312.
[8]方若思.传统黄酒发酵中氨基甲酸乙酯产生的代谢规律及抑制方法研究[D].杭州:浙江大学,2017.
[9]焦志华.氮代谢调控因子Dal80p对黄酒酿造中氨基甲酸乙酯形成的影响[D].杭州:浙江大学,2017.
[10]刘洋,李运奎,韩富亮,等.葡萄酒中氨基甲酸乙酯的研究进展[J].食品科学,2019,40(7):289-295.
[11]林宜锦,欧梦莹,关统伟,等.酿造酒中氨基甲酸乙酯的研究进展[J].食品工业科技,2019,40(11):358-364.
[12]WEBER J V, SHARYPOV V I.Climate change, intercropping, pest control and beneficial microorganisms[M].Netherlands:Springer,2009:429-452.
[13]胡竞进.基于比较转录组学和ChIP-Seq研究转录因子Dal80p在酿酒酵母氮代谢中的调控功能[D].杭州:浙江大学,2022.
[14]赵鑫锐.代谢工程改造酿酒酵母降低黄酒中的氨基甲酸乙酯[D].无锡:江南大学,2014.
[15]NOBREGA I C C,PEREIRA J A P,PAIVA J E,et al.Ethyl carbamate in pot still cachaas(Brazilian sugar cane spirits):Influence of distillation and storage conditions[J].Food Chem,2009,117(4):693-697.
[16]BRUNO S N F,VAITSMAN D S,KUNIGAMI C N,et al.Influence of the distillation processes from Rio de Janeiro in the ethyl carbamate formation in Brazilian sugar cane spirits[J].Food Chem,2007,104(4):1345-1352.
[17]KOH E,KWON H.Quantification of ethyl carbamate in soy sauce consumed in Korea and estimated daily intakes by age[J].J Sci Food Agr,2007,87(1):98-102.
[18]HAQUE M R,BRADBURY J H.Total cyanide determination of plants and foods using the picrate and acid hydrolysis methods[J].Food Chem,2002,77(1):107-114.
[19]张顺荣.白酒中氨基甲酸乙酯形成的氰化物途径研究[D].无锡:江南大学,2017.
[20]王博,齐晶瑶.发酵酒中氨基甲酸乙酯的研究进展[J].生物信息学,2014,12(4):269-275.
[21]许宏贤,段钢.酒中氨基甲酸乙酯及尿素的研究进展[J].酿酒科技,2012(6):92-95.
[22]焦志华,陈启和.发酵酒精饮品中氨基甲酸乙酯前体物的代谢调控机制研究进展[J].食品科学,2016,37(23):260-266.
[23]仇钰莹.浓香型白酒中氨基甲酸乙酯形成途径解析[D].无锡:江南大学,2017.
[24]张庄英.白酒蒸馏和贮存过程中氨基甲酸乙酯的研究[D].无锡:江南大学,2014.
[25]OUGH C S.Ethyl carbamate in fermented beverages and foods.Ⅱ.Possible formation of ethyl carbamate from diethyl dicarbonate addtion to wine[J].J Agr Food Chem,1976,24(2):328-331.
[26]张伟平,赵鑫锐,堵国成,等.酿酒酵母氮代谢物阻遏效应及其对发酵食品安全的影响[J].应用与环境生物学报,2012,18(5):862-872.
[27]ZHAO X R,DU G C,ZOU H J,et al.Progress in preventing the accumulation of ethyl carbamate in alcoholic beverages[J].Trends Food Sci Technol,2013,32(2):97-107.
[28]CHEN Y,ZENG W Z,FANG F,et al.Elimination of ethyl carbamate in fermented foods[J].Food Biosci,2022,47:101725.
[29]RENDIC S.Summary of information on human CYP enzymes: human P450 metabolism data[J].Drug Metab Rev,2002,34(1-2):83-448.
[30]CHA S W,GU H K,LEE K P,et al.Immunotoxicity of ethyl carbamate in female BALB/c mice:role of esterase and cytochrome P450[J].Toxicol Lett,2000,115(3):173-181.
[31]JUNG S,KIM S,KIM I,et al.Risk assessment of ethyl carbamate in alcoholic beverages in Korea using the margin of exposure approach and cancer risk assessment[J].Food Control,2021,124:107867.
[32]SAKANO K, OIKAWA S, HIRAKU Y, et al.Metabolism of carcinogenic urethane to nitric oxide is involved in oxidative DNA damage[J].Free Radic Biol Med,2002,33(5):703-714.
[33]BELAND F A,BENSON R W,MELLICK P W,et al.Effect of ethanol on the tumorigenicity of urethane(ethyl carbamate)in B6C3F1 mice[J].Food Chem Toxicol,2005,43(1):1-19.
[34]UTHURRY C A,LEPE J A S,LOMBARDERO J,et al.Ethyl carbamate production by selected yeasts and lactic acid bacteria in red wine[J].Food Chem,2006,94(2):262-270.
[35]LACHENMEIER D W,LIMA M C P,NÓBREGA I C C,et al.Cancer risk assessment of ethyl carbamate in alcoholic beverages from Brazil with special consideration to the spirits cachaça and tiquira[J].BMC Cancer,2010,10:1-15.
[36]周凯,唐冰娥,徐振林,等.发酵食品中氨基甲酸乙酯形成机理和快速检测方法研究进展[J].生物加工过程,2018,16(2):31-41.
[37]曹帅,徐岩.白酒固态发酵过程中不同品种高粱原料对氨基甲酸乙酯形成的影响[J].食品与生物技术学报,2016,35(7):677-683.
[38]周韩玲,安明哲,赵东,等.高粱中蜀黍氰苷与浓香型白酒中氰化物及氨基甲酸乙酯关系的研究[J].中国酿造,2022,41(10):25-29.
[39]BELL S J, HENSCHKE P A.Implications of nitrogen nutrition for grapes,fermentation and wine[J].Aust J Grape Wine Res,2010,11(3):242-295.
[40]ARAQUE I,BORDONS A,REGUANT C.Effect of ethanol and low pH on citrulline and ornithine excretion and arc gene expression by strains of Lactobacillus brevis and Pediococcus pentosaceus[J].Food Microbiol,2013,33(1):107-113.
[41]ARENA M E,DE NADRA M C M.Influence of ethanol and low pH on arginine and citrulline metabolism in lactic acid bacteria from wine[J].Res Microbiol,2005,156(8):858-864.
[42]LARCHER R, MOSER S, MENOLLI A U, et al.Ethyl carbamate formation in sub-optimal wine storage conditions and influence of the yeast starter[J].J Int Des Sci De La Vigne Et Du Vin,2013,47(1):65-68.
[43]XUE J,FU F,LIANG M,et al.Ethyl carbamate production kinetics during wine storage[J].S Afr J Enol Viticult,2015,36(2):277-284.
[44]王金龙,程平言,熊晓通,等.存储环境对浓香型基酒中氨基甲酸乙酯的影响[J].中国酿造,2021,40(7):189-193.
[45]辛茜,贾少杰,郑欣欣,等.白酒中氨基甲酸乙酯的研究进展[J].酿酒科技,2022(1):42-46.
[46]郭学武,李园子,黄世永,等.GC-MS测定白酒中氨基甲酸乙酯的不同预处理方法的比较[J].现代食品科技,2016,32(4):249-253.
[47]高年发,宝菊花,孙晓雯,等.HPLC测定白兰地中的氨基甲酸乙酯[J].中国酿造,2008,27(7):84-87.
[48]常瑞红,刁亚琴,郭亚飞,等.气相色谱-质谱联用法检测酒醅中氨基甲酸乙酯的方法研究[J].酿酒科技,2022(8):131-134.
[49]梁晨.固态白酒发酵中氨基甲酸乙酯变化规律及相关微生物代谢特征研究[D].无锡:江南大学,2016.
[50]曾婷婷,吴生文,林培.特香型酒醅发酵过程中氨基甲酸乙酯和尿素变化规律的研究[J].酿酒,2015,42(6):77-79.
[51]范文来,徐岩,史斌斌.酒醅发酵过程中氨基甲酸乙酯与尿素的变化[J].食品工业科技,2012,33(23):171-174.
[52]梁鑫,张成楠,李秀婷.酶法降解氨基甲酸乙酯及其在白酒中的应用研究进展[J].中国酿造,2023,42(7):1-6.
[53]刘洋,李运奎,韩富亮,等.葡萄酒中氨基甲酸乙酯的研究进展[J].食品科学,2019,40(7):289-295.
[54]陈丽叶.饮料酒中氨基甲酸乙酯的研究进展[J].食品工业,2020,41(8):235-239.
[55]范文来,王栋.近10年我国传统饮料酒白酒和黄酒品质安全研究现状与展望[J].食品安全质量检测学报,2019,10(15):4811-4829.
[56]姚晓洁,谷瑞丽,姬建生,等.白酒中氨基甲酸乙酯含量检测及在不同香型白酒中的含量分析[J].食品安全导刊,2019(18):136-138.
[57]ZHAO X R,ZOU H J,FU J W,et al.Nitrogen regulation involved in the accumulation of urea in Saccharomyces cerevisiae[J].Yeast, 2013, 30(11):437-447.
[58]杨红,刘晓艳.氨基甲酸乙酯的研究进展[J].食品安全导刊,2020(20):80-81.
[59]吴晨岑,范文来,徐岩.不同二次蒸馏方式对浓香型白酒中氨基甲酸乙酯去除率的影响[J].食品与发酵工业,2015,41(6):1-7.
[60]吴殿辉.代谢工程改造黄酒酿造用酵母低产氨基甲酸乙酯的研究[D].无锡:江南大学,2016.
[61]赵然然.通过敲除精氨酸酶基因构建低产尿素黄酒酵母工程菌[D].无锡:江南大学,2012.
[62]CUI K X,WU Q,XU Y.Biodegradation of ethyl carbamate and urea with Lysinibacillus sphaericus MT33 in Chinese liquor fermentation[J].J Agr Food Chem,2018,66(6):1583-1590.
[63]WANG C, ZHANG M P, WANG M.Regulation of ethyl carbamate of Saccharomyces cerevisiae in Chinese Luzhou-flavor liquor fermentation[J].J Biobaesd Mater Bioenergy,2020,14(5):670-675.
[64]孟庆达,周新虎,陈翔,等.白酒酿造过程酒醅中尿素的控制与减少[J].食品与发酵工业,2017,43(8):33-39.
[65]方芳,孟庆达,丁霞,等.一种在白酒生产过程中降低氨基甲酸乙酯前体的方法:CN107177444B[P].2018-07-06.
[66]曹甜,刘晓艳,白卫东,等.广东黄酒中氨基甲酸乙酯的研究进展[J].农产品加工,2018(18):61-63.
[67]曹甜,刘晓艳,白卫东,等.壳聚糖复配硅藻土对客家黄酒中EC的去除[J].食品工业,2019,40(8):201-204.
[68]徐岩.中国黄酒贮存过程中氨基甲酸乙酯生成动力学及其吸附减除技术的应用[R].江苏:江南大学,2017-07-24.
[69]谷晓蕾,田亚平.变幻青霉氨基甲酸乙酯降解酶产酶条件优化及酶的底物特异性[J].食品与生物技术学报,2013,32(6):603-607.
[70]李京京,方芳,张继冉,等.氨基甲酸乙酯水解酶的分离纯化及酶学性质[J].食品与生物技术学报,2014,33(12):1239-1245.
[71]吕思熠,方芳,堵国成,等.氨基甲酸乙酯水解酶在枯草芽孢杆菌中的表达及发酵优化[J].过程工程学报,2014,14(5):846-852.
[72]陈启和,方若思,董亚晨,等.一种利用酒酒球菌降解氨基甲酸乙酯的黄酒酿造方法:CN104845811A[P].2015-08-19.
[73]刘晓慧.氨基甲酸乙酯水解酶的筛选及分子改造[D].无锡:江南大学,2016.