青稞(Hordeum vulgare),是禾本科大麦属的一种一年生的禾谷类作物,也叫做裸大麦、元麦、米大麦[1],主要分布在我国西藏、四川、甘肃、青海等高海拔地区,是我国青藏高原地区最主要的农作物[2-3]。青稞营养价值丰富,富含β-葡聚糖[4-5],具有降血糖、降血脂、降胆固醇、降血压、提高免疫力、抗肿瘤等功效[6-10],可以作为一种很好、很健康的酿酒原料。
威士忌是一种以大麦、黑麦、燕麦、小麦等谷物为原料,浸麦使之发芽后的麦芽经粉碎、浸渍、蒸煮后得到麦芽汁,麦芽汁发酵后进行2次蒸馏,放入橡木桶中陈酿,再经勾兑而成的一种蒸馏酒[11]。目前,由于我国起步较晚,并没有具有本土特色的威士忌品牌,因此,威士忌的市场被国外品牌占据,主要是英国、法国、美国和日本的威士忌品牌[12]。由此可看出,发展具有本土特色的威士忌品牌迫在眉睫。酿造威士忌除了常用的原料外,国内还有用红薯[13]、玉米[14-15]、高粱[16-17]作为酿造威士忌的原料,而用青稞为原料生产威士忌酒鲜有报道。酵母对威士忌的风味和出酒率都有影响,发展本土特色威士忌还离不开酵母的选择,WAYMARK C等[18]选用24种市售活性干酵母探讨不同酵母对麦芽威士忌新酒风味的影响,证实了酵母对新酒中的醇味、水果味、硫味和甜味有贡献,得出酿酒酵母相对于蒸馏酵母和葡萄酒酵母来说更适合酿造威士忌。宋绪磊等[19]选用三种酵母(ACBC-1、ACBC-2、ACBC-3)制备麦芽威士忌,通过比较酵母发酵性能、出酒率等得出菌株ACBC-1更适合酿造麦芽威士忌,但是目前市面上鲜有关于哪种威士忌酵母适于酿造青稞威士忌的相关报道,因此有必要对其进行研究。
该研究以青稞和麦芽为原料,选用3种不同的酵母(M-1、D-53、USW-6)生产青稞威士忌,通过比较酵母的发酵性能、发酵液理化指标、原料出酒率,青稞威士忌的风味物质和感官评价来筛选适于酿造青稞威士忌的酵母,为后续青稞威士忌的生产提供借鉴作用。
1 材料与方法
1.1 材料与试剂
康青8号青稞:四川甘孜市售;蒸馏麦芽、弗曼迪斯威士忌酵母M-1、D-53、USW-6:苏州富勒生物科技有限公司;耐高温淀粉酶AHA-200T(180 000 U/g):安琪酵母股份有限公司;氯化钠(分析纯):国药集团化学试剂有限公司;无水乙醇、乙酸正戊酯(均为色谱纯):Sigma Aldrich(上海)贸易有限公司。
1.2 仪器与设备
全自动啤酒分析仪、DMA35便携式密度计:安东帕中国有限公司;8890/7000D气相色谱-质谱(gas chromatographymass spectrometry,GC-MS)仪:美国安捷伦科技有限公司;顶空固相微萃取(headspace solid-phase microextraction,HSSPME)三相萃取头(DVB/CAR/PDMS):默克投资(中国)有限公司;美式糖度计:布洛德旗舰店;PHS-3E pH计:上海雷磁仪器有限公司;BHC-200生化培养箱:上海容威仪器有限公司;B款对辊式麦芽粉碎机:山东极鼎工业设备有限公司;XG-H10小型蒸馏器:酿哥机械设备有限公司;Mili-Q超纯水系统:美国Millipore公司。
1.3 方法
1.3.1 青稞威士忌加工工艺流程及操作要点

操作要点:
原料处理:原料1.67 kg(青稞和大麦芽各占50%),青稞粉碎后过20目筛,麦芽粉碎,粗粒与细粒的比例为1.0∶2.5。
青稞的糊化:青稞按料水比1∶4(g∶mL)加水后外源添加安琪耐高温淀粉酶0.4 g/kg,缓慢升温至92 ℃,直至碘检不变色。
青稞麦汁的糖化:麦芽粉按料水比1∶4(g∶mL)加入35 ℃的温水,此时加入青稞糊化醪后升温至50 ℃保持50 min,加热至65 ℃保持70 min,72 ℃保持20 min至碘检不变色后进行过滤,得到糖度为15 g/100 g的青稞麦汁。
发酵:青稞麦汁降温至30 ℃入桶发酵,选用酵母M-1、D-53、USW-6,酵母添加量为0.5 g/L,发酵温度30 ℃,发酵72 h,每24 h测定一次糖度,若连续两次测定糖度不变则发酵结束,每种酵母做3次平行试验。
蒸馏:使用小型蒸馏器对发酵液进行蒸馏,第一次蒸馏:蒸馏至酒精度为1%vol时停止蒸馏,第二次蒸馏:酒精度76%vol及以上为酒头,60%vol~76%vol为酒心,40%vol~60%vol为酒尾,40%vol以下的酒液为废液[19]。
贮存:橡木桶中贮存3年,由于酒液在橡木桶中贮存时间过长,且贮存前风味差异主要由酵母决定,长期贮存后会减少这种差异,不利于比较不同酵母的对威士忌的影响,因此,本研究决定以未经橡木桶贮存过的酒液作为酒样进行分析。
调配:取上述蒸馏后的酒心用纯净水降度稀释至40%vol,所得即为青稞威士忌。
1.3.2 青稞麦汁糖化时间的确定
麦汁醪液达到糖化温度65 ℃时开始计时并测定麦汁糖度,每10 min测定一次麦汁糖度,当麦汁糖度无明显变化时,此时的时间就是最佳糖化时间。
1.3.3 理化指标测定
pH的测定:采用pH计;麦汁糖度的测定:采用糖度计;发酵液酒精度和糖度的测定:采用全自动啤酒分析仪;蒸馏酒液酒精度的测定:采用DMA 35便携式密度计。
1.3.4 单位原料出酒率计算
酵母除了影响威士忌风味之外,对原料出酒率也有影响,出酒率越高越好,原料出酒率计算公式如下:
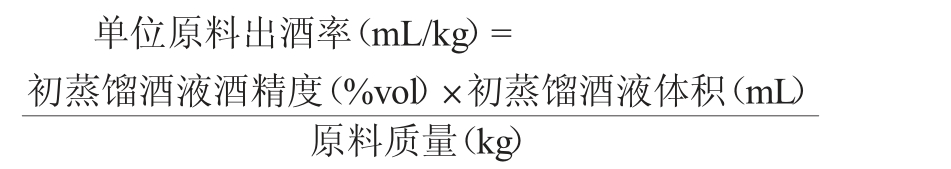
1.3.5 感官品评
品评小组由6人组成(3男3女,平均年龄28岁),其中省级评委4人,四级品酒师1人,普通人1人。感官品评酒液为酒身稀释至40%vol,每人对酒样的色泽(20分)、香味(30分),滋味(40分)和典型性(10分)进行打分,满分100分,参考文献[19]的评价方法,具体评价标准见表1。
表1 青稞威士忌感官评价标准
Table 1 Sensory evaluation standards of highland barley whisky
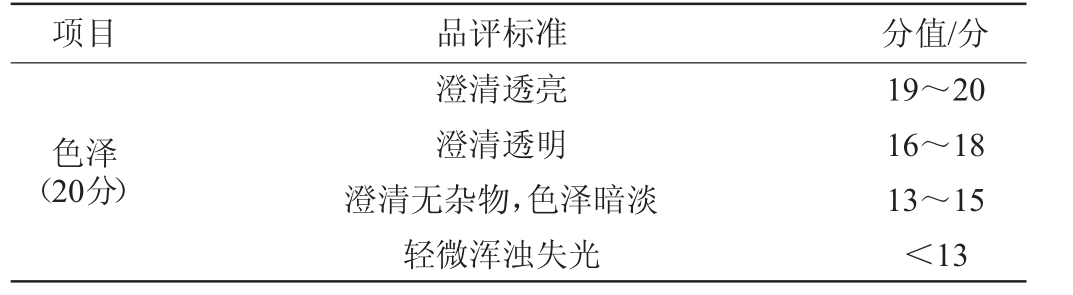
项目 品评标准 分值/分色泽(20分)澄清透亮澄清透明澄清无杂物,色泽暗淡轻微浑浊失光19~20 16~18 13~15<13
续表
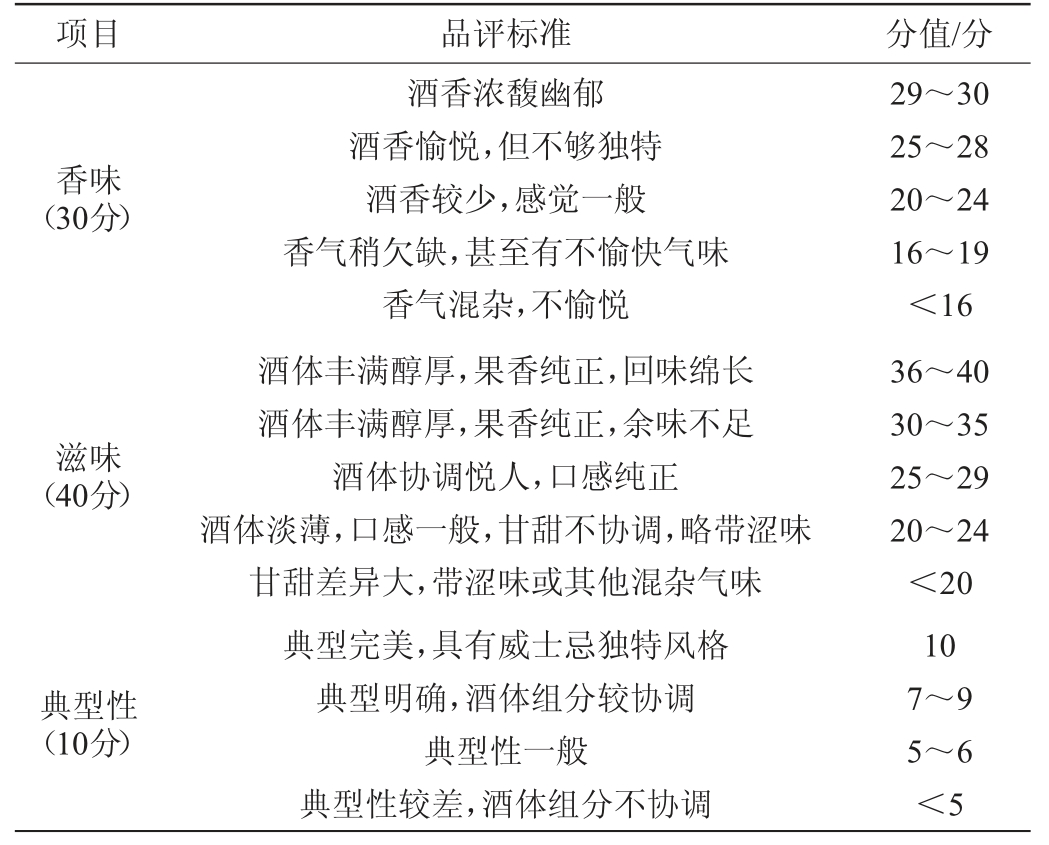
项目 品评标准 分值/分香味(30分)滋味(40分)典型性(10分)酒香浓馥幽郁酒香愉悦,但不够独特酒香较少,感觉一般香气稍欠缺,甚至有不愉快气味香气混杂,不愉悦酒体丰满醇厚,果香纯正,回味绵长酒体丰满醇厚,果香纯正,余味不足酒体协调悦人,口感纯正酒体淡薄,口感一般,甘甜不协调,略带涩味甘甜差异大,带涩味或其他混杂气味典型完美,具有威士忌独特风格典型明确,酒体组分较协调典型性一般典型性较差,酒体组分不协调29~30 25~28 20~24 16~19<16 36~40 30~35 25~29 20~24<20 10 7~9 5~6<5
1.3.6 青稞威士忌挥发性香气物质的检测
HS-SPME条件:将酒样用煮沸过的超纯水稀释到酒精度为10%vol,取5 mL酒样于20 mL顶空瓶中,添加无水氯化钠进行饱和,加入内标乙酸正戊酯(0.4 mg/L)后进行顶空固相微萃取,萃取头为DVB/CAR/PDMS三相萃取头,酒样在50 ℃的条件下预热5 min,吸附萃取45 min,在250 ℃的GC进样口解吸5 min。
GC条件:参考GAO W J等[20]的条件,样品通过DB-WAX(60 m×0.25 mm×0.25 μm)色谱柱进行分离,进样口温度250 ℃,载气为高纯氦气(He),流速1 mL/min,不分流进样,进样量为1 μL。升温程序为:50 ℃保持2 min,然后以6 ℃/min速率升温至230 ℃,并保持15 min。
质谱条件:电子电离(electron ionization,EI)源;电子能量70 eV;离子源温度230 ℃;扫描范围35~350 amu。
定性定量方法:根据改进的KOVATS V E等[21]的方法计算化合物保留指数(retention index,RI)和文献中报道中的RI进行对比定性,RI相差值小于50,内标物质为乙酸正戊酯(0.4 mg/L),根据目标物与内标峰面积的比值乘以内标浓度确定挥发性香气物质的相对含量。
1.3.7 数据处理
所有实验做3次平行,结果以“平均值±标准差”形式展现,采用Excel 2013进行数据整理,使用Origin 2022绘制折线图和雷达图,使用R-4.2.3进行热图的绘制。
2 结果与分析
2.1 青稞麦汁糖化时间的确定
根据前期啤酒试验,得到最佳糖化温度为65 ℃,糖化时间对青稞麦汁糖度的影响结果见图1。由图1可知,随着糖化时间的延长,青稞麦汁糖度呈上升趋势,当糖化时间70 min时趋于平缓。这是由于青稞中具有高含量的β-葡聚糖,其平均含量为5.25%,最高达8.62%,是小麦中β-葡聚糖含量的50倍,是所有谷物中β-葡聚糖含量最高的作物[22],高含量β-葡聚糖形成的高粘度环境易形成凝胶覆盖在淀粉颗粒表面,阻碍淀粉酶与淀粉颗粒接触,从而抑制淀粉的水解[23],使得淀粉利用率较低,且此抑制作用随着β-葡聚糖浓度的增大而增大[24]。β-葡聚糖对淀粉的体外消化试验表明,葡萄糖浓度随着水解时间的延长而增加[25],青稞糖化所需的时间要长于纯麦芽糖化的时间,适当延长糖化时间有利于获得更高糖度的麦汁,但是时间过长糖度增长有限。因此综合考虑成本等因素,本研究确定青稞威士忌在65 ℃的糖化时间为70 min,此时糖度为15 g/100 g。
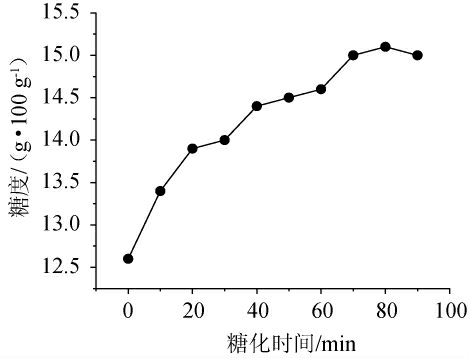
图1 糖化时间对青稞麦汁糖度的影响
Fig.1 Effect of saccharification time on the sugar degree of highland barley wort
2.2 不同酵母的发酵性能
降糖情况在一定程度上可以反映出酵母的发酵性能,不同酵母的发酵性能结果见图2。由图2可知,发酵0~24 h时,酵母M-1的降糖速率较慢,酵母USW-6和酵母D-53的降糖速率较快,要高于酵母M-1;发酵24~48h内酵母USW-6和酵母D-53降糖速率明显下降,而酵母M-1的降糖速率要高于酵母USW-6和酵母D-53;发酵48~72 h时,3种酵母的降糖速率趋于一致。最终发酵到72 h时,酵母M-1发酵液中的残糖量为2.45 g/100 g,酵母USW-6发酵液中的残糖量为2.53 g/100 g,酵母D-53发酵液中的残糖量为2.57 g/100 g。发酵结束时,发酵液的糖度值越低说明酵母的发酵性能越强[26]。因此,酵母M-1相对于其他两种酵母发酵性能略强。
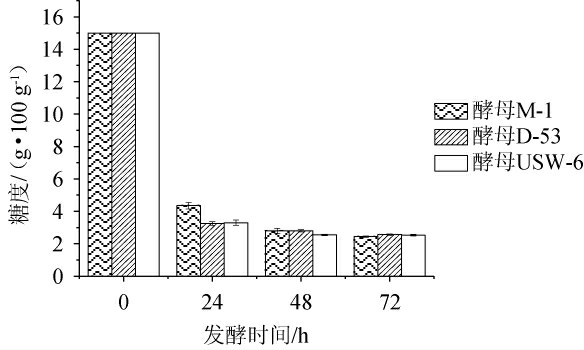
图2 不同酵母发酵性能的测定结果
Fig.2 Determination results of fermentation performance of different yeasts
2.3 不同酵母发酵液的理化指标
青稞麦汁及不同酵母发酵液的理化指标测定结果见表2。由表2可知,3种酵母发酵液的pH在4.07~4.43之间,与发酵前(青稞麦汁)相比pH均下降,但酵母D-53发酵液的pH下降最多,说明酵母D-53产酸能力相对强些。3种酵母发酵72 h后的发酵液酒精度在6.61%vol~7.29%vol之间,其中,酵母M-1产酒精能力最强,发酵液酒精度达到7.29%vol。通过3种酵母发酵液的理化指标综合来看,酵母M-1发酵效果最佳。
表2 青稞麦汁及不同酵母发酵液的理化指标
Table 2 Physicochemical indexes of highland barley wort and different yeast fermentation liquid
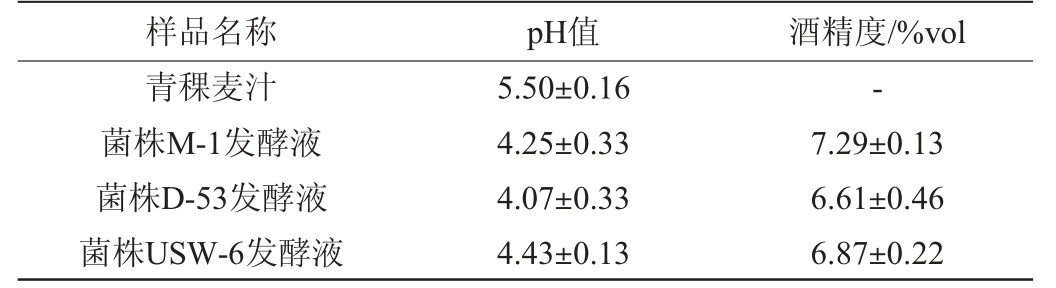
注:“-”表示未检测到。
样品名称 pH值 酒精度/%vol青稞麦汁菌株M-1发酵液菌株D-53发酵液菌株USW-6发酵液5.50±0.16 4.25±0.33 4.07±0.33 4.43±0.13-7.29±0.13 6.61±0.46 6.87±0.22
2.4 不同酵母发酵对单位原料出酒率的影响
发酵液经过一次蒸馏后,计算经过不同酵母发酵的单位原料出酒率,结果见表3。由表3可知,酵母M-1所产威士忌原酒单位原料出酒率要高于其他两种酵母,达到了194.91 mL/kg,这说明在相同质量原料的情况下,酵母M-1可以产出更多的酒精。当投料为1 kg粮食时,酵母M-1相对于酵母D-53和USW-6要分别多产4.94 mL和15.76 mL酒精(按100%乙醇算),若青稞威士忌生产规模扩大时,酵母M-1能产生更高的经济效益。
表3 不同酵母发酵单位原料出酒率
Table 3 Liquor yield per unit raw material of different yeasts
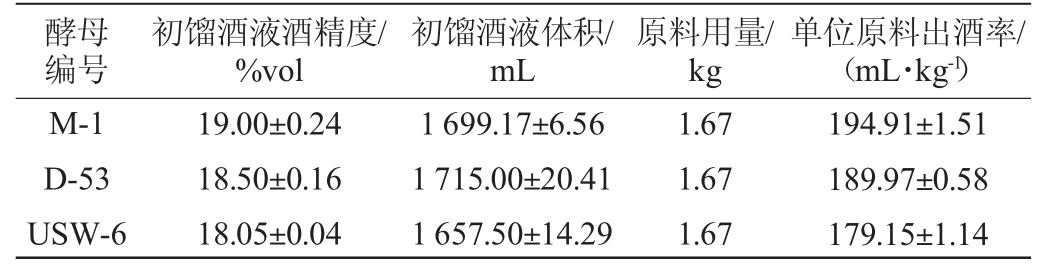
酵母编号初馏酒液酒精度/%vol初馏酒液体积/mL原料用量/kg单位原料出酒率/(mL·kg-1)M-1 D-53 USW-6 19.00±0.24 18.50±0.16 18.05±0.04 1 699.17±6.56 1 715.00±20.41 1 657.50±14.29 1.67 1.67 1.67 194.91±1.51 189.97±0.58 179.15±1.14
2.5 不同酵母制备的青稞威士忌的感官评价
品评小组对3种酵母所产原酒进行感官品评,在色泽、香味、滋味和典型性四个方面评分,并绘制雷达图,结果见图3。由图3可知,在色泽方面,3个酒样均澄清透亮,感官评分均为20分;在香味方面,菌株M-1制备酒样平均得分最高为25.3分,酒香愉悦;在滋味方面,菌株M-1制备酒样平均得分最高,为29.7分,酒体丰满协调悦人,口感纯正;在典型性方面,菌株M-1制备酒样平均得分最高为6.8分,典型明确,酒体组分较协调。综上,菌株M-1制备酒样感官评分最高,总分为81.8分,其酒体丰满,口感纯正,具有明显的粮香和花果香。
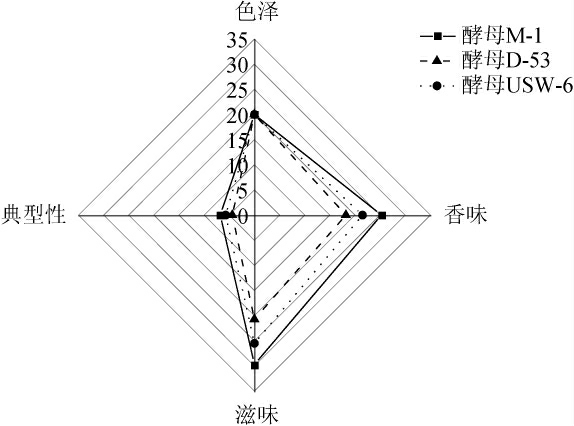
图3 不同青稞威士忌酒样感官评分雷达图
Fig.3 Radar map of sensory scores of different highland barley whiskey samples
2.6 不同酵母对青稞威士忌挥发性香气物质的影响
通过质谱和参考文献[27-32]中的相对保留指数定性,3种酵母制备的青稞威士忌酒样中的主要挥发性香气物质测定结果见图4。

图4 不同酵母制备威士忌酒样中挥发性香气物质的热图
Fig.4 Heatmap of volatile aroma compounds in highland barley whiskey samples prepared by different yeasts
由图4可知,M-1酵母生产的威士忌原酒中共定性19种挥发性香气物质,其中酯类10种、醇类5种、芳香族2种和其他类2种,USW-6酵母生产的威士忌原酒中定性出17种挥发性香气物质,其中2-甲基丙酸乙酯和辛酸己酯未检测到。D-53酵母生产的威士忌原酒相对于前两者风味化合物数量更少,只定性了13种挥发性香气物质,其中2-甲基丙酸乙酯、庚酸乙酯、壬酸乙酯、辛酸己酯、辛酸-3-甲基丁酯和糠醛均未检测到。通过风味化合物种类来说,M-1酵母更具优势。
由图4可以清晰地看出,菌株M-1制备酒样中风味化合物相对含量整体上要高于其他两种酵母生产的威士忌原酒。菌株M-1制备酒样的酯类物质中除了乙酸-3-甲基丁酯和己酸乙酯外其他酯类物质含量均高于菌株USW-6制备酒样和菌株D-53制备酒样,其中乙酸乙酯含量是菌株USW-6制备酒样的1.56倍,菌株D-53制备酒样的3.24倍,庚酸乙酯、壬酸乙酯、辛酸-3-甲基丁酯含量分别是菌株USW-6制备酒样的1.51倍、1.84倍、2.65倍,而菌株D-53制备酒样中均未检测到,乙酸-2-苯乙酯含量是菌株USW-6制备酒样的2.11倍,菌株D-53制备酒样的4.69倍,这些物质可以为酒体带来水果香和花香,从侧面证明了酵母M-1生产的威士忌原酒在香味上要优于其他两种酵母生产的威士忌原酒。菌株M-1制备酒样中3-甲基-1-丁醇、2-己醇和2-苯乙醇含量要低于菌株USW-6制备酒样和菌株D-53制备酒样,菌株USW-6制备酒样和菌株D-53制备酒样中的3-甲基-1-丁醇含量分别是菌株M-1制备酒样的1.15倍和1.48倍。由于威士忌原酒中3-甲基-1-丁醇的含量在醇类化合物中占比最高[19],适当控制3-甲基-1-丁醇含量能尽量避免饮后出现头痛症状。由此可得出M-1酵母生产的威士忌原酒要优于另外两种酵母生产的威士忌原酒。
3 结论
本研究以青稞和麦芽为原料(1∶1),选用3种不同的威士忌酵母酿造威士忌。研究结果表明,糖化时,在65 ℃保持70 min能获得更高原麦汁浓度的麦汁,利于产生更多的酒精。酵母M-1发酵性能最好,理化指标良好,单位原料出酒率最高,达到194.91 mL/kg。M-1酵母生产的威士忌原酒中检测出的挥发性香气物质种类最多,达到了19种。菌株M-1制备酒样中挥发性香气物质含量相对于菌株USW-6制备酒样和菌株D-53制备酒样整体偏高,酯类物质中除了乙酸-3-甲基丁酯和己酸乙酯外其他酯类物质含量均高于菌株USW-6制备酒样和菌株D-53制备酒样,为酒体带来更多的水果香和花香。菌株M-1制备酒样中3-甲基-1-丁醇含量最少,饮后更不容易出现头痛症状。酵母M-1所生产的威士忌原酒感官评分最高,达到了81.8分,香气口感方面更佳。因此,酵母M-1更适合酿造青稞威士忌。
[1]刘小娇,王姗姗,白婷,等.青稞营养及其制品研究进展[J].粮食与食品工业,2019,26(1):43-47.
[2]阚建全,洪晴悦.青稞生物活性成分及其生理功能研究进展[J].食品科学技术学报,2020,38(6):11-20.
[3]尹小庆,靳玉龙.国内青稞酒企业的发展现状概述[J].西藏农业科技,2021,43(4):96-99.
[4]冯格格,佘永新,洪思慧,等.青稞中主要功效成分最新研究进展[J].农产品质量与安全,2020(2):82-89.
[5]侯殿志,沈群.我国29种青稞的营养及功能组分分析[J].中国食品学报,2020,20(2):289-298.
[6]邓鹏,张婷婷,王勇,等.青稞的营养功能及加工应用的研究进展[J].中国食物与营养,2020,26(2):46-51.
[7]ZOU S W,DUAN B C,XU X J.Inhibition of tumor growth by β-glucans through promoting CD4+T cell immunomodulation and neutrophil-killing in mice[J].Carbohydr Polym,2019,213:370-381.
[8]CHENG D, ZHANG X Y, MENG M, et al.Inhibitory effect on HT-29 colon cancer cells of a water-soluble polysaccharide obtained from highland barley[J].Int J Biol Macromol,2016,92:88-95.
[9]杜艳,梁锋,李婷玉,等.发芽青稞的营养品质及降血压效果[J].食品与生物技术学报,2023,42(7):44-52.
[10]张晖,朱玲,陈晓宇.青稞:一种潜在的辅助降血糖食品资源[J].粮油食品科技,2022,30(2):1-7.
[11]郑福平,马雅杰,侯敏,等.世界6大蒸馏酒香气成分研究概况与前景展望[J].食品科学技术学报,2017,35(2):1-12.
[12]张韵,熊嘉楠.国内市场持续向好威士忌巨头纷纷建厂提价[J].中国食品,2022(20):42-43.
[13]王准生.薯粮威士忌的生产工艺[J].中国酿造,2005,24(1):48-49.
[14]林灼华.玉米威士忌生产工艺[J].食品界,2019(4):160.
[15]宗绪岩,李丽,刁冲,等.玉米威士忌生产工艺研究[J].四川理工学院学报(自然科学版),2017,30(5):14-19.
[16]林灼华.高粱生产威士忌技术研究[J].现代食品,2018(16):159-161.
[17]杨小兰.高粱威士忌酒的生产工艺[J].食品科学,2000,21(8):29-30.
[18]WAYMARK C,HILL A E.The influence of yeast strain on whisky new make spirit aroma[J].Fermentation,2021,7(4):311.
[19]宋绪磊,沈国全,路峻,等.不同酵母对威士忌品质的影响[J].中国酿造,2021,40(10):89-94.
[20]GAO W J,FAM W L,XU Y.Characterization of the key odorants in light aroma type Chinese liquor by gas chromatography-olfactometry,quantitative measurements, aroma recombination, and omission studies[J].J Agr Food Chem,2014,62(25):5796-5804.
[21]CATES V E,MELOAN C E.Separation of sulfones by gas chromatography[J].J Chromatogr A,1963,11:472-478.
[22]张文会.青稞β-葡聚糖提取工艺优化[J].农产品加工,2017(12):23-25.
[23]邓婧,马小涵,赵天天,等.青稞β-葡聚糖对淀粉体外消化性的影响[J].食品科学,2018,39(10):106-111.
[24]游茂兰,邓婧,覃小丽,等.β-葡聚糖对传统青稞酒发酵的影响[J].食品与发酵工业,2019,45(10):149-154.
[25]张洁.燕麦颗粒中谷粒态β-葡聚糖对淀粉消化以及糖脂代谢的影响[D].无锡:江南大学,2016.
[26]宋瑶,缪礼鸿,高素芹,等.耐高温酒精酵母菌株的筛选及发酵能力比较[J].中国酿造,2009,28(5):38-42.
[27]FAN W L,QIAN M C.Characterization of aroma compounds of Chinese"Wuliangye"and"Jiannanchun"liquors by aroma extract dilution analysis[J].J Agr Food Chem,2006,54(7):2695-2704.
[28]LEE P R,CHONG I S-M, YU B, et al.Effect of precursors on volatile compounds in papaya wine fermented by mixed yeasts[J].Food Technol Biotech,2013,51:92-100.
[29]FAN W L, QIAN M C.Identification of aroma compounds in Chinese'Yanghe Daqu' liquor by normal phase chromatography fractionation followed by gas chromatography/olfactometry[J].Flavour Fragr J,2006,21(2):333-342.
[30]GYAWALI R,KIM K S.Bioactive volatile compounds of three medicinal plants from Nepal[J].Kathmandu Univ J Sci,2012,8:51-62.
[31]WELKE J E, MANFROI V, ZANUS M, et al.Characterization of the volatile profile of Brazilian Merlot wines through comprehensive two dimensional gas chromatography time-of-flight mass spectrometric detection[J].J Chromatogr A,2012,1226:124-139.
[32]FANG Y, QIAN M C.Aroma compounds in Oregon Pinot Noir wine determined by aroma extract dilution analysis(AEDA)[J].Flavour Fragr J,2005,20(1):22-29.