红曲糟为福建红曲酒加工副产物,产量大、利用率低,其不仅含有35%(干基计)左右的蛋白质,蛋白主要为糯米源的谷蛋白及微生物源蛋白,还含有20%左右的淀粉、10%左右纤维素等[1]。利用其原料特性,将其应用于以酒糟蛋白为原料开发优质可食用蛋白[2]、色素添加剂[3]。采用红曲糟制曲可以降低酱油等调味料的生产成本,增加其酱香风味,米曲霉(Aspergillus oryzae)可以产生中性蛋白酶、酸性蛋白酶、谷氨酰胺酶等,米曲霉产蛋白酶的特性是发酵酱油的基础[4-5]。AO X L等[6]在发酵的蚕豆中分离出了一株中性蛋白酶高产菌株Y1,中性蛋白酶经纯化后比活力(2 264.3 U/mg)提高了10倍,MAMO J等[7]从埃塞俄比亚土壤样品中分离筛选出可分泌凝乳蛋白酶的米曲酶DRDFS13,经过优化后的培养基培养后,凝乳活力从优化前的77.74 U/mL提高至168.47 U/mL。
米曲霉MJY2-5是以红曲糟为培养基发酵制备调味液基料的优良菌株,将其应用于红曲糟固态发酵制曲,可制备出色泽红褐有光泽、酱香浓郁、具有红曲糟典型性的调味液,蛋白酶解率和氨氮转化率分别比传统酱油酿造曲3.042提高59.36%、53.56%[8]。菌株MJY2-5产的谷氨酰胺酶可催化谷氨酰胺水解生成L-谷氨酸[9],是影响调味液风味的关键酶[10],比传统酱油酿造曲3.042高出45%,产孢能力超过酱油酿造曲的制曲要求[11]。中性蛋白酶是影响酱油等调味液品质的关键因素,也是影响蛋白酶解率的关键酶系,可以将原料中的蛋白质分子降解为游离氨基酸、多肽、寡肽等物质[12]。因此,提高红曲糟固态发酵制曲中中性蛋白酶及谷氨酰胺酶的酶活力是制备优质调味液的必要条件。目前,鲜有关于酱油酿造曲制曲过程中谷氨酰胺酶酶活力的研究报道。
本研究以红曲糟为主要原料,以米曲霉(Aspergillus oryzae)MJY2-5为菌种,采用固态发酵制曲,以中性蛋白酶、谷氨酰胺酶活力为指标,通过单因素和正交试验优化红曲糟等制曲条件,以酶解率为指标,研究米曲霉最佳产酶条件。以期为红曲糟调味液的研制提供技术支持,促进红曲糟的开发利用。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
红曲糟:来自古田蓝溪红酒业有限公司,经造粒、干制,粉碎80目过筛,备用;麸皮:市售;米曲霉(Aspergillus oryzae)MJY2-5:于福建省传统酱油醅中分离鉴定得到;大米蛋白:来自西安冰禾生物科技有限责任公司。
1.1.2 试剂
浓硫酸、浓盐酸、硼酸、冰醋酸、氢氧化钠、甲醛、无水乙醇、硫酸钾、无水硫酸铜、福林酚试剂、无水碳酸钠、三氯乙酸、乳酸、乳酸钠、磷酸氢二钾、磷酸二氢钾、L-酪氨酸、酪蛋白、硼砂、氧化镁、甲基红指示剂、亚甲基蓝指示剂、重铬酸钾、亚铁氰化钾:国药集团化学试剂有限公司。谷氨酰胺酶试剂盒、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS):北京索莱宝科技有限公司。所用试剂均为分析纯。
1.1.3 培养基
孟加拉红培养基、麦芽汁琼脂培养基(均为生化试剂):海博生物技术有限公司。
红曲糟培养基:按红曲糟与麸皮配比为3∶7,其添加量为60%,水分添加量为40%,121 ℃灭菌20 min,待用。
1.2 仪器与设备
LDZX-50KBS立式压力蒸汽灭菌锅:上海申安医疗器械厂;BC/BD-217CH冷柜:河南新飞电器有限公司BS110s电子天平:赛多利斯科学仪器(北京)有限公司;sW-CJ-2FD型超净工作台:苏州安泰空气技术有限公司;TGL16M台式高速冷冻离心机:上海诺顶仪器设备有限公司;LRH-160生化培养箱:上海一恒科学仪器有限公司;UV2800/UV2800S紫外可见分光光度计、DHG-9070A鼓风干燥机:厦门精艺兴业科技有限公司;HYP-320消化炉、K9840海能凯氏定氮仪:烟台海能仪表科技有限公司;LC-600B-超声波清洗机:福建省医疗器械公司。
1.3 方法
1.3.1 红曲糟固态制曲的质量比对米曲霉MJY2-5产酶的影响
米曲霉的活化及孢子液制备:将米曲霉MJY2-5甘油管倒在孟加拉红平板上于30 ℃培养3 d,长出孢子后,在无菌操作条件下使用接种铲接入麦芽汁琼脂斜面培养基中,待长出大量成熟孢子时,置于4 ℃冷藏。在相同的条件下二次活化米曲霉,至米曲霉达到最旺盛产孢子能力时,用接种环将斜面孢子洗下,摇匀,获得孢子悬液备用,孢子液浓度为1.0×106个/mL。
将上述孢子活化液以接种量为1.0×106个/g接种至红曲糟培养基中,于培养湿度90%、温度32 ℃培养72 h,检测红曲糟固态制曲中的产中性蛋白酶活力及谷氨酰胺酶活力。以红曲糟、麸皮为基础物料,总质量为200 g,水占总质量的40%。分别考察红曲糟∶麸皮质量比(3∶7、4∶6、5∶5、6∶4、7∶3)对红曲糟固态制曲中的产中性蛋白酶活力及谷氨酰胺酶活力的影响。
1.3.2 米曲霉MJY2-5固态制曲产酶条件优化
单因素试验:以红曲糟∶麸皮质量比为4∶6作为培养基基质,分别考察发酵温度(26 ℃、29 ℃、32 ℃、35 ℃、38 ℃)、发酵时间(48 h、60 h、72 h、84 h、96 h),初始pH值(5.2、5.7、6.2、6.7、7.2),对米曲霉MJY2-5固态制曲产中性蛋白酶及谷氨酰胺酶的影响。
正交试验:在单因素试验基础上,以红曲糟∶麸皮质量比为4∶6作为培养基基质,以中性蛋白酶、谷氨酰胺酶能力为评价指标,以发酵温度(A)、发酵时间(B)、初始pH值(C)为考察因素,设计3因素3水平正交试验,确定米曲霉MJY2-5固态制曲的最优产酶工艺条件。正交试验设计因素与水平见表1。
表1 固态发酵制曲条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal tests for conditions optimization of koji-making with solid-state fermentation
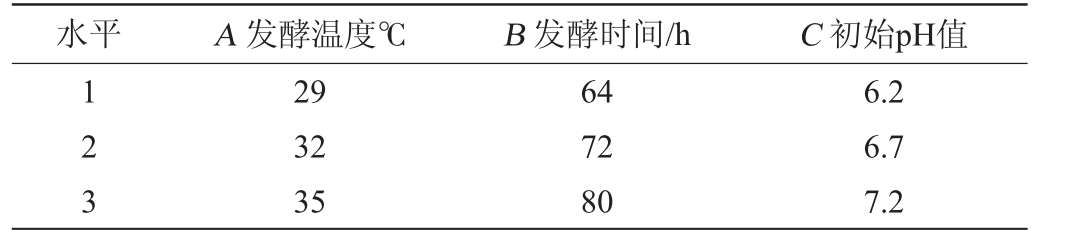
水平 A 发酵温度℃ B 发酵时间/h C 初始pH值123 29 32 35 64 72 80 6.2 6.7 7.2
1.3.3 米曲霉MJY2-5固态制曲酶解条件
酶解底物溶液的配制:于200 mL无菌水中添加质量分数为5%的大米蛋白。称取研细的固态曲5 g,加水至100 mL,在40 ℃水浴条件下间断搅拌1 h,三层滤纸过滤后取上清滤液,将25 mL滤液添加至酶解底物溶液,测定米曲霉MJY2-5固态制曲酶解率,其计算公式如下:
式中:A0、A1、A2分别为酶解初始、酶解结束、酶解终点时的蛋白质的含量,g/100 g。
1.3.4 米曲霉MJY2-5固态制曲酶解条件优化
单因素试验:在1.3.4工艺条件的基础上,考察酶解时间(2 h、3 h、4 h、5 h、6 h)、酶解温度(35 ℃、40 ℃、45 ℃、50 ℃、55 ℃),初始pH值(5.0、5.5、6.0、6.5、7.0),对米曲霉MJY2-5固态制曲酶解率的影响。
正交试验:在单因素试验基础上,以酶解率为评价指标,以初始pH值(A)、酶解温度(B)、酶解时间(C)为考察因素,设计3因素3水平的正交试验,确定米曲霉MJY2-5固态制曲的最优酶解工艺条件。正交试验因素与水平见表2。
表2 酶解条件优化正交试验因素与水平
Table 2 Factors and levels of orthogonal tests for optimization of enzyme production conditions

水平 A 初始pH值 B 酶解温度/℃ C 酶解时间/h 123 5.2 5.5 5.8 47 50 53 456
1.3.5 分析检测
水分含量的测定:参照GB 5009.3—2016《食品安全国家标准食品中水分的测定》[14]。
中性蛋白酶活力的测定:参照SB/T10317—1999《蛋白酶活力的测定法》[15]中的福林酚法;中性蛋白酶活力单位(U/g)定义为每克固态曲在40 ℃、pH7.2条件下水解酪蛋白每分钟产生1 μg酪氨酸的量。
谷氨酰胺酶活力的测定:参照邹敏娟等[13,16]的方法,作适当调整。利用谷氨酰胺酶活性检测试剂盒,采用可见分光光度法检测。谷氨酰胺酶活力单位(U/g)定义为每g固态曲在37 ℃条件下每小时催化谷氨酰胺生成1 μmol/L NH3-N的量。
氨基酸态氮的测定:参照GB/T 5009.235—2016《食品中氨基酸态氮的测定》[17]的酸度计法。
蛋白质的测定:参照GB/T 5009.5—2016《食品安全国家标准食品中蛋白质的测定》[18]的凯氏定氮法。
1.3.6 数据处理与统计分析
所有试验均重复进行3次,数据以“平均值±标准偏差”表示。使用SPSS 24进行Duncan检验,对数据进行方差分析和多重测试分析。P<0.05表示差异显著。采用Origin 9.0进行作图。
2 结果与分析
2.1 红曲糟及麸皮质量比对米曲霉MJY2-5产酶的影响
由图1可知,当红曲糟及麸皮质量比为4∶6时,中性蛋白酶酶活及谷氨酰胺酶酶活均达到最高值,分别为(1 250.22±9.99)U/g、(15.67±0.34)U/g。结果表明,适宜的红曲糟和麸皮配比有利于提高米曲霉产中性蛋白酶及谷氨酰胺酶的活力。因此,确定红曲糟∶麸皮质量比为4∶6。
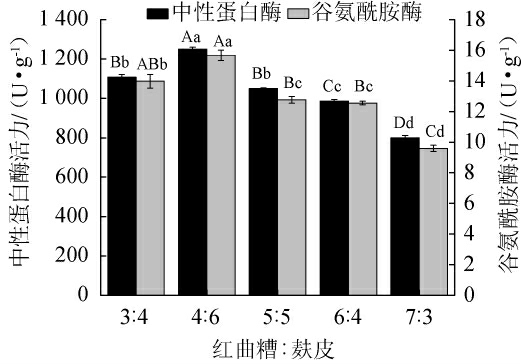
图1 红曲糟与麸皮质量比对米曲霉MJY2-5产中性蛋白酶及谷氨酰胺酶的影响
Fig.1 Effect of mass ratio of Hongqu rice wine grains and bran on activities of neutral protease and glutaminase produced by Aspergillus oryzae MJY2-5
图中大写字母指组间差异显著(P<0.05);小写字母指组间差异极显著(P<0.01)。下同。
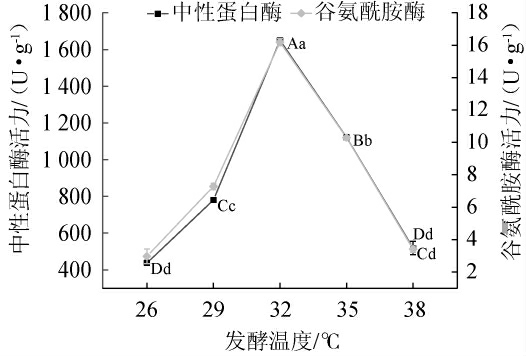
图2 发酵温度对米曲霉MJY2-5产中性蛋白酶及谷氨酰胺酶的影响
Fig.2 Effect of fermentation temperature on activities of neutral protease and glutaminase produced by Aspergillus oryzae MJY2-5

图3 发酵时间对米曲霉MJY2-5产中性蛋白酶及谷氨酰胺酶的影响
Fig.3 Effect of fermentation time on activities of neutral protease and glutaminase produced by Aspergillus oryzae MJY2-5
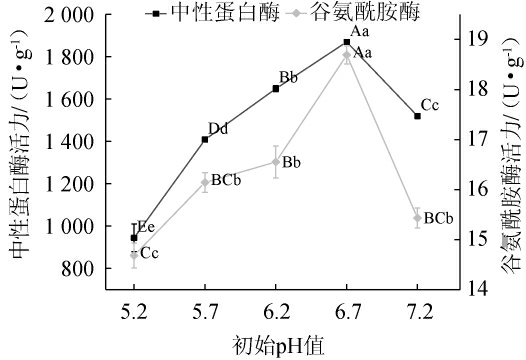
图4 初始pH值对米曲霉MJY2-5产中性蛋白酶及谷氨酰胺酶的影响
Fig.4 Effect of initial pH on activities of neutral protease and glutaminase produced by Aspergillus oryzae MJY2-5
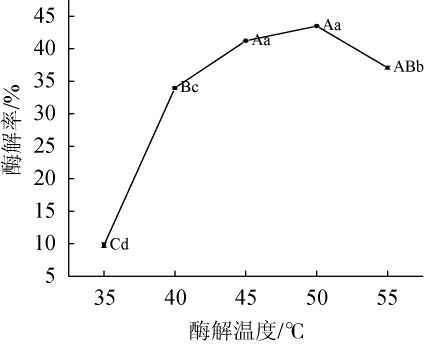
图5 酶解温度对酶解率的影响
Fig.5 Effect of enzymolysis temperature on enzymatic hydrolysis rate
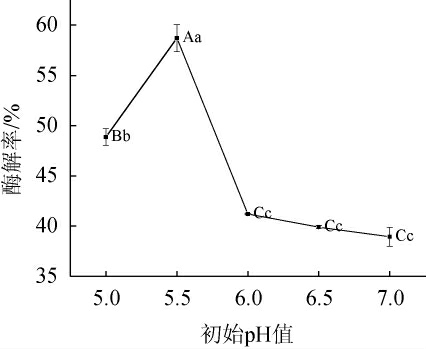
图6 初始pH值对酶解率的影响
Fig.6 Effect of initial pH on enzymatic hydrolysis rate
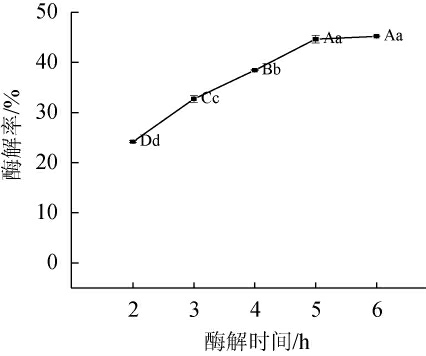
图7 酶解时间对酶解率的影响
Fig.7 Effect of enzymolysis time on enzymatic hydrolysis rate
2.2 发酵温度对米曲霉MJY2-5产酶的影响
随着发酵温度在26~32 ℃范围内的升高,中性蛋白酶及谷氨酰胺酶酶活力均呈上升趋势;当发酵温度为32 ℃时,中性蛋白酶及谷氨酰胺酶酶活力均达到最大值分别为(1 649.53±13.89)U/g、(16.18±0.22)U/g,且与其他处理组差异极显著(P<0.01);当发酵温度高于32 ℃时,中性蛋白酶及谷氨酰胺酶酶活力均下降,适宜的发酵温度有利于提高米曲霉的产酶能力,温度过低或过高时均会影响菌丝生长,菌丝生长旺盛程度影响其产中性蛋白酶及谷氨酰胺酶能力[19],因此,确定最佳发酵温度为32 ℃。
2.3 发酵时间对米曲霉MJY2-5产酶的影响
随着发酵时间在48~72 h范围内的延长,固态制曲产中性蛋白酶及谷氨酰胺酶的活力均呈上升趋势;当发酵时间为72 h时达最大值分别为(1 649.53±13.89)U/g、(16.18±0.22)U/g,且与其他处理组差异呈极显著(P<0.01);当发酵时间>72 h,中性蛋白酶及谷氨酰胺酶的活力均呈下降趋势,米曲霉在适宜条件下生长迅速,前期迅速摄取培养基中营养成分生长,其产酶水平随着菌丝逐渐旺盛而增强,当营养成分摄取完后,菌株生长减慢并趋向衰老,产酶的能力呈下降趋势[20]。因此,确定最佳发酵时间为72 h。
2.4 初始pH值对米曲霉MJY2-5产酶的影响
随着初始pH值在5.2~7.2范围内的升高,固态制曲产中性蛋白酶及谷氨酰胺酶的活力呈先上升后下降趋势,初始pH 6.7时均达最大值分别为(1 869.45±3.08)U/g和(18.69±0.18)U/g,且与其他处理组差异呈极显著(P<0.01),pH值可以影响微生物的产酶的能力、营养物质的吸收和代谢产物的合成,所以适宜的pH环境下,米曲霉的产酶能力最高[21]。因此,确定最佳初始pH值为6.7。
2.5 米曲霉MJY2-5固态制曲产酶正交试验结果
由表3可知,由R值可知,各因素对米曲霉MJY2-5产中性蛋白酶影响顺序依次为发酵温度(A)>发酵时间(B)>初始pH(C),对米曲霉MJY2-5产谷氨酰胺酶影响顺序依次为发酵温度(A)>初始pH(C)>发酵时间(B),由k值可知,确定最优发酵工艺组合为A2B2C2。由表4可知,各因素对米曲霉MJY2-5固态制曲产中性蛋白酶及谷氨酰胺酶酶活均有极显著影响(P<0.01)。经3次平行验证试验,中性蛋白酶及谷氨酰胺酶酶活分别为(1 891.79±6.34)U/g、(19.96±0.44)U/g。因此,确定米曲霉MJY2-5固态制曲的最佳制曲条件为:发酵温度32 ℃,发酵时间72 h,发酵pH值6.7。
表3 固态发酵制曲条件优化正交试验结果与分析
Table 3 Results and analysis of orthogonal tests for conditions optimization of koji-making with solid-state fermentation
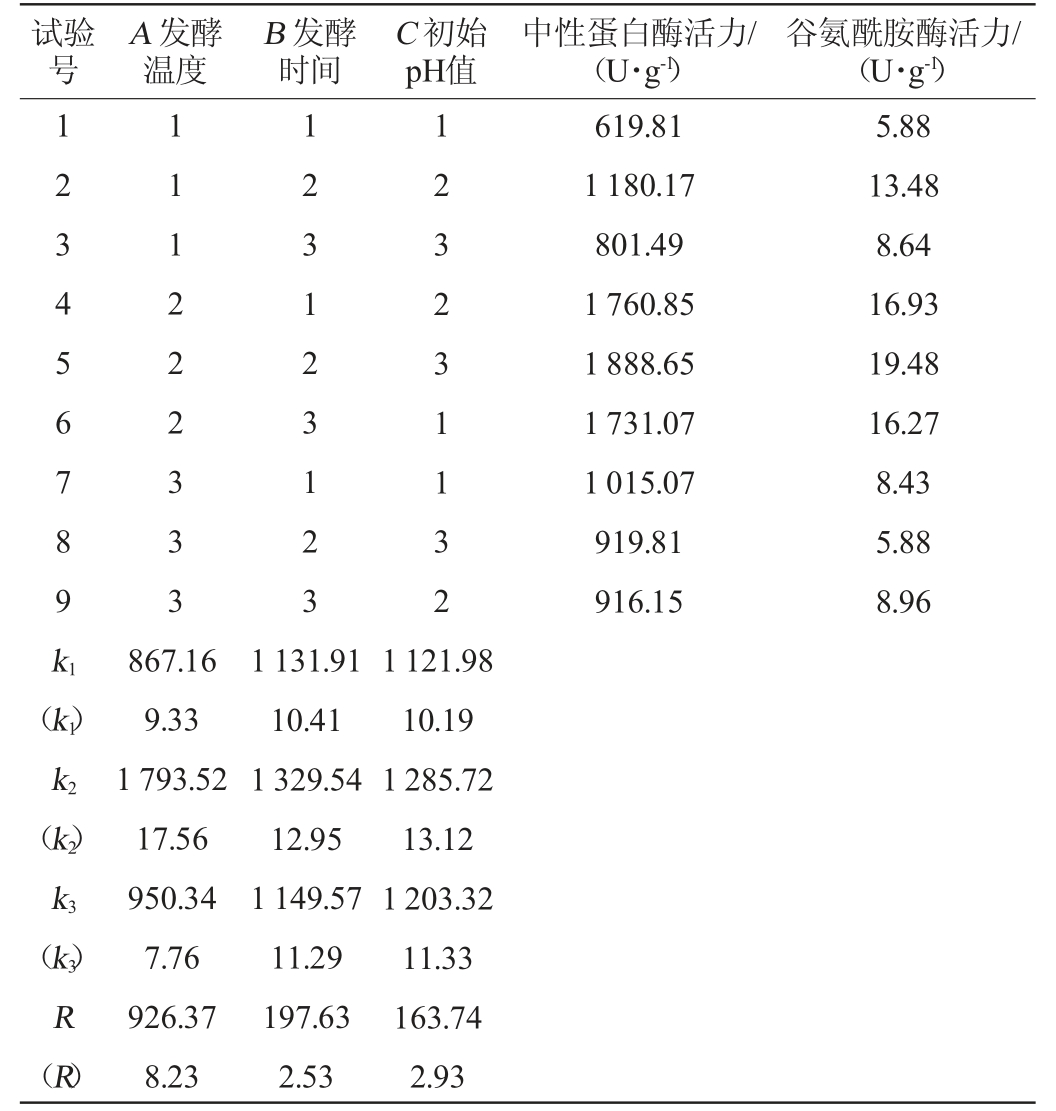
注:括号中的值代表谷氨酰胺酶活力。下同。
试验号A 发酵温度B 发酵时间C 初始pH值中性蛋白酶活力/(U·g-1)谷氨酰胺酶活力/(U·g-1)1 2 3 4 5 6 7 8 9 k1 1 1 1 2 2 2 3 3 3 1 2 3 1 2 3 1 2 3 1 2 3 2 3 1 1 3 2 619.81 1 180.17 801.49 1 760.85 1 888.65 1 731.07 1 015.07 919.81 916.15 5.88 13.48 8.64 16.93 19.48 16.27 8.43 5.88 8.96(k1)k2(k2)k3(k3)R(R)867.16 9.33 1 793.52 17.56 950.34 7.76 926.37 8.23 1 131.91 10.41 1 329.54 12.95 1 149.57 11.29 197.63 2.53 1 121.98 10.19 1 285.72 13.12 1 203.32 11.33 163.74 2.93
表4 固态发酵制曲条件优化正交试验结果方差分析
Table 4 Variance analysis of orthogonal tests results for conditions optimization of koji-making with solid-state fermentation
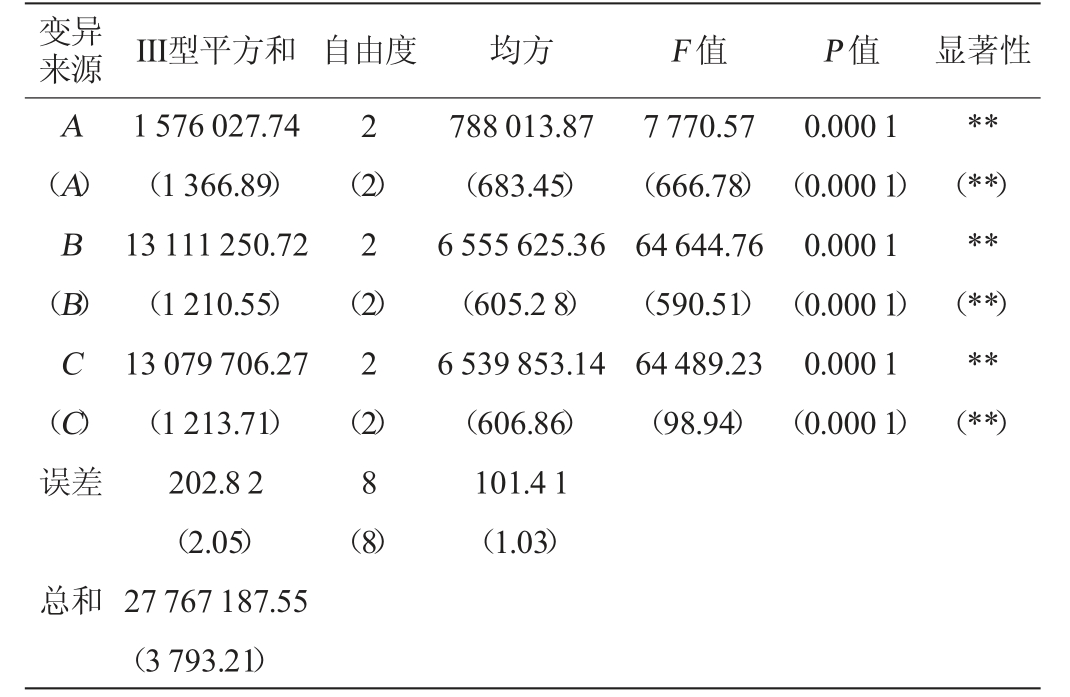
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
变异来源 III型平方和 自由度 均方 F 值 P 值 显著性A(A)B(B)C(C)误差2 1 576 027.74(1 366.89)13 111 250.72(1 210.55)13 079 706.27(1 213.71)202.8 2(2.05)27 767 187.55(3 793.21)(2)2(2)2(2)8(8)788 013.87(683.45)6 555 625.36(605.2 8)6 539 853.14(606.86)101.4 1(1.03)7 770.57(666.78)64 644.76(590.51)64 489.23(98.94)0.000 1(0.000 1)0.000 1(0.000 1)0.000 1(0.000 1)**(**)**(**)**(**)总和
2.6 酶解条件优化单因素试验结果
2.6.1 酶解温度的确定
随着酶解温度在35~50 ℃范围内的升高,酶解率呈上升趋势;当酶解温度为50 ℃,酶解率达到最高值,为(44.25±0.62)%;当酶解温度高于55 ℃时,酶解能力开始下降。在适宜温度条件内,温度越高分子运动越剧烈,酶活性越大,酶解能力越强,超过适宜温度后,酶活性降低,酶解能力下降[22]。因此,确定最佳酶解温度为50 ℃。
2.6.2 初始pH值的确定
随着初始pH值在5.0~5.5范围内的升高,酶解率呈上升趋势;当初始pH为5.5时酶解率达到最高值,为(58.35±0.31)%;当初始pH值为5.5~6.0时,酶解率快速下降;当初始pH值>6.0时,酶解率下降趋势趋于平稳。在最适pH时,酶分子上活性中心上的有关基团的解离状态最适于与底物结合,pH高于或低于最适pH时,活性中心上的有关基团的解离状态发生改变,酶和底物的结合力降低,因而酶反应速度降低[23]。因此,确定最佳初始pH值为5.5。
2.6.3 酶解时间的确定
随着酶解时间在2~5 h内的延长,酶解率呈快速上升的趋势;当酶解时间为5 h时,酶解率达最高值,为(43.49±0.85)%;当酶解时间>5 h时,酶解率变化趋于平稳。酶与底物结合后会快速反应,酶解速率较快,当底物或酶反应完全时,将不再继续进行酶解反应,酶解速率逐渐降低至趋于平缓[24]。因此,确定最佳酶解时间为5 h。
2.7 酶解条件优化正交试验结果
由表5可知,由R值可知,各因素对米曲霉MJY2-5成曲的酶解能力影响顺序依次为初始pH值(A)>酶解温度(B)>酶解时间(C),由k值可知,最优发酵工艺组合为A2B1C3,即初始pH值5.5,酶解温度47 ℃,酶解时间6 h。由表6可知,初始pH值对酶解率影响极显著(P<0.01),酶解温度、酶解时间对酶解率影响显著(P<0.05)。因最优发酵工艺组合A2B1C3不在处理组中,进行3次验证实验,酶解率可达(63.42±0.98)%。因此,确定米曲霉MJY2-5固态制曲的最佳酶解条件为初始pH值5.5,酶解温度47 ℃,酶解时间6 h。
表5 产酶条件优化正交试验结果与分析
Table 5 Results and analysis of orthogonal tests for optimization of enzyme production conditions
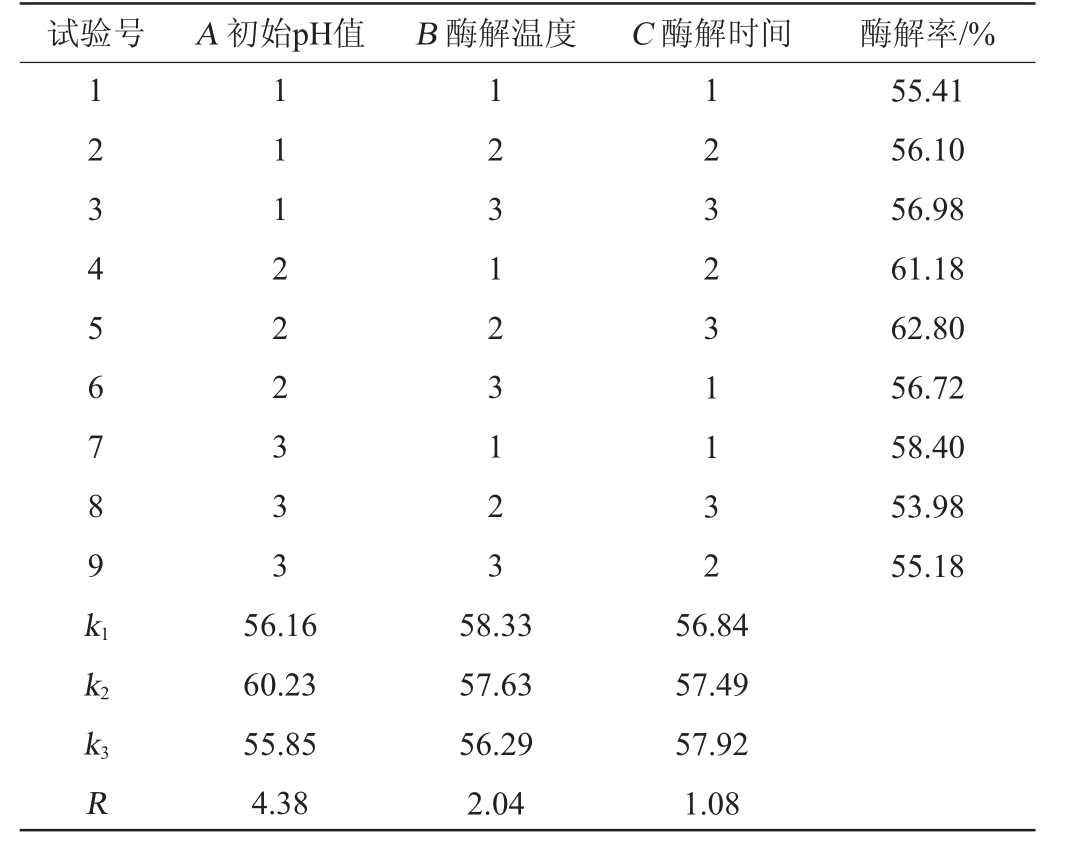
试验号 A 初始pH值 B 酶解温度 C 酶解时间 酶解率/%1 2 3 4 5 6 7 8 9 k1 1 1 1 2 2 2 3 3 3 1 2 3 1 2 3 1 2 3 1 2 3 2 3 1 1 3 2 55.41 56.10 56.98 61.18 62.80 56.72 58.40 53.98 55.18 k2 k3R 56.16 60.23 55.85 4.38 58.33 57.63 56.29 2.04 56.84 57.49 57.92 1.08
表6 产酶条件优化正交试验结果方差分析
Table 6 Variance analysis of orthogonal tests results for optimization of enzyme production conditions
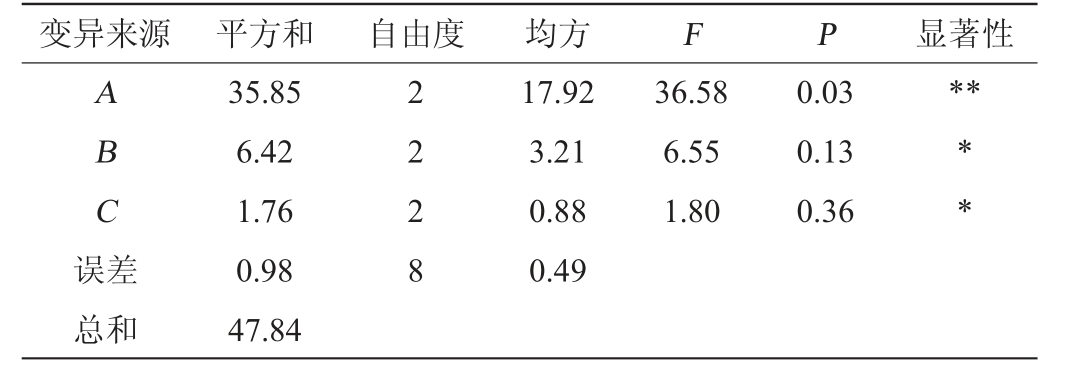
注:“*”表示对结果影响显著显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
变异来源 平方和 自由度 均方 F P 显著性ABC误差2 2 2 8 17.92 3.21 0.88 0.49 36.58 6.55 1.80 0.03 0.13 0.36****总和35.85 6.42 1.76 0.98 47.84
3 结论
该研究以红曲糟为原料,以米曲霉(Aspergillus oryzae)MJY2-5为发酵菌种,通过固态发酵制备成曲,以中性蛋白酶及谷氨酰胺酶酶活为指标,采用单因素和正交试验优化红曲糟制曲条件;以酶解率为指标,研究米曲霉最佳产酶条件。结果表明,米曲霉MJY2-5固态制曲的最优条件为红曲糟、麸皮质量比4∶6、发酵温度32 ℃,发酵时间72 h,初始pH值6.7。在此优化条件下,米曲霉产中性蛋白酶及谷氨酰胺酶的酶活分别为(1 891.79±6.34)U/g、(19.96±0.44)U/g。米曲霉产酶最佳条件为初始pH值5.5,酶解温度47 ℃,酶解时间6 h。在此优化条件下,酶解率为(63.42±0.98)%。本研究可促进红曲糟的加工及利用,为红曲糟调味液的研制提供技术支持。
[1]林晓婕,何志刚,梁璋成,等.红曲黄酒糟蛋白酶解物制备工艺优化及营养评价[J].中国粮油学报,2019,34(1):43-49.
[2]刘姗.霉菌种类、酶制剂和黄酒糟酶解物对黄酒发酵影响的研究[D].合肥:合肥工业大学,2019.
[3]曹文涛.红曲霉液态发酵黄酒废弃物产天然食用色素的研究[D].无锡:江南大学,2022.
[4]LI Q H, LU J C, LIU J Y, et al.High-throughput droplet microfluidics screening and genome sequencing analysis for improved amylase-producing Aspergillus oryzae[J].Biotechnol Biofuels,2023,16(1):185.
[5]罗雯,郭建,樊君,等.酱油酿造中复合米曲霉发酵制曲研究[J].中国调味品,2022,47(4):164-166.
[6]AO X L,YU X,WU D T,et al.Purification and characterization of neutral protease from Aspergillus oryzae Y1 isolated from naturally fermented broad beans[J].AMB Express,2018,8:1-10.
[7]MAMO J,KANGWA M,FERNANDEZ-LAHORE H M,et al.Optimization of media composition and growth conditions for production of milkclotting protease(MCP) from Aspergillus oryzae DRDFS13 under solidstate fermentation[J].Braz J Microbiol,2020,51:571-584.
[8]赵燚涛,梁璋成,任香芸,等.红曲糟固态制曲对米曲霉3.042产孢子及产酶特性影响[J].福建农业学报,2023,38(2):238-244.
[9]喻晨,詹飞,程宇勤,等.耐盐性谷氨酰胺酶在酱油发酵过程中的应用与分析[J].食品工业,2023,44(11):41-46.
[10]孙启星,曾小波,李学伟,等.酱油曲中谷氨酰胺酶酶学特性研究[J].中国调味品,2021,46(4):82-85.
[11]国家质量技术监督局.GB 18186—2000 酿造酱油[S].北京:中国标准出版社,2000.
[12]童星,彭勃.一株高酶活力米曲霉菌株的选育及其在酱油生产中的应用[J].中国酿造,2018,37(11):51-55.
[13]中华人民共和国国家卫生健康委员会,国家市场监督管理总局.GB 1886.174—2024 食品添加剂食品工业用酶制剂[S].北京:中国标准出版社,2024.
[14]中华人民共和国国家卫生和计划生育委员会.GB 5009.3—2016 食品安全国家标准食品中水分的测定[S].北京:中国标准出版社,2016.
[15]国家国内贸易局.SB/T 10317—1999 蛋白酶活力测定法[S].上海:中国标准出版社,1999.
[16]滑欢欢,扈圆舒,梁亮,等.一种高产谷氨酰胺酶的米曲霉菌种的筛选及应用的研究[J].现代食品,2022,28(20):78-83.
[17]中华人民共和国国家卫生和计划生育委员会.GB 5009.235—2016 食品安全国家标准食品中氨基酸态氮的测定[S].北京:中国标准出版社,2016.
[18]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 5009.5—2016 食品安全国家标准食品中蛋白质的测定[S].北京:中国标准出版社,2016.
[19]王丽娜,汪卓,高原,等.添加江蓠对酱油制曲及成曲品质的影响[J].食品与发酵工业,2024,50(10):40-47.
[20]李少鹏,夏婷,张竹君,等.枸杞果酒发酵工艺优化及营养功能成分分析[J].中国酿造,2021,40(7):94-100.
[21]扈圆舒,滑欢欢,梁亮,等.通过调节固态发酵大曲pH来实现抑制杂菌和提高蛋白酶活方法的研究[J].现代食品,2023,29(22):190-193.
[22]徐哲萱,杨海龙.米曲霉固态发酵铁皮石斛叶工艺条件的优化[J].现代食品,2023,29(11):43-49.
[23]李少鹏,夏婷,张竹君,等.枸杞果酒发酵工艺优化及营养功能成分分析[J].中国酿造,2021,40(7):94-100.
[24]赵雪,张展开,张智宏,等.酱油酿造过程中微生物及生物酶的研究进展[J].现代食品科技,2024,40(2):329-337.
[25]郭婷,王凤军,周新运,等.米曲霉盐胁迫对酱油发酵理化指标及微生物群落的影响[J].中国酿造,2023,42(6):97-102.
[26]LI C M,CAO L P,LIU T Y,et al.Preparation of soybean meal peptide for chelation with copper/zinc using Aspergillus oryzae in solid-state fermentation[J].Food Biosci,2023,53:102610.
[27]HU W K,LIU Z P,FU B,et al.Metabolites of the soy sauce koji making with Aspergillus niger and Aspergillus oryzae[J].Int J Food Sci Technol,2021,57(1):301-309.