我国是农业大国,农作物秸秆的种类繁多、资源量巨大。因利用率不高,出现秸秆资源供给过剩的问题[1-2]。秸秆主要由纤维素、半纤维素、木质素和可溶性糖等物质组成,其中纤维素含量很高[3]。由于纤维素复杂的结构及其与半纤维素和木质素之间还存在很多交连,其在高温和较低温度下均较为稳定,自然降解难度大[4-6]。寻找合适的降解方式成为了秸秆处理的关键[7]。在众多的秸秆处理方式中,生物处理特别是利用微生物降解秸秆因具有成本低、反应条件温和、产生的有害副产物少等优点,被认为是一种安全、环境友好的处理方式[8-9]。故而筛选高效的纤维素降解菌处理秸秆是一种行之有效的方法。
在自然环境中,许多微生物都具有降解纤维素的能力。现已分离纯化出能够降解纤维素的微生物有细菌、放线菌和真菌等[10],其中以真菌种类居多,产纤维素酶的能力较强[11]。刘清锋等[12]分离出1株青霉菌,其最佳羧甲基纤维素(carboxymethyl cellulose,CMC)酶活性为45.01 IU/mL,滤纸酶活为6.89 IU/mL,其降解稻草粉后糖化率可达40.17%。陈露露[13]从常年覆盖秸秆的土壤中分离得到1株能够高效降解玉米秸秆的烟曲霉菌,静态发酵30 d后玉米秸秆失重率达到了27%。张冬雪等[14-15]分别从水稻田土壤和自然堆肥中分离出真菌草酸青霉和黑曲霉,对水稻秸秆和玉米秸秆的降解率分别达到了45.72%和33.07%。然而,相比真菌,细菌对环境有更强的适应性,且种类更多、生长更快、来源更广,还具有能够产生特异性更高的多酶复合物及应用更广等优点[16-17]。因此对纤维素降解细菌的筛选和研究是十分必要的。
目前,纤维素降解细菌的来源多为土壤和堆肥发酵,从牛羊粪中筛选的研究较少。牛羊为草食性家畜,相比其他动物,其粪便中纤维素含量高,故而纤维素降解菌成为了牛羊粪分解过程中最关键、最活跃的生物因素[18-21]。与舍饲的牛羊相比,放牧养殖的牛羊采食天然牧草,其粪便中的微生物会更加丰富[18]。因此,青海天然牧场的牛羊粪是选育高效纤维素降解菌株的天然宝库。本研究以青海放牧养殖的牛羊粪为研究对象,以羧甲基纤维素钠(CMC-Na)为唯一碳源,采用刚果红染色法筛选具有优良纤维素降解能力的菌株,并通过形态学观察及分子生物学技术对其进行鉴定。以CMC酶活性为响应值,采用单因素试验及Box-Behnken响应面法优化菌株的产酶条件,并评估其对不同秸秆的降解能力,以期为高效降解秸秆菌剂的研制提供优良菌种资源。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
牛羊粪:青海省海北藏族自治州海晏县海西镇牧场。青稞秸秆、藜麦秸秆和油菜秸秆:青海大学农林科学院试验地;菊芋秸秆:青海大学农林科学院园艺创新基地。各类秸秆自然条件下风干粉碎后过40目筛,于阴凉通风处保存备用。
1.1.2 化学试剂
EZUP柱氏细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒、羧甲基纤维素钠(CMC-Na)、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(均为分析纯):生工生物工程(上海)股份有限公司;刚果红(分析纯):上海展云化工有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
富集培养基:CMC-Na 10 g,蛋白胨10.0 g,K2HPO41.0 g,MgSO4·7H2O 0.1 g,MgSO4 0.000 05 g,FeSO4·7H2O 0.015 g,酵母膏10.0 g,蒸馏水1 L,pH 6.0。
初筛培养基:CMC-Na 10.0 g,K2HPO4 1.0 g,NH4NO3 1.0 g,MgSO4·7H2O 0.2 g,CaCl20.02 g,琼脂15.0 g,蒸馏水1 L,pH自然。
LB培养基:酵母膏5.0 g,蛋白胨10.0 g,NaCl 10.0 g,琼脂18.0 g,蒸馏水1 L,pH自然。
滤纸条崩解培养基:滤纸条(1×6 cm),KH2PO4 1 g,NaCl 0.1 g,MgSO4·7H2O 0.3 g,FeCl3 0.01 g,CaCl2 0.1 g,蒸馏水1 L,pH 7.2~7.4。
产酶培养基:CMC-Na 10.0 g,蛋白胨5.0 g,MgSO4·7H2O 0.4 g,KH2PO4 2.0 g,酵母粉5.0 g,NaCl 10.0 g,蒸馏水1 L。pH 6.0。
秸秆发酵培养基:将上述产酶培养基的CMC-Na替换成粉碎过筛后的秸秆。
上述培养基均在121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
MBS-83G型立式压力蒸汽灭菌器:冰山松洋生物科技(大连)有限公司;ZQZY-98C振荡培养箱:上海知楚仪器有限公司;SW-CJ-2FD型洁净工作台:苏州安泰空气技术有限公司;MJ-300B-11细菌培养箱:上海百典仪器设备有限公司;UV2800S型紫外可见分光光度计:上海舜宇恒平科学仪器有限公司;HR/T20MM型立式高速冷冻离心机:湖南赫西仪器装备有限公司;BX3显微镜:奥林巴斯(中国)有限公司。
1.3 方法
1.3.1 菌株的分离与纯化
称取2 g样品加入100 mL灭菌的富集培养基中,35 ℃振荡培养3~5 d。取1 mL培养液转接至装有99 mL富集培养基的三角瓶中,35 ℃振荡培养3~5 d;转接3~5次后,按照梯度稀释法,将稀释菌液10-4~10-8涂布到初筛培养基平板上,35 ℃恒温培养3~7 d。待菌落长出后,挑取形态不同的菌落在初筛培养基上重复划线分离多次得到单菌株,标记编号,并置于LB固体培养基于4 ℃保存。
1.3.2 菌株的筛选
初筛:将得到的纯化菌株点接于初筛培养基平板上培养3 d,刚果红溶液(1 mL/mg)染色30 min,1 mol/L NaCl溶液脱色2~3次,选取水解圈直径与单菌落直径比值较大的菌株。
复筛:对水解值较大的菌株开展滤纸崩解试验。以5%接种量接种至滤纸条崩解培养基中,混匀后置于35 ℃、120 r/min条件下培养7 d,观察并记录滤纸崩解情况。
1.3.3 菌种鉴定
形态学观察:挑取纯化菌株单菌落在LB固体培养基上进行划线,于35 ℃条件下倒置培养至平板上长出清晰菌落,观察菌落形态特征;并挑取单菌落涂片进行革兰氏染色,显微镜下观察菌体形态。
分子生物学鉴定:采用EZUP柱氏细菌基因组DNA抽提试剂盒提取菌株的总DNA,以细菌通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-TACGGCACCTTGTTACGACTT-3')进行PCR扩增。PCR扩增体系(25μL):模板DNA(20ng/μL)1μL,通用引物27F(10μmol/L)和1492R(10 μmol/L)各1 μL,双蒸水(ddH2O)9.5 μL。PCR扩增条件:95 ℃预变性5 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸90 s,共循环30次;72 ℃终延伸10 min。扩增产物经1%琼脂糖凝胶电泳检测后送至上海生工生物工程有限公司进行测序。将获得的序列通过基于局部比对算法的搜索工具(basic local alignment search tool,BLAST)与美国国立生物技术信息中心(national center for biotechnology information,NCBI)GenBank数据库中的已知序列进行同源性比对,并利用MEGA11.0软件对菌株亲缘性相近属种进行分析,采用邻接法(neighbor joining,NJ)构建系统发育树。
1.3.4 酶活性测定
采用DNS法[22]测定CMC酶活性。分别设置对照组和试验组,各3个重复。对照组用于后续调零。1 min内将底物转化为1 μg葡萄糖的酶量定义为1个酶活力单位,U/mL。
1.3.5 生长曲线绘制和产酶时间的测定
将在LB液体培养基中35 ℃振荡培养12 h后的菌液按照1%的接种量接种于产酶培养基中进行培养,同时设置一个不接种菌液的空白样,于35 ℃、190 r/min摇床振荡培养。培养过程的前12 h,每4 h取一次样,之后每12 h取一次样,测定菌液波长600 nm处的吸光度值(OD600nm值)。以取样时间为横坐标,OD600nm值为纵坐标绘制菌株的生长曲线。同时,每24 h取一次样,测定CMC酶活性,连续测定120 h,以确定菌株最佳产酶时间。
1.3.6 菌株产酶条件优化
单因素试验:细菌培养过程中,为避免初期生长过快而导致后期无法合成更多酶类物质,需要选择合适的接种量[23]。在初始发酵培养条件(初始pH 6.0、发酵温度35 ℃、接种量1%、摇床转速190 r/min)[24-25]下,固定其他条件不变,改变单一因素分别考察初始pH值(5.0、6.0、7.0、8.0、9.0)、发酵温度(25 ℃、30 ℃、35 ℃、40 ℃、45 ℃)、接种量(1%、2%、3%、4%、5%)以及摇床转速(170 r/min、180 r/min、190 r/min、200 r/min、210 r/min)对菌株CMC酶活性和OD600 nm值的影响。
响应面试验:在单因素试验的基础上,选择对纤维素降解菌BC-4产CMC酶活性影响较大的3个条件发酵温度(A)、接种量(B)、初始pH值(C)为自变量,以CMC酶活性(Y)为响应值,设计3因素3水平的响应面优化试验,响应面试验因素与水平见表1,优化出最佳的产酶条件组合。
表1 纤维素降解菌BC-4产酶条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for enzyme production conditions optimization of cellulose-degrading bacterium BC-4

水平 A 发酵温度/℃ B 接种量/% C 初始pH值-1 0 1 30 35 40 1 2 3 7.0 8.0 9.0
1.3.7 秸秆降解试验
在制备好的各类秸秆液体发酵培养基中,按照优化条件发酵培养15 d。同时设置不加菌液作为对照(CK),每组均进行3个重复。分别在发酵第5天、第10天和第15天取样。取样后5 000 r/min离心10 min弃上清,用蒸馏水反复清洗,直至无菌体,于80 ℃烘至质量恒定,采用质量损失法计算秸秆降解率,其计算公式如下:
式中:η为降解率,%;W0为对照秸秆残渣干质量,g;W为降解后秸秆残渣干质量,g。
2 结果与分析
2.1 纤维素降解菌的分离筛选
以放牧养殖的牛羊粪为研究对象,从初筛培养基平板中挑取形态、大小、颜色等不同的单菌落,使用刚果红染色法对获得菌株进行检测,结果见表2。由表2可知,共分离得到具有产纤维素酶能力细菌菌株7株,其中3株来自羊粪,4株来自牛粪;其透明圈直径与菌落直径的比值(D/d)在1.5~3.1之间,其中菌株BC-4最高;经滤纸条崩解试验发现,菌株BC-4的崩解程度最高,因此选择菌株BC-4进行后续试验。
表2 7株纤维素降解菌的透明圈大小和滤纸条崩解情况
Table 2 Transparency circle size and filter paper strip disintegration of 7 strains of cellulose-degrading bacteria
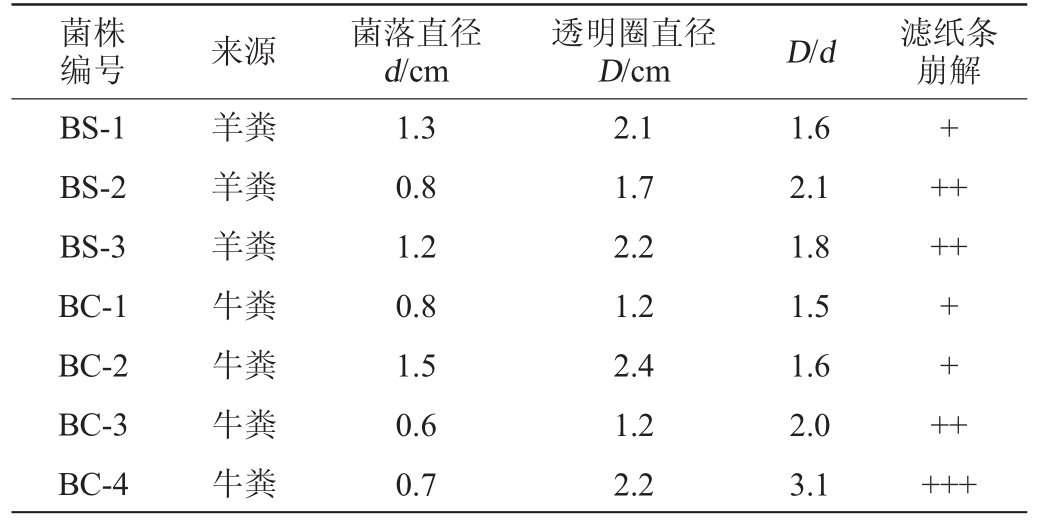
注:“+”表示滤纸没有断裂,出现毛边;“++”表示滤纸出现断裂,没有成糊状;“+++”表示滤纸出现断裂,振荡出现碎片糊状。
菌株编号 来源 菌落直径d/cm透明圈直径D/cm D/d 滤纸条崩解BS-1 BS-2 BS-3 BC-1 BC-2 BC-3 BC-4羊粪羊粪羊粪牛粪牛粪牛粪牛粪1.3 0.8 1.2 0.8 1.5 0.6 0.7 2.1 1.7 2.2 1.2 2.4 1.2 2.2 1.6 2.1 1.8 1.5 1.6 2.0 3.1++++++++++++
2.2 纤维素降解菌BC-4的鉴定
2.2.1 形态学观察
由图1a可知,培养3 d后,菌株BC-4在平板上形成边缘整齐,表面湿润,不透明的菌落;由图1b可知,在光学显微镜下观察,菌体细胞呈杆状,两端钝圆,单个、成对或成串出现。

图1 菌株BC-4的菌落(a)及细胞(b)形态
Fig.1 Colony (a) and cell (b) morphology of strain BC-4
2.2.2 分子生物学鉴定
基于16S rDNA序列构建系统发育树,结果见图2。由图2可知,菌株BC-4与Bacillus sonorensis L46亲缘关系最接近(序列相似性达到100%),结合形态学特性,菌株BC-4被鉴定为索诺拉沙漠芽孢杆菌(Bacillus sonorensis)。

图2 菌株BC-4基于16S rDNA基因序列的系统发育树
Fig.2 Phylogenetic tree of strain BC-4 based on 16S rDNA gene sequences
2.3 菌株BC-4的生长曲线及最佳产酶时间确定
由图3可知,菌株BC-4在0~24 h处于对数生长期,菌体大量繁殖,且生长速率较快,具有较强的适应能力[26];24 h后菌体生长放缓,但仍持续增长;60 h后进入平稳期,菌株生长速率逐渐降低,菌体数量基本稳定。同时,随着发酵时间从24~72 h,菌株BC-4的CMC酶活性持续升高,在72 h时达到最大值63.4 U/mL;但在72 h后,CMC酶活性并未随发酵时间的延长而进一步提高。结果表明,菌株BC-4的最佳发酵产酶时间为72 h,因此后续试验均在发酵72 h后开展。
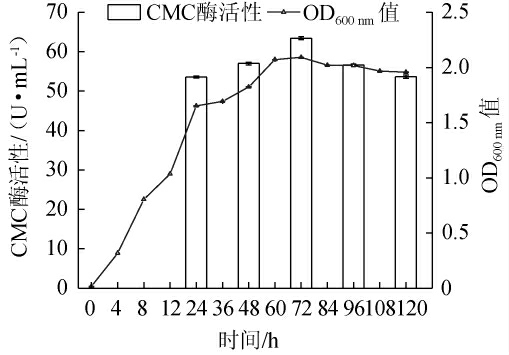
图3 菌株BC-4的生长曲线及产酶曲线
Fig.3 Growth and enzyme production curves of strain BC-4
2.4 纤维素降解菌的产酶条件优化
2.4.1 纤维素降解菌的产酶条件优化单因素试验
在微生物生长和繁殖过程中,pH是影响其生长和代谢的重要因素[27-29]。由图4a可知,菌株BC-4在初始pH值5.0~9.0的范围内均能生长,说明其pH适应性较广。同时,发酵液在初始pH值5.0~9.0范围内的CMC酶活性随pH值的升高呈先上升后下降的趋势;当初始pH值为8.0时,发酵液CMC酶活性最高为82.1 U/mL。因此,选择最佳初始pH值为8.0。
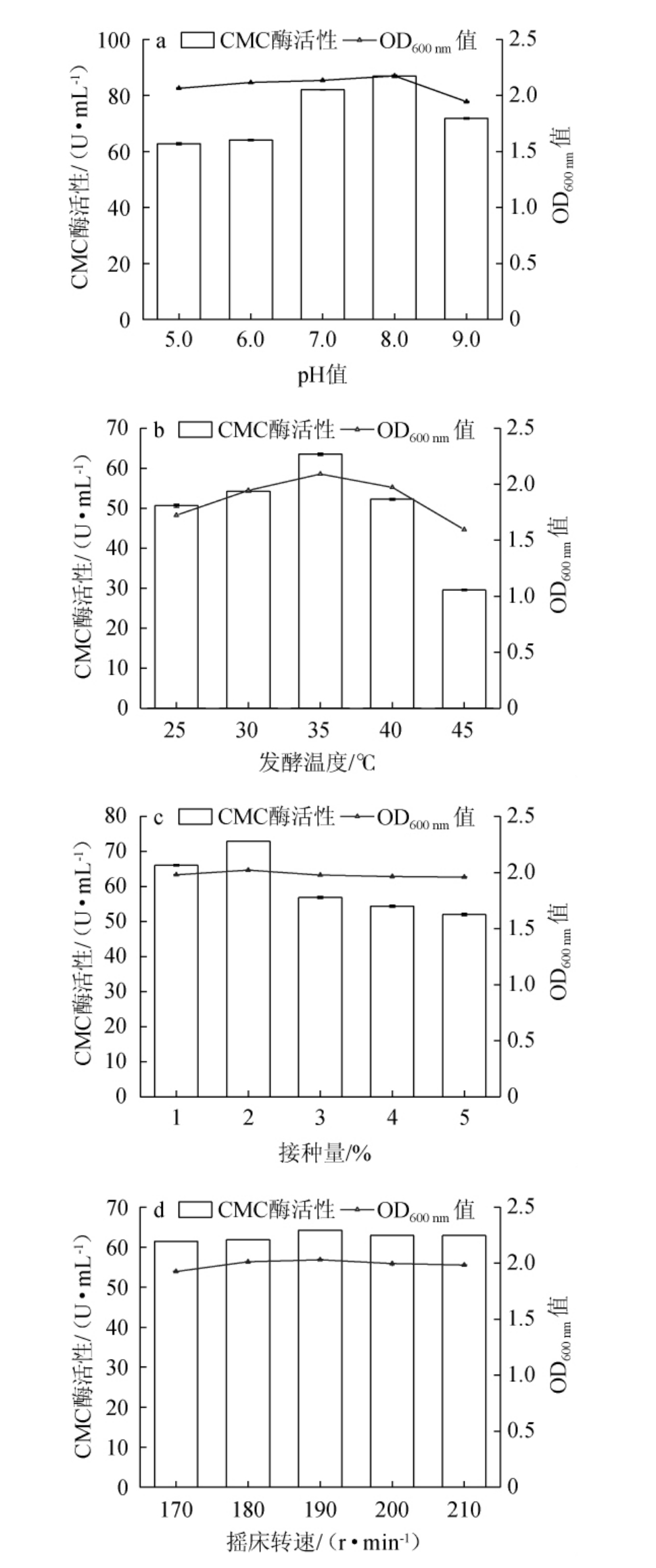
图4 初始pH值(a)、发酵温度(b)、接种量(c)、摇床转速(d)对纤维素降解菌BC-4生长及羧甲基纤维素酶活性的影响
Fig.4 Effects of initial pH (a), fermentation temperature (b), inoculum(c) and shaking speed (d) on the growth of cellulose degrading bacterium BC-4 and the carboxymethyl cellulose activities
由图4b可知,随发酵温度的升高,菌株BC-4的生长及发酵液CMC酶活性均呈先上升后下降的趋势;当发酵温度升高至45 ℃时,菌株生长受到明显抑制,OD600nm值仅有1.6;此时的发酵液CMC酶活性也较低,仅有29.6 U/mL。可能因为温度较高时,细菌生长受到抑制,且高温容易引起酶蛋白变性,导致酶活性降低[30-32]。菌株BC-4在发酵温度为35 ℃时生长最佳,CMC酶活性最高为63.5 U/mL。因此,选择最佳发酵温度为35 ℃。由图4c可知,接种量对菌株BC-4的生长影响不大,随接种量的升高,发酵液CMC酶活性呈先上升后下降的趋势;接种量为2%时,发酵液CMC酶活性最大,为72.9 U/mL。因此,选择最佳接种量为2%。由图4d可知,摇床转速对菌株BC-4的生长及发酵液CMC酶活影响不大,摇床转速为190 r/min时,OD600 nm值最高为2.03,发酵液CMC酶活性最高为64.3 U/mL。因此,选择最佳摇床转速为190 r/min。
2.4.2 纤维素降解菌的产酶条件优化响应面试验
纤维素降解菌的产酶条件优化Box-Behnken试验设计及结果见表3。用Design-Expert 10.0软件对表3数据进行拟合分析得到二次多项回归方程为:
表3 纤维素降解菌的产酶条件优化Box-Behnken试验设计及结果
Table 3 Design and results of Box-Behnken tests for enzyme production conditions optimization of cellulose degrading bacteria
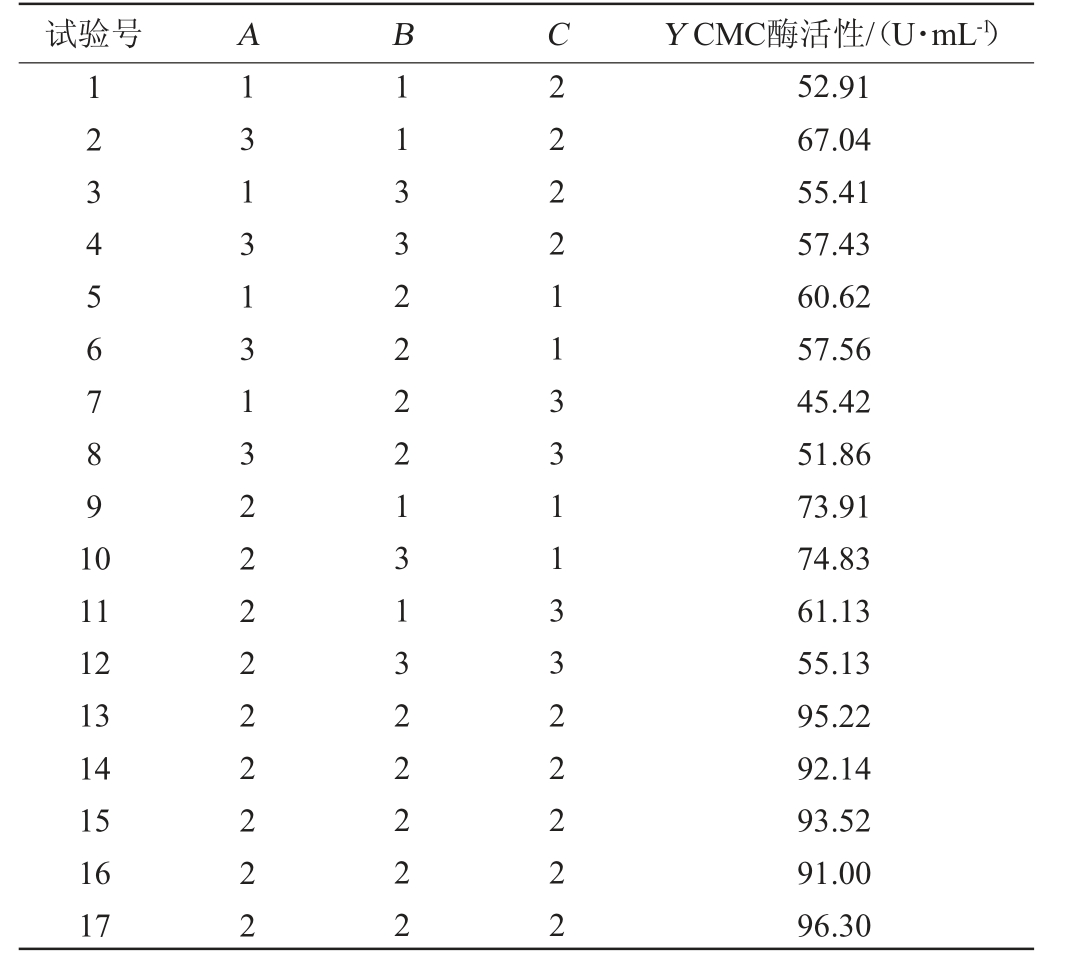
试验号 A B C Y CMC酶活性/(U·mL-1)1234567891 0 11 12 13 14 15 16 17 13131313222222222 11332222131322222 22221133113322222 52.91 67.04 55.41 57.43 60.62 57.56 45.42 51.86 73.91 74.83 61.13 55.13 95.22 92.14 93.52 91.00 96.30
Y=93.64+2.44A-1.52B-6.67C-3.03AB+2.37AC-1.73BC-23.91A2-11.53B2-15.86C2
由表4可知,模型P<0.000 1,极显著;失拟项P=0.183 2>0.05,不显著,表明回归方程与试验结果拟合较好。由各因素的P值可知,一次项A对CMC酶活性影响显著(P<0.05),一次项C,二次项A2、B2、C2对CMC酶活性影响极显著(P<0.01)。由F值可知,各因素对CMC酶活性影响程度表现为初始pH值(C)>发酵温度(A)>接种量(B)。
表4 回归模型方差分析
Table 4 Variance analysis of regression model

注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型ABCA B***4 937.41 47.68 18.57 356.18 36.66 22.56 11.97 2 407.46 559.44 1 059.01 56.47 37.66 18.81 4 993.88 91111111117341 6 548.60 47.68 18.57 356.18 36.66 22.56 11.97 2 407.46 559.44 1 059.01 8.07 12.55 4.70 68.01 5.91 2.30 44.15 4.54 2.80 1.48 298.44 69.35 131.28<0.000 1 0.045 3 0.172 9 0.000 3 0.070 5 0.138 4 0.262 6<0.000 1<0.000 1<0.000 1**AC BC A2 B2 C2残差失拟项纯误项总离项******2.67 0.183 2不显著R2=0.988 7
2.4.3 验证试验
利用Design Expert 10.0软件对回归方程进行求解,得到纤维素降解菌BC-4产CMC酶最优条件为pH 7.796 6、发酵温度35.223 4 ℃、接种量1.943 6%,在此条件下的CMC酶活性预测值为94.4 U/mL。为了方便实际操作,修改条件为pH 8、发酵温度35 ℃、接种量2%,在优化条件下进行3次重复试验后得到的CMC酶活性的平均值为93.7 U/mL,与预测值接近,相对误差<5%,说明该验证模型有效。
2.5 秸秆降解试验
菌株BC-4对4种秸秆发酵5~15 d的降解效果见图5。
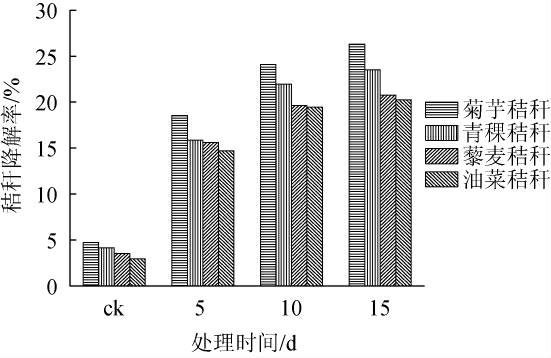
图5 菌株BC-4对不同秸秆的降解效果
Fig.5 Degradation effect of strain BC-4 on different stalks
由图5可知,未添加菌株BC-4时,15 d后4种秸秆的降解率仅为2.95%~4.75%;在添加菌株BC-4后,4种秸秆在第5天和第10天的降解率分别达到了14.70%~18.55%和19.45%~24.10%,而第15天时对菊芋秸秆、青稞秸秆、藜麦秸秆和油菜秸秆的降解率分别为26.3%、23.5%、20.8%和20.3%,平均降解率达到了22.7%。其中,对菊芋秸秆降解率最高,较其CK提高了21.5%,说明菌株BC-4能够很好的降解各类秸秆,且木质素含量越低的秸秆降解相对越容易[33-37]。周泽等[21]从新鲜羊粪中分离出7株细菌,对秸秆降解率均在15%以上。本研究中筛选得到的菌株BC-4对4种秸秆的降解率均在20.3%以上,且对菊芋秸秆的降解率达到了26.3%,说明菌株BC-4在降解秸秆方面具有很大的潜力,能够成为后续高效降解秸秆菌剂的优良菌种资源。
3 结论
本研究以青海天然牧场的牛羊粪为研究对象进行了纤维素降解菌的筛选,获得了一株索诺拉沙漠芽孢杆菌(Bacillus sonorensis),命名为BC-4。通过响应面优化试验确定菌株BC-4的最优产酶条件为:初始pH8,接种量2%,发酵温度35 ℃。在此优化条件下,CMC酶活性达到了93.7 U/mL。同时,菌株BC-4对不同秸秆均具有较好的降解效果,其中对菊芋降解率可达到26.3%,表明该菌株具有良好的秸秆降解潜力,能够为后续高效降解秸秆菌剂的开发和研制提供一定的理论指导。
[1]王红梅,屠焰,张乃锋,等.中国农作物秸秆资源量及其“五料化”利用现状[J].科技导报,2017,35(21):81-88.
[2]毕于运,高春雨,王红彦,等.农作物秸秆综合利用和禁烧管理国家法规综述与立法建议[J].中国农业资源与区划,2019,40(8):1-10.
[3]HARUTA S,CUI Z,HUANG Z,et al.Construction of a stable microbial community with high cellulose degradation ability[J].Appl Microbiol Biotechnol,2002,59:529-534.
[4]HONEINA K, KANEKOA G, KATSUYAMAB I, et al.Studies on the cellulose-degrading system in a shipworm and its potential applications[J].Energy Procedia,2012,18:1271-1274.
[5]BILAL M,IQBAL H M N,HU H B,et al.Metabolic engineering and enzyme-mediated processing: A biotechnological venture towards biofuel production-a review[J].Renew Sust Energ Rev,2018,82:436-447.
[6]李健.三株耐低温纤维素降解菌的筛选及性能研究[D].哈尔滨:东北农业大学,2019.
[7]常燕青,宫亚斌,谭婧,等.秸秆预处理技术探讨及试验研究[J].中国沼气,2021,39(2):35-42.
[8]张国言.高效纤维素降解菌株筛选及其复合微生物菌剂在堆肥中的应用研究[D].济南:山东农业大学,2024.
[9]YU J,ZHANG J B,HE J,et al.Combinations of mild physical or chemical pretreatment with biological pretreatment for enzymatic hydrolysis of rice hull[J].Bioresource Technol,2009,100(2):903-908.
[10]李君风.牦牛瘤胃中高效纤维素降解菌的分离、鉴定及其在青贮中的应用研究[D].南京:南京农业大学,2022.
[11]宁露佳.酒糟纤维素降解菌的筛选、发酵条件优化及应用[D].石家庄:河北大学,2023.
[12]刘清锋,支晓鹏,徐惠娟,等.纤维素降解菌青霉T242的分离及产酶特性[J].工业微生物,2007,37(3):1519.
[13]陈露露.玉米秸秆降解菌的分离鉴定及其降解性能研究[D].哈尔滨:黑龙江科技大学,2019.
[14]张冬雪,文亚雄,罗志威,等.纤维素降解菌的分离筛选及其对水稻秸秆的降解效果分析[J].江西农业学报,2020,32(1):72-76.
[15]杨娜,何鑫,杜春梅.一株纤维素降解菌的筛选与鉴定[J].中国农学通报,2021,37(17):26-31.
[16]VENTORINO V,ALIBERTI A,FARACO V,et al.Exploring the microbiota dynamics related to vegetable biomasses degradation and study of lignocellulose-degrading bacteria for industrial biotechnological application[J].Sci Rep,2015,5:8161.
[17]刘瑞,郭琪,曹颖,等.一株竹木质素降解菌的筛选及降解效果[J].微生物学通报,2024,51(6):2170-2181.
[18]冷艳.青藏高原牦牛粪降解微生物多样性及其应用研究[D].兰州:兰州交通大学,2015.
[19]杨敬辉,吴琴燕,陈宏州,等.发酵床猪粪腐解菌群筛选[J].生态学杂志,2012,31(3):659-663.
[20]单建荣,全鑫,朱用哲,等.一株低温纤维素降解菌的筛选与产酶条件优化[J].生态学杂志,2021,40(4):1128-1136.
[21]周泽,付卫刚,雷杨,等.羊粪中纤维素降解菌的筛选、鉴定及评价[J].草地学报,2023,31(11):3535-3542.
[22]康鑫.高产纤维素酶菌株筛选、诱变选育及其秸秆降解效果研究[D].哈尔滨:东北农业大学,2022.
[23]钟斌,陶文玲,倪思毅,等.一株纤维素降解菌的筛选、鉴定及产酶条件优化[J].江西农业大学学报,2021,43(5):1167-1177.
[24]崔登雪.产纤维素酶芽胞杆菌的筛选鉴定及产酶条件优化[D].哈尔滨:东北农业大学,2018.
[25]李爽.秸秆纤维素降解菌株的筛选鉴定及产酶条件的优化[D].哈尔滨:东北农业大学,2019.
[26]王永伦,余克非,郑展望.1株耐高温纤维素降解菌发酵条件优化与秸秆降解应用[J].江苏农业科学,2023,51(19):229-236,244.
[27]倪小英,张永普,贾守菊,等.pH和温度对小荚蛏淀粉酶和纤维素酶活性的影响[J].海洋湖沼通报,2009,(1):151-154.
[28]王希国,杨谦,燕红.高效降解纤维素菌株的筛选与鉴定[J].黑龙江畜牧兽医,2007(8):70-71.
[29]温冬灼,张智,魏罡,等.纤维素降解芽孢杆菌筛选及产酶条件优化[J].中南林业科技大学学报,2022,42(2):169-180.
[30]冯海玮,周培,毛亮,等.一株高效纤维素降解菌的筛选及其产酶条件优化[J].上海交通大学学报(农业科学版),2013,31(2):24-29.
[31]张元昊,李豪,张敏琪,等.一株蚕沙纤维素降解菌的鉴定及产酶优化和生物强化效果[J].蚕业科学,2023,49(6):551-559.
[32]张慧,赵恪,林陈强,等.纤维素降解菌的分离筛选及产酶条件优化[J].福建农业学报,2023,38(9):1117-1123.
[33]孟艳,李屹,陈来生,等.HCl和NaOH预处理对菊芋秸秆产甲烷潜力的影响[J].可再生能源,2023,41(2):174-179.
[34]柳丽,杜中平,李屹,等.NaOH预处理对青稞秸秆厌氧发酵特性的影响[J].中国农业科技导报,2022,24(8):192-200.
[35]张琴萍,邢宝,周帮伟,等.藜麦饲用研究进展与应用前景分析[J].中国草地学报,2020,42(2):162-168.
[36]王亦闻,伍玉鹏,王砚,等.油菜秸秆饲料化潜力及展望[J].农学学报,2020,10(5):77-83.
[37]宋雨,白红娟,胡锦俊,等.秸秆纤维素降解菌的分离筛选、复合菌系构建及产酶条件优化[J].中国酿造,2023,42(2):108-114.