富含木质纤维素的农业废弃物如甘蔗渣(含40%~50%纤维素)、稻秆(含32%~47%纤维素)等产量高、廉价且环保,是获得各种增值产品的可再生资源[1-3]。据估计,全球每年有7.41亿~11.11亿t稻秆产生,到2024年,全球甘蔗产量将超过22.1亿t,进而产生达2.8亿t的甘蔗渣[1,4]。近年来,甘蔗渣和稻秆常被用作造纸、发酵和发电的原料,但其高值化利用(生物炼制)潜力尚未被充分开发,且仍有大部分被直接丢弃或作为废物在田间焚烧,造成空气污染,甚至损害人和动物的呼吸系统[1,4]。
木质纤维素的生物炼制首先需要纤维素酶的解聚作用,纤维素酶是由内切-β-1,4-葡聚糖酶(EC 3.2.1.4)、外切纤维二糖水解酶(EC 3.2.1.91)和β-葡萄糖苷酶(EC 3.2.1.21)组成的复合酶系[5-6],被广泛应用于食品、饮料、造纸和纸浆、纺织、生物洗涤剂、饲料、制药和生物燃料(替代能源)的生产[5-8]。纤维素酶主要来源于植物、动物、原生动物和微生物,但相较于植物和动物纤维素酶,微生物纤维素酶具有操作方便、生长快、易于遗传物质操纵、在恶劣条件下酶促稳定性好、生产简单、成本低等优点[9]。此外,与其他微生物产酶相比,木霉(Trichoderma)、曲霉(Aspergillus)、青霉(Penicillium)和腐质霉(Humicola)等真菌属的纤维素酶产率更高,目前,大多数商业纤维素酶是从真菌中获得的[7,10-11]。虽然纤维素酶约占全球酶市场的20%,但较高的生产成本和较低的产量仍是制约工业酶应用的瓶颈[5,10]。因此,这些富含木质纤维素的农业废弃物可以作为真菌的发酵底物,以实现高值化利用的同时高效生产纤维素酶[5]。其中,培养组分和条件参数的优化是酶经济合成和商业化的关键步骤,对提高酶产率和降低生产成本具有实质性的意义[10]。
现阶段,真菌生产纤维素酶的技术主要有固态发酵(solid-state fermentation,SSF)和深层液体发酵(submerged fermentation,SmF)两种[12-13]。为方便管理和控制温度、pH等非生物参数,大多数酶制剂生产公司使用SmF技术进行酶生产。SSF技术越来越突显出其优势[14]。首先,发酵基质不必经过复杂的预处理,可以直接使用木质纤维素等原料来诱导酶的产生,发酵过程静置、操作简易、工艺简单[7,13]。其次,SSF可模拟土壤微生物的自然栖息地,多种微生物可以在没有或几乎没有自由流动的水的固体表面上生长,相较于SmF更利于保持其高活力,如草酸青霉(Penicillium oxalicum)可以在低含水量的固体材料上快速生长[14-15]。此外,投资成本和能耗低,发酵结束后酶-底物-菌易分离,产品回收率和产率提升[7]。最后,SSF技术因其用水量减少、无废水废渣产生、不造成对环境的二次污染而得到认可[7]。目前,已有研究报道了利用农工业残留物,如甘蔗渣、稻米副产物、麦麸、米糠、竹子、原油棕榈叶、荨麻生物质、啤酒糟和藤蔓枝条作为纤维素酶生产的SSF底物[16-23]。总之,从各种农业废弃物中生产纤维素酶已被广泛实践,但是所得的酶活性仍然很低[24]。
本研究旨在利用廉价、可广泛获取的农业废弃物如甘蔗渣、稻秆等,从实验室保藏菌种库中筛选高产纤维素酶的菌株,并通过形态学观察及分子生物学技术对其进行菌种鉴定。以纤维素酶活力为评价指标,利用单因素和正交试验优化筛选菌株SSF产酶条件,提高纤维素酶产率。将筛选菌株与已报道高产纤维素酶菌株进行纤维素酶活力比对分析,评估其产业化应用潜能。最后,对其粗纤维素酶的酶学性质进行初步研究。本研究将为农业废弃物的高值化利用和降低纤维素酶的生产成本提供了一定的理论参考,具有十分重要的应用价值和环保意义。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
12株真菌菌株(BW1、BW3、BW4、BW6、H1、H2、H3、LQ2、LQ8、LT1、LX2、SC1):分离自广西各地甘蔗地,保藏于本实验室;草酸青霉(Penicillium oxalicum)EU2101[25]及EU2106[26]:由广西大学冯家勋课题组提供;麦麸、甘蔗渣、稻秆:市售,经烘干及粉碎后过20目筛后备用;定量滤纸(1 cm×6 cm):GE Healthcare Life Sciences China网站。
1.1.2 化学试剂
羧甲基纤维素钠、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(均为分析纯):上海源叶生物科技有限公司;酵母粉、蛋白胨(均为生化试剂):北京兰杰柯科技有限公司;其余试剂均为国产分析纯。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA):美国BD公司。
基础盐溶液培养基[25]:酵母粉5.0 g,KH2PO4 2.5 g,MgSO4·7H2O 2.5 g,吐温-80 1.0 mL,微量元素混合溶液(2.5 g/L MgSO4·7H2O、0.8 g/L MnSO4·7H2O、0.9 g/L ZnCl2、1.0 g/L CoCl2,自然pH)0.1 mL,蒸馏水1 000 mL,用HCl溶液调节pH至5.0,121 ℃高压蒸汽灭菌20 min。
固态发酵培养基[27]:每250 mL三角瓶中称量干发酵基质5.0 g(麦麸+甘蔗渣+稻秆=2 g+0 g+3 g),121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
LDZF-50L高压灭菌锅:上海申安医疗器械厂;ZQZY-78CE振荡培养箱:上海知楚仪器有限公司;SAP18恒温水浴槽:英国GRANT公司;SpectraMax ABS 96孔板全波段酶标仪:美谷分子仪器(上海)有限公司;Q5000超微量分光光度计:北京东林昌盛生物科技有限公司;SimpliAmP聚合酶链式反应(polymerase chain reaction,PCR)仪、Sorvall ST1R Plus水平冷冻离心机:赛默飞世尔科技(中国)有限公司;WD-9413B凝胶成像仪、DYCP-31DN电泳仪:北京六一生物科技有限公司;DHG-9240A恒温鼓风干燥箱:上海一恒科学仪器有限公司。
1.3 方法
1.3.1 高产纤维素酶菌株的筛选
参考ZHAO S等[25]的方法并稍加改动,将实验室保藏的12株真菌菌株接种于PDA培养基中,28 ℃条件下恒温静置培养120 h,用已灭菌的0.1%吐温-80溶液制备种子液并进行显微镜计数;将种子液按1.0×108个孢子接种于50 mL基础盐溶液培养基中,于28 ℃、180 r/min条件下培养24 h;取10 mL发酵液接种于固态发酵培养基中,充分搅拌混匀,于28 ℃条件下恒温静置培养6 d,测定滤纸酶(filter paper cellulase,FPase)活力,筛选高产纤维素酶菌株,并进一步测定高产纤维素酶菌株的羧甲基纤维素酶(carboxymethyl cellulase,CMCase)活力。
1.3.2 纤维素酶活力的测定
固态发酵结束后加入100 mL蒸馏水,28 ℃、180 r/min培养30 min,8层纱布过滤,取滤液后4 000 r/min离心10 min,上清液即为粗酶液[26]。根据ZHANG T等[27]的方法测定FPase及CMCase活力,以U/g干发酵基质(U/g)表示。酶活力单位定义[27]:在特定反应条件下,1 min水解底物生成1 μmol还原糖所需的酶量为1 U。
1.3.3 筛选菌株的鉴定
形态学观察:将筛选菌株划线接种于PDA培养基上,28 ℃条件下恒温静置培养5 d后,观察菌落形态。将筛选菌株接种于含1%葡萄糖的基础盐溶液培养基中,28 ℃、180 r/min条件下培养24 h,每隔12 h采用电子显微镜观察孢子萌发状态;取100 μL 1.0×105个孢子/mL孢子悬浮液涂布于PDA培养基平板上,插片倒置培养60 h后显微镜观察细胞形态。
分子生物学鉴定:参照祝晓飞等[28]的方法提取筛选菌株的基因组脱氧核糖核酸(deoxyribonucleic acid,DNA),并以其为模板,采用真菌内部转录间隔区(internal transcribed spacer,ITS)序列通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')通过PCR扩增转录间隔区。PCR扩增体系(25 μL):DNA模板2.0 μL、引物IST1和IST4各1.0 μL、2×Phanta MAX Master Mix 12.5 μL、双蒸水(ddH2O)8.5 μL。PCR扩增条件:95 ℃预变性3 min;95 ℃变性15 s,56 ℃退火15 s,72 ℃延伸60 s,共35个循环;72 ℃再延伸5 min。采用0.8%琼脂糖凝胶检测PCR扩增产物,将检测合格的PCR扩增产物委托生工生物工程(上海)股份有限公司进行测序。将测序结果提交至美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源序列比对分析,选取同源性较高的模式菌株的ITS基因序列,采用MEGA7.0软件中的邻接法(neighbor joining,NJ)法构建系统发育树。
1.3.4 筛选菌株产纤维素酶固态发酵工艺优化单因素试验
在方法1.3.1基础上,通过改变单一条件,分别考察干发酵基质组合(麦麸+甘蔗渣+稻秆=2.0 g+0 g+3.0 g、2.0 g+3.0 g+0 g、2.0 g+1.5 g+1.5 g、1.0 g+2.0 g+2.0 g、1.0 g+1.5 g+2.5 g和1.0 g+2.5 g+1.5 g)、基础盐溶液培养基中氮源种类(酵母粉、硫酸铵、蛋白胨、尿素、硝酸钾)、发酵液添加量(6 mL、8 mL、10 mL、12 mL、14 mL)、发酵温度(24 ℃、26 ℃、28 ℃、30 ℃、32 ℃)及发酵时间(3 d、4 d、5 d、6 d、7 d)对筛选菌株产纤维素酶活力的影响。
1.3.5 筛选菌株产纤维素酶固态发酵工艺优化正交试验
选取发酵液添加量(A)、发酵温度(B)和发酵时间(C)为考察因素,以FPase和CMCase活力为评价指标,进行3因素3水平的L9(33)正交试验,试验因素与水平见表1。
表1 筛选菌株产纤维素酶固态发酵工艺优化正交试验因素与水平
Table 1 Factors and levels of orthogonal tests for solid-state fermentation process optimization of cellulase production by screened strain

水平 A 发酵液添加量/mL B 发酵温度/℃ C 发酵时间/d 1 2 3 6 8 1 0 24 26 28 4 5 6
1.3.6 产酶应用潜能评估
将筛选菌株及草酸青霉菌株EU2101和EU2106在最优固态发酵工艺条件下进行发酵,测定纤维素酶活力,以评估其应用潜能。
1.3.7 纤维素酶的酶学性质研究
(1)最适反应温度及温度稳定性分析
将粗酶液分别于30~70 ℃条件下测定纤维素酶活力,设定最高酶活力为100%,计算不同温度下的相对酶活力。将粗酶液分别于45 ℃、50 ℃、55 ℃条件下保温1 h,在50 ℃、pH 4.0条件下测定纤维素酶活力,设定未保温纤维素酶活力为100%,每隔15 min取样检测剩余酶活力,计算相对酶活力。
(2)最适反应pH及pH稳定性分析
将粗酶液加入不同pH(3.0~7.0)底物缓冲液中测定纤维素酶活力,设定最高酶活力为100%,计算不同pH下的相对酶活力。将粗酶液用0.1 mol/L柠檬酸-Na2HPO4(pH 3.0~7.0)缓冲溶液稀释5倍,4 ℃冰箱静置24 h后在50 ℃、pH 4.0条件下下测定残余酶活力,设定未处理的纤维素酶酶活力为100%,计算相对酶活力。
1.3.8 数据处理与统计分析
所有试验均重复3次,结果以“平均值±标准差”表示,使用SPSS 27.0进行单因素方差分析和正交试验方差分析;采用Microsoft Excel 2021、PowerPoint 2021进行图表绘制。
2 结果与分析
2.1 高产纤维素酶活力菌株的筛选
12株真菌菌株的FPase活力测定结果见图1。
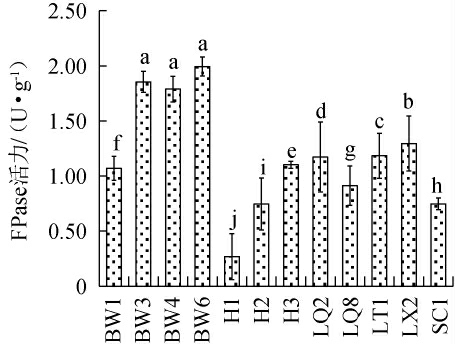
图1 12株真菌菌株的滤纸酶活力测定结果
Fig.1 Determination results of filter paperase activities of 12 fungal strains
不同字母表示差异显著(P<0.05)。
由图1可知,菌株BW3、BW4、BW6的FPase活力显著高于其他菌株(P<0.05),其中菌株BW6的FPase活力最高,达到1.99 U/g。因此,选择菌株BW6为高产纤维素酶活力的菌株。进一步测定菌株BW6的CMCase活力,结果CMCase活力达到7.02 U/g。
2.2 高产纤维素酶活力菌株BW-6的鉴定
2.2.1 形态学观察
菌株BW-6在PDA培养基上的菌落形态和显微形态见图2。由图2可知,菌株BW-6的菌落呈浅绿色,毛绒蓬松状;产生的分生孢子近球形,分枝呈金字塔形,分生孢子倾向于聚集在分枝上,类似“葡萄串”,且分生孢子在富营养状态下萌发产生分叉菌丝。与已报道的棘孢木霉(Trichoderma asperellum)表型类似[29-30]。
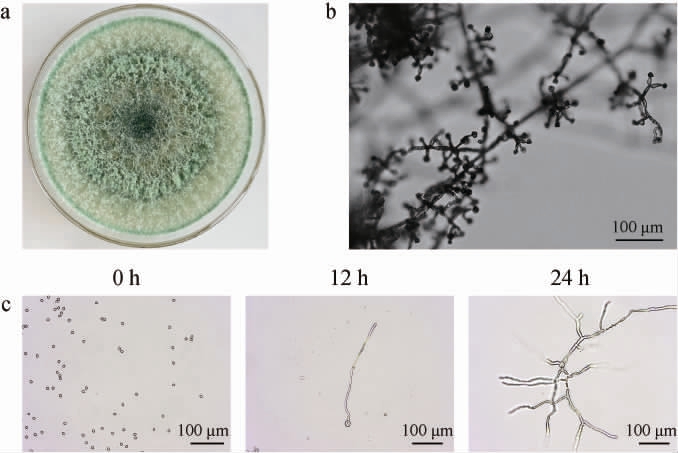
图2 菌株BW-6的菌落(a)、菌丝及细胞(b、c)形态
Fig.2 Colony (a), mycelium and cell(b, c) morphology of strain BW-6
2.2.2 分子生物学鉴定
基于ITS基因序列构建菌株BW-6的系统发育树,结果见图3。由图3可知,菌株BW-6的ITS基因序列与棘孢木霉(Trichoderma asperellum)upm13(MK027316.1)聚于同一分支,亲缘关系最近,同源性达到99.83%。结合形态学特征,鉴定菌株BW-6为棘孢木霉(Trichoderma asperellum)。

图3 基于ITS基因序列菌株BW-6的系统发育树
Fig.3 Phylogenetic tree of strain BW-6 based on ITS gene sequences
2.3 棘孢木霉BW-6固态发酵产酶条件优化
2.3.1 干发酵基质组合对棘孢木霉BW-6产纤维素酶活力的影响
由图4可知,当干发酵基质为麦麸+甘蔗渣+稻秆=2.0 g+0 g+3.0 g时,棘孢木霉BW-6的FPase活力最高,为2.07 U/g;当干发酵基质为麦麸+甘蔗渣+稻秆=2.0 g+1.5 g+1.5 g时,棘孢木霉BW-6的CMCase活力最高,为7.68 U/g。综合二者酶活力分析,为充分利用各类农业废弃物,确定最佳的干发酵基质为麦麸+甘蔗渣+稻秆=2.0 g+1.5 g+1.5 g。
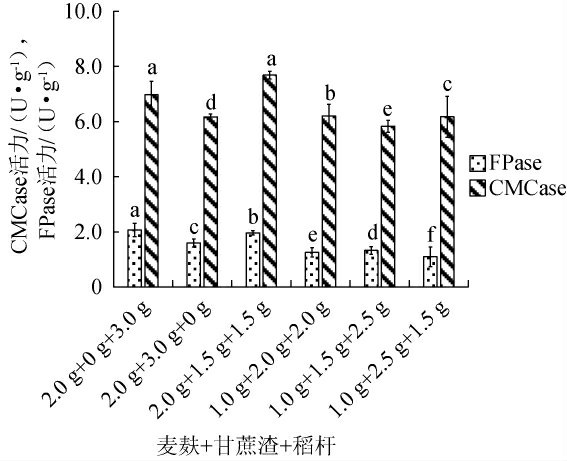
图4 干发酵基质组合对棘孢木霉BW-6产纤维素酶活力的影响
Fig.4 Effect of dry fermentation substrate combinations on cellulase activities produced by Trichoderma asperellum BW-6
2.3.2 基础盐溶液培养基中氮源种类对棘孢木霉BW-6产纤维素酶活力的影响
由图5可知,当基础盐溶液培养基中氮源为蛋白胨时,棘孢木霉BW-6的FPase活力和CMCase活力均最高,分别达到2.68 U/g和8.44 U/g。相比于其他氮源,蛋白胨提供了更丰富和全面的氮源,有利于微生物的生长和酶的产生[29]。因此,确定蛋白胨为基础盐溶液培养基中的最佳氮源。
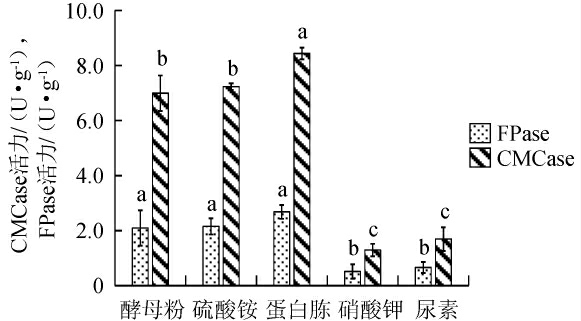
图5 基础盐溶液培养基中氮源种类对棘孢木霉BW-6产纤维素酶活力的影响
Fig.5 Effect of nitrogen source types in basic salt solution medium on cellulase activities produced by Trichoderma asperellum BW-6
2.3.3 发酵液添加量对棘孢木霉BW-6产纤维素酶活力的影响
由图6可知,随着发酵液添加量的升高,棘孢木霉BW-6的FPase和CMCase活力呈先升高后下降的趋势,当发酵液添加量为8 mL时,FPase和CMCase活力均达到最高,分别为1.99 U/g和7.96 U/g,因此,确定最佳发酵液添加量为8 mL。
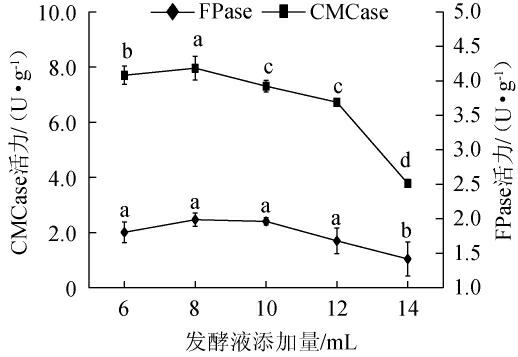
图6 发酵液添加量对棘孢木霉BW-6产纤维素酶活力的影响
Fig.6 Effect of fermentation broth addition on cellulase activities produced by Trichoderma asperellum BW-6
2.3.4 发酵温度对棘孢木霉BW-6产纤维素酶活力的影响
木霉菌的最适产酶温度会因不同的木霉菌种类和所产生的酶类而有所不同[31]。由图7可知,随着发酵温度的升高,FPase和CMCase活力呈先升高后下降的趋势,当发酵温度为26℃时,FPase及CMCase酶活力均达到最高,分别为2.27U/g、9.27 U/g。因此,确定最适发酵温度为26 ℃。
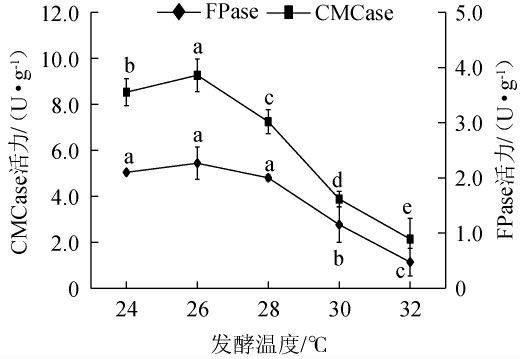
图7 发酵温度对棘孢木霉BW-6产纤维素酶活力的影响
Fig.7 Effect of fermentation temperature on cellulase activities produced by Trichoderma asperellum BW-6
2.3.5 发酵时间对棘孢木霉BW-6产纤维素酶活力的影响
由图8可知,当发酵时间<5 d时,随着发酵时间的延长,纤维素酶活力逐渐上升;当发酵5 d时,FPase和CMCase活力均达到最高,分别为2.29 U/g和8.02 U/g;而后随着发酵时间的延长,底物逐渐耗尽、抑制物质积累、酶的失活以及环境条件变化等因素共同作用导致纤维素酶活力也随之下降[31]。因此,确定最佳发酵时间为5 d。
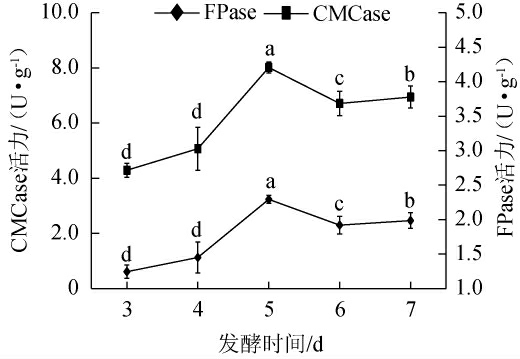
图8 发酵时间对棘孢木霉BW-6产纤维素酶活力的影响
Fig.8 Effect of fermentation time on cellulase activities produced by Trichoderma asperellum BW-6
2.3.6 正交试验结果及分析
在单因素试验的基础上,确定干发酵基质为麦麸+甘蔗渣+稻秆=2.0 g+1.5 g+1.5 g,基础盐溶液培养基中氮源为0.5%蛋白胨,以FPase活力和CMCase活力为评价指标,选择发酵液添加量(A)、发酵温度(B)和发酵时间(C)进行3因素3水平的正交试验,试验结果与分析见表2。
表2 棘孢木霉BW-6产纤维素酶固态发酵工艺优化正交试验结果与分析
Table 2 Results and analysis of orthogonal tests for solid-state fermentation process optimization of cellulase production by Trichoderma asperellum BW-6
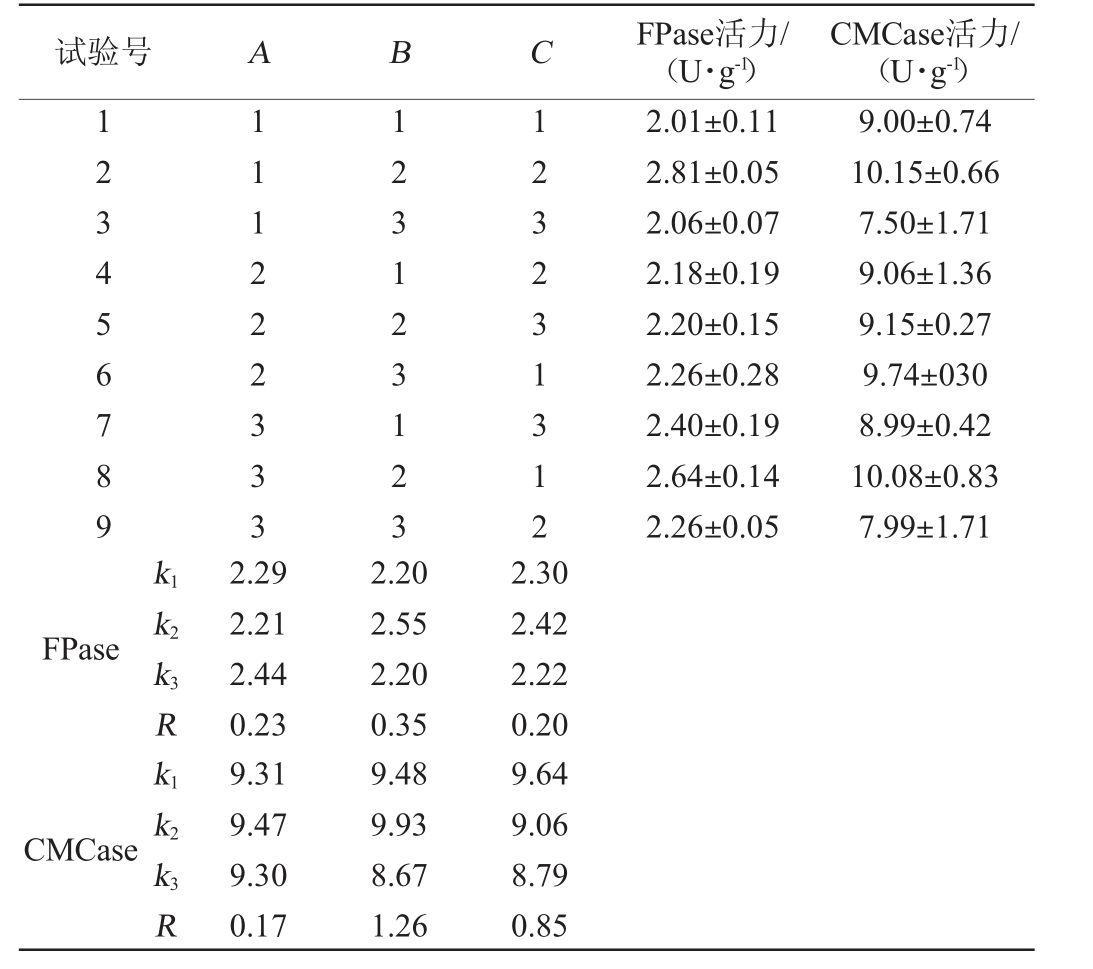
试验号 A B C FPase活力/(U·g-1)CMCase活力/(U·g-1)123456789 111222333 123123123 123231312 2.01±0.11 2.81±0.05 2.06±0.07 2.18±0.19 2.20±0.15 2.26±0.28 2.40±0.19 2.64±0.14 2.26±0.05 9.00±0.74 10.15±0.66 7.50±1.71 9.06±1.36 9.15±0.27 9.74±030 8.99±0.42 10.08±0.83 7.99±1.71 k1 FPase k2 k3R k1 CMCase k2 k3R 2.29 2.21 2.44 0.23 9.31 9.47 9.30 0.17 2.20 2.55 2.20 0.35 9.48 9.93 8.67 1.26 2.30 2.42 2.22 0.20 9.64 9.06 8.79 0.85
由表2可知,根据极差R值可知,影响棘孢木霉BW-6产CMCase的因素主次顺序为B>C>A,即发酵温度>发酵时间>发酵液添加量;影响棘孢木霉BW-6产FPase的因素主次顺序为B>A>C。根据k值可知,以FPase活力为评价指标,最优发酵条件组合为A3B2C2;以CMCase活力为评价指标,最优发酵条件组合为A2B2C1。通过验证试验可知,在A3B2C2组合条件下,FPase活力为(2.56±0.21)U/g;在A2B2C1组合条件下,CMCase活力为(9.12±0.77)U/g,两组的试验结果均比2号试验组A1B2C2低,结合实际情况,确定最优发酵条件组合为A1B2C2,即发酵液添加量6 mL、发酵温度26 ℃、发酵时间5 d。通过方差分析,结果显示,发酵液添加量、发酵温度和发酵时间对FPase和CMCase活力均无显著性影响(P>0.05)。
2.4 棘孢木霉BW-6产纤维素酶的应用潜能评估
在最优固态发酵工艺条件下,测定棘孢木霉BW-6及草酸青霉EU2101和EU2106[24-25]的纤维素酶活力,以评估棘孢木霉BW-6的工业应用潜能,结果表明,菌株EU2101的FPase和CMCase活力分别为1.03 U/g和6.10 U/g;菌株EU2106的FPase和CMCase活力分别为1.09 U/g和6.91 U/g,均极显著低于菌株BW-6的FPase和CMCase活力(2.88 U/g和10.33 U/g)(P<0.01),说明菌株BW-6具有工业化应用潜能。
2.5 棘孢木霉BW-6所产纤维素酶的酶学性质研究
2.5.1 纤维素酶的最适反应温度及温度稳定性
棘孢木霉BW-6所产纤维素酶的最适反应温度及温度稳定性见图9。
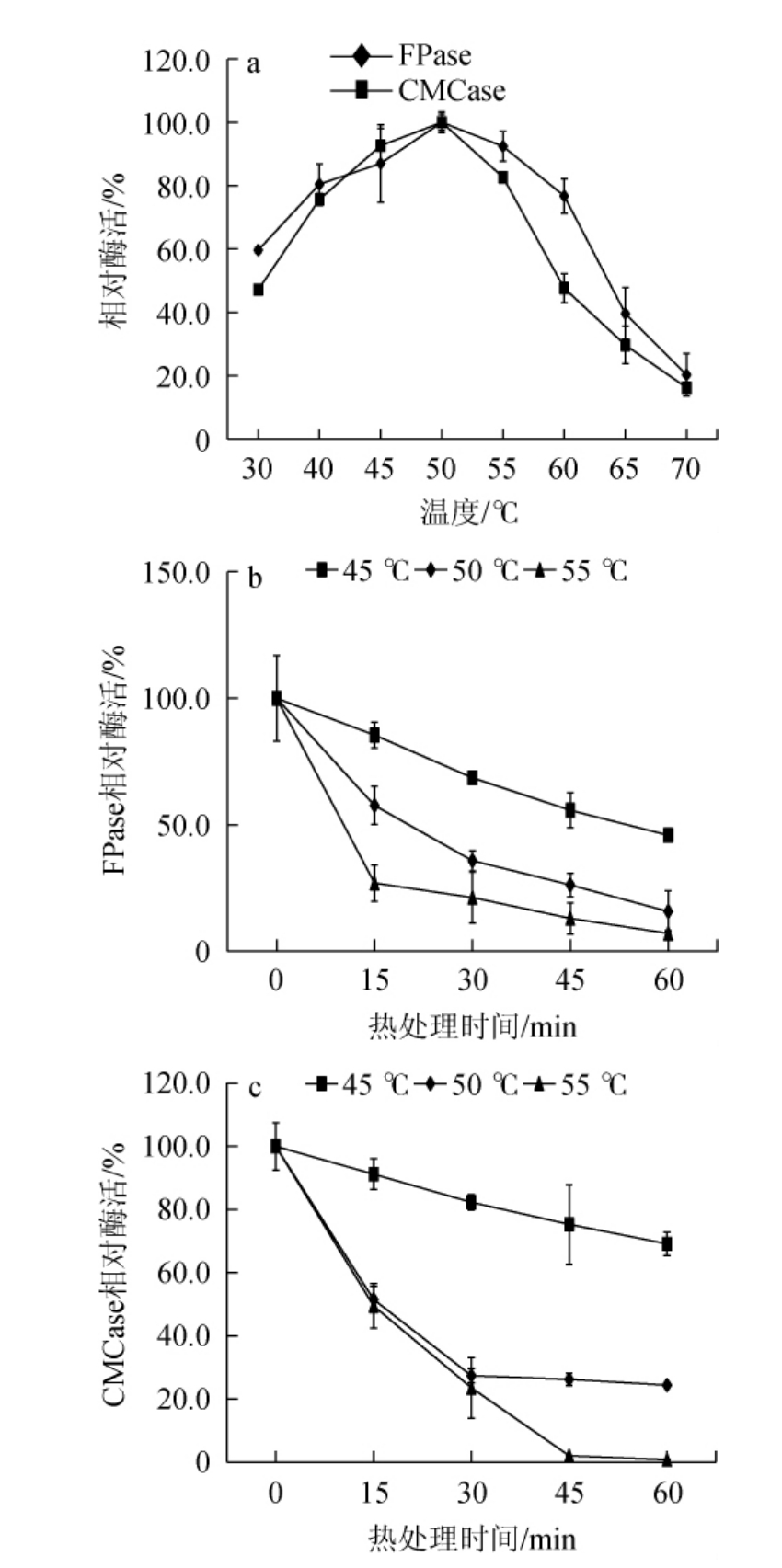
图9 棘孢木霉BW-6所产纤维素酶的最适反应温度(a)及温度稳定性(b、c)
Fig.9 Optimum reaction temperature (a) and temperature stability(b,c)of cellulase produced by Trichoderma asperellum BW-6
由图9a可知,棘孢木霉BW-6所产FPase和CMCase在45~55 ℃范围内相对酶活力均>80%,且均在50 ℃时酶活力最高,因此,确定纤维素酶的最适反应温度为50 ℃。由图9b和9c可知,在45 ℃保温30 min时,FPase和CMCase的相对酶活力分别为68.59%和82.30%,而在50 ℃和55 ℃保温30 min后,相对酶活力<40%,表明纤维素酶在45 ℃条件下相对稳定。
2.5.2 纤维素酶的最适反应pH及pH稳定性
棘孢木霉BW-6所产纤维素酶的最适反应pH及pH稳定性见图10。由图10a可知,棘孢木霉BW-6所产FPase和CMCase在pH为3.5~5.0时保持较高的酶活力,相对酶活力均>80%,且均在pH为4.0时酶活力最高,因此,确定纤维素酶的最适反应pH为4.0。由图10b可知,在pH 5.5~6.0条件下,FPase和CMCase的相对酶活力均>50%,表明纤维素酶在pH 5.5~6.0条件下相对稳定。
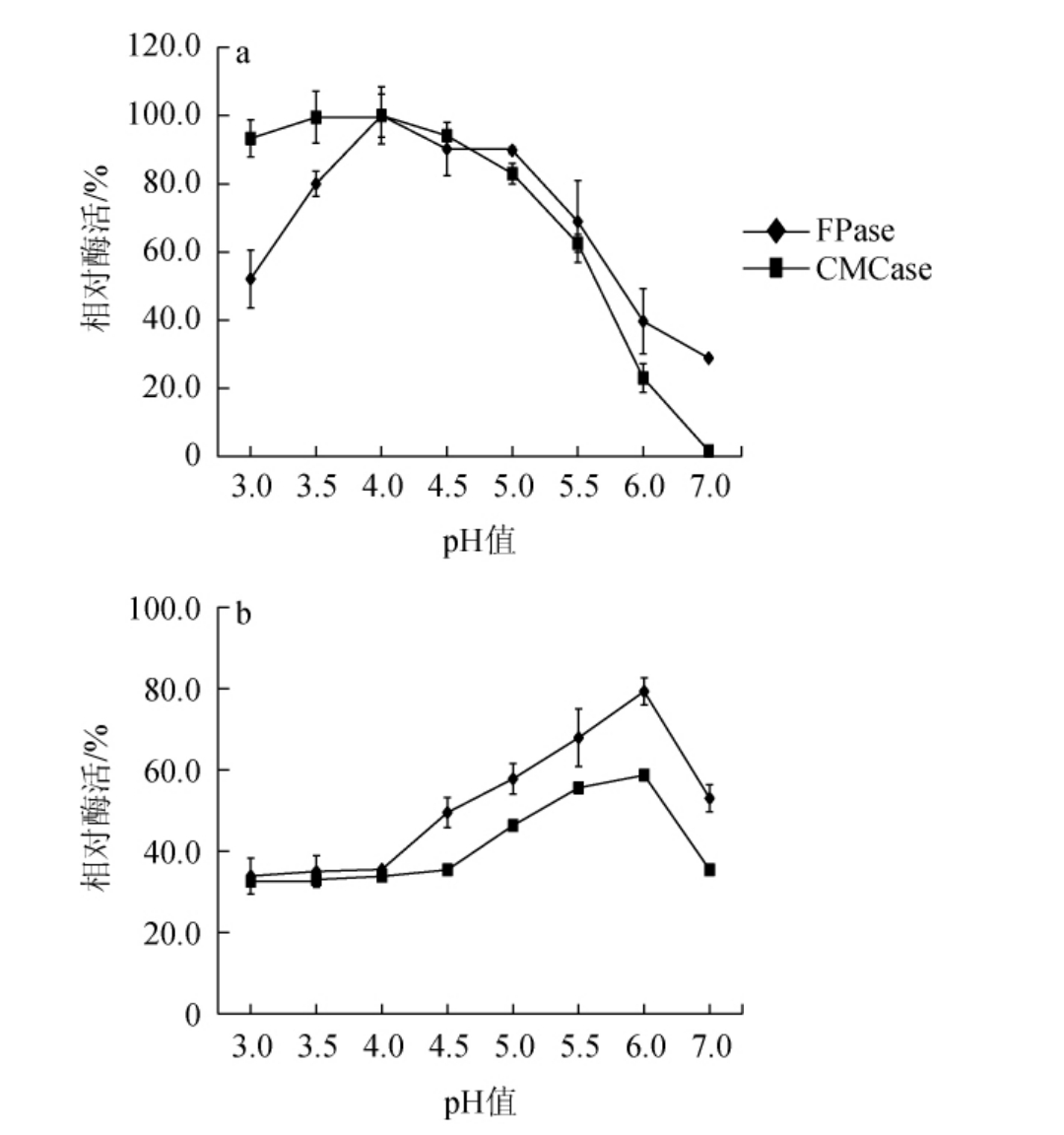
图10 棘孢木霉BW-6所产纤维素酶的最适反应pH(a)及pH稳定性(b)
Fig.10 Optimum reaction pH (a) and pH stability (b) of cellulase produced by Trichoderma asperellum BW-6
3 结论
本研究从12株真菌菌株中筛选鉴定得到一株高产纤维素酶的棘孢木霉(Trichoderma asperellum)BW-6,滤纸酶活力和羧甲基纤维素酶活力分别达到1.99 U/g和7.02 U/g。经单因素试验及正交试验优化得到棘孢木霉BW-6固态发酵产酶的最优条件为以麦麸+甘蔗渣+稻秆(2.0g+1.5g+1.5g)为固态发酵基质,基础盐溶液培养基中以0.5%蛋白胨为氮源,发酵液添加量6 mL,26 ℃静置培养5 d。在此条件下,棘孢木霉BW-6的FPase和CMCase活力分别达到2.81 U/g和10.15 U/g,分别是优化前的1.41倍和1.46倍,且极显著高于同等条件下草酸青霉(Penicillium oxalicum)EU2101和EU2106的纤维素酶活力(P<0.01),具有工业化应用潜能。此外,菌株BW-6所产纤维素酶的最适反应温度和pH分别为50 ℃和4.0,在45 ℃和pH 5.5~6.0条件下稳定。本研究为农业废弃物的高值化利用和降低纤维素酶的生产成本提供了一定的理论参考,为高产纤维素酶棘孢木霉菌株的开发和利用奠定了基础,具有十分重要的应用价值和环保意义。
[1]THONGSOMBOON W, BAIMARK Y, SRIHANM P.Valorization of cellulose-based materials from agricultural waste: comparison between sugarcane bagasse and rice straw[J].Polymers,2023,15(15):3190.
[2]XU P,SHU L L,LI Y,et al.Pretreatment and composting technology of agricultural organic waste for sustainable agricultural development[J].Heliyon,2023,9(5):e16311.
[3]KUMR SARANGI P,SUBUDHI S,BHATIA L,et al.Utilization of agricultural waste biomass and recycling toward circular bioeconomy[J].Environ Sci Pollut R,2023,30(4):8526-8539.
[4]DEY P,CHAKRABORTTY S,HALDAR D,et al.On-site enriched production of cellulase enzyme using rice straw waste and its hydrolytic performance evaluation through systematic dynamic modeling[J].Environ Sci Pollut R,2023,30(13):36710-36727.
[5]MOSTAFA F A,WEHAIDY H R,SHARAF S,et al.Aspergillus awamori MK788209 cellulase: production, statistical optimization, pea peels saccharification and textile applications[J].Microb Cell Fact,2024,23:11.
[6]ZHANG T, LI H Z, LI W T, et al.Kinase POGSK-3β modulates fungal plant polysaccharide-degrading enzyme production and development[J].Appl Microbiol Biotechnol,2023,107(11):3605-3620.
[7]BOONDAENG A,KEABPIMAI J,TRAKUNJAE C,et al.Cellulase production under solid-state fermentation by Aspergillus sp.IN5: Parameter optimization and application[J].Heliyon,2024,10(5):e26601.
[8]OKAL E J,ASLAM M M,KARANJA J K,et al.Mini review:advances in understanding regulation of cellulase enzyme in white-rot basidiomycetes[J].Microb Pathog,2020,147:104410.
[9]SREENA C P, SEBASTIAN D.Augmented cellulase production by Bacillus subtilis strain MU S1 using different statistical experimental designs[J].J Genet Eng Biotechnol,2018,16(1):9-16.
[10]SOROUR A A,OLAMA Z A,El-NAGGAR M Y,et al.Bioprocess development for extraction and purification of cellulases from Aspergillus niger 3ASZ using statistical experimental design techniques[J].Int J Biol Macromol,2023,242(Pt 1):124759.
[11]YANG J,YUE H R,PAN L Y,et al.Fungal strain improvement for efficient cellulase production and lignocellulosic biorefinery:current status and future prospects[J].Bioresource Technol,2023,385:129449.
[12]LENO N, AJAYAN A S, THAMPATTI K C M, et al.Humification evaluation and carbon recalcitrance of a rapid thermochemical digestate fertiliser from degradable solid waste for climate change mitigation in the tropics[J].Sci Total Environ,2022,849:157752.
[13]周艳华,张春艳.黑曲霉产纤维素酶的研究进展[J].农业技术与装备,2021(8):72-73,76.
[14]MATTEDI A,SABBI E,FARDA B,et al.Solid-state fermentation:applications and future perspectives for biostimulant and biopesticides production[J].Microorganisms,2023,11(6):1408.
[15]ZHAO S,WANG J X,HOU R,et al.Novel transcription factor CXRD regulates cellulase and xylanase biosynthesis in Penicillium oxalicum under solid-state fermentation[J].Appl Microbiol Biotechnol,2023,89(6):e0036023.
[16]DARABZDEH N,HAMIDI-ESFAHANI Z,HEJAZI P.Optimization of cellulase production under solid-state fermentation by a new mutant strain of Trichoderma reesei[J].Food Sci Nutr,2019,7(2):572-578.
[17]IDRIS A S O,PANDEY A,RAO S S,et al.Cellulase production through solid-state tray fermentation, and its use for bioethanol from sorghum stover[J].Bioresource Technol,2017,242:265-271.
[18]PANDEY R K, CHAND K, TEWARI L.Solid state fermentation and crude cellulase based bioconversion of potential bamboo biomass to reducing sugar for bioenergy production[J].J Sci Food Agr,2018,98(12):4411-4419.
[19]EZEILO U R,LEE C T,HUYOP F,et al.Raw oil palm frond leaves as cost-effective substrate for cellulase and xylanase productions by Trichoderma asperellum UC1 under solid-state fermentation[J].J Environ Manage,2019,243:206-217.
[20]TAHERZADEH-GHAHFAROKHI M,PANAHI R,MOKHTARANI B.Medium supplementation and thorough optimization to induce carboxymethyl cellulase production by Trichoderma reesei under solid state fermentation of nettle biomass[J].Prep Biochem Biotechnol,2022,52(4):375-382.
[21]CAMASSSOLA M,DILLON A J.Cellulases and xylanases production by Penicillium echinulatum grown on sugar cane bagasse in solid-state fermentation[J].Appl Biochem Biotechnol,2010,162(7):1889-1900.
[22]WANG Z,TANG H,LIU G,et al.Compound probiotics producing cellulase could replace cellulase preparations during solid-state fermentation of millet bran[J].Bioresource Technol,2023,385:129457.
[23]GUIMARAES A,MOTA A C,PEREIRA A S,et al.Rice husk,brewer's spent grain, and vine shoot trimmings as raw materials for sustainable enzyme production[J].Materials,2024,17(4):935.
[24]刘淼.黑曲霉固态发酵秸秆生产纤维素酶工艺条件优化[J].化学工程师,2020,34(6):5-9.
[25]ZHAO S,LIAO X Z,WANG J X,et al.Transcription factor Atf1 regulates expression of cellulase and xylanase genes during solid-state fermentation of Ascomycetes[J].Appl Environ Microbiol,2019,85(24):e01226-19.
[26]ZHAO S,YAN Y S,HE Q P,et al.Comparative genomic,transcriptomic and secretomic profiling of Penicillium oxalicum HP7-1 and its cellulase and xylanase hyper-producing mutant EU2106, and identification of two novel regulatory genes of cellulase and xylanase gene expression[J].Biotechnol Biofuels,2016,9:203.
[27]ZHANG T, MAI R M, FANG Q Q, et al.Regulatory function of the novel transcription factor CxrC in Penicillium oxalicum[J].Mol Microbiol,2021,116(6):1512-1532.
[28]祝晓飞,刘洪,周倩.一种快速制备丝状真菌PCR反应模板的方法[J].菌物学报,2023,42(8):1798-1806.
[29]JI H,YU R,LIU H,et al.Metabolic features of a novel Trichoderma asperellum YNQJ1002 with potent antagonistic activity against Fusarium graminearum[J].Metabolites,2023,13(11):1144.
[30]XUE M, WANG R, ZHANG C, et al.Screening and identification of Trichoderma strains isolated from natural habitats in China with potential agricultural applications[J].Biomed Res Int,2021,2021:7913950.
[31]NANJUNDASWAMY A,OKEKE B C.Comprehensive optimization of culture conditions for production of biomass-hydrolyzing enzymes of Trichoderma SG2 in submerged and solid-state fermentation[J].Appl Biochem Biotechnol,2020,191(1):444-462.