白酒是我国传统的发酵饮料,具有典型的自然发酵过程,以粮谷作物为原料,在曲类发酵剂的作用下经传统工艺酿造而来[1-2]。酱香型白酒的风味特征源自其复杂的生产工艺,发酵所用高温大曲也正是其独有的酿造特点之一。酒醅中的微生物广泛来自于大曲[3],对整个发酵过程中原料的利用及特征风味物质的产生起到了决定性的作用,是白酒发酵的前提,是影响整个白酒品质的关键因素[4]。大曲不仅为白酒酿造提供了霉菌、酵母、细菌等微生物,同时还提供了多种复合酶系[1]。酶的种类、活性、配比以及相互之间的协同差异使得白酒呈现出不同的特点及风味[5]。
淀粉酶是一类能够将淀粉水解为以葡萄糖为单位的低聚糖的水解酶类,在食品、洗涤、酿酒等行业有着广泛应用[6-7]。高温大曲中主要的产淀粉酶微生物为芽孢杆菌属(Bacillus sp.)[8]。近年来,淀粉酶的温度稳定性、pH稳定性等酶学特性为广大学者所持续关注[9-11]。DAI J C等[12]筛选到的枯草芽孢杆菌(Bacillus subtilis)所产淀粉酶在pH 6~8范围内仅处理30 min活性下降40%,在pH 5条件下处理30 min活性下降60%,说明该淀粉酶对于酸性环境的耐受性较低。HUANG L等[13]对地衣芽孢杆菌(Bacillus licheniformis)所产淀粉酶进行耐酸性定点突变,突变后淀粉酶活性在pH 4.5下处理20 min后残余酶活仅为21%,距离满足工业酶高效持久的特性要求仍有很大的差距。LIU Y H等[14]对地衣芽孢杆菌所产淀粉酶进行定点突变后,在pH 4.5条件下处理40 min后,突变体H293R/H316R/H327R所产淀粉酶活性仅能保持在初始活性的31%,虽相比较野生型淀粉酶完全失活而言有一定的提高,但针对工业化生产所需酶的高效性来说仍旧远远不足。以上研究均表明淀粉酶在高温、酸性的环境下稳定性较差,这在酱香型白酒的实际生产中对于原料的利用效率有极大的影响,因此,提高淀粉酶在高温酸性环境下稳定性的问题亟待解决。
本研究采用传统培养分离法结合透明圈法、淀粉酶活性测定方法从酱香型白酒大曲中筛选产淀粉酶芽孢杆菌,通过形态观察及分子生物学技术对筛选菌株进行鉴定,并对其耐酸性进行驯化,同时对比驯化前后菌株所产淀粉酶的酶学性质,以研究耐酸性驯化对该芽孢杆菌所产淀粉酶酶学性质的影响,为进一步改进和应用淀粉酶提供重要的参考价值。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
酱香型白酒大曲样品:贵州省仁怀市茅台镇某酒厂。
1.1.2 试剂
酵母提取物、胰蛋白胨(均为生化试剂):北京奥博星生物技术有限责任公司;聚合酶链式反应(polymerase chain reaction,PCR)引物、rTaq Mix:生工生物工程(上海)股份有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、酒石酸钾钠(均为分析纯):国药集团药业股份有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
液体培养基:即Luria-Bertani(LB)培养基[15],121 ℃高压蒸汽灭菌20 min。
固体培养基:在液体培养基中添加琼脂及可溶性淀粉各20 g/L,121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
DHP-9402型恒温培养箱:上海森信实验仪器有限公司;BSD-YX3200型立式智能精密摇床:上海博讯实业有限公司;S1000TM型PCR扩增仪:美国Bio-Rad公司;HH-2型恒温水浴锅:上海力辰邦西仪器科技公司;UV-5100型紫外可见分光光度计:上海棱光技术有限公司。
1.3 方法
1.3.1 产淀粉酶芽孢杆菌的分离与初筛[16]
称取1 g酱香型白酒大曲样品,加入10 mL生理盐水,振荡混匀,在已经预热好的80 ℃水浴锅中保温10 min,每间隔2 min振荡一次。取1 mL菌悬液并用生理水按10倍系列梯度稀释至10-8。取不同稀释度的菌悬液分别划线于固体培养基中,于30 ℃培养箱中倒置培养24 h。使用卢戈氏碘液染色后观察平板上单菌落的透明水解圈,测定透明圈直径(D)和菌落直径(d),并计算D/d值,挑取D/d值大的菌落进行复筛。
1.3.2 产淀粉酶芽孢杆菌的复筛[16]
将初筛菌株接种于液体培养基中,30 ℃、200 r/min条件下振荡培养16 h。将培养液的OD600 nm值稀释为0.6,按照2%(V/V)的接种量转接于液体培养基中,相同条件下振荡培养。于不同时间点取样,并以12 000 r/min离心10 min,收集上清液,测定上清液中淀粉酶的活性,筛选确定淀粉酶活性高的菌株。
1.3.3 淀粉酶活性的测定
采用DNS法[17]测淀粉酶活性。淀粉酶酶活力定义:1 mL粗酶液在40 ℃条件下,1 min水解淀粉生成1 μg葡萄糖所需酶量定义为一个酶活力单位,U/mL。
1.3.4 高产淀粉酶芽孢杆菌菌株的鉴定
形态学观察:将高产淀粉酶芽孢杆菌菌株划线接种至固体培养基上,30 ℃倒置静置培养24 h后,观察菌落形态,并挑取单菌落至液体培养基中,于30 ℃、200 r/min条件下培养16 h后进行革兰氏染色,经显微镜观察细胞形态特征。
分子生物学鉴定:采用苯酚氯仿抽提法[18]提取目标菌株的基因组脱氧核糖核酸(deoxyribonucleic acid,DNA),以其为模板,采用引物27F(5'-AGAGTTTGATCMTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')PCR扩增16S rDNA。PCR扩增体系[16]:DNA模板0.5 μL,引物27F和1492R各2 μL,PCR预混液补足50 μL。PCR扩增条件:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火10 s,72 ℃延伸30 s,共35次循环;72 ℃再延伸7 min。PCR扩增产物经1%琼脂糖凝胶电泳检测合格后委托生工生物工程(上海)股份有限公司进行测序,将测序结果提交至美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对,选取同源性较高的模式菌株的16S rDNA基因序列,采用MEGA 11.0生物学软件中的邻接(neighbor-joining,NJ)法构建系统发育树[19-20],确定菌株的种属。
1.3.5 高产淀粉酶芽孢杆菌菌株的耐酸性驯化
驯化点的确定:将高产淀粉酶芽孢杆菌菌株接种于50mL液体培养基中,在30 ℃、200 r/min条件下振荡培养16 h后,以2%(V/V)的接种量分别转接于pH值分别为7.0、6.0、5.0、4.0、3.0、2.0、1.0的100 mL液体培养基,在30 ℃、200 r/min条件下振荡培养30 h,每隔3 h取一次样,测定不同培养时间下培养液的OD600nm值,同时对淀粉酶活力进行测定。
耐酸性驯化:确定驯化点后,首先将高产淀粉酶芽孢杆菌菌株接种于驯化点pH的50 mL液体培养基中,30 ℃、200 r/min条件下振荡培养至OD600 nm值达到0.6;然后以2%(V/V)的接种量转接入低于驯化点0.5个pH的100 mL液体培养基中,30 ℃、200 r/min条件培养至OD600nm值达到0.6时;再以2%(V/V)的接种量转接入低于驯化点1个pH的100 mL液体培养基中,30 ℃、200 r/min条件下培养,使用紫外分光光度计测定培养3 h、6 h、9 h、12 h、15 h、24 h、27 h、30 h时菌液的OD600nm值,并测定淀粉酶活力。
1.3.6 淀粉酶的酶学性质研究[21-22]
pH对淀粉酶活性的影响:将底物用不同pH值(1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0)的缓冲液溶解配制,并依次对淀粉酶活性进行测定,确定淀粉酶的最适反应pH。
温度对淀粉酶活性的影响:分别在20 ℃、30 ℃、40 ℃、50 ℃、60 ℃、70 ℃下进行酶促反应并测定淀粉酶活性,考察温度对淀粉酶活性的影响,确定淀粉酶的最适反应温度。
淀粉酶的pH及温度稳定性:参考文献[16]。
1.3.7 数据处理
每个试验重复测定3次,结果用“平均值±标准差”表示。数据结果使用GraphPad Prism 9制图。
2 结果与分析
2.1 高产淀粉酶芽孢杆菌菌株的分离及筛选
2.1.1 分离及初筛
从酱香型白酒大曲样品中共分离纯化得到96株芽孢杆菌菌株,其中具有明显水解透明圈的菌株为10株(1#~10#),其D/d值见表1。由表1可知,5#、8#和9#菌株的D/d值较高,且菌株8#>5#>9#。因此,将这3株菌株作为初筛菌株。
表1 产淀粉酶芽孢杆菌菌株的透明水解圈及菌落直径比值
Table 1 Ratio of transparent hydrolytic circle and colony diameter of amylase-producing Bacillus strain
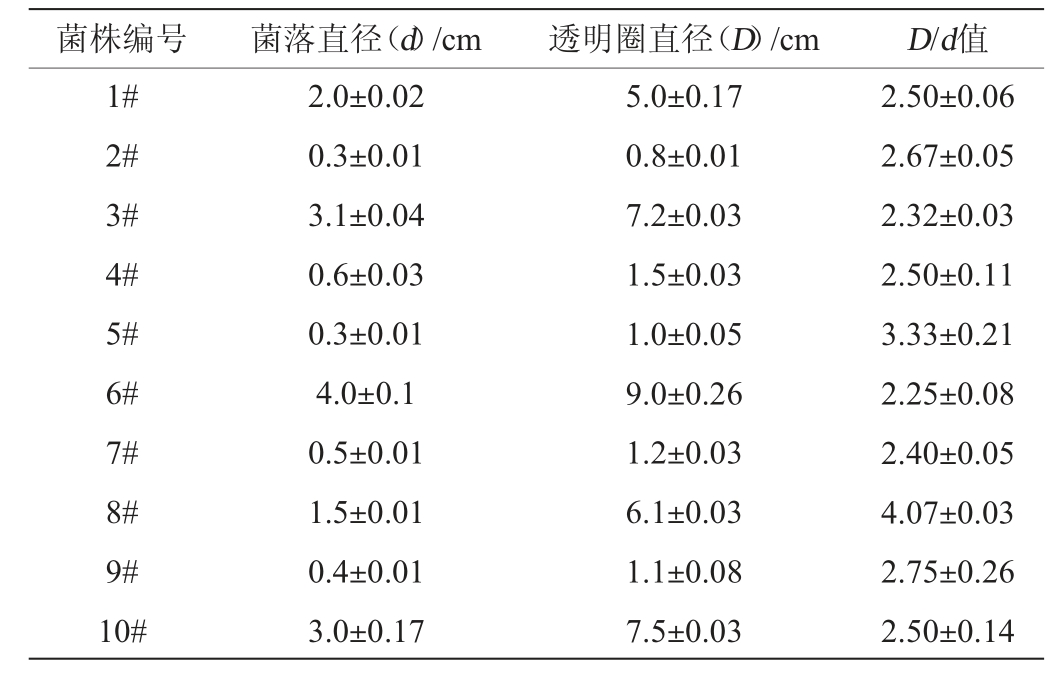
菌株编号 菌落直径(d)/cm 透明圈直径(D)/cm D/d值1#2#3#4#5#6#7#8#9#10#2.0±0.02 0.3±0.01 3.1±0.04 0.6±0.03 0.3±0.01 4.0±0.1 0.5±0.01 1.5±0.01 0.4±0.01 3.0±0.17 5.0±0.17 0.8±0.01 7.2±0.03 1.5±0.03 1.0±0.05 9.0±0.26 1.2±0.03 6.1±0.03 1.1±0.08 7.5±0.03 2.50±0.06 2.67±0.05 2.32±0.03 2.50±0.11 3.33±0.21 2.25±0.08 2.40±0.05 4.07±0.03 2.75±0.26 2.50±0.14
2.1.2 复筛
测定3株初筛菌株的淀粉酶活性,结果见图1。由图1可知,发酵前6 h,3株菌株的淀粉酶活性上升均较为缓慢,其中5#和8#菌株在发酵6~12 h时活性有明显上升,在发酵12 h时均达到最高酶活,分别为343.9 U/mL和570.6 U/mL,之后5#和8#菌株的淀粉酶活性均有较为明显的下降,30 h时淀粉酶活分别下降87%和72%。9#菌株的淀粉酶活性总体较低,在测量范围内活性增长缓慢,发酵15 h处达到最高酶活(103.5 U/mL),之后又缓慢下降。3个菌株的淀粉酶活性存在较为明显的差异,但其活性大小和D/d值保持一致。因此,选择8#菌株为高产淀粉酶的菌株进行耐酸性驯化,并将其命名为菌株AmyX8。
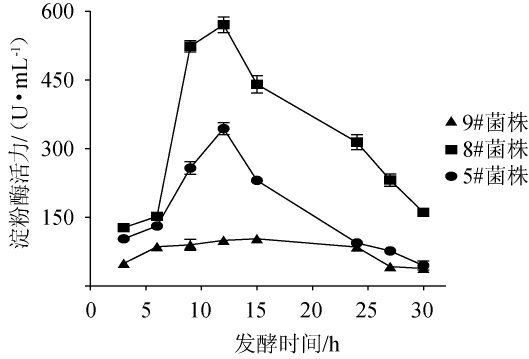
图1 不同初筛菌株所产淀粉酶活性测定结果
Fig.1 Determination results of amylase activity produced by different primary screening strains
2.2 菌株AmyX8的鉴定
2.2.1 形态学特征
菌株AmyX8的菌落及细胞形态见图2。由图2a可知,菌株AmyX8的菌落白色不透明,边缘无规则不平滑,菌落褶皱且不易被挑起。由图2b可知,经革兰氏染色后结果呈阳性,菌株AmyX8的细胞形态为杆状,单细胞,可形成椭圆形的芽孢。根据菌株AmyX8的菌落形态和细胞形态,可初步鉴定菌株AmyX8为芽孢杆菌属(Bacillus sp.)。
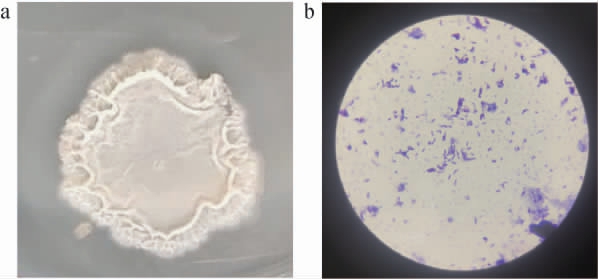
图2 菌株AmyX8的菌落(a)及细胞(b)形态特征
Fig.2 Morphological characteristics of colony (a) and cell (b) of strain AmyX8
2.2.2 分子生物学鉴定
基于16S rDNA基因序列构建菌株AmyX8的系统发育树,结果见图3。

图3 基于16S rDNA基因序列菌株AmyX8的系统发育树
Fig.3 Phylogenetic tree of strain AmyX8 based on 16S rDNA gene sequences
由图3可知,菌株AmyX8与枯草芽孢杆菌(Bacillus subtilis)同属一个分支,亲缘关系最近,综合菌落形态、细胞形态和分子生物学结果,最终鉴定菌株AmyX8为枯草芽孢杆菌(Bacillus subtilis)。
2.3 枯草芽孢杆菌AmyX8的耐酸性驯化
2.3.1 菌株AmyX8在不同pH下的生长情况及淀粉酶活性变化
酱香型白酒多轮次生产工艺使得发酵环境的pH持续下降,这对菌株的生长代谢有较大的影响[23]。因此,考察不同pH对于枯草芽孢杆菌AmyX8生长情况及所产淀粉酶活性的影响,结果见图4。
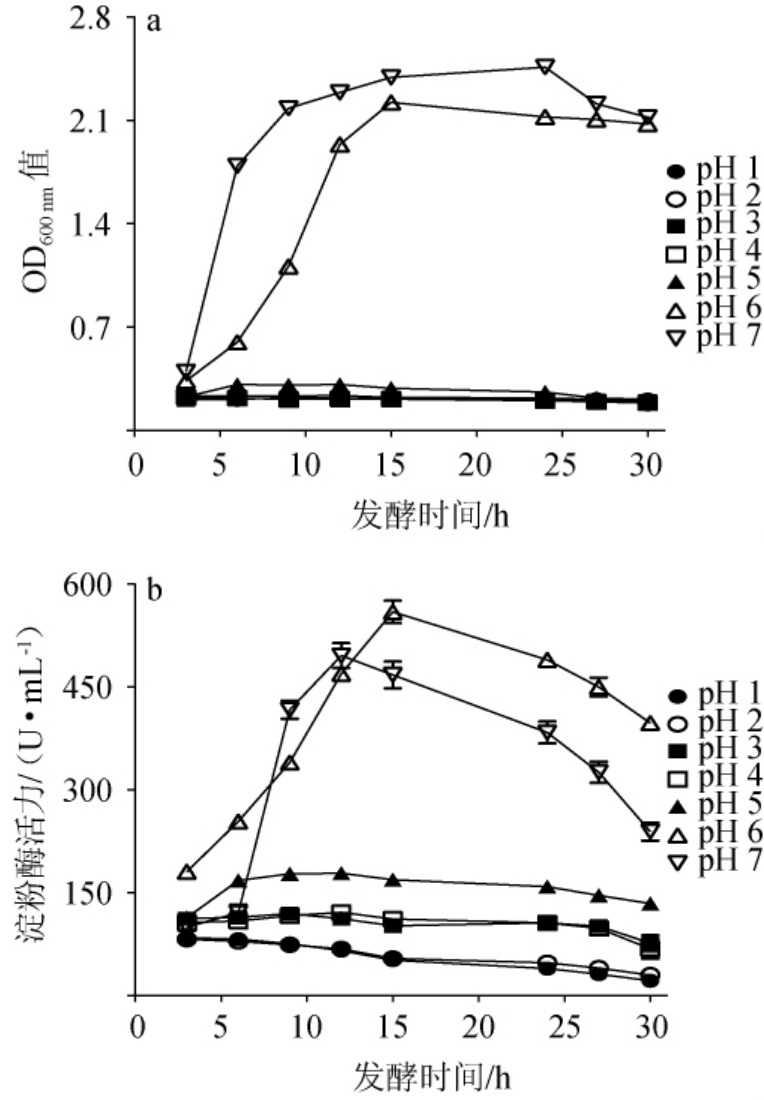
图4 不同pH条件下菌株AmyX8的生长情况(a)及淀粉酶活性变化(b)
Fig.4 Growth (a) and amylase activity change (b) of strain AmyX8 under different pH conditions
由图4a可知,菌株AmyX8在pH 1~5的环境下生长均受到严重抑制,相比较pH 6及pH 7培养条件时生长量具有明显的下降。结合图4b可知,虽然较低的pH严重影响了菌株AmyX8的生长活性,但在pH 5以下的环境中依旧能够持续产酶。与pH 6环境下发酵15 h的淀粉酶活性(549.8 U/mL)相比,pH 5培养条件下活性下降明显,但仍远高于pH 1~4培养时菌株所分泌淀粉酶活性。芽孢杆菌是高温大曲中的优势细菌,在较低pH环境中生长量及所产淀粉酶的活性均会受到抑制[24-25],这对于发酵后期原料的利用及白酒呈香呈味物质的产生有着严重的影响。因此,后续选用pH 5作为驯化点对枯草芽孢杆菌AmyX8进行驯化。
2.3.2 菌株AmyX8耐酸性驯化后的生长情况及淀粉酶活性变化
为提高菌株AmyX8在pH 5时的生物量及淀粉酶活性,对其进行耐酸性驯化。pH会严重影响微生物生长过程中机体内发生的酶促反应,培养酸度的剧烈改变,可能会增加菌株对生长环境的适应难度,导致延长适应期甚至引起菌株的死亡。因此,采用较为缓和的梯度降酸的方式对菌株AmyX8进行驯化,并将驯化后的菌株命名为AmyX8AR。驯化前后菌株的生长情况及淀粉酶活性变化见图5。
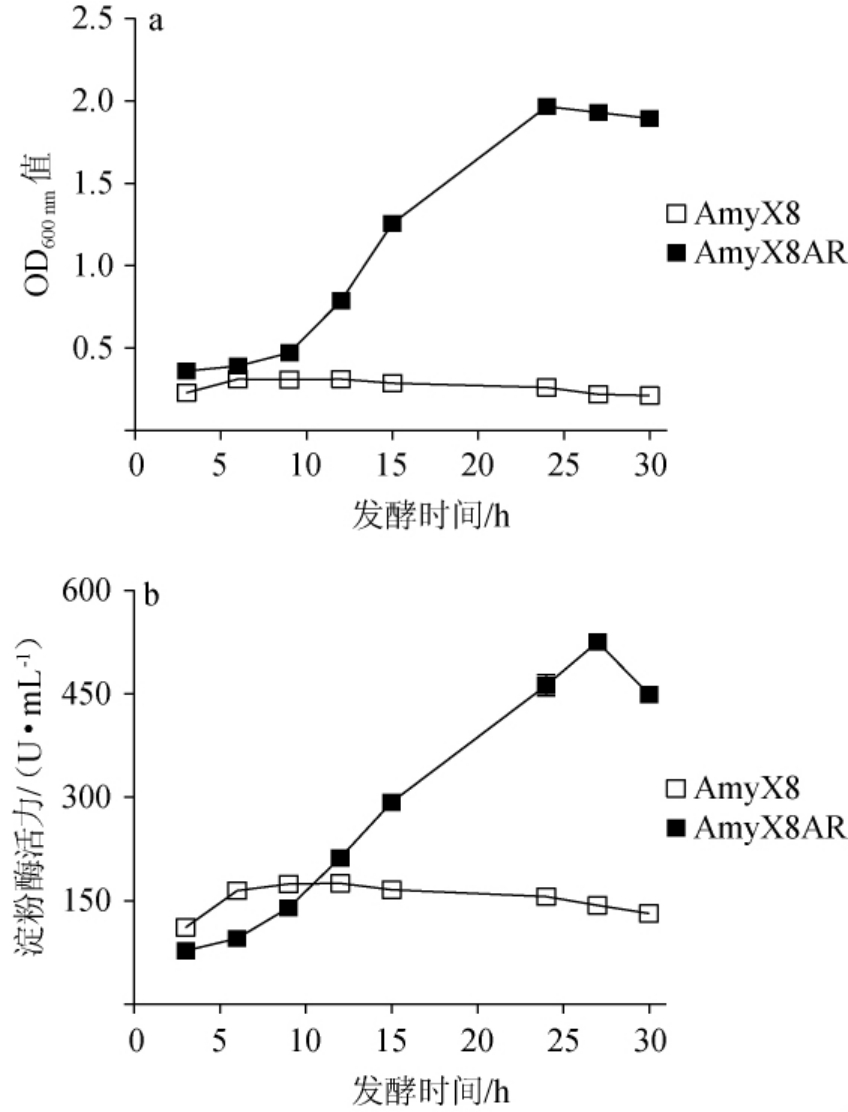
图5 耐酸性驯化前后菌株的生长情况(a)及淀粉酶活性(b)对比
Fig.5 Comparison of growth (a) and amylase activities (b) of strain before and after acid resistance acclimation
由图5a可知,经过驯化,菌株AmyX8AR在pH 5条件下培养24 h的OD600 nm值是驯化前的7.5倍。同时,由图5b可知,菌株AmyX8AR所产淀粉酶的酶活也得到了显著的提高。菌株AmyX8AR所产淀粉酶在培养至27 h时表现出最高活力,酶活达525.8 U/mL,是驯化前菌株AmyX8所产淀粉酶最高酶活的3.2倍。较酸环境下较多的生物量和较高的淀粉酶活性,能够促进酿酒原料的利用和转化,提升生产效率和设备使用率,对于白酒及酒精的发酵生产来说十分有利。
2.4 菌株AmyX8和AmyX8AR所产淀粉酶粗酶液的酶学性质分析
2.4.1 最适反应条件
酶的催化性质会受到温度、pH等环境因素的影响而产生截然不同的结果[26-27]。驯化前(菌株AmyX8)后(菌株AmyX8AR)菌株所产淀粉酶粗酶液的最适反应温度及pH见图6。
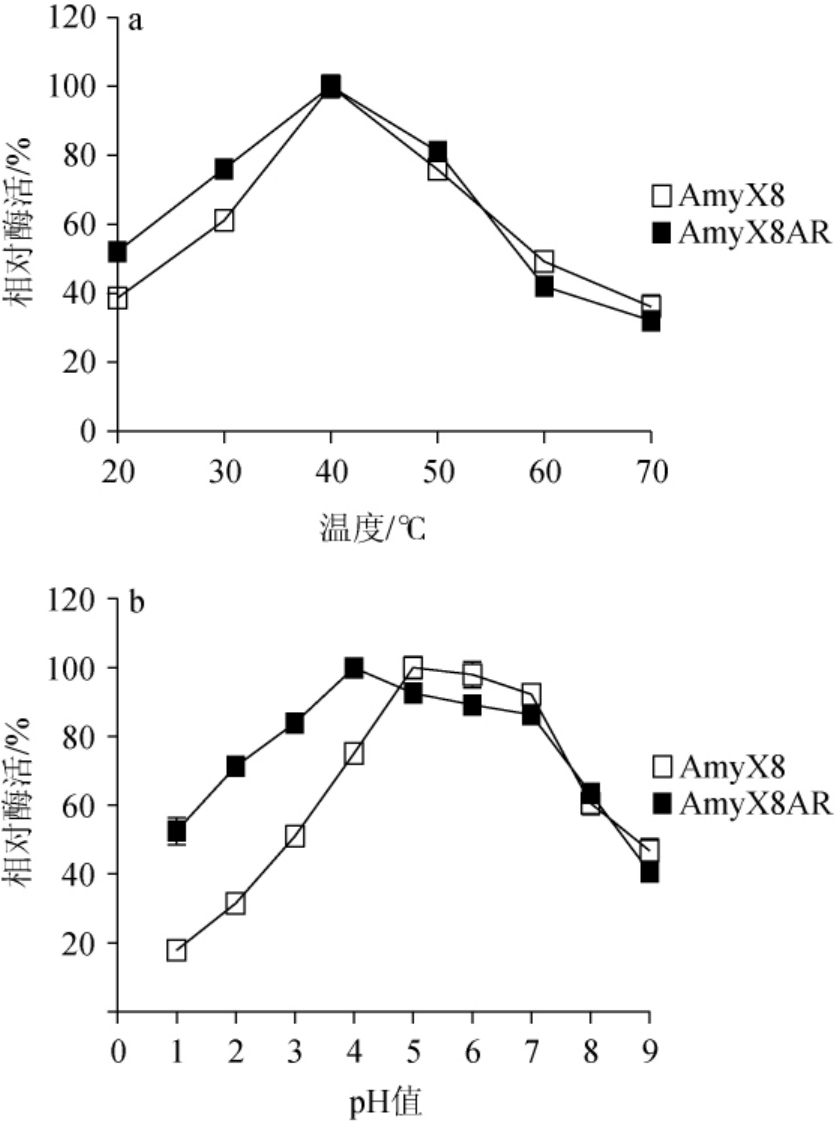
图6 菌株AmyX8和AmyX8AR所产淀粉酶粗酶液的最适反应条件
Fig.6 Optimum reaction conditions of crude amylase solution produced by strains AmyX8 and AmyX8AR
由图6a可知,驯化前后菌株所产淀粉酶的最适反应温度并没有变化,均为40 ℃;但驯化后菌株AmyX8AR所产淀粉酶活力在20~40 ℃内留存率较高,相比较驯化前菌株AmyX8所产淀粉酶在20 ℃时的相对酶活下降至40%以下而言,驯化后菌株AmyX8AR所产淀粉酶在20 ℃时仍保持有50%以上的相对酶活。由图6b可知,耐酸性驯化使菌株所产淀粉酶的最适反应pH降低,从pH 5下降到pH 4。且菌株AmyX8AR所产淀粉酶在pH 1~9之间相对酶活均在40%以上,在pH 2~8之间相对酶活能够保持在60%以上。与菌株AmyX8仅在pH 4~8范围内保持60%以上相对酶活相比,菌株AmyX8AR的pH适用范围更为广泛,具有巨大的实际应用潜能。较低的培养pH增加了菌株AmyX8AR所产淀粉酶在偏酸环境(pH 1~4)下的活性,可能是长时间的低pH培养环境促使菌株AmyX8AR分泌的淀粉酶更适用于酸性环境的催化。菌株AmyX8AR所产淀粉酶在最适反应条件下的最高酶活性达到559.6 U/mL,为pH 5培养环境下菌株AmyX8所产淀粉酶活性的3.4倍,提升较为显著。
2.4.2 稳定性研究
酶在反应过程中的稳定性也决定着其在工业实际生产中的应用效果,因此研究菌株AmyX8和AmyX8AR所产淀粉酶在其最适反应温度及最适反应pH下的稳定性,结果见图7。
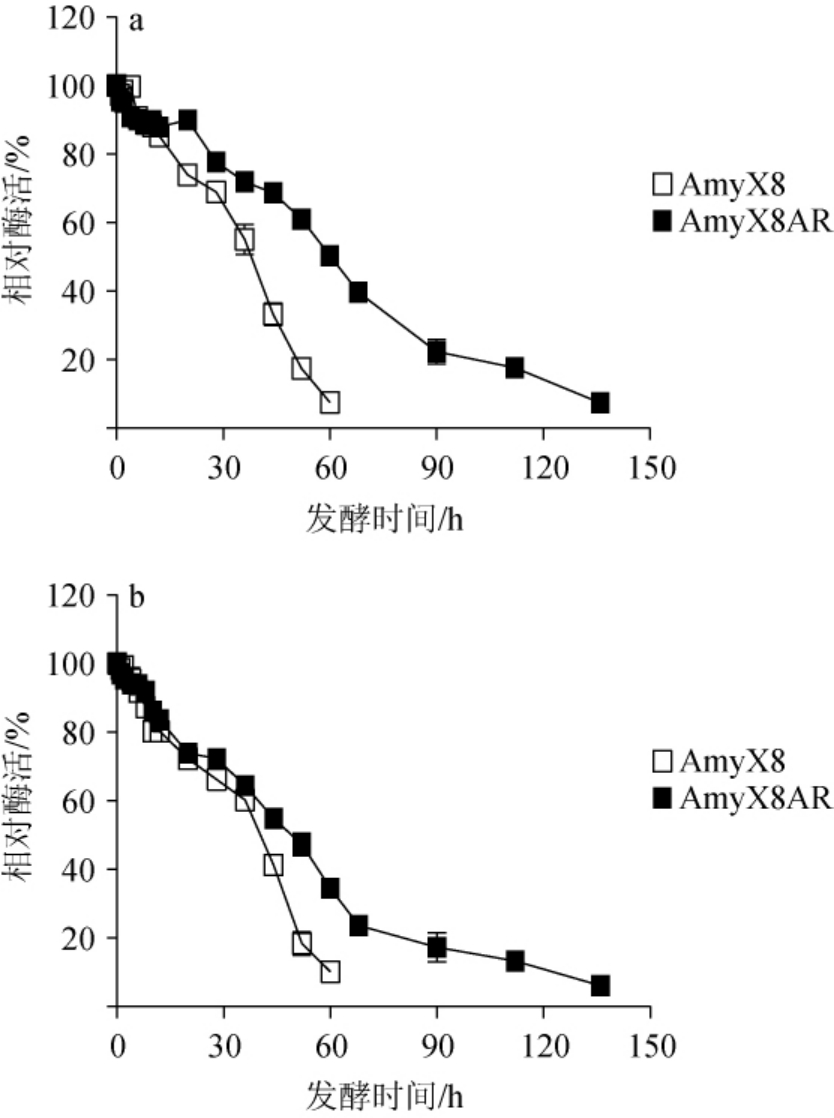
图7 菌株AmyX8和AmyX8AR所产淀粉酶粗酶液的温度(a)及pH(b)稳定性
Fig.7 Temperature (a) and pH (b) stability of crude amylase solution produced by strains AmyX8 and AmyX8AR
由图7a可知,耐酸性驯化显著提高了菌株所产淀粉酶的温度稳定性,菌株AmyX8所产淀粉酶在40 ℃处理60 h时,相对酶活仅为7.6%,而菌株AmyX8AR所产淀粉酶在40 ℃处理136 h时相对酶活才降至7.4%。由图7b可知,驯化后菌株AmyX8AR所产淀粉酶的pH稳定性也得到了明显的提高,菌株AmyX8AR所产淀粉酶在pH 4条件下处理60 h以内相对酶活均能保持在34%以上,而菌株AmyX8所产淀粉酶在pH 5条件下处理60 h时相对酶活仅为10%。pH对蛋白质构象的影响是巨大的[28],大量文献报道经过突变等手段促使酶的稳定性提高[29-31],因此较低的培养pH可能使淀粉酶在某些关键位点发生突变,从而引起AmyX8AR淀粉酶稳定性增加。由此可知,耐酸性驯化对于枯草芽孢杆菌淀粉酶稳定性的提高有着积极的作用。
3 结论
本研究采用传统培养分离法结合透明圈法、淀粉酶活性测定方法从酱香型白酒大曲中分离筛选到一株高产淀粉酶的芽孢杆菌,将其命名为菌株AmyX8,通过形态学观察、生理生化试验及分子生物学技术鉴定该菌株为枯草芽孢杆菌(Bacillus subtilis)。菌株AmyX8在pH 7条件下培养时具有较高的生物量,在pH 6培养时具有最高酶活,为549.8 U/mL;菌株AmyX8所产淀粉酶的最适反应温度为40 ℃,最适反应pH为5。通过比较不同pH条件下菌株的生长特性及酶活特性,选择pH 5为驯化点对其进行耐酸性驯化。经耐酸性驯化,成功将菌株AmyX8的生长pH驯化至5,得到菌株AmyX8AR。在pH 5条件下,菌株AmyX8AR发酵24 h时的OD600nm值是驯化前菌株AmyX8的7.5倍,发酵27 h时的淀粉酶活(525.8 U/mL)最高,是驯化前菌株AmyX8所产淀粉酶最高酶活的3.2倍;其所产淀粉酶的最适反应温度与驯化前保持一致,仍为40 ℃,最适反应pH从5下降为4,pH和温度稳定性均得到提高,且在最适反应条件最高活性达到559.6 U/mL。本试验驯化得到的产淀粉酶枯草芽孢杆菌具有良好的工业应用前景,其不仅能够提高酱香型白酒的生产效率和质量,而且能够适应酱香型白酒多轮次发酵生产的发酵条件和环境变化。
[1]简何,简江,周娜.不同酶类物质在白酒酿造中的应用研究进展[J].酿酒科技,2022(12):85-90.
[2]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998:19-25.
[3]田瑞杰.中温大曲原核微生物群落解析及高产淀粉酶菌株的筛选与应用探究[D].郑州:郑州轻工业大学,2022.
[4]WANG X S, DU H, ZHANG Y, et al.Environmental microbiota drives microbial succession and metabolic profiles during Chinese liquor fermentation[J].Appl Environ Microbiol,2018,84(4):e02369-17.
[5]庄名扬.中国白酒香味物质形成机理及酿酒工艺的调控[J].四川食品与发酵,2007(2):1-6.
[6]DE SOUZA P M, DE OLIVEIRA MAGALHÃES P.Application of microbial α-amylase in industry-A review[J].Braz J Microbiol,2010,41(4):850-861.
[7]RAVEENDRAN S, PARAMESWARAN B, UMMALYMA S B, et al.Applications of microbial enzymes in food industry[J]. Food Technol Biotechnol,2018,56(1):16-30.
[8]刘晶晶.大曲酶系和代谢物组分析及其中产复合酶菌株的应用研究[D].北京:中国农业大学,2018.
[9]SHARMA A,SATYANARAYANA T.Microbial acid-stable α-amylases:Characteristics,genetic engineering and applications[J].Process Biochem,2013,48(2):201-211.
[10]BOZˇIC′ N,LONCˇAR N,SLAVIC′ M Š,et al.Raw starch degrading α-amylases:an unsolved riddle[J].Amylase,2017,1(1):12-25.
[11]PAUL J S, GUPTA N, BELIYA E, et al.Aspects and recent trends in microbial α-amylase: a review[J]. Appl Biochem Biotechnol, 2021,193(8):2649-2698.
[12]DAI J C,DONG A J,XIONG G X,et al.Production of highly active extracellular amylase and cellulase from Bacillus subtilis ZIM3 and a recombinant strain with a potential application in tobacco fermentation[J].Front Microbiol,2020,11:1539.
[13]HUANG L,SHAN M Y,MA J Y,et al.Directed evolution of α-amylase from Bacillus licheniformis to enhance its acid-stable performance[J].Biologia,2019,74:1363-1372.
[14]LIU Y H,HUANG L,JIA L B,et al.Improvement of the acid stability of Bacillus licheniformis alpha amylase by site-directed mutagenesis[J].Process Biochem,2017,58:174-180.
[15]赵佳慧.一种耐高温淀粉酶对淀粉分子理化特性的影响及其酶学性质的研究[D].长春:长春大学,2018.
[16]张璋,赵腾飞,李红霞,等.产淀粉酶芽孢杆菌的分离鉴定、高温驯化及酶学性质研究[J].中国酿造,2023,42(9):79-84.
[17]徐寒冰,郁书怀.双果糖酐水解酶分子改造提升酶活性研究[J].食品与发酵工业,2023,49(5):1-8.
[18]SINGH S.DNA extraction by the utilization of phenol chloroform[J].Adv Tech Biol Med,2021,9:318.
[19]TAMURA K,STECHER G,KUMAR S.MEGA11:molecular evolutionary genetics analysis version 11[J].Mol Biol Evol,2021,38(7):3022-3027.
[20]JAFFE A,AMSEL N,AIZENBUD Y,et al.Spectral neighbor joining for reconstruction of latent tree models[J].SIAM J Math Data Sci,2021,3(1):113-141.
[21]刘雪莲,申培立,牛丹丹,等.地衣芽胞杆菌α-淀粉酶耐热耐酸突变体的酶学性质[J].食品与发酵工业,2020,46(2):7-10.
[22]胡倩.贝莱斯芽孢杆菌α-淀粉酶基因的突变、表达与酶学性质研究[D].合肥:安徽农业大学,2022.
[23]陈剑,蒋英丽,程伟,等.酱香型白酒酒糟中耐酸产酯香细菌的筛选[J].酿酒科技,2016(2):61-64.
[24]郭全友,刘玲,李保国,等.Nisin、ε-聚赖氨酸、pH值对虾源枯草芽孢杆菌生长/非生长界面模型构建与评价[J].食品科学,2020,41(22):140-147.
[25]师瑞琳.耐酸性高温α-淀粉酶的分子改造、性质表征和热稳定性研究[D].长春:吉林大学,2016.
[26]DANIEL R M, PETERSON M E, DANSON M J, et al.The molecular basis of the effect of temperature on enzyme activity[J].Biochem J,2010,425(2):353-360.
[27]BISSWANGER H.Enzyme assays[J].Perspect Sci,2014,1:41-55.
[28]PINNEY M M, MOKHTARI D A, AKIVA E, et al.Parallel molecular mechanisms for enzyme temperature adaptation[J]. Science,2021,371(6533):eaay2784.
[29]LIU Z, ZHAO H, HAN L, et al.Improvement of the acid resistance,catalytic efficiency, and thermostability of nattokinase by multisite-directed mutagenesis[J].Biotechnol Bioeng,2019,116(8):1833-1843.
[30]NISTHAL A,WANG C Y,ARY M L,et al.Protein stability engineering insights revealed by domain-wide comprehensive mutagenesis[J]. Proc Natl Acad Sci USA,2019,116(33):16367-16377.
[31]CHOWDHURY R,MARANAS C D.From directed evolution to computational enzyme engineering-a review[J].AIChE J,2020,66(3):e16847.