发酵蔬菜是以蔬菜为原料,经微生物发酵而成的发酵食品[1-2]。随着时代的发展,发酵蔬菜已不仅是保存蔬菜的一种方法,更是赋予蔬菜独特口感和风味的一种加工方式[3-4]。发酵蔬菜的风味主要来源于两方面:一部分来源于蔬菜原辅料,另一部分来源于发酵过程中的微生物代谢[5-6]。有机酸是发酵蔬菜中重要的风味物质,其中非挥发性有机酸是其重要组成部分,这些滋味物质与香气物质使得发酵蔬菜具有了独特的风味[7-8]。此外,发酵类蔬菜在制备和贮藏过程中,亚硝酸盐过度积累影响食品安全。亚硝酸盐的降解,主要有酸降解和酶降解两种途径,研究表明有机酸均能显著降低发酵类蔬菜中亚硝酸盐的含量[9-10]。微生物在发酵蔬菜风味形成过程中具有重要的作用[11-12]。因此,研究蔬菜发酵中微生物和风味物质之间的关系意义重大。研究表明,南方泡菜、西北浆水、南丰腌菜、北方酸菜、东北辣白菜、江南梅干菜和糟菜中厚壁菌门(Firmictes)和变形菌门(Proteobacteria)是优势菌门,但其相对丰度各不相同,乳杆菌属(Lactobacillus)是优势菌属[13]。从不同地区发酵蔬菜微生物群落结构研究发现,其丰富度和多样性随样品和地区的变化而发生变化[14-15]。虽然不同地域具有不同的代表性发酵蔬菜,但乳杆菌是发酵蔬菜中常见的微生物[16]。研究显示,自然发酵酸菜发酵过程中假单胞菌是在前期发酵过程中的主要优势菌群之一,到了发酵后期乳杆菌属为主要优势菌属,这些已知菌属能够影响酸菜的风味与成熟时间,乳酸菌、明串珠菌属的代谢有助于风味的形成[17]。
内蒙古自治区东西跨度在2 000 km以上,但都有食用酸菜(自然发酵的白菜)的习惯。内蒙古东西部酸菜在风味口感上存在显著差异,何种微生物为内蒙古地区自然发酵酸菜中优势菌,以及不同地区酸菜中细菌与亚硝酸盐和有机酸相关性研究鲜有报道。基于以上,本研究通过采集内蒙古东西10个盟市(阿拉善盟、巴彦淖尔市、鄂尔多斯市、包头市、呼和浩特市、乌兰察布市、赤峰市、通辽市、兴安盟、呼伦贝尔市)的传统自然发酵酸菜样品,利用高效液相色谱(high-performance liquid chromatography,HPLC)技术和高通量测序技术分析酸菜汤中亚硝酸盐、有机酸含量和细菌群落组成,为揭示和评价内蒙古地区酸菜微生物和风味物质特征及安全性奠定基础。
1 材料与方法
1.1 材料与试剂
Agarose琼脂糖凝胶、TAE缓冲液:美国英杰生命技术有限公司;DL15000脱氧核糖核酸(deoxyribonucleic acid,DNA)Marker:宝生物工程(大连)有限公司;Q5R High-Fidelity DNA 聚合酶:瑞士NBE公司;亚铁氰化钾:山东西亚化学工业有限公司;乙酸锌:天津永晟精细化工有限公司;冰醋酸:天津市风船化学试剂科技有限公司;硼酸钠、盐酸萘乙二胺:上海麦克林生化材料有限公司;对氨基苯磺酸:天津市大茂化学试剂厂;亚硝酸钠:上海山浦化工有限公司;仲辛醇:上海易恩化学技术有限公司。实验所用试剂均为分析纯。
1.2 仪器与设备
NC2000 NanoDrop紫外分光光度计:美国Thermo Scientific公司;DYY-6C电泳仪:北京六一仪器厂;BG-gdsAUTO(130)凝胶成像系统:北京百晶生物技术有限公司;2720聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:美国ABI公司;FLX800T酶标仪:美国BioTek公司;PHS-3CpH计:赛多利斯科学有限公司;LC-20AT高效液相色谱仪:日本岛津公司。
1.3 方法
1.3.1 样品采集
样品于2022年12月分别采集自内蒙古自治区阿拉善盟额济纳左旗(ALS)、巴彦淖尔市五原县(BM)、鄂尔多斯市乌审旗(EEDS)、包头市达尔罕茂明安联合旗(BT)、呼和浩特市武川县(HS)、赤峰市克什克腾旗(CF)、乌兰察布市商都县(WLCB)、通辽市科尔沁区(TL)、兴安盟扎赉特旗(XAM)、呼伦贝尔市鄂温克旗(HM)等地。酸菜制作的工艺为:选择抱心好的白菜,经晾晒蔫萎后去除表面一层菜叶,再经漂烫后(部分地区)加盐、加水入缸发酵。每个采样地区采集三份(共30份)样品于低温条件下送回实验室,取酸菜汤进行后续研究。
1.3.2 理化指标的测定
pH值的测定:使用pH计进行测定。
亚硝酸盐的测定[18]:参照GB 5009.33—2016《食品安全国家标准食品中亚硝酸盐与硝酸盐的测定》中的分光光度法。
有机酸含量的测定[19]:参照GB5009.157—2016《食品安全国家标准食品中有机酸的测定》中的高效液相色谱法。HPLC色谱条件:Xaqua C18色谱柱(4.6 mm×250 mm,5 μm)。紫外波长210 nm。柱温28 ℃,流速0.8 mL/min,进样量20 μL。流动相:0.01 mol/L磷酸氢二铵,用磷酸调pH为3.0,等度洗脱。
1.3.3 基因组DNA提取、PCR扩增及16S rRNA测序分析
基因组DNA提取使用Q5 R High-Fidelity DNAPolymerase试剂盒按说明书进行。用细菌通用引物338F(5'-ACTCCTACGGGAGGCAGCA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')扩增16S rRNA基因的V3~V4可变区,并进行高通量测序。其中测序由上海派森诺生物科技有限公司完成。PCR扩增程序:98 ℃预变性2 min;98 ℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s,30个循环;最后72 ℃延伸5 min。PCR扩增体系(25 μL):5 μL 5×缓冲液,5 μL 5×聚合酶,2 μL脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTP)(2.5 mol/L),正向引物(10 μmol/L)1 μL,反向引物(10 μmol/L)1 μL,DNA模板2 μL,8.75 μL ddH2O(双蒸水),Q5 DNA聚合酶0.25 μL。对高通量测序的原始下机数据根据序列质量进行初步筛查,通过质量初筛的原始序列按照Index和Barcode信息,进行文库和样本划分,并去除Barcode序列。数据库为:Silva数据库(http://greengenes.secondgenome.com/)。按照QIIME2 dada2分析流程或Vsearch软件的分析流程进行序列去噪或操作分类单元(operational taxonomic unit,OTU)聚类。根据ASV/OTU(抽平操作分类单元)在不同样本中的分布,评估每个样本的Alpha多样性水平,并通过稀疏曲线反映测序深度是否合适,计算各样本的距离矩阵,并通过多种非监督的排序、聚类手段,结合相应统计学检验方法,衡量不同样本间的beta多样性差异及差异显著性。
1.3.4 数据处理
利用Microsoft Excel和IBM SPSS Statistics 25.0软件进行数据处理与分析,结果以“平均值±标准差”表示。利用派森诺(https://www.genescloud.cn/login)、迈维(https://cloud.metware.cn/#/user/login)等云平台进行绘图。
2 结果与分析
2.1 不同地区样品pH、亚硝酸盐和有机酸含量
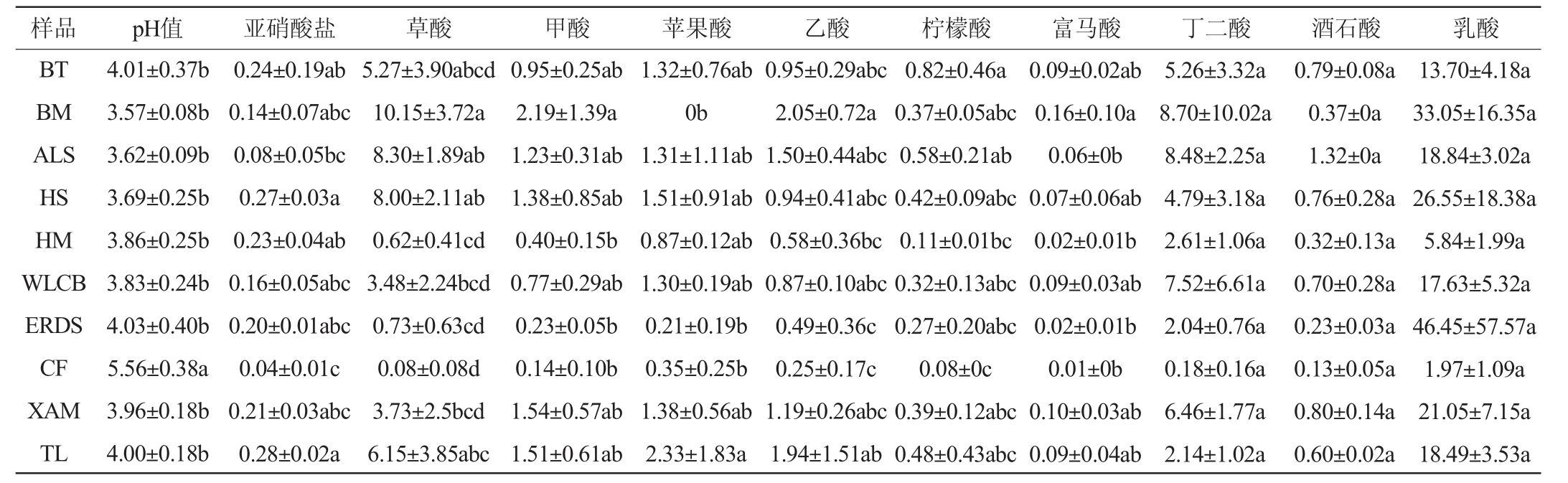
不同地区样品pH值、亚硝酸盐和有机酸测定含量测定结果见表1。
表1 内蒙古不同地区酸菜汤样品pH值、亚硝酸盐和有机酸含量测定结果
Table 1 Determination results of pH, nitrite and organic acid contents of sauerkraut soup samples from Inner Mongolia different regions
注:字母不同表示差异显著(P<0.05)。下同。
样品 pH值 亚硝酸盐 草酸 甲酸 苹果酸 乙酸 柠檬酸 富马酸 丁二酸 酒石酸 乳酸BT BM ALS HS HM WLCB ERDS CF XAM TL 4.01±0.37b 3.57±0.08b 3.62±0.09b 3.69±0.25b 3.86±0.25b 3.83±0.24b 4.03±0.40b 5.56±0.38a 3.96±0.18b 4.00±0.18b 0.24±0.19ab 0.14±0.07abc 0.08±0.05bc 0.27±0.03a 0.23±0.04ab 0.16±0.05abc 0.20±0.01abc 0.04±0.01c 0.21±0.03abc 0.28±0.02a 5.27±3.90abcd 10.15±3.72a 8.30±1.89ab 8.00±2.11ab 0.62±0.41cd 3.48±2.24bcd 0.73±0.63cd 0.08±0.08d 3.73±2.5bcd 6.15±3.85abc 0.95±0.25ab 2.19±1.39a 1.23±0.31ab 1.38±0.85ab 0.40±0.15b 0.77±0.29ab 0.23±0.05b 0.14±0.10b 1.54±0.57ab 1.51±0.61ab 1.32±0.76ab 0b 1.31±1.11ab 1.51±0.91ab 0.87±0.12ab 1.30±0.19ab 0.21±0.19b 0.35±0.25b 1.38±0.56ab 2.33±1.83a 0.95±0.29abc 2.05±0.72a 1.50±0.44abc 0.94±0.41abc 0.58±0.36bc 0.87±0.10abc 0.49±0.36c 0.25±0.17c 1.19±0.26abc 1.94±1.51ab 0.82±0.46a 0.37±0.05abc 0.58±0.21ab 0.42±0.09abc 0.11±0.01bc 0.32±0.13abc 0.27±0.20abc 0.08±0c 0.39±0.12abc 0.48±0.43abc 13.70±4.18a 33.05±16.35a 18.84±3.02a 26.55±18.38a 5.84±1.99a 17.63±5.32a 46.45±57.57a 1.97±1.09a 21.05±7.15a 18.49±3.53a 0.09±0.02ab 0.16±0.10a 0.06±0b 0.07±0.06ab 0.02±0.01b 0.09±0.03ab 0.02±0.01b 0.01±0b 0.10±0.03ab 0.09±0.04ab 5.26±3.32a 8.70±10.02a 8.48±2.25a 4.79±3.18a 2.61±1.06a 7.52±6.61a 2.04±0.76a 0.18±0.16a 6.46±1.77a 2.14±1.02a 0.79±0.08a 0.37±0a 1.32±0a 0.76±0.28a 0.32±0.13a 0.70±0.28a 0.23±0.03a 0.13±0.05a 0.80±0.14a 0.60±0.02a
由表1可知,10个地区样品的pH值为3.57~5.56,其中CF样品pH值(5.56)显著高于其他地区样品(P<0.05);10个地区样品的亚硝酸盐含量为0.04~0.28 mg/kg,均低于国标GB 2714—2015《酱腌菜卫生标准》中亚硝酸含量的规定(≤20 mg/kg)[20]。其中CF样品亚硝酸盐含量(0.04 mg/kg)显著低于其他地区(P<0.05)。
由表1亦可知,所有样品共检出9种有机酸,草酸含量为0.08~10.15 mg/mL,其中BM样品草酸含量最高,CF样品草酸含量最低。所有样品甲酸含量为0.14~2.19 mg/mL,BM样品甲酸含量显著高于ERDS、CF和HM样品(P<0.05)。所有样品苹果酸含量为0~2.33 mg/mL,TL样品苹果酸含量显著高于BM、ERDS和CF样品(P<0.05)。所有样品乙酸含量为0.25~2.05 mg/mL,BM样品乙酸含量显著高于ERDS、CF和HM样品(P<0.05),TL样品中的乙酸含量显著的高于ERDS和CF样品(P<0.05)。所有样品柠檬酸含量为0.08~0.82mg/mL,ALS样品柠檬酸含量显著高于CF样品(P<0.05),BT样品柠檬酸含量显著高于CF和HM样品(P<0.05)。所有样品中富马酸含量为0.01~0.16mg/mL,BM样品富马酸含量显著高于ALS、ERDS、CF和HM样品(P<0.05)。所有样品的丁二酸、酒石酸和乳酸含量间无显著差异(P>0.05)。9种有机酸中,乳酸含量在各样品中均为最高(1.97~46.45 mg/mL)。CF样品中除苹果酸之外,其余8种有机酸含量均最低。
研究表明乳杆菌发酵会大量产生乳酸,所以有机酸含量的变化,也可以反映出蔬菜发酵体系微生物菌群结构的变化[21]。魏振勇等[22]研究表明,乳酸菌是东北酸菜发酵过程中的关键菌属,它可以产生有机酸,导致pH降低。在本研究中,CF样品中8种有机酸含量均为最低,pH值最高。有机酸主要赋予酸菜的酸味,如柠檬酸可呈现温和而爽快的酸味。苹果酸可呈现爽快酸味,但是略含苦味。丁二酸呈现具有独特的能赋予泡菜类似贝类的鲜味。乙酸呈现的酸味比较刺激且短促,可以促进人的食欲,乳酸呈现的酸味比较柔和,后酸味绵长[21]。
2.2 不同地区酸菜汤中细菌多样性分析
2.2.1 不同地区酸菜汤中细菌α多样性
10个不同地区酸菜汤中细菌多样性指数结果见表2。
表2 内蒙古不同地区酸菜汤样品中细菌α多样性
Table 2 Bacterial α diversity in sauerkraut soup samples from Inner Mongolia different regions

样品 Shannon指数 Simpson指数 Chao1指数 Observed_species BT BM ALS HS HM WLCB ERDS CF XAM TL 5.55±0.8ab 5.73±0.62ab 6.09±0.86a 4.23±0.82bc 5.48±0.63ab 3.24±0.84c 5.48±0.81ab 5.34±0.38ab 5.42±0.57ab 5.96±0.44a 0.87±0.09ab 0.91±0.02ab 0.95±0.02a 0.78±0.06b 0.88±0.07ab 0.61±0.15c 0.92±0.04ab 0.93±0.03ab 0.89±0.06ab 0.95±0.01a 1001.24±132.52a 991.12±381.26a 957.05±440.70a 553.79±131.02ab 895.95±233.81ab 359.51±77.13b 661.49±252.48ab 816.07±47.79ab 810.10±216.24ab 891.89±270.22ab 939.6±155.71a 939.2±376.92a 920.13±438.53a 493.97±123.45ab 882.00±232.59ab 319.57±62.45b 646.50±258.3ab 793.30±48.53ab 780.63±210.71ab 862.00±248.23ab
从Shannon指数来看,ALS样品最高(6.09),WLCB样品最低(3.24),WLCB样品显著低于BT、BM、ALS、HM、ERDS、CF、XAM、TL样品(P<0.05)。从Simpson指数来看,ALS与TL样品最高(0.95),WLCB样品最低(0.61),ALS、TL与HS和WLCB样品之间Simpson指数差异显著(P<0.05),WLCB样品与BT、BM、ALS、HS、HM、ERDS、CF、XAM、TL样品之间Simpson指数差异显著(P<0.05)。Shannon指数和Simpson指数的差异表明,ALS地区酸菜样品中细菌多样性最高,WLCB地区酸菜样品中细菌多样性最低。从Chao1指数来看,BT样品最高(1 001.24),WLCB样品最低(359.51)。从Observed_species来看,BT样品最高(939.6),WLCB样品最低(319.57)。从Chao1指数和Observed_species来看,WLCB样品与BT、BM、ALS样品有显著差异(P<0.05),BT样品的Chao1指数和Observed_species指数最高,说明其物种总数与丰富度最高,WLCB样品Chao1指数和Observed_species指数最低,说明其物种总数与丰富度低于其他地区。
2.2.2 不同地区酸菜汤中细菌菌落组成
不同地区酸菜汤样品中细菌群落结构分析结果见图1。

图1 基于门水平(A)及属水平(B)内蒙古不同地区酸菜汤样品中细菌群落相对丰度的变化
Fig.1 Changes of relative abundance of bacterial communities of sauerkraut soup samples from Inner Mongolia different regions based on phylum (A) and genus (B) level
由图1A可知,在门水平上,WLCB、HS、BM、XAM、ERDS、BT、ALS、TL、HM、CF样品中的厚壁菌门(Firmictes)相对丰度依次减少,WLCB样品的厚壁菌门相对丰度最高为(88.01%),CF样品的厚壁菌门相对丰度最低(21.70%),而WLCB、HS、BM、XAM、ERDS、BT、ALS、TL、HM、CF样品中的变形菌门(Proteobacteria)相对丰度依次增加,CF样品的变形菌门相对丰度最高(71.36%),WLCB样品的变形菌门最低(11.43%)。除此之外,不同地区也有其他特有菌门,BT、BM、WLCB样品中Actinobacteria相对丰度分别为0.36%、2.09%、0.12%,ALS、HM、ERDS、CF、XAM、TL样品中拟杆菌门(Bacteroidetes)相对丰度分别为0.16%、0.25%、0.06%、6.76%、0.09%、0.35%,WLCB样品中Epsilonbacteraeota相对丰度为0.51%。因此,在门水平上各地样品虽然存在差异,但厚壁菌门和变形菌门为内蒙古地区酸菜汤的优势菌门。
由图1B可知,在属水平上,相对丰度前10的属分别为乳杆菌属(Lactobacillus)、片球菌属(Pediococcus)、假单胞菌属(Pseudomonas)、嗜冷杆菌属(Psychrobacter)、明串珠菌属(Leuconostoc)、盐单胞菌属(Halomonas)、乳球菌属(Lactococcus)、肠杆菌属(Enterbacter)、海单胞菌属(Marinomonas)、八叠球菌属(Sporosarcina)。其中,在10个地区的前10个属中,Lactobacillus和Pediococcus为共有菌属,从BM到HS的Lactobacillus相对丰度逐渐降低,其中,BM样品Lactobacillus相对丰度最高,为64.07%,HS样品Lactobacillus相对丰度最低,为9.51%。CF样品中假单胞菌属(Pseudomonas)相对丰度最高,为43.57%。此外,Pediococcus在WLCB样品中相对丰度最高,为74.62%,BM样品相对丰度最低,为1.24%。因此,Lactobacillus和Pediococcus为内蒙古地区发酵酸菜汤中的优势细菌属。
2.2.3 不同地区酸菜汤中细菌种属分析
不同地区酸菜汤中细菌属韦恩图见图2。
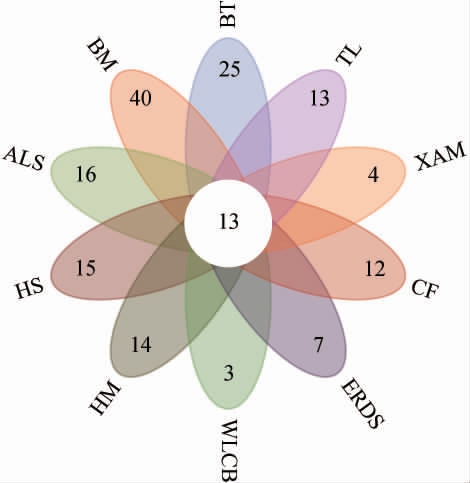
图2 内蒙古不同地区酸菜汤中细菌属韦恩图
Fig.2 Venn diagram of bacterial genera in sauerkraut soup samples from Inner Mongolia different regions
由图2可知,10个地区中共有菌属有13个,分别为Brevundimonas、Lactobacillus、Leuconostoc、Pediococcus、Pseudomonas、Psychrobacter、Stenotrophomonas。WLCB样品特有菌属有3个,BT样品特有菌属有25个,BM样品特有菌属有40个,ALS样品特有菌属有16个,HS样品特有菌属有15个,HM样品特有菌属有14个,CF样品特有菌属有12个,XAM样品特有菌属有4个,TL样品特有菌属有13个。
据研究表明,乳杆菌属(Lactobacillus)、片球菌属(Pediococcus)、乳球菌属(Lactococcus)与风味形成密切相关,其中乳杆菌属最为重要,是发酵过程中的核心功能菌种[23-25],碳水化合物、氨基酸和核苷酸的代谢是决定酸菜特征的主要因素[26]。明串珠菌属(Leuconostoc)主要代谢产物包括乳酸、乙醇、甘露醇和氨基酸等风味物质,对特有风味的形成具有重要作用[27],假单胞菌属(Pseudomonas)与发酵酸菜中生物胺的形成息息相关[28]。本研究中也发现样品中存在嗜冷杆菌属,这可能是由于在冬天盐渍,在寒冷的环境中,蔬菜表面附着有嗜冷杆菌的缘故[26]。综上所述,内蒙古地区酸菜样品中菌种群组成丰富,不同地区中菌属差异明显,表明菌群结构的复杂性与不同地区有着密切联系。
2.2.4 不同地区酸菜汤样品层次聚类分析
不同地区酸菜汤样品层次聚类分析结果见图3。由图3可知,10个地区酸菜样品可分为三大类型,其中HS和WLCB样品可分为一类,CF自成一个类,其余样品可分为一类型。HS和WLCB样品细菌群落相似度较高,一方面可能是因为地理位置接近,另一方面可能因为腌制酸菜的生活习惯相似导致。CF样品可能是因为其门水平及属水平结构与其他样品不同,且其pH值与其他地区具有显著性差异以及CF样品中含有机酸的含量也均为最低,有其独特性。
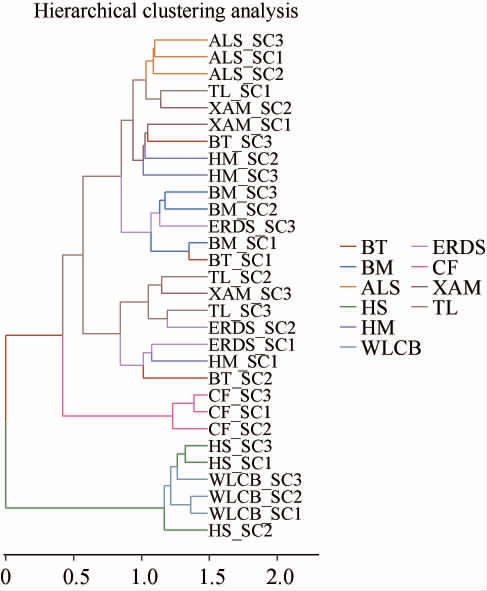
图3 内蒙古不同地区酸菜汤样品层次聚类分析
Fig.3 Hierarchical cluster analysis of sauerkraut soup samples from Inner Mongolia different regions
2.3 不同地区酸菜汤差异细菌菌属
利用线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)分析三种类型样品间的差异细菌属,结果见图4。

图4 内蒙古不同地区酸菜汤样品中差异细菌种属线性判别分析效应大小
Fig.4 Linear discriminant analysis effect size of differential bacterial species in sauerkraut soup samples from different regions of Inner Mongolia different regions
A:HS、WLCB;B:CF;C:BT、BM、ALS、HM、ERDS、XAM、TL。
由图4可知,Pediococcus可以作为A组的差异细菌属。Pseudomnas、Psychrobacter、Dysgonomonas、Stenotrophomonas、Providencia、Janthinobacterium、Morganella、Carnobacterium、Clostridioides、Tissierella、Sphingobacterium、Pseudoclavibacter、Sanguibacter、Leucobacter、Paenibacillus、Porphyromonadaceeae、Paenisporosarcina、Enterococcus、Brevundimonas、Myroides、Anaerocolumna可以作为B组的差异细菌属。Lactobacillus、Lactococcus、Enterobacter、Sporosarcina、Serratia、Weissella、Jeotgalicoccus、Rahnella可以作为C组的差异细菌属。
2.4 不同地区酸菜汤中亚硝酸盐、有机酸与细菌种属的相关性分析
为进一步揭示发酵酸菜汤中细菌种属与pH、有机酸和亚硝酸盐之间的关系,基于Spearman相关系数对相对丰度前五十的细菌属、亚硝酸盐和有机酸间进行了相关性分析,结果见图5。
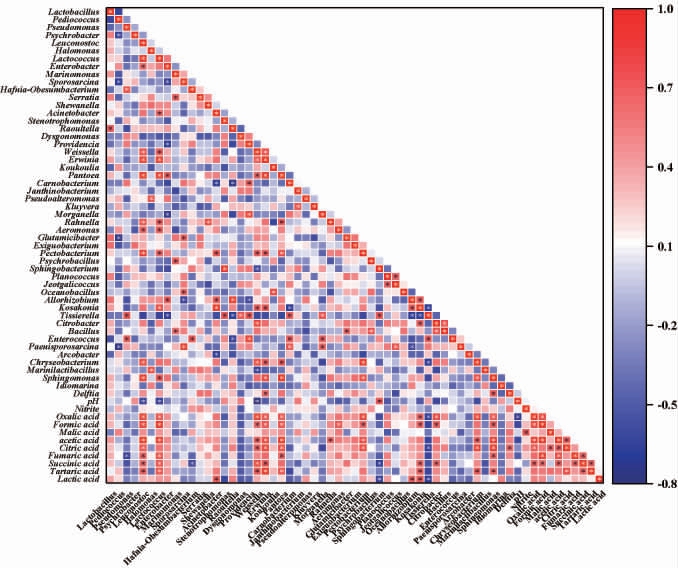
图5 内蒙古不同地区酸菜汤样品理化指标与细菌种属的相关性分析
Fig.5 Correlation analysis between physiochemical indexes and bacterial species of sauerkraut soup samples from Inner Mongolia different regions
“*”表示显著相关(P<0.05)。
由图5可知,pH与Leuconostoc、Lactococcus、Weissella呈显著负相关(P<0.05),与Sphingobacterium呈显著正相关(P<0.05)。苹果酸与亚硝酸盐呈显著正相关(P<0.05)。从细菌间相关性来看,相对丰度前10的属中Leuconostoc与Lactococcus、Enterobacter、Weissella、Erwinia、Pantoea、Rahnella、Aeromonas、Pectobacterium、Chryseobacterium和Sphingomonas呈显著正相关(P<0.05)。Lactococcus与Leuconostoc、Acinetobacter、Raoultella、Weissella、Erwinia、Pantoea、Rahnella、Aeromonas、Pectobacterium、Kosakonia和Sphingomonas呈显著正相关(P<0.05)。乳酸菌中的Weissella与Leuconostoc、Lactococcus、Erwinia、Pantoea、Pectobacterium、Sphingobacterium、Kosakonia、Chryseobacterium呈显著正相关(P<0.05),与Marinilactibacillus呈显著负相关(P<0.05)。Tissierella与Pseudomonas、Stenotrophomonas、Dysgonomonas、Providencia、Carnobacterium、Morganella、Sphingobacterium呈显著正相关(P<0.05),与Enterobacter、Raoultella、Allorhizobium、Kosakonia、Chryseobacterium呈显著负相关(P<0.05)。Bacillus与Marinomonas、Glutamicibacter、Psychrobacillus、Citrobacter呈显著正相关(P<0.05)。
从有机酸与细菌间的相关性来看,草酸与Leuconostoc、Lactococcus、Weissella、Erwinia、Pantoea、Pectobacterium、Kosakonia、Citrobacter、Chryseobacterium、Sphingomonas呈显著正相关(P<0.05),与Tissierella、pH呈显著负相关(P<0.05)。甲酸与Leuconostoc、Lactococcus、Weissella、Erwinia、Pantoea、Aero monas、Pectobacterium、Kosakonia、Citrobacter、Sphingomonas呈显著正相关(P<0.05)。乙酸与Leuconostoc、Lactococcus、Weissella、Erwinia、Pantoea、Rahnella、Pectobacterium、Chryseobacterium、Sphingomonas呈显著正相关(P<0.05)。柠檬酸与Leuconostoc、Weissella、Erwinia、Pantoea、Pectobacterium、Kosakonia、Citrobacter、Chryseobacterium、Sphingomonas、Delftia呈显著正相关(P<0.05),与Tissierella呈显著负相关(P<0.05)。富马酸与Pseudomonas呈显著负相关(P<0.05),与Leuconostoc、Lactococcus、Pantoea、Sphingobacterium呈显著正相关(P<0.05)。丁二酸与Leuconostoc、Lactococcus、Weissella、Erwinia、Kosakonia、Citrobacter呈显著正相关(P<0.05),与Hafnia-Obesumbacterium呈显著负相关(P<0.05)。酒石酸与Leuconostoc、Lactococcus、Weissella、Erwinia、Pantoea、Kosakonia、Chryseobacterium、Sphingomonas呈显著正相关(P<0.05)。乳酸与Acinetobacter、Allorhizobium、Kosakonia呈显著正相关(P<0.05),与Sphingobacterium、Tissierella呈显著负相关(P<0.05)。
总体来看,Lactococcus和Leuconostoc与众多菌属呈显著正相关(P<0.05),除乳酸、苹果酸之外的7种有机酸与Lactococcus、Leuconostoc、Weissella、Tissierella 和Pantoea五种菌属间呈显著正相关(P<0.05)。苹果酸与亚硝酸盐呈显著正相关(P<0.05)。pH与Leuconostoc、Lactococcus、Weissella、草酸呈显著负相关(P<0.05)。
3 结论
本研究对收集自内蒙古共30份(HS、WLCB、CF、BT、BM、ALS、HM、ERDS、XAM和TL)酸菜汤样品的亚硝酸盐、有机酸和细菌群落多样性进行了分析,结果显示,所有样品的亚硝酸盐含量均满足相关国标规定要求。CF样品pH值显著高于其他地区,且CF样品亚硝酸盐含量显著低于其他地区。乳酸是含量最高的有机酸。多样性分析发现,厚壁菌门(Firmictes)和变形菌门(Proteobacteria)是所采集样品中的优势细菌门,乳杆菌属(Lactobacillus)和片球菌属(Pediococcus)是优势细菌属。根据细菌群落结构差异可将内蒙10个地区样品分为三大类型,其中HS和WLCB样品相似度较高聚为一类,CF自成一类,其余样品聚为一类型。相对丰度前10的属中,Lactococcus和Leuconostoc与多数菌属呈显著正相关(P<0.05),除乳酸、苹果酸之外的7种有 机 酸 与Lactococcus、Leuconostoc、Weissella、Tissierella 和Pantoea五个属间呈显著正相关(P<0.05)。苹果酸与亚硝酸盐呈显著正相关(P<0.05)。pH与Leuconostoc、Lactococcus、Weissella、草酸呈显著负相关(P<0.05)。
[1]陈功.试论中国泡菜历史与发展[J].食品与发酵科技,2010,46(3):1-5.
[2]卢晓黎,尼海峰.发酵蔬菜功能菌研究与应用进展[J].中国食品学报,2012,12(2):1-6.
[3]LEE S H, KANG K M.Quality characteristics of low salt kalopanax pictus shoot Jangajji using soybean sauce[J].J Korean Soc Food Sci Nutr,2015,44(1):104-110.
[4]XIAO M Y, XIONG T, PENG Z, et al.Correlation between microbiota and flavors in fermentation of Chinese Sichuan Paocai[J].Food Res Int,2018,114:123-132.
[5]赵明阳.泡菜发酵优良菌株筛选及细菌组成、风味特性研究[D].济南:山东农业大学,2020.
[6]KANG J H,LEE J H,MIN S,et al.Changes of volatile compounds,lactic acid bacteria, pH, and headspace gases in kimchi, a traditional Korean fermented vegetable product[J].J Food Sci,2003,68(3):849-854.
[7]QI C,LI Y,YAN K L,et al.Variations of volatile flavors and microbial communities in Chinese Chaozhou pickle during natural fermentation revealed by GC-IMS and high-throughput sequencing[J].LWT-Food Sci Technol,2024,191:115610.
[8]ZHANG M, WU J R, LI X, et al.Survey of nitrite in the naturally fermented sour pickled cabbages in northeast of China[J].Adv Mater Res,2012,613:409-412.
[9]皮佳婷,刘冬敏,王建辉,等.乳酸菌降解泡菜中亚硝酸盐的机制及应用研究现状[J].食品与发酵工业,2021,47(24):301-307.
[10]商景天,王修俊,王继辉.有机酸对泡菜中亚硝酸盐的降解作用[J].食品与机械,2018,34(3):73-78.
[11]YE Z, SHANG Z X, ZHANG S Y, et al.Dynamic analysis of flavor properties and microbial communities in Chinese pickled chili pepper(Capsicum frutescens L.):A typical industrial-scale natural fermentation process[J].Food Res Int,2022,153:110952.
[12]陈弦,张雁,陈于陇,等.发酵蔬菜风味形成机制及其分析技术的研究进展[J].中国食品学报,2014,14(2):217-224.
[13]解文利.贵州吉林传统发酵蔬菜微生物多样性及其乳酸菌抗氧化功能评估[D].贵阳:贵州大学,2021.
[14]CAI W C,TANG F X,WANG Y R,et al.Bacterial diversity and flavor profile of Zha-Chili,a traditional fermented food in China[J].Food Res Int,2021,141:110112.
[15]颜娜,王玉荣,廖华,等.恩施地区酸萝卜中细菌多样性研究[J].中国食品添加剂,2019,30(1):69-76.
[16]刘长根.我国传统发酵蔬菜微生物多样性比较[D].南昌:南昌大学,2019.
[17]贾晶晶,赵虎威,燕平梅.酸菜发酵过程中细菌群落结构变化及驱动机制[J].中国食品学报,2023,23(8):354-368.
[18]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 5009.33—2016 食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定[S].北京:中国标准出版社,2016.
[19]中华人民共和国国家卫生和计划生育委员会.GB 5009.157—2016食品安全国家标准食品中有机酸的测定[S].北京:中国标准出版社,2016.
[20]中华人民共和国国家卫生和计划生育委员会.GB 2714—2015 酱腌菜卫生标准[S].北京:中国标准出版社,2015.
[21]王勇.模拟不同工艺发酵白菜(Brassica pekinensis Rupr)制作过程中细菌菌群结构和风味成分的变化[D].雅安:四川农业大学,2020.
[22]魏振勇,李娜,孙全敏,等.亚硝酸盐对酸菜中菌属微生物量的影响及相关性分析[J].中国调味品,2023,48(10):33-38,72.
[23]LEE M,SONG H J,JUNG Y M,et al.Large-scale targeted metagenomics analysis of bacterial ecological changes in 88 kimchi samples during fermentation[J].Food Microbiol,2017,66:173-183.
[24]GUAN Q Q,ZHENG W D,HUANG T,et al.Comparison of microbial communities and physiochemical characteristics of two traditionally fermented vegetables[J].Food Res Int,2020,128:108755.
[25]LEE M,SONG J H,PARK J M,et al.Bacterial diversity in Korean temple kimchi fermentation[J].Food Res Int,2019,126:108592.
[26]陈倩,李永杰,扈莹莹,等.传统发酵食品中微生物多样性与风味形成之间关系及机制的研究进展[J].食品工业科技,2021,42(9):412-419.
[27]杜晓华.四川泡菜微生态研究及优良乳酸菌的分离、筛选[D].雅安:四川农业大学,2012.
[28]汪铃.传统低盐泡菜发酵体系稳定性及香辛料对其影响[D].镇江:江苏大学,2022.