真菌毒素是最常见的食品安全风险因子之一,赭曲霉毒素是继黄曲霉毒素后又一个引起世界广泛关注的真菌毒素。赭曲霉毒素包括7种结构类似的化合物,其中赭曲霉毒素A(ochratoxin A,OTA)最为常见且毒性最强,已有研究证明,其具有肝肾毒性[1]、神经毒性[2]、免疫毒性[3]、致畸性、致突变性、遗传毒性、胚胎毒性以及睾丸毒性等多种毒性[4-5],故OTA已被国际癌症研究机构列为2B类致癌物[6]。2002年欧盟调查结果表明,除谷物及谷物产品外,葡萄酒也是人们摄入OTA的一个主要来源[7];鉴于OTA对人体的危害,我国国家标准(GB 2761—2017《食品安全国家标准食品中真菌毒素限量》)规定其在葡萄酒中的最大允许检出量为2 μg/kg[8]。目前,全球葡萄酒中OTA污染发生率较高,但大部分葡萄酒中OTA含量均未超过限量值。
OTA的去除方法主要包括物理法、化学法及生物法,目前已被证实生物法与传统理化方式相比,具有亲和性强,经济高效,不破坏食品的品质和营养价值等特点。酵母作为葡萄酒生产的主要微生物,已有许多研究者证实其具有OTA去除潜力,BEJAOUI H等[9]评估了一种商业菌株和一种酿酒酵母野生菌株在酒精发酵过程中去除OTA的能力,结果表明,野生酵母ZIM 1927和商业酵母Lalvin EC-1118可去除培养基质中29.7%和25.4%的OTA,去除OTA的方式主要是细胞吸附作用;全莉等[10]针对葡萄酒生产各阶段OTA含量的变化做了评估,发现酒精发酵阶段对葡萄酒中OTA的含量的变化影响最大,酒精发酵结束后葡萄酒中OTA的含量下降了30.19%~35.45%,澄清、过滤和陈酿阶段OTA的含量变化为10%~20%。然而,鲜有研究对本土酵母CECA的OTA去除潜力进行探究,本研究探究了本土酿酒酵母(Saccharomyces cerevisiae)CECA在不同发酵基质(酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基、红葡萄醪)以及不同的发酵方式(单独发酵、混合发酵)对OTA含量变化的影响,以处理前后的OTA含量变化作为参考依据,比较不同发酵条件下酵母对OTA去除的效果,通过对酵母细胞的不同处理(热致死、细胞培养上清液、酵母胞内酶)与OTA共培养进行OTA去除机理探究,通过透射电子显微镜深入分析酵母细胞壁厚度,不仅评估了本土酵母CECA的OTA清除潜力,并且揭示了其对OTA的清除机理,为不同发酵基质的OTA的去除提供了参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
赤霞珠酿酒葡萄:杨陵曹新庄葡萄园;本土酿酒酵母(Saccharomyces cerevisiae)CECA、非酿酒酵母(non-S.cerevisiae)菌株(耐热克鲁维酵母(Kluyveromyces thermotolerans)KT-CVE7、东方伊萨酵母(Issatchenkia orientalis)IO QC、德尔布有孢圆酵母(Torulaspora delbrueckii)NS-D):安琪酵母有限公司。根据各酵母英文名称首字母将酵母在本文中分别简称为C、K、I、N,共同培养处理组根据酵母名称命名为C-K、C-I、C-N,所有组合均进行3次重复实验。
1.1.2 化学试剂
OTA标准品(纯度>98%):上海安谱实验科技股份有限公司;乙腈、冰醋酸、甲醇、二氯甲烷、碳酸氢钠、葡萄糖、氯化钠(均为色谱纯):四川西陇科学有限公司;福林酚(分析纯):北京索莱宝科技有限公司;蛋白胨、酵母浸粉(均为生化试剂):青岛海博生物科技有限公司;果胶酶(酶活30 000 U/g),氢氧化钠(分析纯):上海麦克林生化科技股份有限公司;亚硫酸(分析纯):天津市科密欧化学试剂有限公司。
1.1.3 培养基
WL培养基:上海优选生物科技有限公司。
YPD液体培养基:酵母浸粉10 g,蛋白胨20 g,葡萄糖20 g,蒸馏水1 000 mL,121 ℃灭菌20 min。
1.2 仪器与设备
ZQLY-300N恒温振荡培养箱:上海知楚仪器有限公司;SX-700蒸汽消毒柜:上海坦尔生物科技有限公司;UV-2450紫外可见分光光度计:美国安捷伦公司;LC-20A高效液相色谱仪(high performance liquid chromatography,HPLC)(配荧光检测器(fluorescence detector,FLD)):日本岛津公司;HC-3016R高速冷冻离心机:安徽中科中佳科学仪器有限公司;CM-12水浴氮吹仪:北京成萌伟业科技有限公司;CJ-1D超净工作台:天津市泰斯特仪器有限公司;LHR-250A恒温生化培养箱:韶关市泰宏医疗器械有限公司。
1.3 方法
1.3.1 酵母在不同含量OTA的YPD培养基中的生长情况分析
将酵母干粉用37℃温水活化,在WL培养基上划线培养,挑取生长出的单菌落,以106 CFU/mL的浓度接种于YPD液体培养基,28℃活化培养16h至对数生长期,以106CFU/mL的接种量分别接种到不同OTA含量(0、10 μg/L、50 μg/L)的YPD培养基中,28 ℃、120 r/min培养48 h,分别在0、2 h、8 h、14 h、24 h、48 h取样,采用平板计数法,记录在不同时间点的菌落数,取菌落对数值绘制相应的酵母生长曲线。
1.3.2 各酵母对YPD培养基中OTA含量变化的影响
(1)单独培养:将酵母N、I、K、C纯化培养至第三代,以106 CFU/mL的接种量添加至OTA含量为10 μg/L的YPD培养基中,28 ℃、120 r/min培养48 h,利用HPLC测定处理前后OTA含量。
(2)混合培养:将酵母N、I、K、C纯化培养至第三代,以106 CFU/mL的接种量将酵母C分别与酵母N、I、K以1∶1的比例混合添加至OTA含量为10 μg/L的YPD培养基中,分别记为C-N、C-I、C-K,28 ℃、120 r/min培养48 h,利用HPLC测定处理前后OTA含量,
1.3.3 葡萄酒的制备
将葡萄分选除杂后进行破碎、除梗得到葡萄醪液,同时添加果胶酶(0.25 g/L),之后添加0.6 mL/L的偏重亚硫酸钾使SO2的含量达到60 mg/L,设定酵母接种量为1×106 CFU/mL,在含OTA的葡萄醪液中,将酿酒酵母与每种非酿酒酵母以1∶1的比例进行添加,混合发酵处理组有3组(C-N、C-I、C-K),酿酒酵母CECA在含和不含OTA的葡萄醪中单独发酵的对照组各1个,含OTA的对照组记为C,不含OTA的对照组记为对照,每个处理设置3组平行。发酵温度保持在26 ℃,用手持式糖度计测量其可溶性固形物,可溶性固形物3 d不变时可认定发酵结束。
1.3.4 葡萄酒生产各阶段OTA含量的变化
葡萄醪液添加酵母启动酒精发酵之前,将葡萄醪液中OTA含量设置为10 μg/L。在主发酵阶段每2 d取样并检测OTA的含量变化情况,在皮渣分离、4 ℃条件下静置澄清、陈酿6个月的处理阶段再分别取样检测OTA的含量。
1.3.5 酵母去除OTA的机理探究
(1)酵母、热致死酵母及酵母培养上清液对OTA含量的影响
将纯化培养至第三代的各酵母培养48 h,稀释为1×106 CFU/mL的菌悬液,平分为两份,4 500 r/min、10 min离心3次收集菌体,保留离心上清液。
①吸取其中一份菌悬液1 mL于锥形瓶,再加入100 mL OTA含量为20 μg/L的YPD培养基,28 ℃、120 r/min培养24 h,取样,4 ℃避光保存备用。
②取另一份菌悬液进行热致死(121 ℃、30 min),同样吸取1 mL于锥形瓶,再加入100 mL OTA含量为20 μg/L的YPD培养基,28 ℃、120 r/min培养48 h,取样,4 ℃避光保存备用。将热灭活菌体涂布在WL培养基上,28 ℃静置培养24 h后观察有无菌落长出,以此判断菌体是否完全灭活。
③取酵母培养上清液100 mL,添加OTA使其最终含量为20μg/L,28℃、120r/min培养24h,取样,4℃避光保存备用。
各取500 μL的色谱甲醇和样品混匀,经0.22 μm有机滤膜过滤后,采用HPLC测定OTA含量。
(2)酵母胞内酶对OTA的影响
取活化后的菌液离心(4 500 r/min、10 min)后用Tris-HCl(50 mmol/L,pH 6.8)洗涤两次,取酵母细胞经液氮快速研磨,重悬于10 mL Tris-HCl缓冲液中,剧烈振荡1 min后冰浴0.5 h,促进胞内酶的提取,离心(10 000 r/min、4 ℃),收集上滤液(即胞内粗酶液)。未加酵母细胞的提取液作为对照组,即Tris-HCl缓冲液。
各取等量的胞内酶粗液和未加酵母细胞提取液,向两组处理中(A)胞内酶粗液(B)Tris-HCl缓冲液中添加OTA储备液,使含量达到20 μg/L,28 ℃、120 r/min培养24 h,4 500 r/min离心10 min后过滤,测定OTA含量。
(3)酵母细胞壁厚度测量统计
利用透射电子显微镜对4株酵母进行细胞壁厚度测量计算,具体步骤如下:酵母细胞→蒸馏水洗涤→戊二醛固定→磷酸缓冲液(pH7.2)漂洗→1%的锇酸固定→磷酸缓冲液(pH7.2)漂洗→乙醇脱水→胶∶乙醇(1∶1)渗透过夜→纯胶渗透2次→烘干胶粒→切样→透射电子显微镜观察。细胞壁厚度的测定遵循随机和平均的原则,首先,随机寻找5个不同的视野,每个视野中随机选定10个完整的酵母细胞,每个细胞中分别测定4个不同点的厚度值,利用频率直方统计法计算每株酵母菌的平均细胞厚度。
1.3.6 测定方法
(1)葡萄酒基本理化指标的测定
总糖的测定:参考3,5-二硝基水杨酸比色法测定葡萄酒中的总糖[13];总酚的测定:采用福林-肖卡法[14];pH的测定:pH计;酒精度、总酸、残糖的测定参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》[15]。
(2)OTA含量测定
样品前处理:参考曾慧等[16]的方法并略作修改。依次吸取2.0 mL样品、10 mL1 mol/L盐酸溶液、2.0 mL二氯甲烷于10 mL离心管中,振荡1 min后放入离心机(4 500 r/min)离心10 min,移取1.0 mL下层有机相于吹氮管中,60 ℃缓慢氮吹浓缩。用1.0 mL 0.13 mol/L碳酸氢钠溶液溶解残余物,过0.22 μm有机滤膜备用。
分析方法:通过具有分析柱UItimate XB-C18(4.6 mm×250 mm×5 μm)的HPLC-FLD仪器进行OTA分析。在等度洗脱条件下,流速1 mL/min(水/乙腈/乙酸:102/96/2,V/V/V),柱温35 ℃,进样量50 μL。分别在波长333 nm和460 nm的激发和发射波长下进行检测。在此检测条件下,于15 min前后会出现OTA的特征峰,对不同质量浓度OTA标品(1 μg/L、5 μg/L、10μg/L、20 μg/L、50 μg/L)进行测定,得到相应质量浓度下的峰面积,以峰面积(y)与OTA质量浓度(x)绘制标准曲线图,后续可根据样品出峰情况及峰面积对OTA含量进行定性定量分析。
1.3.7 数据处理与统计分析
采用Microsoft Office 2016软件进行数据统计,Excel 2016进行均值的计算;SPSS 26软件对不同发酵处理酒样的理化指标进行单因素方差分析(one-way analysis ofvariance,one-way ANOVA),邓肯法(Duncan)进行事后多重比较,P<0.05表示差异显著;用Origin 2022软件绘制统计图。每组实验均设置了3组重复。
2 结果与分析
2.1 各酵母在不同含量OTA的YPD培养基中的生长情况及生长参数分析
由图1可知,试验所选用的所有酵母生物量整体呈现先增加后趋于平稳的趋势,且不同的OTA含量对酵母生长几乎没有影响,在3种不同OTA含量的YPD培养基中,各酵母的生长曲线基本吻合,表明实验所选的4株酵母均可以在OTA存在的培养基中正常生长,可继续进行酵母对OTA的去除试验。
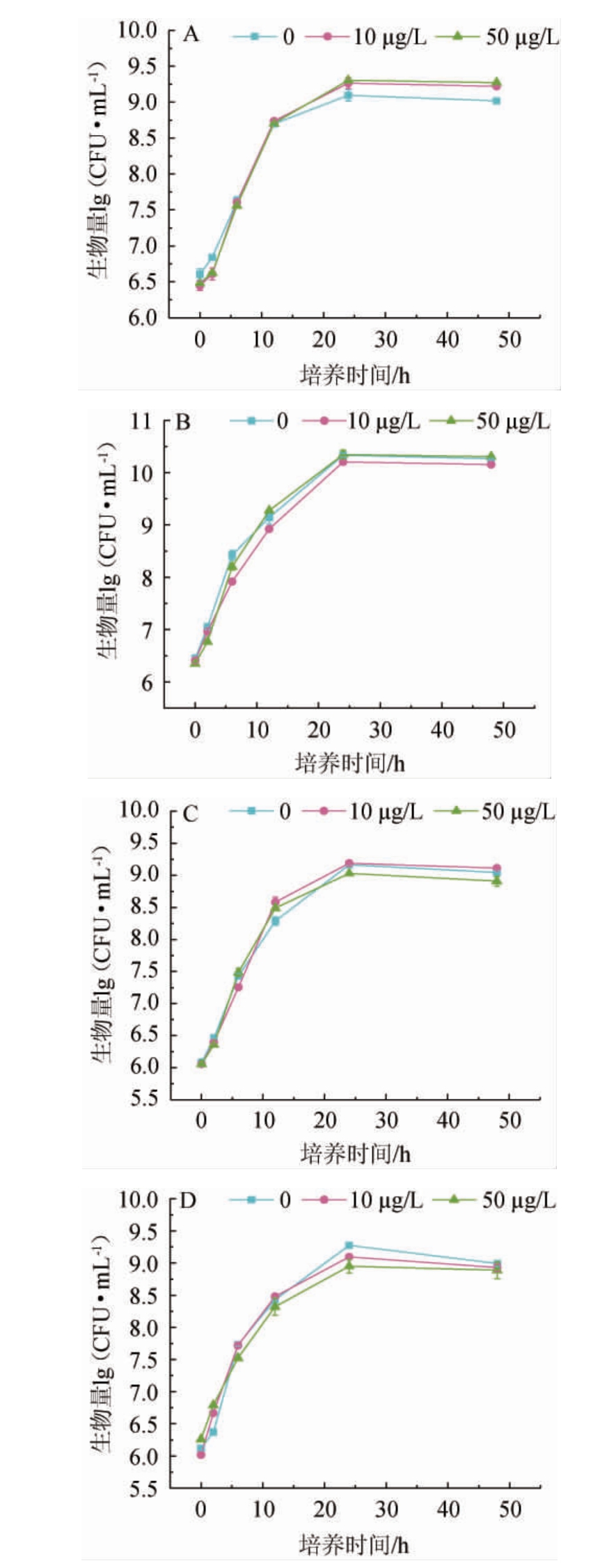
图1 4种酵母在不同赭曲霉毒素A含量的YPD培养基中单独培养的生长曲线
Fig.1 Growth curves of 4 yeasts cultured individually in YPD medium with different concentrations of ochratoxin A
有研究发现,在OTA(6.0 μg/L)存在时,20多种酿酒酵母与柠檬克勒克酵母菌株的生长不受影响[17];FREIRE L等[12]将从葡萄园筛选得到的酿酒酵母在含量为10 μg/L、20 μg/L和30 μg/L的YPD培养基中进行培养,同样发现酵母生长曲线并不受OTA含量的影响,这与本实验的结果一致;本实验将OTA含量提高至50 μg/L,进一步探究了高浓度OTA的存在对酵母生长的影响。有研究者在利用酿酒酵母对以玉米为原材料进行酒精发酵的实验中,将OTA的含量设置为177.5 μg/L[18],然而,该实验所评估的OTA含量远高于天然被OTA污染的发酵食品中发现的含量[12,19-20]。考虑到实际葡萄原料中OTA的可能污染量以及OTA后期的检测问题,将后续实验基质中OTA的含量设置为10 μg/L。
2.2 各酵母对YPD培养基中OTA的含量变化影响
由图2A可知,单独培养时OTA去除率最高的为酿酒酵母C(21.94%),非酿酒酵母中OTA去除率最高的为酵母K(20.54%),OTA去除率均显著高于非酿酒酵母N(10.18%)和I(9.56%)(P<0.05),YPD培养基中OTA含量的变化率在各菌株之间差异显著。
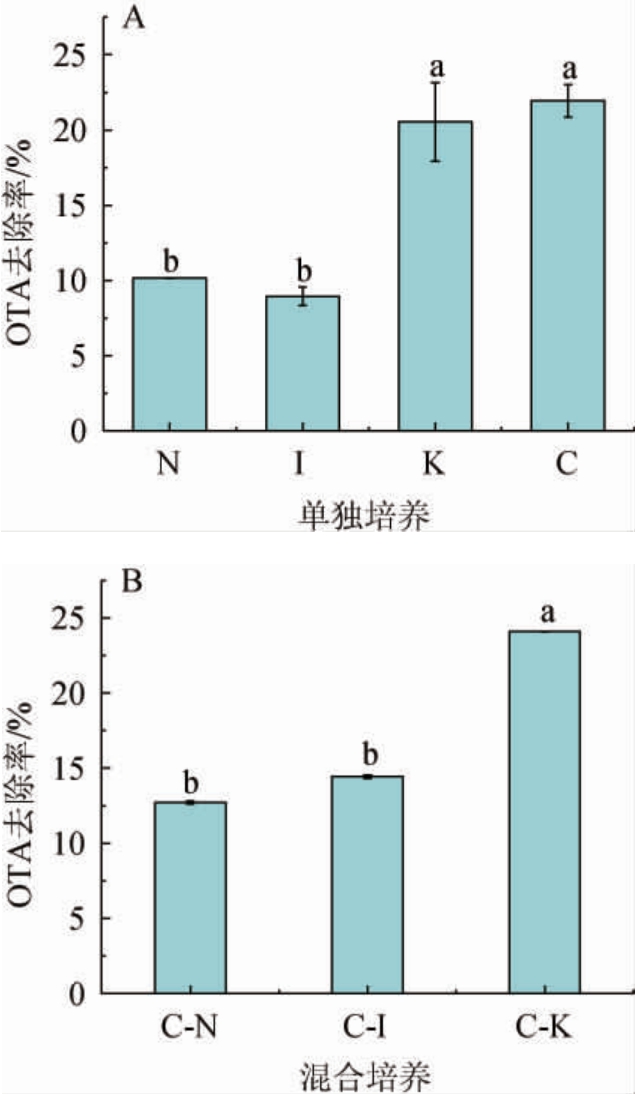
图2 酵母单独培养(A)及混合培养(B)48 h后对YPD培养基中赭曲霉毒素A含量变化的影响
Fig.2 Effect of yeasts culture on ochratoxin A content in YPD medium after yeasts individual culture (A) and mixed-strain culture (B)for 48 h
不同小写字母表示差异显著(P<0.05)。
由图2B可知,酵母C与K的混合培养组(C-K)的OTA去除率最高(24.09%),且高于C在YPD培养基中单独培养时的OTA去除率(21.94%),其次是C-I(14.43%)和C-N(12.71%)。可能是基于酿酒酵母CECA本身较强的OTA去除能力,使得非酿酒酵母混合培养组具有较单独培养时更高的OTA去除能力,也可能与混合培养时酵母之间争夺营养物质时互相作用产生的代谢物质有关,在YPD培养基中混合培养表现出更好的OTA去除的潜力。
2.3 葡萄酒不同酿造阶段OTA含量的变化
如图3A所示,在葡萄酒酿造的主发酵、皮渣分离和陈酿等节点OTA的含量均有下降,主发酵阶段OTA含量的变化最为明显(47.41%~63.02%),由于所接种酵母菌株的差异,使得各处理组之间OTA含量的变化存在显著差异,C(63.02%)>C-K(53.31%)>C-I(51.11%)>C-N(50.74%),酵母C在主发酵过程中表现出优异的OTA去除潜力。
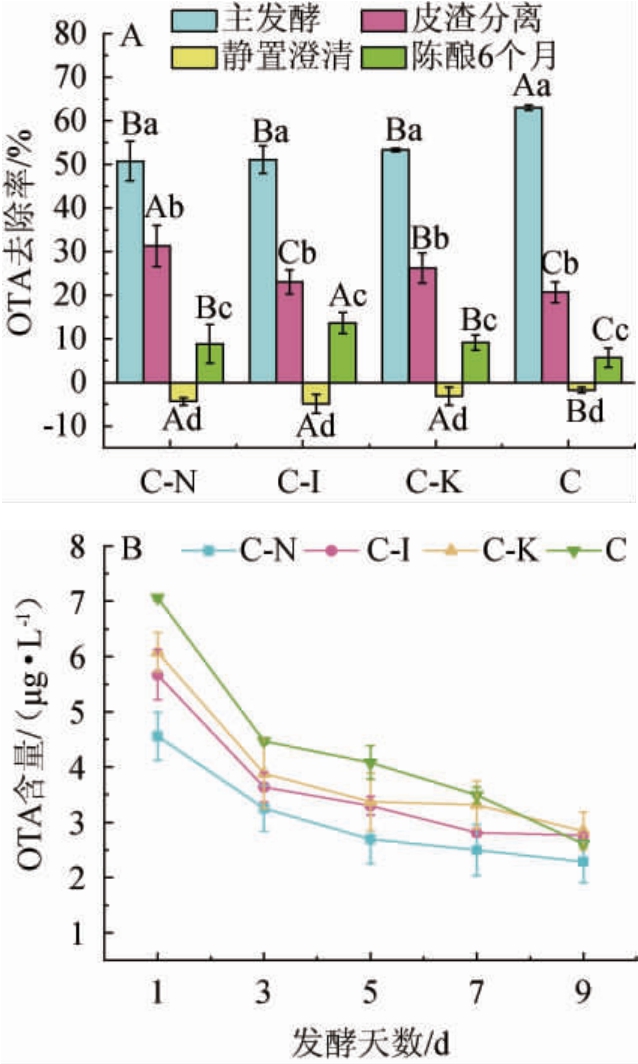
图3 不同发酵处理组在葡萄酒发酵过程中对赭曲霉毒素A含量的影响
Fig.3 Effect of different fermentation treatment groups on ochratoxin A content during wine fermentation
图(A)中相同发酵阶段的大写字母不同表示差异显著(P<0.05),相同组别中小写字母不同表示差异显著(P<0.05)。
如图3B所示,在主发酵过程中OTA含量呈现逐步下降的趋势,在主发酵的前3 d,OTA含量变化最明显,呈现显著下降的趋势,之后下降趋势变得缓慢。在酵母添加后,OTA含量变化很大,可能的原因有以下几点:①OTA是一种弱酸,在葡萄酒的低pH值下部分解离,并带有负电荷,从而导致葡萄汁中可检测到的OTA含量变得很低[21];②酵母对OTA的代谢作用以及酵母细胞壁对OTA的吸附作用;③本实验选择带皮发酵工艺酿造红葡萄酒,故而葡萄醪液中复杂的物质如多酚、蛋白等物质可能会与OTA存在相互作用,如花色素苷与OTA之间的离子键合以及OTA分子的羧基和花色素苷的羟基之间的酯化反应,使得一部分OTA结构发生改变,从而对OTA含量的定量产生影响[17]。不同的酵母对OTA去除的差异可能取决于酵母细胞壁不同的甘露聚糖含量,但也可能取决于不同的发酵和细胞沉降动力学,细胞尺寸和絮凝作用[22]。
皮渣分离阶段去除了酒样中20.7%~31.31%的OTA,研究者们认为,OTA水平降低的最显著因素似乎是来自浸渍步骤的葡萄皮渣等物质充当了OTA吸附剂,这些粒子就像海绵一样,涂有负电荷,与OTA的酸性特征相互作用,使得一部分OTA吸附在皮渣上[23],当皮渣从葡萄酒中分离之后,皮渣上吸附的OTA也随此过程得以去除。
4 ℃静置澄清阶段OTA含量会有小幅度的升高,可能与酵母对OTA的解吸有关,有研究者研究发现,酵母在吸附OTA后会出现解吸现象,且这一现象与酵母类型、温度和糖浓度密切相关[24]。本实验在4 ℃静置澄清时,随着酒精发酵的结束,基质中糖浓度大量减少,且温度环境由发酵温度时的24 ℃变化为静置澄清时的4 ℃,这些环境因素的改变可能会导致酵母上所吸附的一部分OTA脱离酵母重新回到酒中,使得短时间内酒中OTA的含量出现了小幅度的上升。OTA的释放是可变的过程并且依赖于菌株效应,酵母对OTA具体的解吸机制还需进行更多的研究。
由于酵母K具有将苹果酸转化为乳酸的能力[25-26],故对葡萄酒不进行苹果酸-乳酸发酵,其他处理组与其保持一致,不引入乳酸菌,只研究酵母对OTA去除的影响。选择4 ℃环境下在酒泥上对葡萄酒进行陈酿,由于酒泥中还存在大量的酵母细胞,在陈酿过程中酵母细胞会发生自溶现象,产生甘露糖蛋白、葡聚糖和少量的蛋白质等物质[27],这些物质可能与OTA发生结合作用,使得基质中一部分OTA的结构发生改变,最终陈酿结束后葡萄酒中OTA含量下降了5.7%~13.63%。有研究表明,OTA含量在酿酒过程中会出现持下降的现象,下降率可达92%,大部分的OTA都留在了果渣中[28];葡萄皮渣对OTA的吸附作用可去除葡萄酒中大部分的OTA,从而使得大部分葡萄酒的OTA含量处于安全阈值[10,29],这些研究与本研究结果一致。未来的研究可能更要关注酵母细胞壁电荷和发酵条件对OTA去除和释放的复杂现象的作用,以使由发酵剂释放回培养基中毒素量最小化。
2.4 不同处理组葡萄酒的基本理化指标
在葡萄酒陈酿完成后,对其基本理化指标进行测定,如表1所示,各处理组均完成了葡萄酒的发酵。与对照组相比,处理组在酒精发酵结束后残糖含量在(3.135±0.30)~(4.28±0.25)g/L之间,相应地酒精度分别为(8.905±0.01)%vol~(9.71±0.03)%vol,对照组在酒精发酵结束后残糖含量为(2.15±0.30)g/L,酒精度为(10.175±0.02)%vol。处理组总酚含量在(1.42±0.09)~(1.85±0.03)g/L,对照组的总酚含量为(1.91±0.034)g/L,对照组的总酚含量均高于处理组,原因可能是OTA与葡萄酒中的酚类物质和花色苷类物质存在相互作用,CECCHINI F等[30]向含有OTA的白葡萄汁中添加两种不同浓度的花色苷提取物,并以不添加花色苷的白葡萄汁作为对照进行发酵实验,研究结果表明,添加了花青素的白葡萄汁发酵结束后OTA的下降率显著高于未添加花色苷的白葡萄汁,他们认为,作用于酵母细胞壁上的不同靶标的花色苷和OTA之间的化学键增强了OTA的吸附。本实验中处理组的总酚物质和总花色苷物质含量均显著低于对照组未添加OTA的酿酒酵母CECA单独发酵组,可推测总酚与总花色苷物质的存在可能会影响酵母去除OTA的能力。
表1 各发酵处理组葡萄酒的基本理化指标
Table 1 Basic physicochemical indexes of wine in each fermentation treatment group
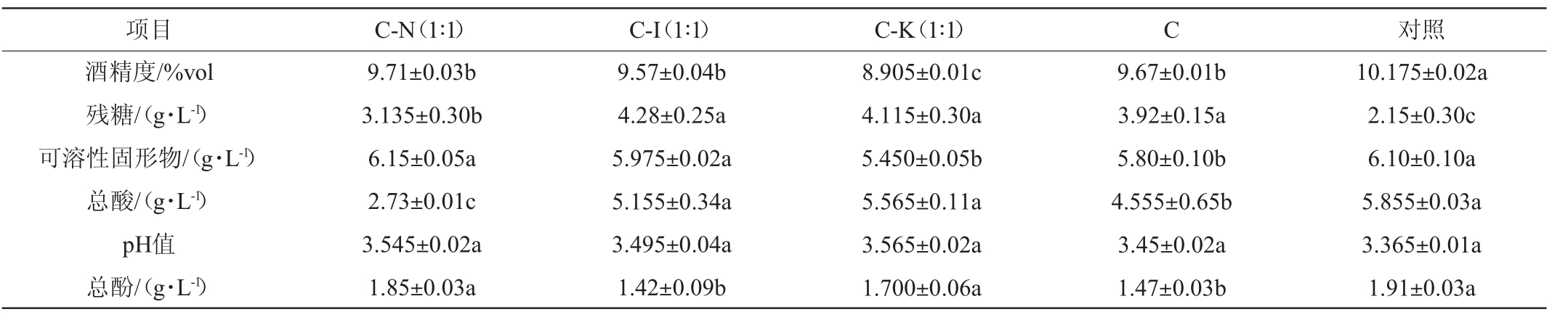
项目 C-N(1∶1) C-I(1∶1) C-K(1∶1) C 对照酒精度/%vol残糖/(g·L-1)可溶性固形物/(g·L-1)总酸/(g·L-1)pH值总酚/(g·L-1)9.71±0.03b 3.135±0.30b 6.15±0.05a 2.73±0.01c 3.545±0.02a 1.85±0.03a 9.57±0.04b 4.28±0.25a 5.975±0.02a 5.155±0.34a 3.495±0.04a 1.42±0.09b 8.905±0.01c 4.115±0.30a 5.450±0.05b 5.565±0.11a 3.565±0.02a 1.700±0.06a 9.67±0.01b 3.92±0.15a 5.80±0.10b 4.555±0.65b 3.45±0.02a 1.47±0.03b 10.175±0.02a 2.15±0.30c 6.10±0.10a 5.855±0.03a 3.365±0.01a 1.91±0.03a
2.5 酵母去除OTA机理的探究
综合上述实验结果,本土酿酒酵母CECA与耐热克鲁维酵母KT-CVE7不论是在YPD培养基中还是在葡萄酒酿造过程中,均表现出较好的OTA去除能力,分别对这两株酵母的培养上清液、胞内酶粗提液和热致死酵母细胞进行OTA去除能力试验。由图4可知,与对照组相比,酵母C的热致死酵母细胞可去除54%的OTA,细胞培养上清液可去除2.23%的OTA,胞内酶可去除15.15%的OTA;酵母K的热致死酵母细胞可去除50%的OTA,细胞培养上清液可去除14.97%的OTA,胞内酶可去除7.1%的OTA。这两株酵母的热致死酵母细胞的OTA去除能力显著高于其他处理组,可推断该这两株酵母去除OTA的主要方式为细胞吸附作用。
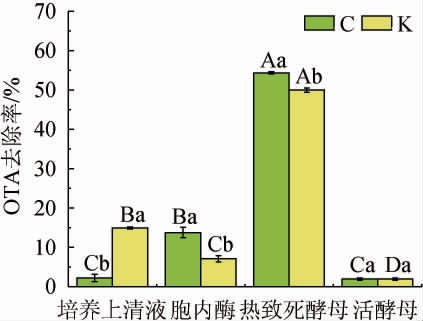
图4 不同发酵处理组的酵母对赭曲霉毒素A含量变化的影响
Fig.4 Effect of yeast in different fermentation treatment groups on ochratoxin A content changes
图中小写字母不同表示同部位不同酵母OTA去除率差异显著(P<0.05);大写字母不同表示相同酵母不同部位OTA去除率差异显著(P<0.05)。
2.6 酵母细胞壁厚度分析
为了更直观地展现这几株酵母细胞的细胞壁厚度差异,对四株酵母细胞固定包埋,染色切片后进行透射电子显微镜观察测量,利用频率直方统计法计算出了每株酵母菌的细胞厚度,细胞壁厚度正态分布见图5。根据细胞壁厚度正态分布(图5)计算结果可知,酵母K、C、N、I的细胞壁平均厚度分别为195.01 nm、192.76 nm、146.35 nm、140.32 nm,进一步认为所选酵母主要是通过细胞壁的吸附作用去除基质中的OTA。
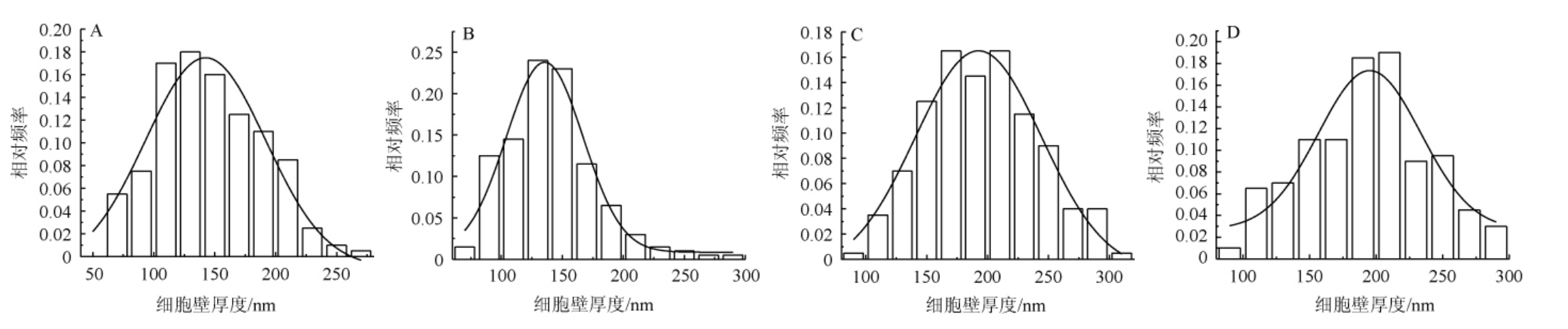
图5 酵母细胞壁厚度正态分布图
Fig.5 Normal distribution of yeasts cell wall thickness
图A、B、C、D依次为酵母N、I、K、C。
3 结论
本研究以本土酿酒酵母CECA为研究对象,探究了在不同发酵基质及不同接种方式下该酵母的OTA去除效果,结果表明,4株酵母的OTA耐受能力较好,混合发酵C-K组的OTA去除率(24.09%)显著高于其他组(P<0.05);4组红葡萄酒(C、C-N、C-I、C-K)酿造完成后OTA含量均处于安全范围,其中主发酵阶段OTA含量变化最大(47.41%~63.02%),其次为皮渣分离后和陈酿后;由于酿酒酵母C的细胞壁较厚(192.76 nm),对OTA吸附能力较强,因此其单独发酵时OTA的去除率高达63.02%。CECA酵母在未来葡萄酒中具有很大的应用潜力,可根据实际生产的具体情况选择合适的接种方式来进行葡萄酒的安全控制。该酵母在不同基质中的OTA去除效果存在显著差异,未来研究可针对产生这种差异的原因及CECA酵母的OTA解吸作用进行深入探究。
[1]TANG J Y,YIN L W,ZHAO Z Y,et al.Isolation,identification and safety evaluation of OTA-detoxification strain Pediococcus acidilactici NJB421 and its effects on OTA-induced toxicity in mice[J].Food Chem Toxicol,2023,172:113604.
[2] BABAYAN N, TADEVOSYAN G, KHONDKARYAN L, et al.Ochratoxin A induces global DNA hypomethylation and oxidative stress in neuronal cells in vitro[J].Mycotoxin Res,2020,36(1):73-81.
[3]FRANGIAMONE M,LOZANO M,CIMBALO A,et al.AFB1 and OTA promote immune toxicity in human lymphoblastic T cells at transcriptomic level[J].Foods,2023,12(2):259.
[4]STOEV S D.Studies on teratogenic effect of ochratoxin A given via mouldy diet in mice in various sensitive periods of the pregnancy and the putative protection of phenylalanine[J].Toxicon,2022,210:32-38.
[5]BRYLA M,DAMAZIAK K,TWARUZ˙EK M,et al.Toxico-pathological effects of ochratoxin A and its diastereoisomer under in ovo conditions and in vitro evaluation of the toxicity of these toxins against the embryo gallus fibroblast cell line[J].Poultry Sci,2023,102(2):102413.
[6]ZUCKERMAN A J.IARC monographs on the evaluation of carcinogenic risks to humans[J].J Clin Pathol,1995,48(7):691.
[7]SOLFRIZZO M, AVANTAGGIATO G, PANZARINI G, et al.Removal of ochratoxin A from contaminated red wines by repassage over grape pomaces[J].J Agr Food Chem,2010,58(1):317-323.
[8]WEI D M,WU X H,XU J,et al.Determination of ochratoxin A contamination in grapes, processed grape products and animal-derived products using ultra-performance liquid chromatography-tandem mass spectroscopy system[J].Sci Rep,2018,8(1):2051.
[9]BEJAOUI H,MATHIEU F,TAILLANDIER P,et al.Ochratoxin A removal in synthetic and natural grape juices by selected oenological Saccharomyces strains[J].J Appl Microbiol,2004,97(5):1038-1044.
[10]全莉,马文瑞,王雪薇,等.新疆葡萄酒中赭曲霉毒素A含量分析[J].中国酿造,2018,37(7):5-6.
[12]FREIRE L,FURTADO M M,GUERREIRO T M,et al.The presence of ochratoxin A does not influence Saccharomyces cerevisiae growth kinetics but leads to the formation of modified ochratoxins[J]. Food Chem Toxicol,2019,133:110756.
[13]王明瑞,侯彦喜,张亚丹.3,5-二硝基水杨酸法测定发酵液中多糖含量[J].现代食品,2020(4):7-8.
[14]牛雪.福林酚法测定葡萄酒总酚的优化研究[D].银川:宁夏大学,2015.
[15]葛亮,李芳.葡萄酒酿造与检测技术[M].北京:化学工业出版社,2013:118-123.
[16]曾慧,张明珠.液液萃取-高效液相色谱法测定红茶中赭曲霉毒素A[J].饮料工业,2023,26(2):25-28.
[17]CECCHINI F,MORASSUT M,MORUNO E G,et al.Influence of yeast strain on ochratoxin A content during fermentation of white and red must[J].Food Microbiol,2006,23(5):411-417.
[18]KLOSOWSKI G,MIKULSKI D,GRAJEWSKI G,et al.The influence of raw material contamination with mycotoxins on alcoholic fermentation indicators[J].Bioresource Technol,2010,101(9):3147-3152.
[19]卢迪莎,王序,杨金易,等.同时检测玉米中黄曲霉毒素B1和赭曲霉毒素A的时间分辨荧光免疫层析试纸条的研制[J].食品科学,2022,43(2):2346-2354.
[20]ELARIDI J,YAMANI O,MATARI A A,et al.Determination of ochratoxin A(OTA),ochratoxin B(OTB),T-2,and HT-2 toxins in wheat grains,wheat flour,and bread in Lebanon by LC-MS/MS[J].Toxins,2019,11(8):4-5.
[21]CASTTELLARI M,VERSARI A,FABIANI A,et al.Removal of ochratoxin A in red wines by means of adsorption treatments with commercial fining agents[J].J Agr Food Chem,2001,49(8):3917-3921.
[22]ECHEVERRIGARAY S, SCARIOT F J, MENEGOTTO M, et al.Anthocyanin adsorption by Saccharomyces cerevisiae during wine fermentation is associated to the loss of yeast cell wall/membrane integrity[J].Int J Food Microbiol,2020,314:108383.
[23]HUWIG A,FREIMUND S,KAPPELI O,et al.Mycotoxin detoxication of animal feed by different adsorbents[J]. Toxicol Lett, 2001, 122(2):179-188.
[24]BEVILACQUA A,PETRUZZI L,CORBO M R,et al.Ochratoxin A released back into the medium by Saccharomyces cerevisiae as a function of the strain,washing medium and fermentative conditions[J].J Sci Food Agr,2015,94(15):3291-3295.
[25]GUIMARAES A, VENANCIO A, ABRUNHOSA L, et al.Antifungal effect of organic acids from lactic acid bacteria on Penicillium nordicum[J].Food Addit Contam: Part A,2018,35(9):1803-1818.
[26]董琦楠,李莹,叶冬青,等.耐热克鲁维酵母在葡萄酒酿造中的研究进展[J].微生物学通报,2022,49(5):1941-1954.
[27]李明月,杨雪,王斐,等.带酒泥陈酿对红提葡萄酒香气的影响[J].齐鲁工业大学学报,2021,35(3):6-7.
[28]YU J M,SMITH I N,MIKIASHVILI N.Reducing Ochratoxin A content in grape pomace by different methods[J].Toxins,2020,12(7):424.
[29]王甜甜,刘建利,林勤,等.葡萄酒酿造过程中赭曲霉毒素A迁移规律的研究[J].酿酒科技,2013(9):5-6.
[30]CECCHINI F,MORASSUT M,SAIZ J C,et al.Anthocyanins enhance yeast's adsorption of ochratoxin A during the alcoholic fermentation[J].Eur Food Res Technol,2019,245(2):309-314.