猫爪草(Ranunculus ternatus Thunb.)是毛茛属植物的干燥块根,俗称三散草、猫爪草、毛茛、金花草等[1]。20世纪50年代在河南信阳发现了野生的猫爪草,此外,湖北、湖南、江西、安徽省等地区也有分布[2-3]。猫爪草可用于化痰止咳平喘、消毒消肿,疗效显著[4],其醇溶性浸出物是2020版《中国药典》质量标准的重要控制项目。研究发现,猫爪草的主要化学成分为多糖类、脂肪酸类、皂苷类、醇及酯类、挥发油类、生物碱、黄酮类及微量元素等成分[2],具有防治肺结核、免疫调节、抑制恶性肿瘤等相关功效[5-7],其抗氧化活性也成为研究猫爪草特性的一个热点问题。此外,猫爪草还富含多种人体必需氨基酸[8],对人体具有较好的辅助疗效和营养价值。
微生物发酵在食品、化工和制药等行业中应用广泛。发酵过程中,微生物可能会将植物中某些成分作为碳源、氮源而消耗掉或通过次级代谢使有效成分增加,从而使植物化学成分在含量上有所改变[9-10]。但是,在长期的实验与生产实践中,研究发现许多重要的生化反应仅仅依赖单一的微生物是无法实现的,必须要两个以上的微生物联合培养才能实现,即混菌发酵[11-12]。枯草芽孢杆菌(Bacillus subtilis)、酿酒酵母(Saccharomyces cerevisiae)和植物乳杆菌(Lactobacillus plantaurum)作为工业中重要的微生物,常被用于改善食品的营养性能和生物活性[13-15]。内生菌由于和宿主植物具有相同或相近的有效成分合成途径,近年来也被用于研究植物与微生物的协同共生效应,具有开发发酵食品的潜力[16]。
本试验以猫爪草粉末为原料,采用猫爪草两种内生真菌进行固态发酵。并对菌种的最佳添加比例、发酵时间、目号、液料比、发酵温度、接种量等进行优化,再比较发酵前后猫爪草醇溶性浸出物中主要成分含量和抗氧化活性的变化,以期为研究开发猫爪草的食药价值、产业发展提供理论基础。
1 材料与方法
1.1 材料与试剂
猫爪草:河南信阳淮滨地区。镰刀菌(Fusariumequiseti)、球毛壳菌(Chaetomium globosum):本实验室保藏。
齐墩果酸对照品、芦丁对照品、没食子酸对照品(纯度均≥99%):飞净生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2'-联氮-二(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)(≥98%):上海浩洋生物科技有限公司过硫酸钾;维生素C(vitamin C,VC)标准品(纯度≥99%):上海源叶生物科技有限公司;氨基酸对照品(天冬氨酸、苏氨酸、丝氨酸、谷氨酸、甘氨酸、丙氨酸、胱氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、酪氨酸、苯丙氨酸、组氨酸、赖氨酸、精氨酸、脯氨酸,批号SLBM6769V):美国Sigma-Aldrich公司。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g,葡萄糖20 g,琼脂15~20 g,蒸馏水1 000 mL。
1.2 仪器与设备
JP-500B-2型多功能粉碎机:上海市久品工贸有限公司;XFH-75CA电热式压力蒸汽灭菌器:浙江新封医疗器械有限公司;GHA-300Y全温摇床:杭州绿博仪器有限公司;SWCJ-2F落地式洁净工作台:上海市力辰邦西仪器科技有限公司;25564真空冷冻干燥机:德国Marin Christ公司;DHG-9023AS电热鼓风干燥箱:南京昕仪生物科技有限公司;SHBIIIG循环水式多用真空泵:郑州世纪双科实验仪器有限公司;TU-1901紫外可见分光光度计:北京普析通用仪器有限责任公司;DNM-9876酶标仪:上海赛默飞责任有限公司;L8900氨基酸分析仪:英国百康责任有限公司。
1.3 实验方法
1.3.1 种子液的制备
在无菌超净台中,采用划线法将镰刀菌、球毛壳菌菌丝接种到PDA斜面培养基上,放在培养箱中28 ℃恒温且恒湿条件下培养7~10 d后备用。将活化的菌种按照2%的接种量接种于PDA液体培养基中进行扩繁,30 ℃、220 r/min条件下培养24 h。
每天同一时间分别取镰刀菌、球毛壳菌菌悬液真空抽滤,收集滤渣,所得滤渣在60 ℃条件下干燥至质量恒定,用电子天平对干燥后的菌丝体称质量,连续测定7 d。绘制生长曲线,研究菌丝体干质量的变化情况,选取扩大培养达到生长指数期即为种子液。
1.3.2 发酵菌种的筛选
将中药猫爪草洗净晾干,粉碎,过40目筛,备用。取56个锥形瓶,8瓶为一组,分别装15 g猫爪草粉末。
单菌发酵:分别接入2%镰刀菌和球毛壳菌,另在每瓶中各加入青霉素和链霉素,使每个锥形瓶中青霉素和链霉素的含量达到100 U。28 ℃、150 r/min发酵培养7 d,每天同一时间取样测定,40 ℃干燥1 h。计算发酵前后醇溶性浸出物得率。
混菌发酵:分别按不同体积比的混合菌种接种(镰刀菌∶球毛壳菌=1∶1;镰刀菌∶球毛壳菌=1∶2;镰刀菌∶球毛壳菌=2∶1;镰刀菌∶球毛壳菌=1∶3;镰刀菌∶球毛壳菌=3∶1),总接种量为2%,另在每瓶中各加入青霉素和链霉素,每个锥形瓶中青霉素和链霉素的含量达到100 U。28 ℃、150 r/min发酵培养7 d,每天同一时间取样测定,40 ℃干燥1 h。计算发酵前后醇溶性浸出物得率。
1.3.3 猫爪草粉末固态发酵工艺优化
单因素试验:精密称取猫爪草粉末15 g过筛(20目、40目、60目、80目、100目),置于250 mL锥形瓶中,按一定液料比(0.50∶1.00、0.75∶1.00、1.00∶1.00、1.25∶1.00、1.50∶1.00(mL∶g))加入少量蒸馏水,在121 ℃条件下高压蒸汽灭菌15 min,取出,冷却后按一定接种量比例(2%、4%、6%、8%、10%)接入菌种,置于恒温箱中一定温度(26 ℃、28 ℃、30 ℃、32 ℃、34 ℃)避光发酵5 d,发酵结束后将发酵产物二次灭菌,40 ℃干燥1 h。以猫爪草发酵产物的醇溶性浸出物得率为评价指标,分别考察过筛目号、液料比、接种量及发酵温度对猫爪草固态发酵影响。
响应面试验:在单因素试验的基础上,以Box-Behnken试验设计优化猫爪草固态发酵工艺,以目号(A)、液料比(B)、接种量(C)及发酵温度(D)为自变量,发酵产物醇溶性浸出物的得率(Y)为响应值,进行4因素3水平试验设计。
1.3.4 测定方法
醇溶性浸出物的含量测定:依据《中国药典》2020版浸出物测定法(通则2201)[1]测定猫爪草中醇溶性浸出物,测定醇溶性浸出物时以稀乙醇替代蒸馏水为溶剂。醇溶性浸出物得率计算公式如下:
多糖的含量测定:参照苯酚-硫酸法[17]进行测定。
总黄酮参照硝酸铝-亚硝酸钠-氢氧化钠法[18]进行测定;皂苷参照香草醛-冰乙酸法[19]进行测定;多酚参照Folin-酚法[20]进行测定。
有机酸的含量测定[21]:采用电位滴定法以下式计算样品中总有机酸(以柠檬酸计C6H8O7)的含量。1 mL mol/L HCl标准液相当于柠檬酸(C6H8O7)3.302 mg。
式中:T为滴定度,mg;V为滴定样品消耗HCl标溶液体积,mL;V0为空白消耗HCl的体积,mL;W为样品质量,g。
氨基酸的含量测定[22]:称取猫爪草样品粉末0.1 g置于水解管中,加6 mol/L盐酸溶液4 mL,氮吹仪吹氮气15 min后封管,在烘箱中于110 ℃水解24 h。冷却开管,过滤,水解液蒸干后,以0.02 mol/L盐酸定容至100 mL。准确吸取定容后的样品2 mL,置氮吹仪上脱酸。温度60 ℃,脱至干燥。准确加入0.02 mol/L HCl旋涡器上混匀,过0.22 μm过滤小柱,上机。用外标法测定样品溶液中游离氨基酸含量,脯氨酸检测波长为440 nm,其他氨基酸检测波长570 nm。
1.3.5 猫爪草发酵前后醇溶性浸出物的抗氧化能力测定
将发酵前后猫爪草冻干粉的醇溶性浸出物用体积分数70%的乙醇分别制成20 mg/mL、10 mg/mL、5 mg/mL、2.5 mg/mL、1.25 mg/mL、0.625 mg/mL的供试品溶液。参照文献[23-24]的方法测定猫爪草发酵前后醇溶性浸出物的DPPH、ABTS和羟基自由基清除能力,以VC溶液作为阳性对照,并计算半抑制浓度(half maximal inhibitory concentration,IC50)值。
2 结果与分析
2.1 球毛壳菌、镰刀菌生长曲线的研究
球毛壳菌和镰刀菌的生长曲线见图1。
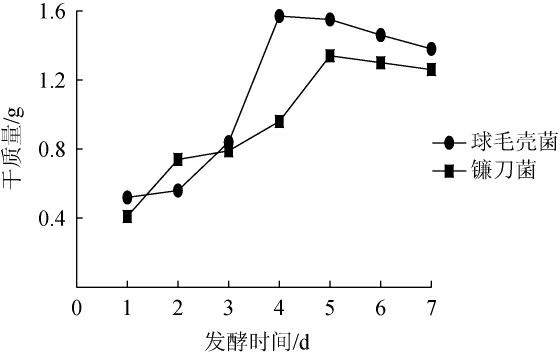
图1 球毛壳菌和镰刀菌的生长曲线
Fig.1 Growth curves of Chaetomium globosum and Fusarium equiseti
由图1可知,球毛壳菌的菌丝体干质量在前2 d变化不大,从第3天开始,菌丝体的干质量迅速增加,第4天时菌丝体干质量达到最大值并且保持平稳。因此,选择培养4 d的球毛壳菌作为发酵种子液。镰刀菌的菌丝体干质量在1~4 d变化不大。第5天时菌丝体干质量达到最大值并且保持平稳。因此,选择培养5 d的镰刀菌作为发酵种子液。
2.2 猫爪草发酵菌种的筛选
球毛壳菌和镰刀菌单菌及混菌发酵对猫爪草醇溶性浸出物得率的影响见图2。
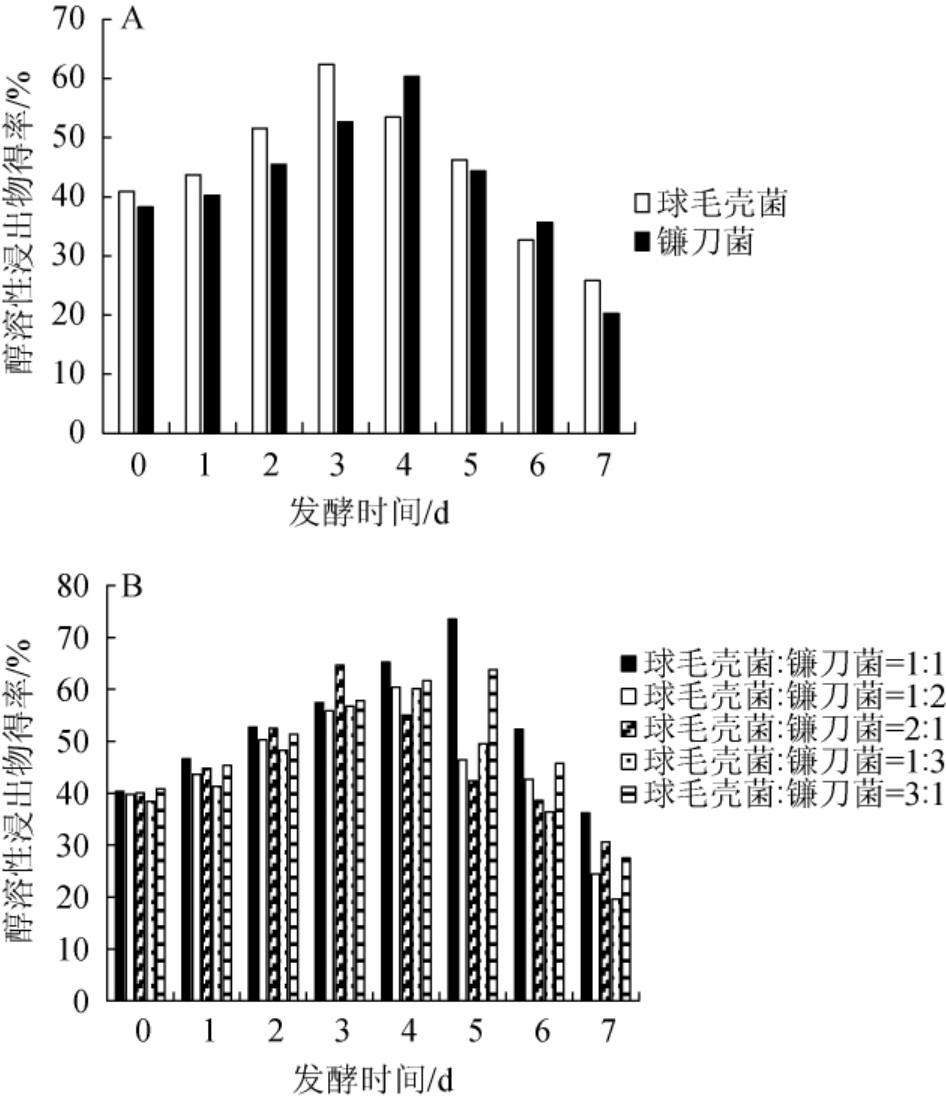
图2 单菌(A)及混菌(B)发酵对猫爪草粉末醇溶性浸出物得率的影响
Fig.2 Effect of single strain (A) and mixed-strains (B) fermentation on the yield of alcohol soluble extract of Ranunculi ternate Thunb.powder
由图2A可知,球毛壳菌单独发酵时猫爪草粉末醇溶性浸出物得率呈先增加后减少的趋势,发酵3 d时达到最大值62.36%,之后持续降低,发酵7 d时醇溶性浸出物的含量最低。可能是因为发酵时用的是PDA液体培养基,没有加入其他营养物质,发酵后期发酵产物作为碳源、氮源被内生真菌消耗。镰刀菌单独发酵时猫爪草粉末醇溶性浸出物得率呈先增加后减少的趋势,发酵4 d时达到最大值60.32%,之后持续降低。
由图2B可知,混菌发酵的猫爪草粉末醇溶性浸出物得率均随发酵时间的增加呈先增加后减少的趋势。当球毛壳菌∶镰刀菌=1∶1时,发酵5 d得到猫爪草粉末的醇溶性浸出物得率最高为73.50%,高于单菌发酵得到的猫爪草粉末醇溶性浸出物得率。因此,选择最佳发酵菌种为球毛壳菌∶镰刀菌=1∶1,混菌发酵时间为5 d。
2.3 猫爪草粉末固态发酵工艺优化单因素试验
2.3.1 猫爪草粉末过筛目号对发酵猫爪草醇溶性浸出物得率的影响
由图3可知,随猫爪草粉末目号的增加,发酵猫爪草醇溶性浸出物得率呈先增加后减少的趋势。猫爪草粉末过筛目号为40目时,发酵猫爪草醇溶性浸出物得率最高为44.21%;推测目号较小时基质颗粒较大,菌丝与基质不能与充分接触进行发酵,而目号过大则基质颗粒越细密度越大,溶氧量降低导致菌丝无法正常生长,使菌种醇溶性浸出物产量下降。因此,选择最适猫爪草粉末过筛目号为40目。
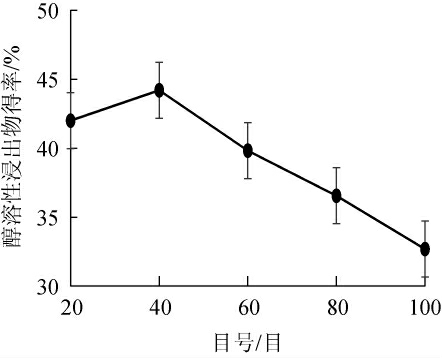
图3 猫爪草粉末过筛目号对发酵猫爪草醇溶性浸出物得率的影响
Fig.3 Effect of mesh number on the yield of alcohol-soluble extract of fermented Ranunculus ternatus Thunb.
2.3.2 水与猫爪草粉末液料比对发酵猫爪草醇溶性浸出物得率的影响
由图4可知,随水与猫爪草粉末液料比的增加,发酵猫爪草醇溶性浸出物得率呈先增加后减少的趋势。液料比为0.75∶1(mL∶g)时,发酵猫爪草醇溶性浸出物得率最高为44.85%;推测液料比低时,基质中水量相对较少,导致菌丝代谢减慢,而液料比过大时,菌液中溶氧量较低使菌丝生长不彻底,使菌种醇溶性浸出物产量下降。因此,选择最适水与猫爪草粉末液料比为0.75∶1(mL∶g)。
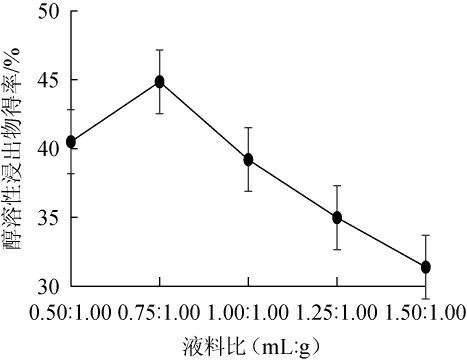
图4 水与猫爪草粉末液料比对发酵猫爪草醇溶性浸出物得率的影响
Fig.4 Effect of water and Ranunculus ternatus Thunb.powder ratio on the yield of alcohol-soluble extract of fermented R.ternatus Thunb.
2.3.3 接种量对发酵猫爪草醇溶性浸出物得率的影响
由图5可知,随接种量的增加,发酵猫爪草醇溶性浸出物得率呈先增加后减少的趋势。接种量为6%时,发酵猫爪草醇溶性浸出物得率最高为45.51%;推测接种量较低时,与原料接触的菌丝较少难以最大程度的发挥微生物的发酵活性,随着接种量增加到一定程度,原料中的碳源氮源又难以满足所有菌丝的生长,导致菌丝的代谢受到抑制,造成菌种醇溶性浸出物得率下降。因此,选择最适接种量为6%进行后续试验。
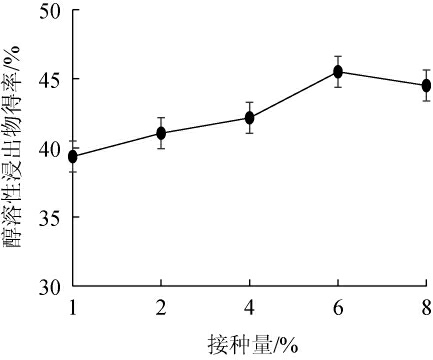
图5 混菌(1∶1)接种量对发酵猫爪草醇溶性浸出物得率的影响
Fig.5 Effect of mixed strains (1∶1) inoculum on the yield of alcoholsoluble extract of fermented R.ternatus Thunb.
2.3.4 发酵温度对发酵猫爪草醇溶性浸出物得率的影响
由图6可知,随发酵温度的上升,发酵猫爪草醇溶性浸出物得率呈先增加后减少的趋势。发酵温度为30 ℃时,发酵猫爪草醇溶性浸出物得率最高为45.85%;推测在30 ℃左右为球毛壳菌和镰刀菌两种内生真菌最适生长温度,在温度低于最适生长温度时,菌丝代谢受到抑制,温度高于最适生长温度时,菌丝代谢能力下降,从而影响发酵中醇溶性浸出物得率。因此,选择最适猫爪草粉末发酵温度为30 ℃进行后续试验。
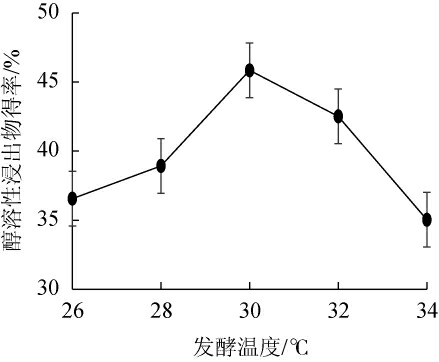
图6 发酵温度对发酵猫爪草醇溶性浸出物得率的影响
Fig.6 Effect of fermentation temperature on the yield of alcoholsoluble extract of fermented Ranunculus ternatus Thunb.
2.4 猫爪草粉末固态发酵工艺优化响应面试验
2.4.1 响应面试验设计与结果分析
Box-Behnken试验设计及结果见表1。通过Design-Expert 10.0.1软件对表1数据进行分析,得到多元二次回归模型方程:Y=49.44+0.82A+1.49B+1.86C-0.06D-0.71AB+1.53AC-3.49AD+1.41BC-0.53BD-0.19CD-6.15A2-5.02B2-4.68C2-2.53D2。
表1 猫爪草粉末固态发酵工艺优化Box-Behnken试验设计及结果
Table 1 Design and results of Box-Behnken tests for solid state fermentation process optimization of Ranunculus ternatus Thunb.powder
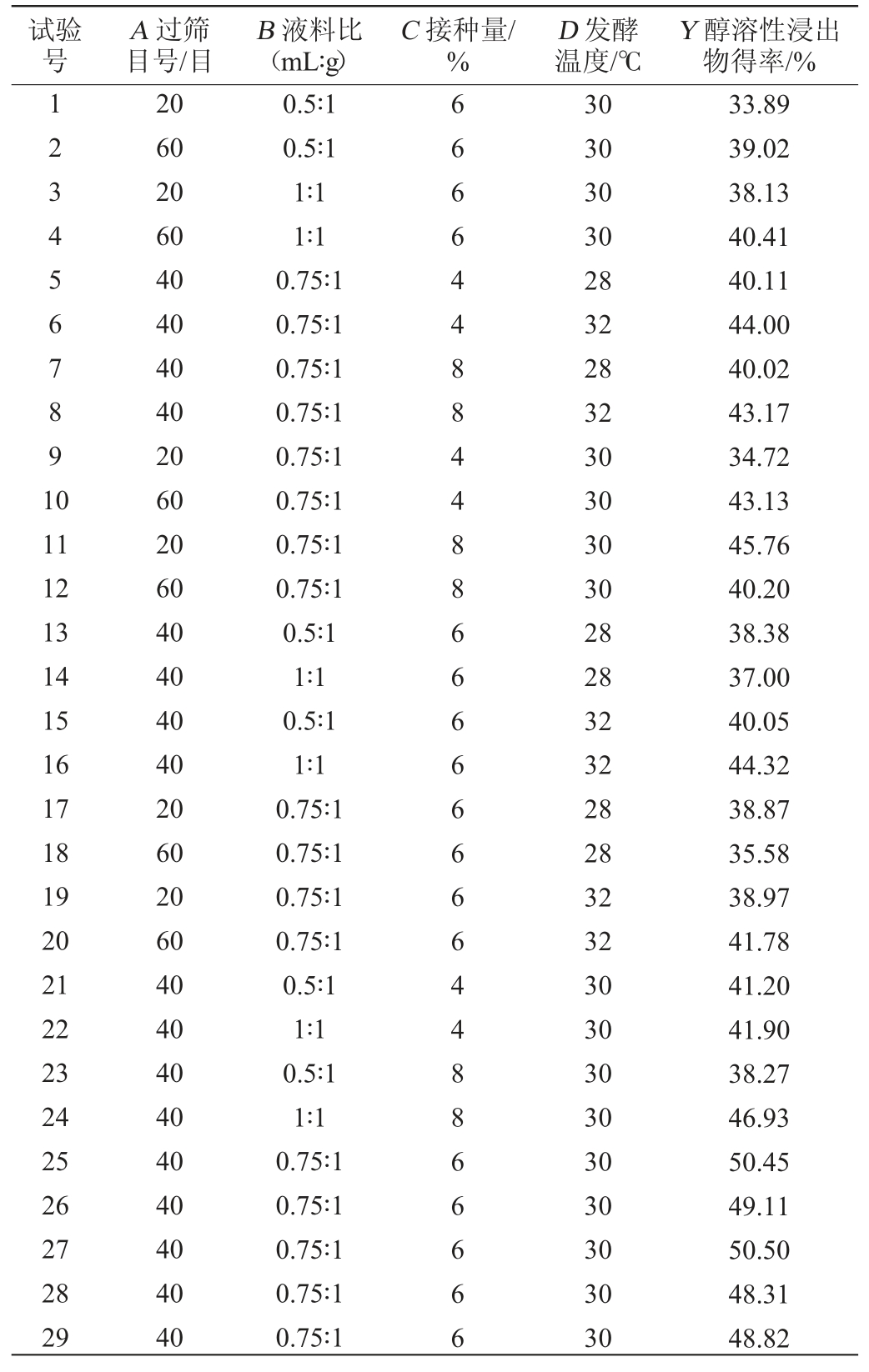
试验号A 过筛目号/目B 液料比(mL∶g)C 接种量/%D 发酵温度/℃Y 醇溶性浸出物得率/%1234567891 0 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 20 60 20 60 40 40 40 40 20 60 20 60 40 40 40 40 20 60 20 60 40 40 40 40 40 40 40 40 40 0.5∶1 0.5∶1 1∶1 1∶1 0.75∶1 0.75∶1 0.75∶1 0.75∶1 0.75∶1 0.75∶1 0.75∶1 0.75∶1 0.5∶1 1∶1 0.5∶1 1∶1 0.75∶1 0.75∶1 0.75∶1 0.75∶1 0.5∶1 1∶1 0.5∶1 1∶1 0.75∶1 0.75∶1 0.75∶1 0.75∶1 0.75∶1 66664488448866666666448866666 30 30 30 30 28 32 28 32 30 30 30 30 28 28 32 32 28 28 32 32 30 30 30 30 30 30 30 30 30 33.89 39.02 38.13 40.41 40.11 44.00 40.02 43.17 34.72 43.13 45.76 40.20 38.38 37.00 40.05 44.32 38.87 35.58 38.97 41.78 41.20 41.90 38.27 46.93 50.45 49.11 50.50 48.31 48.82
对该模型进行方差分析(表2)可知,由F值可知,各因素对发酵猫爪草醇溶性浸出物得率的影响主次顺序为:接种量(C)>液料比(B)>目号(A)>发酵温度(D)。该试验数据所得拟合模型F=10.51,P<0.000 1,说明该模型各项拟合良好。失拟项的P=0.068 5>0.05,表明失拟不显著,试验值与预测值吻合较好。由P值可知,一次项B对响应值影响显著(P<0.05);一次项C,交互项AD,二次项A2、B2、C2、D2对响应值影响极显著(P<0.01),其他项不显著(P>0.05)。此模型的决定系数R2=0.913 2,调整决定系数R2Adj=0.826 3,变异系数(coefficient of variation,CV)=4.62%,说明该模型的自变量和其响应值间线性关系显著,拟合度好,可以对不同发酵条件下猫爪草醇溶性浸出物得率进行预测。
表2 回归模型方差分析
Table 2 Analysis of variance of regression model
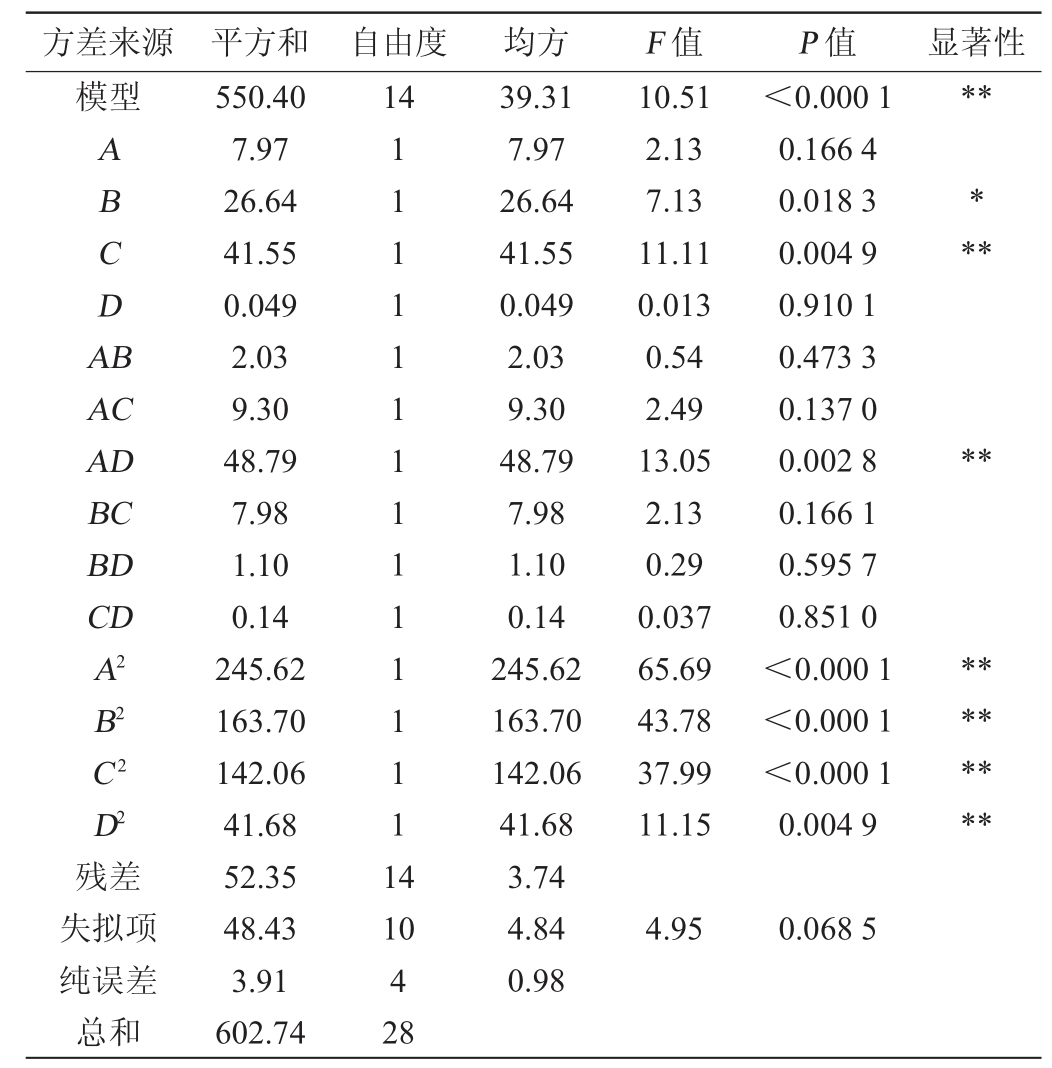
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著(P<0.05)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型14**ABCDA B***AC AD BC BD CD A2 B2 C2 D2残差失拟项纯误差总和550.40 7.97 26.64 41.55 0.049 2.03 9.30 48.79 7.98 1.10 0.14 245.62 163.70 142.06 41.68 52.35 48.43 3.91 602.74 111111111111111 4 10.51 2.13 7.13 11.11 0.013 0.54 2.49 13.05 2.13 0.29 0.037 65.69 43.78 37.99 11.15<0.000 1 0.166 4 0.018 3 0.004 9 0.910 1 0.473 3 0.137 0 0.002 8 0.166 1 0.595 7 0.851 0<0.000 1<0.000 1<0.000 1 0.004 9**********10 4 28 39.31 7.97 26.64 41.55 0.049 2.03 9.30 48.79 7.98 1.10 0.14 245.62 163.70 142.06 41.68 3.74 4.84 0.98 4.95 0.068 5
2.4.2 响应面分析[25]
由图7可知,各因素交互作用下,AD交互作用响应曲面最为陡峭,且等高线密集呈椭圆形,说明目号与接种量间交互作用对响应值的影响较大,这与方差分析的结果一致。
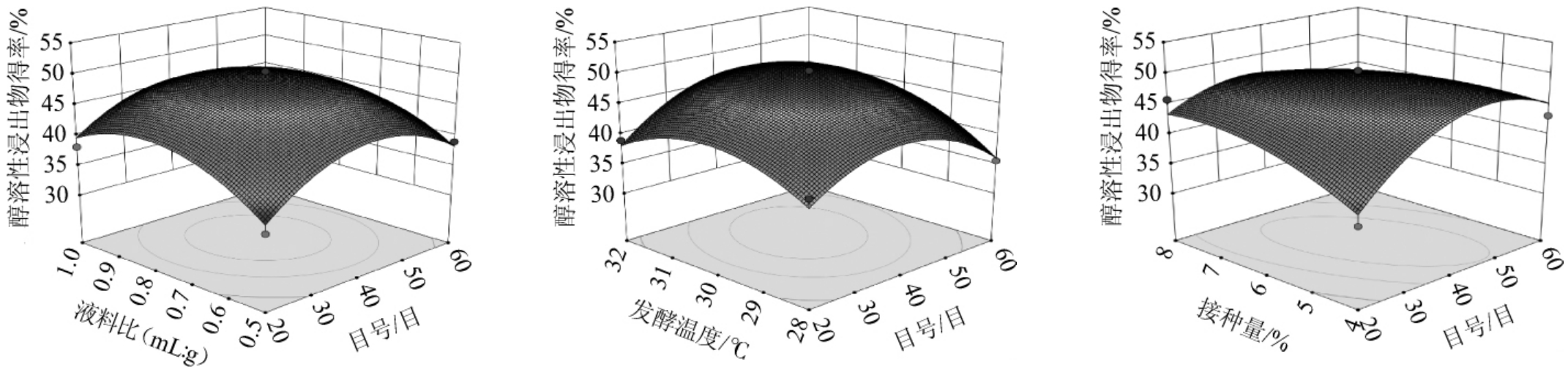
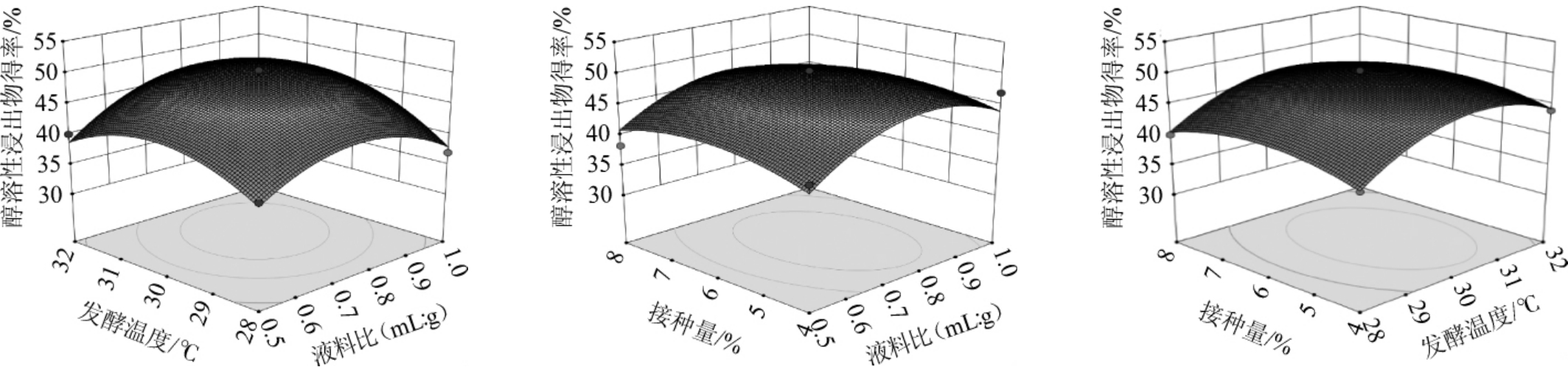
图7 各因素间交互作用对发酵猫爪草醇溶性浸出物得率影响的响应面和等高线
Fig.7 Response surface plots and contour lines of effect of interaction between various factors on the yield of alcohol-soluble extract of fermented Ranunculus ternatus Thunb.
经Design-Expert 10.0.1拟合后得最佳固态发酵工艺为过筛目号37.186目,液料比0.662∶1(mL∶g),发酵温度29.823 ℃,接种量4.713%,在此条件下发酵猫爪草粉末醇溶性浸出物得率理论值为46.454%。考虑实际操作情况,修正试验条件为过筛目号40目,液料比0.7∶1(mL∶g),发酵温度30 ℃,接种量5%。在此条件下进行3次重复提取,测得发酵猫爪草醇溶性浸出物得率实际值为46.12%。
2.5 猫爪草发酵前后有效成分的含量变化
由表3可知,发酵后猫爪草粉多糖含量降低了13.67%。而发酵后醇溶性浸出物、总黄酮、皂苷、多酚、有机酸和总氨基酸含量分别上升12.52%、14.62%、78.19%、14.29%、16.3%和3.78%。除了丙氨酸、缬氨酸、脯氨酸外,其余14种氨基酸含量均升高,其中12种增加率在60%以上,同时药用氨基酸(Glu、Asp、Arg、Gly、Phe、Tyr、Met、Leu、Lys)、人体必需氨基酸(Thr、Val、Met、Phe、Lys、Ile、Leu)含量分别升高66.39%、74.16%。
表3 猫爪草发酵前后有效成分的含量变化
Table 3 Changes of effective constituent content of Ranunculus ternatus Thunb.before and after fermentation
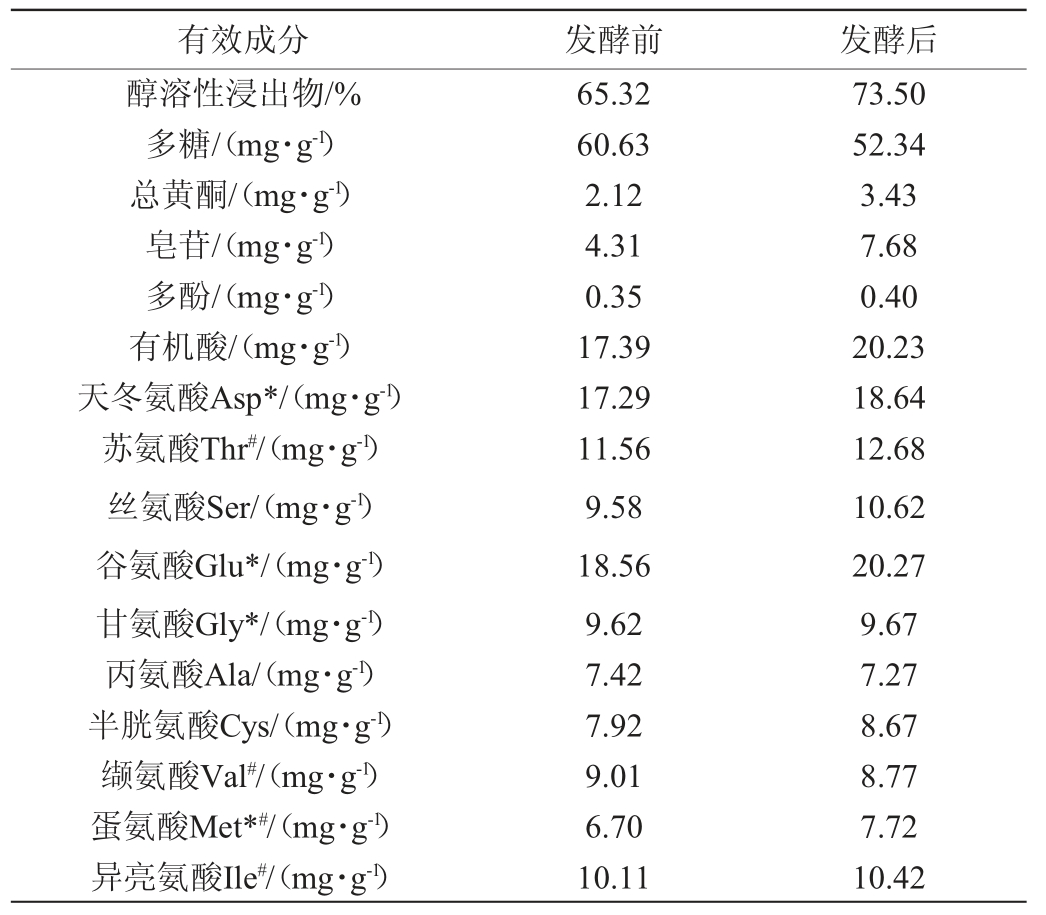
有效成分 发酵前 发酵后醇溶性浸出物/%多糖/(mg·g-1)总黄酮/(mg·g-1)皂苷/(mg·g-1)多酚/(mg·g-1)有机酸/(mg·g-1)天冬氨酸Asp*/(mg·g-1)苏氨酸Thr#/(mg·g-1)丝氨酸Ser/(mg·g-1)谷氨酸Glu*/(mg·g-1)甘氨酸Gly*/(mg·g-1)丙氨酸Ala/(mg·g-1)半胱氨酸Cys/(mg·g-1)缬氨酸Val#/(mg·g-1)蛋氨酸Met*#/(mg·g-1)异亮氨酸Ile#/(mg·g-1)65.32 60.63 2.12 4.31 0.35 17.39 17.29 11.56 9.58 18.56 9.62 7.42 7.92 9.01 6.70 10.11 73.50 52.34 3.43 7.68 0.40 20.23 18.64 12.68 10.62 20.27 9.67 7.27 8.67 8.77 7.72 10.42
续表
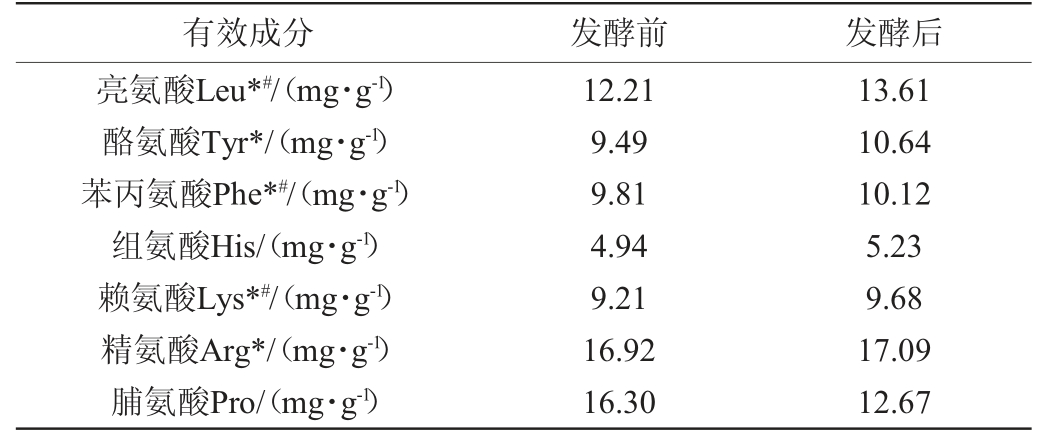
注:“*”为药用氨基酸;“#”为人体必需氨基酸。
有效成分 发酵前 发酵后亮氨酸Leu*#/(mg·g-1)酪氨酸Tyr*/(mg·g-1)苯丙氨酸Phe*#/(mg·g-1)组氨酸His/(mg·g-1)赖氨酸Lys*#/(mg·g-1)精氨酸Arg*/(mg·g-1)脯氨酸Pro/(mg·g-1)12.21 9.49 9.81 4.94 9.21 16.92 16.30 13.61 10.64 10.12 5.23 9.68 17.09 12.67
2.6 猫爪草醇溶性浸出物发酵前后抗氧化能力的变化
由图8可知,在一定范围内,发酵前后猫爪草粉末的醇溶性浸出物都对DPPH、ABTS和羟基自由基均具有一定的清除能力,且随着醇提取物浓度的增加清除率均呈上升趋势,但抗氧化能力均不及VC。发酵前醇溶性浸出物清除DPPH、ABTS、羟基自由基的IC50值分别为8.87 mg/mL、7.33 mg/mL、12.56 mg/mL;发酵后猫爪草的醇溶性浸出物清除DPPH、ABTS、羟基自由基的IC50值分别为4.88 mg/mL、3.29 mg/mL、7.36 mg/mL,均低于发酵前的IC50值,表明发酵后猫爪草的醇提取物的抗氧化能力有所上升。
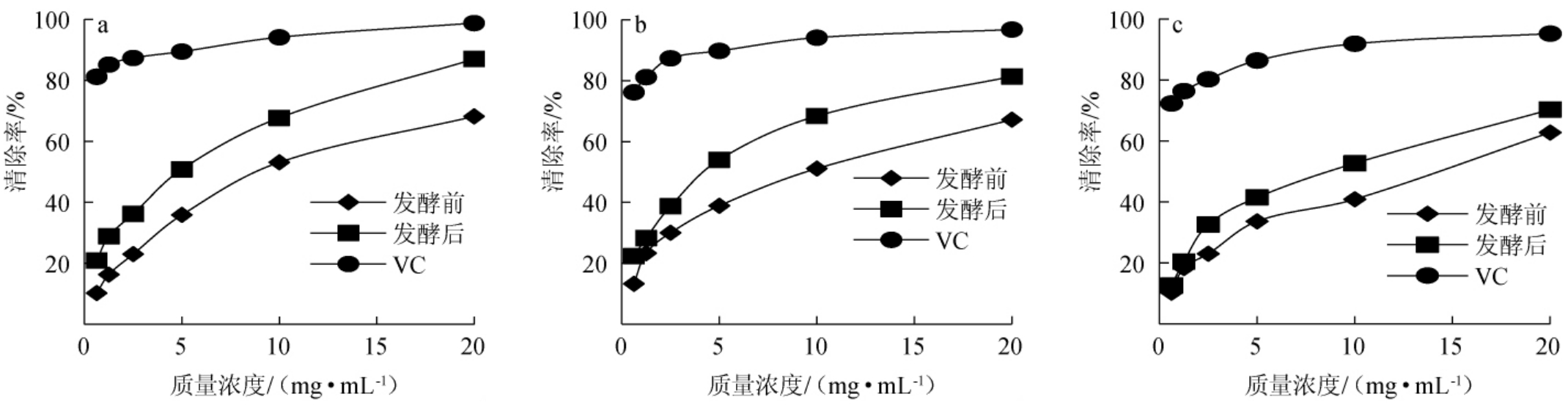
图8 猫爪草醇溶性浸出物发酵前后对DPPH(a)、ABTS(b)、羟基(c)自由基的清除率
Fig.8 Scavenging rates of alcohol-soluble extract of Ranunculus ternatus Thunb.before and after fermentation on DPPH (a), ABTS (b) and hydroxyl (c) free radicals
3 结论
在发酵过程中,添加优势菌种可以对液体发酵底物的质量进行有效的控制。与单菌发酵相比,不同的混合菌种之间通常存在着良好的交互作用,同时筛选最佳的发酵比例,可提高混合菌种发酵的产率,有利于资源的有效利用。本试验以猫爪草粉末作为原料,通过内生真菌固态发酵技术优化得到最佳发酵工艺为:菌种添加比例为球毛壳菌∶镰刀菌=1∶1,发酵时间5 d,猫爪草粉末过筛目号40目,水与猫爪草粉末液料比0.7∶1(mL∶g),发酵温度30 ℃,接种量5%。在此优化条件下,发酵猫爪草醇溶性浸出物得率为46.12%。发酵后的猫爪草水溶性浸出物和多糖含量下降,醇溶性浸出物、黄酮、皂苷、多酚、有机酸和氨基酸含量均增加;发酵后猫爪草醇溶性浸出物对DPPH、ABTS、羟基自由基清除率较发酵前均上升。
微生物发酵是药食同源食品开发利用的一个大趋势,通过对猫爪草进行发酵,可以使其性质发生变化,使其有效成分充分分离,提取出更多的成分,使其更具生物学功能,使其发挥新作用,从而拓宽了其应用领域。
[1]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2020:300.
[2]杨金伟,张莹.猫爪草提取部位及有效成分抗肿瘤作用的研究进展[J].药物评价研究,2021,44(2):446-451.
[3]闫浩利,王雯丽,罗峰,等.猫爪草的提取工艺、药理作用及临床研究进展[J].中医研究,2020,33(11):78-80.
[4]刘莉,王凤云,韩亮.中药猫爪草的研究进展[J].广东药科大学学报,2020,36(1):140-144.
[5]曾伶俐,许尤琪.许尤琪教授治疗大肠癌常用药对举隅[J].中国民族民间医药,2021,30(2):84-86.
[6]王镜辉,杨柱,唐东昕,等.国医大师刘尚义治疗肝癌用药规律研究[J].中国中医药信息杂志,2018,25(11):92-94.
[7]刘帅,梁铁军,王爱武,等.猫爪草皂苷对高转移肝癌细胞株HCCLM3及MHCC97-H增殖的影响[J].山东医药,2015,55(6):8-10.
[8]姚成,陈军,欧阳平凯.中药猫爪草氨基酸的测定[J].林产化学与工业,2003,23(2):97-98.
[9]崔聪.山茱萸提取液微生物发酵前后化学成分比较研究[D].济南:山东中医药大学,2012.
[10]尹程程.北五味子及其发酵产物化学成分及抗炎活性的比较研究[D].长春:长春中医药大学,2021.
[11]朱丹实,吴逗逗,沈雨思,等.多菌种混合发酵果蔬汁的研究进展[J].中国食品学报,2021,21(10):343-352.
[12]化洪苓.发酵提高剌五加黄酮工艺及抗辐射功能研究[D].哈尔滨:东北林业大学,2018.
[13]唐双庆,屈雅宁,刘琴,等.干酪乳杆菌发酵8种食用豆提取物抗氧化活性研究[J].中国酿造,2022,41(10):119-124.
[14]谢晓阳,范毅,王伟,等.响应面法优化刺梨果多糖发酵工艺研究[J].中国酿造,2021,40(4):177-182.
[15]茆鑫,郑剑斌,李广耀,等.响应曲面法优化刺五加-五味子混菌发酵工艺的研究[J].食品科技,2023,48(9):57-64.
[16]高硕.三株植物内生真菌抗癌活性成分研究[D].厦门:厦门大学,2019.
[17]程旺开,许月明,张冬冬.响应面优化黄秋葵叶多糖的提取工艺及其抗氧化活性考察[J].中国实验方剂学杂志,2017,23(4):38-42.
[18]张华,赵大利,王丹,等.超声辅助离子液体提取荷叶黄酮及其抗氧化活性[J].精细化工,2023,40(10):2241-2248.
[19]徐士钊,齐菲,席雅琳,等.响应面法优化辽东楤木总皂苷提取工艺及其抗氧化作用[J].江苏农业科学,2020,48(3):204-209.
[20]许瑞如,张秀玲,李晨,等.微波提取桔梗根多酚工艺优化及抗氧化特性研究[J].食品与发酵工业,2020,46(4):187-196.
[21]杨旭,许杜娟.不同产地猫爪草有机酸含量的测定[J].安徽医药,2011,15(10):1214-1215.
[22]IJAROTIMI O S,OLOPADE A J.Determination of amino acid content and protein quality of complementary food produced from locally available food materials in Ondo state,Nigeria[J].Malaysian J Nutr,2009,15(1):87-95.
[23]田亮,孙碧琪,毛祥飞,等.不同品种诺丽果发酵前后品质、挥发性风味成分和抗氧化活性比较[J].中国酿造,2023,42(9):138-143.
[24]莫宏辉,邓国卫,李珊.牛大力叶中总多糖、总黄酮、总皂苷含量及其抗氧化活性的研究[J].湖北农业科学,2021,60(19):88-91,94.
[25]YE C L,JIANG C J.Optimization of extraction process of crude polysaccharides from Plantago asiatica L.by response surface methodology[J].Carbohyd Polym,2011,84(1):495-502.