白酒是中国传统的酒精饮品,主要以粮谷为原料,经发酵、蒸馏等复杂工艺制成[1]。酱香型白酒是白酒的代表香型之一,具有独特的酱香和醇厚的口感,广受消费者青睐[2]。在酱香型白酒的生产过程中,大曲提供了必要的微生物菌系以启动发酵,尤其是酵母菌[2]。根据功能的不同,可将酵母分为两类:酿酒酵母和非酿酒酵母[3]。前者通常负责进行酒精发酵,而非酿酒酵母则与特定风味物质的产生相关联,也被称为产香酵母、产酯酵母。
产香酵母种类丰富,可从酒曲、酱醪、水果等各种食品原料分离得到,常见的有扣囊覆膜酵母(Saccharomycopsis fibuligera)、鲁氏接合酵母(Zygosaccharomyces rouxii)、异常威克汉姆酵母(Wickerhamomyces anomalus)等[4-6]。产香酵母对活性香气化合物特别是挥发性酯类的高水平代谢能力,在食品行业中显示出了较大的应用价值,目前多用于白酒及其他发酵食品的提酯增香。富志磊等[7]研究发现,异常威克汉姆酵母(W.anomalus)YF1503能够明显提高白酒固态模拟发酵体系中乙酸乙酯的含量,增加其他挥发性成分,从而提升其白酒的整体风味特征和品质。产香酵母的添加也能够改善百合米酒[8]、高盐液态酱油[9]等食品的味道和香气,使其具有更好的感官特性。然而,对产香酵母的利用受到许多因素的制约,包括菌株的特异性和发酵环境的变化。遗传和代谢的差异导致了不同酵母菌株独特的香气特征,这对最终产品的品质有直接影响。卢延想等[10]模拟酱香型白酒生产的过程中,结果发现S.fibuligera Y3能够显著提高酒样中乙酸乙酯和乳酸乙酯的含量,而W.anomalus Y5通过增加苯乙醇和异戊醇的含量来强化其感官品质。即使是相同类型的酵母,也会显示出不同的特性和功能[11]。此外,发酵环境的改变会促使产香酵母进行自我调节,并反映在生物量、酶活性和代谢产物的变化上。极端条件下,酵母生长量和风味物质的合成会受到严重抑制,从而影响发酵效率和产品质量[12]。基于此,产香酵母的筛选和生长、耐受特性分析,对于改善白酒和其他发酵食品的品质具有重要意义。
本研究通过测定酯酶活力和总酯含量对源自酱香大曲的酵母菌株进行初筛及复筛,然后利用顶空-固相微萃取(headspace solid-phase microextraction,HS-SPME)-气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)技术分析筛选酵母菌高梁汁发酵液的挥发性风味物质,最终筛选出产香酵母菌。结合形态学观察、生理生化试验及分子生物学技术对筛选产香酵母进行鉴定,并分析其生长特性和耐受性。旨在获得优良的产香酵母菌株,同时为其在白酒行业中的实际应用和后续深入研究奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 原料和菌株
红缨子高粱:贵州遵义。
源自酱香大曲的22株酵母菌株(编号为FBKL2.0501、FBKL2.0502、FBKL2.0505、FBKL2.0507、FBKL2.0508、FBKL2.0509、FBKL2.0511、FBKL2.0512、FBKL2.0513、FBKL2.0515、FBKL2.0516、FBKL2.0518、FBKL2.0519、FBKL2.0520、FBKL2.0521、FBKL2.0522、FBKL2.0523、FBKL2.0524、FBKL2.0525、FBKL2.0529、FBKL2.0530、FBKL2.0531):本实验室保藏。
1.1.2 化学试剂
DL2000 脱氧核糖核酸(deoxyribonucleic acid,DNA)Marker:北京擎科生物科技股份有限公司;真菌基因组DNA提取试剂盒、琼脂糖、α-高温淀粉酶(40 000 U/g)、糖化酶(100 000 U/g):北京索莱宝科技有限公司;聚合酶链式反应(polymerase chain reaction,PCR)引物、2×San Taq PCR Mix:上海生物工程股份有限公司;NaOH、HCl(均为分析纯)、酚酞:天津市大茂化学试剂厂;三丁酸甘油酯(分析纯)、2-辛醇(色谱纯):上海易恩化学技术有限公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯浸粉5 g/L,葡萄糖20 g/L,琼脂15 g/L,氯霉素0.1 g/L,超纯水1 000 mL,121 ℃灭菌15 min。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸出粉10 g/L,超纯水1 000 mL,115 ℃灭菌20 min。
初筛培养基:三丁酸甘油酯乳化液40 mL,琼脂20 g/L,水960 mL,121 ℃灭菌15 min。
产酯培养基:葡萄糖80 g/L,蛋白胨20 g/L,酵母浸出粉10 g/L,超纯水1 000 mL,115 ℃灭菌20 min。
高梁汁培养基:取粉碎后的高粱,加入四倍体积的水后混合均匀,100 ℃沸水浴蒸煮1 h,90 ℃加入60 U/g α-高温淀粉酶,保温1 h,随后冷却至60 ℃加入200 U/g糖化酶搅拌混匀,保温3 h,搅拌均匀后使用漏筛和纱布进行过滤,滤液经两次离心(8 000 r/min,10 min)得到上清液,用超纯水稀释至最终糖度为10°Bx,115 ℃灭菌20 min。
1.2 仪器与设备
SPX-250B-Z型生化培养箱:上海博迅实业有限公司医疗设备厂;ZQPL-200立式振荡培养箱全温摇床:天津市莱玻特瑞仪器设备有限公司;CFX Connect PCR仪、Power Pac电泳仪:美国Bio-Rad公司;721可见分光光度计:上海菁华科技仪器有限公司;LC-LX-H1850台式高速离心机:上海力辰邦西仪器科技有限公司;HP-TD32数显折光仪:深圳市测友科技有限公司;7890A-5957C气相色谱-质谱联用仪:美国Agilent公司;固相微萃取(SPME)Arrow三相萃取头(DVB/Carbon WR/PDMS):默克化工技术(上海)有限公司。
1.3 试验方法
1.3.1 菌株活化
将甘油保藏的酵母菌接种至PDA固体培养基,30 ℃培养2 d进行活化。
1.3.2 产香酵母初筛
酯酶(esterase)是参与酯合成和酯分解的一类酶,包括羧酸酯酶、脂肪酶等[13]。酯酶是酵母产香的关键酶,其活性与酯类化合物含量的累积密切相关,因此可作为初步筛选指标判断不同酵母的产酯能力。三丁酸甘油酯是一种短链脂肪酸酯,能够被酯酶分解为丁酸和甘油,从而形成透明圈,透明圈的有无和大小反映了酯酶活性的高低[14]。以产酯酶能力作为产香酵母的初筛指标[15],将酵母菌接入YPD液体培养基的试管中,30 ℃、150 r/min条件下振荡培养2 d后,取200 μL加入已打孔的初筛培养基内,30 ℃培养5 d,用游标卡尺测量透明圈的直径,选择产生透明圈且直径较大的菌株进行复筛。
1.3.3 产香酵母的复筛
以总酯含量为评价指标进行产香酵母复筛[16],将初筛菌株以1×106 CFU/mL的接种量接入产酯培养基中,30 ℃恒温培养4 d,以未接菌的培养基做空白对照。结束后取100 mL发酵液和50 mL超纯水进行常压蒸馏,收集一定量的蒸馏液进行总酯含量的测定[17],其计算公式如下:
式中:C1为NaOH标准滴定溶液的浓度,mol/L;C2为HCl标准滴定溶液的浓度,mol/L;V1为皂化时加入的NaOH标准滴定溶液的体积,mL;V2为反滴定消耗的HCl标准滴定溶液的体积,mL;V3为蒸馏液取样体积,mL;0.088 12为相当于1.00 mL NaOH标准滴定溶液的乙酸乙酯的质量,g。
1.3.4 产香酵母高粱汁发酵液挥发性风味物质分析
产香酵母高粱汁发酵液挥发性风味物质的测定采用GCMS法[18]并略作修改。将复筛选择的酵母菌以1×107 CFU/mL接种量接入高梁汁培养基中,30 ℃、150 r/min条件下振荡培养5 d,以未接菌的培养基做空白对照。结束后发酵液在8 000 r/min,10 min的条件下离心得到上清液,向顶空瓶中加入10 mL上清液、4 g氯化钠和10 μL内标溶液(2-辛醇,质量浓度为164 μg/L),于55 ℃下先平衡15 min,再萃取40 min后进行自动进样,进样针于230 ℃进样口中解吸5 min。
GC条件:DB-WAX毛细管色谱柱(600 mm×0.25 mm×0.25 μm);不分流进样;进样口温度230 ℃;升温程序为45 ℃保持5 min,以2.5 ℃/min升温至120 ℃,保持5 min,再以8 ℃/min升温至230 ℃,保持6 min;载气氦气(He)(纯度99.999%),流速1 mL/min;运行时间59.33 min。
MS条件:电子电离(electronic ionization,EI)源,电子能量70 eV;采集模式:全扫描,质量扫描范围20~550 amu,溶剂延迟1 min;离子源温度230 ℃;四极杆温度150 ℃,接口温度230 ℃。
定性定量方法:根据所测质谱图与美国国家标准与技术研究院(national institute of standards and technology,NIST)11谱库检索并结合保留指数进行定性分析,采用内标法进行半定量,利用待测物质与内标物质的峰面积比计算待测物质含量。
1.3.5 产香酵母的鉴定
(1)形态学观察
将产香酵母接入PDA固体培养基中,30 ℃培养2 d,观察并记录其菌落形态。产香酵母在30 ℃、150 r/min条件下于YPD液体培养基中培养2 d,取稀释培养液在显微镜下观察,记录其细胞形态、生殖方式。
(2)生理生化试验
参照李晨[19]的方法和《酵母菌的特征与鉴定手册》[20],对产香酵母进行碳/氮源同化试验、葡萄糖发酵试验、产类淀粉实验和脲酶试验。
(3)分子生物学鉴定
通过试剂盒提取产香酵母DNA,以其为模板,利用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')、ITS4(5'-TCCTCCGCTTATTGATATGC-3')进行PCR扩增。PCR扩增体系为:2×San Taq PCR Mix 25 μL,引物ITS1 2 μL,引物ITS4 2 μL,DNA模板2 μL,双蒸水(ddH2O)19 μL。PCR扩增程序为:94 ℃预变性6 min;94 ℃变性45 s,53 ℃退火45 s,72 ℃延伸120 s,循环次数30次;72 ℃最终延伸10 min,4 ℃终止反应。PCR扩增产物经1%琼脂糖凝胶电泳检测合格后送至上海生物工程股份有限公司进行测序。将获得的ITS序列提交至美国国家生物技术信息中心(National center for biotechnology information,NCBI)的GenBank数据库中采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对,利用MEGA X软件中的邻接(neighbor joining,NJ)法构建菌株系统发育树。
1.3.6 产香酵母的生长特性及耐受性
(1)产香酵母的生长曲线
将酵母以1×106CFU/mL接种于YPD液体培养基,30 ℃、150 r/min摇床培养30 h,每间隔2 h取样测定波长560 nm处的吸光度值。以培养时间为横坐标,吸光度值为纵坐标绘制菌株生长曲线。
(2)耐受性试验
为了考察产香酵母对乙醇体积分数、pH值及温度的耐受性,分别设定YPD液体培养基中乙醇体积分数为0、4%、6%、8%、10%、12%、14%、16%;pH值为2、3、4、5、6、7;温度为15 ℃、20 ℃、25 ℃、30 ℃、35 ℃、40 ℃、45 ℃、50 ℃。将产香酵母以2%的接种量接入上述条件的YPD液体培养基中,除温度耐受性实验为30 ℃恒温静置培养之外,其他耐受性试验在30 ℃、150 r/min条件下恒温振荡培养,24 h后在波长560 nm处测定吸光度值,以同样接种酵母但未培养的菌液作为空白对照。
1.3.7 数据处理
所有数据均重复测定3次,以“平均值±标准差”表示,采用Origin 2021、SPSS 26.0进行数据分析与绘图。
2 结果与分析
2.1 产香酵母初筛
对酱香大曲来源的22株酵母菌进行透明圈试验,初筛结果见表1。由表1可知,共有15株酵母产生了三丁酸甘油酯透明圈,且菌株之间透明圈直径存在显著性差异(P<0.05)。在所有能产生三丁酸甘油酯透明圈的菌株中,除菌株FBKL2.0508、FBKL2.0511、FBKL2.0513外,其他菌株产生的透明圈大小均>1 cm,以菌株FBKL2.0519的透明圈直径最大,为1.467 cm。因此,后续试验选择透明圈平均直径>1的菌株进行复筛。
表1 酱香大曲中分离酵母菌初筛结果
Table 1 Preliminary screening results of yeasts isolated from sauce-flavor Daqu
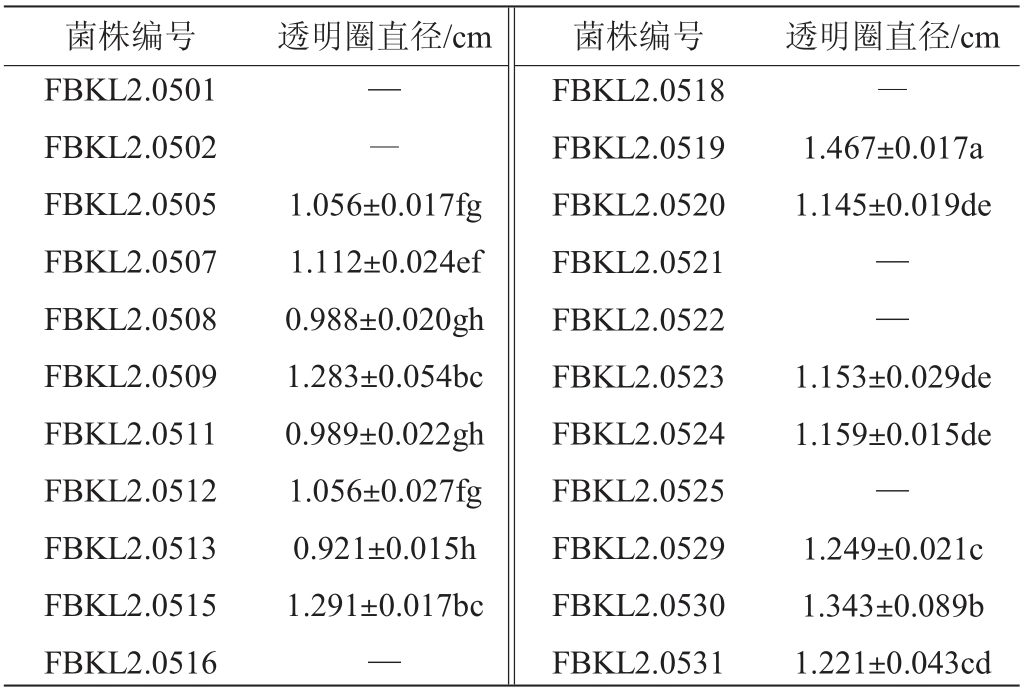
注:“—”未观察到透明圈,小写字母不同表示差异显著(P<0.05)。
菌株编号 透明圈直径/cm 菌株编号 透明圈直径/cm FBKL2.0501 FBKL2.0502 FBKL2.0505 FBKL2.0507 FBKL2.0508 FBKL2.0509 FBKL2.0511 FBKL2.0512 FBKL2.0513 FBKL2.0515 FBKL2.0516—――1.056±0.017fg 1.112±0.024ef 0.988±0.020gh 1.283±0.054bc 0.989±0.022gh 1.056±0.027fg 0.921±0.015h 1.291±0.017bc—FBKL2.0518 FBKL2.0519 FBKL2.0520 FBKL2.0521 FBKL2.0522 FBKL2.0523 FBKL2.0524 FBKL2.0525 FBKL2.0529 FBKL2.0530 FBKL2.0531 1.467±0.017a 1.145±0.019de——1.153±0.029de 1.159±0.015de—1.249±0.021c 1.343±0.089b 1.221±0.043cd
2.2 产香酵母复筛
总酯是反映酵母产酯产香能力的一个重要指标,不同酵母的产酯性能测定结果见图1。由图1可知,12株酵母的总酯含量具有显著性差异(P<0.05),其中菌株FBKL2.0519的总酯含量最高,为3.695 g/L,是其他酵母的3倍及以上。另外,尽管菌株FBKL2.0509和菌株FBKL2.0524的总酯含量不及菌株FBKL2.0519,但与其他酵母相比仍具有显著优势,其余测试菌株的总酯含量相对较低。因此,选择总酯含量较高的酵母菌株FBKL2.0519、FBKL2.0509及FBKL2.0524进行下一步筛选。
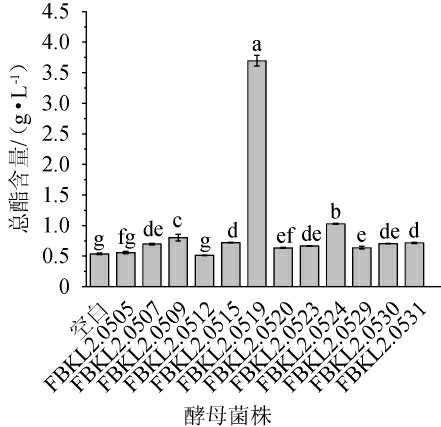
图1 酱香大曲中分离酵母菌总酯含量的测定结果
Fig.1 Determination results of total ester contents of yeasts isolated from sauce-flavor Daqu
小写字母不同表示差异显著(P<0.05)。
2.3 产香酵母高粱汁发酵液挥发性风味物质分析
对菌株FBKL2.0519、FBKL2.0509及FBKL2.0524的高梁汁发酵液中挥发性风味物质进行GC-MS分析,各类别挥发性风味物质含量结果见图2,菌株FBKL2.0519高梁汁发酵液中挥发性风味成分GC-MS分析结果见表2。由图2可知,不同酵母高梁汁发酵液中挥发性风味物质种类和含量存在较大差异,从挥发性物质种类来看,菌株FBKL2.0509(29种)>菌株FBKL2.0519(24种)>菌株FBKL2.0524(19种),以总挥发性物质的平均含量来看,菌株FBKL2.0519(28 728.54 μg/L)>菌株FBKL2.0524(24 540.39 μg/L)>菌株FBKL2.0509(5 532.28 μg/L)。尽管菌株FBKL2.0509检出的挥发性风味成分种类最多,但其总挥发性物质的含量不如另外两种酵母,而与菌株FBKL2.0524相比,菌株FBKL2.0519在挥发性物质种类和总含量上都更有优势,最终选择菌株FBKL2.0519作为理想的产香酵母进行后续实验。
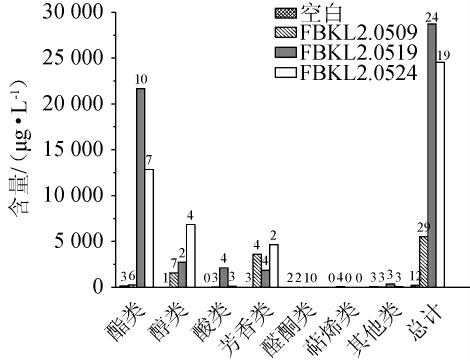
图2 不同酵母菌株高粱汁发酵液中挥发性风味化合物含量
Fig.2 Volatile flavor compounds contents in sorghum juice fermentation liquid by different yeasts
表2 菌株FBKL2.0519高粱汁发酵液中挥发性风味成分测定结果及香气特征
Table 2 Determination results and aroma characteristics of volatile flavor components in sorghum juice fermentation liquid by strain FBKL2.0519
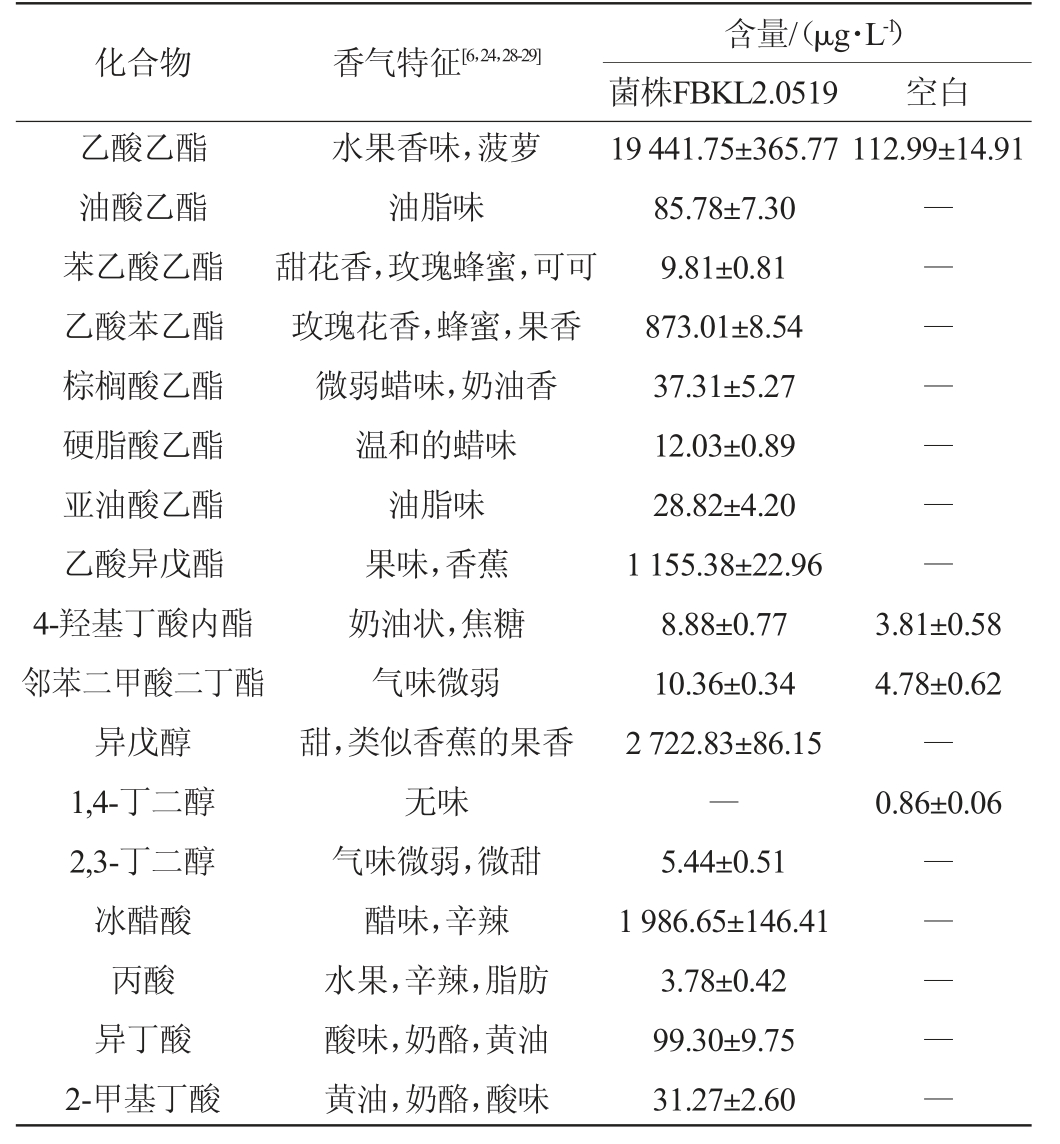
化合物 香气特征[6,24,28-29]含量/(μg·L-1)菌株FBKL2.0519 空白乙酸乙酯油酸乙酯苯乙酸乙酯乙酸苯乙酯棕榈酸乙酯硬脂酸乙酯亚油酸乙酯乙酸异戊酯4-羟基丁酸内酯邻苯二甲酸二丁酯异戊醇1,4-丁二醇2,3-丁二醇冰醋酸丙酸异丁酸2-甲基丁酸水果香味,菠萝油脂味甜花香,玫瑰蜂蜜,可可玫瑰花香,蜂蜜,果香微弱蜡味,奶油香温和的蜡味油脂味果味,香蕉奶油状,焦糖气味微弱甜,类似香蕉的果香无味气味微弱,微甜醋味,辛辣水果,辛辣,脂肪酸味,奶酪,黄油黄油,奶酪,酸味19 441.75±365.77 85.78±7.30 9.81±0.81 873.01±8.54 37.31±5.27 12.03±0.89 28.82±4.20 1 155.38±22.96 8.88±0.77 10.36±0.34 2 722.83±86.15―5.44±0.51 1 986.65±146.41 3.78±0.42 99.30±9.75 31.27±2.60 112.99±14.91―――――――3.81±0.58 4.78±0.62―0.86±0.06―――――
续表
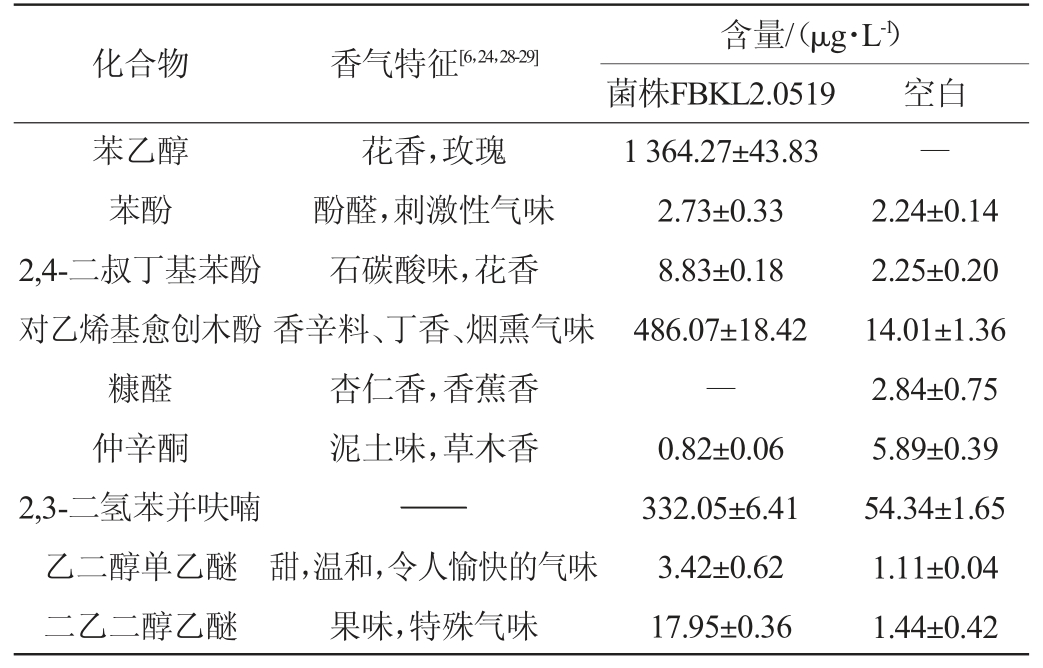
注:“―”表示未检出,“——”表示未查询到香气特征。
化合物 香气特征[6,24,28-29]含量/(μg·L-1)菌株FBKL2.0519 空白苯乙醇苯酚2,4-二叔丁基苯酚对乙烯基愈创木酚糠醛仲辛酮2,3-二氢苯并呋喃乙二醇单乙醚二乙二醇乙醚花香,玫瑰酚醛,刺激性气味石碳酸味,花香香辛料、丁香、烟熏气味杏仁香,香蕉香泥土味,草木香——甜,温和,令人愉快的气味果味,特殊气味1 364.27±43.83 2.73±0.33 8.83±0.18 486.07±18.42―0.82±0.06 332.05±6.41 3.42±0.62 17.95±0.36―2.24±0.14 2.25±0.20 14.01±1.36 2.84±0.75 5.89±0.39 54.34±1.65 1.11±0.04 1.44±0.42
由表2可知,相较于空白组,菌株FBKL2.0519的发酵液中挥发性风味物质的种类和含量都有所增加。具体而言,在其发酵液中共检测出了24种挥发性风味物质,包括酯类、醇类、酸类、芳香类和其他类等。总挥发性风味物质的含量达到了28 728.54 μg/L,而空白组只检测到12种挥发性风味物质且含量仅为206.56 μg/L。分析结果显示,所有挥发性香气化合物中,含量增加较多的有乙酸乙酯、乙酸苯乙酯、乙酸异戊酯、异戊醇、冰醋酸、苯乙醇和对乙烯基愈创木酚等。乙酸乙酯具有水果香气,能够赋予白酒愉悦的风味,同时也是衡量白酒类型和质量的重要指标之一[11]。乙酸乙酯是菌株FBKL2.0519最主要的风味代谢物,其含量在空白组的基础上提高至19 441.75 μg/L,空白组仅为112.99 μg/L。乙酸苯乙酯拥有一种典型的玫瑰花香,可利用β-苯乙醇和乙酸在酯酶的催化作用下生成[21]。同样地,乙酸异戊酯带有类似香蕉的香气,异戊醇和乙酰辅酶A(acetylcoenzyme A,acetyl-CoA)可作为其转化底物[22]。乙酸苯乙酯和乙酸异戊酯的含量在发酵后分别增加了873.01 μg/L和1 155.38 μg/L,这一发现与检测到两种酯类合成所需底物物质的结果相吻合。异戊醇不仅是合成酯的前体物质,其本身也带有轻微的甜味,可为酱香型白酒增加果香[23]。实验中,异戊醇是含量最高的醇类物质,平均质量浓度为2 722.83 μg/L。冰醋酸的香气特征被描述为醋味[6]、辛辣[24],是构成白酒风味的关键酸类物质之一[25],其含量在发酵后达到了1 986.65 μg/L。苯乙醇和对乙烯基愈创木酚是存在于酵母发酵液中的两种主要芳香类化合物,含量分别为1 364.27 μg/L和486.07 μg/L。苯乙醇具有令人愉悦的玫瑰花香,酵母可从Ehrlich、Harris等代谢途径将L-苯丙氨酸、还原糖转化为苯乙醇[26]。能够高效生产苯乙醇的酵母还被视为一种生物转化工具,用于生产这种具有特定风味的化合物,以应用于食品、香水等行业[27]。对乙烯基愈创木酚也叫4-乙烯基愈创木酚,具有强烈的香辛料、丁香、烟熏气味,是白酒、酱油中重要的呈香物质[28]。结果表明,菌株FBKL2.0519的发酵可产生多种重要的香气化合物,有利于调节改善白酒等发酵食品的口感和风味。
2.4 产香酵母FBKL2.0519的鉴定
2.4.1 形态学观察
菌株FBKL2.0519的菌落、细胞形态见图3。由图3可知,其菌落为奶油白色圆形、边缘环纹起皱、表面干燥易挑起。通过显微镜观察发现,该酵母的生殖方式为多端芽殖,细胞形态多为卵圆形、椭圆形。
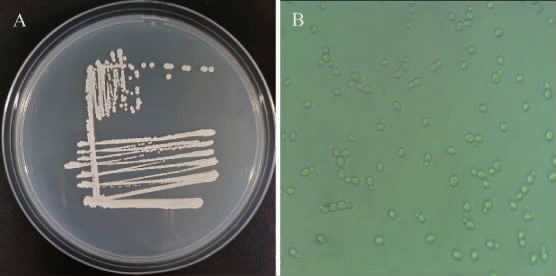
图3 菌株FBKL2.0519的菌落(A)及细胞(B)形态
Fig.3 Colony (A) and cell (B) morphology of strain FBKL2.0519
2.4.2 生理生化试验
菌株FBKL2.0519的生理生化试验结果见表3。由表3可知,该酵母菌株能够利用麦芽糖、葡萄糖、蔗糖、果糖、半乳糖、甘露醇、山梨醇及乙醇作为碳源进行生长,而无法利用乳糖和海藻糖进行生长;能够利用测试牛肉膏、蛋白胨、酵母浸膏、硫酸铵、硝酸钠等五种氮源进行生长;葡萄糖发酵试验结果为阳性;类淀粉化合物及脲酶试验结果呈阴性。
表3 菌株FBKL2.0519的生理生化试验结果
Table 3 Results of physiological and biochemical experiments of strain FBKL2.0519

注:“+”表示结果阳性;“-”表示结果阴性。
项目 结果 项目 结果麦芽糖葡萄糖蔗糖果糖乳糖半乳糖海藻糖甘露醇山梨醇++ + + - + - + +乙醇牛肉膏蛋白胨酵母浸膏硫酸铵硝酸钠葡萄糖发酵产类淀粉实验脲酶实验++ + + + + + - -
2.4.3 分子生物学鉴定
基于ITS基因序列构建菌株FBKL2.0519的系统发育树,结果见图4。由图4可知,菌株FBKL2.0519与异常威克汉姆酵母(Wickerhamomyces anomalus strain MW284508.1)的同源性最高,相似度为100%,因而菌株FBKL2.0519被鉴定为异常威克汉姆酵母(Wickerhamomyces anomalus)。

图4 基于ITS基因序列菌株FBKL2.0519的系统发育树
Fig.4 Phylogenetic tree of strain FBKL2.0519 based on ITS gene sequences
2.5 产香酵母FBKL2.0519的生长特性
生长曲线显示了Wickerhamomyces anomalus FBKL 2.0519不同生长阶段的特征,对指导其发酵和培养有重要的参考价值。W.anomalus FBKL2.0519的生长曲线见图5。由图5可知,0~4 h时酵母FBKL2.0519生长处于延滞期,4~14 h时为对数生长期,14 h以后进入稳定期。
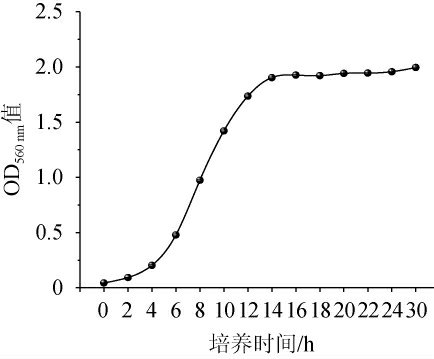
图5 菌株FBKL2.0519的生长曲线
Fig.5 Growth curve of strain FBKL2.0519
2.6 产香酵母FBKL2.0519的耐受性分析
不同发酵环境中,酵母所受到的胁迫因素可能有所不同,而酒精度、酸碱性、温度通常是酿造环境中酵母面临的主要应激因素[30]。因此,对W.anomalus FBKL2.0519进行耐受性测试,以波长560 nm处的吸光度值(OD560nm值)为评价指标,测定不同耐受条件下W.anomalus FBKL2.0519的生物量,结果见图6。
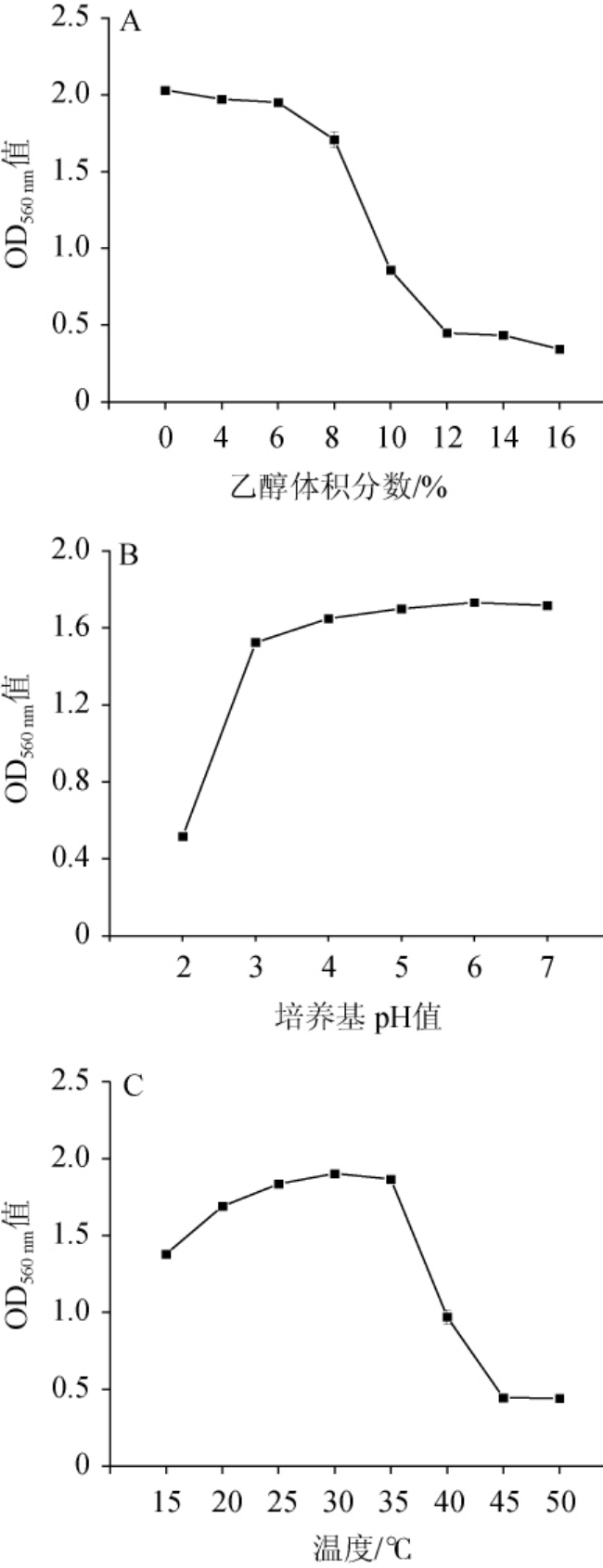
图6 菌株FBKL2.0519的耐受性试验结果
Fig.6 Results of tolerance experiments of strain FBKL2.0519
高浓度乙醇会干扰膜转运蛋白的结构和功能,导致酵母细胞膜稳定性降低和通透性增加,从而抑制其生长[31]。由图6A可知,W.anomalus FBKL2.0519生物量随乙醇体积分数的增加而逐渐降低,但在乙醇体积分数达到10%的体系中仍然能够进行生长。酸胁迫会引起细胞膜的透性变化,进而造成蛋白质变性,细胞死亡[32]。由图6B可知,W.anomalus FBKL2.0519在pH 3~7的培养条件下均能生长,并在pH值为3.0的培养条件下,仍具有相对较高的生长量。温度影响酵母细胞中酶的活性,高温还会诱导有害活性氧的积累,损伤蛋白质、DNA、脂质等重要细胞分子[33]。由图6C可知,W.anomalus FBKL2.0519的最佳生长温度条件为30 ℃,但直到温度升高至40 ℃时依然具有一定生长力。结果表明,酵母FBKL2.0519具有较好的耐受性。
3 结论
本研究通过初筛、复筛及挥发性风味物质分析,筛选出一株来源于酱香大曲且产酯产香性能优异的酵母FBKL 2.0519,其发酵液总酯产量为3.695 g/L。GC-MS结果显示,菌株FBKL2.0519的高梁汁发酵液中挥发性风味物质的含量和种类大幅增加,其主要风味物质乙酸乙酯的平均含量为19 441.75 μg/L。菌株FBKL2.0519被鉴定为异常威克汉姆酵母(Wickerhamomyces anomalus),具有良好的生长特性及耐受性,且能够在乙醇体积分数10%、pH值为3、温度为40 ℃的胁迫环境中生长。W.anomalus FBKL2.0519对提升发酵食品的香气具有重要价值,后续可深入研究其产香机制,拓宽其应用前景。
[1]LIU H L, SUN B G.Effect of fermentation processing on the flavor of Baijiu[J].J Agr Food Chem,2018,66(22):5425-5432.
[2]罗小叶,王晓丹,邱树毅.酱香酒生产过程中的微生物研究[J].酿酒科技,2018(10):108-113.
[3]TU W Y,CAO X N,CHEN J,et al.Chinese Baijiu:The perfect works of microorganisms[J].Front Microbiol,2022,13:919044.
[4]罗小叶,邱树毅,陆安谋,等.酱香大曲产香酵母的分离及鉴定[J].食品与发酵工业,2016,42(12):26-31.
[5]彭东,蒋雪薇,陈幽,等.高盐稀态酱醪中耐盐生香酵母的筛选及生香特性研究[J].食品与发酵工业,2020,46(13):76-84.
[6]赵书田,丁波,熊灵,等.产香酵母的筛选及桑葚酒发酵特性分析[J].食品科技,2023,48(12):9-15.
[7]富志磊,马景浩,周泉宇,等.模拟白酒固态发酵中异常威克汉姆酵母的提酯增香作用[J].中国食品学报,2023,23(5):175-183.
[8]YAN S B,CHEN X S,XIANG X B.Improvement of the aroma of lily rice wine by using aroma-producing yeast strain Wickerhamomyces anomalus HN006[J].AMB Express,2019,9(1):89.
[9]JIANG X W,PENG D,ZHANG W,et al.Effect of aroma-producing yeasts in high-salt liquid-state fermentation soy sauce and the biosynthesis pathways of the dominant esters[J].Food Chem,2020,344:128681.
[10]卢延想,梁慧珍,陈鹏,等.高温大曲中产香酵母的筛选及特征香气分析[J].食品研究与开发,2021,42(11):167-174.
[11]WANG W H,FAN G S,LI X T,et al.Application of Wickerhamomyces anomalus in simulated solid-state fermentation for Baijiu production:Changes of microbial community structure and flavor metabolism[J].Front Microbiol,2020,11:598758.
[12]CHEN Y R,WAN Y,CAI W Q,et al.Effects on cell membrane integrity of Pichia anomala by the accumulating excessive reactive oxygen species under ethanol stress[J].Foods,2022,11(22):3744.
[13]毕文慧,桂伦,姚健.微生物酯酶的开发及其在食品工业中的应用现状[J].食品与发酵工业,2019,45(17):272-277.
[14]张杰,侯珺淇,代振玉,等.一株产羧酸酯酶菌的鉴定及酯酶特征的研究[J].食品工业科技,2021,42(19):126-134.
[15]杜春迎.浓香型大曲中高产酯化酶菌株的筛选及产酶条件优化[D].哈尔滨:黑龙江大学,2012.
[16]王鹏昊,关统伟,张习超,等.小曲中优质产酯酵母分离鉴定及其产酯条件优化[J].食品与发酵工业,2018,44(2):62-67.
[17]国家市场监督管理总局,国家标准化管理委员会.GB/T 10345—2022白酒分析方法[S].北京:中国标准出版社,2022.
[18]莫祯妮.浓香白酒发酵过程中生物膜对风味物质合成的影响[D].贵阳:贵州大学,2022.
[19]李晨.一株产香酵母的筛选、鉴定及其产香条件的优化研究[D].武汉:武汉轻工大学,2019.
[20]巴尼特,佩恩亚罗,胡瑞卿(译),等.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991:68-171.
[21]刘志彬,张雯,陈玉香,等.异常维克汉姆酵母的乙酸苯乙酯合成途径[J].中国食品学报,2015,15(11):48-53.
[22]YOSHIMOTO H, BOGAKI T.Mechanisms of production and control of acetate esters in yeasts[J].J Biosci Bioeng,2023,136(4):261-269.
[23]王荣钰,赵金松,苏占元,等.酱香型白酒关键酱香风味物质研究现状[J].酿酒科技,2020(6):81-86.
[24]彭璐,明红梅,陶敏,等.樱桃酒酿造用产香酵母的筛选及其特征香气成分分析[J].中国酿造,2020,39(11):36-42.
[25]WU Y S, HOU Y X, CHEN H, et al."Key Factor" for Baijiu quality:Research progress on acid substances in Baijiu[J].Foods,2022,11(19):2959.
[26]任宇婷,乔美灵,孙子羽,等.清香型白酒发酵过程中高级醇形成规律[J].食品与发酵工业,2023,49(4):38-44.
[27]TIAN S F,LIANG X L,CHEN J,et al.Enhancement of 2-phenylethanol production by a wild-type Wickerhamomyces anomalus strain isolated from rice wine[J].Bioresource Technol,2020,318:124257.
[28]李青卓,王嘉瑞,张小龙,等.风味物质4-乙烯基愈创木酚的研究进展[J].中国酿造,2021,40(4):15-19.
[29]张建敏,杨康卓,刘芳,等.一株产香假丝酵母的筛选及其特征代谢风味物质分析[J].酿酒科技,2020(12):34-37,43.
[30]CHEN Y R,YANG Y L,CAI W Q,et al.Research progress of anti-environmental factor stress mechanism and anti-stress tolerance way of Saccharomyces cerevisiae during the brewing process[J].Crit Rev Food Sci,2022,63(33):12308-12323.
[31]TEIXEIRA M C,RAPOSO L R,MIRA N P,et al.Genome-wide identification of Saccharomyces cerevisiae genes required for maximal tolerance to ethanol[J].Appl Environ Microbiol,2009,75(18):5761-5772.
[32]刘兴艳,贾博,赵芳,等.酿酒酵母对弱有机酸胁迫的应激机制研究进展[J].食品与发酵工业,2013,39(6):125-129.
[33]LIN N X, XU Y, YU X W.Overview of yeast environmental stress response pathways and the development of tolerant yeasts[J].Syst Microbiol Biomanuf,2021,2(2):232-245.