米酒是一种以大米、糯米或小米等谷物作为原料,经浸泡、蒸煮、糖化后接种酒曲发酵等工艺制得的低酒精度饮料[1]。米酒起源于仰韶文化时期,是世界上最古老的酒种之一,也是中华民族传统的特色酒种,具有抗氧化、抗癌和抗炎等功效[2]。2019年,我国的米酒产量达到353万kL,成为日常主要生产和消费酒种之一[3]。米酒糟是米酒经酿造后产生的残渣,通常米酒糟的出糟率为20%~30%,按此计算预计我国每年会产生约100万t的米酒糟[4]。米酒糟作为米酒工业生产后的主要废弃物,含有丰富的蛋白质、淀粉、氨基酸、酵母以及各种酶类[5],具有巨大的利用价值和转化潜力。
目前,米酒糟的资源化利用方式主要包括用作动物饲料、提取功能性成分、微生物发酵生产高附加值产品等,不同地区开展的酒糟资源化利用也有所差异[6]。米酒糟常被用于制作动物饲料,但若将鲜酒糟直接投喂牲畜,由于其缺乏赖氨酸等反刍动物必需的氨基酸,不利于动物肠道消化吸收,长期投喂会引起牲畜的胃肠道疾病,甚至会影响肉质;且鲜酒糟含水率高,难以运输,易腐败变质,对于规模大且集中的酒厂难以从根本上解决问题[7-8]。利用米酒糟进行微生物分离或转化实现其产品的高附加值化一直是一个研究热点。万吉志等[9]用Acetobacter sp.-16对米酒糟进行发酵,并将酒糟、麸皮、麦壳、米酒按2∶1∶1∶3的质量比拌入发酵液中,生产所得到的香醋与传统香醋中的氨基酸含量相比提升了1.51%,使香醋的营养价值有所提升。WU D L等[10]以米酒糟作为碳源,经过KOH活化和FeCl3·6H2O催化得到氮硫共掺多孔碳材料,显示出良好的电容性能和较大的比表面积,实现了产品的高附加值化。因此解析米酒糟的组成成分,并对其进行高值化利用,对于减轻米酒糟处理带来的环保压力,提升米酒生产企业的综合效益具有重要的意义。
丁醇具有可再生、热值高、蒸汽压低、腐蚀性小等优点,实践探索证明,丁醇已成为具有较高性价比的新一代生物燃料[11]。与化学合成法相比,生物发酵法生产丁醇具有原料来源广、反应条件温和等优点,但其高昂的原料成本仍然是限制发酵法生物丁醇工业化应用的关键限制性因素之一[12]。本研究通过单因素试验探究水解温度、水解时间、pH、中温淀粉酶添加量、糖化酶添加量等因素对米酒糟淀粉水解得率的影响,在此基础上,采用响应面法和神经网络分析法对水解工艺进行优化。最后,探究了米酒糟作为原料发酵生产生物丁醇的可行性,为米酒糟的综合利用提供了参考。
1 材料与方法
1.1 材料与试剂
米酒糟A、B、C:分别来自湖北省孝感市某酒厂、湖北省十堰市某酒厂、湖北省黄冈市某酒厂;米酒糟经烘干至质量恒定之后,粉碎过筛(0.45 mm)备用。糖化酶(酶活力100 000 U/g):阿拉丁试剂有限公司;中温α-淀粉酶(酶活力10 000 U/g):上海麦克林生化科技有限公司。
菌种:拜氏梭菌(Clostridium beijerinckii)LY-5,实验室-80 ℃甘油管保藏。
种子培养基:葡萄糖20 g、蛋白胨20 g、酵母膏10 g,加入1 000 mL蒸馏水,搅拌溶解,121 ℃蒸汽灭菌15 min。
1.2 仪器与设备
TG16-WS高速离心机:上海湘仪仪器有限公司;GC7890A气相色谱仪(gas chromatography,GC):美国安捷伦科技公司;DK-S22电热恒温水浴锅:上海精宏实验设备有限公司;ZHJH-1214B超净工作台:上海智诚分析仪器制造公司;YXQ-LS-75SH高压蒸汽灭菌锅:上海博讯实业公司医疗设备厂。
1.3 实验方法
1.3.1 米酒糟水解液的制备流程
取烘干、粉碎过筛后的米酒糟粉末,加入一定量的蒸馏水,充分混匀后置于60 ℃条件下糊化2 h,糊化后用2 mol/L的氢氧化钠调节pH至5.0,分别加入30 U/g中温α-淀粉酶和180 U/g糖化酶,并于60 ℃水浴90 min酶解,得到水解液米酒糟。
1.3.2 不同米酒糟添加量对米酒糟淀粉水解条件的影响
在水解温度60 ℃、水解时间120 min、水解pH5.0、中温α-淀粉酶添加量40 U/g、糖化酶添加量180 U/g的条件下,考察不同米酒糟添加量(100 g/L、200 g/L、300 g/L、400 g/L、500 g/L)对米酒糟淀粉水解的影响。
1.3.3 米酒糟淀粉水解条件优化单因素试验
在水解时间90 min,水解温度60 ℃,pH5.0,中温α-淀粉酶添加量30 U/g,糖化酶添加量180 U/g的基础条件下,分别考察水解温度(20 ℃、40 ℃、60 ℃、80 ℃、100 ℃),水解时间(30 min、60 min、90 min、120 min、150 min),pH(3.0、4.0、5.0、6.0、7.0),中温α-淀粉酶添加量(10 U/g、20 U/g、30 U/g、40 U/g、50 U/g),糖化酶添加量(80 U/g、130 U/g、180 U/g、230 U/g、280 U/g)对米酒糟淀粉水解的影响。
1.3.4 神经网络分析结合遗传算法优化
通过Matlab 2016a建立人工神经网络(artificial neural network,ANN)模型,对米酒糟的淀粉水解条件进行优化。神经网络包含1个输入层、1个隐藏层和1个输出层,其中输入层包括5个神经元(水解温度、水解时间、pH、中温α-淀粉酶添加量、糖化酶添加量),隐藏层包含9个神经元,输出层包含1个神经元(还原糖含量)。将单因素和中心复合设计(central composite design,CCD)试验的数据导入数据集中,随机选取70%的数据为训练集,30%的数据为测试集,设置最大迭代次数为200次,种群大小为40,交叉概率为0.7,变异概率为0.02,误差为10-3。当输入数据迭代至最终误差<10-3,此时神经网络已构建完成,通过遗传算法求得最优的米酒糟淀粉水解工艺条件,并进行验证试验[13]。
1.3.5 米酒糟淀粉水解液发酵产丁醇
参照WANG J B等[14]的方法,选取固体平板培养基表面上长得较好的4~6个菌落,用无菌接种环接种至种子培养基内,置于34 ℃恒温培养箱中培养42 h。随后,将成熟的种子培养液按照10%(V/V)的接种量接入灭菌后(121 ℃、15 min)的米酒糟淀粉水解液中,并加入3 g/L的CaCO3。最后,插上发酵栓,于34 ℃条件下培养72 h。发酵过程中,每24 h取样检测发酵液中丁醇、乙醇、异丙醇、丙酮、乙酸、丁酸、还原糖含量变化。
1.3.6 分析方法
米酒糟中水分、淀粉和还原糖含量:参照T/CBJ004—2018《固态发酵酒醅通用分析方法》[15]的方法测定;灰分含量:采用GB 5009.4—2016《食品中灰分的测定》[16]的方法测定;氨基酸态氮:采用甲醛滴定法进行测定;脂肪含量:采用索氏抽提法测定;蛋白质:采用GB 5009.5—2016《食品中蛋白质的测定》[17]测定。
丁醇发酵过程中溶剂(丁醇、异丙醇、乙醇、丙酮)和有机酸(乙酸、丁酸)的测定采用气相色谱法[18]:色谱柱使用DB-WAX 122-7032(30 m×0.25 mm×0.25 μm),进样口温度设为220 ℃,进样量为0.6 μL,分流比60∶1,分流流量为48 mL/min,配备氢火焰离子检测器(flame ionization detector,FID),检测器温度为220 ℃。柱箱升温过程如下:起始35 ℃维持5 min,然后以4 ℃/min升至60 ℃,再以6 ℃/min升至78 ℃,最后以20 ℃/min升至220 ℃,维持10 min。内标物为4%乙酸正戊酯,以保留时间定性,内标法定量。
1.3.7 数据处理
本研究中所有试验和检测均重复进行3次,数值以平均值表示。采用Origin 2021软件进行数据绘图。使用Design Expert 8.0.6软件进行响应面试验设计和数据处理。使用Matlab 2016a软件进行神经网络试验设计和数据处理。
2 结果与分析
2.1 米酒糟理化指标
不同来源米酒糟的主要理化指标如表1所示。由表1可知,米酒糟理化成分受发酵原料及生产工艺影响,表现出较大差异。其中,米酒糟中的淀粉、蛋白质、脂肪含量分别为10.5%~22.7%、21.2%~34.9%、4.8%~8.0%,这表明米酒糟中存在大量的营养物质未被利用。这些营养物质经一定的酶解处理后,可以产生丰富的还原糖和氨基酸,为微生物的生长提供适宜的营养条件。因此,米酒糟具有通过微生物转化生产生物丁醇的潜力。实验室前期的Plackett-Burman试验结果表明,培养基中的葡萄糖、蛋白胨、MgSO4·7H2O对Clostridium beijerinckii LY-5发酵生产丁醇具有显著影响,其中,葡萄糖含量对于丁醇的产量影响最大[14]。米酒糟A的还原糖含量为2.48%,淀粉含量为22.69%,均高于米酒糟B和米酒糟C,因此选择米酒糟A进行后续试验。
表1 不同来源米酒糟主要理化指标
Table 1 Main physicochemical indexes of rice wine residue from different sources
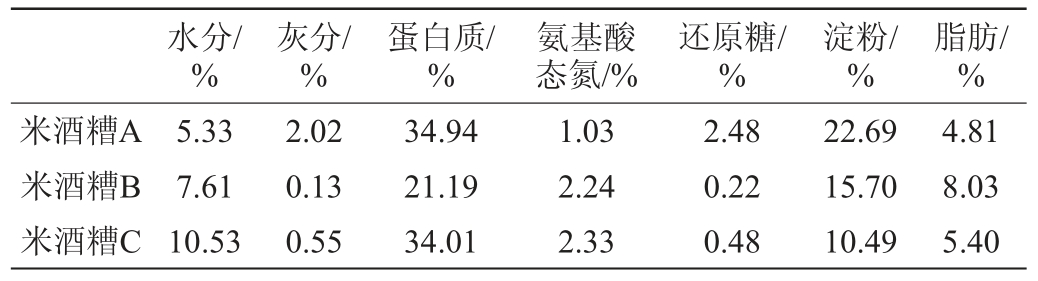
注:表中除水分外的其他理化指标均以绝干计。
水分/%灰分/%蛋白质/%氨基酸态氮/%还原糖/%淀粉/%脂肪/%米酒糟A米酒糟B米酒糟C 5.33 7.61 10.53 2.02 0.13 0.55 34.94 21.19 34.01 1.03 2.24 2.33 2.48 0.22 0.48 22.69 15.70 10.49 4.81 8.03 5.40
2.2 米酒糟水解条件优化单因素试验
2.2.1 米酒糟添加量对米酒糟淀粉水解的影响
由图1可知,随着米酒糟添加量在100~500 g/L范围内的增加,米酒糟淀粉水解液中的还原糖含量呈现先增加后减少的趋势。这可能是由于两方面的原因导致:一方面是由于在酶解反应初期两种酶能够快速分解淀粉生成还原糖,并且酒糟中也含有一定量的还原糖,随着米酒糟比例的增大,其中所包含的还原糖含量越多;另一方面当固形物含量>300 g/L时,水解液越来越粘稠,这会降低传质能力,使得酶与底物之间的接触变得不充分,从而造成还原糖含量有所下降[14]。当米酒糟添加量为300 g/L时,米酒糟淀粉水解液的还原糖含量最高,为18.00 g/L。因此,选择米酒糟最佳添加量为300 g/L。
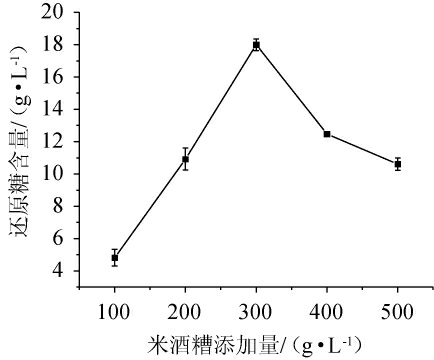
图1 米酒糟添加量对米酒糟淀粉水解液还原糖含量的影响
Fig.1 Effect of rice wine residue addition on reducing sugar content in starch hydrolysate of rice wine residue
2.2.2 不同水解温度对米酒糟淀粉水解的影响
由图2可知,随着水解温度在20~100 ℃范围内的上升,米酒糟淀粉水解液中的还原糖含量呈现先增加后减少的趋势。这可能是因为温度会影响酶促反应的速率,而中温α-淀粉酶的最适反应温度一般为40~60 ℃[19],糖化酶的最适反应温度一般为40~60 ℃[16]。当水解温度<60 ℃时,随着温度的升高,单位体积内活化分子数增多,有更多的反应物分子能越过反应壁垒,从而使中温α-淀粉酶和糖化酶的催化效率提高,淀粉大分子断键程度增大,形成小分子糖类增多,还原糖含量升高[20];当水解温度>60 ℃时,酶蛋白的热变性会导致酶活力降低,与底物的结合能力变弱,水解效果较差。当水解温度为60 ℃时,米酒糟淀粉水解液的还原糖含量最高,为35.62 g/L。因此,选择最佳水解温度为60 ℃。
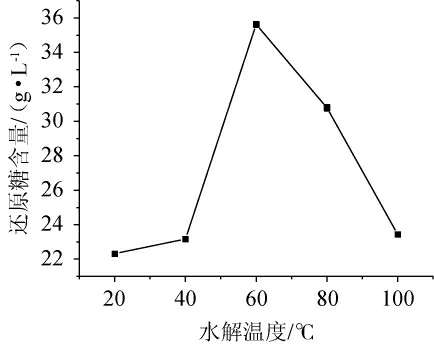
图2 水解温度对米酒糟淀粉水解液还原糖含量的影响
Fig.2 Effect of hydrolysis temperature on reducing sugar content in starch hydrolysate of rice wine residue
2.2.3 不同水解时间对米酒糟淀粉水解的影响
由图3可知,随着水解时间在30~150 min范围内的延长,米酒糟淀粉水解液中的还原糖含量呈现先增加后减少的趋势。这可能是因为在一定的水解时间内,酶解效果与时间呈正相关,随着水解时间的逐渐增加,淀粉不断地被水解,还原糖含量也随之上升。然而,过长的水解时间对水解效率的提升意义不大,并且水解介质pH会随着反应时间的延长而变化,从而影响酶分子活性部位基团的解离,导致造成还原糖含量的降低[22]。当水解时间为90 min时,米酒糟淀粉水解液的还原糖含量最高,为33.23 g/L。因此,选择最佳水解时间为90 min。
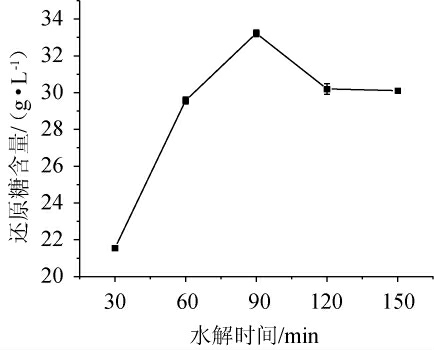
图3 水解时间对米酒糟淀粉水解液还原糖含量的影响
Fig.3 Effect of hydrolysis time on reducing sugar content in starch hydrolysate of rice wine residue
2.2.4 不同pH对米酒糟淀粉水解的影响
由图4可知,随着pH在3~7范围内的增加,米酒糟淀粉水解液中的还原糖含量呈现先增加后减少的趋势。这可能是因为pH会改变或破坏酶的空间结构、影响酶分子活性部位基团的解离,因此pH会引起中温α-淀粉酶和糖化酶分子的构象改变,影响其对淀粉的催化结合能力,从而导致淀粉不能被水解完全[22,23]。各种酶都有其特定的最适pH和适宜的pH范围,在最适pH时酶和底物之间有最适宜的结合和解离状态,从而使得酶具有最高的活力。其中,中温α-淀粉酶的最适pH常在5.0~7.0之间[19],糖化酶的最适pH在5.0~6.0之间[21]。当pH为5.0时,两种酶的协同作用最佳,米酒糟淀粉水解液的还原糖含量最高,为35.80 g/L。因此,选择最佳pH为5.0。
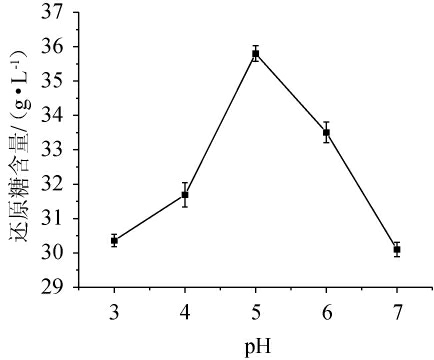
图4 pH对米酒糟淀粉水解液还原糖含量的影响
Fig.4 Effect of pH on reducing sugar contents in starch hydrolysate of rice wine residue
2.2.5 不同中温α-淀粉酶添加量对米酒糟淀粉水解的影响
由图5可知,随着中温α-淀粉酶添加量在10~50 U/g范围内的增加,米酒糟淀粉水解液中的还原糖含量呈现先增加后减少的趋势。这可能是由于当中温α-淀粉酶添加量较少时,在一定的温度和pH条件下,酶浓度与酶促反应的速度呈正相关。反应中酶分子的数量不足以与底物全部结合,从而导致淀粉水解程度不高,生成小分子糖类少,还原糖较少。当中温α-淀粉酶的添加量达到一定值后,这时所有的酶分子均已被底物所饱和,还原糖含量达到最大。当中温α-淀粉酶添加量超过这一值时,淀粉分解率虽高,但由于受到酸和热的作用,其中一部分葡萄糖会发生复合反应和分解反应,生成一些复合二糖、复合低聚糖和非糖物质,导致还原糖含量降低[20]。当中温α淀粉酶添加量为30 U/g时,米酒糟淀粉水解液中的还原糖含量最高,为35.19 g/L。因此,选择中温α-淀粉酶最佳添加量为30 U/g。
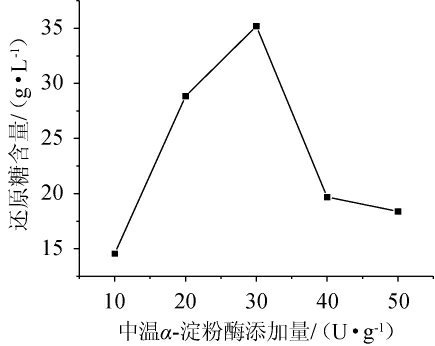
图5 中温α-淀粉酶添加量对米酒糟淀粉水解液还原糖含量的影响
Fig.5 Effect of medium temperature α-amylase addition on reducing sugar contents in starch hydrolysate of rice wine residue
2.2.6 不同糖化酶添加量对米酒糟淀粉水解的影响
由图6可知,随着糖化酶添加量在80~280 U/g范围内的增加,米酒糟淀粉水解液中的还原糖含量呈现先增加后减少的趋势。这可能是由于在糖化酶添加量较低的情况下,酶水解底物原料相对充足,酶与底物不断地结合,淀粉被不断地分解,直至还原糖含量上升至最高。但是当糖化酶的添加量超过180 U/g时,反应中发生的复合反应和分解反应将会影响葡萄糖的产率和纯度,因此还原糖含量会有所降低。当糖化酶添加量为180 U/g时,米酒糟淀粉水解液的还原糖含量最高,为35.19 g/L。因此,选择糖化酶最佳添加量为180 U/g。

图6 糖化酶添加量对米酒糟淀粉水解液还原糖含量的影响
Fig.6 Effect of saccharifying enzyme addition on reducing sugar contents in starch hydrolysate of rice wine residue
2.3 神经网络分析
ANN具有强大的数据拟合能力,能够不断学习并适应非线性关系的复杂数学模型,具有较好的拟合效果和预测能力[24-26],在实际操作中得到了广泛的应用。根据前期在单因素试验的基础上,选择水解温度(A)、水解时间(B)、pH(C)、中温α-淀粉酶添加量(D)、糖化酶添加量(E)为5个评价因素,米酒糟淀粉水解液还原糖含量(Y)为响应值,设计5因素3水平响应面试验对米酒糟淀粉水解条件进行优化,试验设计与结果见表2。
表2 水解条件优化响应面试验设计与结果
Table 2 Design and results of response surface tests for hydrolysis conditions optimization
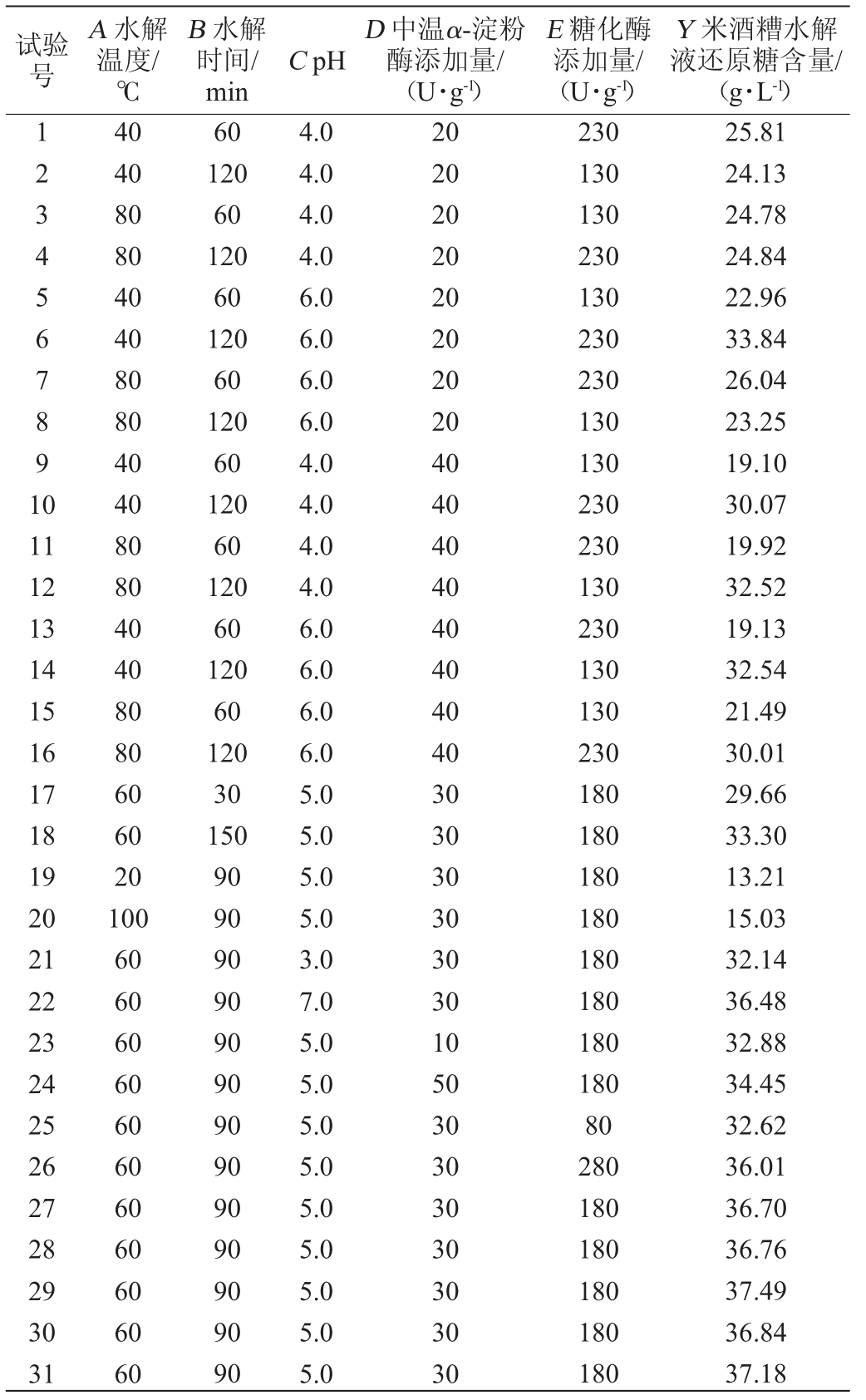
试验号A 水解温度/℃B 水解时间/min C pH D 中温α-淀粉酶添加量/(U·g-1)E 糖化酶添加量/(U·g-1)Y 米酒糟水解液还原糖含量/(g·L-1)1234567891 0 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 40 40 80 80 40 40 80 80 40 40 80 80 40 40 80 80 60 60 20 100 60 60 60 60 60 60 60 60 60 60 60 60 120 60 120 60 120 60 120 60 120 60 120 60 120 60 120 30 150 90 90 90 90 90 90 90 90 90 90 90 90 90 4.0 4.0 4.0 4.0 6.0 6.0 6.0 6.0 4.0 4.0 4.0 4.0 6.0 6.0 6.0 6.0 5.0 5.0 5.0 5.0 3.0 7.0 5.0 5.0 5.0 5.0 5.0 5.0 5.0 5.0 5.0 20 20 20 20 20 20 20 20 40 40 40 40 40 40 40 40 30 30 30 30 30 30 10 50 30 30 30 30 30 30 30 230 130 130 230 130 230 230 130 130 230 230 130 230 130 130 230 180 180 180 180 180 180 180 180 80 280 180 180 180 180 180 25.81 24.13 24.78 24.84 22.96 33.84 26.04 23.25 19.10 30.07 19.92 32.52 19.13 32.54 21.49 30.01 29.66 33.30 13.21 15.03 32.14 36.48 32.88 34.45 32.62 36.01 36.70 36.76 37.49 36.84 37.18
将试验的条件与结果用于神经网络的训练与检测,隐藏层为采用“5-9-1”拓扑结构的神经网络训练模型。当训练周期进行了207个阶段时,预测结果和实际输出值之间的均方误差(0.000 992 24)小于设定值10-3,说明神经网络模型建立,可以用于米酒糟淀粉水解条件参数的预测(图7A)。此外,数据点基本在直线附近,说明试验值与预测值相近,并且R值为0.998 69(图7B),相关性较好,这说明神经网络训练状况良好,可以用于预测。随后,利用遗传算法对该模型进行最优值求解,得到预测的最优工艺参数为:水解温度63.61 ℃,水解时间100.84 min,pH 5.36,中温α-淀粉酶添加量31.81 U/g,糖化酶添加量168.55 U/g,此时还原糖含量预测值为44.07 g/L。为便于实际操作,将水解条件参数调整为水解温度64 ℃,水解时间101 min,pH 5.4,中温α-淀粉酶添加量32 U/g,糖化酶添加量170 U/g。在此条件下进行3次验证试验,米酒糟淀粉水解液还原糖含量平均值为40.49 g/L,与优化前的还原糖含量(30.17 g/L)相比提高了34.21%,说明其该模型准确性较好。综上说明ANN更适于米酒糟的淀粉水解工艺,对本实验模拟仿真效果较好。
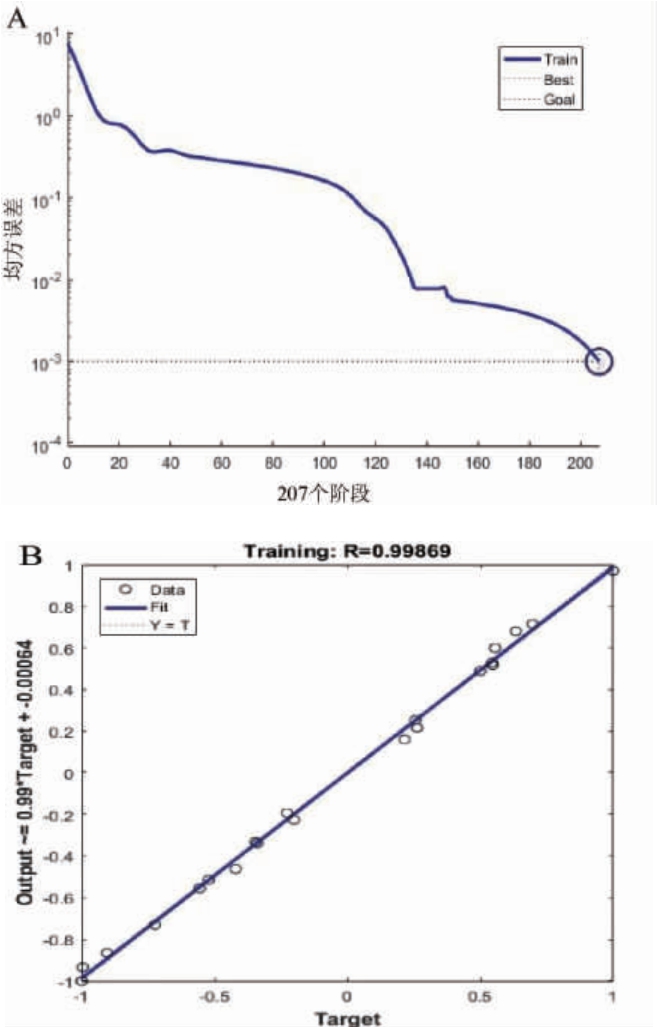
图7 预测值与实际值的均方差随训练次数的变化情况(A)和预测值与实际值的相关性(B)
Fig.7 Mean square error of predicted and actual value changes with training times (A) and correlation between predicted and actual value (B)
2.4 丁醇发酵
将优化后的米酒糟淀粉水解液作为原料用于丁醇发酵,结果见图8。
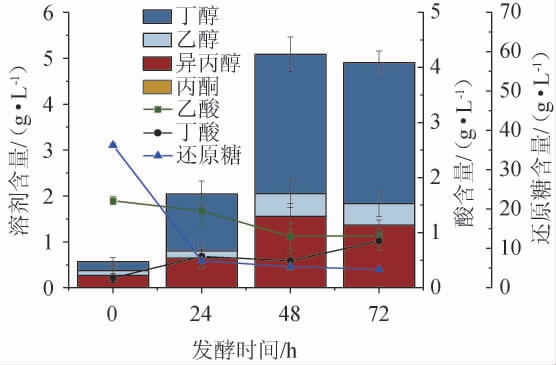
图8 米酒糟淀粉水解液作为原料用于丁醇发酵的效果
Fig.8 Effect of starch hydrolysate of rice wine residue as raw material for butanol fermentation
由图8可知,发酵0 h时,培养基中的还原糖含量为36.23 g/L,相比于米酒糟淀粉水解液中的糖含量降低了10.52%,这可能是由于在灭菌过程中水解液中的部分还原糖发生了美拉德反应[27]。此外,种子液中的糖含量较低,在接种后也起到了稀释作用。丁醇连续生产至第72小时时发酵结束,此时还原糖含量降低至4.65 g/L,糖利用率达到了87.17%。乙酸和丁酸的含量分别为0.95 g/L和0.85 g/L。
发酵结束时丁醇和总溶剂(丙酮(acetone)、丁醇(butanol)、乙醇(ethanol)的总和,简称ABE)的产量分别达到了3.07和3.59 g/L,其中丁醇的产率和还原糖得率分别为0.043 g/(L·h)和0.097 g/g糖,ABE的生产率和产量分别为0.050 g/(L·h)和0.114 g/g糖。此外,丙酮和乙醇的含量分别为0.05 g/L和0.47 g/L,丁醇、丙酮和乙醇的比例为8.56∶0.14∶1.30,与FORMANEK J等[28]报道的典型值(6∶3∶1)相比,丙酮含量大大降低,乙醇含量略有上升。这一现象可能是因为耐氧性或好氧性ABE菌株与一般的厌氧性菌株产生溶剂的比例不同,如AL-SHORGANI N K N等[29]发现乙酰丁酸梭菌YM1菌株在耐氧条件下发酵时丁醇、丙酮、乙醇的比例为6.29∶2.87∶0.54。因此,本研究中的溶剂比例可能是由于新型耐气菌株的独特性所致。另一方面,发酵结束时异丙醇的质量浓度达到1.37 g/L,这说明C.beijerinckii LY-5中具有利用异丙醇脱氢酶将丙酮转化为异丙醇的能力。丙酮由于其燃烧特性和腐蚀性被认为是ABE发酵中不需要的副产物,经分离得到的ABE仍需将丙酮去除,这增加了下游的分离成本。与之相比,异丙醇则可直接作为汽油燃料的替代品,且异丙醇、丁醇和乙醇的混合物也已成功用作生物燃料。综上所述,米酒糟可以作为发酵生产生物丁醇的优良原料。
3 结论
对米酒糟中淀粉的水解工艺进行了研究,并在此基础上进行丁醇发酵。在单因素试验的基础上,通过人工神经网络分析结合遗传算法对米酒糟水解条件进行优化,最终确定米酒糟水解的最佳工艺条件为水解温度64 ℃、水解时间101 min、pH5.4、中温α-淀粉酶添加量32 U/g、糖化酶添加量170 U/g。在此条件下,米酒糟经水解后还原糖浓度可达到40.49 g/L。将米酒糟淀粉水解液作为原料用于丁醇发酵,丁醇含量可达到3.07 g/L,这说明米酒糟具有作为原料生产生物丁醇的潜力。本研究对米酒糟的综合利用有一定的积极意义,应用前景广。
[1]TIAN S F,ZENG W Z,FANG F,et al.The microbiome of Chinese rice wine(Huangjiu)[J].Curr Res Food Sci,2022,5:325-335.
[2]袁国亿,何宇淋,王春晓,等.米酒风味品质形成相关因素的研究进展[J].食品与发酵工业,2022,48(9):286-294.
[3]YUAN H W,ZHANG C,CHEN S Y,et al.Effect of different moulds on oenological properties and flavor characteristics in rice wine[J]. LWTFood Sci Technol,2023,173:114201.
[4]张德勇,许晓路,谢广发.黄酒糟中功能性成分的开发利用研究进展[J].食品与发酵工业,2023,49(6):332-338.
[5]王晓玲.保健米酒酿造及利用米酒糟培养泰山赤芝的研究[D].无锡:江南大学,2009.
[6]陶雪,吕佳顺,许华杰,等.酒糟综合利用研究进展及茅台实践[J].中国酿造,2023,42(6):22-27.
[7]卢建明.米酒糟的综合利用[D].广州:广东工业大学,2006.
[8]YANG Y H, SHEN Y C, PAN Y Q, et al.Effects of dietary sorghum dried distiller's grains with solubles on growth performance,diet nutrient digestibility,carcass characteristics and immunity in growing rabbits[J].J Anim Physiol Anim Nutr,2019,103(1):363-369.
[9]万吉志,冷云伟,吴根江,等.综合利用黄酒糟生产食醋的研究[J].中国酿造,2016,35(1):170-173.
[10]WU D L,CHENG J Y,WANG T,et al.A novel porous N- and S-selfdoped carbon derived from Chinese rice wine lees as high-performance electrode materials in a supercapacitor[J]. ACS Sustain Chem Eng,2019,7(14):12138-12147.
[11]高越,郭晓鹏,杨阳,等.生物丁醇发酵研究进展[J].生物技术通报,2018,34(8):27-34.
[12]NI Y,SUN Z.Recent progress on industrial fermentative production of acetone-butanol-ethanol by Clostridium acetobutylicum in China[J].Appl Microbiol Biot,2009,83(3):415-423.
[13]蔡林洋.耐氧型丁醇生产菌的筛选及高效转化白酒糟生产丁醇的研究[D].武汉:湖北工业大学,2020.
[14]WANG J B, KONG B, FENG J W, et al.A novel strategy for comprehensive utilization of distillers'grain waste towards energy and resource recovery[J].Process Biochem,2022,113:141-149.
[15]中国酒业协会团体标准.T/CBJ004—2018 固态发酵酒醅通用分析方法[S].北京:中国标准出版社,2018.
[16]中华人民共和国国家卫生和计划生育委员会.GB 5009.4—2016 食品中灰分的测定[S].北京:中国标准出版社,2016.
[17]中华人民共和国国家卫生和计划生育委员会.GB 5009.5—2016 食品中蛋白质的测定[S].北京:中国标准出版社,2016.
[18]张瑞景,王浩,蔡凤娇,等.高效液相色谱法检测白酒中四种有机酸的方法研究[J].中国酿造,2022,41(3):238-242.
[19]高银涛.固态双边发酵糖化过程调控技术研究[D].无锡:江南大学,2022.
[20]易蒲红,林巧.马铃薯淀粉水解糖的工艺[J].现代食品,2017(24):90-94.
[21]高银涛.固态双边发酵糖化过程调控技术研究[D].无锡:江南大学,2022.
[22]刘旭东,徐岩.一种新的中温酸性α-淀粉酶的分离纯化及酶学性质[J].应用与环境生物学报,2008(2):235-239.
[23]周志豪,李芸芸,王唯,等.酱油渣水解液养殖小球藻积累蛋白质可行性研究[J].湘潭大学学报(自然科学版),2023,45(1):115-126.
[24]王俊敏.黑藜麦山楂酒的研制及抗氧化分析[D].太原:山西大学,2021.
[25]GADEKAR R M,AHAMMED M M.Modelling dye removal by adsorption onto water treatment residuals using combined response surface methodology-artificial neural network approach[J]. J Environ Manage,2019,231:241-248.
[26]SHAFI J,SUN Z H,JI M S, et al.ANN and RSM based modelling for optimization of cell dry mass of Bacillus sp.strain B67 and its antifungal activity against Botrytis cinerea[J].Biotechnol Biotechnol Equip,2018,32(1):58-68.
[27]邹曼,张雪丹,张倩,等.新梨7号梨汁加工过程中品质的变化[J].食品研究与开发,2021,42(12):19-23.
[28]FORMANEK J,MACKIE R,BLASCHEK H P,et al.Enhanced butanol production by Clostridium beijerinckii BA101 grown in semidefined P2 medium containing 6 percent maltodextrin or glucose[J].Appl Environ Microbiol,1997,63(6):2306-2310.
[29]AL-SHORGANI N K N,KALIL S M,YUSOFF W M W,et al.Biobutanol production by a new aerotolerant strain of Clostridium acetobutylicum YM1 under aerobic conditions[J].Fuel,2015,158:855-863.