凝结魏茨曼氏菌(Weizmannia coagulans),是一种同时具有乳酸菌和芽孢杆菌共同特点,能形成芽孢且产乳酸的兼性厌氧革兰氏阳性菌[1]。一方面作为同型乳酸发酵菌,凝结魏茨曼氏菌能产生乳酸降低肠道pH,并且研究表明其自身可分泌抗菌物质,能抑制有害菌群滋生,调节肠道功能[2]。另一方面,凝结魏茨曼氏菌在不适的环境下能形成芽孢作为休眠体,因此它具有耐高温、耐酸碱环境、耐胆盐等特性[3]。
根据凝结魏茨曼氏菌益生作用和高抗逆性等特点,广泛应用于饲料、食品、环境等领域。在中国、美国以及欧盟等多个地区,凝结魏茨曼氏菌是公认的可安全使用的益生菌,可以帮助维持肠道微生态平衡、促进消化吸收、调节免疫功能等功效,大量的科学研究已经证实,凝结魏茨曼氏菌对人体具有一定程度的保健和治疗效果[4-5]。凝结魏茨曼氏菌已被农业农村部列入新型微生物饲料添加剂,可以降低腹泻率、促进抗病能力、提高饲料利用率,是抗生素的潜在替代品,已经从最初的工业饲养肉鸡和猪中应用,发展到犬、猫等宠物日粮中添加[1,6]。在水产养殖中,它可以净化水质、去除氨氮和磷、分解粪便和多余的饲料等有机物[7]。还有研究表明,凝结魏茨曼氏菌在处理重金属方面也起到了关键的作用[1]。
高密度培养是一种利用特定的培养技术和设备来实现微生物大规模繁殖、提高菌体密度和活性的培养方法。这主要涉及培养参数优化,如温度、pH值和溶氧等,以及培养基的优化,如碳源、氮源、无机盐和生长因子等[8]。范洪臣等[9]对筛选到的清酒乳杆菌通过响应面在MRS培养基的基础上进行了优化,试验结果显示活菌数提高了1 478.28%,达到1.98×108 CFU/mL。南树港等[10]对乳酸乳球菌的培养条件和培养基进行优化,从而使菌体的密度和活菌数都显著提高。综上,优化培养条件和培养基对于实现高密度培养十分关键。
为满足对高质量凝结魏茨曼氏菌日益增长的市场需求,该研究以本实验室筛选和保藏的生长和益生特性较好的一株凝结魏茨曼氏菌D1为研究对象,设计单因素试验和响应面试验分别对培养参数和培养基进行了优化,最后以10 L发酵罐放大培养,以期为凝结魏茨曼氏菌工业化高密度培养提供依据,为后期高质量菌粉生产奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与试剂
凝结魏茨曼氏菌(Weizmannia coagulans)D1:四川省食品发酵工业研究设计院有限公司菌种保藏实验室。
蔗糖、果糖、乳糖、海藻糖、麦芽糊精、葡萄糖、低聚果糖、可溶性淀粉、酵母浸粉、玉米浆、大豆蛋白胨、蛋白胨(胰)、蛋白胨、牛肉膏粉:北京奥博星生物技术有限责任公司。其余化学试剂均为分析纯:成都市科隆化学品有限公司。
1.1.2 培养基
MRS培养基:蛋白胨10 g/L、酵母粉5 g/L、牛肉膏10 g/L,磷酸氢二钾2 g/L、柠檬酸氢二铵2 g/L、乙酸钠5 g/L、葡萄糖20 g/L、吐温80 1 g/L、七水合硫酸镁0.58 g/L、四水合硫酸锰0.25 g/L,121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
ESJ200-4A电子天平:沈阳龙腾电子有限公司;LDZF-75L-II立式压力蒸汽灭菌器:上海申安医疗器械厂;SPX-150B-4生化培养箱:上海博讯实业有限公司医疗设备厂;PHSJ-3FpH计:上海仪电科学仪器股份有限公司;SW-CJ-1F洁净工作台:苏州安泰空气技术有限公司;TG-16高速离心机:四川蜀科仪器有限公司;752G紫外可见分光光度计:上海仪电分析仪器有限公司;10 L全自动发酵罐:温州兆曜机械科技有限公司;BLT-20A博莱特压缩机:博莱特(上海)压缩机有限公司;YN12-0.7-D全自动电加热蒸汽发生器:上海扬诺锅炉制造有限公司。
1.3 试验方法
1.3.1 菌种活化与培养
将-80 ℃冰箱中保藏的D1菌种甘油管解冻,按2%的接种量将其接种到50 mL的MRS培养基中,在37 ℃的温度下培养24 h,并进行两次传代培养。
1.3.2 菌体生物量的测定
比浊法测定吸光度值:将发酵液稀释5倍后,用紫外分光光度计测定菌液波长620 nm处吸光度值(OD620 nm值),以接种前培养基作为空白。
干质量测定:参考孙标等[11]的方法略有修改,用50 mL离心管准确装取40 mL的发酵液,在8 000 r/min条件下离心10 min,弃去上清液,用蒸馏水洗涤沉淀两次,放入烘箱将菌体干燥至恒质量,即得菌体的干质量。
1.3.3 培养条件优化单因素试验
设置初始培养条件为培养温度37 ℃,装液量100 mL/150 mL,接种量2%,pH不调整,培养24 h。考察初始pH(5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0)、中和剂(2 mol/L的氢氧化钾、氢氧化钠、碳酸钠、氨水)、培养温度(30 ℃、35 ℃、、37℃、40℃、45 ℃、50 ℃、55 ℃、60 ℃)、装液量(25 mL/150 mL、50mL/150mL、75mL/150mL、100mL/150mL、125mL/150mL、150 mL/150 mL)以及接种量(0.5%、1%、2%、4%、8%)对菌株OD620nm值及干质量的影响。
1.3.4 培养基配方优化单因素试验
设置MRS培养基为基础培养基,通过改变单一变量,考察碳源(20 g/L的蔗糖、果糖、乳糖、海藻糖、麦芽糊精、葡萄糖、低聚果糖、可溶性淀粉,并选择生长较好的碳源进行1∶1复配)、氮源(25 g/L的玉米浆、大豆蛋白胨、牛肉膏、胰蛋白胨、蛋白胨、硫酸铵、酵母浸粉,并选择生长较好的氮源进行1∶1复配)、无机盐(0.50 g/L的七水合硫酸镁、四水合硫酸锰、氯化钙、氯化钾、氯化钠、硫酸锌、硫酸铜、柠檬酸铁、硫酸亚铁以及不添加七水合硫酸镁和四水合硫酸锰的MRS培养基作为空白组)、生长因子(0.50 g/L的维生素C、维生素B1、组氨酸、精氨酸、赖氨酸、鸟氨酸盐酸盐、半胱氨酸盐酸盐、苯丙氨酸、脯氨酸、酪氨酸、色氨酸、谷氨酸钠)对菌株OD620 nm值及干质量的影响[12]。在上述试验确定培养基碳源、氮源、无机盐种类的基础上,探究培养基最佳碳源添加量(10 g/L、15 g/L、20 g/L、25 g/L、30 g/L)、氮源添加量(15 g/L、20 g/L、25 g/L、30 g/L、35 g/L)和无机盐添加量(0、0.25 g/L、0.50 g/L、0.75 g/L、1.00 g/L)对菌株OD620 nm的影响。
1.3.5 培养基优化响应面试验
根据上述试验结果,以(A)葡萄糖添加量、(B)酵母浸粉-胰蛋白胨(1∶1)添加量和(C)七水合硫酸镁添加量为评价因素,以OD620 nm值为响应值,进行3因素3水平Box-Behnken中心组合试验,试验因素与水平见表1。
表1 培养基配方优化Box-Behnken试验因素与水平
Table 1 Factors and levels of Box-Behnken test for media formula optimization

水平 A 葡萄糖/(g·L-1)C 七水合硫酸镁/(g·L-1)-1 B 酵母浸粉-胰蛋白胨/(g·L-1)01 20 25 30 25 30 35 0.00 0.25 0.50
1.3.6 不同参数10 L发酵罐放大培养
根据上述优化培养基的试验结果,配制6 L培养基,火焰法进行接种,接种量为1%,设置了不同的发酵罐条件(转速50 r/min、200 r/min和350 r/min和是否通气),在50 ℃、pH8条件下进行放大培养30 h,通过比较OD620nm确定放大培养发酵罐参数。
1.3.7 数据处理
所有试验数据进行三次重复,结果采用“平均值±标准差”表示。用IBM SPSS Statistics 26软件进行单因素方差分析和Duncan多重比较,P<0.05表明存在统计学上的差异,用不同的字母表示。部分数据采用Origin2022b进行绘图,采用Design Expert 8.0.6软件进行响应面试验的设计和分析。
2 结果与分析
2.1 培养条件优化单因素试验
2.1.1 不同初始pH和中和剂对凝结魏茨曼氏菌D1生长的影响
在微生物培养的过程中,不同的微生物均有适合自身生长代谢的最适和耐受pH范围,主要影响着微生物细胞的原生质膜的电荷以及生物酶的活性[13]。凝结魏茨曼氏菌作为一种同型乳酸菌,在发酵过程中会产生大量的乳酸,这会导致发酵液的pH值逐渐下降,因此,对pH值的控制变得尤为重要,不同初始pH值和中和剂对凝结魏茨曼氏菌D1生长的影响见图1。

图1 不同初始pH(A)和中和剂(B)对凝结魏茨曼氏菌D1生长的影响
Fig.1 Effects of different initial pH (A) and neutralizer (B) on the growth of Weizmannia coagulans D1
不同小写字母表示数据差异显著(P<0.05),下同。
由图1A可知,培养基的初始pH值对凝结魏茨曼氏菌D1生长的影响十分显著(P<0.05),当初始pH值从5.5上升到10.0时,其生长情况呈现先上升后下降的趋势。从菌体干质量和OD620 nm值综合来看,培养基的初始pH值在7.5~9.0范围内都能正常生长,而在8.0~8.5的范围内生长最为理想。由图1B可知,通过比较氢氧化钾、氢氧化钠、碳酸钠和氨水这四种中和剂,通过单因素方差分析氢氧化钾、氢氧化钠、氨水无显著性差异(P>0.05),而碳酸钠会对凝结魏茨曼氏菌D1生长产生不利影响,这可能是由于加入了不同的离子,从而影响了细胞内外的渗透压[14]。因此选择用氢氧化钠作为中和剂调节培养基初始pH为8.0。
2.1.2 不同温度和装液量对凝结魏茨曼氏菌D1生长的影响
温度作为影响微生物生长最为关键的物理因素,不仅影响生物酶的活性,还会对细胞的流动性和物质的传输能力产生影响[15]。不同温度和装液量对凝结魏茨曼氏菌D1生长的影响见图2。
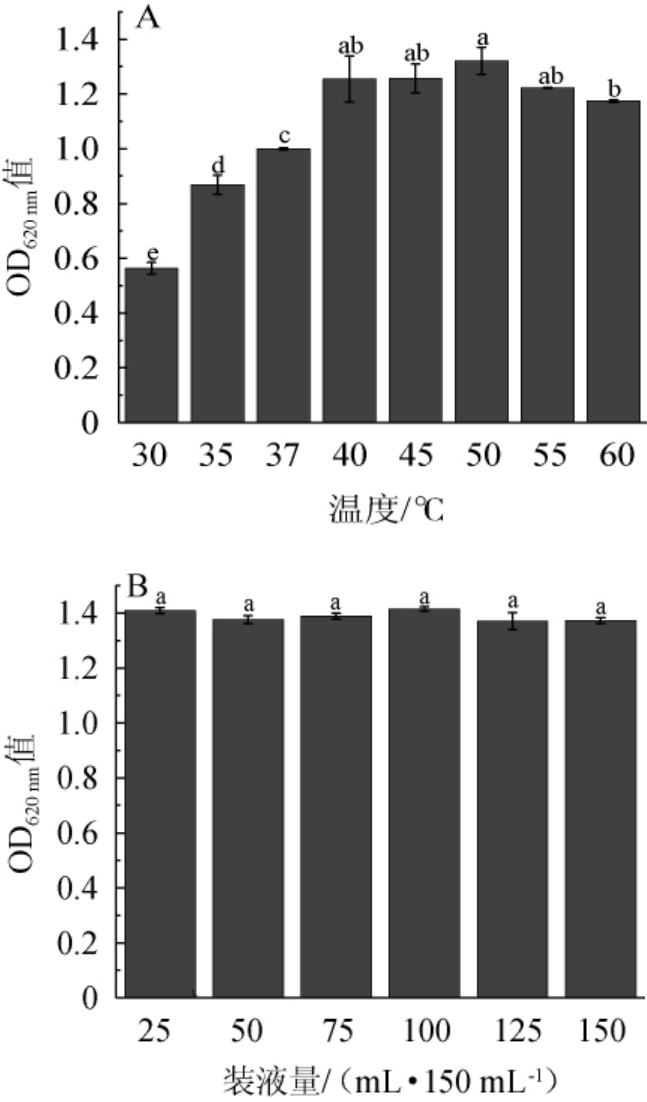
图2 不同温度(A)和装液量(B)对凝结魏茨曼氏菌D1生长的影响
Fig.2 Effects of different temperature (A) and liquid loading (B) on the growth of Weizmannia coagulans D1
由图2A可知,随着温度从30 ℃升高到60 ℃,菌株生长情况呈现先上升后下降的趋势,其在40 ℃到55 ℃均能良好生长,且培养温度50 ℃时OD620 nm值最高,因此选择最佳培养温度为50 ℃。凝结魏茨曼氏菌生长温度高于大多数微生物适宜生长温度,因此可应用于高温发酵。凝结魏茨曼氏菌作为一种兼性厌氧的微生物,它能够在有氧和无氧的环境中通过多种代谢途径生长繁殖,适宜的溶氧量环境可以加速其代谢过程并促进其生长,随着装液量的增加溶氧逐渐减少[15]。由图2B可知,装液量在25~150 mL/150 mL之间并没有显著的差异(P>0.05),推测这可能是因为此方法培养基溶氧量变化不大或D1对溶氧量不敏感所致,因此装液量保持100 mL/150 mL。
2.1.3 不同接种量对凝结魏茨曼氏菌D1生长的影响
接种量为种子液与培养基的体积比,决定着生长繁殖空间,若接种量过大,会导致培养基中有害代谢物质增加,也会增加种子液制备成本;但过低会延长发酵周期[16]。不同接种量对凝结魏茨曼氏菌D1生长的影响结果见图3。由图3可知,接种量从0.5%~4.0%时对于发酵影响较小,但是随着接种量的增加(4.0%~8.0%),发酵速度越快,延滞期越短。适当的初始菌浓度可以缩短菌株的生长繁殖周期[17]。综合考虑发酵速率与初始菌浓度,选择接种量为2.0%。
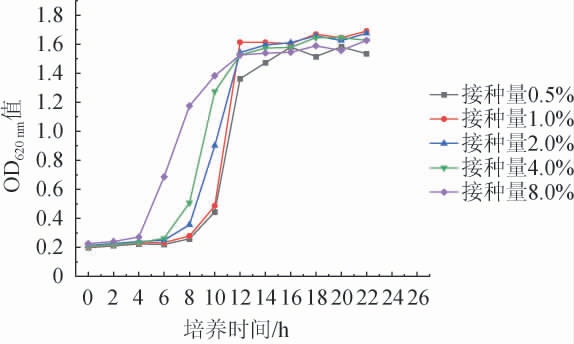
图3 不同接种量对凝结魏茨曼氏菌D1生长的影响
Fig.3 Effects of different inoculum on the growth of Weizmannia coagulans D1
2.2 培养基配方优化单因素试验
2.2.1 不同碳源对凝结魏茨曼氏菌D1生长的影响
在培养基中,碳源为所有微生物的生长和代谢过程提供了所需的碳元素。这些碳源既为细胞提供能量,又构成菌体,不同的碳源不仅对微生物的生长产生影响,还影响其代谢和产物的合成[12]。不同碳源对凝结魏茨曼氏菌D1生长的影响结果见表2。
表2 不同碳源对凝结魏茨曼氏菌D1生长的影响
Table 2 Effects of different carbon sources on the growth of Weizmannia coagulans D1
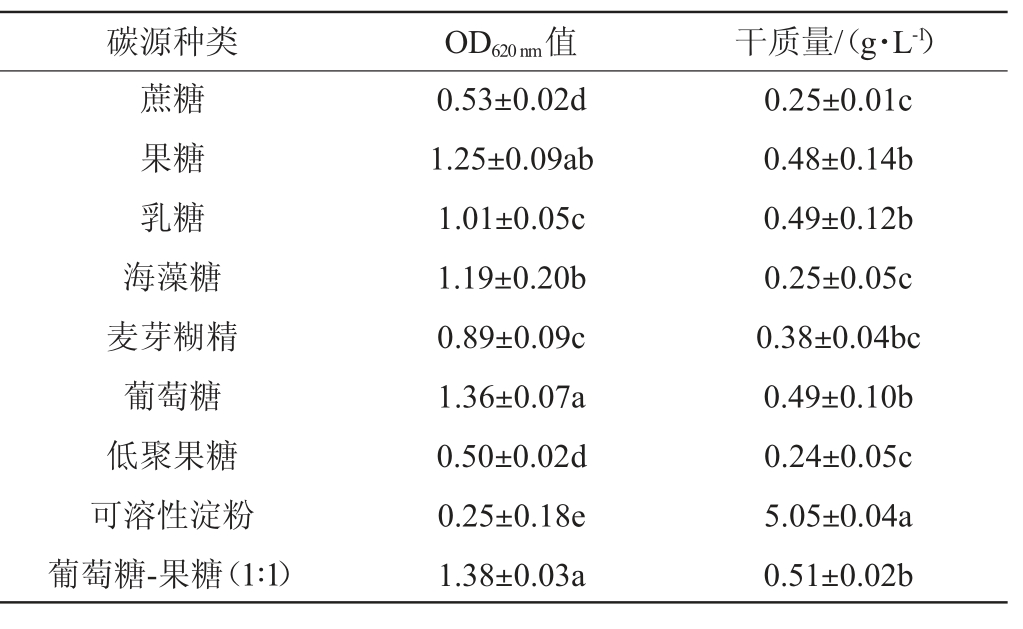
碳源种类 OD620 nm值 干质量/(g·L-1)蔗糖果糖乳糖海藻糖麦芽糊精葡萄糖低聚果糖可溶性淀粉葡萄糖-果糖(1∶1)0.53±0.02d 1.25±0.09ab 1.01±0.05c 1.19±0.20b 0.89±0.09c 1.36±0.07a 0.50±0.02d 0.25±0.18e 1.38±0.03a 0.25±0.01c 0.48±0.14b 0.49±0.12b 0.25±0.05c 0.38±0.04bc 0.49±0.10b 0.24±0.05c 5.05±0.04a 0.51±0.02b
由表2可知,不同的碳源对凝结魏茨曼氏菌D1有显著的影响(P<0.05),其中葡萄糖对其生长最为有利,其次为果糖。进一步对葡萄糖-果糖(1∶1)进行碳源复配,结果表明复配碳源与单一碳源葡萄糖无明显差异(P>0.05),值得注意的是部分可溶性淀粉未溶解,使菌体干质量最高,造成一定的干扰。由于葡萄糖是单糖,它可以更迅速地进入细胞并被利用[9],因此选择葡萄糖作为碳源。
2.2.2 不同氮源对凝结魏茨曼氏菌D1生长的影响
培养基中的氮源可以分为有机氮源和无机氮源两种,它们主要构成细胞中的蛋白质和核酸。不同氮源对凝结魏茨曼氏菌D1生长的影响结果见表3。由表3可知,酵母浸粉和胰蛋白胨对菌株生长最有利,在对玉米浆进行灭菌处理后,会出现少量的沉淀物,这导致了其干质量相对较高。与有机氮源相比,无机氮源整体都生长较差,甚至几乎无法生长。采用酵母浸粉和胰蛋白胨1∶1复配后的菌株OD620 nm值相较于原MRS培养基增加了26.09%,同时干质量也增加了85.37%,也显著高于其他氮源(P<0.05),复合氮源普遍比单一氮源更利于生长,可能是氮源之间相互补充的结果[18]。因此选择酵母浸粉-胰蛋白胨(1∶1)为最佳氮源。
表3 不同氮源对凝结魏茨曼氏菌D1生长的影响
Table 3 Effects of different nitrogen sources on the growth of Weizmannia coagulans D1
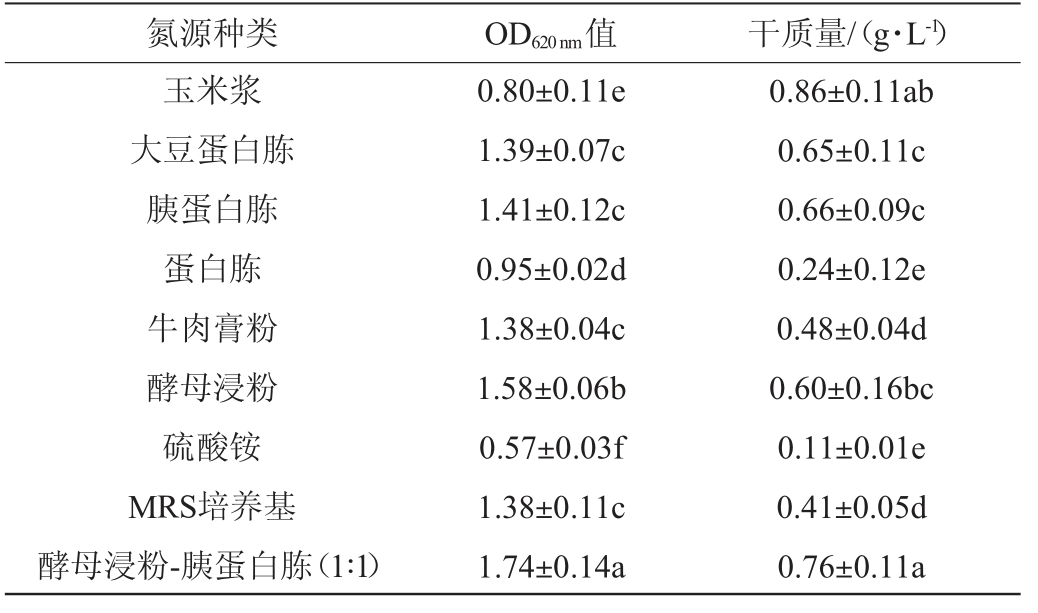
氮源种类 OD620 nm值 干质量/(g·L-1)玉米浆大豆蛋白胨胰蛋白胨蛋白胨牛肉膏粉酵母浸粉硫酸铵MRS培养基酵母浸粉-胰蛋白胨(1∶1)0.80±0.11e 1.39±0.07c 1.41±0.12c 0.95±0.02d 1.38±0.04c 1.58±0.06b 0.57±0.03f 1.38±0.11c 1.74±0.14a 0.86±0.11ab 0.65±0.11c 0.66±0.09c 0.24±0.12e 0.48±0.04d 0.60±0.16bc 0.11±0.01e 0.41±0.05d 0.76±0.11a
2.2.3 不同无机盐对凝结魏茨曼氏菌D1生长的影响
在微生物培养基中,无机盐作为微量的无机成分,对于微生物的生长和代谢过程是至关重要的。无机盐主要包括磷、钾、镁、硫等,它们可调节渗透压、组成酶或维持酶活性和调节氧化还原电位等作用[19-20],不同无机盐对凝结魏茨曼氏菌D1生长的影响见表4。由表4可知,氯化钙和硫酸铜对凝结魏茨曼氏菌D1的生长具有显著的抑制效果(P<0.05),与AL-KHAYRI J M等[21]的研究一致。七水合硫酸镁表现出明显的促进作用,其OD620nm值和干质量分别相较于空白增加了22.52%和32.61%。镁离子作为是众多酶的活化剂,有助于加速细胞内的代谢活动,并且还与细胞生物膜的形成有关[18,22]。因此选择七水合硫酸镁作为最佳无机盐。
表4 不同无机盐对凝结魏茨曼氏菌D1生长的影响
Table 4 Effects of different inorganic salts on the growth of Weizmannia coagulans D1
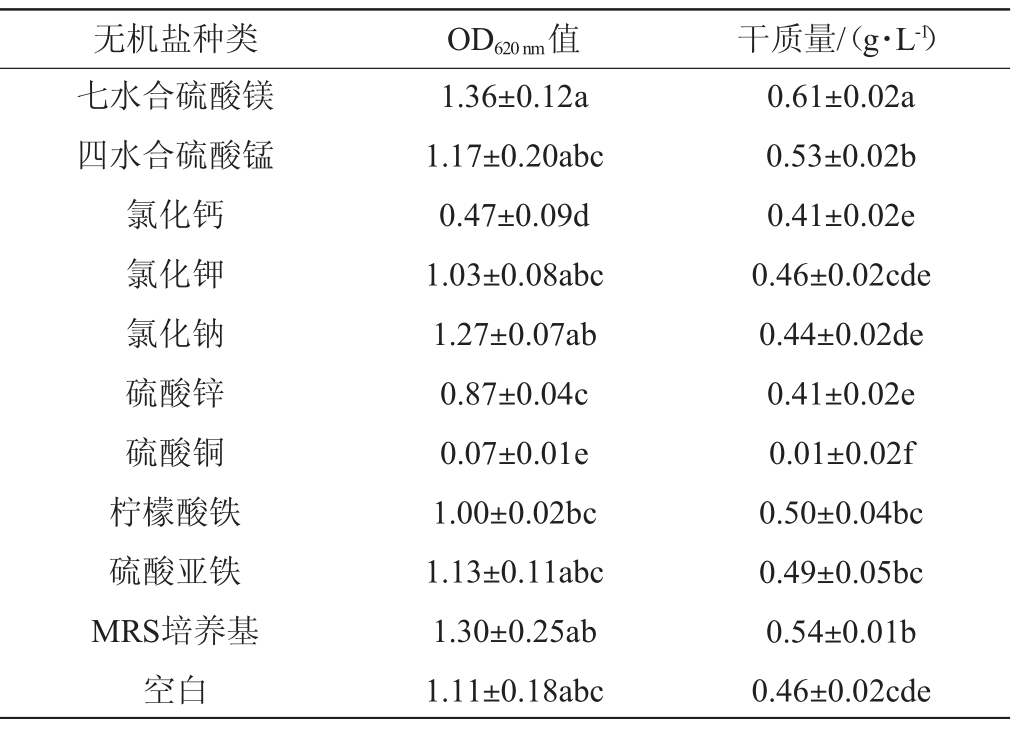
无机盐种类 OD620 nm值 干质量/(g·L-1)七水合硫酸镁四水合硫酸锰氯化钙氯化钾氯化钠硫酸锌硫酸铜柠檬酸铁硫酸亚铁MRS培养基空白1.36±0.12a 1.17±0.20abc 0.47±0.09d 1.03±0.08abc 1.27±0.07ab 0.87±0.04c 0.07±0.01e 1.00±0.02bc 1.13±0.11abc 1.30±0.25ab 1.11±0.18abc 0.61±0.02a 0.53±0.02b 0.41±0.02e 0.46±0.02cde 0.44±0.02de 0.41±0.02e 0.01±0.02f 0.50±0.04bc 0.49±0.05bc 0.54±0.01b 0.46±0.02cde
2.2.4 不同生长因子对凝结魏茨曼氏菌D1生长的影响
生长因子作为微量的有机成分,以维生素、氨基酸、核苷酸为主,它们主要作为细胞内酶的辅酶或辅基[19-20]。不同生长因子对凝结魏茨曼氏菌D1生长的影响结果见表5。由表5可知,本试验在MRS培养基的基础上添加了12种生长因子都无明显的促进作用,这意味着原培养基或其自身的合成量满足生长的需求,因此不需要再添加额外的生长因子。
表5 不同生长因子对凝结魏茨曼氏菌D1生长的影响
Table 5 Effects of different growth factors on the growth of Weizmannia coagulans D1
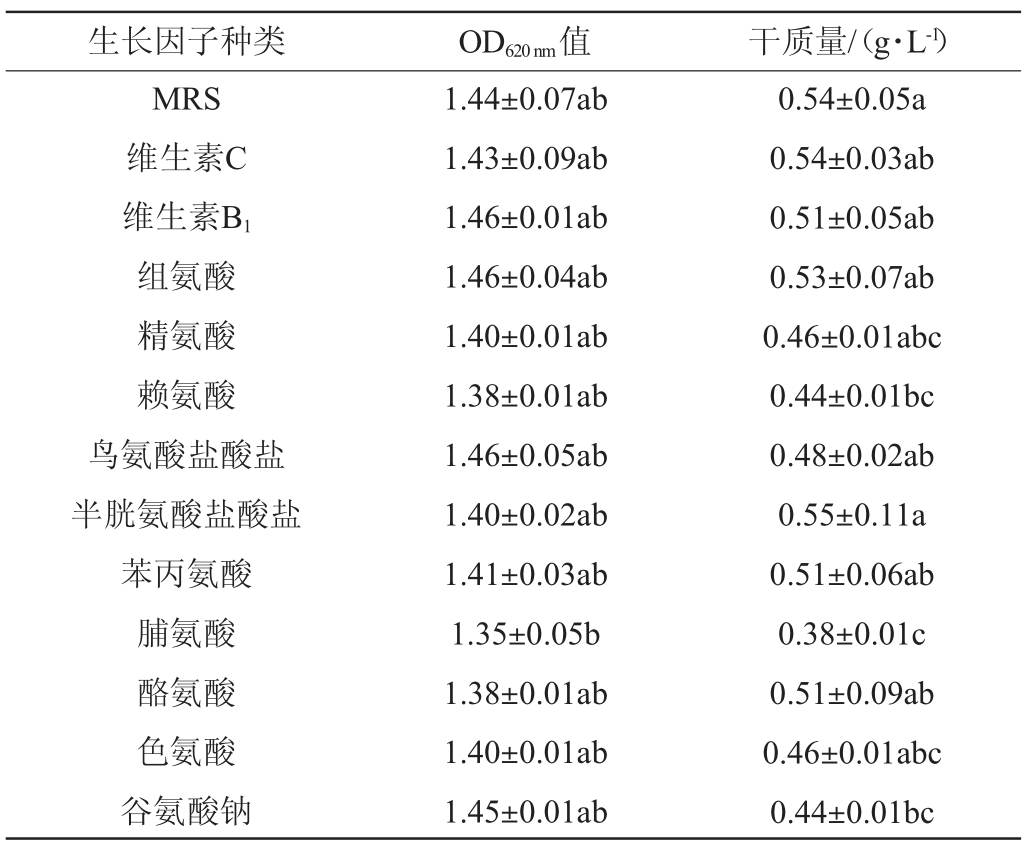
生长因子种类 OD620 nm值 干质量/(g·L-1)MRS维生素C维生素B1组氨酸精氨酸赖氨酸鸟氨酸盐酸盐半胱氨酸盐酸盐苯丙氨酸脯氨酸酪氨酸色氨酸谷氨酸钠1.44±0.07ab 1.43±0.09ab 1.46±0.01ab 1.46±0.04ab 1.40±0.01ab 1.38±0.01ab 1.46±0.05ab 1.40±0.02ab 1.41±0.03ab 1.35±0.05b 1.38±0.01ab 1.40±0.01ab 1.45±0.01ab 0.54±0.05a 0.54±0.03ab 0.51±0.05ab 0.53±0.07ab 0.46±0.01abc 0.44±0.01bc 0.48±0.02ab 0.55±0.11a 0.51±0.06ab 0.38±0.01c 0.51±0.09ab 0.46±0.01abc 0.44±0.01bc
2.2.5 碳源、氮源和无机盐添加量对凝结魏茨曼氏菌D1生长的影响
微生物的高密度培养会受到底物营养物的制约。营养底物过低会限制微生物的生长,而营养底物过高则会增加渗透压,这对微生物的生长是不利的[9,15]。不同添加量的最佳碳源、氮源和无机盐对对凝结魏茨曼氏菌D1生长的影响见图4。由图4可知,随着碳源和氮源添加量的增加,OD620nm值显著增加(P<0.05)后保持平衡,而无机盐七水合硫酸镁添加量的增加,没有对OD620 nm值产生显著性影响(P>0.05),但都显著高于空白组(P<0.05)。综合考虑添加成本和OD620 nm值,以碳源(葡萄糖)25 g/L、氮源(酵母浸粉-胰蛋白胨)30 g/L和无机盐(七水合硫酸镁)0.25 g/L作为Box-Behnken中心组合试验中心点,进行后续优化。

图4 碳源、氮源和无机盐添加量对凝结魏茨曼氏菌D1生长的影响
Fig.4 Effects of carbon, nitrogen and inorganic salt additions on the growth of Weizmannia coagulans D1
2.3 Box-Behnken中心组合设计试验分析
根据单因素试验结果,以葡萄添加量(A)、酵母浸粉-胰蛋白胨添加量(B)、七水合硫酸镁添加量(C)为评价因素,以OD620 nm值为响应值,进行Box-Behnken中心组合3因素3水平试验,试验设计与结果见表6,方差分析见表7。
表6 培养基配方优化Box-Behnken试验设计与结果
Table 6 Design and results of Box-Behnken test for media formula optimization
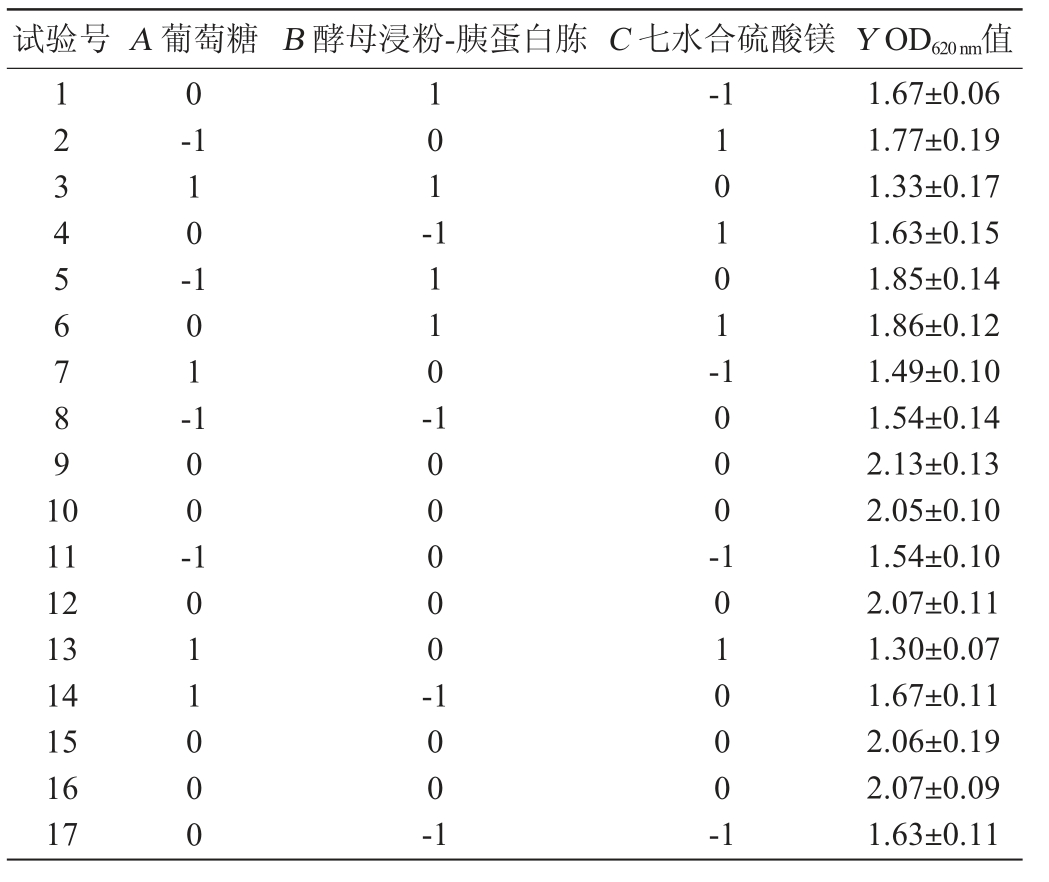
试验号A 葡萄糖 B 酵母浸粉-胰蛋白胨C 七水合硫酸镁Y OD620 nm值1234567891 0 0-1-110-101-101-1110-10101-11 12 13 14 15 16 17 100-1011000 100000-1000-100-1 101000-1 1.67±0.06 1.77±0.19 1.33±0.17 1.63±0.15 1.85±0.14 1.86±0.12 1.49±0.10 1.54±0.14 2.13±0.13 2.05±0.10 1.54±0.10 2.07±0.11 1.30±0.07 1.67±0.11 2.06±0.19 2.07±0.09 1.63±0.11
表7 回归模型方差分析
Table 7 Variance analysis of regression model
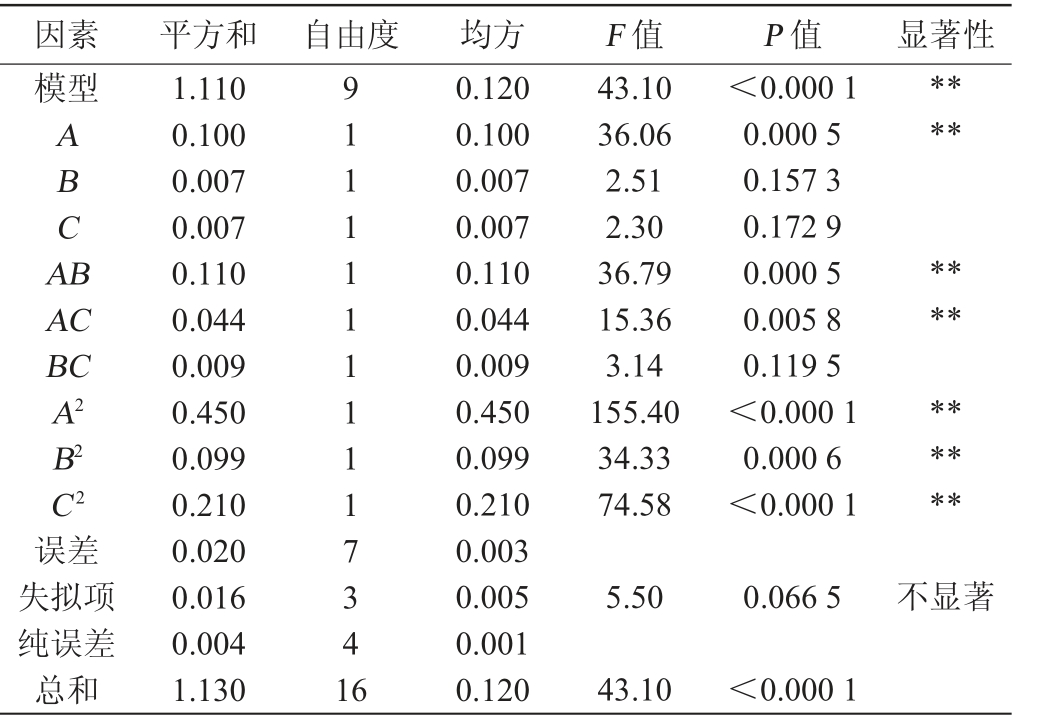
注:“**”表示差异极显著(P<0.01);“*”表示差异显著(P<0.05)。
因素 平方和 自由度 均方 F 值 P 值 显著性模型ABCA B****AC BC A2 B2 C2 43.10 36.06 2.51 2.30 36.79 15.36 3.14 155.40 34.33 74.58<0.000 1 0.000 5 0.157 3 0.172 9 0.000 5 0.005 8 0.119 5<0.000 1 0.000 6<0.000 1**********误差失拟项纯误差总和1.110 0.100 0.007 0.007 0.110 0.044 0.009 0.450 0.099 0.210 0.020 0.016 0.004 1.130 91111111117341 6 0.120 0.100 0.007 0.007 0.110 0.044 0.009 0.450 0.099 0.210 0.003 0.005 0.001 0.120 5.50 0.066 5不显著43.10<0.000 1
通过Design Expert软件对表6的数据进行回归分析和拟合,得到回归方程:Y=2.08-0.11A+0.030B+0.029C-0.16AB-0.11AC+0.048BC-0.33A2-0.15B2-0.23C2。该试验设计的试验模型的P值为0.000 1<0.01,这表明各因素的高水平和低水平对响应值OD620 nm值具有极显著的影响。失拟项的P值为0.07,影响不显著(P>0.05),表明该模型拟合较好,并能进行有效的分析和预测。从F值来看,影响OD620nm值的因素从大到小依次为葡萄糖、酵母浸粉-胰蛋白胨和七水合硫酸镁。模型的相关系数R2为0.98,具有良好的相关性,校正系数R2Adj为0.96,变异系数为3.07%<10%,这表明可信度和精确度较好,信噪比为18.03>4是符合要求的。通过对回归方程最大值进行求解,并根据实际条件进行修约,得到各因素最佳添加量为葡萄糖24 g/L、酵母浸粉-胰蛋白胨(1∶1)31 g/L和七水合硫酸镁0.29 g/L。
各因素交互作用对凝结魏茨曼氏菌D1生长影响的响应面及等高线见图5。通过对比响应曲面与等高线图,可以分析各种因素交互对响应值OD620nm值产生的影响程度,曲面越陡或等高线越密集,影响越显著;等高线越趋近于椭圆而非圆形时,则两个因素相互影响,交互作用越强[17,23]。由图5可知,因素AB、AC交互作用所得的响应面均呈现明显的凸面,其等高线为椭圆形,这说明交互作用对响应值OD620nm值有着极显著的影响(P<0.01),这与响应面的方差分析结果相吻合。
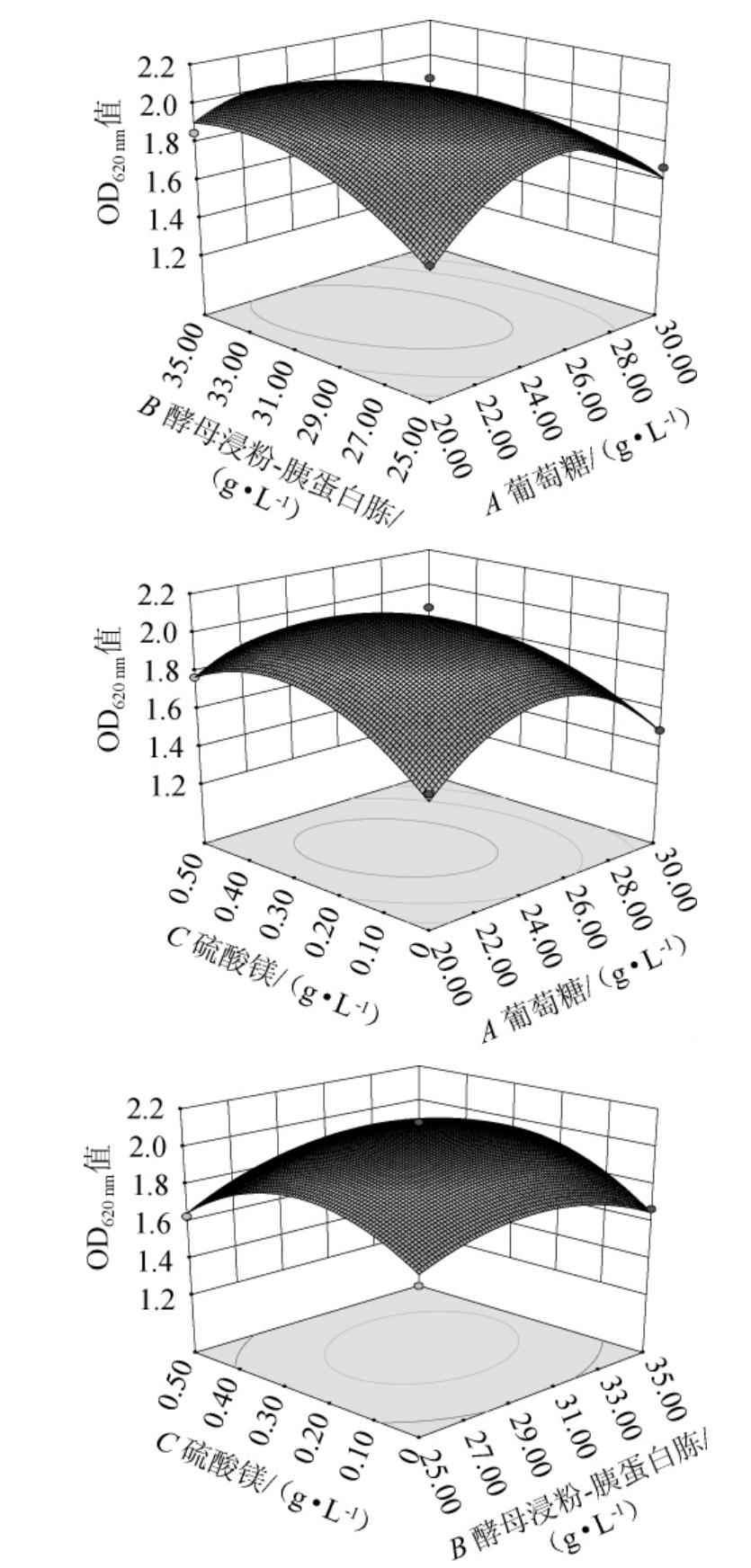
图5 各因素交互作用对凝结魏茨曼氏菌D1生长影响的响应面及等高线
Fig.5 Response surface plots and contour lines of effects of interaction between each factors on the growth of Weizmannia coagulans D1
2.4 验证优化效果
为了验证优化后的结果,根据上述培养条件和培养基单因素试验和Box-Behnken中心组合设计试验条件下进行菌株培养,与优化前的菌株生长曲线进行比较,结果见图6。由图6可知,培养24 h时,优化培养条件后的菌株OD620 nm值为2.15,与预测值接近,与优化前相比增加了67.97%,优化效果显著,并且生长延滞期更短,显示出更快的生长速度,培养16 h即达到终点。
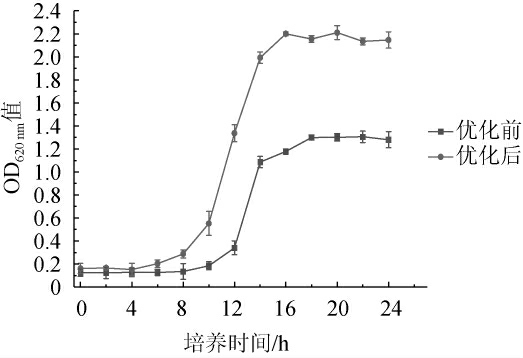
图6 培养条件优化前后菌株的生长曲线
Fig.6 Growth curves of strain before and after culture conditions optimization
2.5 10 L发酵罐放大培养
发酵罐配备pH和温度探头,通过发酵罐的循环夹套和添加中和剂,可以控制发酵过程在指定的温度和pH值。虽然提升转速有助于增加发酵液中的溶氧含量,但这也会导致剪切力对菌体产生机械性的损害[14]。通过空压机和冷干机,对发酵罐进行补气是另一种增加溶氧的方式,此时罐内需要维持适当的压力和通气量[24-25]。在前文优化的培养条件下设置不同的转速和通气参数对菌株进行培养,结果见表8。由表8可知,当温度为50 ℃、pH值为8.0、转速为200 r/min并进行通气的条件下,OD620 nm值最高,达到7.90,这比优化前的生物量提高了6~7倍。
表8 不同参数10 L发酵罐放大培养结果
Table 8 Amplification culture results of 10 L fermenter with different parameters

序号 温度/℃ pH值 转速/(r·min-1) 是否通气 OD620 nm值123456 50 50 50 50 50 50 8.0 8.0 8.0 8.0 8.0 8.0 50 200 350 50 200 350否否否是是是3.04±0.48c 2.71±0.30c 2.84±0.39c 4.76±0.64b 7.90±0.71a 7.83±0.32a
3 结论
本研究以凝结魏茨曼氏菌D1为试验对象,以MRS培养基为基础,通过培养条件单因素试验,培养基单因素试验和培养基响应面试验,最终确定了最佳培养条件为培养温度50 ℃、初始pH值8.0、培养时间16 h,葡萄糖24 g/L、酵母浸粉-胰蛋白胨(1∶1)31 g/L、七水合硫酸镁0.29 g/L,此条件下OD620 nm值为2.15,比优化前提高了67.97%,并且生长延滞期更短,在转速200 r/min和通气条件下进行10 L发酵罐的放大培养,OD620 nm值达到7.90,比优化前提高了6~7倍。该研究可为工业化培养凝结魏茨曼氏菌提供依据,为后续高质量菌粉生产奠定基础。
[1]丁泓皓.凝结芽孢杆菌的筛选及高密度发酵研究[D].武汉:湖北工业大学,2021.
[2]曹江.凝结魏茨曼氏菌对宿主肠道功能的调节作用及其差异性解析[D].无锡:江南大学,2022.
[3]孙彦婷,康宇,詹妍,等.鸡源凝结芽孢杆菌的分离鉴定及耐受性分析[J].中国畜牧兽医,2022,49(11):4187-4196.
[4]孔素芬,朱明明,朱建国,等.凝结魏茨曼氏菌BC66的筛选、鉴定及特性研究[J].食品工业科技,2023,44(15):134-142.
[5]CAO J,YU Z,LIU W,et al.Probiotic characteristics of Bacillus coagulans and associated implications for human health and diseases[J]. J Funct Foods,2020,64:103643.
[6]ZHOU Y,ZENG Z,XU Y,et al.Application of Bacillus coagulans in animal husbandry and its underlying mechanisms[J].Animals,2020,10(3):454.
[7]李雪,刘述凤,鄢雨朦,等.复合芽孢杆菌对鲫鱼养殖水体水质及细菌群落结构的影响[J].生态与农村环境学报,2020,36(4):522-530.
[8]陈百莹,郑苗,邓泽元,等.植物乳杆菌ZJ316培养基优化和高密度培养的研究[J].中国食品学报,2020,20(7):65-74.
[9]范洪臣,柴利平,郑惠丹,等.一株清酒乳杆菌的分离、鉴定及培养基优化[J].食品研究与开发,2023,44(6):204-210.
[10]南树港,李理.腐乳源乳酸乳球菌17M1高密度培养条件研究[J].中国酿造,2022,41(12):40-45.
[11]孙标,陈维菁,赵迎庆,等.凝结芽孢杆菌的产孢条件及高密度培养工艺[J].湖南农业大学学报(自然科学版),2021,47(2):171-179.
[12]杨静.苏云金芽孢杆菌的选育,及其多糖发酵和性能研究[D].无锡:江南大学,2021.
[13]ZHANG C,WANG J,XIE J.Effect on the quality of Larimichthys crocea pretreated with dual-frequency orthogonal ultrasonic-assisted immersion with different powers during refrigerated storage at 4 ℃[J].Foods,2023,12(17):3259.
[14]郭建军,熊大维,曾静,等.5 L发酵罐中粪肠球菌发酵工艺参数优化[J].中国饲料,2020(3):21-26.
[15]左梦楠,刘伟,张菊华,等.发酵乳杆菌BLHN3的高密度培养优化[J].食品与机械,2022,38(12):181-189.
[16]陈欢.秀珍菇液体菌种发酵工艺优化及应用研究[D].长沙:湖南农业大学,2019.
[17]YANG Y,LAN G,TIAN X,et al.Effect of fermentation parameters on natto and its thrombolytic property[J].Foods,2021,10(11):2547.
[18]赵燕霞.嗜酸乳杆菌IMAU30067高密度培养工艺研究[D].呼和浩特:内蒙古农业大学,2018.
[19]GOMES R J, de SOUSA F P, TISCHER C A, et al. Komagataeibacter intermedius V-05:an acetic acid bacterium isolated from vinegar industry,with high capacity for bacterial cellulose production in soybean molasses medium[J].Food Technol Biotech,2021,59(4):432-442.
[20]SHENDEROV B A, MIDTVEDT T.Epigenomic programing: a future way to health?[J].Food Technol Biotech,2014,25:24145.
[21]AL-KHAYRI J M, NAIK P M.Elicitor-induced production of biomass and pharmaceutical phenolic compounds in cell suspension culture of date palm(Phoenix dactylifera L.)[J].Molecules,2020,25(20):4669.
[22]MULCAHY H,CHARRON-MAZENOD L,LEWENZA S.Extracellular DNA chelates cations and induces antibiotic resistance in Pseudomonas aeruginosa biofilms[J].Plos Pathog,2008,4(11):e1000213.
[23]朱其顺,李其琴,汪乐飞,等.草莓味黄大茶发酵饮料的开发及工艺优化[J].食品与生物技术学报,2023,42(6):67-77.
[24]梁芳.氨基葡萄糖的发酵中试放大和提取工艺研究[D].无锡:江南大学,2013.
[25]DELAMARE-DEBOUTTEVILLE J,BATSTONE D J,KAWASAKI M,et al.Mixed culture purple phototrophic bacteria is an effective fishmeal replacement in aquaculture[J].Water Res,2019,4:100031.