中国白酒,作为世界六大蒸馏酒之一[1],承载着中国源远流长的历史与独特文化[2]。而其中的清香型白酒更是独树一帜,它以高粱为原料,使用大曲作为发酵剂[3],在天然微生物的作用下,经过特殊的工艺精心酿制而成[4]。这种白酒口感醇厚绵甜、丰满细腻、协调爽净、回味绵延悠长[5]。在白酒中,决定其风格的风味物质约占白酒总量的2%左右[6-7]。乙酸乙酯是清香型白酒的主要风味物质之一,它呈现出的果香[8],在很大程度上提升了清香型白酒的品质和风格[9]。白酒中的风味物质的种类及含量受发酵过程中的微生物种类及发酵条件的影响,具有一定的波动性[10-11]。产酯酵母,也被称为生香酵母[12],是一类能够代谢产生酯类化合物的酵母菌的总称[13]。库德毕赤酵母(Pichia kudriavzevii)是发酵食品中常见菌属,是一种生香酵母在食品发酵技术领域应用广泛。李群等[14]对45株毕赤酵母进行了初筛和复筛,获得5株产酯能力较强的菌株。并对其特性进行研究发现,费比恩毕赤酵母Y10在固态发酵条件下的产乙酸乙酯能力最高,达到1.21 g/L,相比对照组(桂花曲)提升57.1%。库德毕赤酵母(Pichia kudriavzevii)FJZ是一株具有高产乙酸乙酯能力的产酯酵母,对乙醇具有较强的耐受性,常应用于清香型白酒发酵生产,对于提高酒醅中乙酸乙酯含量具有很大潜力[15]。本研究利用高产乙酸乙酯库德毕赤酵母(Pichia kudriavzevii)FJZ进行强化发酵,以酒醅中乙酸乙酯和总酯含量为检测指标,通过单因素试验探究接种量、大曲添加量、料液比、发酵时间、发酵温度等因素对清香型白酒酒醅中乙酸乙酯形成的影响,并在单因素试验的基础上进行响应面试验,优化发酵工艺条件。该研究旨在为稳定和提高清香型白酒中乙酸乙酯的含量,进而对白酒品质的提升提供技术支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 实验菌株
库德毕赤酵母(Pichia kudriavzevii)FJZ:分离自传统清香型白酒某酒厂新鲜酒醅中,本实验保藏。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)液体培养基:蛋白胨20 g/L、酵母膏10 g/L、葡萄糖20 g/L;YEPD固体培养基:YEPD液体培养基添加20 g/L琼脂。121 ℃高压蒸汽灭菌20 min。
1.1.3 化学试剂
蛋白胨、酵母膏、琼脂(均为生化试剂)、葡萄糖、CaCl2、(NH4)2SO4、MgSO4·7H2O、KH2PO4、(均为分析纯):北京索莱宝科技有限公司;乙腈、乙酸乙酯(均为色谱纯):上海阿拉丁科技公司。其他常规试剂均为国产分析纯。
1.2 仪器与设备
PR-CJT-4超净工作台:上海普瑞斯仪器有限公司;YXQ-LS-50SⅡ立式压力蒸汽灭菌锅:上海博讯实业有限公司医疗设备厂;Agilent 1260高效液相色谱仪、ZORBAX SB-C18色谱柱(4.6 mm×150 mm,5 μm):安捷伦科技(中国)有限公司;85-2A磁力搅拌器:精凿科技(上海)有限公司;pHSJ-4A pH计:美国奥立龙公司;SCAA-104有机相尼龙针式滤器:上海安谱实验科技股份有限公司;GNP-9160电热恒温培养箱:上海精宏试验设备有限公司。
1.3 方法
1.3.1 清香型白酒生产工艺流程及操作要点
高粱原料→粉碎→高温润糁→装甑蒸料→冷却→添加大曲和强化发酵菌株→入缸发酵→出缸蒸馏→清香型白酒
操作要点[16]:
粉碎:每颗高粱破碎成4~8瓣。
高温润糁:加入高粱质量55%~65%的热水,多次翻拌,拌匀后堆积24 h进行高温润糁。
装甑蒸料:先煮沸锅底水,在甑篦上撒1层清蒸后的谷糠,见汽撒料,均匀上平,再加润糁后的原料,蒸料60 min。
冷却:将蒸料后得到的红糁趁热出甑,泼入高粱质量25%左右的冷水,再加入高粱质量10%的谷糠,通风快速冷却。
添加大曲和强化菌株:当红糁降温到15 ℃左右时加曲和强化菌株并搅拌。
入缸发酵:采用地缸发酵,将酒醅放入地缸后,盖上石盖,发酵28~35 d。
出缸蒸馏:在结束发酵的酒醅中拌入高粱质量10%的谷糠并进行搅拌,待酒醅疏松后蒸酒。将酒醅上甑蒸酒,当甑内温度达到85 ℃左右时开始馏酒,接收酒液,即得清香型白酒。
1.3.2 分析检测
总酯含量测定:采用碱皂化回流法[17];乙酸乙酯含量测定:采用高效液相色谱法[18]。
1.3.3 发酵工艺优化
(1)单因素试验
初始发酵工艺条件为接种量5%、大曲添加量10%、料液比1∶0.8(g∶mL)、发酵时间28 d、发酵温度28 ℃。分别考察接种量(0、1%、3%、5%、7%、9%);大曲添加量(0、2%、6%、10%、14%、18%);高粱与水料液比(1∶0.6、1∶0.8、1∶1.0、1∶1.2、1∶1.4(g∶mL));发酵时间(0、7 d、14 d、21 d、28 d);发酵温度(22 ℃、25 ℃、28 ℃、31 ℃、34 ℃),每组做3个平行,分别考察接种量、大曲添加量、高粱与水料液比、发酵时间、发酵温度对酒醅中总酯和乙酸乙酯含量的影响。
(2)响应面试验
通过单因素试验,选取接种量(A)、大曲添加量(B)、料液比(C)、发酵温度(D)为自变量,为进一步优化工艺,以总酯含量(Y1)和乙酸乙酯含量(Y2)为响应值,采用Design Expert 8.0.6软件进行Box-Behnken响应面试验设计,Box-Behnken试验因素与水平见表1。
表1 发酵工艺优化Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experiments design for fermentation process optimization

因素A 接种量/%B 大曲添加量/%C 料液比(g∶mL)D 发酵温度/℃-1水平0 1 28 3 4 1∶0.9 26 10 1∶1.0 28 12 1∶1.1 30
1.3.4 数据处理
利用Origin 2021软件、IBM SPSS Statistics 25.0和Design Expert 8.0.6进行数据分析。
2 结果与分析
2.1 发酵工艺优化单因素试验
2.1.1 接种量对菌株FJZ强化发酵的影响
接种量对菌株的发酵周期及微生物的代谢均有着较大的影响。适当的接种量可以促进菌株的生长和代谢,提高产酯能力。接种量过低将导致菌株生长缓慢、代谢下降以及产酯能力不足[19];而接种量过高,则会造成菌株的过量生长、消耗过多的底物,导致产酯所需的营养物质严重不足,从而降低酯类的转化率和浓度[20]。不同接种量对菌株FJZ强化发酵的影响结果见图1。
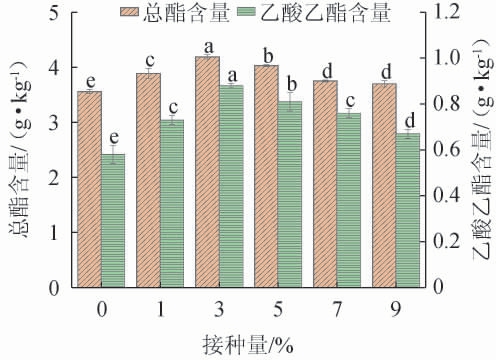
图1 接种量对菌株FJZ强化发酵的影响
Fig.1 Effect of inoculum on enhanced fermentation of strain FJZ
不同字母表示差异显著(P<0.05)。下同。
由图1可知,酒醅中总酯和乙酸乙酯含量随着接种量的增加呈现先上升后下降的变化。未接种的总酯含量和乙酸乙酯含量分别为(3.56±0.04)g/kg和(0.58±0.02)g/kg,均低于接种条件下酒醅的总酯含量和乙酸乙酯含量,这是因为菌株FJZ具有较强的产乙酸乙酯能力。当接种量为1%~3%时,总酯和乙酸乙酯含量随之增高;当接种量为3%时,总酯和乙酸乙酯含量均达到最高,分别为(4.19±0.04)g/kg和(0.88±0.01)g/kg;当接种量>3%之后,总酯和乙酸乙酯含量有所下降。因此,菌株FJZ的最适接种量为3%。
2.1.2 大曲添加量对菌株FJZ强化发酵的影响
大曲具有大量的微生物和酶类物质[21],所以大曲添加量对菌株的发酵动力和产酯能力有着很大的影响[22]。适量的添加大曲可以促进菌株FJZ的生长和代谢,提高产酯能力。大曲添加量不足会导致发酵不完全,酯类物质含量降低;而添加过多的大曲则会导致发酵过快,资源利用不足,同样酯类物质含量也会降低[23]。不同大曲添加量对菌株FJZ强化发酵的影响结果见图2。
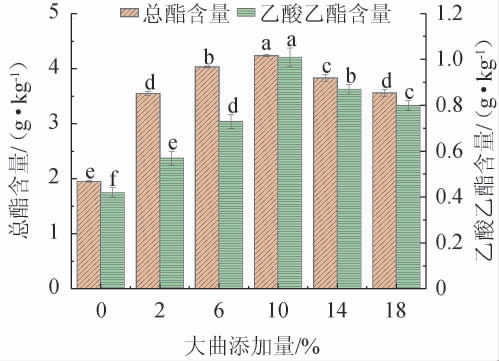
图2 大曲添加量对菌株FJZ强化发酵的影响
Fig.2 Effect of Daqu addition on enhanced fermentation of strain FJZ
由图2可知,随着大曲添加量的增加,酒醅中的总酯和乙酸乙酯含量呈现先上升后下降的变化。未添加大曲的总酯含量和乙酸乙酯含量分别为(1.95±0.02)g/kg和(0.42±0.02)g/kg,均低于添加条件下酒醅的总酯含量和乙酸乙酯含量,这可能是因为未添加大曲时,合成酯类的前体物质生成不足,导致酯类含量较低。当大曲添加量为2%~10%时,总酯和乙酸乙酯含量随之增高;当大曲添加量为10%时,总酯和乙酸乙酯含量达到最高,分别为(4.24±0.02)g/kg和(1.01±0.04)g/kg;当大曲添加量>10%之后,总酯和乙酸乙酯含量有所下降。因此,大曲的最适添加量为10%。
2.1.3 料液比对菌株FJZ强化发酵的影响
料液比会影响酒醅的发酵程度以及白酒中风味物质的含量[24]。合理的料液比可以保证发酵基质具有适当的疏松性和空间,有利于菌株的生长和代谢,从而提高产酯能力。料液比过低会导致酒醅干燥,不利于微生物的生长和产酶,从而影响酯类的生成;料液比过高会使物料结合紧密,难以散热,导致菌株被烧死,产酯能力下降。不同料液比对菌株FJZ强化发酵的影响结果见图3。
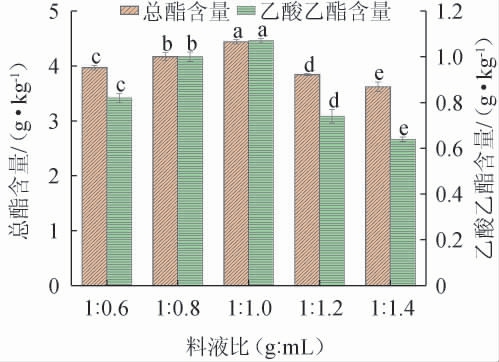
图3 料液比对菌株FJZ强化发酵的影响
Fig.3 Effect of material and liquid ratio on enhanced fermentation of strain FJZ
由图3可知,酒醅中总酯和乙酸乙酯含量随着料液比的变化呈现先上升后下降的趋势。当料液比为1∶0.6~1∶1.0(g∶mL)时,总酯和乙酸乙酯含量随之增高;当料液比为1∶1.0(g∶mL)时,总酯和乙酸乙酯含量达到最高,分别为(4.44±0.04)g/kg和(1.07±0.01)g/kg;当料液比为1∶1.0~1∶1.4(g∶mL)时,总酯和乙酸乙酯含量有所下降。因此,最适料液比为1∶1.0(g∶mL)。
2.1.4 发酵时间对菌株FJZ强化发酵的影响
合理的发酵时间有利于酯类物质的生成,可以提高酯类物质的含量[25]。如果发酵时间过短,营养物质转换率低,不利于菌株FJZ的生长和繁殖,将导致酯类物质产量下降;而发酵时间过长,则会导致营养物质消耗过度,酒醅中会积累大量的次级代谢产物,这将会抑制微生物的生长,微生物便开始衰退,产生有害副产物且合成乙酸乙酯的逆反应加速,导致酯类物质含量下降[26]。不同发酵时间对菌株FJZ强化发酵的影响结果见图4。
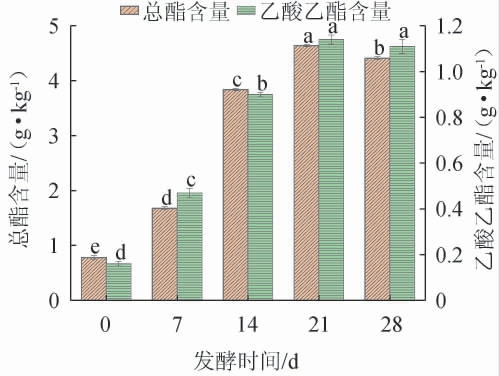
图4 发酵时间对菌株FJZ强化发酵的影响
Fig.4 Effect of fermentation time on enhanced fermentation of strain FJZ
由图4可知,随着发酵时间的增加,酒醅中总酯和乙酸乙酯含量呈现先上升后下降的趋势。当发酵时间为0~21 d时,总酯和乙酸乙酯含量随之增高;当发酵时间为21 d时,总酯和乙酸乙酯含量都达到最高,分别为(4.64±0.04)g/kg和(1.14±0.02)g/kg;当发酵时间>21 d之后,总酯和乙酸乙酯含量有所下降。因此,最适发酵时间为21 d。
2.1.5 发酵温度对菌株FJZ强化发酵的影响
适宜的发酵温度有利于微生物的生长代谢[27],从而提高产酯能力。温度过低会减缓微生物的生长和产酶,使产酯能力下降;而温度过高则会抑制微生物生长和产酶,不利于发酵,导致产酯不足[28-29]。不同发酵温度对菌株FJZ强化发酵的影响结果见图5。
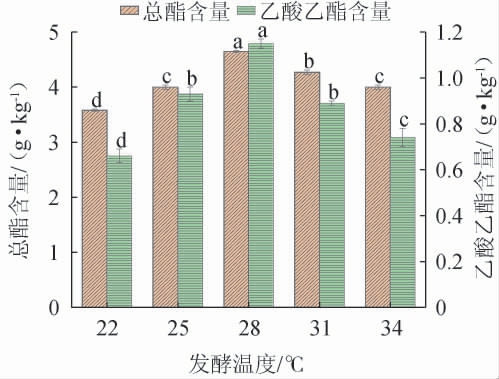
图5 发酵温度对菌株FJZ强化发酵的影响
Fig.5 Effect of fermentation temperature on enhanced fermentation of strain FJZ
由图5可知,随着发酵温度的升高,酒醅中总酯和乙酸乙酯含量呈现先上升后下降的趋势。当发酵温度为22~28 ℃时,总酯和乙酸乙酯含量随之增加;当发酵温度为28 ℃时,总酯和乙酸乙酯含量都达到最大值,分别为(4.65±0.02)g/kg和(1.15±0.02)g/kg;当发酵温度>28 ℃之后,总酯和乙酸乙酯含量随之下降。因此,最适发酵温度为28 ℃。
2.2 发酵工艺优化响应面试验
根据单因素试验结果,筛选出4个影响酒醅中总酯和乙酸乙酯含量的显著因子,固定发酵时间为21 d,以总酯含量(Y1)及乙酸乙酯含量(Y2)为响应值,通过响应面试验进一步确定发酵工艺条件,Box-Behnken试验设计及结果见表2,方差分析结果见表3。
表2 发酵工艺优化Box-Behnken试验设计与结果
Table 2 Design and results of Box-Behnken experiments for fermentation process optimization
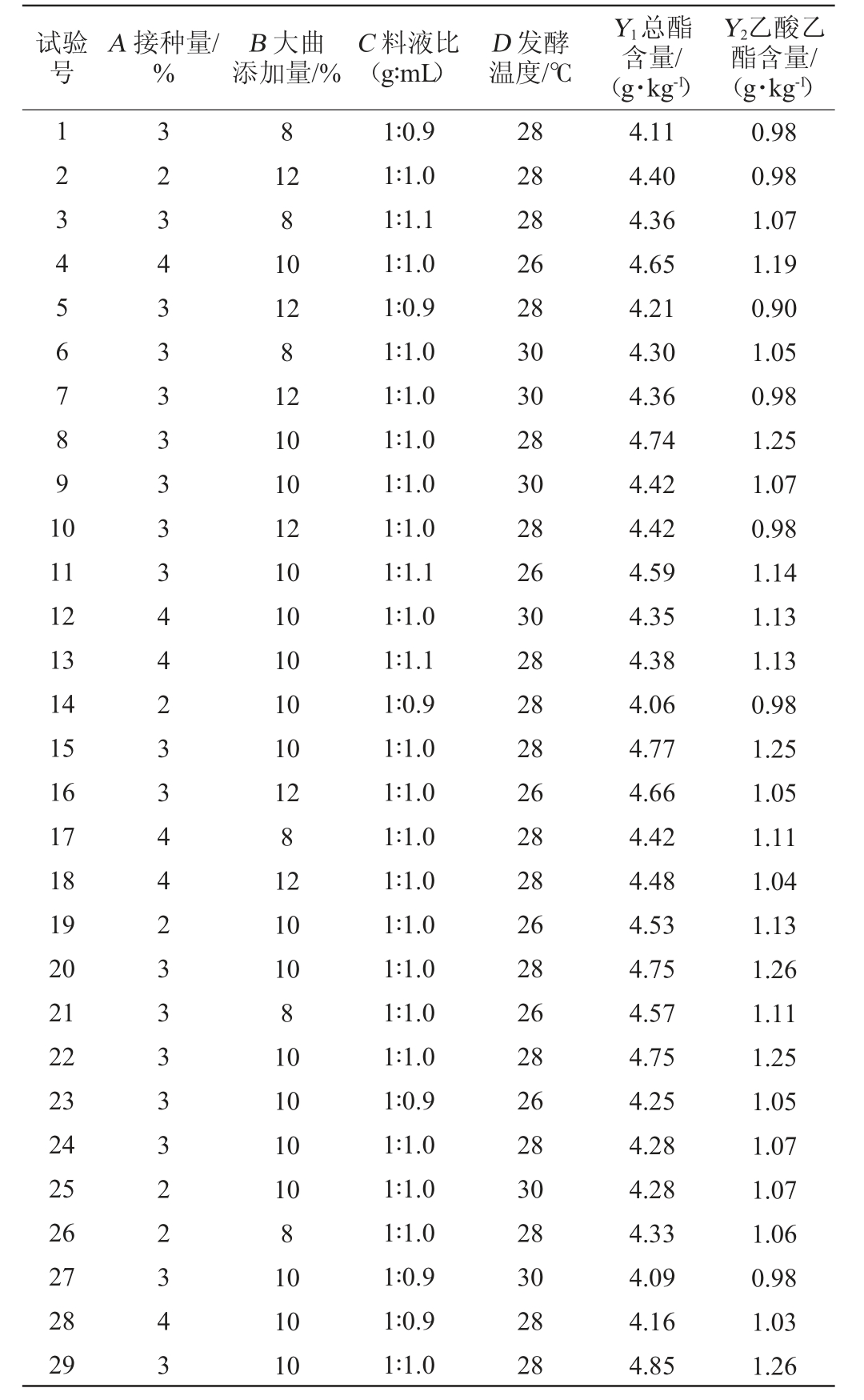
试验号A 接种量/%B 大曲添加量/%C 料液比(g∶mL)D 发酵温度/℃Y1总酯含量/(g·kg-1)Y2乙酸乙酯含量/(g·kg-1)1234567891 0 8 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 32343333333442334423333322343 12 8 10 12 8 12 10 10 12 10 10 10 10 10 12 8 12 10 10 8 10 10 10 10 8 10 10 10 1∶0.9 1∶1.0 1∶1.1 1∶1.0 1∶0.9 1∶1.0 1∶1.0 1∶1.0 1∶1.0 1∶1.0 1∶1.1 1∶1.0 1∶1.1 1∶0.9 1∶1.0 1∶1.0 1∶1.0 1∶1.0 1∶1.0 1∶1.0 1∶1.0 1∶1.0 1∶0.9 1∶1.0 1∶1.0 1∶1.0 1∶0.9 1∶0.9 1∶1.0 28 28 28 26 28 30 30 28 30 28 26 30 28 28 28 26 28 28 26 28 26 28 26 28 30 28 30 28 28 4.11 4.40 4.36 4.65 4.21 4.30 4.36 4.74 4.42 4.42 4.59 4.35 4.38 4.06 4.77 4.66 4.42 4.48 4.53 4.75 4.57 4.75 4.25 4.28 4.28 4.33 4.09 4.16 4.85 0.98 0.98 1.07 1.19 0.90 1.05 0.98 1.25 1.07 0.98 1.14 1.13 1.13 0.98 1.25 1.05 1.11 1.04 1.13 1.26 1.11 1.25 1.05 1.07 1.07 1.06 0.98 1.03 1.26
表3 回归模型方差分析
Table 3 Variance analysis of regression model
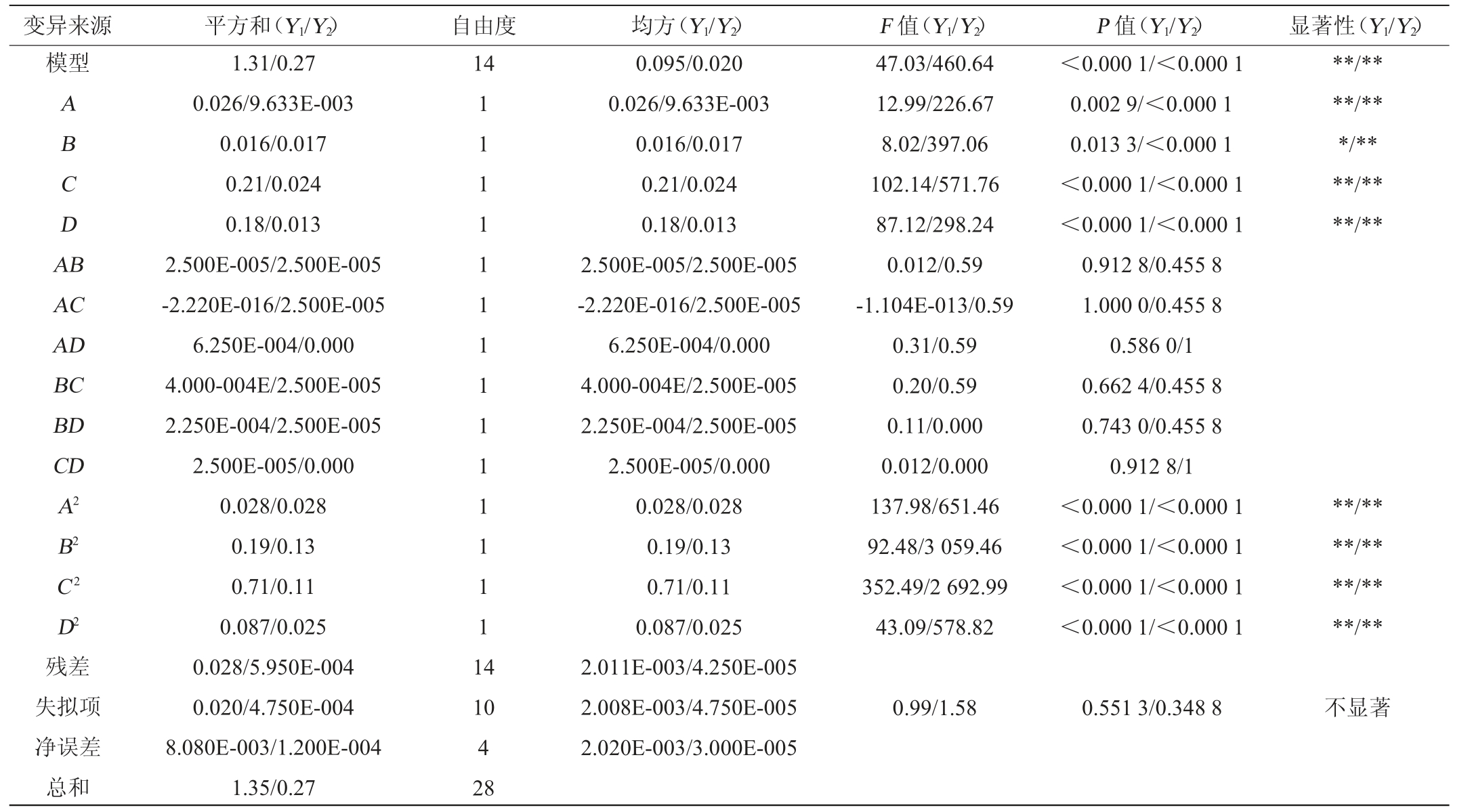
注:“**”表示对结果影响极显著(P<0.01),“*”表示对结果影响显著(P<0.05)。
变异来源 平方和(Y1/Y2) 自由度 均方(Y1/Y2) F 值(Y1/Y2) P 值(Y1/Y2) 显著性(Y1/Y2)模型14 ABCDA B**/****/***/****/****/**AC AD BC BD CD A2 B2 C2 D2残差失拟项净误差总和1.31/0.27 0.026/9.633E-003 0.016/0.017 0.21/0.024 0.18/0.013 2.500E-005/2.500E-005-2.220E-016/2.500E-005 6.250E-004/0.000 4.000-004E/2.500E-005 2.250E-004/2.500E-005 2.500E-005/0.000 0.028/0.028 0.19/0.13 0.71/0.11 0.087/0.025 0.028/5.950E-004 0.020/4.750E-004 8.080E-003/1.200E-004 1.35/0.27 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 4 47.03/460.64 12.99/226.67 8.02/397.06 102.14/571.76 87.12/298.24 0.012/0.59-1.104E-013/0.59 0.31/0.59 0.20/0.59 0.11/0.000 0.012/0.000 137.98/651.46 92.48/3 059.46 352.49/2 692.99 43.09/578.82<0.000 1/<0.000 1 0.002 9/<0.000 1 0.013 3/<0.000 1<0.000 1/<0.000 1<0.000 1/<0.000 1 0.912 8/0.455 8 1.000 0/0.455 8 0.586 0/1 0.662 4/0.455 8 0.743 0/0.455 8 0.912 8/1<0.000 1/<0.000 1<0.000 1/<0.000 1<0.000 1/<0.000 1<0.000 1/<0.000 1**/****/****/****/**10 4 28 0.095/0.020 0.026/9.633E-003 0.016/0.017 0.21/0.024 0.18/0.013 2.500E-005/2.500E-005-2.220E-016/2.500E-005 6.250E-004/0.000 4.000-004E/2.500E-005 2.250E-004/2.500E-005 2.500E-005/0.000 0.028/0.028 0.19/0.13 0.71/0.11 0.087/0.025 2.011E-003/4.250E-005 2.008E-003/4.750E-005 2.020E-003/3.000E-005 0.99/1.58 0.551 3/0.348 8不显著
对Design Expert 8.0.6软件设计的响应面试验结果进行多元化回归拟合分析,得出该菌株固态发酵总酯含量(Y1)和乙酸乙酯含量(Y2)与接种量(A)、大曲添加量(B)、料液比(C)、发酵温度(D)的多元二次回归方程为:
Y1=4.77+0.047A+0.037B+0.13C-0.12D-2.500E-003AB+0.000AC-0.013AD-0.010BC-7.500E-003BD-2.500E-003CD-0.21A2-0.17B2-0.33C2-0.12D2
Y2=1.25+0.028A-0.037B+0.045C-0.032D+2.500E-003AB+2.500E-003AC-2.500E-003BC+2.500E-003BD-0.065A2-0.14B2-0.13C2-0.062D2
根据表3的方差分析结果,回归模型的P值均<0.0001,显示该回归模型的差异极显著。失拟项P=0.551 3/0.348 8>0.05,差异均不显著,说明试验误差较小,模型预测结果可靠。回归方程决定系数R2=0.979 2/0.997 8,说明四个因素与总酯和乙酸乙酯含量之间存在显著的多元回归关系。试验设计的可靠性高,因此可以使用该回归方程来预测上述因素对菌株FJZ产酯工艺的优化。由P值可知,接种量、料液比和发酵温度对酒醅中总酯含量和乙酸乙酯含量都有极显著的影响(P<0.01);大曲添加量对酒醅中总酯含量影响显著(P<0.05),对乙酸乙酯含量影响极显著(P<0.01)。由F值可知,各因素对总酯含量的影响顺序为C>D>A>B,对乙酸乙酯含量的影响顺序为C>B>D>A。
2.3 各因素交互作用响应面分析
接种量和料液比(AC)、接种量和大曲添加量(AB)、大曲添加量和料液比(BC)对总酯含量影响最大。料液比和发酵温度(CD)交互作用影响其次,接种量和发酵温度(AD)、大曲添加量和发酵温度(BD)的交互作用对总酯含量的影响最弱。但各因素交互作用对总酯含量影响均不显著,这与方差分析结果一致。
接种量和料液比(AC)、接种量和大曲添加量(AB)、大曲添加量和料液比(BC)、料液比和发酵温度(CD)对乙酸乙酯含量影响最大,大曲添加量和发酵温度(BD)交互作用影响其次,接种量和发酵温度(AD)的交互作用对乙酸乙酯含量的影响最弱。但各因素交互作用对乙酸乙酯含量影响均不显著,这与方差分析结果一致。
2.4 发酵工艺条件验证试验
通过Design Expert 8.0.6软件对数据进行分析后得到菌株FJZ最佳发酵工艺条件为:接种量为3.79%、大曲添加量为9.93%、料液比为1∶1.02(g∶mL)、发酵时间为21 d,发酵温度为27.22 ℃。在此条件下,总酯含量预测值为4.728 g/kg、乙酸乙酯含量预测值为1.248 g/kg。为了便于实际操作,调整发酵工艺条件为:接种量4%、大曲添加量10%、料液比1∶1.0(g∶mL)、发酵时间21 d,发酵温度27 ℃。在此优化条件下进行3次平行验证试验,发酵酒醅中总酯含量实际值为(4.75±0.06)g/kg,乙酸乙酯含量实际值为(1.25±0.02)g/kg。实际数值与模型预测值基本一致,说明该模型预测准确性较高。总酯含量和乙酸乙酯含量分别比未强化发酵分别提高了55.74%和76.06%。
3 结论
本研究采用单因素试验及响应面试验,优化库德毕赤酵母FJZ强化发酵生产清香型白酒的工艺条件确定库德毕赤酵母FJZ强化发酵生产清香型白酒最佳发酵条件为:接种量4%、大曲添加量10%、料液比为1∶1.0(g∶mL)、发酵时间21 d、发酵温度27 ℃。在此优化条件下,清香型白酒酒醅中的总酯含量为(4.75±0.06)g/kg,乙酸乙酯含量为(1.25±0.02)g/kg,分别比未强化发酵提高了55.74%和76.06%。此试验结果可应用于白酒生产行业,通过提高清香型白酒中的乙酸乙酯含量,能够改善白酒的口感和风味,满足消费者对高品质白酒的需求,有助于提高相关企业的产品品质和市场竞争力。
[1]张健,范奇高,陆伦维,等.浅析酱香型白酒发展现状及趋势思考[J].中国酿造,2022,41(4):234-238.
[2]WEI W L, SHEN Y, CHENG W, et al.Analysis of microbial diversity and volatile metabolites across different types of pit mud in sauce-flavored Baijiu based on nanopore sequencing and metabolomics[J].LWT-Food Sci Technol,2023,188:115465.
[3]LUO L J,SONG L,HAN Y,et al.Microbial communities and their correlation with flavor compound formation during the mechanized production of light-flavor Baijiu[J].Food Res Int,2023,172:113139.
[4]李艳婷,郭尚,郭霄飞,等.清香型白酒发酵过程中微生物群落结构变化及与理化性质的相关性[J].中国食品学报,2023,23(5):330-340.
[5]国家市场监督管理总局,国家标准化管理委员会.GB/T 10781.2—2022白酒质量要求第2部分:清香型白酒[S].北京:中国标准出版社,2022.
[6]孙细珍,熊亚青,刘家欢,等.清香型白酒新酒和陈酒感官特征及香气物质的差异性分析[J].食品科学,2023,44(14):266-273.
[7]莫新良,杨亮,吴德光,等.不同甜香风味特征的酱香型白酒中挥发性物质分析[J].食品工业科技,2022,43(18):311-321.
[8]LI H, ZHANG X, GAO X, et al.Comparison of the aroma-active compounds and sensory characteristics of different grades of light-flavor Baijiu[J].Foods,2023,12(6):1238.
[9]李昊,曹雯雯,冯思雨,等.气相色谱法测定清香型白酒中乙酸乙酯的不确定度评定[J].中国酿造,2023,42(8):242-246.
[10]黄治国,曾永仲,扶勇,等.酱香型白酒轮次堆积发酵新工艺的研究[J].酿酒科技,2023(1):61-64.
[11]汪晗,高瑞杰,杨团元,等.白酒酿造中低产高级醇酿酒酵母的筛选及应用研究[J].中国酿造,2023,42(8):78-83.
[12]刘小改,马美荣,周林艳,等.高产乙酸乙酯酵母菌筛选及固态发酵应用研究[J].中国酿造,2020,39(10):79-83.
[13]QU C Y,PENG L Y,FEI Y T,et al.Screening ester-producing yeasts to fortify the brewing of rice-flavor Baijiu for enhanced aromas[J].J Bioeng,2023,14(1):2255423.
[14]李群,林斌,柯锋.高产乙酸乙酯毕赤酵母筛选及其耐受性能研究[J].酿酒科技,2022(12):39-45.
[15]贾丽艳,张丽,李惠源,等.果香风味导向的库德毕赤酵母FJZ的分离鉴定及生物学特性研究[J].中国食品学报,2021,21(1):276-282.
[16]康明官.清香型白酒生产技术[M].北京:化学工业出版社,2005:28-29.
[17]郝林.食品微生物学实验技术[M].北京:中国农业出版社,2016:28-30.
[18]魏志阳,李秋志,邢爽,等.HPLC法同时测定清香类酒醅中主要酸和酯类物质[J].中国酿造,2018,37(8):167-171.
[19]李祥,娄延岳,曾悦潘,等.酿酒酵母和植物乳杆菌对葡萄皮渣固态发酵蛋白饲料的条件优化[J].饲料研究,2022,45(15):78-83.
[20]边名鸿,袁天萌,杨南,等.乳杆菌强化发酵对苦荞酵素抗氧化特性及风味的影响[J].食品工业科技,2024,45(2):118-125.
[21]HAN P J, LUO L J, HAN Y, et al.Microbial community affects Daqu quality and the production of ethanol and flavor compounds in Baijiu fermentation[J].Foods,2023,12(15):2936.
[22]张兵,张宿义,杨艳,等.高粱整粒酿造大曲清香型白酒工艺研究[J].酿酒,2023,50(4):37-41.
[23]曹冉.荞麦酿造酒及后处理过程中黄酮类物质变化规律的研究[D].石家庄:河北科技大学,2019.
[24]WANG H,SUN C H,YANG S Z,et al.Exploring the impact of initial moisture content on microbial community and flavor generation in Xiaoqu Baijiu fermentation[J].Food Chem,2023,20:100981.
[25]TANG J,LIU Y,LIN B,et al.Effects of ultra-long fermentation time on the microbial community and flavor components of light-flavor Xiaoqu Baijiu based on fermentation tanks[J].World J Microbiol Biotechnol,2021,38(1):3.
[26]蔡程山,白飞荣,许玲,等.国井白酒窖池发酵过程中酒醅微生物多样性及理化特性[J].中国酿造,2023,42(11):90-98.
[27]JIE T,BIN L,WEI J,et al.Screening of β-damascenone-producing strains in light-flavor Baijiu and its production optimization via response surface methodologys[J].Front Microbiol,2022,13:1067671.
[28]王丹,春阳,邓乔晟,等.地参发酵酒的工艺优化及品质分析[J].食品工业科技,2023,44(6):235-243.
[29]颜建虹,张祥瑞,卢红梅,等.响应面法优化刺梨白兰地原料酒发酵工艺[J].中国酿造,2023,42(6):186-191.