腐乳是中华民族具有特色的传统发酵食品,亦名豆腐乳、乳腐、乳豆腐、长毛豆腐,腐乳质地与奶酪相似,在许多西方国家被称为“中国奶酪”[1-2]。腐乳可直接食用也可作为食品调味料使用[3-4]。腐乳以优质黄豆为原料,经泡豆、磨浆、滤浆、煮浆、点浆、压榨沥水后切块制作成豆腐,自然发酵,最后加以不同汤料密封腌制成熟[5-7]。腐乳因其易于消化、独特的口感、风味、多样性、细腻的质地和丰富的营养,被认为是一种健康的食物,受到广大消费群众的喜爱[8-10]。
腐乳在我国已有悠久历史,目前对传统块状腐乳研究贯穿生产工艺、发酵菌种、风味成分等。目前,国内关于膏状腐乳的研究比较少。腐乳基本都是市面上常见的块状形态进入广大消费者的视线中。周鸿翔等[11]向原料豆腐中添加不同的酶制备膏状腐乳;刘本勇[4]研究了能快速发酵的低盐直装全子叶膏状腐乳的生产工艺,对其成品进行品质评价,与传统腐乳比较,出品率和原料利用率均有较大提高。传统块状腐乳存在发酵周期长、机械化程度低、安全性差及产品单一等缺点[12-14]。针对这些不足,本研究在传统腐乳的基础上加以改进,在原料中添加大米,达到降低成本、丰富风味、增添腐乳多样性的目的,膏状腐乳摒弃原有的块状豆腐接菌方式,将块状豆腐制成膏状再发酵,并采用混菌发酵剂,不仅极大地缩短了发酵时间,并且不再需要人工搓毛,提高了腐乳生产机械化生产效率。
该研究通过对毛霉(Mucor)、少孢根霉(Rhizopus oligosporus)、酵母及植物乳植杆菌(Lactiplantibacillus plantarum)混菌发酵制备腐乳,分析不同比例混菌发酵对膏状腐乳的影响,基于单菌发酵的基础上,研究四种菌混菌发酵制备腐乳的最佳工艺条件,分析单菌发酵与混菌发酵对膏状腐乳理化指标和游离氨基酸含量的影响,为混菌发酵膏状腐乳的研究提供理论依据与实践参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
毛霉(Mucor)40899:中国工业微生物菌种保藏管理中心;少孢根霉(Rhizopus oligosporus):从云南牟定自制腐乳中分离得到,并保存于本实验室;酵母(yeast):安琪酵母股份有限公司;植物乳植杆菌(Lactiplantibacillus plantarum):美国菌种保藏管理中心(ATCC8014)。
1.1.2 材料
大豆、大米(粳米):云南旭睿尚购商贸有限公司;块状腐乳:云南羊泉生物科技股份有限公司;福林酚:上海源叶生物科技有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS):福州飞净生物科技有限公司;氯化钠、乙酸钠、磺基水杨酸、磷酸氢二钠、磷酸二氢钠(均为分析纯):天津市风船化学试剂科技有限公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、MRS培养基、营养琼脂:广东环凯微生物科技有限公司。
1.2 仪器与设备
L8900氨基酸分析仪:英国Biochrom公司;BCM-1000A超净工作台:苏州安泰技术有限公司;Eppendorf移液枪:南京贝登医疗股份有限公司;9053A烘箱:上海实研电炉有限公司;HHPX-9272ME恒温培养箱:上海博讯实业有限公司;LX-B高压蒸汽灭菌锅:北京市永光明医疗仪器有限公司;TF-B60超低温冰箱:上海赛默飞世尔科技公司;pH-10 pH计:广州市铭睿电子科技有限公司;725N分光光度计:南京晓晓仪器设备有限公司。
1.3 方法
1.3.1 膏状腐乳发酵工艺流程及操作要点
大豆、大米→浸泡→磨浆→滤浆→煮浆→点浆→豆腐白坯→接菌→前酵→加入辅料→后酵→成品
操作要点:
发酵剂的制备:将毛霉、少孢根霉和酵母分别接种于PDA培养基上,28 ℃培养3 d;植物乳植杆菌接种于MRS培养基培养,37 ℃培养3 d,用10 mL灭菌后的生理盐水对培养皿进行冲洗,将冲洗后的菌悬液倒回装有90 mL无菌生理盐水的锥形瓶,充分振荡摇匀并过滤。用血平板计数法对菌悬液进行计数,添加灭菌生理盐水,均调整至1.0×106CFU/mL,发酵剂应现配现用。
豆腐白坯的制作:按大豆和大米的质量比为2∶1,豆水比为1∶7(g∶mL),米水比为1∶2(g∶mL)进行浸泡后磨浆,用120目筛网滤浆除去豆渣,加热煮沸8 min,85 ℃时加入15%的酸浆水点浆,保温30 min,倒入模具中压榨成型,制作出豆腐白坯[15]。
腐乳的前发酵:选取品质良好的豆腐白坯500 g用打浆机制成膏状放入玻璃发酵罐中,加入发酵剂,总接种量1.0×106 CFU/mL,混匀后加盖,在一定条件下进行前发酵,此时发酵物水分含量为80%。
腐乳的后发酵:在经前发酵后的膏状腐乳中各加入腐乳质量3%的50%vol白酒、食盐和香料,搅拌均匀后旋盖密封,放于室温发酵36 d,得腐乳成品。
1.3.2 膏状腐乳前发酵条件优化单因素试验
以毛霉、少孢根霉、酵母和植物乳杆菌单菌发酵产生蛋白酶能力的不同,确定混菌发酵剂的混菌比例,以少孢根霉和毛霉为主要菌种,酵母和植物乳杆菌为辅助菌种。在接菌浓度为1.0×106 CFU/mL的条件下,以混菌发酵膏状腐乳前发酵阶段蛋白酶活力为参考指标,考察少孢根霉∶毛霉∶酵母∶植物乳杆菌的接菌体积比(A:6∶2∶1∶1、B:4∶2∶2∶2、C:4∶4∶1∶1、D:2∶4∶2∶2、E:2∶6∶1∶1)[16]、发酵时间(36 h、48 h、60 h、72 h、84 h)、发酵温度(28 ℃、30 ℃、32 ℃、34 ℃、36 ℃)对混菌发酵膏状腐乳前发酵的影响。
1.3.3 响应面法优化混菌发酵膏状腐乳前发酵条件
结合混菌发酵单因素试验的结果,将蛋白酶活力作为响应值[17],以发酵温度(A)、发酵时间(B)和接菌比例(C)为自变量进行响应面设计,各因素水平编码见表1。
表1 腐乳前发酵条件优化Box-Benhnken试验因素与水平
Table 1 Factors and levels of Box-Benhnken tests for prefermentation conditions optimization of sufu
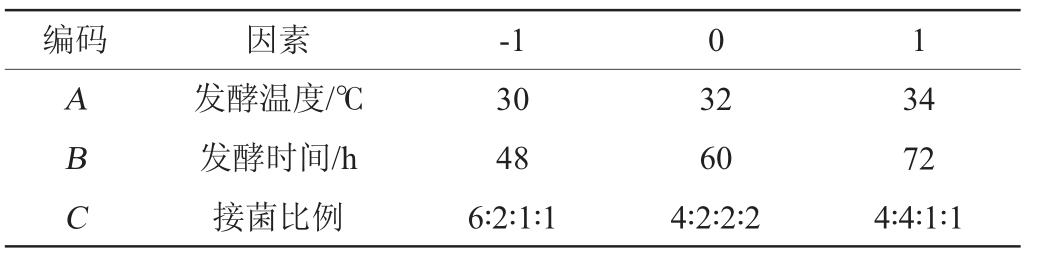
编码 因素-1 0 1 ABC发酵温度/℃发酵时间/h接菌比例30 48 6∶2∶1∶1 32 60 4∶2∶2∶2 34 72 4∶4∶1∶1
1.3.4 腐乳发酵过程中主要理化性质的测定
腐乳中蛋白酶活力测定:参照GB/T 23527—2009《蛋白酶制剂》[18]进行测定,以吸光度值(Y)为纵坐标,酪氨酸的质量浓度(X)为横坐标绘制标准曲线,得到标准曲线回归方程Y=0.009 2X+0.009 4,相关系数R2=0.999 1,依据标准曲线回归方程计算腐乳中蛋白酶活力,结果以μg/g计。
腐乳中还原糖含量测定参照周子文[19]的方法,并稍作修改;氨基酸态氮含量的测定:按照GB 5009.235—2016《食品中氨基酸态氮的测定》[20]中的比色法测定;可溶性蛋白含量:采用凯氏定氮法测定[21]。
膏状腐乳中游离氨基酸测定:采用全自动L-8900氨基酸分析仪进行测定[22-23]。取前发酵终点的腐乳样品100 mg,放入10 mL离心管中,加入4%磺基水杨酸9 mL。16 000 r/min离心5 min,上清液经0.45 μm膜过滤器过滤后测定。
1.3.5 膏状腐乳的感官品评
膏状腐乳的感官评分参照蒋芳芳等[24-25]的评分标准,并稍作修改。邀请本专业具有感官评定经验的10名同学作为品评人员进行感官评定,满分100分,腐乳感官品评标准见表2。
表2 腐乳感官评分标准
Table 2 Sensory evaluation standards of sufu

项目 评分标准 得分/分色泽香气滋味质地腐乳膏体呈淡黄色膏体颜色偏暗颜色发黑或白点明显香气浓郁纯正,具有腐乳特有的香气香气偏淡有不良气味滋味温和,鲜香爽口,具有乳腐特有的滋味滋味寡淡,乳腐滋味微弱有异味软硬适中、细腻平滑太软或太硬,不易挑起口感粗糙,颗粒感明显17~25 8~16 1~7 17~25 8~16 1~7 17~25 8~16 1~7 17~25 8~16 1~7
1.3.6 数据处理与统计分析
试验数据的处理分别采用Design-Expert.V8.0.6、IBM SPSS Statistics 19和Origin Pro 2022等软件进行分析及绘制图形。
2 结果与分析
2.1 混菌发酵膏状腐乳前发酵单因素试验结果
2.1.1 不同混菌比例对混菌发酵膏状腐乳前发酵的影响
不同混菌比例对混菌发酵膏状腐乳前发酵的影响结果见图1。由图1可知,混菌发酵膏状腐乳蛋白酶活力随混菌比例的不同而各有差异,混菌发酵剂混菌比例为B(少孢根霉∶毛霉∶酵母∶植物乳杆菌=4∶2∶2∶2)时,蛋白酶活力最高为96.65 μg/g,显著高于其他比例(P<0.05)。这是由于菌株之间的协同作用达到最强[16]。因此,混菌发酵膏状腐乳的最适接菌比例为少孢根霉∶毛霉∶酵母∶植物乳杆菌=4∶2∶2∶2。
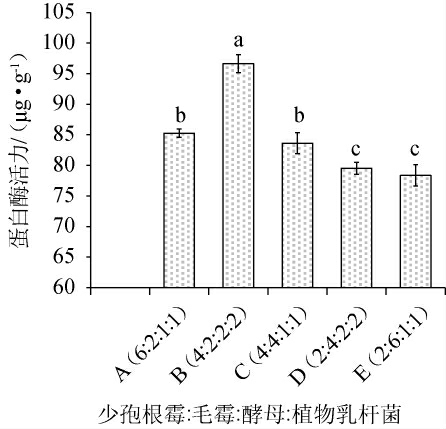
图1 不同混菌比例对混菌发酵膏状腐乳前发酵的影响
Fig.1 Effect of different mixed strains ratio on the pre-fermentation of paste sufu
不同字母表示差异显著(P<0.05),下同。
2.1.2 不同发酵温度对混菌发酵膏状腐乳前发酵的影响
不同发酵温度对混菌发酵膏状腐乳前发酵的影响结果见图2。由图2可知,混菌发酵膏状腐乳的蛋白酶活力随着发酵温度的升高呈现先升高后下降的趋势,在发酵温度为32 ℃时,蛋白酶活力达到最高为98.42 μg/g。温度对发酵菌的影响较大,在适宜的温度条件下,菌丝生长良好,蛋白酶活力较高,但是在超过适宜温度后,微生物生长受到抑制。因此混菌发酵的适宜发酵温度为32 ℃。
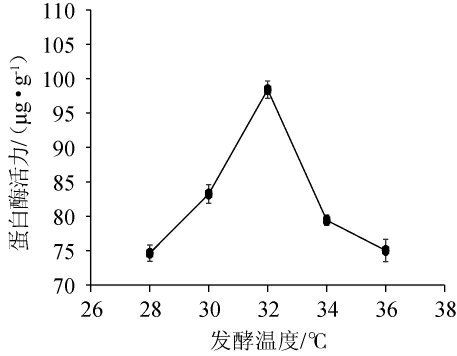
图2 不同发酵温度对混菌发酵膏状腐乳前发酵的影响
Fig.2 Effect of different fermentation temperature on the pre-fermentation of paste sufu
2.1.3 不同发酵时间对混菌发酵膏状腐乳前发酵的影响
不同发酵时间对混菌发酵膏状腐乳前发酵的影响见图3。由图3可知,在不同发酵温度下,混菌发酵膏状腐乳前发酵蛋白酶活力先升后降。在60 h内,霉菌菌丝生长逐渐旺盛,分泌的蛋白酶活力逐渐升高,而发酵60 h后,霉菌菌丝上开始长出孢子,分泌蛋白酶的能力逐渐下降。腐乳感官品质下降,有异味产生,因此最佳发酵时间是60 h。
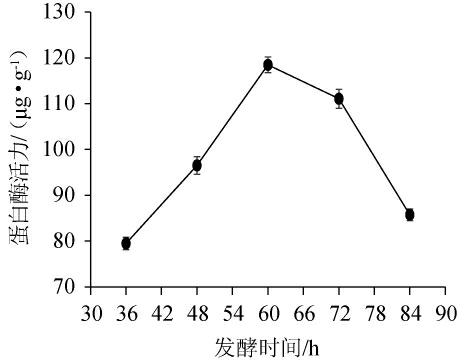
图3 不同发酵时间对混菌发酵膏状腐乳前发酵的影响
Fig.3 Effects of different fermentation time on the pre-fermentation of paste sufu
2.2 混菌发酵膏状腐乳前发酵响应面优化试验结果
在单因素试验的基础上,根据表1的因素水平编码,以发酵温度(A)、发酵时间(B)、接菌比例(C)为自变量,以蛋白酶活力(Y)为响应值,进行3因素3水平响应面设计,试验方案和结果见表3,方差分析结果见表4。
表3 腐乳前发酵条件优化Box-Benhnken试验设计及结果
Table 3 Design and results of Box-Benhnken tests for prefermentation conditions optimization of sufu
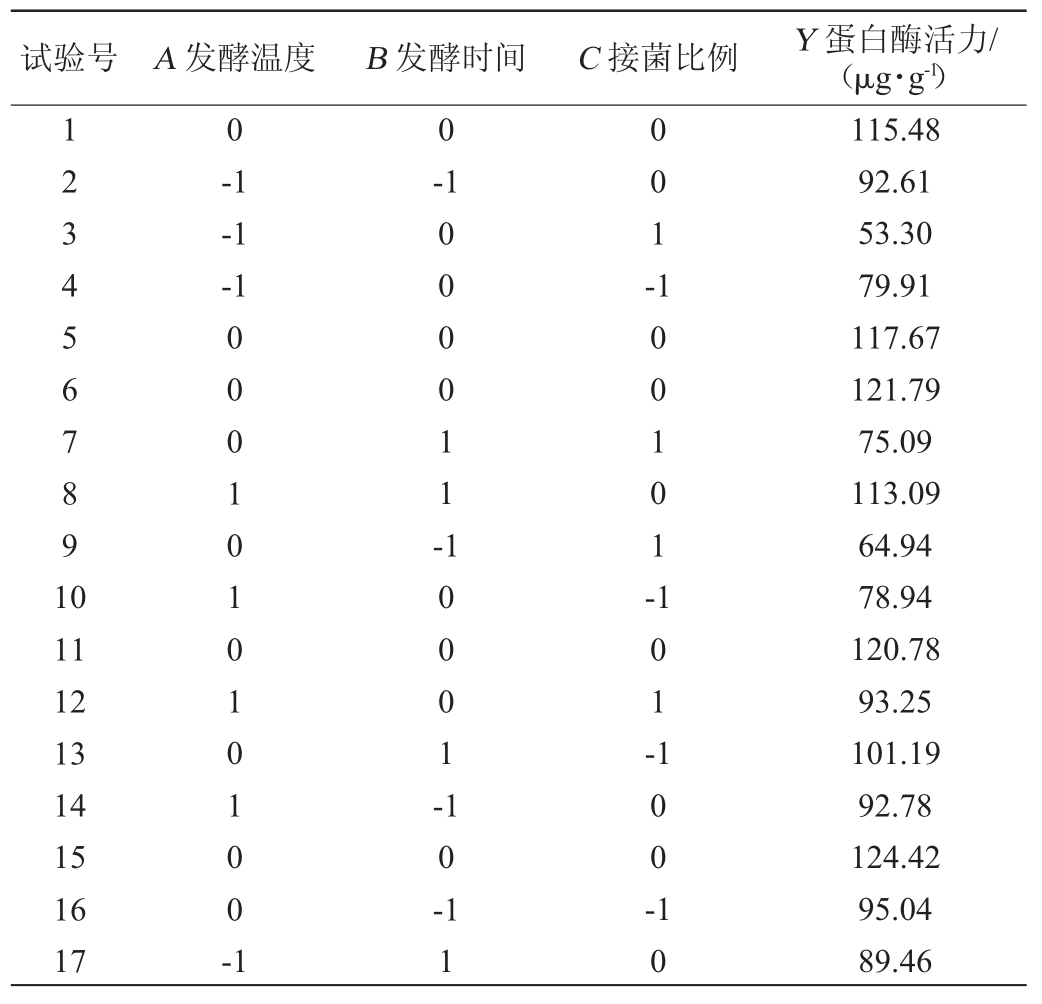
试验号 A 发酵温度 B 发酵时间 C 接菌比例 Y 蛋白酶活力/(μg·g-1)1234567891 0 0 0-1-1-1-1 000011-001-100101-11 12 13 14 15 16 17 000101010100-1 10001-101-10-11 100-10 115.48 92.61 53.30 79.91 117.67 121.79 75.09 113.09 64.94 78.94 120.78 93.25 101.19 92.78 124.42 95.04 89.46
表4 回归模型方差分析结果
Table 4 Results of variance analysis of regression model
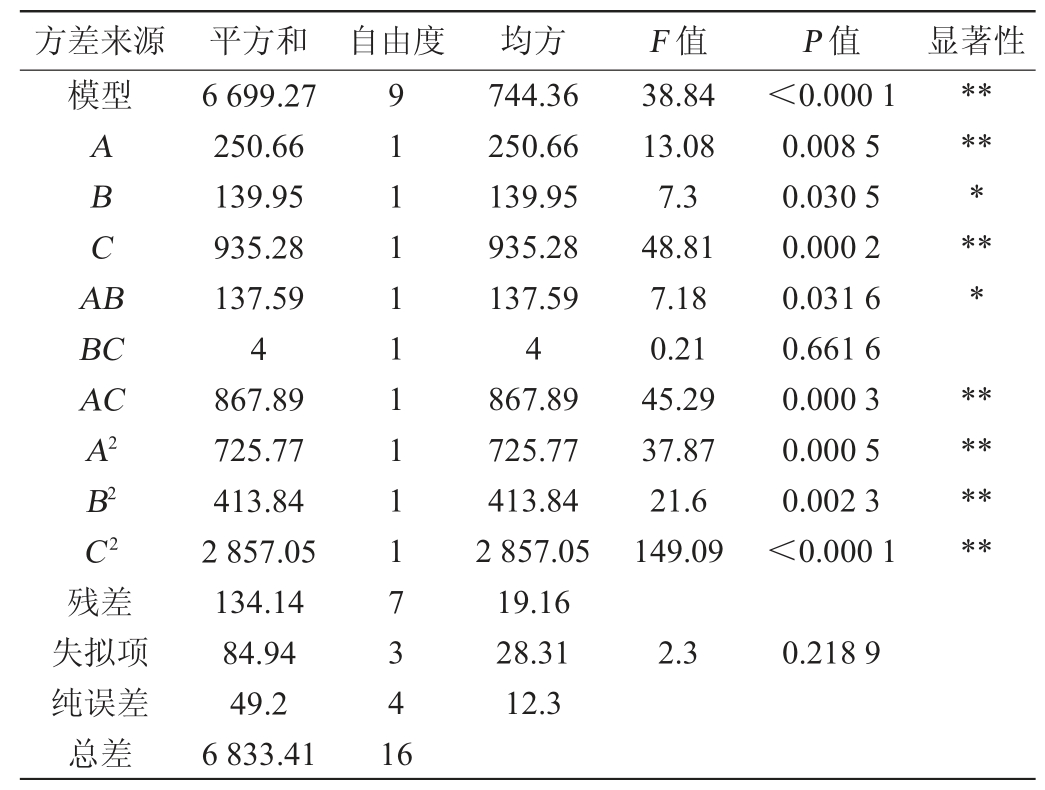
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型ABCA B********BC AC A2 B2 C2 38.84 13.08 7.3 48.81 7.18 0.21 45.29 37.87 21.6 149.09<0.000 1 0.008 5 0.030 5 0.000 2 0.031 6 0.661 6 0.000 3 0.000 5 0.002 3<0.000 1********残差失拟项纯误差总差6 699.27 250.66 139.95 935.28 137.59 4 867.89 725.77 413.84 2 857.05 134.14 84.94 49.2 6 833.41 91111111117341 6 744.36 250.66 139.95 935.28 137.59 4 867.89 725.77 413.84 2 857.05 19.16 28.31 12.3 2.3 0.218 9
利用Design-Expert 8.0.6分析试验结果,对数据进行多元二次回归拟合,建立回归模型方程为:
Y=-2 275.159 50+145.052 75B+1.132 29A+3.733 50C+0.244 37AB+0.500 00BC+1.227 50AB-2.478 50B2-0.091 174A2-26.049 00C2
由表4可知,该模型是极显著的(P<0.01)。模型的失拟项P值为0.218 9,不显著(P>0.05),表示该方程对实验模型拟合较好,模型的选择和建立是合理的。从该回归方程方差分析结果可看出,一次项B和交互项AB对蛋白酶活力的影响显著(P<0.05),一次项A、C和二次项A2、B2、C2及交互项AC对蛋白酶活力的影响极显著(P<0.01);交互项BC对蛋白酶活力的影响不显著(P>0.05),根据F值的不同,判断出影响混菌发酵膏状腐乳前发酵阶段蛋白酶活力的顺序为:接菌比例(C)>发酵温度(A)>发酵时间(B)。
根据试验结果绘制响应曲面和等高线图见图4。
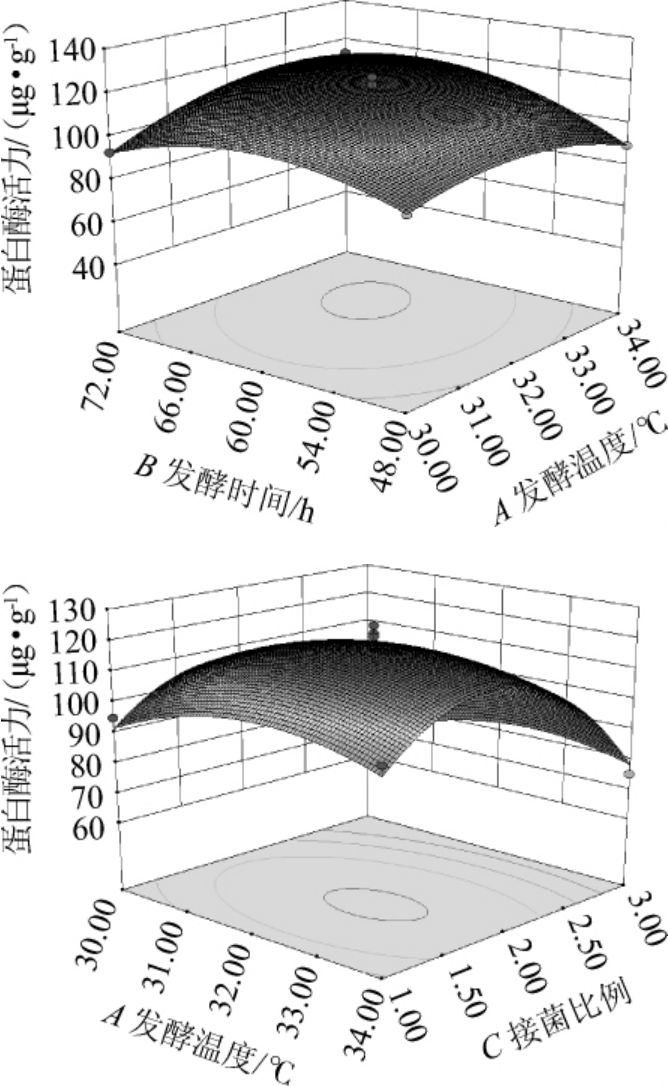
图4 各因素交互作用对膏状腐乳蛋白酶活力影响的响应面及等高线
Fig.4 Response surface plots and contour lines of effects of interaction between each factor on protease activity of paste sufu
接菌比例中1~3分别代表图1中A~E。
接菌比例一定时,发酵时间的延长和发酵温度的升高对混菌发酵膏状腐乳前发酵的蛋白酶活力的影响从促进转变为抑制;发酵时间一定时,接菌比例中少孢根霉的下降和发酵温度的上升对混菌发酵膏状腐乳前发酵的蛋白酶活力的影响从促进转变为抑制;这与方差分析的结果一致。
以蛋白酶活力为响应指标,拟合出混菌发酵膏状腐乳前发酵的最佳发酵工艺参数为:发酵温度32.52 ℃,发酵时间62.25 h,接菌比例为少孢根霉∶毛霉∶酵母∶植物乳杆菌=3.7∶1.85∶1.85∶1.85),此条件下蛋白酶活力为121.90 μg/g。为检验拟合最佳发酵工艺与试验结果的一致性,对上述响应面优化条件进行试验验证。考虑到实际操作的可行性,将最佳工艺条件修正为发酵温度32 ℃,发酵时间60 h,接菌比例为少孢根霉∶毛霉∶酵母∶植物乳杆菌=4∶2∶2∶2,此时蛋白酶活力为123.84 μg/g,接近拟合结果,证明模型拟合性好,结果有效。
2.3 膏状腐乳指标测定
2.3.1 膏状腐乳前发酵终点主要理化成分的比较
以响应面得出的最佳工艺条件进行发酵,检测前发酵终点的还原糖、氨基酸态氮和可溶性蛋白的含量,与相同接种量的单菌(毛霉、少孢根霉)发酵膏状腐乳进行对比,结果见表5。
表5 膏状腐乳理化指标测定结果
Table 5 Determination results of physicochemical indexes of paste sufu
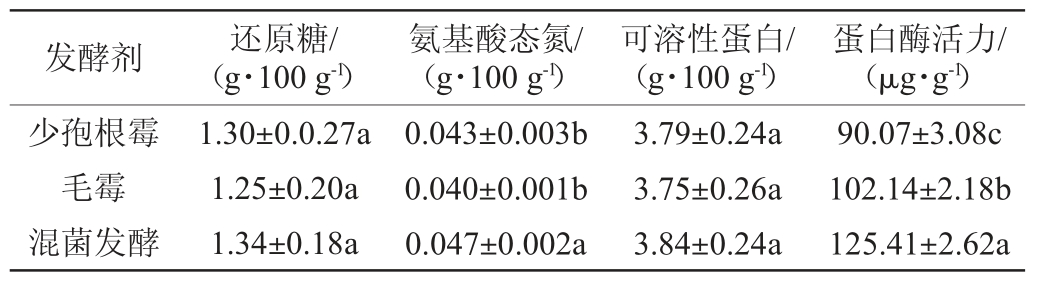
注:同列数据肩字母不同,表明差异显著(P<0.05)。
发酵剂 还原糖/(g·100 g-1)氨基酸态氮/(g·100 g-1)可溶性蛋白/(g·100 g-1)蛋白酶活力/(μg·g-1)少孢根霉毛霉混菌发酵1.30±0.0.27a 1.25±0.20a 1.34±0.18a 0.043±0.003b 0.040±0.001b 0.047±0.002a 3.79±0.24a 3.75±0.26a 3.84±0.24a 90.07±3.08c 102.14±2.18b 125.41±2.62a
由表5可知,混菌发酵膏状腐乳的还原糖、氨基酸态氮和可溶性蛋白的含量均比单菌发酵膏状腐乳高,混菌发酵膏状腐乳氨基酸态氮的含量与单菌发酵有显著性差异(P<0.05),这是因为混菌发酵剂的蛋白酶活力高,能分解更多的蛋白质。蛋白质水解为氨基酸是提高风味和口感的重要过程[26]。
2.3.2 膏状腐乳前发酵终点游离氨基酸组分分析
游离氨基酸既是营养物质,又是腐乳发酵过程中滋味和风味的重要前体物质,还是衡量腐乳风味的一个重要指标[27]。以混菌发酵膏状腐乳前发酵的最佳发酵工艺进行发酵,分别将单菌(少孢根霉、毛霉)发酵膏状腐乳及市售块状腐乳与混菌发酵膏状腐乳的前发酵终点的游离氨基酸组分相对比,结果见表6。
表6 各腐乳中游离氨基酸组分分析
Table 6 Analysis of free amino components in various sufu

注:“*”代表必需氨基酸。
游离氨基酸 少孢根霉前酵/(mg·g-1)毛霉前酵/(mg·g-1)混菌发酵前酵/(mg·g-1)市售腐乳/(mg·g-1)天冬氨酸苏氨酸*丝氨酸谷氨酸甘氨酸丙氨酸胱氨酸缬氨酸*蛋氨酸*异亮氨酸*亮氨酸*酪氨酸苯丙氨酸*组氨酸赖氨酸*总量必需氨基酸(百分比)0.171 0.120 0.402 0.155 0.146 0.384 0.070 0.326 0.170 0.290 0.334 0.177 0.188 0.170 0.322 4.245 1.75(41.14%)0.249 0.068 0.167 0.800 0.120 0.204 0.052 0.162 0.125 0.163 0.173 0.056 0.138 0.118 0.301 3.661 1.13(30.87%)0.294 0.142 0.028 0.849 0.124 0.153 0.021 0.311 0.087 0.196 0.337 0.059 0.206 0.087 0.473 3.611 1.75(48.51%)0.237 0.154 0.804 0.962 0.208 0.446 0.076 0.232 0.343 0.331 0.296 0.121 0.245 0.272 0.383 5.775 1.98(34.35%)
由表6可知,共检出15种氨基酸,不同的氨基酸有不同的滋味,参考4种腐乳中氨基酸呈味的分类依据[22,28],15种氨基酸分为鲜味氨基酸(谷氨酸、天门冬氨酸、赖氨酸和胱氨酸)、甜味氨基酸(丙氨酸、丝氨酸、甘氨酸、苏氨酸和组氨酸)、苦味氨基酸(异亮氨酸、亮氨酸、蛋氨酸、缬氨酸);芳香族氨基酸(苯丙氨酸、酪氨酸)。由表6亦可知,混菌发酵膏状腐乳前发酵终点游离氨基酸总含量为5.77 mg/g,优于少孢根霉腐乳(4.25 mg/g)、毛霉腐乳(3.66 mg/g)和市售腐乳(3.61 mg/g),其中必需氨基酸有1.98 mg/g,占氨基酸总量的34.35%,含量最高的是赖氨酸,其次是蛋氨酸、异亮氨酸、亮氨酸、苯丙氨酸、缬氨酸及苏氨酸。混菌发酵膏状腐乳鲜味氨基酸占氨基酸总量的28.71%,是毛霉发酵膏状腐乳的1.2倍、少孢根霉发酵膏状腐乳的2.3倍,故混菌发酵膏状腐乳整体鲜味最突出[29-30];丙氨酸、丝氨酸、甘氨酸、苏氨酸、组氨酸的含量也较高,呈现出甜味,使膏状腐乳整体风味较为协调[31]。混菌发酵的膏状腐乳滋味品质较好。
2.3.3 膏状腐乳前发酵终点的感官品评结果
将单菌(少孢根霉、毛霉)发酵膏状腐乳、市售块状腐乳及混菌发酵膏状腐乳随机编号,邀请10位有感官评定经验的人员根据腐乳感官品评标准进行感官评价,结果见图5。
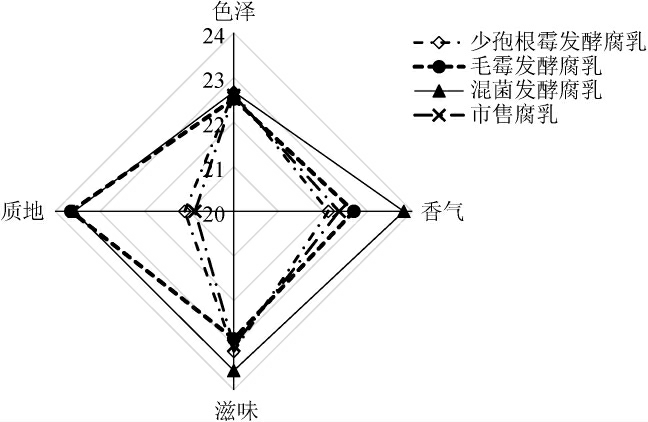
图5 腐乳的感官品评结果
Fig.5 Sensory evaluation results of sufu
由图5可知,四种腐乳在色泽上差异并不明显,都具有良好的色泽;混菌发酵膏状腐乳的香气比单菌发酵及市售块状腐乳更加浓郁,且滋味更丰富,这与游离氨基酸的分析结果一致;少孢根霉膏状腐乳的质地与其他两种膏状腐乳相比要差一些,毛霉膏状腐乳和混菌发酵膏状腐乳口感更细腻,综合来看,混菌发酵膏状腐乳在感官方面优于单菌发酵膏状腐乳及市售腐乳。
3 结论
本研究以大豆为主要原料,经孢根霉、毛霉、酵母、植物乳杆菌多菌种混菌发酵制备膏状腐乳,在单因素试验的基础上,以蛋白酶活力为响应值进行响应面试验,对混菌发酵膏状腐乳前发酵的条件进行优化,得到混菌发酵膏状腐乳前发酵的最优条件为:发酵温度32 ℃,发酵时间60 h,接菌比例为少孢根霉∶毛霉∶酵母∶植物乳杆菌=4∶2∶2∶2,接菌浓度1.0×106 CFU/mL。混菌发酵膏状腐乳的蛋白酶活力和游离氨基酸含量显著高于单菌发酵,其游离氨基酸总含量为5.77 mg/g,其中必需氨基酸占34.35%,鲜味氨基酸占氨基酸总量的28.71%,其含量是毛霉膏状腐乳的1.2倍、少孢根霉膏状腐乳的2.3倍。混菌发酵膏状腐乳的香气比单菌发酵膏状腐乳及市售块状腐乳更加浓郁,且滋味更丰富,在感官评分上具有较大优势。混菌发酵膏状腐乳可以在单一菌种发酵的基础上,优势互补,为腐乳奠定良好的风味基础,为腐乳产品开发提供科学依据。
[1]石黎琳.自然发酵腐乳微生物多样性及其品质的研究[D].重庆:西南大学,2021.
[2]HU X,LIU S,LI E.Microbial community succession and its correlation with the dynamics of flavor compound profiles in naturally fermented stinky sufu[J].Food Chem,2023,427:136742.
[3]孙菁赫.腐乳风味指纹图建立及直装腐乳风味形成规律研究[D].哈尔滨:哈尔滨商业大学,2014.
[4]刘本勇.腐乳白坯保形处理技术及全子叶膏状腐乳技术的研究[D].哈尔滨:哈尔滨商业大学,2014.
[5]HU M,DONG J,TAN G,et al.Metagenomic insights into the bacteria responsible for producing biogenic amines in sufu[J].Food Microbiol,2021,98:103762.
[6]马偲臆.不同霉对腐乳及全豆腐乳前发酵影响的研究[J].现代食品,2020(6):53-56.
[7]谢斌,张敏,李鑫峰,等.大豆红曲对红腐乳风味及感官品质的影响[J].中国酿造,2023,42(7):234-240.
[8]庄洋,田盼盼,单长海,等.腐乳的营养价值及其生理活性[J].湖北民族学院学报(自然科学版),2016,34(2):179-183,188.
[9]LI K,TANG J,ZHANG Z,et al.Correlation between flavor compounds and microorganisms of Chaling natural fermented red sufu[J].LWT-Food Sci Technol,2022,154:112873.
[10]陈曦,包峻州,罗豪,等.毛霉型白腐乳发酵过程中的质构变化研究[J/OL].中国食物与营养,1-7[2024-07-16].https://doi.org/10.19870/j.cnki.11-3716/ts.20230423.002.
[11]周鸿翔,陈龙,滕钰,等.酶促膏状腐乳酱中相关酶的作用研究[J].中国调味品,2014(7):57-61.
[12]LEE S Y,LEE S,LEE S M,et al.Primary and secondary metabolite profiling of doenjang,a fermented soybean paste during industrial processing[J].Food Chem,2014,165:157-166.
[13]徐淼.腐乳菌株发酵特性评价与发酵剂制备研究[D].哈尔滨:东北农业大学,2015.
[14]YANG B, TAN Y, KAN J.Regulation of quality and biogenic amine production during sufu fermentation by pure Mucor strains[J]. LWTFood Sci Technol,2020,117:108637.
[15]杜鹏,包媛媛,杨明,等.结合云南牟定腐乳探究传统发酵豆制品腐乳的研究现状[J].食品工业,2019,40(11):242-247.
[16]CHEN Z,ZHANG C,DU H,et al.Effect of starter cultures on dynamics succession of microbial communities, physicochemical parameters, enzyme activities, tastes and volatile flavor compounds during sufu fermentation[J].Food Chem Adv,2022,1:100057.
[17]CHUNG H Y, CHEN Z, CHUNG H Y.Dynamic correlations between major enzymatic activities, physicochemical properties and targeted volatile compounds in naturally fermented plain sufu during production[J].Food Chem,2022,378:131988.
[18]国家质量监督检验检疫总局,国家标准化管理委员会.GB/T 23527—2009 食品国家安全标准蛋白酶制剂[S].北京:中国标准出版社,2009.
[19]周子文.白腐乳工艺优化及品质分析研究[D].广州:仲恺农业工程学院,2019.
[20]国家卫生和计划生育委员会,国家食品药品监督管理总局.GB5009.235—2016 食品安全国家标准食品中氨基酸态氮的测定[S].北京:中国标准出版社,2016.
[21]CAI H,DUMBA T,SHENG Y,et al.Microbial diversity and chemical property analyses of sufu products with different producing regions and dressing flavors[J]. LWT-Food Sci Technol,2021,144:111245.
[22]杨智慧,张军伟,魏冠棉,等.云南腐乳发酵菌种的分离鉴定及其低盐腐乳的品质分析[J].食品与发酵工业,2020,46(1):62-68.
[23]TIAN M,DING S,YANG L,et al.Weissella confusa M1 as an adjunct culture assists microbial succession and flavor formation in gray sufu[J].LWT-Food Sci Technol,2023,185:115155.
[24]蒋芳芳.腐乳发酵过程中各成分变化的研究[D].长沙:湖南农业大学,2012.
[25]MOY Y, LU T, CHOU C.Volatile components of the enzyme-ripened sufu, a Chinese traditional fermented product of soy bean[J]. J Biosci Bioeng,2012,113(2):196-201.
[26]HUANG X, YU S, HAN B, et al.Bacterial community succession and metabolite changes during sufu fermentation[J].LWT-Food Sci Technol,2018,97:537-545.
[27]郑春龙.牟定腐乳品质质量提升研究[D].昆明:昆明理工大学,2022.
[28]沈子林,翁本德,管有根.浅谈腐乳的色、香、味、质的感官品评方法[J].中国酿造,2003,22(5):39-40.
[29]CHEN Z,SONG J,REN L,et al.Effect of the succession of the microbial community on physicochemical properties and flavor compounds of Mucor wutungkiao-fermented sufu[J].Food Biosci,2023,51:102345.
[30]ZHAO C J, SCHIEBER A, GÄNZLE M G.Formation of taste-active amino acids,amino acid derivatives and peptides in food fermentations-A review[J].Food Res Int,2016,89:39-47.
[31]CHEN Z, LIU L, DU H, et al.Microbial community succession and their relationship with the flavor formation during the natural fermentation of Mouding sufu[J].Food Chem X,2023,18:100686.