番茄红素是一种类胡萝卜素,在自然界中主要存在于番茄、西瓜等水果中,是成熟番茄中的主要色素[1]。番茄红素作为强抗氧化剂,具有抗氧化、抗癌、降血脂等生理学功能[2-3],被广泛应用于保健食品[4-5]、医药[6-7]等行业。当下番茄红素主要从番茄[8]及其制品[9-10]、胡萝卜[11]、番石榴[12]、西瓜[13]等天然富含番茄红素的蔬菜水果中提取获得。然而,植物中番茄红素含量低、生产成本高、不利于番茄红素的应用推广[14]。
除了从生源植物中获取番茄红素外,近年来逐步兴起利用合成生物学技术在微生物中异源合成番茄红素[15],可为番茄红素的供应提供新的途径。在多种微生物宿主中通过基因工程和代谢工程实现了番茄红素的生物合成[16-18]。酿酒酵母(Saccharomyces cerevisiae)由于其食品安全、遗传操作简单、易高密度发酵等特性[19],作为宿主细胞合成番茄红素的研究较多,且取得了产量上的突破。如CHEN Y等[20]通过在酿酒酵母中删除远端基因位点ypl062w增强乙酰辅酶A的通量并最终增加番茄红素的产量,结合代谢工程技术使番茄红素产量达1.65 g/L;SHI B等[21]通过系统代谢工程改造酿酒酵母高效生物合成番茄红素,结合酿酒酵母全合成培养基发酵优化,番茄红素产量达到3.2 g/L;ZHOU K等[22]利用酿酒酵母菌株自适应进化结合代谢工程技术,使番茄红素的分批补料发酵产量达8.15 g/L。这些研究中,酿酒酵母异源合成番茄红素产量达到了可工业化生产的水平。但是这些研究主要针对番茄红素的合成基因筛选及其发酵产量评价,鲜见报道酿酒酵母产番茄红素的提取纯化方法及其结构鉴定。
本研究在前期得到高产番茄红素酿酒酵母工程菌的基础上,通过单因素和正交试验优化酿酒酵母产番茄红素的提取纯化工艺,并采用核磁共振(nuclear magnetic resonance,NMR)技术对其结构进行鉴定,旨在提高工程酿酒酵母番茄红素提取率及纯度,为后续工业化利用奠定重要的理论与方法基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
重组酿酒酵母工程菌BS106湿菌体:实验室进行分批补料发酵后收集的湿菌体,菌株构建及发酵参见文献[21]。
1.1.2 试剂
丙酮、乙酸乙酯、正己烷、醋酸钠、浓盐酸、无水乙醇、氢氧化钠(均为分析纯):国药集团化学试剂有限公司;番茄红素标准品(纯度>98%):美国Sigma-Aldrich公司。
1.2 仪器与设备
PL303电子天平、FE20实验室pH计:梅特勒-托利多仪器(上海)有限公司;Nanodrop 2000c微量紫外可见光光度计、Ultimate 3000高效液相色谱(high performance liquid chromatography HPLC)仪:赛默飞世尔科技公司;5425R控温微型高速离心机:艾本德(中国)有限公司;SW-CJ-2FD超净工作台:苏州净化设备有限公司;SH-250恒温生化培养箱:上海森信实验仪器有限公司;ZHWY-211C恒温摇床:上海智城分析仪器制造有限公司;400-MR DD2超导核磁共振波谱仪:安捷伦科技(中国)有限公司。
1.3 方法
1.3.1 番茄红素检测
在提取工艺的优化过程中,番茄红素的检测,使用紫外分光光度计进行检测,在番茄红素最大吸收波长472 nm处检测提取液的吸光度值[23],来反映提取液中的番茄红素浓度,验证提取效果。
番茄红素含量的精确定量采用HPLC法[24]。HPLC色谱条件:Agilent Zorbax C18非极性色谱柱(4.6 mm×150 mm×5 μm),流动相A(乙腈∶水=9∶1,V/V)和流动相B(甲醇∶异丙醇=3∶2,V/V),流动相洗脱条件:0 min:0% B,15 min:90%B,30~35 min:90%B,35 min:0%B,流速1 mL/min,柱温30 ℃。紫外检测器,检测波长472 nm。通过标准品保留时间定性,按照标准曲线回归方程计算番茄红素含量。
1.3.2 酵母菌破壁方法
(1)酸热法
称取发酵收集的重组酿酒酵母工程菌株BS106湿菌体0.1 g,加入5.0 mL 3 mol/L盐酸,酸化1.5 h后,45 ℃水浴加热10 min,冷却后4 000 r/min离心10 min,倒出上层酸液,水洗一次、离心后去上清,加入35 mL丙酮浸提1 h,取丙酮浸提液,加入丙酮进行稀释至吸光度值(A472nm)为1左右,测定吸光度值(A472nm)。
(2)碾磨法
称取发酵收集的重组酿酒酵母工程菌BS106湿菌体0.1 g置于匀浆器中,加适量冰的无水乙醇避光碾磨破壁15 min,转移至离心管,4 000 r/min离心10 min,倒出上层液,水洗一次、离心后去上清加35 mL丙酮浸提1 h,取丙酮浸提液,加入丙酮进行梯度稀释,在与上述同等倍数下测定吸光度值(A472nm)。
(3)未破壁
称取发酵收集的重组酿酒酵母工程菌BS106湿菌体0.1 g,加35 mL丙酮浸提1 h,取丙酮浸提液,加入丙酮进行梯度稀释,在与上述同等倍数下测定吸光度值(A472nm)。
1.3.3 酸热破壁法条件优化
分别设置盐酸浓度(1.0 mol/L、2.0 mol/L、2.5 mol/L、3.0 mol/L、4.0 mol/L、4.5 mol/L、5.0 mol/L)、每0.1 g菌体盐酸用量(2.0 mL、2.5 mL、3.0 mL、3.5 mL、4.0 mL、4.5 mL)、酸化温度(30 ℃、35 ℃、40 ℃、45 ℃、50 ℃、55 ℃)、酸化时间(30 min、50 min、60 min、80 min、90 min、100 min),分别考察上述各因素对酸热法番茄红素提取的影响。
在单因素试验的基础上,设计3因素3水平的正交试验,以番茄红素提取效率(A472 nm值)为评价指标,确定最佳酸热破壁法条件。
1.3.4 脱脂方法
分别考察有机溶剂正己烷、环己烷脱脂(相似相溶原理)以及利用氢氧化钠、碳酸钠、碳酸氢钠等不同碱液脱脂(皂化反应原理)对番茄红素提取的影响。
称取含番茄红素的重组酿酒酵母湿菌体1.0 g,通过酸热破壁法破壁,称取破壁后的菌体6份、每份0.1 g,其中3份分别加入1 mL的0.25 mol/L氢氧化钠、0.25 mol/L碳酸钠、0.25 mol/L碳酸氢钠进行皂化处理0.5 h后45 ℃水浴加热3 min[25-26],另外2份分别加入1 mL环己烷、正己烷后放置4 ℃冰箱0.5 h,一组不做脱脂处理为对照。随后将这6份样本4 000 r/min离心10 min,水洗2次,加45 mL丙酮浸提,取丙酮浸提液加入丙酮进行稀释至吸光度值(A472 nm)为1左右,同等倍数下测定吸光度值(A472nm)。
1.3.5 NaOH脱脂条件优化
分别考察NaOH浓度(0.05 mol/L、0.10 mol/L、0.15 mol/L、0.20 mol/L、0.25 mol/L、0.30 mol/L)、0.1 g菌体NaOH溶液用量(1.5 mL、2.0 mL、2.5 mL、3.0 mL、3.5 mL)、皂化后水浴温度(30 ℃、35 ℃、40 ℃、45 ℃、50 ℃)、皂化时间(30 min、50 min、60 min、70 min、90 min)对番茄红素提取的影响。
在单因素试验基础上,进行4因素3水平正交试验确定最佳的NaOH脱脂条件。
1.3.6 提取溶剂的筛选及丙酮浸提条件的优化
称取含番茄红素重组酿酒酵母工程菌BS106湿菌体5.0 g,通过酸热破壁法破壁、NaOH脱脂后,称取3份(每份0.1 g),分别加入45 mL丙酮、正己烷、乙酸乙酯浸提60 min,并都加入适量的2,6-二叔丁基对甲酚(butylated hydroxytoluene,BHT)抗氧化剂,取浸提液稀释到最终相同倍数后,测定吸光度值(A472nm)。分别考察菌体与有机试剂的料液比(1∶5、1∶10、1∶15、1∶20、1∶25(g∶mL))、浸提温度(30 ℃、35 ℃、40 ℃、45 ℃、50℃)、浸提时间(20 min、30 min、40 min、50 min、60 min)对番茄红素提取的影响。
在得到最佳单因素的条件下,根据单因素试验结果,进行3因素3水平正交试验确定最佳的丙酮浸提条件。
1.3.7 番茄红素粗提物纯化方法
重组酿酒酵母湿菌体经过破壁、脱脂、丙酮浸提后的丙酮提取液,40 ℃减压回收丙酮得番茄红素浸膏(番茄红素粗提物)。称取番茄红素粗提取物,分别加入正己烷、乙酸乙酯,置40 ℃将提取物全部溶解,趁热过滤,放冷后-20 ℃析晶12 h以上,抽滤得番茄红素结晶。番茄红素纯度及提取率计算公式如下:

1.3.8 核磁共振检测
番茄红素结构鉴定采用Agilent 400MHz 超导核磁共振波谱仪,检测依据JYT 006—1996《脉冲傅里叶变换电磁体核磁共振波谱方法通则》,溶剂是含有0.03%四甲基硅烷(tetramethylsilane,TMS)的氘代氯仿(Chloroform-d,CDCl3),探头是1H-19F/31P-15N 5 mm PFG ONENMR Probe,自动进样器是Agilent 7620-AS Autosampler(96位)。
2 结果与分析
2.1 酿酒酵母产番茄红素的提取研究
2.1.1 酵母菌不同破壁方法结果
不同破壁方法对酵母源番茄红素提取效果的影响。每种方法重复3次提取,取平均值,结果见图1。由图1可知,酸热法破壁效果较好,相对于对照组的未破壁处理能显著提高番茄红素的提取效果(P<0.05)。
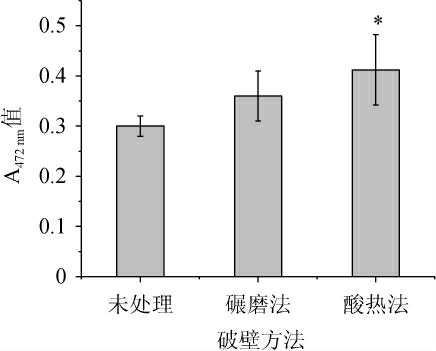
图1 不同破壁方法对番茄红素提取效果的影响
Fig.1 Effect of different wall breaking methods on lycopene extraction
“*”表示与未处理组相比差异显著(P<0.05)。
2.1.2 酸热破壁法的条件优化
考察酸热破壁法中各因素对番茄红素提取效果的影响,结果见图2。
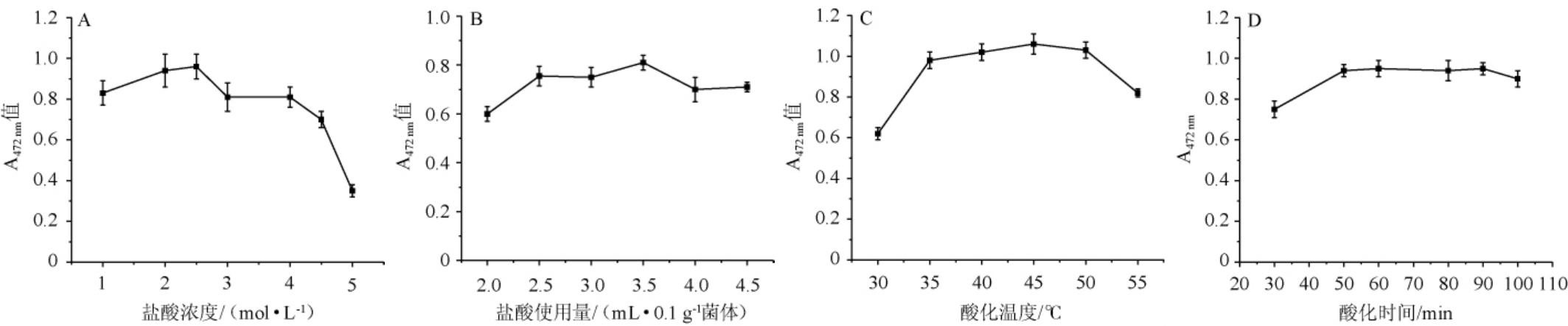
图2 酸热法破壁条件优化单因素试验结果
Fig.2 Results of single factor tests for wall breaking conditions optimization by acid heat method
由图2A可知,当盐酸浓度为1.0~2.5 mol/L时,提取效果随之增加;当盐酸浓度为2.5 mol/L时,提取效果最佳;当盐酸浓度>2.5 mol/L之后,提取效果有所下降。因此,最适盐酸浓度为2.5 mol/L。由图2B可知,当盐酸用量为2.0~3.5 mL时,提取效果随之增加;当0.1 g菌体中盐酸用量为3.5 mL时,提取效果最佳;当盐酸用量>3.5 mL之后,提取效果有所下降。因此,最适盐酸用量为3.5 mL。由图2C可知,当酸化温度为30~45 ℃时,提取效果随之增加;当酸化温度为45 ℃时,番茄红素的提取效果最佳;当酸化温度>45 ℃之后,提取效果有所下降。因此,最适酸化温度为45 ℃。由图2D可知,酸化时间对提取效果影响较小,当酸化时间为30~60 min时,提取效果随之增加;当酸化时间为60 min时,番茄红素的提取效果最佳;当酸化时间>60 min之后,提取效果有所下降。因此,最适酸化时间为60 min。
由于酸化时间对结果影响较小,在单因素试验基础上,固定酸化时间为60 min,选择酸化温度(A)、盐酸浓度(B)、盐酸用量(C)为影响因素,番茄红素提取效果(A472 nm值)为评价指标,进行3因素3水平正交试验,正交试验结果与分析见表1。由极差R值可知,各因素影响番茄红素提取率的大小次序为A>B>C。酸热法破壁的最佳条件组合是A2B3C2,即酸化温度45 ℃,盐酸浓度3.0 mol/L,盐酸用量3.0 mL/0.1 g菌体,酸化时间60 min。在此优化条件下,A472nm值为1.054。
表1 酸热法破壁条件优化正交试验结果与分析
Table 1 Results and analysis of orthogonal tests for conditions optimization of wall breaking by acid heat method
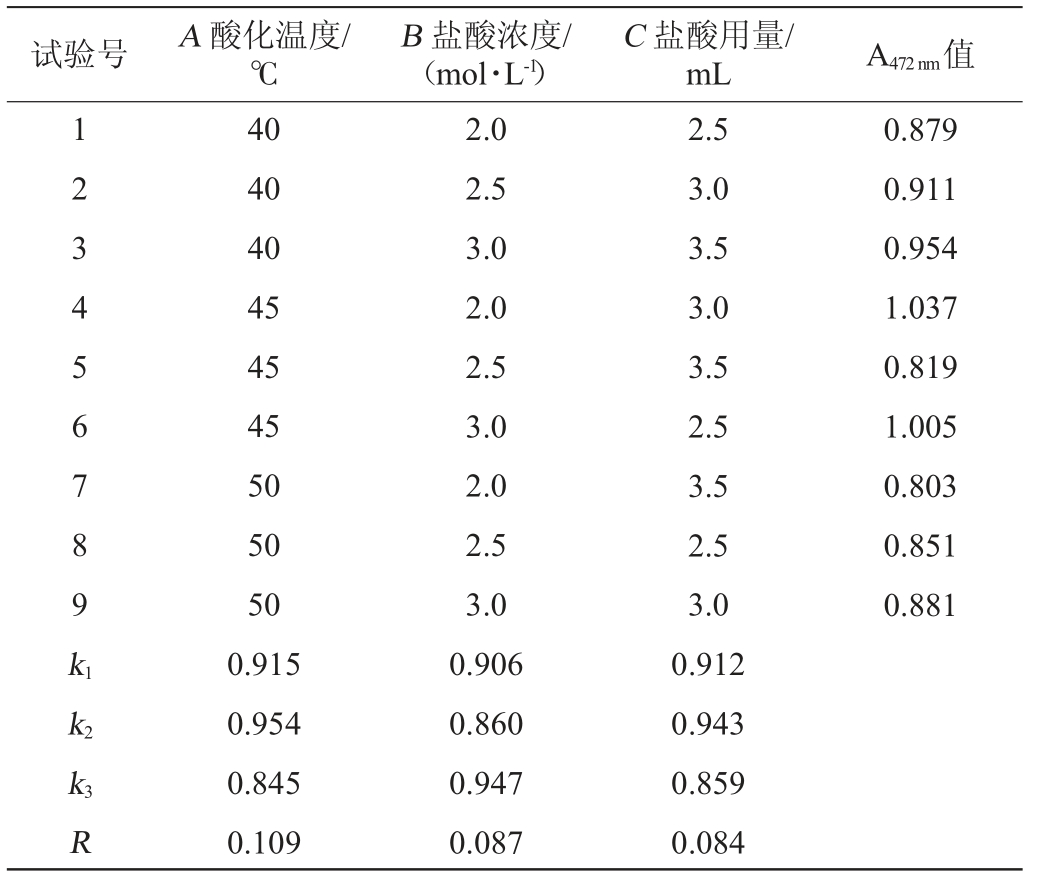
试验号 A 酸化温度/℃B 盐酸浓度/(mol·L-1)C 盐酸用量/mL A472 nm值1 2 3 4 5 6 7 8 9 k1 0.879 0.911 0.954 1.037 0.819 1.005 0.803 0.851 0.881 k2 k3R 40 40 40 45 45 45 50 50 50 0.915 0.954 0.845 0.109 2.0 2.5 3.0 2.0 2.5 3.0 2.0 2.5 3.0 0.906 0.860 0.947 0.087 2.5 3.0 3.5 3.0 3.5 2.5 3.5 2.5 3.0 0.912 0.943 0.859 0.084
2.1.3 脱脂方法的筛选
不同脱脂方法对番茄红素提取效果的影响结果如图3所示,相对于未脱脂的对照组,各脱脂试验组番茄红素提取率都有一定的提升,最大提升了96%,最小提升了35%,说明脱脂对番茄红素提取影响较大。氢氧化纳、碳酸钠、碳酸氢钠这三种脱脂方法均可以显著提高番茄红素的提取效果,其中NaOH皂化脱脂效果较好。
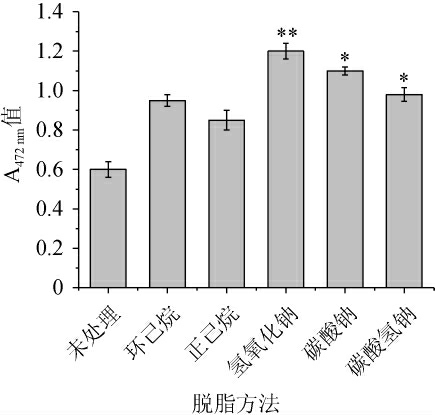
图3 不同脱脂方法对番茄红素提取的影响
Fig.3 Effect of different degreasing methods on lycopene extraction
与未处理组相比,“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01)。
2.1.4 NaOH脱脂条件优化单因素试验
考察NaOH皂化脱脂中各因素对番茄红素提取效果的影响,结果见图4。由图4A可知,当NaOH浓度在0.05~0.10 mol/L时,提取效果随之增加;当NaOH浓度为0.10 mol/L时,提取效果最佳;当NaOH浓度>0.10 mol/L之后,提取效果有所下降。因此,最适NaOH浓度为0.10 mol/L。由图4B可知,当NaOH用量在1.5~2.5 mL/100 mg时,提取效果随之增加;当NaOH用量在2.5 mL/100 mg时,提取效果最佳;当NaOH用量>2.5mL/100 mg之后,提取效果有所下降。因此,最适NaOH用量为2.5 mL/100 mg。由图4C可知,当水浴温度为30~45 ℃时,提取效果随之增加;当水浴温度为45 ℃时,提取效果最佳;当水浴温度>45 ℃之后,提取效果有所下降。因此,最适水浴温度为45 ℃。由图4D可知,当皂化时间为30~50 min时,提取效果随之增加;当皂化时间为50 min时,提取效果最佳;当皂化时间>50 min之后,提取效果有所下降。因此,最适皂化时间为50 min。

图4 NaOH皂化脱脂条件优化单因素试验结果
Fig.4 Results of single factor tests for conditions optimization of NaOH saponification degreasing
在单因素试验基础上,以NaOH浓度(A),NaOH用量(B),皂化后水浴温度(C),皂化时间(D)为影响因素,番茄红素提取效果为评价指标,进行4因素3水平正交试验,正交试验结果与分析见表2。
表2 NaOH皂化脱脂条件优化正交试验结果与分析
Table 2 Results and analysis of orthogonal tests for conditions optimization of NaOH saponification degreasing
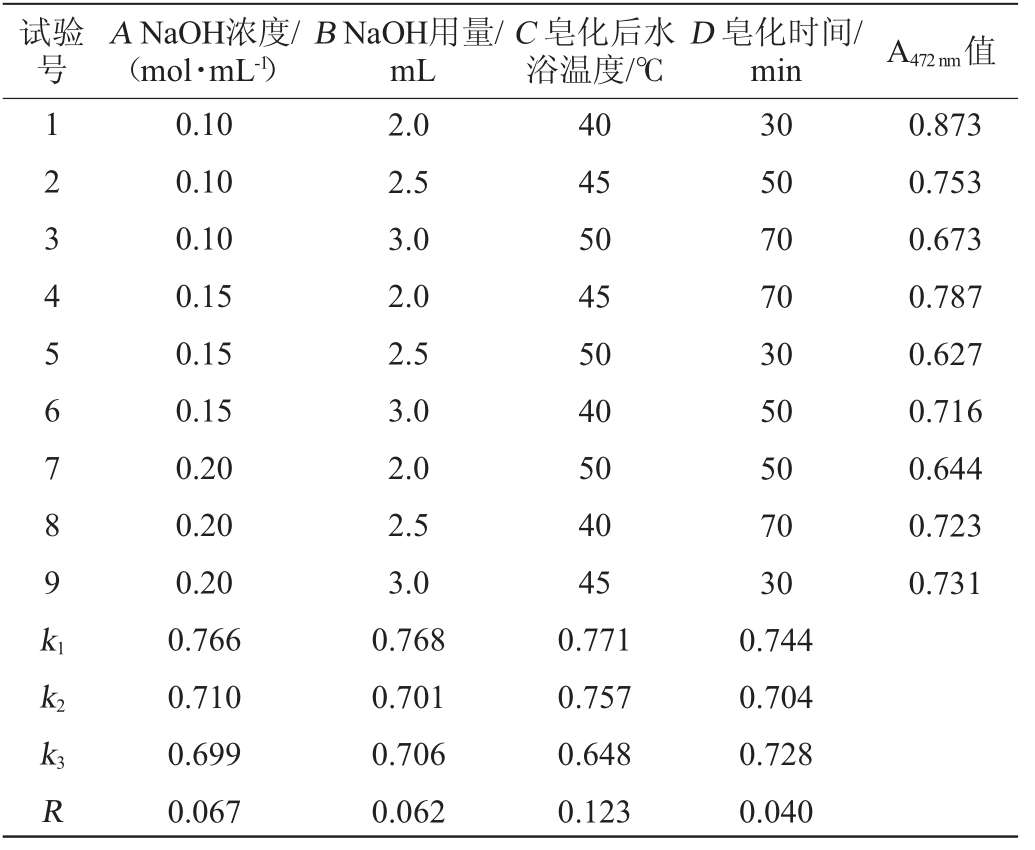
试验号A NaOH浓度/(mol·mL-1)B NaOH用量/mL C 皂化后水浴温度/℃D 皂化时间/min A472 nm值1 2 3 4 5 6 7 8 9k1 0.873 0.753 0.673 0.787 0.627 0.716 0.644 0.723 0.731 k2 k3R 0.10 0.10 0.10 0.15 0.15 0.15 0.20 0.20 0.20 0.766 0.710 0.699 0.067 2.0 2.5 3.0 2.0 2.5 3.0 2.0 2.5 3.0 0.768 0.701 0.706 0.062 40 45 50 45 50 40 50 40 45 0.771 0.757 0.648 0.123 30 50 70 70 30 50 50 70 30 0.744 0.704 0.728 0.040
由表2可知,NaOH浓度(A),NaOH用量(B),皂化后水浴温度(C),皂化时间(D)这4个因素都会影响番茄红素的提取效果。根据极差R可以得出,各因素影响番茄红素提取率的大小次序为C>A>B>D。NaOH脱脂的最佳条件组合是A1B1C1D1,即NaOH浓度为0.10 mol/L、NaOH用量为2.0 mL/0.1g菌体、皂化时间30 min,皂化后水浴温度40 ℃。在此优化条件下,A472nm值为0.887。
2.1.5 提取溶剂的筛选及最佳提取溶剂浸提条件的优化
提取溶剂的筛选及最佳提取溶剂提取条件优化结果见图5。由图5A可知,丙酮提取效果最好,乙酸乙酯其次,正己烷最差。而且丙酮毒性小,价格便宜[9],因此,选择丙酮作为最适提取试剂。
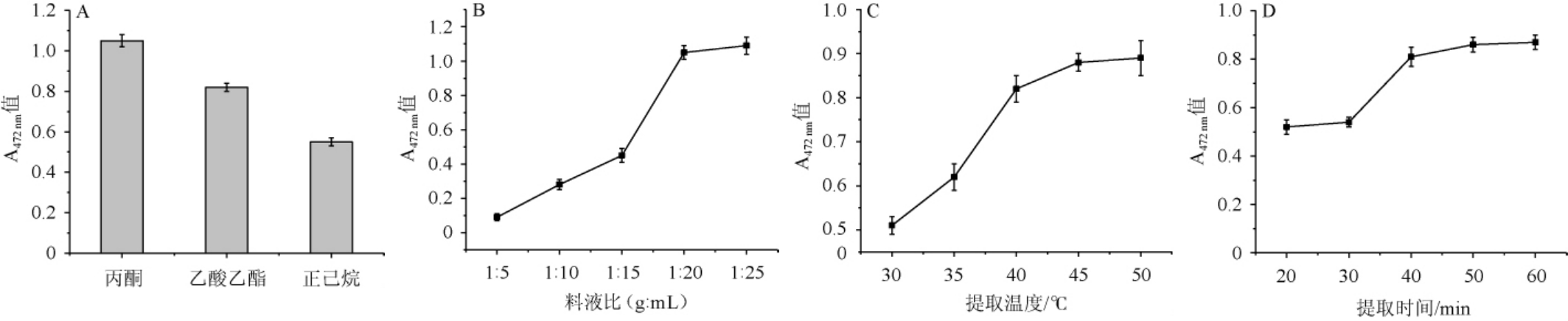
图5 提取溶剂的筛选及丙酮提取条件优化单因素试验结果
Fig.5 Results of single factor tests for extraction solvent screening and acetone extraction conditions optimization
由图5B可知,当料液比在1∶5~1∶20(g∶mL)时,番茄红素提取效果随之增大;当料液比在1∶20(g∶mL)时,对番茄红素提取效果较高,A472nm值为1.045;当料液比在1∶20(g:mL)后继续增大,对番茄红素提取效果提升不大。这主要由于液料比增大即有机溶剂增加可使含番茄红素的酿酒酵母细胞碎片在提取剂中更均匀的分布,扩散速度加快,但当分布空间足够大的时候,继续增加溶剂量对提取率效果影响不大[9]。为了节约有机溶剂的使用,降低试验成本,最适料液比为1∶20(g∶mL)。由图5C可知,当提取温度在30~45 ℃时,提取效果随之增加;当提取温度为45 ℃时,提取效果较高,A472nm值为0.887;当提取温度>45 ℃之后,提取效果基本稳定。因此,最适提取温度为45 ℃。由图5D可知,当提取时间为20~40 min时,提取效果随之增加;当提取时间为40 min时,提取效果最佳,A472 nm值为0.806;当提取时间>40 min之后,提取效果基本不变。因此,最适提取时间为40 min。
在单因素试验基础上,以提取温度(A)、提取时间(B)、料液比(C)为影响因素,以番茄红素提取效果(A472 nm值)为评价指标,进行3因素3水平正交试验,正交试验结果见表3。
表3 丙酮提取条件优化正交试验结果与分析
Table 3 Results and analysis of orthogonal tests for acetone extraction conditions optimization
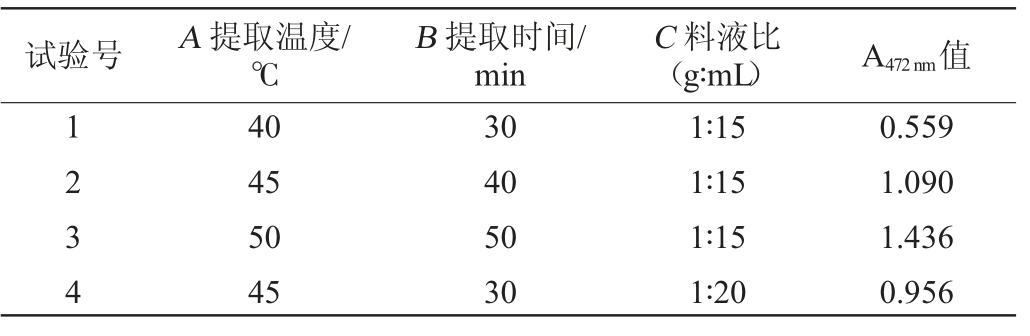
试验号 A 提取温度/℃B 提取时间/min C 料液比(g∶mL) A472 nm值1234 40 45 50 45 30 40 50 30 1∶15 1∶15 1∶15 1∶20 0.559 1.090 1.436 0.956
续表
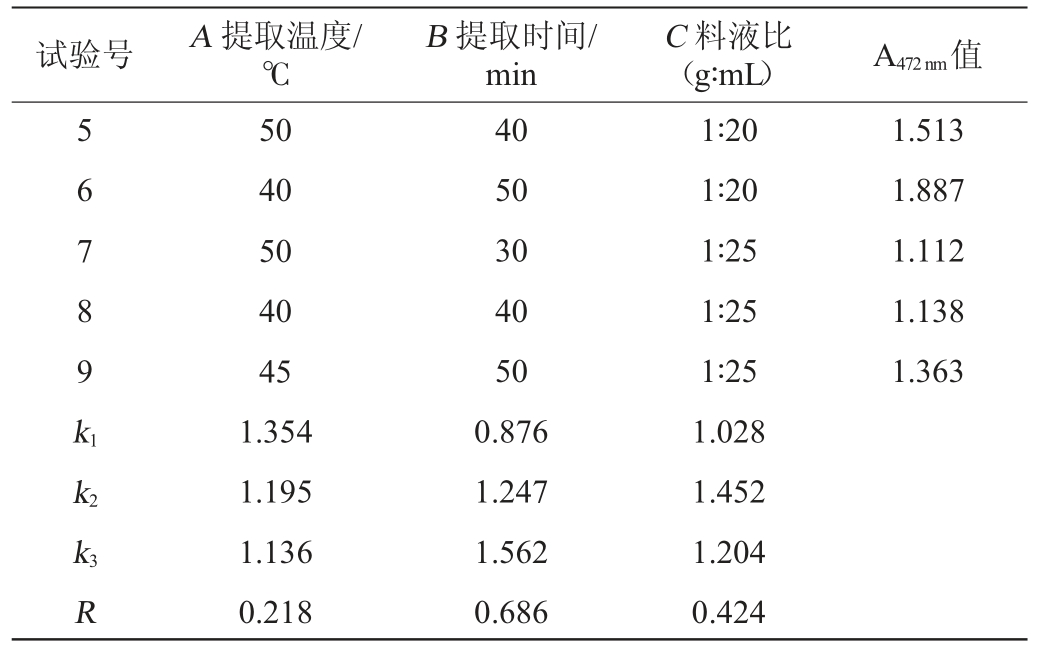
试验号 A 提取温度/℃B 提取时间/min C 料液比(g∶mL) A472 nm值5 6 7 8 9 k1 1.513 1.887 1.112 1.138 1.363 k2 k3R 50 40 50 40 45 1.354 1.195 1.136 0.218 40 50 30 40 50 0.876 1.247 1.562 0.686 1∶20 1∶20 1∶25 1∶25 1∶25 1.028 1.452 1.204 0.424
由表3可知,根据极差R可以得出,各因素影响番茄红素提取率的大小次序为B>C>A。最佳丙酮提取条件组合为A1B3C2,即提取温度40 ℃,提取时间50 min,料液比1∶20(g∶mL)。在此优化条件下,A472nm值为1.902。
2.2 番茄红素粗提物纯化工艺研究
含番茄红素的工程酿酒酵母细胞,经过上述条件优化的各个步骤依次处理(HCl酸热破壁-氢氧化纳脱脂-丙酮提取-减压回收丙酮)得到番茄红素粗提物后,采用正己烷和乙酸乙酯进行重结晶均可获得番茄红素结晶,乙酸乙酯结晶得到红色针状晶体,正己烷结晶得到红色簇状晶体,但由于乙酸乙酯对番茄红素溶解度较大、晶体产量很低,故优先选用正己烷作为结晶溶剂。
尽管全程操作尽量避光和加入抗氧化剂2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene,BHT)等操作来减少异构体,但由于操作过程中的加热、不可避免的光照等因素会造成少量番茄红素异构化,但异构化的番茄红素主要存在于结晶用正己烷的母液当中,所得番茄红素晶体纯度较高。该工艺纯化所得晶体经HPLC分析其纯度为96.7%,总提取率为76%。
2.3 酿酒酵母源提取纯化番茄红素的结构表征
为了对纯化番茄红素样品的结构进行鉴定,将纯化所得番茄红素样品进行结构核磁共振检测,样品的1H NMR谱、13C NMR谱图见图6。
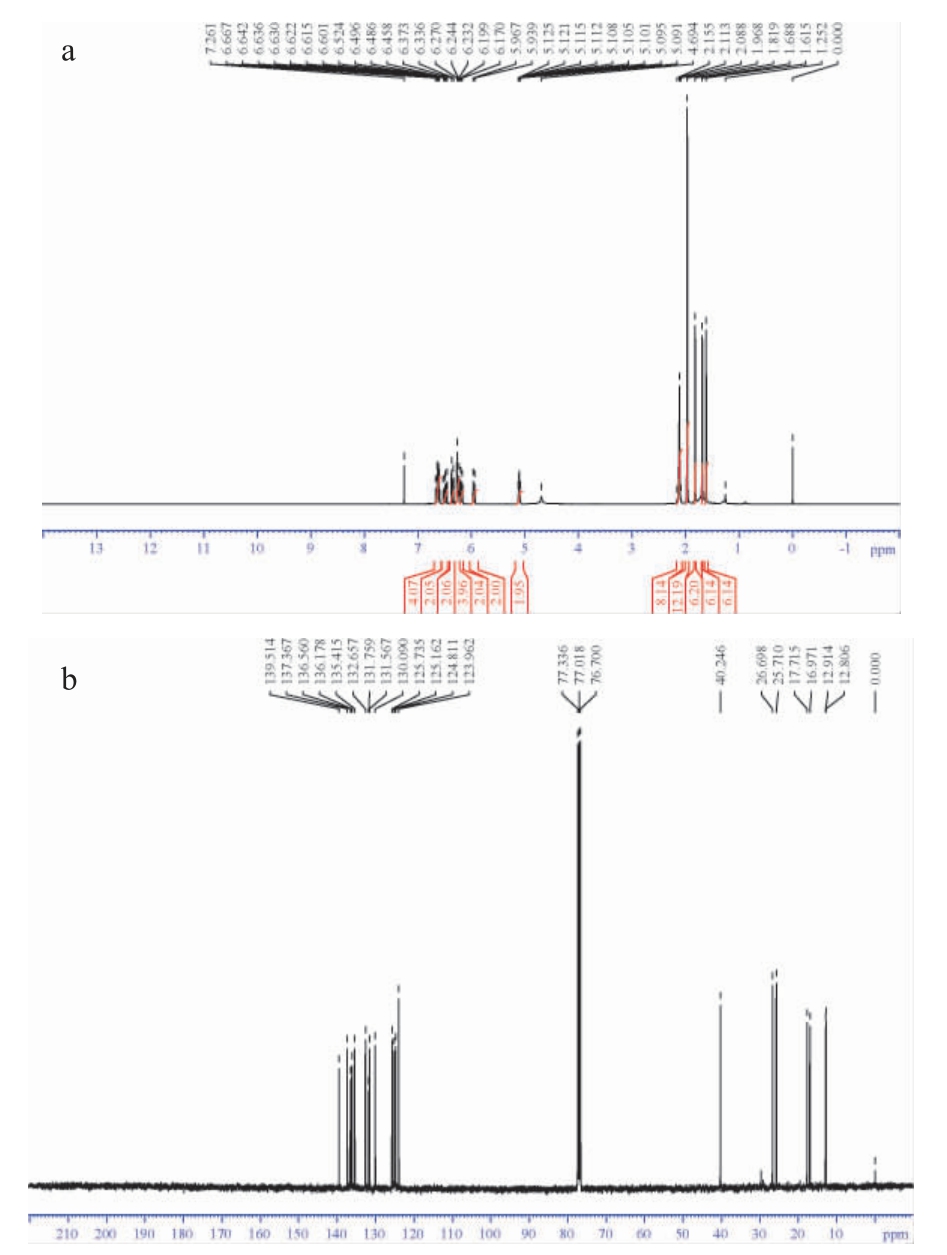
图6 纯化番茄红素样品的1H NMR谱(a)及13C NMR谱(b)
Fig.6 1H NMR spectrum (a) and 13C NMR spectrum (b) of purified lycopene samples
送检样品的1H-NMR图给出12组质子峰,根据其积分面积比(由低场至高场)为4∶2∶2∶4∶2∶2∶2∶8∶12∶6∶6∶6,共56个质子,与番茄红素lycopene的氢原子数目相符。送检样品的13C-NMR图中全去偶谱图中出现20个峰,由于番茄红素lycopene 为中心对称结构,其分子中有20个化学位移不等价碳原子,与送检样品碳谱中出现的峰的数目相符。之前有文献报道了全反式番茄红素lycopene的1H和13C的化学位移[27],酵母源番茄红素样品的1H和13C 的化学位移与其一致。综上,工程酿酒酵母源合成并纯化的番茄红素样品的结构是全反式番茄红素。
3 结论
在本研究中,针对代谢工程改造的高产番茄红素酿酒酵母BS106发酵收集的湿菌体进行番茄红素的提取纯化研究。最终确定了一套完整的针对重组酿酒酵母菌体的番茄红素提取纯化工艺,从重组酿酒酵母中提取番茄红素的最佳工艺条件为酸热破壁:盐酸浓度3.0 mol/L,用量3.0 mL/0.1 g菌体,酸化时间60 min,酸化温度45 ℃;NaOH脱脂:NaOH浓度0.10 mol/L、NaOH用量2.0 mL/0.1g菌体、皂化时间30 min,皂化后水浴温度40 ℃;丙酮提取:料液比1∶20(g∶mL),提取温度40 ℃,提取时间50 min。纯化工艺为正己烷析晶:40 ℃下用正己烷将粗提物溶解过滤,-20 ℃析晶12 h。在该优化工艺下番茄红素提取率为76%,纯度为96.7%。最后对提取纯化的番茄红素的结构进行鉴定,经过核磁共振检测,证明纯化得到的番茄红素结构为全反式。
这将有利于推进工程酿酒酵母产番茄红素未来的工业化应用。后续将深化研究,进一步提升工程酿酒酵母产番茄红素的提取率以及提取规模的扩大。
[1]石彬,邓小敏.生物技术合成番茄红素的研究进展[J].华中农业大学学报,2023,42(4):244-253.
[2]梁凡,黎晨晨,李紫硕,等.番茄红素生物活性功能及其在食品中的应用研究[J].农产品加工,2022(11):94-98.
[3]乔强.番茄红素保健功能研究及其应用进展[J].现代食品,2022,28(13):20-22.
[4]刘琨毅,刘祥宇,王琪,等.D-最优混料设计优化富含番茄红素复合果蔬酒的主料配比[J].中国酿造,2022,41(2):164-169.
[5]丁敏,李阔,张悦,等.马克斯克鲁维酵母发酵番茄浆工艺条件优化及抗氧化能力分析[J].中国酿造,2023,42(8):179-185.
[6]殷实,唐紫雯,刘冬菊,等.番茄红素在雄性生殖领域上的研究进展[J].西南民族大学学报(自然科学版),2023,49(1):18-23.
[7]GAO X M,LIN B W,CHEN C,et al.Lycopene from tomatoes and tomato products exerts renoprotective effects by ameliorating oxidative stress,apoptosis,pyroptosis,fibrosis,and inflammatory injury in calcium oxalate nephrolithiasis:the underlying mechanisms[J].Food Funct,2024,15(8):4021-4036.
[8]范芳芳,魏宁果,邹力,等.番茄红素的提取工艺优化及应用[J].农产品加工,2022(17):35-38.
[9]干建松,余九霞.圣女果中番茄红素的提取工艺研究[J].食品工程,2022(3):26-29.
[10]霍书香,杨清山,岳新海,等.番茄皮中番茄红素含量测定方法[J].食品工业,2019,40(6):263-265.
[11]李传天,马雪红,朱金芳,等.不同温度对番茄红素原料和胶束中番茄红素异构体的影响[J].食品安全质量检测学报,2023,14(12):187-194.
[12]王记莲.响应面法优化番石榴中番茄红素的提取工艺及其抗氧化活性研究[J].食品科技,2021,46(9):239-245.
[13]李杰,罗建成,李慧星,等.响应面分析法优化西瓜番茄红素提取工艺条件[J].食品研究与开发,2017,38(10):53-58.
[14]LI L,LIU Z,JIANG H,et al.Biotechnological production of lycopene by microorganisms[J].Appl Microbiol Biotechnol,2020,104(24):10307-10324.
[15]WANG Y H, ZHANG R R, YIN Y, et al.Advances in engineering the production of the natural red pigment lycopene: A systematic review from a biotechnology perspective[J].J Adv Res,2023,46:31-47.
[16]孙瑞,尚坤,武琪琪,等.番茄红素生物合成及抗氧化研究进展[J].食品科技,2023,48(6):246-252,260.
[17]李方迪,李由然,张梁,等.代谢改造酿酒酵母生产番茄红素[J].食品与发酵工业,2022,48(23):25-33.
[18]苟宗芹,音提扎尔·吐尔逊买买提,田园,等.响应面法优化大肠杆菌异源合成番茄红素[J].食品与发酵工业,2022,48(15):110-117.
[19]OTTO M,LIU D,SIEWERS V.Saccharomyces cerevisiae as a heterologous host for natural products[J].Methods Mol Biol,2022,2489:333-367.
[20]CHEN Y, XIAO W H, WANG Y, et al.Lycopene overproduction in Saccharomyces cerevisiae through combining pathway engineering with host engineering[J].Microb Cell Fact,2016,15(1):113-116.
[21]SHI B,MA T,YE Z L,et al.Systematic metabolic engineering of Saccharomyces cerevisiae for lycopene overproduction[J]. J Agr Food Chem,2019,67(40):11148-11157.
[22]ZHOU K,YU C,LIANG N,et al.Adaptive evolution and metabolic engineering boost lycopene production in Saccharomyces cerevisiae via enhanced precursors supply and utilization[J].J Agr Food Chem,2023,71(8):3821-3831.
[23]ZHU F Y,LU L,FU S,et al.Targeted engineering and scale up of lycopene overproduction in Escherichia coli[J]. Process Biochem, 2015, 50(3):341-346.
[24]MA T,SHI B,YE Z L,et al.Lipid engineering combined with systematic metabolic engineering of Saccharomyces cerevisiae for high-yield production of lycopene[J].Metab Eng,2019,52:134-142.
[25]杨阳,刘蕊,王英明,等.番茄红素提纯工艺条件的研究[J].中国酿造,2016,35(3):111-113.
[26]张雅琦.番茄红素提取提纯方法的研究进展[J].农产品加工,2019,12(6):84-86.
[27]TAKEHARA M,NISHIMURA M,KUWA T,et al.Characterization and thermal isomerization of(all-E)-lycopene[J].J Agr Food Chem,2014,62(1):264-269.