淀粉是烟叶中含量丰富的生物大分子物质,烤烟叶片中的淀粉含量可达40%[1]。烟叶中淀粉、果胶、纤维素等生物大分子物质的含量对烟叶质量和人体健康有较大影响[2-3],一方面,大分子物质含量较高往往会导致烟叶燃烧不完全,释放更多如丙烯醛、杂环胺类化合物和苯并芘等的有害物质[4-5];另一方面,这些大分子物质含量过高会影响烟叶的烟气特性,降低感官品质,其中淀粉含量在感官评价中与总体评价呈负相关[6]。烟叶淀粉分解后产生的还原糖除可与游离氨基酸发生美拉德反应增加风味物质外[7],还可进一步转化为有机酸,减少烟叶燃烧过程中的刺激性气味[8]。因此,降低烟叶淀粉含量已成为提升烟草品质和降低其健康危害的关键问题[9]。
目前,从烟草培育到烟叶采收烘烤,再到最终的卷烟加工,已有多种方法被应用于降低烟叶中的淀粉含量以提升烟草品质[10]。在烟草栽培阶段,通过对氮肥施加量和施加方式的控制可以改变烟叶中的淀粉含量[11-12]。烟叶采收烘烤阶段,烟叶中的淀粉含量会随着烘烤时间的增加呈现出线性降低[13]。在工业醇化加工阶段,应用微生物酶制剂降解大分子物质来提高烟叶质量和降低健康危害取得了重要的进展,近年来,使用淀粉酶处理烟叶已成为了烟草行业的重点[14]。
淀粉酶是一种水解酶,可以高效且专一降解淀粉产生单糖等糖类物质,目前已经在多种工业大量应用,已经占到了全球酶市场的65%[15-17]。由于微生物淀粉酶具有广泛的生化多样性、大规模培养的可行性、极端条件下的高度稳定性和易于遗传操作等特点,在工业上有着广泛的应用[18-19],而工业淀粉酶制剂生产用到最多的是芽孢杆菌属(Bacillus sp.)微生物[20]。为了实现淀粉酶制剂更好地在烟叶醇化过程中的应用,国内外对烟草源产淀粉酶的微生物进行了相关研究,如GONG Y N等[21]在烤烟叶片上筛选分离到一株解淀粉类芽孢杆菌(Paenibacillus amylolyticus)A17,利用该菌制得的淀粉酶制剂用于醇化烟叶可以大幅降低淀粉含量,产生更多的香气成分;于少藤等[22]在自然醇化烟叶上分离到一株盖氏假单胞菌(Pseudomonas gessardii)yc10,通过对其发酵条件进行优化后,烟叶中的淀粉降解效果得到显著提升;王勇[23]在烟草根际土壤中分离到一株枯草芽孢杆菌(Bacillus subtilis)B5221,由其制得的菌酶复合制剂在对烤烟进行喷施和发酵处理后,总糖和还原糖等致香前体物质大幅增加,有助于提升烟草的感官品质。目前的研究主要围绕烟草源产淀粉酶菌株的筛选进行,而对菌株产酶能力的提升和利用其制备固体酶制剂的研究开展较少,因此,开展产酶条件优化和制备固体酶制剂是利用烟草源微生物生产酶制剂从而应用于烟叶感官提升的关键。
本研究从37株烟草源产淀粉酶的细菌和真菌中筛选高产淀粉酶的菌株,并结合形态学观察、生理生化试验和分子生物学技术对筛选菌株进行鉴定,通过单因素试验对其产酶条件进行优化,并对粗酶液进行澄清,对淀粉酶进行分离纯化,制备固体淀粉酶制剂,研究其稳定性,以期为后续淀粉酶制剂的高效制备和应用提供菌种资源和研究基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
以酶制剂生产所要求的安全性微生物菌种为范围[24],选择具有产淀粉酶潜力的20株细菌(MK10033、MK10047、MK10141~MK10145、MK10152和MK10154~MK10168)和17株真菌(MK30101、MK30128和MK30130~MK30145)为供试菌株,这些菌株前期从植烟土壤中分离筛选获得,保藏于本实验室。
1.1.2 化学试剂
氯化钠、氯化铵、氯化钙、碘、碘化钾、琼脂粉、磷酸氢二钠、磷酸缓冲盐溶液(phosphate buffer saline,PBS)、硫酸铵、氢氧化钾、亚甲基蓝(均为分析纯):美国Sigma公司;酵母提取物、胰蛋白胨、牛肉膏(均为生化试剂):英国Oxoid公司;2×Taq聚合酶链式反应(polymerase chain reaction,PCR)Mix:南京诺唯赞生物科技股份有限公司;无水乙醇、葡萄糖、可溶性淀粉(均为分析纯):国药集团化学试剂有限公司;可溶性淀粉标准品:湖州展望药业有限公司;玉米粉、豆饼粉:市售。其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
LB液体培养基[25]:氯化钠10 g/L,胰蛋白胨10 g/L,酵母提取物5 g/L,pH自然,121 ℃灭菌30 min。LB固体培养基:在LB液体培养基的基础上添加琼脂粉18 g/L。
马铃薯葡萄糖琼脂(potatodextroseagar,PDA)培养基[26]:新鲜去皮马铃薯200 g/L,葡萄糖20 g/L,琼脂18 g/L,pH自然,121 ℃灭菌30 min。
细菌初筛培养基[25]:可溶性淀粉10 g/L,蛋白胨10 g/L,氯化钠5 g/L,牛肉膏5 g/L,琼脂粉18 g/L,pH自然,121 ℃灭菌30 min。
真菌初筛培养基[27]:蛋白胨10 g/L,氯化钠5 g/L,牛肉膏5 g/L,琼脂粉18 g/L,蒸馏水1 L,pH自然,121 ℃灭菌30 min;可溶性淀粉20 g/L,放置于105 ℃干热处理2 h,无菌条件下加入冷却到50 ℃左右的培养基中,混匀后倒平板。
液体产酶培养基[25]:豆饼粉40 g/L,玉米粉30 g/L,磷酸氢二钠8 g/L,硫酸铵4 g/L,氯化铵2 g/L,氯化钙4 g/L,pH 6.50,121 ℃灭菌30 min。
1.2 仪器与设备
BD260生化培养箱:德国Binder公司;BCE622-1CCN电子天平:德国Sartorius公司;CX40显微镜:舜宇光学科技有限公司;HCB-1300V超净工作台、HYC-310医用冷藏箱、W-86L578ST超低温冰箱:青岛海尔生物医疗股份有限公司;GF54DA灭菌锅:厦门致微仪器有限公司;DYY-5D水平电泳仪:北京六一仪器厂;ChemiScope 6200 Touch荧光凝胶成像系统:上海勤翔科学仪器有限公司;S210-K台式pH计:瑞士Mettler Toledo公司;TQZY-5020C恒温振荡培养箱:天津市泰斯特仪器有限公司;Nexus gradient PCR仪、5910R台式高速冷冻离心机:德国Eppendorf公司;UH5300紫外可见分光光度计:日本Hitachi公司;Alpha2-4LSCbasic冷冻干燥机:德国Christ公司;DC-0204干式真空泵:海宁大成过滤设备有限责任公司;Cascada 3.1超纯水机:美国Avidity公司。
1.3 方法
1.3.1 高产淀粉酶菌株的筛选
初筛:将供试细菌菌株划线接种于LB固体培养基,30 ℃活化培养16 h;挑取少量菌体点接于细菌初筛培养基平板上,30 ℃恒温培养48 h后,加入5 mL细菌用碘染色液染色,如果菌株具有淀粉酶活性,则菌落周围会因淀粉水解而出现透明圈,使用游标卡尺测定透明圈直径(H)和菌落直径(C),计算H/C值。将供试真菌菌株划线接种至PDA培养基,30 ℃培养48 h;采用打孔器打取边缘菌丝,接种至真菌初筛培养基平板上,30 ℃恒温培养48 h后,加入5 mL真菌用碘染色液染色,使用游标卡尺测定透明圈直径(H)和菌落直径(C),并计算H/C值。
复筛:将初筛菌株接种至5 mL LB液体培养基中,32 ℃、200 r/min条件下培养16 h获得种子液。按照4%(V/V)的接种量将种子液转接到装液量为50 mL/500 mL,初始pH为6.5的液体产酶培养基中,32 ℃、200 r/min条件下振荡培养40 h。将所得发酵液在4 ℃条件下8 000 r/min离心20 min,取上清液测定淀粉酶活力,复筛高产淀粉酶的菌株。
1.3.2 淀粉酶活力测定
参照GB1886.174—2024《食品安全国家标准食品添加剂食品工业用酶制剂》[28]采用紫外分光光度法测定淀粉酶活力。
淀粉酶酶活的定义:1 mL液体酶制剂(或1 g固体酶粉)在pH 6.0、温度60 ℃条件下,1 h液化可溶性淀粉1 g所需的酶量为一个酶活单位,U/mL。
1.3.3 高产淀粉酶菌株的鉴定
形态学观察:将筛选菌株接种于LB固体培养基,30 ℃恒温培养48 h,观察并记录单菌落的大小、形状、颜色、透明度等情况。使用美兰染色法对菌株进行染色[29],通过显微镜对菌株微观形态进行观察。
生理生化试验:参照《伯杰氏细菌鉴定手册》[30]对筛选菌株进行生理生化鉴定。
分子生物学鉴定:挑取少量筛选菌株接种于5 mL LB液体培养基中,37 ℃、180 r/min条件下振荡培养8 h,取1 μL菌液为模板,采用上游引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和下游引物1492R(5'-GGTTACCTTGTTACGACTT-3')对其16S rDNA基因序列进行菌落PCR扩增[31]。PCR扩增体系(20μL):1μL菌液,2μL上游引物27F(10μmol/L),2 μL下游引物1492R(10 μmol/L),10 μL 2×Taq PCR Mix,5 μL双蒸水(ddH2O)。PCR扩增条件:94 ℃预变性5 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,共30个循环;72 ℃再延伸10 min。PCR扩增产物委托睿博兴科(北京)生物技术有限公司进行测序,将得到的16S rDNA基因序列信息提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,Blast)进行同源性比对搜索,选取同源性较高的模式菌株的16S rDNA基因序列,通过MEGA7.0软件采用邻接法(neighbor-joining,NJ)构建系统发育树。
1.3.4 产淀粉酶发酵条件优化单因素试验
在方法1.3.1的基础上,依次考察发酵时间(0 h、16 h、20 h、24 h、28 h、32 h、36 h、40 h、44 h、48 h)、发酵温度(28 ℃、30℃、32℃、35℃、37℃)、装液量(40mL/500mL、50mL/500mL、60 mL/500 mL、70 mL/500 mL、80 mL/500 mL)、摇床转速(180 r/min、190 r/min、200 r/min、210 r/min、220 r/min)和初始pH(5.0、5.5、6.0、6.5、7.0)对筛选菌株产淀粉酶的影响。
1.3.5 淀粉酶的分离纯化
粗酶液的澄清:为了获得澄清发酵液,设置以下三组处理对50 mL初次离心(4 ℃条件下8 000 r/min离心20 min)后的粗酶液进行澄清试验:①粗酶液中加入1%氯化钙和1%磷酸氢二钠,混合均匀后4 ℃静置4 h;②粗酶液中加入5%硅藻土,4 ℃条件下匀速搅拌20 min,然后将上述样品在4 ℃、8 000 r/min条件下离心20 min;③粗酶液经滤纸和0.22 μm水相膜抽滤(精滤除菌)。每组处理结束后,观察粗酶液的变化,并测定澄清液体积和淀粉酶活力,计算淀粉酶回收率,其计算公式如下:
淀粉酶的分离纯化:进一步对澄清后的粗淀粉酶液进行分离纯化试验。硫酸铵盐析:各取100 mL澄清后的发酵上清液分别缓慢加入30 g、93 g、158 g硫酸铵粉末,使发酵液硫酸铵终含量为30%、40%、50%,边加入边搅拌,勿使局部浓度过高,盐析液放置冰箱4 ℃过夜。次日在4 ℃、5 000 r/min条件下离心5 min,收集沉淀,测定沉淀质量(湿酶质量)和淀粉酶活力,计算淀粉酶回收率。乙醇醇沉:各取100 mL澄清后的发酵上清液,放置于10~15 ℃冰浴中,分别缓慢加入150 mL、200 mL、250 mL事先预冷的体积分数为95%的乙醇,使乙醇的终体积分数为57.0%、63.3%、67.8%,边加入边搅拌,4 ℃静置30 min后,在4 ℃、5 000 r/min条件下离心5 min,收集沉淀,测定沉淀质量和淀粉酶活力,计算淀粉酶活回收率,其计算公式如下:
1.3.6 固体淀粉酶样品制备及稳定性试验
在最优发酵条件下制备筛选菌株MK10163的淀粉酶粗酶液,通过最佳粗酶液澄清方法和最佳淀粉酶分离纯化方法得到高淀粉酶回收率的淀粉酶固体沉淀,将沉淀用PBS重新溶解,分装于直径为15 cm的玻璃平皿中,每皿约30 mL,放置于超低温冰箱中冷冻过夜,次日将样品放于冷冻干燥机中,冷冻干燥24 h后,取出样品称质量,研磨过80目筛后装瓶,4 ℃保存。分别于制备当天、制备后第15天、第30天、第45天、第60天测定样品淀粉酶活力,并以最高酶活力计为100%计算相对酶活。
2 结果与分析
2.1 高产淀粉酶菌株的筛选结果
2.1.1 初筛
采用透明圈法测定20株细菌和17株真菌的产淀粉酶活性,得到各菌株在初筛培养基上均能产生淀粉透明圈,H/C值在1.06±0.01~5.55±0.31之间。选择细菌中H/C值较高的3株菌株(MK10143、MK10163、MK10167)和真菌中H/C值较高的2株菌株(MK30101、MK30133)进行复筛。
2.1.2 复筛
5株初筛菌株液体产酶能力见图1。由图1可知,5株初筛菌株的淀粉酶活力为(28.45±0.94)~(167.37±1.38)U/mL,其中,菌株MK10163的淀粉酶活力最高,达到(167.37±1.38)U/mL。因此,确定菌株MK10163为高产淀粉酶活力的菌株。
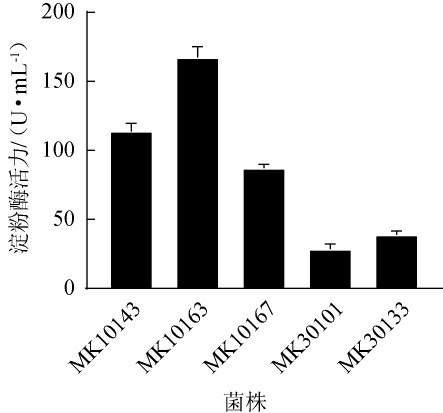
图1 初筛菌株产淀粉酶活力测定结果
Fig.1 Determination results of amylase activity produced by primary screening strains
2.2 高产淀粉酶活力菌株MK10163的鉴定
2.2.1 形态学观察
菌株MK10163的菌落形态和显微形态见图2。由图2可知,菌株MK10163的单菌落大部分呈现圆形,表面磨砂感,边缘不整齐,不透明,无光泽,有粘稠性,颜色为乳白色或灰白色;菌体呈杆状,两端钝圆,单个排列,菌体长度约1.6~2.2 μm,宽度约0.3~0.5 μm。
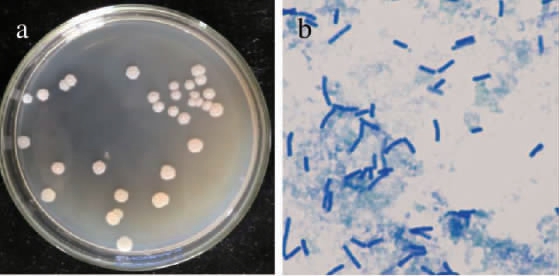
图2 菌株MK10163的菌落(a)及细胞(b)形态
Fig.2 Colony (a) and cell (b) morphology of strain MK10163
2.2.2 生理生化鉴定
菌株MK10163的部分生理生化鉴定结果见表1。由表1可知,菌株MK10163为革兰氏阳性菌,具有运动性,能够水解淀粉和明胶,不能水解酪蛋白,V.P试验、吲哚试验和甲基红试验结果均为阴性,可以分解尿素,硝酸盐还原试验、接触酶试验和氧化酶试验结果均为阳性。参照《伯杰氏细菌鉴定手册》[30],并结合形态观察结果,初步将菌株MK10163鉴定为芽孢杆菌属(Bacillus sp.)。
表1 菌株MK10163的生理生化试验结果
Table 1 Results of physiological and biochemical tests of strain MK10163

注:“-”表示结果呈阴性,“+”表示结果呈阳性。
项目 结果 项目 结果革兰氏染色淀粉水解试验酪蛋白水解试验V.P试验吲哚试验甲基红试验++----明胶水解试验硝酸盐还原试验尿素分解试验运动性试验接触酶氧化酶++++++
2.2.3 分子生物学鉴定
基于16S rDNA基因序列构建菌株MK10163的系统发育树,结果见图3。由图3可知,菌株MK10163的16S rDNA基因序列与解淀粉芽孢杆菌(Bacillus amyloliquefaciens)CP054415.1聚在系统发育树的同一分支上,亲缘关系最近。结合形态学观察和生理生化鉴定的结果,最终将菌株MK10163鉴定为解淀粉芽孢杆菌(Bacillusamyloliquefaciens)。

图3 基于16S rDNA基因序列菌株MK10163的系统发育树
Fig.3 Phylogenetic tree of strain MK10163 based on 16S rDNA gene sequences
2.3 解淀粉芽孢杆菌MK10163产淀粉酶发酵条件优化
2.3.1 发酵时间对菌株MK10163产淀粉酶的影响
不同发酵时间对菌株MK10163产淀粉酶的影响见图4。由图4可知,菌株MK10163所产淀粉酶的活力随发酵时间的延长呈先升高后降低的趋势,当发酵时间为44 h时,淀粉酶活力最高,为(186.29±5.31)U/mL。分析原因可能是,在产酶发酵过程中,前期一般酶活力增长较快,到达最高点后,由于营养物质的匮乏、pH的变化和溶解氧的不足会导致菌株产酶能力的下降,进而导致淀粉酶活力的降低[32]。因此,确定菌株MK10163的最佳发酵时间为44 h。
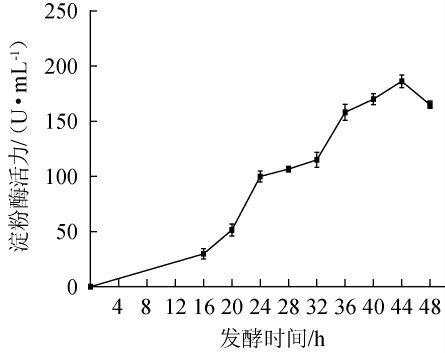
图4 发酵时间对解淀粉芽孢杆菌MK10163产淀粉酶活力的影响
Fig.4 Effect of fermentation time on amylase activities produced by strain MK10163
2.3.2 发酵温度对菌株MK10163产淀粉酶的影响
在工业生产中,适宜的温度有助于加快发酵速度,提高发酵效率,降低能耗和生产成本[33]。因此,考察不同发酵温度对菌株MK10163产淀粉酶的影响,结果见图5。由图5可知,菌株MK10163所产淀粉酶的活力在28~37 ℃的温度范围内随着发酵温度的升高呈现先升高后降低的趋势。当发酵温度为35 ℃时,淀粉酶活力最高,为(199.22±6.37)U/mL。因此,确定菌株MK10163的最佳发酵温度为35 ℃。
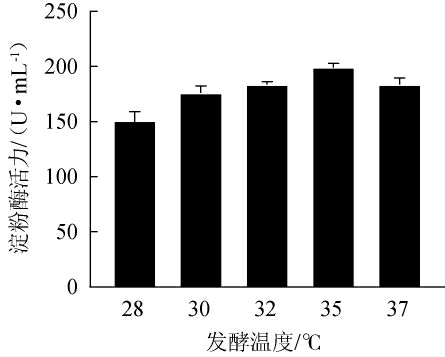
图5 发酵温度对菌株MK10163产淀粉酶活力的影响
Fig.5 Effect of fermentation temperature on amylase activities produced by strain MK10163
2.3.3 装液量对菌株MK10163产淀粉酶的影响
在液体摇瓶发酵转速一定的情况下,装液量可以影响发酵体系中的溶解氧情况,进而影响发酵产物的产率[29]。因此,考察不同装液量对菌株MK10163产淀粉酶的影响,结果见图6。由图6可知,菌株MK10163所产淀粉酶的活力随着装液量的增大呈现先升高后降低的趋势,当装液量为50 mL/500 mL时,淀粉酶活力最高,为(205.31±5.99)U/mL。因此,确定菌株MK10163的最佳装液量为50 mL/500 mL。
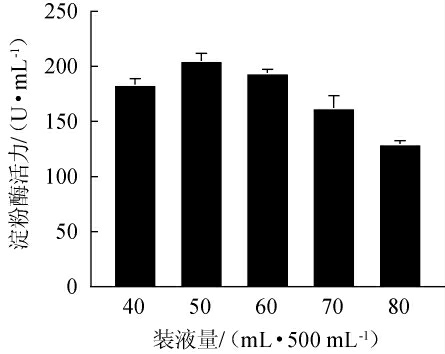
图6 装液量对菌株MK10163产淀粉酶活力的影响
Fig.6 Effect of liquid loading volume on amylase activities produced by strain MK10163
2.3.4 摇床转速对菌株MK10163产淀粉酶的影响
在液体摇瓶发酵装液量一定的情况下,摇床转速可以影响发酵体系中的溶解氧情况,进而影响发酵产物的产率[34]。因此,考察不同摇床转速对菌株MK10163产淀粉酶的影响,结果见图7。由图7可知,随着摇床转速的升高,淀粉酶活力呈先升高后下降的趋势,当摇床转速为200 r/min时,淀粉酶活力最高,达(212.35±5.24)U/mL,说明此时发酵体系中的溶解氧含量最适宜菌体生长和分泌淀粉酶。分析原因可能是,摇床转速过高,会使微生物受到较大的剪切力,导致菌株的细胞膜损伤,致使淀粉酶活力下降[35]。因此,确定菌株MK10163的最佳摇床转速为200 r/min。
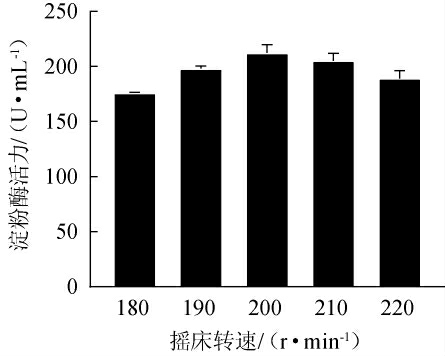
图7 摇床转速对菌株MK10163产淀粉酶活力的影响
Fig.7 Effect of shaking speed on amylase activities produced by strain MK10163
2.3.5 初始pH对菌株MK10163产淀粉酶的影响
pH对菌株产酶发酵过程有很大影响,一是会改变菌株的正常代谢活动,二是会影响菌株发酵产物的活性[36],因此适宜的pH可以促进产酶发酵。不同初始pH对菌株MK10163产淀粉酶的影响见图8。由图8可知,随着初始pH的升高,淀粉酶活力呈先升高后下降的趋势,当初始pH为6.0时,淀粉酶活力最高,为(224.63±7.34)U/mL。因此,确定菌株MK10163的最佳初始pH值为6.0。
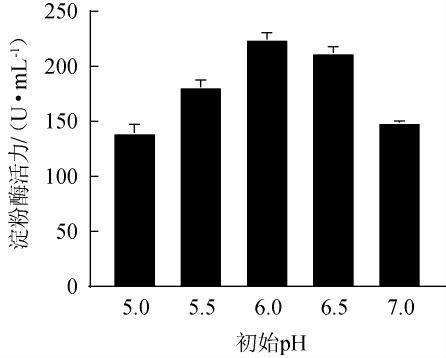
图8 初始pH对菌株MK10163产淀粉酶活力的影响
Fig.8 Effect of initial pH on amylase activities produced by strain MK10163
2.4 淀粉酶的分离纯化
2.4.1 粗淀粉酶液澄清试验
菌株MK10163的发酵液较粘稠,含有多糖等物质,通过二次离心依然很难获得澄清酶液,限制后续纯化工艺,影响酶的纯度。因此,采用不同的澄清方法对初次离心后的粗酶液进行澄清,结果见图9。由图9可知,添加1%氯化钙和1%磷酸氢二钠可使发酵离心液澄清,淀粉酶回收率最高,为(82.78±3.12)%;添加5%硅藻土没有明显澄清作用,并且淀粉酶回收率最低,为(74.43±2.89)%;滤纸和0.22 μm水相膜抽滤也可以起到澄清作用,但是抽滤时过0.22 μm水相滤膜,可能会导致部分淀粉酶被截留,淀粉酶活力损失(19.89±0.96)%。综合比较而言,添加1%氯化钙和1%磷酸氢二钠是淀粉酶回收率最高又能获得较好澄清效果的方法。
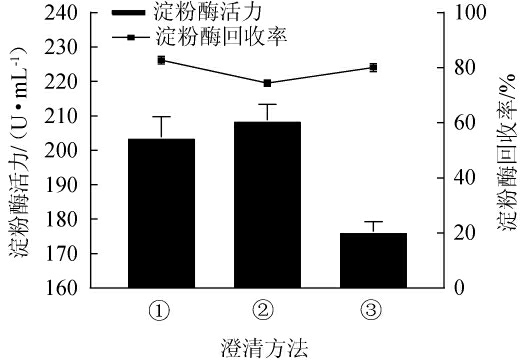
图9 粗酶液不同澄清方法的比较
Fig.9 Comparison of different clarification methods of crude enzyme solution
2.4.2 淀粉酶的分离纯化
淀粉酶分离纯化试验的结果见表2。由表2可知,硫酸铵含量为30%时,淀粉酶活力较高,随着硫酸铵含量增加,淀粉酶湿质量增加,但酶活活力下降,可能是由于硫酸铵将其他蛋白沉降导致的。醇沉获得的湿酶活力与硫酸铵盐析获得的湿酶活力有明显差异,当乙醇体积分数为63.3%和67.8%时,淀粉酶回收率和酶活较高,在此范围内,乙醇体积分数对回收率和酶活影响差异较小,从成本考虑,乙醇体积分数为63.3%的处理性价比更高。此外,工业生产中虽常用硫酸铵进行酶制剂纯化,但因为盐离子浓度高,如果用于食品工业酶制剂纯化,还需透析或过柱除盐,而用乙醇醇沉制备的酶制剂,因乙醇可以挥发,其安全性有保障。综合比较而言,发酵液与体积分数95%乙醇的体积比为1∶2的醇沉工艺是菌株MK10163所产淀粉酶的最佳分离纯化工艺。
表2 淀粉酶分离纯化试验结果
Table 2 Results of isolation and purification tests of amylase
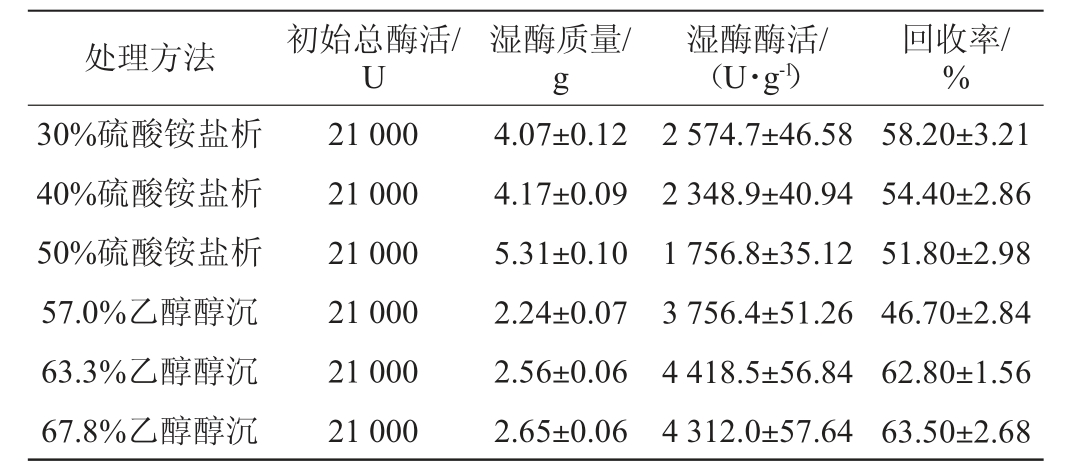
处理方法 初始总酶活/U湿酶质量/g湿酶酶活/(U·g-1)回收率/%30%硫酸铵盐析40%硫酸铵盐析50%硫酸铵盐析57.0%乙醇醇沉63.3%乙醇醇沉67.8%乙醇醇沉21 000 21 000 21 000 21 000 21 000 21 000 4.07±0.12 4.17±0.09 5.31±0.10 2.24±0.07 2.56±0.06 2.65±0.06 2 574.7±46.58 2 348.9±40.94 1 756.8±35.12 3 756.4±51.26 4 418.5±56.84 4 312.0±57.64 58.20±3.21 54.40±2.86 51.80±2.98 46.70±2.84 62.80±1.56 63.50±2.68
2.5 固体淀粉酶样品的稳定性试验
固体淀粉酶制剂的稳定性试验结果见图10。由图10可知,固体淀粉酶制剂存放60 d时仍具有(91.12±1.16)%的相对酶活,表明其具有较强的稳定性。
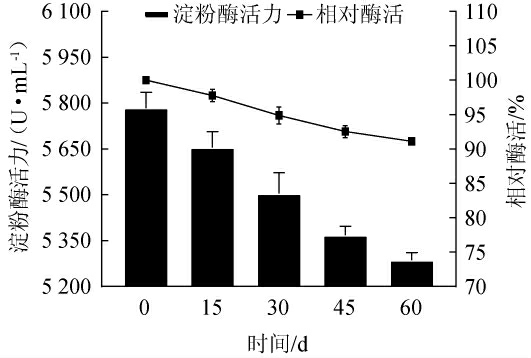
图10 固体淀粉酶样品在储藏过程中的稳定性试验结果
Fig.10 Stability test results of solid amylase samples during storage process
3 结论
本研究从分离自植烟土壤的具有产淀粉酶能力的20株细菌和17株真菌中筛选出一株高产淀粉酶的菌株MK10163,基于形态学观察、生理生化检测和分子生物学技术被鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。通过单因素试验得到解淀粉芽孢杆菌MK10163的最佳发酵产酶条件为:发酵时间44 h、发酵温度35 ℃、装液量50 mL/500 mL,摇床转速200 r/min、初始pH 6.0,在此条件下淀粉酶活力为(224.63±7.34)U/mL,相比于优化前提升了34.21%。粗酶液中的淀粉酶最佳分离纯化方法为:加入1%氯化钙和1%磷酸氢二钠,混合均匀后4 ℃静置4 h澄清,之后加入2倍体积的95%乙醇进行醇沉,收集沉淀,即为淀粉酶;通过对冷冻干燥后的固体淀粉酶进行60 d的酶活力监测,发现解淀粉芽孢杆菌MK10163产的淀粉酶在储存60 d时仍具有91.12%的相对酶活,具有较强的稳定性。综上,本研究不仅丰富了烟草源产淀粉酶的优质菌种资源,而且通过发酵工艺优化、分离纯化研究和稳定性试验验证其淀粉酶大量制备的可行性,为工业应用提供了基础。
[1]CHU K L,KOLEY S,JENKINS L M,et al.Metabolic flux analysis of the non-transitory starch tradeoff for lipid production in mature tobacco leaves[J].Metab Eng,2022,69:231-248.
[2]YAN S,REN T B,WAN MAHARI W A,et al.Soil carbon supplementation: Improvement of root-surrounding soil bacterial communities, sugar and starch content in tobacco(N.tabacum)[J].Sci Total Environ,2022,802:149835.
[3]ZHONG D, ZENG K, LI J, et al.Characteristics and evolution of heavy components in bio-oil from the pyrolysis of cellulose,hemicellulose and lignin[J].Renew Sust Energ Rev,2022,157:111989.
[4]董维杰,张忠锋,窦玉青,等.烤烟烟叶淀粉含量影响因素及其与烟叶质量关系研究进展[J].广东农业科学,2015,42(8):11-16.
[5]TIAN D Y,HUANG L,ZHANG Z,et al.A novel approach for quantitative determination of cellulose content in tobacco via 2D HSQC NMR spectroscopy[J].Carbohydr Res,2023,526:108790.
[6]CHEN X,LIU L,ZHANG Y M,et al.Acetylsalicylic acid application decreased tobacco-specific nitrosamines and its precursors but maintained quality of air-cured burley tobacco(Nicotiana tabacum L.)[J].Ind Crop Prod,2017,104:221-228.
[7]MITSUI K,DAVID F,TIENPONT B,et al.Analysis of the reaction products from micro-vial pyrolysis of the mixture glucose/proline and of a tobacco leaf extract:Search for Amadori intermediates[J].J Chromatogr A,2015,1422:27-33.
[8]朱顺成,李洪臣.不同烤烟品种美拉德反应产物的差异及其与烟叶品质的关系[J].安徽农业科学,2019,47(21):31-33.
[9]YANG Y, WANG J J, WANG C X, et al.Awareness of tobacco-related health hazards among adults in China[J].Biomed Environ Sci,2010,23(6):437-444.
[10]韩宗辰.烟草专用α-淀粉酶的基因挖掘及其表达优化[D].武汉:华中农业大学,2023.
[11]YAN S,ZHAO J Y,REN T B,et al.Correlation between soil microbial communities and tobacco aroma in the presence of different fertilizers[J].Ind Crop Prod,2020,151:112454.
[12]李洪臣,杨志晓,武云杰,等.氮肥用量和施用方式对烟草中部叶碳氮代谢的影响[J].江苏农业科学,2013,41(3):65-68.
[13]SUN J G, HE J W, WU F G, et al.Comparative analysis on chemical components and sensory quality of aging flue-cured tobacco from four main tobacco areas of China[J].Agr Sci China,2011,10(8):1222-1231.
[14]XING L,ZHANG M,LIU L L,et al.Multiomics provides insights into the succession of microbiota and metabolite during plant leaf fermentation[J].Environ Res,2023,221:115304.
[15]AHMED S A,ABDELLA M A A,EL-SHERBINY G M,et al.Application of one actor-at-a-time and statistical designs to enhance α-amylase production by a newly isolate Bacillus subtilis strain-MK1[J]. Biocatal Agr Biotech,2019,22(6):101397.
[16]GURUMALLESH P, ALAGU K, RAMAKRISHNAN B, et al.A systematic reconsideration on proteases[J].Int J Biol Macromol,2019,128:254-267.
[17]林楚迎.关于工业酶制剂的发展与应用研究[J].工业微生物,2023,53(1):64-66.
[18]ASRAT B, GIRMA A.Isolation, production and characterization of amylase enzyme using the isolate Aspergillus niger FAB-211[J].Int J Biotechnol Mol Biol Res,2018,9(2):7-14.
[19]SHARIF S,SHAH A H,FARIQ A,et al.Optimization of amylase production using response surface methodology from newly isolated thermophilic bacteria[J].Heliyon,2023,9(1):e12901.
[20]徐挺亮,唐诗哲,彭晶,等.芽孢杆菌属产α-淀粉酶的研究进展[J].生命科学研究,2019,23(1):65-72.
[21]GONG Y N, LI J J, DENG X H, et al.Application of starch degrading bacteria from tobacco leaves in improving the flavor of flue-cured tobacco[J].Front Microbiol,2023,14:1211936.
[22]于少藤,毛淑蕊,胡安妥,等.改善烟叶品质微生物的筛选及其作用效果研究[J].南京农业大学学报,2021,44(4):766-777.
[23]王勇.降解淀粉功能菌筛选及在烘烤烟叶上的应用[D].广州:华南农业大学,2017.
[24]中华人民共和国农业农村部.直接饲喂微生物和发酵制品生产菌株鉴定及其安全性评价指南[EB/OL].(2021.11.01).http://www.moa.gov.cn/nybgb/2021/202111/202112/t20211221_6385218.htm.
[25]钟丽娟,张庆华.一株饲用贝莱斯芽孢杆菌的分离鉴定及其生理特性[J].中国饲料,2021(11):26-29.
[26]杨立军,花娇娇,崔晨旭,等.一株高产胞外多糖半夏内生真菌的鉴定、发酵条件优化及生物活性测定[J].中国酿造,2023,42(11):109-114.
[27]张刚,汪天虹,张臻峰,等.产低温淀粉酶的海洋真菌筛选及研究[J].海洋科学,2002,26(2):3-5.
[28]国家卫生和计划生育委员会.GB 1886.174—2024 食品安全国家标准食品添加剂食品工业用酶制剂[S].北京:中国标准出版社,2016.
[29]BISTAS E, SANGHAVI D K.Methylene blue[M].Florida: StatPearls Publishing,2024:190-192.
[30]布坎南R E,吉本斯N E.伯杰氏细菌鉴定手册[M].北京:科学出版社,1984:729-740.
[31]FU Z H,ZHONG L B,TIAN Y,et al.Identification of cellulose-degrading bacteria and assessment of their potential value for the production of bioethanol from coconut oil cake waste[J]. Microorganisms, 2024, 12(2):240.
[32]CUI J N,HU W,LIU Y X,et al.Isolation and screening of high-yielding α-amylase mutants of Bacillus subtilis by heavy ion mutagenesis[J].Appl Biochem Biotechnol,2023,195(1):68-85.
[33]依妮皮姑丽·麦麦提依明,艾麦尔江·麦提库尔班,阿依安·布胡达西,等.一株产α-淀粉酶芽孢杆菌的分离及产酶条件优化[J].中山大学学报(自然科学版),2017,56(4):126-132.
[34]CUI G.Analysis of effects of initial medium volume on the fermentation production[J].Amino Acid Bio Res,2013,35(1):35-38.
[35]白茹玉,石彦鹏,张萍.不同培养条件对林可链霉菌种子液代谢影响[J].中国兽药杂志,2022,56(3):53-59.
[36]李正风,张鹏,王萝萍,等.摩加夫芽孢杆菌产酶条件优化及对烟叶品质的影响[J].中国烟草科学,2023,44(3):69-76.