澳洲坚果(Macadamia ternifolia)又名夏威夷果、澳洲胡桃、昆士兰栗等,是山龙眼科(Proteaceae)澳洲坚果属(Macadamia F.Muell)的常绿乔木果树,原产于澳大利亚昆士兰东南部和新南威尔士东北部沿岸的亚热带雨林地区[1-2]。1981年澳洲坚果被云南省热带作物科学研究所首次引入云南试种[3],2020年末云南省澳洲坚果种植面积达23.53万hm2[4],目前,云南省已成为我国乃至世界上最大的澳洲坚果种植区[5-6]。澳洲坚果果实具有很高的营养价值,脂肪含量在70%以上,且多为不饱和脂肪酸如油酸、棕榈油酸等[7],蛋白质含量为8%~20%[8],此外还含有丰富的酚类、黄酮类、醛类、酯类等功能成分,具有较好的抗氧化、降血脂、抗衰老、抗癌等功效[9-12]。
澳洲坚果蜂蜜是蜜蜂采集澳洲坚果花蜜,经工蜂充分酿造而成的单花种蜂蜜。坚果树花序枝条长,花朵数量多且花期长,流蜜量大[13],故澳洲坚果蜂蜜的产量可观,随着云南省澳洲坚果种植面积的不断扩大,澳洲坚果蜂蜜逐渐成为云南主要的特色蜂蜜。目前,国内外有少量文献研究了澳洲坚果蜂蜜的感官品质[14]、理化性质[15-16]、挥发性风味成分[13,17]、蜂蜜糖组分[18]等,研究主要集中在蜜种识别上。而蜂蜜中具有丰富的微生物资源[19],特别是蜂蜜特殊的低含水量、高含糖量的极端条件,为一些耐高渗酵母菌的生长提供了有利的环境[20]。目前,已报道在蜂蜜中分离得到的酵母菌多达20余种[21],不同蜂蜜中的酵母菌种类和特性具有一定的差异,澳洲坚果蜂蜜作为新兴的特色蜜种,其中的酵母菌资源有待开发利用。
本研究采用传统培养方法从澳洲坚果蜂蜜中分离酵母菌,通过形态学观察及分子生物学技术对其进行菌种鉴定,并对菌株的耐受性进行分析,以期从澳洲坚果蜂蜜中筛选出生长性能较优的耐高渗酵母菌菌种,为酵母菌资源利用提供数据支持。
1 材料与方法
1.1 材料与试剂
1.1.1 样品采集
澳洲坚果蜂蜜3份,JG01样品:2021年3月采自云南省临沧市耿马县;JG02样品:2022年3月采自云南省临沧市永德县;JG03样品:2022年3月采自云南省保山市隆阳区潞江坝。
1.1.2 试剂
酵母基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)快速抽提试剂盒、DNA分子质量标准Marker、6×蔗糖凝胶上样缓冲液:生工生物工程(上海)股份有限公司;无水乙醇(分析纯):成都市科隆化学品有限公司;蛋白胨、琼脂粉、酵母浸出粉(均为生化试剂):北京奥博星生物技术有限责任公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基[22]:取去皮马铃薯200 g,切块,煮沸20 min,冷却过滤,添加葡萄糖20 g,琼脂粉20 g,蒸馏水定容至1 000 mL,121 ℃高压蒸汽灭菌20 min。不添加琼脂粉则为马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基[23]:酵母浸出粉10 g,蛋白胨20 g,葡萄糖20 g,蒸馏水定容至1 000 mL,115 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
TST-RO-10离子交换纯水机、WPL-125BE电热恒温培养箱、YC-R50恒温培养摇床:天津市泰斯特仪器有限公司;LDZM-40KCS-11立式压力蒸汽灭菌锅:上海申安医疗器械厂;SW-CJ-2FD洁净工作台:苏州安泰空气技术有限公司;UV-1900紫外可见光分光光度计:上海美谱达仪器有限公司;AE 224电子天平:上海舜宇恒平科学仪器有限公司;TGL-16M冷冻离心机:湖南湘仪仪器有限公司;FE28-Standard pH计:梅特勒-托利多公司;EPS-600电泳仪、Tanon 4600 SF全自动荧光化学发光成像系统:上海天能科技有限公司;OLYMPUS CX33显微镜:日本奥林巴斯公司。
1.3 方法
1.3.1 酵母菌的分离纯化
准确称取10 g蜂蜜样品,加入装有90 mL无菌水的锥形瓶中,充分混匀,以10倍梯度稀释法稀释至10-6。梯度稀释后,取不同稀释度的样品悬液100 μL,涂布于PDA培养基平板,倒置于28 ℃的恒温培养箱中,培养3 d后观察菌落形态特征。使用接种环挑取具有典型酵母菌特征的菌落,在PDA培养基上进行划线纯化至得到纯菌菌落。
挑取单一菌落至PDB培养基中,28℃恒温振荡(200r/min)培养24 h,连续培养两代,按酵母菌液∶二甲基亚砜=9.5∶0.5(V/V)的比例添加无菌二甲基亚砜溶液,混匀后于-80 ℃冷冻保藏。保藏菌种使用前需进行活化,即将菌种划线接种于PDA培养基中,28 ℃活化培养3 d。
1.3.2 酵母菌的鉴定
形态学观察:根据《酵母菌的特征与鉴定手册》[24],将纯化后的酵母菌菌株分别接种于PDA培养基上,28 ℃培养3 d,观察并记录酵母菌菌株的菌落颜色、形状、大小、湿润度、边缘、表面光滑度等特征,对酵母菌进行初步判断。同时采用嗅闻法[25]筛选酯香味强的菌株。挑取单一菌落,使用亚甲基蓝染色,并在光学显微镜物镜(40×)下观察菌体形态,记录菌体形态和出芽情况。
分子生物学鉴定:使用酵母基因组DNA快速抽提试剂盒提取筛选得到的酵母菌株的总DNA,以其为模板,采用通用引物NS1(5'-GTATCATATGCTTGTCTC-3')和NS8(5'-TCCGCAGGTTCACCTACGGA-3')对18S rDNA基因序列进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。PCR扩增体系:PCR Buffer(×10)4 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)(2.5 mmol/L)3.2μL,rTaq酶(5U/μL)0.2μL,引物NS12μL,引物NS8 2 μL,DNA模板2 μL,双蒸水(ddH2O)补充至40 μL。PCR扩增条件:95 ℃预变性3 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸90 s,30个循环;72 ℃再延伸10 min。PCR扩增产物经1%琼脂糖凝胶电泳检测合格后委托生工生物工程(上海)股份有限公司进行测序。将测序得到的DNA序列提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,通过基于局部比对算法的搜索工具(basic local alignment search tool,BLAST)程序进行同源性搜索比对,选取同源性较高的模式菌株的18S rDNA基因序列,采用MEGA 7.0软件以邻接(neighbor-joining,NJ)法构建系统发育树,自展值(bootstrap value)分析设置重复1 000次。
1.3.3 酵母菌的生长特性
乙醇耐受性:调整YPD培养基中乙醇体积分数分别为1%、3%、5%、7%、9%,按照1%(V/V)的接种量将活化的筛选菌株接种于YPD培养基中,装液量为100 mL/250 mL,置于28 ℃、200 r/min的恒温摇床中培养,培养48 h后用分光光度计测定OD600nm值,考察酵母菌的乙醇耐受性。
pH耐受性:调整YPD培养基的pH分别为2.0、3.0、4.0、5.0、6.0,按照1%(V/V)的接种量将活化的筛选菌株接种于YPD培养基中,装液量为100 mL/250 mL,置于28 ℃、200 r/min的恒温摇床中培养,培养48 h后用分光光度计测定OD600nm值,考察酵母菌的酸耐受性。
NaCl耐受性:调整YPD培养基中NaCl含量分别为5%、10%、15%、20%、25%,按照1%(V/V)的接种量将活化的筛选菌株接种于YPD培养基中,装液量为100 mL/250 mL,置于28 ℃、200 r/min的恒温摇床中培养,培养48 h后用分光光度计测定OD600nm值,考察酵母菌的NaCl耐受性。
葡萄糖耐受性:调整YPD培养基中葡萄糖含量分别为20%、30%、40%、50%、60%,按照1%(V/V)的接种量将活化的筛选菌株接种于YPD培养基中,装液量为100 mL/250mL,置于28 ℃、200 r/min的恒温摇床中培养,培养48 h后用分光光度计测定OD600nm值,考察酵母菌的葡萄糖耐受性。
1.3.4 生长曲线的测定
将活化后的筛选菌株接种于YPD培养基,置于28 ℃、200 r/min的恒温摇床中培养24 h,获得种子液。按照1%(V/V)的接种量将种子液接种于YPD培养基中,装液量为100 mL/250 mL,28 ℃、200 r/min恒温培养48 h,每隔3 h无菌取样,采用分光光度计测定OD600 nm值。以培养时间为横坐标,OD600nm值为纵坐标,绘制酵母菌的生长曲线。
1.3.5 数据处理与分析
每个试验重复3次,使用Excel 2019和Origin 9.1软件处理数据和绘图。
2 结果与分析
2.1 酵母菌的分离筛选
经过3次平板划线培养,从3份坚果蜂蜜样品中共分离筛选到6株具有酯香味的酵母菌疑似菌株。其中,临沧市耿马县坚果蜂蜜样品(JG01)中分离得到3株,命名为JG01-8、JG01-15和JG01-H4;临沧市永德县坚果蜂蜜样品(JG02)中分离得到2株,命名为JG02-9和JG02-11;保山市隆阳区潞江坝坚果蜂蜜样品(JG03)中分离得到1株,命名为JG03-1。
2.2 酵母菌的鉴定
2.2.1 形态学鉴定
观察6株疑似酵母菌的菌落特征与细胞形态,结果见图1和表1。由图1及表1可知,6株菌的菌落形状都呈圆形,颜色大部分呈白色,少数呈乳黄色或红色,菌落边缘整齐、表面光滑。6株酵母菌的细胞形态呈腊肠形和椭圆形,均观察到典型酵母菌的出芽繁殖方式,初步认为这6株菌为酵母菌。
表1 澳洲坚果蜂蜜样品中6株疑似酵母菌的形态学特征
Table 1 Morphological characteristics of 6 suspected yeasts from Macadamia ternifolia honey samples
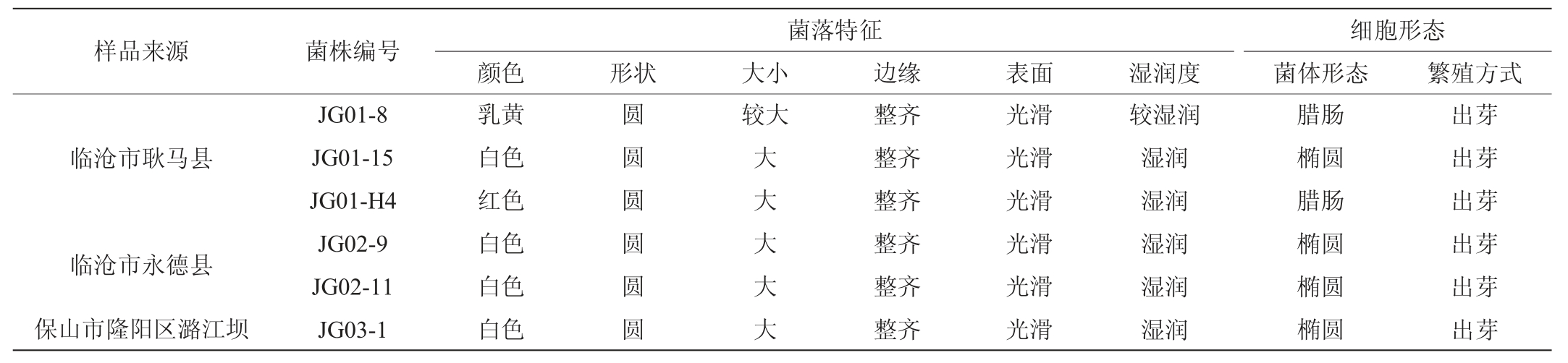
临沧市耿马县临沧市永德县保山市隆阳区潞江坝样品来源 菌株编号JG01-8 JG01-15 JG01-H4 JG02-9 JG02-11 JG03-1菌落特征颜色 形状 大小 边缘 表面乳黄白色红色白色白色白色圆圆圆圆圆圆较大大大大大大整齐整齐整齐整齐整齐整齐光滑光滑光滑光滑光滑光滑湿润度较湿润湿润湿润湿润湿润湿润细胞形态菌体形态 繁殖方式腊肠椭圆腊肠椭圆椭圆椭圆出芽出芽出芽出芽出芽出芽
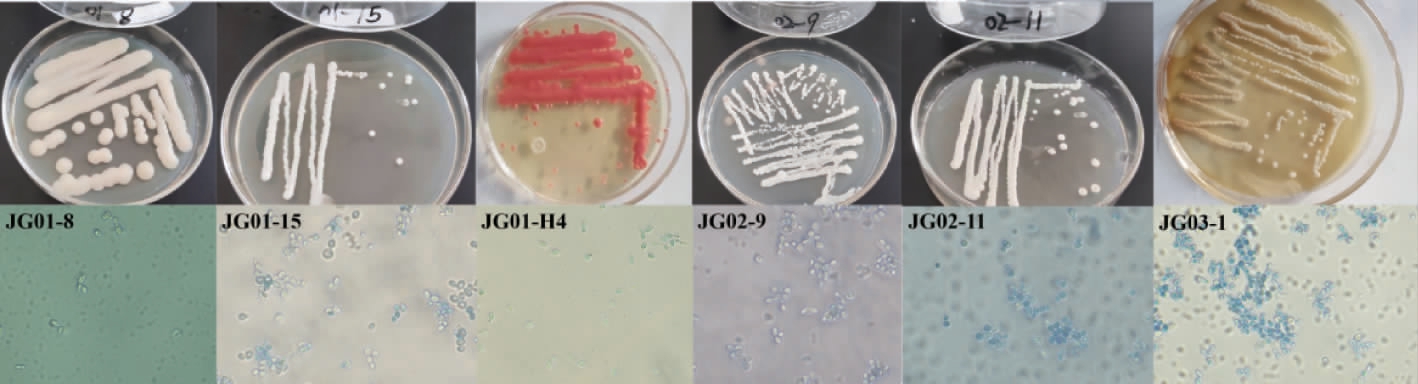
图1 澳洲坚果蜂蜜样品中6株疑似酵母菌的菌落和细胞形态
Fig.1 Colony and cell morphology of 6 suspected yeasts in Macadamia ternifolia honey samples
2.2.2 分子生物学鉴定
基于18S rDNA基因序列构建6株酵母菌的系统发育树,结果见图2。

图2 基于18S rDNA基因序列6株酵母菌株的系统发育树
Fig.2 Phylogenetic tree of 6 yeasts based on 18S rDNA gene sequence
由图2可知,菌株JG01-15、JG02-9、JG02-11和JG03-1与鲁氏接合酵母(Zygosaccharomyces rouxii)(KT199372.1)聚于一支,亲缘关系最近,因此,鉴定这4株菌株为鲁氏接合酵母(Z.rouxii);菌株JG01-8与微黄汉纳酵母(Hannaella luteola)(NG 063467.1)聚于一支,亲缘关系最近,因此,鉴定其为H.luteola;菌株JG01-H4与赭色掷孢酵母(Sporobolomyces carnicolor)(KJ708434.1)聚于一支,亲缘关系最近,因此,鉴定其为赭色掷孢酵母(S.carnicolor)。接合酵母属和汉逊酵母属的许多菌株已经在蜂蜜中分离得到[21],而关于蜂蜜中掷孢酵母属的报道较少,应以坚等[26-27]曾从植物叶片中分离得到掷孢酵母,有研究认为蜂蜜中的酵母菌可能来自植物花粉、叶片、种植区的空气、土壤等环境[28],KOGAN H V等[29]研究发现,环境中的酵母菌可以在蜜蜂消化道内定植,因此,澳洲坚果蜂蜜中的S.carnicolor JG01-H4可能来自坚果叶片,被蜜蜂带入到蜂蜜中,但该菌株是否曾定植在蜜蜂消化道内,有待进一步研究。
2.3 耐受性分析
2.3.1 乙醇耐受性
筛选菌株的乙醇耐受性结果见图3。
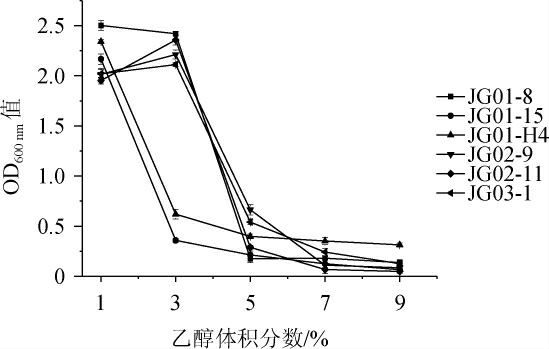
图3 不同乙醇体积分数对6株酵母菌生长的影响
Fig.3 Effects of different ethanol volume fraction on the growth of 6 yeasts
乙醇含量影响酵母菌细胞膜和细胞壁的稳定性[30],环境中乙醇体积分数越高,对酵母菌细胞的毒害作用越大,最终导致酵母生长缓慢甚至死亡,因此,酵母菌株的乙醇耐受性与其发酵性能密切相关[31]。由图3可知,当乙醇体积分数为1%时,6株酵母菌均表现出较好的生长趋势;当乙醇体积分数为3%时,菌株JG02-9、JG02-11和JG03-1的生长呈现向好的趋势,对菌株JG01-8的生长影响较小,表明这3株菌更适合在含有少量乙醇的环境中生长,而菌株JG01-15和JG01-H4的生长明显受到抑制;当乙醇体积分数≥5%时,6株酵母菌的生长均受到抑制。但值得注意的是,菌株JG01-H4在乙醇体积分数为7%、9%环境中的生长情况均优于其他5株菌,表明菌株JG01-H4在高乙醇环境中的耐受性较好。
2.3.2 pH耐受性
筛选菌株的pH值耐受性结果见图4。
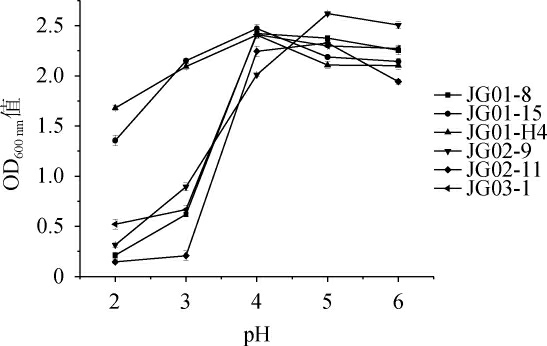
图4 不同pH对6株酵母菌生长的影响
Fig.4 Effects of different pH on the growth of 6 yeasts
酵母菌大多适合在中性或偏酸性的条件下生长,发酵过程中产生的一些副产物如有机酸会降低环境的pH值,导致酵母菌生长能力和发酵能力减弱[32],此时酵母菌的耐酸性就显得尤为重要。由图4可知,当pH值为2.0~3.0时,菌株JG01-15和JG01-H4的生长趋势较好,然而此时菌株JG01-8、JG02-9、JG02-11和JG03-1的生长都受到不同程度的抑制;当pH≥4.0时,6株酵母菌均能良好生长,且菌株JG01-8、JG01-15、JG01-H4和JG03-1生长的最适pH值为4.0,菌株JG02-9和JG02-11生长的最适pH值为5.0。结果表明,菌株JG01-15和JG01-H4对酸性的耐受性优于其他菌株,更能适应发酵后期有机酸积累带来的不利影响。
2.3.3 NaCl耐受性
筛选菌株的NaCl耐受性结果见图5。
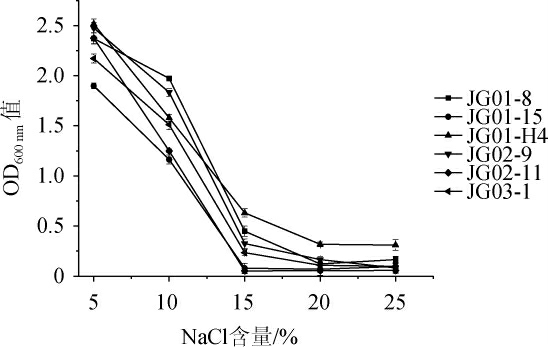
图5 不同NaCl含量对6株酵母菌生长的影响
Fig.5 Effects of different NaCl contents on the growth of 6 yeasts
菌株在高盐条件下生长对于酱油、火腿的发酵具有重要的意义[33-34]。由图5可知,当NaCl含量≤10%时,6株酵母菌均表现出较好的盐耐受性;随着NaCl含量的增加,酵母的生长均呈现下降的趋势;当NaCl含量≥15%时,菌株JG01-H4的生长优于其他菌株,表现出较好的NaCl耐受性。
2.3.4 葡萄糖耐受性
筛选菌株的葡萄糖耐受性结果见图6。
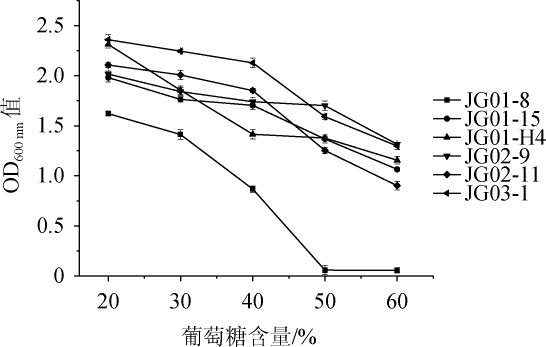
图6 不同葡萄糖含量对6株酵母菌生长的影响
Fig.6 Effects of different glucose contents on the growth of 6 yeasts
葡萄糖是酵母菌发酵的能量来源,有研究表明,在高糖胁迫下参与酵母菌细胞膜和细胞壁合成的蛋白表达下调,过高的葡萄糖含量会形成高渗透压环境,抑制酵母菌的生长[35]。由图6可知,葡萄糖含量的增加对菌株JG01-8有较明显的抑制作用,当葡萄糖含量≥50%时,该菌株几乎不能生长,可能是高浓度葡萄糖溶液形成的高渗透压环境导致酵母菌细胞破裂、水分流失,从而抑制了酵母菌的生长[23]。因此,菌株JG01-8与其他菌株相比,葡萄糖耐受性较差。而随着葡萄糖含量的增加,菌株JG01-15、JG01-H4、JG02-9、JG02-11和JG03-1的生长均呈现出不同程度、不同幅度的下降,但总体而言,这5株菌均表现出较好的葡萄糖耐受性,在葡萄糖含量为60%时依然生长良好。
综上,从澳洲坚果蜂蜜中分离得到的6株酵母菌都具有较好的耐受性,6株菌在乙醇体积分数为5%、pH 3.0、NaCl含量10%、葡萄糖含量40%的条件下均能生长。其中菌株JG01-H4在乙醇体积分数为9%、pH 2.0、NaCl含量25%、葡萄糖含量60%的条件下仍能生长,表现出更强的耐受性。
2.4 赭色掷孢酵母JG01-H4的生长曲线
赭色掷孢酵母JG01-H4的生长曲线见图7。
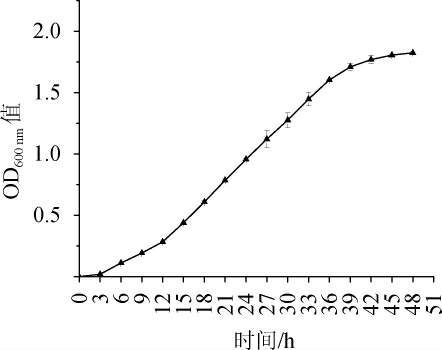
图7 赭色掷孢酵母JG01-H4的生长曲线
Fig.7 Growth curve of Sporobolomyces carnicolor JG01-H4
由图7可知,在培养0~3 h时,菌株JG01-H4的生长缓慢,为延滞期;培养3~39 h时,菌株JG01-H4快速增殖,为对数生长期;培养39 h以后,菌株JG01-H4增殖较缓慢,逐渐进入稳定期。菌株JG01-H4对环境的适应期较短,对数生长期较长,由于对数生长期的菌种生长能力最旺盛[36],在实际的生产中能够缩短发酵周期,对工业化生产具有重大的意义,因此,菌株JG01-H4具有作为工业菌种的潜力。
3 结论
从3份澳洲坚果蜂蜜样品中分离得到6株具有酯香味的酵母菌株。通过形态学观察及18S rDNA序列分析,菌株JG01-8被鉴定为微黄汉纳酵母(H.luteola),菌株JG01-H4被鉴定为赭色掷孢酵母(S.carnicolor),菌株JG01-15、JG02-9、JG02-11和JG03-1被鉴定为鲁氏接合酵母(Z.rouxii),说明澳洲坚果蜂蜜中酵母菌的种类较丰富。耐受性试验结果显示,6株酵母菌株均具有较好的环境耐受性,说明澳洲坚果蜂蜜中具有适合在高渗透环境中生长繁殖的酵母菌株,其中,菌株JG01-H4的耐受性更好,可耐受乙醇体积分数9%、pH值2.0、NaCl含量25%和葡萄糖含量60%,是高渗透环境发酵的潜在菌株。本研究结果对开发澳洲坚果蜂蜜的微生物资源和特殊环境酵母菌资源具有重要意义。
[1]杨帆,付小猛,陶亮,等.澳洲坚果起源、育种及种质资源研究现状[J].中国果树,2023(11):1-7,26.
[2]付镓榕,马尚玄,魏元苗,等.澳洲坚果抗氧化肽的分离纯化及肽段鉴定[J].食品工业科技,2024,45(6):91-99.
[3]施彬,聂艳丽,贺熙勇.澳洲坚果丰产栽培管理技术[M].昆明:云南科技出版社,2016:104.
[4]贺熙勇,聂艳丽,吴霞,等.云南澳洲坚果产业高质量发展的建议[J].中国南方果树,2022,51(4):205-210.
[5]王瑞丽,施蕊,雷娥,等.澳洲坚果种植地土壤固氮微生物群落结构和多样性[J].江苏农业科学,2023,51(8):211-217.
[6]高波,骆瑞麟,杨斌,等.云南高原特色澳洲坚果新兴产业发展分析与对策[J].云南科技管理,2018,31(2):4-9.
[7]梁燕理,杨湘良,韦素梅,等.澳洲坚果油脂肪酸组成及氧化稳定性分析[J].粮油食品科技,2019,27(5):33-36.
[8]NAVARRO S L B,RODRIGUES C E C.Macadamia oil extraction methods and uses for the defatted meal byproduct[J].Trends Food Sci Technol,2016,54:148-154.
[9]BUTHELEZI N M D, MAGWAZA L S, TESFAY S Z.Postharvest prestorage processing improves antioxidants,nutritional and sensory quality of macadamia nuts[J].Sci Hortic,2019,251:197-208.
[10]马尚玄,郭刚军,黄克昌,等.不同分子量澳洲坚果多肽氨基酸组成与抑菌活性[J].食品工业科技,2021,42(7):83-88.
[11]杨艳芬,段敏仙,张碧蓉,等.澳洲坚果加工与副产物综合利用研究进展[J/OL].中国油脂,1-8[2024-03-08].https://doi.org/10.19902/j.cnki.zgyz.1003-7969.230123.
[12]徐文婷,付镓榕,马尚玄,等.不同包装和贮藏温度的澳洲坚果果仁贮藏品质及货架期预测[J].食品科学,2024,45(16):232-243.
[13]杨明华,谭霞,宋文菲,等.源自中华蜜蜂和西方蜜蜂的澳洲坚果蜜挥发性成分比较分析[J].云南农业大学学报(自然科学),2022,37(2):269-277.
[14]GRACE E,MANTILLA S M O, SUNARHARUM W B, et al.Sensory properties of yellow pea and macadamia honeys from conventional and flow hive extraction methods[J].J Sci Food Agr,2020,100(5): 2027-2034.
[15]王文林,贺鹏,覃振师,等.澳洲坚果蜂蜜质量评价[J].安徽农业科学,2016,44(24):72-74,77.
[16]张云双,姜晓林,王艳敏,等.云南省3种特色单花种蜂蜜理化指标检测与分析[J].食品研究与开发,2021,42(21):110-115.
[17]王桃红,张云双,姜晓林,等.云南3种特色蜂蜜的挥发性成分测定与比较[J].现代食品科技,2021,37(9):252-262.
[18]黄学者,王蕾,魏红跃,等.云南3种特色蜂蜜糖组分的稳定碳同位素比值测定与分析[J].核农学报,2020,34(S1):79-88.
[19]ZIUZIA P,JANIEC Z,WROBEL-KWIATLKOWSKA M,et al.Honey's yeast-new source of valuable species for industrial applications[J].Int J Mol Sci,2023,24(9):7889.
[20]CˇADEŽ N,FÜLÖP L,DLAUCHY D,et al.Zygosaccharomyces favi sp.nov.,an obligate osmophilic yeast species from bee bread and honey[J].Anton Van Leeuw,2015,107:645-654.
[21]黄晓,王莎莎,刘雅文,等.蜂蜜中的酵母菌及其在食品工业中的应用[J].中国蜂业,2020,71(11):38-40.
[22]田辉,谢引荣,王琰,等.三种传统发酵食品中酵母菌的分离鉴定与特性分析[J].中国酿造,2022,41(3):87-92.
[23]赵广河,胡梦琪,陆玺文,等.桃金娘果酒酵母菌的筛选鉴定及生长特性分析[J].中国酿造,2023,42(9):103-108.
[24]BARNETT J A.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991:157-159.
[25]刘小改,李洪媛,周林艳,等.清香型大曲中产香细菌的分离筛选及鉴定[J].中国酿造,2022,41(5):96-100.
[26]应以坚,王雪奇,金亚倩.野生环境中叶栖酵母菌资源的研究[J].轻工科技,2015,31(11):12-13,17.
[27]臧威,刘春月,谢广发,等.浙江雁荡山山脉叶栖酵母菌资源与物种多样性[J].生态学报,2018,38(11):3920-3930.
[28]DAMTO T,KEBEBE D,GEMEDA M.Physicochemical properties and microbial qualities of honey produced by a stingless bee (Meliponula beccarii L.)in the Oromia region,Ethiopia[J].Cogent Food Agr,2023,9(1):2258784.
[29]KOGAN H V,ELIKAN A B,GLASER K F,et al.Colonization of honey bee digestive tracts by environmental yeast Lachancea thermotolerans is naturally occurring,temperature dependent,and impacts the microbiome of newly emerged bees[J].Microbiol Spectr,2023,11(2):e05194-22.
[30]张二豪,何萍,刘盼盼,等.西藏沙棘酵母菌的分离鉴定及其产香特性分析[J].食品科学,2022,43(20):207-215.
[31]王凯月,陈延儒,范浩伟,等.优良酿酒酵母筛选及其对脐橙果醋品质的影响[J].南昌大学学报(理科版),2023,47(5):433-440.
[32]李玉花.山西葡萄产区酿酒酵母的优选与鉴定及其共发酵特性分析[D].呼和浩特:内蒙古农业大学,2021.
[33]续丹丹,王文平,张欣,等.一株耐盐产香鲁氏接合酵母FA-1的鉴定及其在酱油酿造中的应用[J].中国酿造,2022,41(12):31-39.
[34]吴阳,罗欣.贵州火腿风味研究进展[J].现代食品,2023,29(17):80-82,97.
[35]XU X L, ZHU Y X, LI Y J, et al.Proteomics analysis of Zygosaccharomyces mellis in response to sugar stress[J].Processes,2022,10(6):1193.
[36]杨凯环,相里加雄,曹苗文,等.清香型酒曲中高产乙酸乙酯酵母的筛选及鉴定[J].酿酒科技,2023(7):38-43.