葡萄酒作为一种具有较高营养价值的酒精性饮料,备受消费者青睐。但葡萄酒在瓶贮过程中容易被氧化,影响了酒的质量。SO2长期以来作为葡萄酒的抗氧化剂,在葡萄酒酿制及贮存过程中发挥着重要作用,但过量的SO2不但影响了葡萄酒的风味,同时也对人体有危害[1-2]。因此,寻找到其他抗氧化能力强且无负面影响的葡萄酒抗氧化剂至关重要。
抗坏血酸因其有较强的还原能力和清除溶解氧的活性被认为是可能代替SO2的抗氧化剂,然而有研究表明,在某些条件下抗坏血酸依赖于其浓度表现出很强的促氧化作用而不是抗氧化作用,尤其是与SO2配合使用时,不仅促进了酒样对SO2的消耗,而且加快了褐色物的产生[3-4]。多项研究表明:谷胱甘肽可以与酚类化合物的氧化产物—醌类物质,形成非深色且不易被氧化的产物,从而有效抑制葡萄酒的氧化褐变,但添加量少,达不到抗氧化的作用,添加量多,容易促进H2S气体的产生,影响葡萄酒的风味[5-6]。甘露聚糖可以与游离色素结合,保护葡萄酒的色泽,同时可改善葡萄酒的蛋白稳定性,但更适合于红葡萄酒的抗氧化[7]。螯合剂因能够清除具有催化氧化作用的金属离子,可与抗氧化剂协同起抗氧化作用。葡萄酒中常用的螯合剂有亚铁氰化钾、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)等。亚铁氰化钾由于会在葡萄酒中残留过多的有毒氰化物,已受到严格限制[8];EDTA可以与葡萄酒中的金属离子形成复合物以防止葡萄酒发生褐变,但国际葡萄与葡萄酒局(International Office of Vine and Wine,OIV)规定酒中最后的残留量不能超过25 mg/L[9]。
酚类化合物是优良的天然抗氧化剂资源,赋予了葡萄酒抗氧化、抗癌、预防心血管疾病等生物活性功能[10]。葡萄酒酿造过程中会产生大量的副产物,如葡萄茎和葡萄籽,其含有大量原花青素的黄酮类化合物。BARROS A等[11]报道了将葡萄茎提取物添加到其他附加值产品中而发挥的抗氧化应用潜力。DUMITRIU D等[12]报道了添加葡萄渣乙醇提取物,可以使葡萄酒中黄烷醇、黄酮醇和原花青素含量更高,提高了葡萄酒的保护作用和抗氧化性能。LLAUDY M C D等[13]研究了葡萄籽和茎浸渍对葡萄酒成分的影响。然而,到目前为止葡萄籽和葡萄茎提取物在葡萄酒生产中的替代作用鲜见报道。如能提取出此类物质并替代SO2用于葡萄酒中,不仅可以解决SO2对葡萄酒带来的风味影响,同时能消除食品安全的问题,故应用前景非常可观。
本研究采用高压水快速萃取法分别从葡萄酿酒副产物—葡萄茎和籽中获得提取物,在干白葡萄酒瓶贮期间添加葡萄茎和籽提取物,探讨白葡萄酒贮存过程中颜色参数、氧化还原电位、抗氧化活性、酚类物质的变化,并对其进行感官评价,分析葡萄籽提取物和葡萄茎提取物添加量对干白葡萄酒贮存期品质的影响。
1 材料与方法
1.1 材料与试剂
2022年玫瑰香干白葡萄酒酒样(酒精度11.84%vol;残糖(以葡萄糖计)3.67 g/L;总酸(以酒石酸计)5.64 g/L;游离SO2 16 mg/L,pH 2.98):王朝葡萄酒公司;葡萄籽、葡萄藤茎:来自天津汉沽产区玫瑰香葡萄;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸[2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS]:福州飞净生物科技有限公司;福林酚、无水乙醇(均为分析纯)、甲醇、甲酸(均为色谱纯):国药集团试剂(上海)有限公司;没食子酸、咖啡酸、儿茶素、表儿茶素、对香豆酸标准品(纯度均>98%):美国Sigma公司;其余试剂均为国产分析纯。
1.2 仪器与设备
FD-1A-50型冷冻干燥机:北京博医康实验仪器有限公司;UV1000紫外-可见光光度仪:长沙艾克赛普仪器仪表公司;1200型高效液相色谱(high performance liquid chromatography,HPLC)仪:美国Agilent公司;WondaSilTM C18色谱柱(5 μm,250 mm×4.6 mm);SDZF-6210真空干燥箱:上海苏达实验仪器有限公司;ASE200快速溶解萃取仪:美国Dionex公司;PHS-3CW型pH计:上海般特仪器有限公司;501型氧化还原电极(oxidation-reduction potential,ORP):上海仪电科学仪器公司。
1.3 方法
1.3.1 葡萄酿酒副产物提取物的制备
将葡萄酿酒副产物—葡萄藤茎、葡萄籽置于真空干燥箱中30 ℃干燥至恒质量,粉碎过40目筛,葡萄籽粉用索氏抽提法脱脂。取两种粉末各10 g,分别用高压水快速萃取法[14](压力100 bar,时间10 min,提取溶剂为水,料液比1∶1.5(g∶mL))循环萃取两次,提取液合并后在-55 ℃下真空冷冻干燥成冻干粉末,即得葡萄藤茎提取物冻干粉和葡萄籽提取物冻干粉,贮存在干燥器中备用。
1.3.2 干白葡萄酒贮存过程中添加葡萄酿酒副产物提取物
以玫瑰香干白葡萄酒为实验对象,装瓶前向玫瑰香干白葡萄酒酒样中分别添加葡萄籽提取物冻干粉100 mg/L、200 mg/L、300 mg/L(编号为Z1、Z2、Z3);葡萄藤茎提取物冻干粉200 mg/L、300 mg/L、400 mg/L(编号为J2、J3、J4);40 mg/L游离SO2(编号为S);以不添加任何提取物玫瑰香干白葡萄酒为空白对照组(编号为C)。封塞装瓶,20 ℃恒温贮存12个月,每3个月检测一次酒样的颜色参数、氧化还原电位、抗氧化能力、酚类物质等指标,并对酒样进行感官评价。
1.3.3 分析检测
(1)颜色参数测定
颜色参数测定采用紫外-可见光光度法[15]。根据国际照明委员会(International Commission on Illumination,CIE)1976 LAB法测定酒样的L*值、a*值、b*值,其中L*值表示明亮度,正数表示偏白,负数表示偏黑。a*值表示红绿度,正数表示偏红,负数表示偏绿。b*值表示黄蓝度,正数表示偏黄,负数表示偏蓝。
(2)氧化还原电位(Eh)测定
氧化还原电位(Eh)用pH计配合501 氧化还原电位复合电极测定,测定前利用标准氧化还原电位溶液进行校正。
(3)抗氧化能力测定[16]
DPPH法:制备0.06 mmol/L的DPPH甲醇溶液。取0.1 mL酒样加入DPPH甲醇溶液4.9 mL,摇匀后避光反应30 min,在波长为517 nm处测吸光度值Ai;用甲醇代替DPPH除去样品本身颜色的误差,测出参比吸光度值A0;以相同体积的甲醇替代样品作为对照,测定吸光度值AZ;DPPH自由基清除率=[1-(Ai-A0)/AZ)×100%。
ABTS法:取2.5 mL 2.45 mmol/L的过硫酸钾溶液与2.5 mL 7 mmol/L的ABTS乙醇溶液混合均匀,室温避光放置16 h,然后用无水乙醇稀释,使其在波长734 nm 处的吸光度值达到0.70±0.02。酒样稀释10倍后移取0.1 mL,加4.9 mL ABTS+溶液,避光反应30 min,然后在波长734 nm处测定吸光度值Ai,以相同体积的甲醇替代样品作为对照,测定吸光度值AZ;ABTS自由基清除率=(1-Ai/AZ)×100%。
(4)酚类物质测定[17]
分别称取0.1 g葡萄藤茎和葡萄籽提取物冻干粉,溶解于100 mL无水乙醇中,用0.45 μm膜过滤后测定总酚、总黄酮、单宁含量。
单体酚测定采用HPLC法[18]。酒样测定前经0.45 μm微孔滤膜过滤。高效液相色谱条件:WondaSilTM C18色谱柱(5 μm,250 mm×4.6 mm)流动相为A 0.2%甲酸-水、B甲醇,流速1 mL/min,运行时间25 min,进样量20 μL,柱温30 ℃,紫外检测器波长280 nm。采用梯度洗脱,洗脱程序为0~10 min 10%~22%B,10~15 min 22%~25%B,15~40 min 25%~35%B,40~45 min 35%B。通过与标准品的液相色谱峰对比,根据保留时间定性分析,采用峰面积外标法定量分析[17]。
(5)感官评价
由10名专业人员参照国标GB/T 15038—2006《葡萄酒、果酒通用分析方法》[19],从玫瑰香干白葡萄酒酒样视觉(色泽10%、透明度10%)、嗅觉(香气20%、纯正度20%)、味觉(协调性20%、氧化味20%)三方面评定,满分100分。
1.3.4 数据处理
采用Microsoft Excel 2010和SPSS 26.0进行数据处理,所有检测均进行3次重复实验。
2 结果与分析
2.1 葡萄酿酒副产物提取物的酚类物质含量
葡萄酿酒副产物提取物的酚类物质含量测定结果见表1。由表1可知,葡萄籽提取物中总酚、总黄酮和单宁含量均高于葡萄藤茎提取物。
表1 葡萄酿酒副产物提取物中总酚、总黄酮及单宁含量测定结果
Table 1 Determination results of total phenols,total flavonoids and tannins contents of grape wine-making by-product extract mg/g
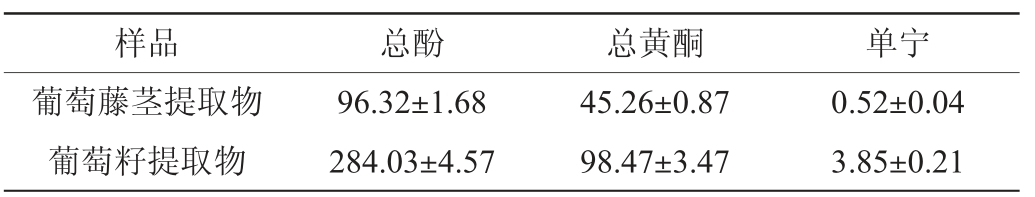
样品 总酚 总黄酮 单宁葡萄藤茎提取物葡萄籽提取物96.32±1.68 284.03±4.57 45.26±0.87 98.47±3.47 0.52±0.04 3.85±0.21
2.2 葡萄酿酒副产物提取物添加对干白葡萄酒贮存期颜色的影响
葡萄酿酒副产物提取物添加对干白葡萄酒贮存期颜色的影响结果见图1。新鲜干白葡萄酒的色泽为浅麦秆黄色带绿色调,晶莹透亮,随着干白葡萄酒贮存期酒样被氧化,明亮度L*值和a*值绿色调逐渐降低,黄色调b*值逐渐增高,因此,葡萄酒的颜色是衡量酒样被氧化程度的重要指标。
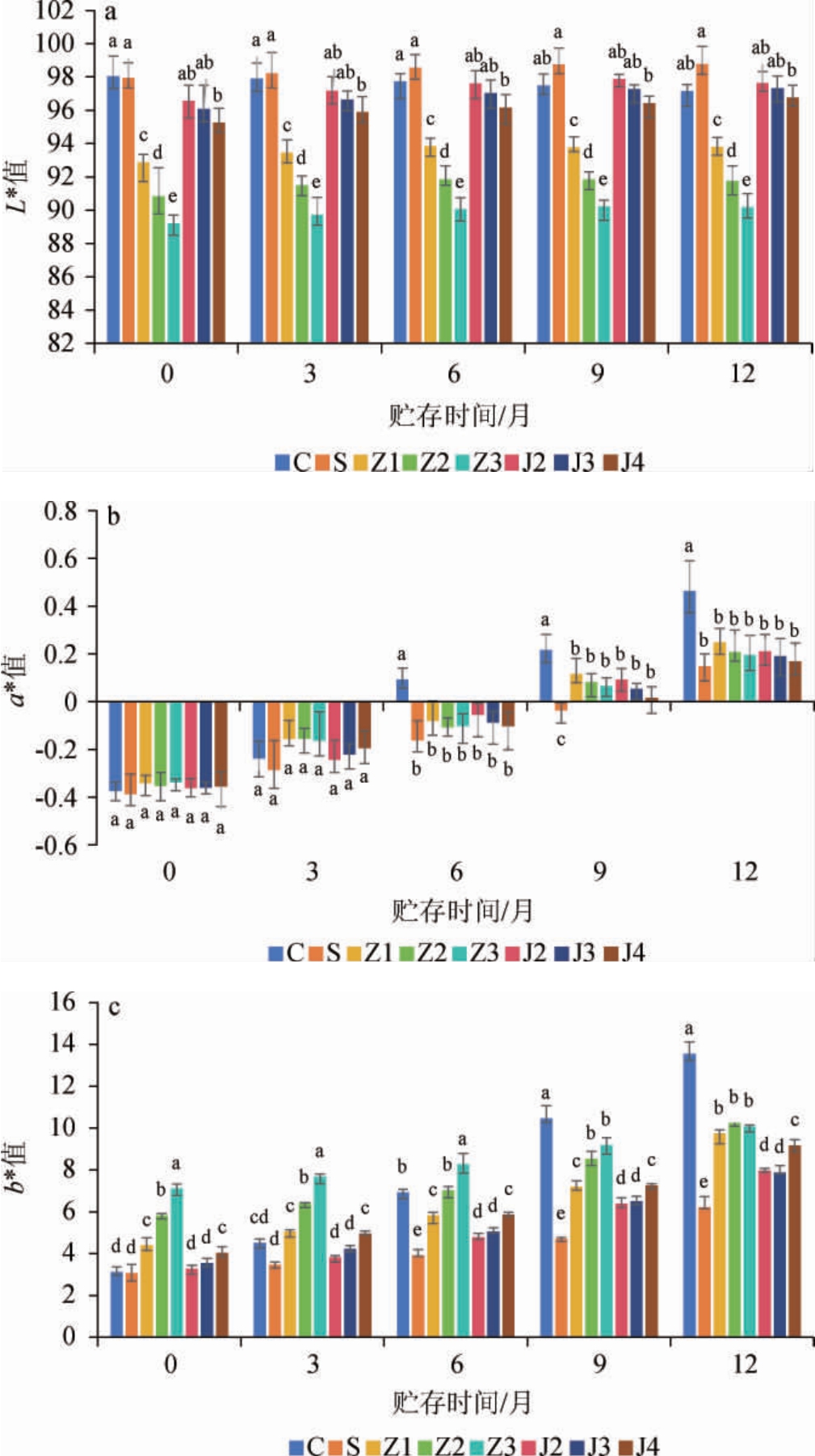
图1 葡萄酿酒副产物提取物添加对干白葡萄酒贮存期颜色参数的影响
Fig.1 Effects of grape wine-making by-product extract addition on color parameters of dry white wine during storage period
不同小写字母表示差异显著(P<0.05)。下同。
在CIE Lab体系中,L*值代表酒样的明暗程度,L*值越大,颜色越明亮,反之则反[20]。由图1a可知,添加SO2的酒样L*值最大(98),200 mg/L、300 mg/L、400 mg/L添加量葡萄藤茎提取物的酒样L*值均在95~98之间,无显著性差异(P>0.05),且L*值均随贮藏时间延长变化不大。200 mg/L、300 mg/L、400 mg/L添加量葡萄籽提取物的酒样L*值在89~94之间,显著低于添加葡萄藤茎提取物酒样L*值(P<0.05),且随葡萄籽提取物添加量的增大酒样L*值呈现下降趋势,说明葡萄籽提取物添加降低了酒样的明亮度,应该是葡萄籽提取物自身颜色所致;随贮存时间的延长其酒样L*值变化不大。
a*值>0且逐渐增大,表示酒样红色色调逐渐增强,a*值<0且逐渐减小,表示酒样绿色色调逐渐增强;b*值>0且逐渐增大,表示酒样黄色色调逐渐增强;b*值<0且逐渐减小,表示酒样蓝色色调逐渐增强[21-22]。由图1b可知,所有酒样的a*值随贮存时间延长均呈增加趋势,但添加葡萄酿酒副产物提取物的酒样增加趋势显著低于空白组酒样(P<0.05),说明葡萄酿酒副产物提取物的添加可以减缓白葡萄酒绿色调减弱,可能是葡萄酿酒副产物中的多酚抑制了酒的氧化。
由图1c可知,所有酒样的b*值随贮存时间延长均呈增加趋势,空白对照组酒样增加趋势最明显,添加葡萄藤茎提取物的酒样增加趋势次之,添加葡萄籽提取物的酒样增加趋势最缓慢,说明葡萄籽提取物的添加可以更好的抑制酒样被氧化;但添加葡萄籽提取物的酒样b*值均显著高于添加葡萄藤茎提取物的酒样(P<0.05),应该是葡萄籽提取物自身颜色所导致的结果,说明葡萄籽提取物添加到白葡萄酒中会影响白葡萄酒的色泽;添加200 mg/L和300 mg/L葡萄藤茎提取物的酒样之间b*值无显著差异(P>0.05),但添加400 mg/L葡萄藤茎提取物的酒样b*值显著高于添加200 mg/L和300 mg/L的酒样(P<0.05)。
不同葡萄酿酒副产物提取物添加量的酒样颜色存在明显差异。添加SO2的酒样颜色最鲜亮(L*值最大),黄色调最低(b*值最小);添加葡萄籽提取物可以更好的抑制酒样被氧化,但葡萄籽提取物自身颜色会显著影响白葡萄酒的色泽;添加葡萄藤茎提取物也可以一定程度抑制酒样被氧化。故添加300 mg/L葡萄藤茎提取物既可以抑制干白葡萄酒的氧化,又对其色泽影响较小。
2.3 葡萄酿酒副产物提取物添加对干白葡萄酒贮存期氧化还原电位的影响
氧化还原电位能够反映白葡萄酒的宏观氧化-还原性,当Eh为正,且随Eh的升高,酒样氧化性增强,越容易发生氧化反应;当Eh为负,说明酒样显示出还原性,酒体相对稳定[23]。由图2可知,随着贮存时间的延长,添加葡萄酿酒副产物提取物的酒样Eh上升趋势显著低于空白对照酒样(P<0.05),且随着添加量的增加Eh上升趋势逐渐减缓;贮存12个月时,空白对照酒样的Eh是贮存开始时的223%,酒样氧化性最强,添加100 mg/L葡萄籽提取物和200 mg/L葡萄藤茎提取物的酒样Eh上升幅度无显著差异(P>0.05),是贮存开始时的213%左右,酒样氧化性次之,添加300 mg/L葡萄藤茎提取物、400 mg/L葡萄藤茎提取物和SO2对照的酒样Eh上升幅度无显著差异(P>0.05),是贮存开始时的183%左右,酒样氧化性相对较弱,不同葡萄藤茎添加量的酒样氧化性无显著差异说明当酒样中的添加物达到一定量后,更多的添加物对酒样几乎无抗氧化保护作用了。添加300 mg/L葡萄籽提取物的酒样Eh上升幅度最小,是贮存开始时的176%,酒样氧化性最弱。综上添加300 mg/L葡萄籽提取物的酒样氧化性最弱,添加300 mg/L葡萄藤茎提取物的酒样氧化性次之。
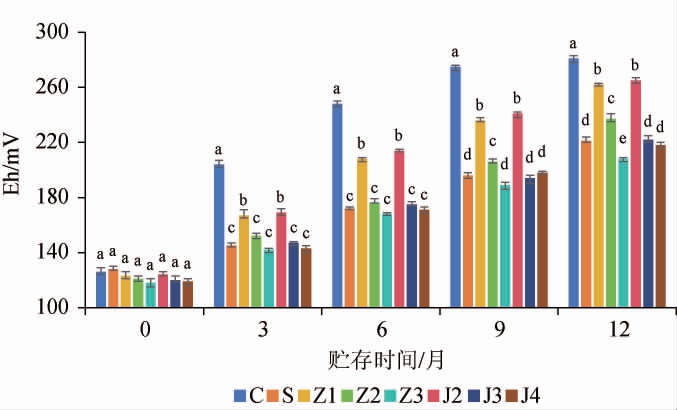
图2 葡萄酿酒副产物提取物添加对干白葡萄酒贮存期氧化还原电位的影响
Fig.2 Effects of grape wine-making by-product extract addition on oxidation-reduction potential of dry white wine during storage period
2.4 葡萄酿酒副产物提取物添加对干白葡萄酒贮存期抗氧化活性的影响
采用DPPH和ABTS两种不同的体外方法对干白葡萄酒的抗氧化活性进行评价,结果见图3。
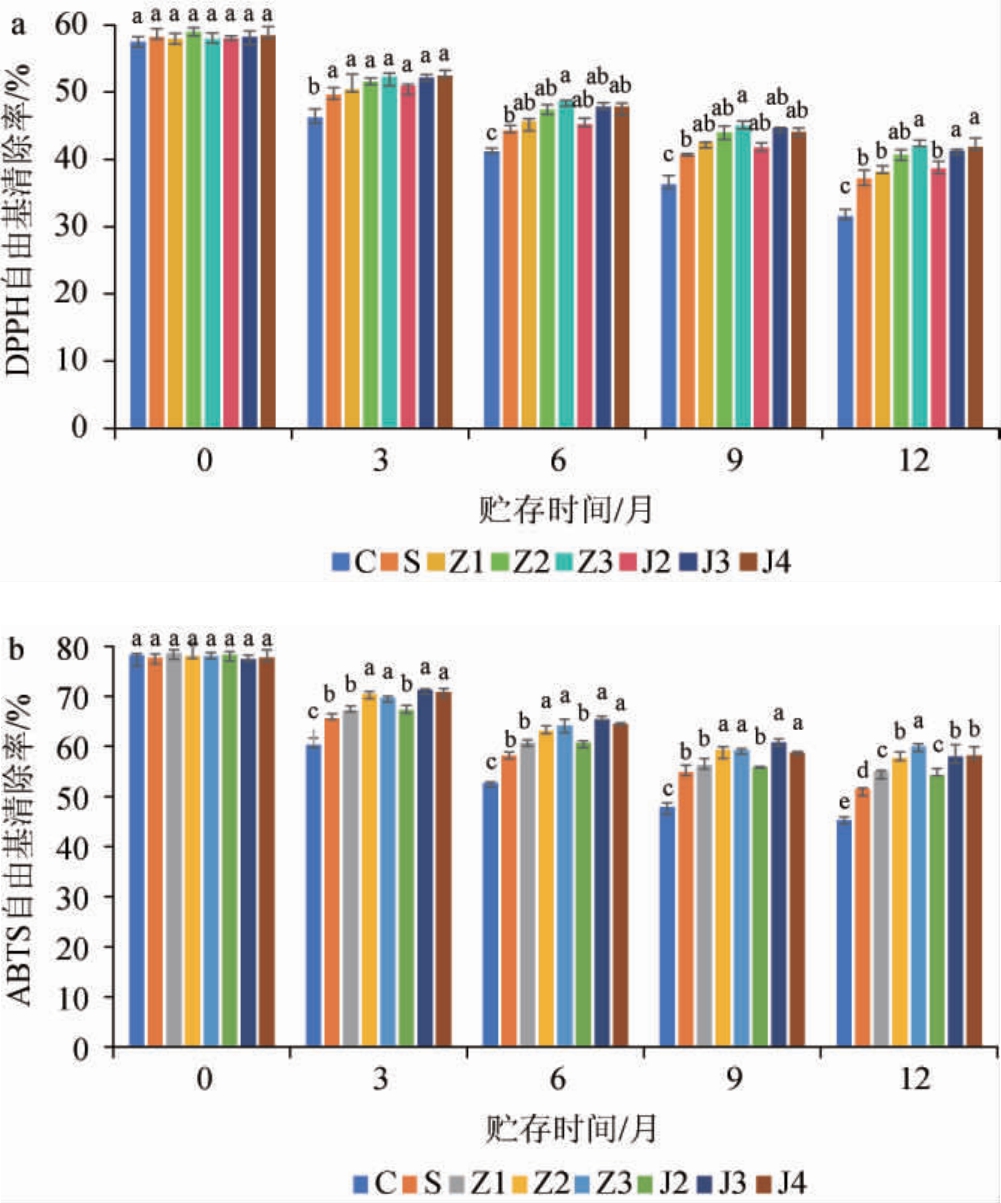
图3 葡萄酿酒副产物提取物添加对干白葡萄酒贮存期DPPH(a)、ABTS(b)自由基清除率的影响
Fig.3 Effects of grape wine-making by-product extract addition on DPPH(a)and ABTS(b)free radical scavenging rates of dry white wine during storage period
由图3可知,白葡萄酒贮存一年期内,其对DPPH和ABTS自由基清除率均随贮存时间的延长逐渐下降,且前3个月最明显;随着葡萄籽提取物和藤茎提取物添加量的增加,酒样对DPPH和ABTS自由基清除率逐渐升高,贮存12个月时,添加300 mg/L葡萄籽提取物的酒样对DPPH和ABTS自由基清除率均最高,分别为42.05%和59.98%,添加400 mg/L葡萄藤茎提取物的酒样对DPPH和ABTS自由基清除率分别为41.81%和58.17%,添加300 mg/L葡萄藤茎提取物的酒样对DPPH和ABTS自由基清除率分别为41.24%和57.92%;添加SO2的酒样DPPH自由基清除率和ABTS自由基清除率均略低于添加葡萄籽提取物和葡萄藤茎提取物的酒样,这与其他学者的研究结果一致[24],这可能是由于SO2有一定挥发性的原因。综上,添加300 mg/L葡萄籽提取物的酒样抗氧化性能最强。
2.5 葡萄酿酒副产物提取物添加对干白葡萄酒贮存期酚类化合物的影响
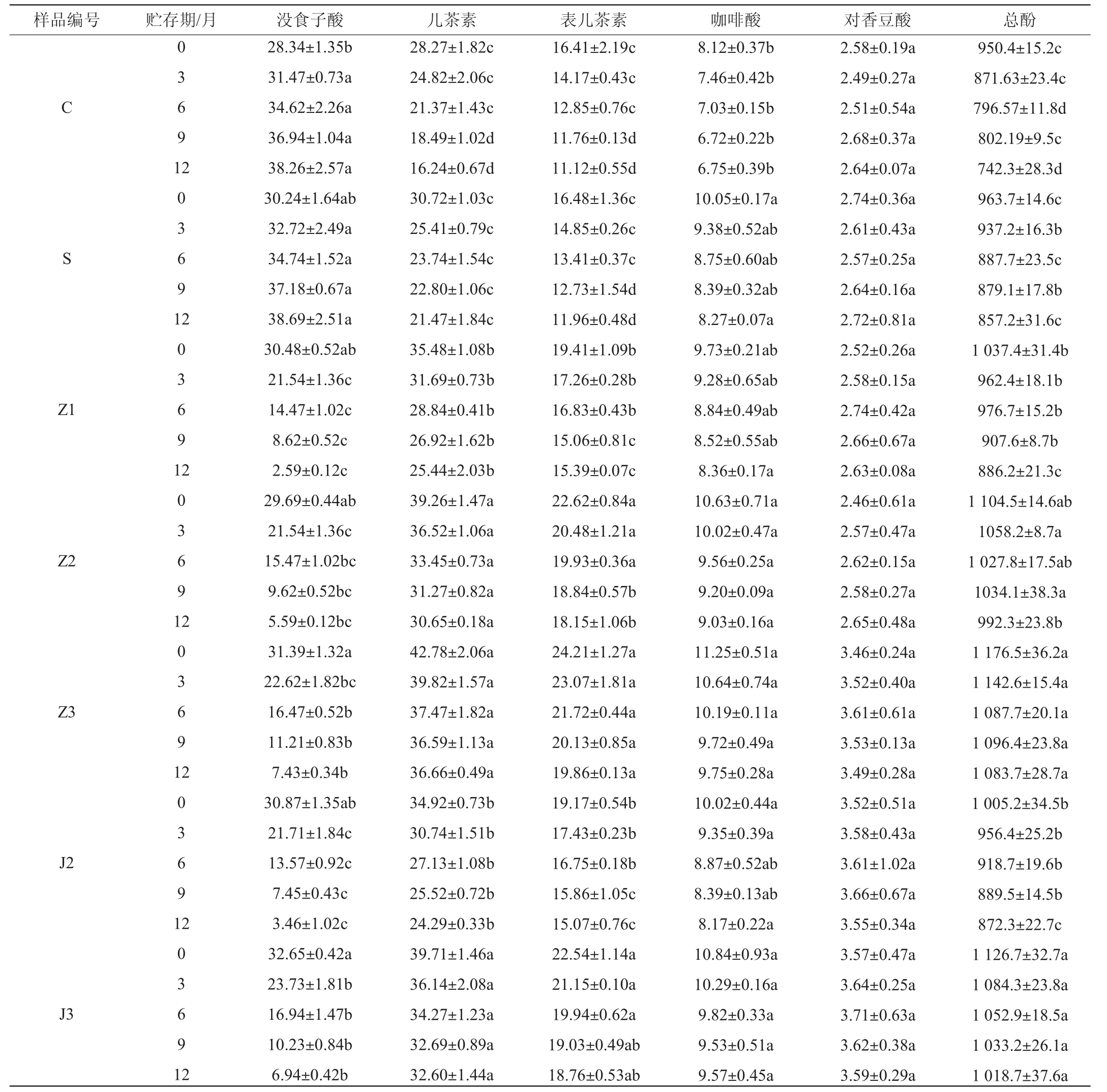
葡萄酿酒副产物提取物添加对干白葡萄酒贮存期酚类化合物含量的影响,结果见表2。
表2 葡萄酿酒副产物提取物添加对干白葡萄酒贮存期酚类化合物含量的影响
Table 2 Effect of grape wine-making by-product extract addition on phenolic compound contents of dry white wine during storage period mg/L
样品编号 贮存期/月 没食子酸 儿茶素 表儿茶素 咖啡酸 对香豆酸 总酚C 0 3 6 9 1 S 2 0 3 6 9 1 Z1 2 0 3 6 9 1 Z2 2 0 3 6 9 1 Z3 2 0 3 6 9 1 J2 2 0 3 6 9 1 J3 2 0 3 6 9 1 2 28.34±1.35b 31.47±0.73a 34.62±2.26a 36.94±1.04a 38.26±2.57a 30.24±1.64ab 32.72±2.49a 34.74±1.52a 37.18±0.67a 38.69±2.51a 30.48±0.52ab 21.54±1.36c 14.47±1.02c 8.62±0.52c 2.59±0.12c 29.69±0.44ab 21.54±1.36c 15.47±1.02bc 9.62±0.52bc 5.59±0.12bc 31.39±1.32a 22.62±1.82bc 16.47±0.52b 11.21±0.83b 7.43±0.34b 30.87±1.35ab 21.71±1.84c 13.57±0.92c 7.45±0.43c 3.46±1.02c 32.65±0.42a 23.73±1.81b 16.94±1.47b 10.23±0.84b 6.94±0.42b 28.27±1.82c 24.82±2.06c 21.37±1.43c 18.49±1.02d 16.24±0.67d 30.72±1.03c 25.41±0.79c 23.74±1.54c 22.80±1.06c 21.47±1.84c 35.48±1.08b 31.69±0.73b 28.84±0.41b 26.92±1.62b 25.44±2.03b 39.26±1.47a 36.52±1.06a 33.45±0.73a 31.27±0.82a 30.65±0.18a 42.78±2.06a 39.82±1.57a 37.47±1.82a 36.59±1.13a 36.66±0.49a 34.92±0.73b 30.74±1.51b 27.13±1.08b 25.52±0.72b 24.29±0.33b 39.71±1.46a 36.14±2.08a 34.27±1.23a 32.69±0.89a 32.60±1.44a 16.41±2.19c 14.17±0.43c 12.85±0.76c 11.76±0.13d 11.12±0.55d 16.48±1.36c 14.85±0.26c 13.41±0.37c 12.73±1.54d 11.96±0.48d 19.41±1.09b 17.26±0.28b 16.83±0.43b 15.06±0.81c 15.39±0.07c 22.62±0.84a 20.48±1.21a 19.93±0.36a 18.84±0.57b 18.15±1.06b 24.21±1.27a 23.07±1.81a 21.72±0.44a 20.13±0.85a 19.86±0.13a 19.17±0.54b 17.43±0.23b 16.75±0.18b 15.86±1.05c 15.07±0.76c 22.54±1.14a 21.15±0.10a 19.94±0.62a 19.03±0.49ab 18.76±0.53ab 8.12±0.37b 7.46±0.42b 7.03±0.15b 6.72±0.22b 6.75±0.39b 10.05±0.17a 9.38±0.52ab 8.75±0.60ab 8.39±0.32ab 8.27±0.07a 9.73±0.21ab 9.28±0.65ab 8.84±0.49ab 8.52±0.55ab 8.36±0.17a 10.63±0.71a 10.02±0.47a 9.56±0.25a 9.20±0.09a 9.03±0.16a 11.25±0.51a 10.64±0.74a 10.19±0.11a 9.72±0.49a 9.75±0.28a 10.02±0.44a 9.35±0.39a 8.87±0.52ab 8.39±0.13ab 8.17±0.22a 10.84±0.93a 10.29±0.16a 9.82±0.33a 9.53±0.51a 9.57±0.45a 2.58±0.19a 2.49±0.27a 2.51±0.54a 2.68±0.37a 2.64±0.07a 2.74±0.36a 2.61±0.43a 2.57±0.25a 2.64±0.16a 2.72±0.81a 2.52±0.26a 2.58±0.15a 2.74±0.42a 2.66±0.67a 2.63±0.08a 2.46±0.61a 2.57±0.47a 2.62±0.15a 2.58±0.27a 2.65±0.48a 3.46±0.24a 3.52±0.40a 3.61±0.61a 3.53±0.13a 3.49±0.28a 3.52±0.51a 3.58±0.43a 3.61±1.02a 3.66±0.67a 3.55±0.34a 3.57±0.47a 3.64±0.25a 3.71±0.63a 3.62±0.38a 3.59±0.29a 950.4±15.2c 871.63±23.4c 796.57±11.8d 802.19±9.5c 742.3±28.3d 963.7±14.6c 937.2±16.3b 887.7±23.5c 879.1±17.8b 857.2±31.6c 1 037.4±31.4b 962.4±18.1b 976.7±15.2b 907.6±8.7b 886.2±21.3c 1 104.5±14.6ab 1058.2±8.7a 1 027.8±17.5ab 1034.1±38.3a 992.3±23.8b 1 176.5±36.2a 1 142.6±15.4a 1 087.7±20.1a 1 096.4±23.8a 1 083.7±28.7a 1 005.2±34.5b 956.4±25.2b 918.7±19.6b 889.5±14.5b 872.3±22.7c 1 126.7±32.7a 1 084.3±23.8a 1 052.9±18.5a 1 033.2±26.1a 1 018.7±37.6a
续表
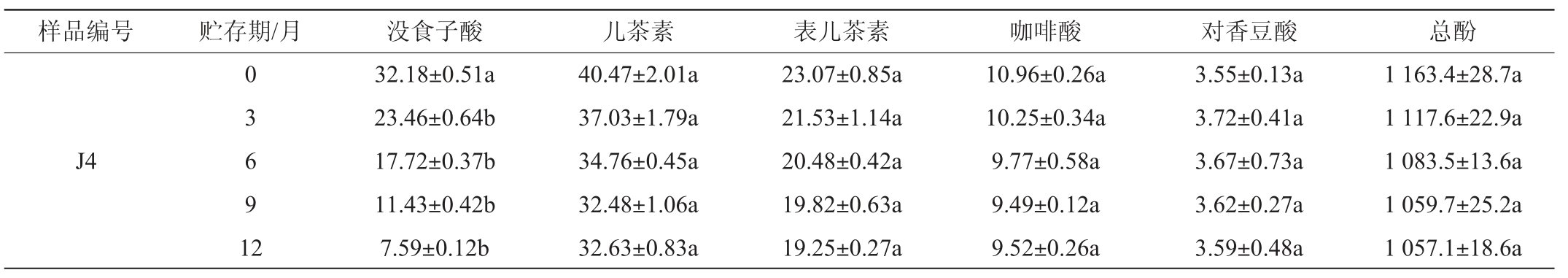
注:不同字母表示添加不同抗氧化剂及其量的酒样之间差异性显著(P<0.05)。
样品编号 贮存期/月 没食子酸 儿茶素 表儿茶素 咖啡酸 对香豆酸 总酚J4 0 3 6 9 1 2 32.18±0.51a 23.46±0.64b 17.72±0.37b 11.43±0.42b 7.59±0.12b 40.47±2.01a 37.03±1.79a 34.76±0.45a 32.48±1.06a 32.63±0.83a 23.07±0.85a 21.53±1.14a 20.48±0.42a 19.82±0.63a 19.25±0.27a 10.96±0.26a 10.25±0.34a 9.77±0.58a 9.49±0.12a 9.52±0.26a 3.55±0.13a 3.72±0.41a 3.67±0.73a 3.62±0.27a 3.59±0.48a 1 163.4±28.7a 1 117.6±22.9a 1 083.5±13.6a 1 059.7±25.2a 1 057.1±18.6a
由表2可知,贮存一年内,添加葡萄藤茎提取物和葡萄籽提取物的酒样中没食子酸含量大幅下降,其中添加100 mg/L葡萄籽提取物和200 mg/L葡萄藤茎提取物的酒样均降低了90%左右,可能是葡萄藤茎提取物和葡萄籽提取物促进了酒样中的没食子酸与某些金属或酶之间发生了氧化反应所致[17],而添加SO2和空白对照的酒样中没食子酸含量增加了36%左右,可能是没食子酸前体物质慢慢释放的结果[17,25];酒样中的儿茶素和表儿茶素含量均逐渐降低,但添加葡萄籽提取物和葡萄藤茎提取物的酒样较空白对照酒样降低幅度明显减缓,添加300 mg/L籽提取物和300 mg/L葡萄藤茎提取物的酒样儿茶素含量降低幅度最少,分别较空白对照酒样减少28.28%和24.26%,添加300 mg/L葡萄籽提取物和400 mg/L葡萄藤茎提取物的酒样表儿茶素含量降低幅度最少,分别较空白对照酒样减少14.27%和15.68%,可能是这些添加物表现出了一定的抗氧化作用,抑制了黄烷-3-醇类多酚的氧化;酒样中的香豆酸含量变化不明显,咖啡酸含量逐渐小幅降低,不同添加物之间香豆酸和咖啡酸含量没有显著性变化(P>0.05);酒样中的总酚含量变化不规律,但整体呈降低趋势,且随着提取物含量的增加降低趋势减缓,添加300 mg/L葡萄籽提取物和300 mg/L葡萄藤茎提取物的酒样总酚含量降低幅度最少,分别较空白对照酒样减少14.01%和12.31%,添加葡萄籽提取物和葡萄藤茎提取物的酒样中总酚含量显著高于添加SO2和空白对照的酒样(P<0.05)。综上,添加300 mg/L籽提取物、300 mg/L藤茎提取物、400 mg/L藤茎提取物的酒样在贮存期间其总酚、儿茶素、表儿茶素等主要多酚化合物含量降低幅度最少,说明其对酒样中的多酚物质保护效果最明显。
2.6 葡萄酿酒副产物提取物添加对干白葡萄酒贮存期感官评价的影响
葡萄酿酒副产物提取物添加对干白葡萄酒贮存期感官评分的影响见表3。由表3可知,添加葡萄籽提取物的酒样色泽较其他酒样更深,且随其浓度升高,有增加趋势,说明葡萄籽冻干粉的颜色影响了白葡萄酒的外观;添加葡萄籽提取物和藤茎提取物的酒样较空白对照果香更突出,而添加SO2的酒样有轻微的臭鸡蛋味;添加葡萄籽提取物的酒样有轻微苦味,且随其浓度升高苦味越严重,因为酒样中的黄烷-3-醇含量较高,而黄烷-3-醇类是苦味的主要原因;添加300 mg/L葡萄籽提取物、300 mg/L葡萄藤茎提取物、400 mg/L葡萄藤茎提取物的酒样氧化感最弱,与添加SO2的酒样相当;从整体感官评分来看,添加300 mg/L葡萄藤茎提取物的酒样感官评分(82分)与添加SO2的酒样(82分)相当,高于其他所有酒样的感官评分。
表3 葡萄酿酒副产物提取物添加对干白葡萄酒贮存期感官评分的影响
Table 3 Effect of grape wine-making by-product extract addition on sensory score of dry white wine during storage period
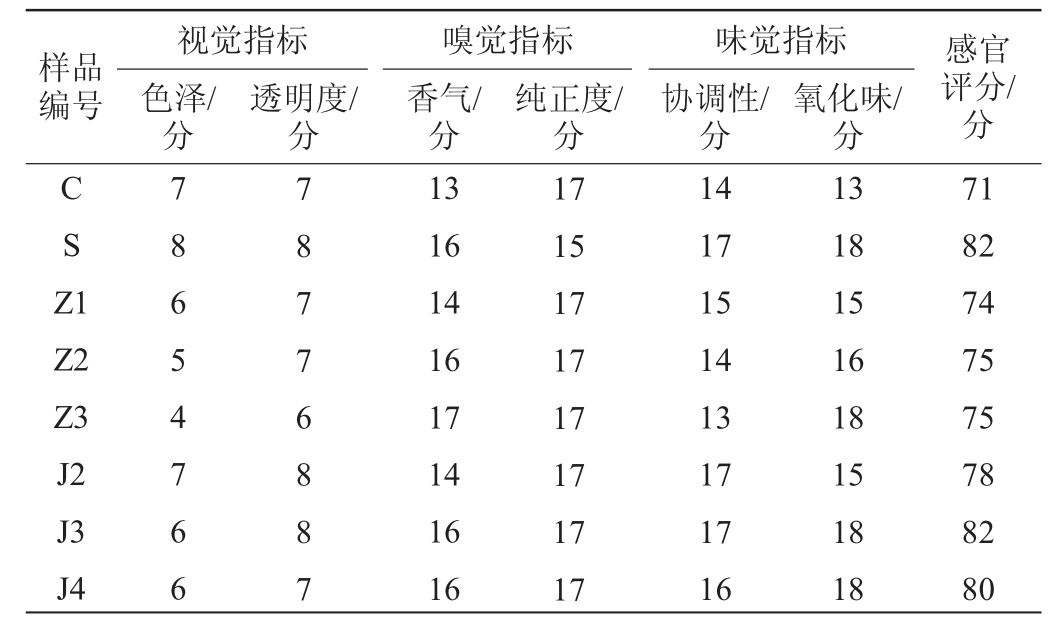
样品编号视觉指标色泽/分透明度/分嗅觉指标香气/分纯正度/分味觉指标协调性/分氧化味/分感官评分/分CSZ 1 Z2 Z3 J2 J3 J4 78654766 78776887 13 16 14 16 17 14 16 16 17 15 17 17 17 17 17 17 14 17 15 14 13 17 17 16 13 18 15 16 18 15 18 18 71 82 74 75 75 78 82 80
3 结论
将葡萄酿酒副产物(葡萄籽、葡萄藤茎)中提取物添加至干白葡萄酒中,探讨干白葡萄酒在贮存过程中颜色参数、氧化还原电位、抗氧化能力、酚类化合物的变化,并对其进行感官评价,评估不同添加量葡萄酿酒副产物提取物对干白葡萄酒贮存期间品质的影响。结果表明,300 mg/L葡萄藤茎提取物的酒样对干白葡萄酒的颜色保护最佳;添加300 mg/L葡萄籽提取物的酒样氧化还原电位为222 mV,较空白对照组酒样降低了21%;添加300 mg/L葡萄籽提取物的酒样抗氧化性能最强,300 mg/L葡萄藤茎提取物的酒样抗氧化性次之,略高于添加SO2的酒样;添加300 mg/L葡萄藤茎提取物的酒样总酚、儿茶素、表儿茶素等主要多酚含量降低幅度最少,感官评分最高,为82分。综上,添加300 mg/L葡萄藤茎提取物对干白葡萄酒贮存期间品质有较好的保护作用。
[1]I JANCˇÁRˇOVÁ, L JANCˇÁRˇ, A NÁPLAVOVÁ, et al.A role of reductones in the monitoring of sulphur dioxide content in wines during their maturation and storage[J].Czech J Food Sci,2018,32(3):232-240.
[2]胡奇恒.敞口条件下红葡萄酒稳定性及新型抗氧化剂研究[D].郑州:河南工业大学,2019.
[3]COMUZZO P,ZIRONI R.Biotechnological strategies for controlling wine oxidation[J].Food Eng Rev,2013,5(4):217-229.
[4]LI H,GUO A,WANG H.Mechanisms of oxidative browning of wine[J].Food Chem,2008,108(1):1-13.
[5]苏静,龚荣.葡萄酒酿造过程中谷胱甘肽的研究进展[J].食品科学,2020,41(7):283-291.
[6]ARAPITSAS P,UGLIANO M,PERENZONI D,et al.Wine metabolomics reveals new sulfonated products in bottled white wines, promoted by small amounts of oxygen[J].J Chromatogr A,2015,1429:155-165.
[7]GIOVANI G,CANUTI V,ROSI I.Effect of yeast strain and fermentation conditions on the release of cell wall polysaccharides[J].Int J Food Microbiol,2010,137(2):303-307.
[8]PYRZYNSKA K.Analytical methods for the determination of trace metals in wine[J].Crit Rev Anal Chem,2004,34(2):69-83.
[9]CARLOS E,CARMEN G,PAULA M,et al.Effect of EDTA on divalent metal adsorption onto grape stalk and exhausted coffee wastes[J].J Hazard Mat,2008,152(2):476-85.
[10]常甜甜.干红葡萄酒中酚类物质和抗氧化性的研究[D].烟台:烟台大学,2020.
[11]BARROS A,GIRONES V A,TEXEIRA A,et al.Grape stems as a source of bioactive compounds:Application towards added-value commodities and significance for human health[J]. Phytochem Rev, 2015, 14(6):921-931.
[12]DUMITRIU D, PEINADO R A, PEINADO J, et al.Grape pomace extract improve the in vitro and in vivo antioxidant properties of wines from sun light dried Pedro Ximénez grapes[J].J Funct Food,2015,17:380-387.
[13]LLAUDY M C D,CANALS R,CANALS J M,et al.Influence of ripening stage and maceration length on the contribution of grape skins,seeds and stems to phenolic composition and astringency in wine-simulated macerations[J].Eur Food Res Technol,2008,226(3):337-344.
[14]MARCHANTE L,LOARCE L,IZQUIERDO-CANAS M P,et al.Natural extracts from grape seed and stem by-products in combination with colloidal silver as alternative preservatives to SO2 for white wines: Effects on chemical composition and sensorial properties[J].Food Res Int,2019,125:108594.
[15]陈晓艺.红葡萄酒颜色CIE L*a*b*方法研究[D].银川:宁夏大学,2016.
[16]NOGUEIRA D P,NEREA J,ESPARZA I,et al.Evaluation of grape stems and grape stem extracts for sulfur dioxide replacement during grape wine production[J].Curr Res Food Sci,2023,6:100453.
[17]王勇,张丽芬,强锋,等.葡萄酿酒副产物中酚类化合物种类、含量及抗氧化能力的比较[J].中国酿造,2024,43(5):224-229.
[18]孙玉霞.葡萄藤茎中多酚物质提取及其抗氧化能力的研究[D].济南:山东大学,2011.
[19]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB 15038—2006 葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
[20]葛正凯,黄倩,李洁,等.不同抗氧化剂对白葡萄酒品质的影响[J].中国酿造,2020,39(10):136-144.
[21]刘佩.不同多酚提取物理化性质及其对葡萄酒颜色和涩感的影响研究[D].西安:陕西师范大学,2021.
[22]汤晓宏,丁燕,高德艳,等.基于CIELab色空间法分析海底陈酿对葡萄酒色泽的影响[J].中外葡萄与葡萄酒,2022(5):88-92.
[23]马雷.天然抑菌剂在葡萄酒酿造中的应用[D].大连:大连工业大学,2017.
[24]郝振铭.壳寡糖在葡萄酒中抗氧化性和抑菌性研究[D].大连:大连工业大学,2020.
[25]RAPOSO R, CHINNICI F, RUIZ-MORENO M J, et al.Sulfur free red wines through the use of grapevine shoots:impact on the wine quality[J].Food Chem,2018,243:453-460.