微生物在葡萄酒发酵过程中起着重要的作用[1],微生物通过代谢产生多种香气物质及挥发性代谢产物,包括酯类、高级醇类、挥发性酸类、萜类、苯衍生物、含硫化合物等,造就了丰富的葡萄酒感官特性[2]。
不同产区微生物也有一定差异,最终对葡萄酒香气及品质也产生不同的影响。赵昱等[3]比较4个产区酿酒葡萄果皮微生物发现,不同产区酿酒葡萄上的优势微生物存在一定差异,主要与当地气候、水源、栽培等因素有关。来源于葡萄园的酵母菌日益适应当地的气候、土壤条件,使其在葡萄酒发酵过程中充分发挥主导作用,从而展现出本土特色[4]。生产车间中与葡萄汁接触的生产区、运输工具等都蕴含着丰富的具有本土特色的酵母菌[5]。目前越来越多的研究者对本土酵母进行研究。刘沛通等[6]从辽宁、新疆、湖南3个产区分离得到具有较好耐受性且H2S产量低的本土酵母菌株。冯莉等[7]在甘肃和宁夏地区分离出具有良好嗜杀性、耐受性和较强发酵效力的克鲁维毕赤酵母(Pichia kluyveri)。
葡萄园及葡萄酒生产车间都蕴含着丰富的酵母菌资源,本土特色的优良酵母菌株的筛选与应用对葡萄酒本土风格的形成具有重要意义,不仅可以解决当地葡萄酒商依靠进口活性干酵母导致的品种风格单一、品质同质化问题,也可以进一步发展丰富我国本土酵母菌库,体现本土葡萄酒特色[5]。河北省怀来县位于世界葡萄种植的黄金地带,拥有着悠久的葡萄栽培历史、适宜的气候条件和优越的地理条件,在我国葡萄酒产业发展中起着重要作用[8]。但对于怀来地区真菌微生物多样性及本土优良酵母的筛选与应用却鲜有研究。
近年来,高通量技术广泛应用于食品发酵过程中微生物多样性的研究,可以在较短时间内完成大量的序列测序分析检测工作,快速进行复杂的微生物菌落的多样性分析,并且可以检测到丰度较低以及活的不可培养的微生物。采用传统培养与高通量测序技术相结合的方法,可以取长补短,从不同侧面反映微生物的菌群结构,继而可以更加全面地揭示微生物的菌落信息[9]。
本研究利用Illumina MiSeq高通量测序技术对采集到的河北怀来葡萄园葡萄、土壤、生产车间以及葡萄酒发酵过程的样品进行真菌多样性解析,探究怀来地区葡萄园葡萄、土壤、生产车间及发酵过程中真菌多样性的动态变化。利用传统培养的方法对微生物进行分离筛选及鉴定,并将筛选到的优良菌株应用于葡萄酒发酵,探讨不同菌株酿造葡萄酒的发酵速率、理化指标及香气物质差异,基于挥发性风味物质进行主成分分析(principal component analysis,PCA)及层次聚类分析(hierarchical cluster analysis,HCA),并对葡萄酒进行感官评价。旨在为开发具有本土特色、丰富葡萄酒香气、改善葡萄酒品质的优良酵母菌株资源提供技术支持,为深入开展本土优良酵母的应用研究提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
葡萄园葡萄、土壤、生产车间及发酵过程样品:河北怀来某酒庄;商业对照菌株BDX:法国莱蒙特公司。
1.1.2 化学试剂
果胶酶(60 000 U/mL):北京博奥拓达科技公司;Power SoilR脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:美国MoBio公司;2×Taq聚合酶链式反应(polymerase chain reaction,PCR)Master Mix:天根生物化学科技(北京)有限公司;引物内转录间隔区(internal transcribed spacer,ITS)1、ITS4:上海生工生物技术有限公司;亚硫酸(分析纯):上海麦克林试剂有限公司;蛋白胨、酵母浸粉(均为生化试剂)、氯化钠(分析纯):北京奥博星生物技术有限责任公司;琼脂糖:北京欣兴唐生物科技有限公司。
1.1.3 培养基
孟加拉红培养基、酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:北京博奥拓达科技公司。
1.2 仪器与设备
DPH-9052恒温培养箱:太仓市实验设备有限公司;YXQLS-50S11立式压力蒸汽灭菌锅:上海申安医疗仪器厂;6890-5973N气相色谱-质谱(gaschromatography-massspectrometry,GC-MS)联用仪:广州易析科技有限公司;Y350半自动葡萄酒分析仪:西班牙Bio Systems S.A.公司;ND-2000 Nanodrop微量紫外分光光度计:美国Thermo公司;GeneAmpR 9700型PCR仪:美国ABI公司;PowerPace Basic琼脂糖凝胶电泳仪:美国Bio-Rad公司;5424R离心机:德国Eppendorf公司;Min-Beadbeater-16珠磨式组织研磨器:美国BioSpec公司。
1.3 方法
1.3.1 酵母菌的分离纯化
采集河北怀来某酒庄葡萄园新鲜赤霞珠、马瑟兰葡萄果实,葡萄园土壤,生产车间压榨设备、前处理设备、发酵桶内壁无菌环境涂布样品以及葡萄酒发酵中、末期样品进行梯度稀释,稀释梯度为10%。选取各自适宜稀释度,涂布于孟加拉红培养基,于28 ℃恒温静置培养2 d。挑取单菌落纯化3次。
1.3.2 酵母菌的鉴定
分子生物学鉴定:依据真菌基因组DNA提取试剂盒说明书提取DNA,以真菌总DNA为模板进行PCR扩增,采用ITS通用引物(上游引物ITS1:5'-TCCGTAGGTGAACCTGCGG-3';下游引物ITS4:5'-TCCTCCGCTTATTGATATGC-3')。PCR扩增体系:DNA模板1 μL、ITS1和ITS4各1 μL、2×Taq PCR Master Mix10 μL、双蒸水(ddH2O)补充至25 μL。PCR扩增程序[10]:95 ℃预变性5 min;95 ℃变性45 s,52 ℃退火2 min,72 ℃延伸1 min,35个循环;72 ℃再延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测合格后,送至擎科生物工程公司进行测序。将获得的ITS序列提交至美国国家生物技术信息中心(national center for biotechnologyinformation,NCBI)的GenBank数据库中进行基本局部比对搜索工具(basic local alignmentsearchtool,BLAST)同源性比对分析,利用MEGA 7.0软件中邻接(neighbor joining,NJ)法构建系统进化树[11]。
1.3.3 高通量测序分析
将不同样品的适宜梯度的稀释液,参照PowerSoilR DNA提取试剂盒的步骤,先加入含有十二烷基硫酸钠(sodium dodecyl sulfate,SDS)的细胞裂解试剂,采用Mini-Beadbeater研磨3 min冰浴2 min防止样品温度过高。用微量蛋白核酸测定仪检测提取后的DNA质量,满足测序条件的DNA送至上海美吉生物医药科技公司,根据Illumina MiSeq测序平台进行高通量测序[12],利用Usearch 7.1软件对非重复序列进行操作分类单元(operational taxonomic units,OTU)聚类分析,并对应相应的数据库进行分类学分析[13]。
1.3.4 半干型红葡萄酒的制备
在10 L不锈钢发酵罐内,装入8 kg的已除梗破碎后的赤霞珠葡萄,分别加入0.1 g/kg的果胶酶和1 mL/L的亚硫酸溶液。分别接种用28 ℃葡萄汁活化15 min的所筛选出的5株优良酵母菌株,每个菌株进行3次重复试验,同时以商业酵母BDX和不加入酵母菌株的自然发酵(ZR)作为对照试验,除ZR外其余菌株接种量均为1×106 CFU/mL。在28 ℃环境下静置发酵16 d,每天测量各个罐内发酵液比重,确定其发酵情况。待比重数值稳定不在变化,终止发酵,即得半干型红葡萄酒(残糖含量4~12 g/L)。
1.3.5 分析检测
(1)葡萄酒理化指标
参照国标GB 15037—2006《葡萄酒》测定葡萄酒的pH、游离硫、总硫、挥发酸、酒精度、干浸出物和残糖[14]。
(2)葡萄酒香气物质
利用GC-MS法对酒样的香气物质进行检测[15]。参考谢春梅等[16]的研究方法并结合相关文献进行定性分析,采用面积归一法进行定量分析[17-18]。
(3)葡萄酒感官评价
邀请14位具有品酒师资格的人员对发酵后的半干型红葡萄酒进行感官评价,感官评价标准见表1。首先对商业酵母BDX发酵的葡萄酒进行百分制打分,将感官评价员的结果进行汇总,以此为基准,对不同酵母菌发酵的葡萄酒进行香气评价打分,同时允许增加描述词进行打分。
表1 半干型红葡萄酒感官评价标准
Table 1 Sensory evaluation standards of semi-dry wine
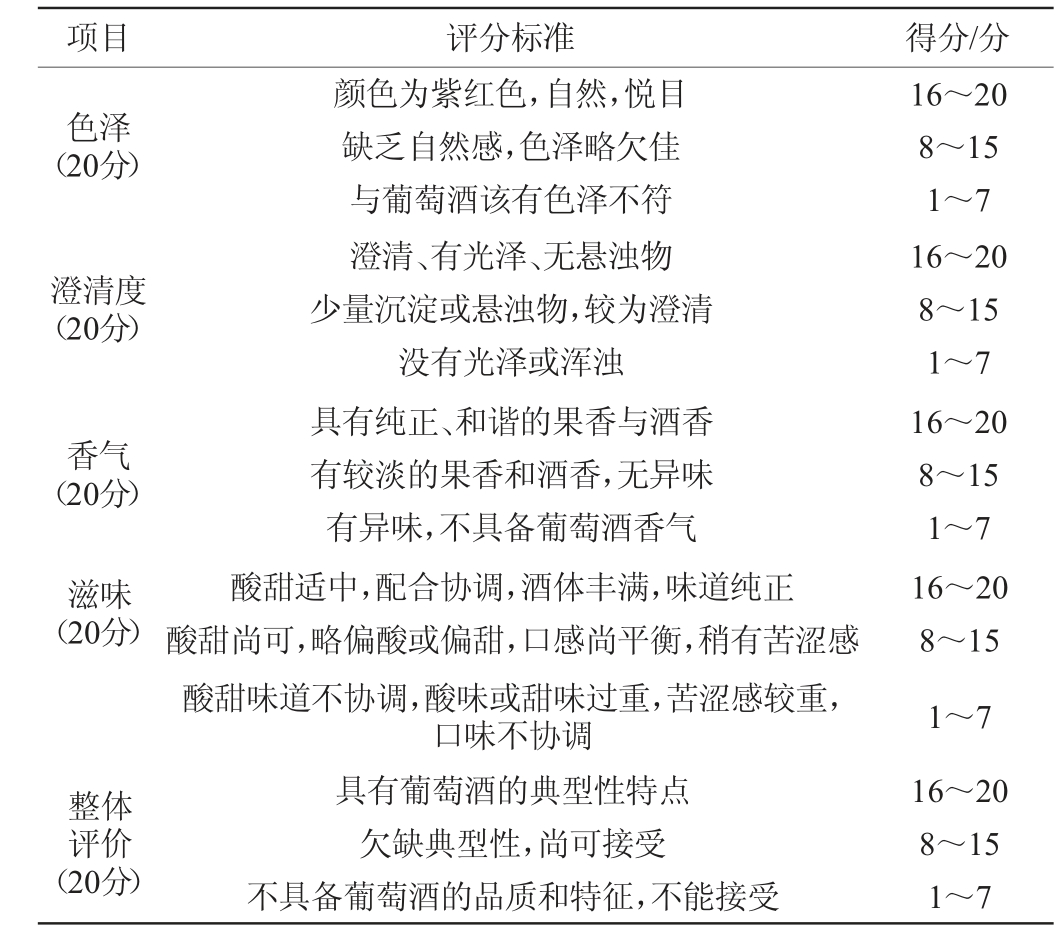
项目 评分标准 得分/分色泽(20分)澄清度(20分)香气(20分)16~20 8~15 1~7 16~20 8~15 1~7 16~20 8~15 1~7滋味(20分)颜色为紫红色,自然,悦目缺乏自然感,色泽略欠佳与葡萄酒该有色泽不符澄清、有光泽、无悬浊物少量沉淀或悬浊物,较为澄清没有光泽或浑浊具有纯正、和谐的果香与酒香有较淡的果香和酒香,无异味有异味,不具备葡萄酒香气整体评价(20分)酸甜适中,配合协调,酒体丰满,味道纯正酸甜尚可,略偏酸或偏甜,口感尚平衡,稍有苦涩感酸甜味道不协调,酸味或甜味过重,苦涩感较重,口味不协调具有葡萄酒的典型性特点欠缺典型性,尚可接受不具备葡萄酒的品质和特征,不能接受16~20 8~15 1~7 16~20 8~15 1~7
1.3.6 数据处理
采用SPSS 22.0进行显著性差异分析,采用SIMCA-14.1软件对不同时期的不同发酵阶段的风味物质进行主成分分析(PCA)、层析聚类分析(HCA)。
2 结果与分析
2.1 葡萄园葡萄、土壤、发酵车间及葡萄酒发酵过程中样品微生物多样性分析
为了揭示葡萄园葡萄、土壤、及酿造车间环境及葡萄酒发酵过程中微生物的多样性,采用高通量测序技术[19]对采集到的样品进行微生物多样性的分析,结果见图1。马瑟兰葡萄种植土壤和赤霞珠葡萄种植土壤的微生物的多样性显著高于其他样品,说明在所有样品中葡萄园土壤的真菌相对丰度最高,此结果与魏玉洁等[20]的研究一致。葡萄酒发酵过程中的微生物多样性较单一,这可能是由于在发酵过程中,产生大量的乙醇和有机酸,抑制了大部分微生物的生长,使微生物多样性逐渐降低。
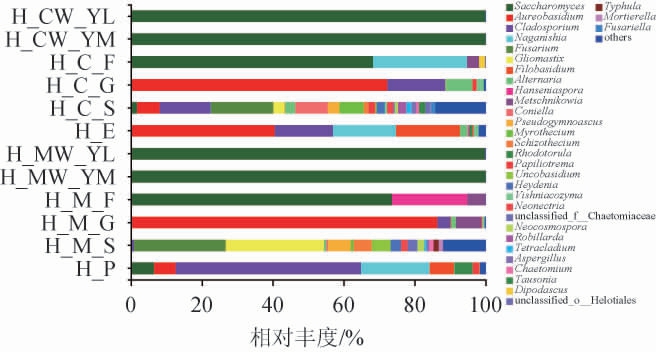
图1 不同菌株酿造葡萄酒样品在属水平的真菌群落结构
Fig.1 Fungal community structure of wine samples brewed by different strains at genus level
HP为压榨机设备;H_M_S为马瑟兰种植土壤;H_M_G为马瑟兰葡萄;H_M_F为马瑟兰发酵桶内壁;H_MW_YM为马瑟兰葡萄酒发酵中期;H_MW_YL为马瑟兰葡萄酒发酵末期;H_E为前处理设备;H_C_S为赤霞珠种植土壤;H_C_G为赤霞珠葡萄;H_C_F为赤霞珠发酵桶内壁;H_CW_YM为赤霞珠葡萄酒发酵中期;H_CW_YL为赤霞珠葡萄酒发酵末期。
由图1可知,相对丰度>1.0%的真菌菌属为酵母属(Saccharomyces)、短梗霉属(Aureobasidium)、枝孢属(Cladosporium)、镰刀菌属(Fusarium)、粘鞭霉属(Gliomastix)、链格孢属(Altemaria)、汉逊酵母(Hanseniaspora)、梅奇酵母属(Metschnikowia)、垫壳孢属(Coniella)、假裸囊菌属(Pseudogymnoascus)、漆斑菌属(Myrothecium)、红酵母属(Rhodotorula)和新赤壳属(Neocosmospora)等。
由图1亦可知,酵母属相对丰度占比最大,在葡萄酒发酵中后期其相对丰度达到99%以上,这种现象是由于酵母菌在葡萄酒发酵过程中产生大量乙醇,从而抑制其他菌属生长所导致的。赤霞珠葡萄酒发酵桶内壁和马瑟兰葡萄酒发酵桶内壁的优势菌均为酵母属,其相对丰度分别为68.29%和73.59%,这是由于发酵桶内壁与发酵液相接触,使得酵母属在内壁富集成为优势菌,从而抑制其他菌属的生长。种植土壤所包含的微生物种类最丰富,主要有镰刀菌属、粘鞭霉属、链格孢属和枝孢属,这与张家晨[21]研究宁夏葡萄酒产区土壤微生物多样性内容相似,与VINCENT R等[22]研究的土壤中的优势真菌菌属为酿酒酵母属和地霉菌属不同。证明不同地区土壤样品在属水平上的物种多样性有一定的差异。赤霞珠葡萄相对丰度最多的是短梗霉菌,其次是粘鞭霉属、链格孢属和梅奇酵母属,与薛蓓等[23]研究的贺兰山东麓赤霞珠葡萄的优势菌属为链格孢属、枝孢属、镰刀菌属、毛壳菌属和亚隔孢壳属存在差异,说明不同产区在属水平上相同葡萄品种的真菌多样性不同。对葡萄进行分析,发现马瑟兰葡萄相较赤霞珠葡萄,特有梅奇酵母属和Filobasidium。这与丁建才等[24]研究昌黎马瑟兰葡萄的优势菌属为汉逊酵母属有一定的差异,说明同种葡萄在不同地区,在真菌属水平上也存在一定差异性。根据图1,分析不同种植土壤发现,马瑟兰葡萄种植土壤主要包括镰刀菌属、粘鞭霉属、假裸囊菌属和裂壳菌属,赤霞珠葡萄种植土壤主要包括镰刀菌属、短梗霉属、枝孢属、垫壳孢属和漆斑菌属。这说明不同葡萄种植土壤真菌菌属存在差异。
综上可知,在属水平上,怀来地区与其他地区土壤和同一品种葡萄的物种多样性存在差异。对河北省内各省的葡萄进行分析,发现不同区县同一葡萄品种的优势菌也存在一定的差异。葡萄酒发酵过程中主要以酵母属为优势菌,葡萄园土壤、车间环境以及葡萄表面微生物菌落结构丰富。为后续不同种属优良酵母的筛选提供理论依据。
2.2 酵母的分离纯化及鉴定
从样品中共分离出104株酵母菌,基于ITS基因序列筛选菌株的系统发育树,结果见图2。由图2可知,相同的种被列在同一主分支上,表明其亲缘关系较近,具有一定的亲缘性;反之则反。
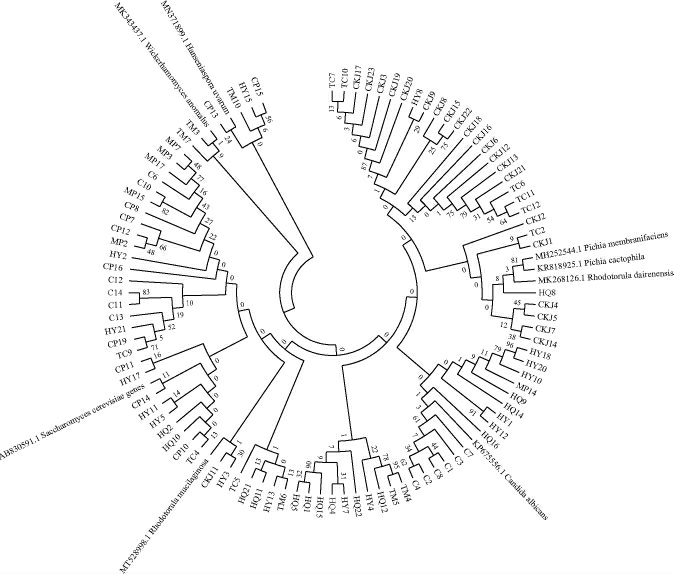
图2 基于ITS基因序列筛选菌株的系统发育树
Fig.2 Phylogenetic tree of screened strains based on ITS gene sequence
由图2可知,104株酵母菌中有孢汉生酵母菌属(Hanseniaspora)5株、红酵母属(Rhodotorula)17株、威克汉姆酵母属(Wickerhamomyces)23株、假丝酵母属(Candida)7株、酿酒酵母属(Saccharomyces)31株、梅奇酵母属(Metschnikowia)14株、毕赤酵母属(Pichia)7株。
通过杜氏小管产气法和酒精度、糖度、SO2耐受性试验综合筛选,最终筛选出的5株优良酵母:酿酒酵母(Saccharomyces cerevisiae)CKJ20,高渗汉逊酵母(Hansenomyces hyperosmolar)HQ16、高渗汉逊酵母(Hansenomyces hyperosmolar)HQ11、美极梅奇酵母(Metschnikowia pulcherrima)HY21、美极梅奇酵母(Metschnikowia pulcherrima)MP14,将其用于半干型红葡萄酒的发酵实验,以评价本土酵母菌的酿造特性。
2.3 葡萄酒发酵过程中比重的动态变化
比重是葡萄酒发酵过程中的一个重要物理参数,直观地反映葡萄酒酒体在发酵过程中的复杂变化。目前,在葡萄酒的发酵过程中,普遍选用比重作为葡萄酒发酵进程的监测指标[25]。高畅等[26]研究发现,酒精度每增加1%vol,对应发酵液的比重下降0.009 57。接种不同菌株发酵过程中比重的动态变化结果见图3。
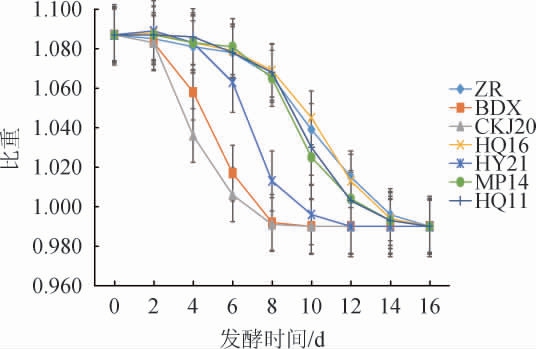
图3 不同菌株酿造葡萄酒发酵过程中比重的变化
Fig.3 Changes of gravity of wines brewed by different strains during fermentation process
ZR:自然发酵的葡萄酒;BDX:商业酵母发酵的葡萄酒;CKJ20:酿酒酵母CKJ20发酵的葡萄酒;HQ16:高渗汉逊酵母HQ16发酵的葡萄酒;HQ11:高渗汉逊酵母HQ11发酵的葡萄酒;HY21:美极梅奇酵母HY21发酵的葡萄酒;MP14:美极梅奇酵母MP14发酵的葡萄酒。下同。
由图3可知,葡萄酒发酵起始比重均为1.087,发酵结束比重为0.990。商业酵母BDX和酿酒酵母CKJ20发酵液的比重快速下降,酿酒酵母CKJ20菌株发酵液第2天的比重为1.083,第4天为1.036,第6天下降到1.006,第8天后保持稳定。BDX菌株发酵液第2天的比重为1.083,第4天为1.058,第6天下降到1.017,第8天后不再变化。说明酿酒酵母CKJ20菌株发酵液起始发酵速率最快,其次是商业酵母BDX菌株发酵液,均于发酵第8天后停止发酵。美极梅奇酵母HY21菌株发酵液在第6~8天比重下降速度最快,12 d后基本保持稳定,说明其启动发酵速率相较酿酒酵母缓慢,但整体发酵周期较短。其他菌株发酵液中比重下降速度缓慢,均于16 d后停止发酵,与靳华荣[27]利用不同酵母在霞多丽葡萄酒发酵过程中17 d停止发酵的研究结果相接近。表明不同酵母菌株在发酵过程中对葡萄糖的利用转化率存在差异,酿酒酵母CKJ20、美极梅奇酵母HY21菌株与商业酵母一样,整体发酵周期相较其他酵母菌株短,具有较高的葡萄糖转化率。综上表明,商业酵母BDX和酿酒酵母CKJ20菌株发酵液起始发酵速率>美极梅奇酵母HY21菌株发酵液起始发酵速率>其他菌株发酵液起始发酵速率。从比重变化来看,酿酒酵母CKJ20菌株和美极梅奇酵母HY21菌株发酵特性较好,起始发酵早,发酵速率快。
2.4 葡萄酒理化指标检测
在发酵过程中,酵母菌对糖的转换能力可以由残糖量来表现,残糖量越低说明酵母发酵越彻底,对糖的利用率越高[28]。不同酵母菌酿造葡萄酒理化指标测定结果见表2。
表2 不同菌株酿造葡萄酒理化指标测定结果
Table 2 Determination results of physiochemical indexes of wines brewed by different strains
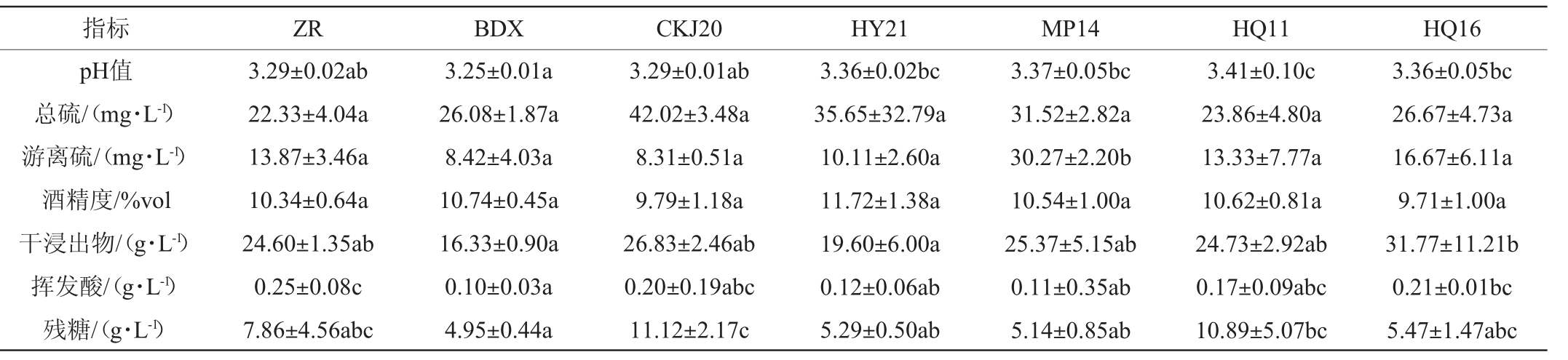
注:同一行不同字母表示在不同处理间有显著性差异(P<0.05)。
指标 ZR BDX CKJ20 HY21 MP14 HQ11 HQ16 pH值总硫/(mg·L-1)游离硫/(mg·L-1)酒精度/%vol干浸出物/(g·L-1)挥发酸/(g·L-1)残糖/(g·L-1)3.29±0.02ab 22.33±4.04a 13.87±3.46a 10.34±0.64a 24.60±1.35ab 0.25±0.08c 7.86±4.56abc 3.25±0.01a 26.08±1.87a 8.42±4.03a 10.74±0.45a 16.33±0.90a 0.10±0.03a 4.95±0.44a 3.29±0.01ab 42.02±3.48a 8.31±0.51a 9.79±1.18a 26.83±2.46ab 0.20±0.19abc 11.12±2.17c 3.36±0.02bc 35.65±32.79a 10.11±2.60a 11.72±1.38a 19.60±6.00a 0.12±0.06ab 5.29±0.50ab 3.37±0.05bc 31.52±2.82a 30.27±2.20b 10.54±1.00a 25.37±5.15ab 0.11±0.35ab 5.14±0.85ab 3.41±0.10c 23.86±4.80a 13.33±7.77a 10.62±0.81a 24.73±2.92ab 0.17±0.09abc 10.89±5.07bc 3.36±0.05bc 26.67±4.73a 16.67±6.11a 9.71±1.00a 31.77±11.21b 0.21±0.01bc 5.47±1.47abc
由表2可知,不同酵母菌酿造葡萄酒理化指标均满足QB/T 5476—2020《果酒通用技术要求》要求。除了商业酵母BDX菌株发酵的葡萄酒外,其他菌株发酵的葡萄酒残糖含量均>5g/L。残糖含量越低,酒精度越高说明其发酵越彻底,可以高效的将葡萄糖转换成酒精。由表2可知,商业酵母BDX菌株发酵能力最强,酿酒酵母CKJ20和高渗汉逊酵母HQ11菌株能力较弱。从理化指标来看,在筛选的酵母菌株中,美极梅奇酵母HY21菌株、MP14菌株和高渗汉逊酵母HQ16菌株发酵的葡萄酒残糖含量与商业酵母无显著性差异(P>0.05),其中美极梅奇酵母HY21菌株发酵的葡萄酒酒精度最高,为11.72%vol,说明其发酵能力较其他菌株更强。因此,可以依据不同菌株的发酵特性生产不同风格特征的葡萄酒。
2.5 葡萄酒香气分析
采用不同酵母菌株发酵的葡萄酒,其香气种类和含量上存在一定的差异,这些差异性会给葡萄酒带来不一样的香气特征,同时影响葡萄酒的整体感官品质。
由表3可知,不同菌株酿造葡萄酒共检出58种挥发性风味物质,包括醇类16种,酯类25种,酸类7种,酮类3种,醛类3种,酚类4种。其中苦杏仁味的异戊醇含量最高。自然发酵的葡萄酒(ZR)共检出30种挥发性风味物质,香气占比含量较高的有仲辛醇和辛酸乙酯,具有一定的甜果香味,其次是具有玫瑰花香的苯乙醇,相对含量分别为34.026%、14.495%、12.819%。美极梅奇酵母HY21、高渗汉逊酵母HQ11和HQ16酿造的葡萄酒分别共检出43种、30种和31种挥发性风味物质。相对含量较高均为苯乙醇,分别为10.211%、18.165%和10.452%。美极梅奇酵母MP14酿造的葡萄酒33种挥发性风味物质。相对含量较高的为正己酸乙酯,可以产生令人愉快的香气,其次是辛酸乙酯,分别为25.907%,22.365%。商业酵母BDX酿造的葡萄酒共检出挥发性风味物质15种。
表3 不同菌株酿造葡萄酒挥发性风味成分含量测定结果
Table 3 Determination results of volatile flavor components contents in wines brewed by different strains
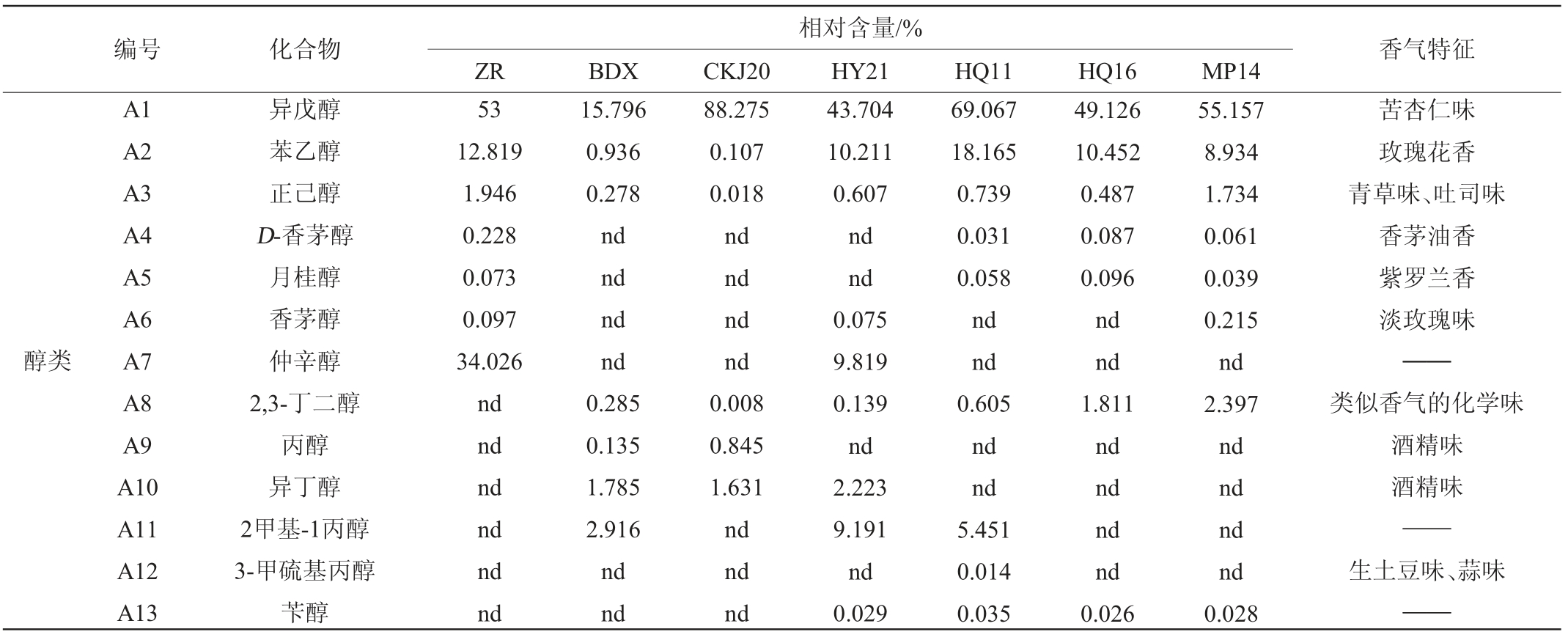
醇类编号 化合物 香气特征相对含量/%ZR BDX CKJ20 HY21 HQ11 HQ16 MP14 A1 A2 A3 A4 A5 A6 A7 A8 A9 A10 A11 A12 A13异戊醇苯乙醇正己醇D-香茅醇月桂醇香茅醇仲辛醇2,3-丁二醇丙醇异丁醇2甲基-1丙醇3-甲硫基丙醇苄醇53 12.819 1.946 0.228 0.073 0.097 34.026 nd nd nd nd nd nd 15.796 0.936 0.278 nd nd nd nd 0.285 0.135 1.785 2.916 nd nd 88.275 0.107 0.018 nd nd nd nd 0.008 0.845 1.631 nd nd nd 43.704 10.211 0.607 nd nd 0.075 9.819 0.139 nd 2.223 9.191 nd 0.029 69.067 18.165 0.739 0.031 0.058 nd nd 0.605 nd nd 5.451 0.014 0.035 49.126 10.452 0.487 0.087 0.096 nd nd 1.811 nd nd nd nd 0.026 55.157 8.934 1.734 0.061 0.039 0.215 nd 2.397 nd nd nd nd 0.028苦杏仁味玫瑰花香青草味、吐司味香茅油香紫罗兰香淡玫瑰味——类似香气的化学味酒精味酒精味——生土豆味、蒜味——
续表

酯类酸类酮类醛类相对含量/%ZR BDX CKJ20 HY21 HQ11 HQ16 MP14编号 化合物 香气特征A14 A15 A16——甜味、淡花香——B1 B2 B3 B4 B5 B6 B7 B8 B9 B10 B11 B12 B13 B14 B15 B16 B17 B18 B19 B20 B21 B22 B23 B24 B25愉快的气味水果香、甜杏仁味脂肪味、果味果香、新鲜香蕉味花香、蜂蜜香果香、甜香、茴香香奶香、肥皂香脂肪香、甜味、水果味新鲜果香果香、酯香蜡香、皂香、果香梨味、蜡味柑橘味——葡萄味———微带果香的酒香草莓香、酸果香———香蕉味、梨味椰子味、蜂蜡香———C1 C2 C3 C4 C5 C6 C7蜡味猫屎味、汗臭味奶酪味、酸败味脂肪味脂肪味、酸败味略带脂肪气味乳香味、蜡味D1 D2 D3紫罗兰香、覆盆子——花香、果香、紫丁香E1 E2 E3正辛醇异辛醇庚醇数量正己酸乙酯乙酸己酯癸酸乙酯乙酸异戊酯乙酸苯乙酯辛酸乙酯月桂酸乙酯棕榈酸乙酯庚酸乙酯壬酸乙酯癸酸甲酯辛酸3-甲基丁酯辛酸甲酯乙酸癸酯9-癸酸乙酯邻苯二甲酸二丁酯乙基9-癸烯酸酯乙酸乙酯丁酸乙酯2-己烯酸乙酯4-羟基丁酸内酯己酸异戊酯肉豆蔻酸乙酯溴乙酸癸酯邻苯二甲酸异丁酯数量乙酸己酸辛酸癸酸棕榈酸硬脂酸肉豆蔻酸数量乙位紫罗兰酮1-苯基-4-戊酮大马士酮数量癸醛4-乙基苯甲醛3,5-二甲基苯甲醛数量nd nd nd 7 7.486 1.056 3.573 11.262 2.044 14.495 0.605 0.012 0.038 0.048 0.011 0.055 0.038 0.004 0.295 0.015 nd nd nd nd nd nd nd 0.104 nd 17 nd nd 0.366 nd nd nd nd 1 nd nd 0.171 1 0.095 0.029 nd 2 nd nd nd 7 0.306 0.033 0.684 2.384 0.028 nd nd nd nd nd nd nd nd nd nd nd 0.02 1.234 nd nd nd 2.384 nd nd nd 8 nd nd nd nd nd nd nd 0 nd nd nd 0 nd nd nd 0 nd nd nd 6 0.361 0.985 0.144 0.316 0.033 0.774 nd nd nd nd nd nd nd nd nd nd nd 0.985 nd nd nd 0.316 nd nd nd 8 0.372 nd nd nd nd nd nd 1 nd nd nd 0 nd nd nd 0 nd 0.045 nd 10 6.223 0.513 4.891 5.459 nd 16.561 0.257 0.015 0.126 0.033 0.025 0.096 0.077 0.012 0.287 0.175 nd 4.562 0.154 0.209 nd 5.459 0.033 0.062 0.175 22 nd nd 0.145 0.058 0.337 0.08 0.016 5 0.001 0.601 0.096 3 0.058 nd nd 1 0.017 nd nd 10 5.779 0.537 6.05 4.09 1.485 14.949 0.163 0.022 0.088 0.029 0.013 0.037 nd nd nd nd 0.195 nd 0.301 0.178 nd nd nd nd nd 15 nd 0.036 0.238 nd nd nd nd 2 nd nd 0.082 1 nd nd nd 0 0.069 nd nd 8 0.43 0.655 2.534 0.952 14.414 6.496 0.258 0.043 0.032 0.066 0.008 0.02 0.022 nd nd nd 0.246 nd nd nd 0.078 nd nd nd nd 15 nd 0.076 0.528 0.101 nd nd nd 3 nd nd 0.078 1 0.03 nd 0.036 2 0.098 nd 0.537 10 25.907 0.54 6.048 nd nd 22.365 0.319 0.015 0.157 nd 0.028 0.077 0.147 nd nd 0.167 nd nd nd 0.442 0.11 nd nd nd 0.046 14 1.331 0.121 0.257 0.094 nd nd nd 4 nd nd 0.174 1 0.094 nd 0.044 2甜香、果香、柑橘香———
续表
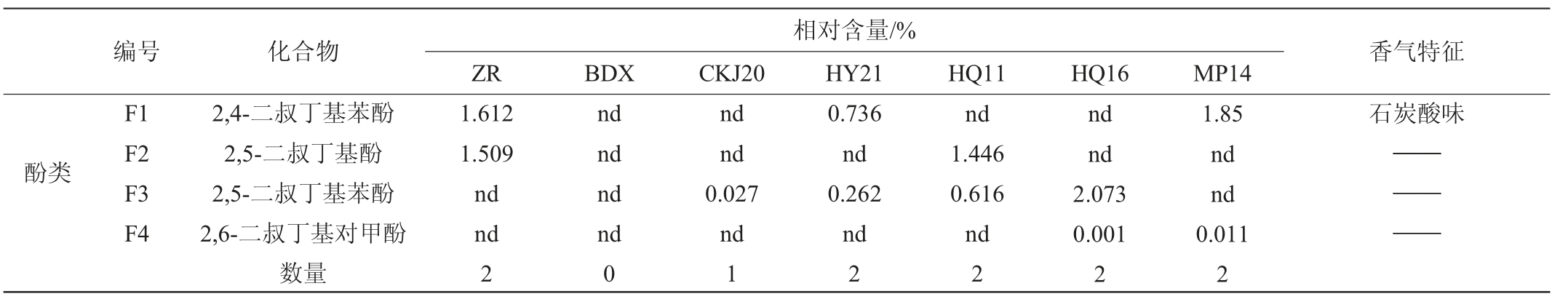
注:“nd”未检测到香气物质;“——”未查阅到相关资料;香气特征在https://www.vcf-online.nl/VcfHome.cfm查阅获得。
相对含量/%ZR BDX CKJ20 HY21 HQ11 HQ16 MP14编号 化合物 香气特征酚类F1 F2 F3 F4 2,4-二叔丁基苯酚2,5-二叔丁基酚2,5-二叔丁基苯酚2,6-二叔丁基对甲酚数量1.612 1.509 nd nd 2 nd nd nd nd 0 nd nd 0.027 nd 1 0.736 nd 0.262 nd 2 nd 1.446 0.616 nd 2 nd nd 2.073 0.001 2 1.85 nd nd 0.011 2石炭酸味————
不同酵母菌株发酵的葡萄酒所产生的醇类、酯类、醛酮类等香气物质含量及种类各不相同,其中醇类和酯类是葡萄酒中主要的香气物质。醇类物质是葡萄酒发酵的重要产物,低浓度醇可以增加葡萄酒香气复杂性,浓度过高则会产生令人不愉快的气味,不同种类所贡献的香气也有所差别[29]。除酿酒酵母CKJ20菌株酿造的葡萄酒外,其余本土酵母菌株酿造的葡萄酒所含醇类种类均高于商业酵母BDX所发酵的葡萄酒,其中种类最丰富的是美极梅奇酵母MP14菌株发酵的葡萄酒具有10种醇类物质。酯类物质对葡萄酒二级香气起着重要的作用,通常带有果香与花香,不同物质之间会有一定的差异。酯类物质在不同菌株发酵的葡萄酒中,香气种类占比均处于最高值,其中种类最丰富的是美极梅奇酵母HY21菌株发酵的葡萄酒含有22种酯类物质,最低的是酿酒酵母CKJ20菌株和商业酵母BDX发酵的葡萄酒含有8种。从挥发性风味物质测定结果来看,美极梅奇酵母HY21菌株酿造的葡萄酒更佳,其酸类、酮类及挥发性风味物质总种类最多,增加了葡萄酒香气复杂性。
2.6 不同菌株酿造葡萄酒挥发性风味物质主成分分析及层次聚类分析
基于挥发性风味物质对不同酵母菌株酿造葡萄酒进行层次聚类分析及主成分分析,结果见图4。
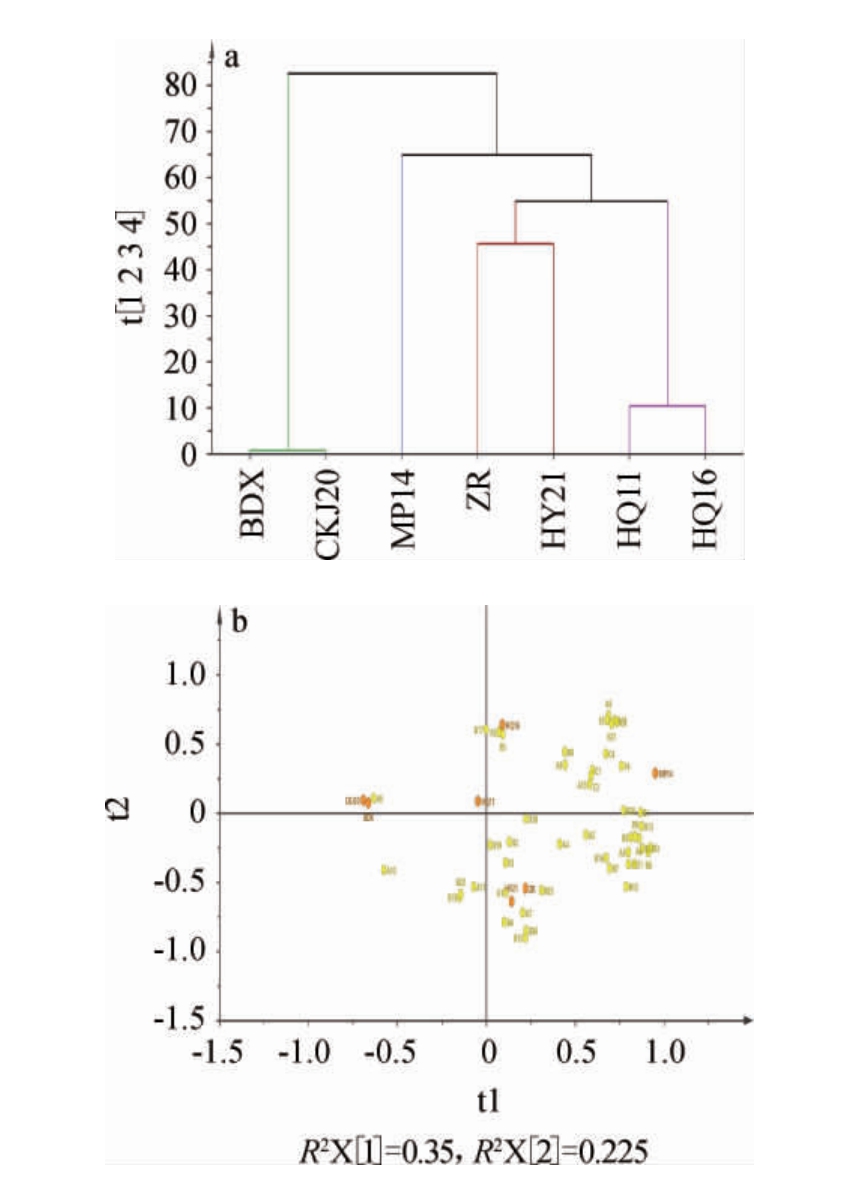
图4 基于挥发性风味物质不同酵母酿造葡萄酒层次聚类分析(a)及主成分分析(b)
Fig.4 Hierarchical cluster analysis (a) and principal component analysis (b) of wines brewed by different strains based on volatile flavor compounds
由图4a可知,不同酵母菌株发酵的葡萄酒可分为4组:商业酵母BDX发酵的葡萄酒与酿酒酵母CKJ20发酵的葡萄酒同为酿酒酵母菌发酵,聚在一起为第一组,美极梅奇酵母MP14发酵的葡萄酒为第二组,自然发酵(ZR)的葡萄酒和美极梅奇酵母HY21发酵的葡萄酒汇聚在一起为第三组,高渗汉逊酵母HQ11和HQ16发酵的葡萄酒为第四组。
由图4b可知,商业酵母BDX和酿酒酵母CKJ20菌株发酵的葡萄酒很好的汇聚在一起,结合表3,其主要香气物质为丙醇(A9),使得发酵葡萄酒的酒香气突出。美极梅奇酵母HY21菌株和自然发酵(ZR)的葡萄酒主要香气物质包含仲辛醇(A7)、乙酸异戊酯(B4)、9-癸酸乙酯(B15)、溴乙酸癸酯(B24),使得发酵的葡萄酒葡萄、香蕉等水果香味比较明显。高渗汉逊酵母HQ11和HQ16菌株发酵的葡萄酒乙基9-癸烯酸酯(B17)、2,5-二叔丁基苯酚(F3)含量较高。美极梅奇酵母MP14菌株发酵的葡萄酒主要香气物质为正己酸乙酯(B1)、庚酸乙酯(B9)、辛酸甲酯(B13)、2-己稀酸乙酯(B20)和2,6-二叔丁基对甲酚(F4),使得发酵的葡萄酒产生令人愉快的甜杏、柑橘等新鲜的水果香。这与SADINENI V等[30]研究发现,美极梅奇酵母在发酵中产生较高含量的甲基丁酯、甲基丙酯和苯乙酯等有一定的差异,说明不同酵母菌株仍存在一定种内差异。结果表明,通过PCA和HCA可以有效区分不同菌株酿造的葡萄酒。
2.7 葡萄酒感官评价
将14名感官评价员对商业酵母BDX发酵的葡萄酒的结果进行汇总,结果如下:青草和青梗味80分、花香60分、红色浆果香90分、黑色浆果香10分、仁果类香气20分、果酱果脯类香气10分、杂醇油味30分、药草和干草香气60分。以此为基准,对其他菌株发酵的葡萄酒进行香气分析及感官评价,结果见图5。
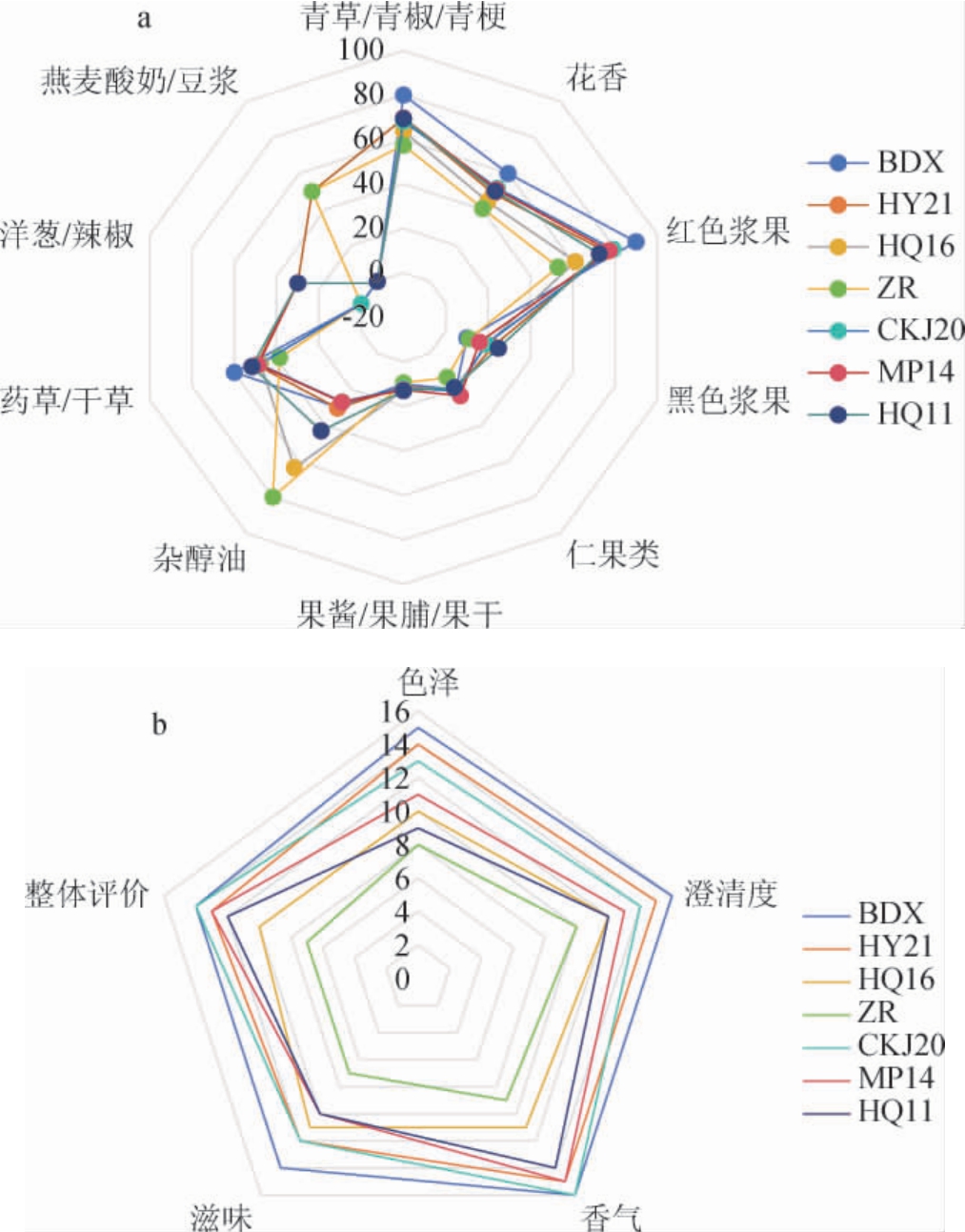
图5 不同菌株酿造葡萄酒香气分析(a)及感官评价(b)雷达图
Fig.5 Radar diagram of aroma analysis (a) and sensory evaluation(b) of wines brewed by different strains
由图5a可知,所有葡萄酒的青草、青梗、青椒的香气均较为突出。杂醇油类气味在不同酵母发酵的葡萄酒中存在显著差异,在自然发酵(ZR)和高渗汉逊酵母HQ16菌株发酵的葡萄酒中气味明显,在其他菌株发酵的葡萄酒中无显著性差异。商业酵母BDX菌株相较于其他酵母菌株发酵的葡萄酒来说,花香和红色浆果味比较浓郁,使得葡萄酒香气更具芳香,同时商业酵母BDX发酵的葡萄酒药草香气突出,增强葡萄酒香气复杂性。其他酵母菌株发酵的葡萄酒黑色浆果香气均高于商业酵母BDX发酵的葡萄酒,其中高渗汉逊酵母HQ11和美极梅奇酵母MP14菌株发酵的葡萄酒香气最明显。美极梅奇酵母MP14菌株和HY21菌株、高渗汉逊酵母HQ11和HQ16菌株与酿酒酵母CKJ20菌株发酵的葡萄酒的果酱类香气均高于商业酵母BDX发酵的葡萄酒,使得葡萄酒香气醇厚丰富,口感更具层次。
由图5b可知,商业酵母菌株酿造的葡萄酒在色泽、澄清度、滋味上,明显高于其他本土酵母酿造的葡萄酒。除商业酵母外,本土酿酒酵母CKJ20菌株酿造的葡萄酒在香气,整体评价均高于其他5组;美极梅奇酵母HY21菌株酿造的葡萄酒在色泽,澄清度上明显高于其他5组。美极梅奇酵母HY21菌株和本土酿酒酵母CKJ20菌株酿造的葡萄酒滋味均处于较高值。
综上,接种不同菌株发酵的葡萄酒具有不同的香气特点,结合试验结果综合考察,美极梅奇酵母HY21菌株更具有应用推广价值。
3 结论
本研究从河北怀来某酒庄葡萄园及酿造车间进行微生物采样,进行真菌微生物多样性分析。结果表明,葡萄园土壤微生物群落多样性最为丰富,主要优势真菌为镰刀菌属(Fusarium)、粘鞭霉属(Gliomastix);葡萄果皮上相对丰度最高的为短梗霉属(Aureobasidium)和枝孢属(Cladosporium);发酵液及发酵桶内壁的优势真菌为酵母属(Saccharomyces)。对所分离的104株酵母菌株进行筛选及鉴定,得到5株优良酵母菌,分别鉴定为酿酒酵母(Saccharomyces cerevisiae)CKJ20、高渗汉逊酵母(Hansenomyces hyperosmolar)HQ16、高渗汉逊酵母(Hansenomyces hyperosmolar)HQ11、美极梅奇酵母(Metschnikowia pulcherrima)HY21、美极梅奇酵母(Metschnikowia pulcherrima)MP14。菌株HY21发酵速率快,发酵产生的酯类、酸类、酚类和醛酮类香气丰富,赋予葡萄酒丰富的花香、果香;通过PCA和HCA可以有效区分不同菌株酿造的葡萄酒。美极梅奇酵母HY21菌株有潜力酿造河北怀来产区特色葡萄酒。本研究为河北省怀来县本土特色优良酵母菌资源的开发提供理论依据,对改善怀来县葡萄酒同质化问题具有重要意义。
[1]战吉宬,曹梦竹,游义琳,等.非酿酒酵母在葡萄酒酿造中的应用[J].中国农业科学,2020,53(19):4057-4069.
[2]TIAN T T,WU D H,NG C T,et al.A multiple-step strategy for screening Saccharomyces cerevisiae strains with improved acid tolerance and aroma profiles[J].Appl Microbiol Biot,2020,104(7):3097-3107.
[3]赵昱,李静媛,解万翠,等.四个不同产区酿酒葡萄果皮微生物多样性的研究[J].食品与发酵工业,2021,47(11):53-60.
[4]李婧.冰葡萄酒发酵过程中酵母菌群落演潜规律及优良菌株的筛选[D].大连:大连理工大学,2020.
[5]汤晓宏,胡文效.葡萄酿酒酵母研究进展[J].中外葡萄与葡萄酒,2012(5):53-57.
[6]刘沛通,许丹丹,许引虎,等.4株本土非酿酒酵母的发酵特性[J].食品科学,2021,42(14):86-93.
[7]冯莉,陈雪,李丽,等.5株克鲁维毕赤酵母的酿造学特性[J].中国食品学报,2018,18(12):66-73.
[8]白思远.怀来县葡萄产业竞争力研究[D].保定:河北农业大学,2021.
[9]吴成,王春晓,王晓丹,等.高通量测序技术在酿酒微生物多样性研究中的应用[J].食品科学,2019,40(3):348-355.
[10]马延琴,徐晓裕,李甜,等.酿酒葡萄表皮产酶非酿酒酵母的筛选及其产酶特性研究[J].中国酿造,2021,40(12):149-154.
[11]张俊杰,杨旭,焦健,等.不同株系赤霞珠葡萄表皮酵母菌的多样性研究[J].中国酿造,2017,36(6):126-131.
[12]庞晓娜.环境微生物对清香型白酒特征风味物质的影响[D].北京:中国农业大学,2018.
[13]罗爱国,郗鑫瑞,郑同庆,等.基于Illumina MiSeq高通量测序分析清香型白酒酒糟微生物群落多样性[J].中国酿造,2022,41(1):98-102.
[14]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB 15037—2006 葡萄酒[S].北京:中国标准出版社,2006.
[15]李媛媛,李德美,张亚东,等.赤霞珠干红葡萄酒在不同子产区香气特征的差异[J].食品与发酵工业,2020,46(6):256-262,268.
[16]谢春梅,焦红茹,曹芳玲.宁夏青铜峡小产区不同品种干红葡萄酒的香气成分分析[J].中国酿造,2018,37(1):170-176.
[17]祝霞,王媛,刘琦,等.混菌发酵对贵人香低醇甜白葡萄酒的香气影响[J].食品与发酵工业,2019,45(4):95-102.
[18]WANG J M,GAMBETTA J M,JEFFERY D W,et al.Comprehensive study of volatile compounds in two Australian rose wines:Aroma extract dilution analysis(AEDA)of extracts prepared using solvent-assisted flavor evaporation(SAFE)or headspace solid-phase extraction(HS-SPE)[J].J Agr Food Chem,2016,64(19):3838-3848.
[19]YOU J,WU G,REN F P,et al.Microbial community dynamics in Baolige oilfield during MEOR treatment,revealed by Illumina MiSeq sequencing[J].Appl Microbiol Biot,2015,100(3):1469-1478.
[20]魏玉洁,邹弯,马文瑞,等.应用高通量测序技术研究新疆产区葡萄果实、叶片及果园土壤微生物多样性[J].食品科学,2018,39(6):162-170.
[21]张家晨.宁夏贺兰山东麓葡萄酒产区微生物多样性研究及菌库的建立[D].林芝:西藏农牧学院,2021.
[22]VINCENT R, OLIVIER C, ALINE L F.Inventory and monitoring of wine microbial consortia[J].Appl Microbiol Biot,2007,75(1):149-164.
[23]薛蓓,于佳俊,杨帆,等.基于高通量测序技术的宁夏贺兰山东麓产区酿酒葡萄微生物多样性的研究[J].食品与发酵工业,2022,48(14):75-83,92.
[24]丁建才,胡博然,林岚,等.河北昌黎产区干红葡萄酒发酵过程中真菌群落的研究[J].食品与发酵工业,2021,47(19):120-125.
[25]赵旗峰,郭文娇,荀志丽,等.树形对酿酒葡萄果实糖含量及蔗糖代谢相关酶活性的影响[J].河南农业科学,2021,50(5):122-128.
[26]高畅,毛晓辉,吴秀飞,等.干红葡萄酒发酵过程中发酵液比重下降与生成酒精浓度关系的研究[J].中外葡萄与葡萄酒,2011(1):16-18.
[27]靳华荣.不同酿造工艺对霞多丽干白葡萄酒的影响[D].济南:齐鲁工业大学,2016.
[28]于洋,粟春燕,陈晶瑜.3株葡萄酒非酿酒酵母的生长与发酵特性[J].食品科学,2015,36(19):106-111.
[29]赵燕飞,王芮东,院虹,等.GC-MS对两种葡萄酒的香气成分对比分析[J].运城学院学报,2020,38(6):14-18.
[30]SADINENI V, KONDAPALLI N, OBULAM V S R.Effect of co-fermentation with Saccharomyces cerevisiae and Torulaspora delbrueckii or Metschnikowia pulcherrima on the aroma and sensory properties of mango wine[J].Ann Microbiol,2012,62(4):1353-1360.