玉米是我国三大主粮之一,同时也是我国主要饲料粮和部分地区的主要口粮,目前已发展为粮、经、饲兼用作物,在国民经济中占有日益重要的地位[1]。玉米秸秆作为其主要副产品,含有大量植物纤维、蛋白质、低聚糖与氮磷化合成分,降解速率低下,很难被合理利用[2]。而且,目前主要采用机械粉碎还田或废弃、焚烧等方式对玉米秸秆进行处理,导致了资源浪费和环境污染。近年来,反刍动物养殖规模持续增长,内蒙古地区畜牧业面临草质降低、可食牧草产量降低的困境[2]。将玉米秸秆经过发酵后制成青贮饲料,可以在很大程度上缓解饲料资源短缺、质量欠缺的现状,为地区畜牧业的可持续发展提供动力[3]。
玉米青贮适口性好、易消化,发酵过程中产生的蛋白质、氨基酸、细菌素等还可有效抑制有害病菌,提高牲畜肉品质,降低其患病概率[4]。不同地区微生物种类及发酵条件相似度较低,青贮发酵品质和营养成分各不相同,与发酵过程中贡献较大的标志微生物也各不相同,其中乳酸菌是主要的发酵微生物[5],具有促进动物生长、调节胃肠道正常菌群、维持微生态平衡、提高机体免疫力等生理功能[6-7]。在前期启动发酵直至发酵后期微生物种类呈动态变化,青贮发酵前期如果不能快速启动发酵抑制肠杆菌等微生物的繁殖,有害物质将在青贮中积累进一步影响家畜健康,所以在发酵过程中添加乳酸菌来调整微生物区系至关重要[8]。筛选能够短时间快速繁殖并降低青贮饲料pH的乳酸菌,将其用于青贮发酵,可以有效抑制好氧菌和有害菌生长,以提高青贮饲料品质[9]。张慧杰等[10]从玉米青贮中分离出5株乳酸菌,其中2株为乳酸片球菌(Pediococcusacidilactici),其余3株分别为戊糖片球菌(Pediococcus pentosaceus)、植物乳杆菌(Lactiplantibacillus plantarum)和弯曲乳杆菌(Latilactobacillus curvatus),其中植物乳杆菌GI62特性优良,可用作青贮发酵添加剂;ROSSI F等[11]对农场玉米青贮饲料展开研究,在分离出玉米青贮中已知的乳酸菌外,还分离出玉米乳杆菌(Lactobacillus zeae)这一新菌种。于佳弘等[12]对青贮中分离的乳酸菌进行研究,说明青贮体系微生物的种类受青贮的种类、产地及发酵条件的影响。由于地域特异性,各地区的青贮发酵微生物生态体系的组成不同,从当地青贮中筛选出的产酸能力较好的乳酸菌能更好地适应当地的环境,加速繁殖,缩短发酵周期,对促进当地畜牧业发展意义重大。
本研究以内蒙古乌兰察布市四子王旗某牧场青贮窖内自然发酵60 d的玉米青贮为研究对象,利用高通量测序技术分析玉米青贮中的细菌群落结构,通过MRS-CaCO3平板溶钙法分离纯化出可以产生溶钙圈的产酸菌株,通过测定产酸能力筛选出优势产酸菌株,对其进行形态学观察及分子生物学鉴定,并研究其生长特性、耐酸、耐胆盐、耐乙醇、人工模拟肠胃液耐受性以及抑菌能力,明确其生物学特性,为高效制备高品质青贮饲料提供优良复合发酵剂。
1 材料与方法
1.1 材料与试剂
1.1.1 材料和菌株
内蒙古乌兰察布市四子王旗(41°36'N,111°42'E,年降水量在150~300 mm之间,平均海拔1 300 m,年均温3 ℃)某牧场自然发酵60 d的全株玉米青贮。
大肠杆菌(Escherichia coli)、枯草芽孢杆菌(Bacillus subtilis)、金黄色葡萄球菌(Staphylococcus aureus):购自中国普通微生物菌种保藏管理中心,保藏于本实验室。
1.1.2 化学试剂
葡萄糖(分析纯):天津市北辰方正试剂厂;蛋白胨、胰蛋白胨(均为生化试剂):北京奥博星生物技术有限责任公司;牛肉浸粉(生化试剂):南京全隆生物技术有限公司;酵母提取物(生化试剂):上海金畔生物科技有限公司;柠檬酸氢二胺、氯化钾、氯化钠、磷酸二氢钾、磷酸氢二钾、碳酸钙、氢氧化钠、硫酸镁、磷酸氢二钠、硫酸锰、乙酸钠、无水乙醇(均为分析纯):天津市科密欧化学试剂有限公司;Tween-80:上海麦克林生化科技有限公司;琼脂粉(生化试剂)、牛胆盐(分析纯)、胃蛋白酶(3 000~3 500 NFU/g)、胰蛋白酶(250 NFU/mg):北京索莱宝科技有限公司;盐酸(分析纯):洛阳市化学试剂厂。
1.1.3 培养基
MRS液体培养基:葡萄糖20 g/L,蛋白胨10 g/L,牛肉浸粉5 g/L,酵母提取物4 g/L,柠檬酸氢二胺2 g/L,磷酸氢二钾2 g/L,乙酸钠5 g/L,硫酸镁0.5 g/L,硫酸锰0.25 g/L,Tween-80 1 mL/L,蒸馏水定容至1 L,调节pH为6.2~6.4。121 ℃高压蒸汽灭菌20 min。
MRS-CaCO3固体培养基:MRS液体培养基中添加1.5%的琼脂粉,0.75%的碳酸钙。
LB液体培养基:胰蛋白胨10 g,酵母提取物5 g,氯化钠10 g,调节pH值为7.0~7.2。121 ℃高压蒸汽灭菌20 min。
LB固体培养基:LB液体培养基中添加1.5%的琼脂粉;LB半固体培养基:LB液体培养基中添加0.5%的琼脂粉。
1.2 仪器与设备
SW-CJ-2D型双人单面净化工作台:苏州净化设备有限公司;HH-6型数显恒温水浴锅:常州荣华仪器制造有限公司;PHS-3C型pH计:上海雷磁仪器厂;V-1800PC型可见分光光度计:上海美谱达仪器有限公司;GI80DS型立式压力蒸汽灭菌锅:上海博讯实业有限公司;ZXMP-R1230型恒温培养箱:上海智城分析仪器制造有限公司;D-37520型离心机:中国赛默飞世尔科技有限公司;BSA124S型分析天平(感量0.000 1 g):METTLERTOLEDO(上海)有限公司;ChemiDocTMXRS+型凝胶成像分析系统:伯乐生命医学产品(上海)有限公司;ABI-2720型聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Applied Biosystems公司。
1.3 方法
1.3.1 自然发酵玉米秸秆中细菌群落结构分析
基于高通量测序对发酵60 d的玉米青贮的细菌微生物多样性进行分析。将样品的脱氧核糖核酸(deoxyribonucleic acid,DNA)进行提取,并使用0.8%琼脂糖凝胶电泳进行分子大小判断。使用338F(5'-ACTCCTACGGGAGGCAGCA-3')和806R(5'-TCGGACTACHVGGGTWTCTAAT-3')引物对细菌16S rRNA基因的V3-V4区域进行PCR扩增。PCR扩增体系(25 μL):模板DNA 2.0 μL、338F引物1.0 μL、806R引物1.0 μL、Taq聚合酶混合物12.5 μL、双蒸水(ddH2O)8.5 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s、54 ℃退火30 s、72 ℃延伸45 s,30次循环;72 ℃终延伸10 min。将同一样本的PCR产物混合后进行2%琼脂糖凝胶电泳,切取目的片段后用凝胶回收试剂盒回收目的片段。利用Quant-iT PicoGreen dsDNA Assay Kit对PCR产物在Microplate reader(BioTek,FLx800)上进行定量,然后按照每个样品所需的数据量进行混样。利用Illumina公司的TruSeq Nano DNA LT Library Prep Kit进行建库,并将建库数据进行质检与定量。对合格的文库,在MiSeq机器上利用MiSeq Reagent Kit V3(600cycles)进行2×250 bp的双端测序。使用QIIME2 2019.4对微生物组生物学信息进行分析。原始序列数据使用demux插件进行解码处理,cutadapt插件进行引物切除,然后使用DADA2插件对序列进行质量过滤、去噪、拼接和嵌合体去除等数据处理。对上述获得的序列按100%的序列相似度进行归并,生成特征性序列扩增子序列变体(amplicon sequence variants,ASVs)以及丰度数据表格。通过采用Greengenes数据库将ASV特征序列与数据库中的参考序列相比对,获取每个ASV所对应的分类学信息。将丰度值低于全体样本测序总量0.001%(十万分之一)的ASV去除,并将去除了稀有ASV的丰度矩阵用于后续分析。根据ASV划分和分类地位鉴定结果,获得样本在各分类水平的具体物种组成情况。
1.3.2 产酸菌的初筛
称取10 g样品于90 mL的无菌水中,梯度稀释后,取不同浓度的稀释液100 μL,均匀涂布在MRS-CaCO3固体培养基上,37 ℃静置培养48 h,根据菌落颜色、大小、形态的不同,挑取产生溶钙圈的单菌落,多次划线纯化,直至菌落和菌体特征均一为止,并对各菌株进行编号标记。用接种环挑取单菌落于30%的过氧化氢液体中,观察气泡产生情况,未产生气泡即为过氧化氢阴性,初步筛选乳酸菌[13]。
1.3.3 产酸菌的复筛
参照何江波等[14]的方法测定菌株产酸速率,将筛选出的过氧化氢阴性产酸菌接种于MRS液体试管培养基中进行活化,37 ℃培养12 h,制备种子液。将各产酸菌种子液的OD600 nm值控制在0.6左右,按2%的接种量接种于MRS液体培养基,37 ℃恒温静置培养,每隔2 h测定菌液的pH值,绘制产酸速率曲线,复筛产酸能力较强的菌株。
1.3.4 优势产酸菌的鉴定
(1)形态学观察
采用平板划线法,将筛选出的产酸能力较强的菌株分别在固体MRS-CaCO3培养基上37 ℃培养48 h,观察菌落形态,记录菌落大小、颜色、凹凸、透明度,通过革兰氏染色观察细胞形态。
(2)分子生物学鉴定
将分离纯化的乳酸菌培养12 h后,按照试剂盒说明书提取菌体基因组DNA。以提取的DNA为模板,利用特异性引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-CTACGGCTACCTTGTTACGA-3')进行PCR扩增。PCR扩增体系(50 μL):基因组DNA 1.0 μL、10×Buffer 5.0 μL、Taq聚合酶1.0 μL、脱氧核糖核苷三磷酸(deoxyribonucleo side triphosphate,dNTP)1.0 μL、27F引物1.5 μL、1492R引物1.5 μL、双蒸水(ddH2O)39.0 μL。PCR扩增程序:95 ℃预变性5 min;95 ℃变性30 s,50 ℃退火30 s,72 ℃延伸1.5 min,35次循环;72 ℃终延伸7 min。PCR产物进行1.0%琼脂糖凝胶电泳检测,并委托上海派森诺生物科技有限公司进行测序。测得的序列利用美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)上的基本局部比对搜索工具(Basic Local Alignment Search Tool,BLAST)将所测定的菌株的16S rRNA序列与GenBank数据库的已知细菌的序列进行比对,寻找与目的基因同源性最高的已知分类地位的菌种。使用软件MEGA 7.0对进行分离菌株系统化分析并采用邻接(neighborjoining,NJ)法绘制系统发育树。
1.3.5 优势产酸菌的生物学特性研究
菌株生长曲线测定:参照韦票[15]的方法测定优势乳酸菌生长曲线。甘油菌化冻后取100 μL接种于10 mL的MRS液体培养基中,37 ℃下静置培养24 h,得到种子液。将产酸能力较强的乳酸菌种子液按2%的接种量接种于MRS液体培养基中,37 ℃静置培养,每隔2 h测定发酵液的OD600nm值,以发酵时间为横坐标,OD600nm值为纵坐标绘制生长曲线。
最适初始pH和温度的确定:将种子液按2%的接种量分别接种于初始pH值分别为3.0、4.0、5.0、6.0、7.0的MRS液体培养基中,37 ℃下静置培养12 h,通过测定菌液的OD600nm值,确定各菌株生长的最适初始pH值[16]。将种子液按2%的接种量接入MRS液体培养基中,分别在温度25 ℃、30 ℃、35 ℃、40 ℃、45 ℃条件下静置培养,测定菌液的OD600 nm值,确定各菌株生长的最适温度[17]。
耐酸性试验:胃液的pH值一般在2.5~3.5之间,而食物在胃中消化需要的时间一般为1~3 h,因此选择pH值为3作为本次试验的条件。按2%的接种量将种子液分别接种于pH为3.0的MRS液体培养基中,以未经处理的MRS培养基为对照,在37 ℃下静置培养,分别取培养1 h、2 h、3 h时的菌液进行梯度稀释并涂布,按式(1)计算耐酸试验菌株存活率[18]。
式中:S为菌株存活率,%;N1为试验组活菌数,CFU/mL;N0为对照组活菌数,CFU/mL。
胆盐耐受性试验:按2%的接种量将种子液分别接种于牛胆盐含量分别为0.1%、0.2%和0.3%的MRS液体培养基中,37 ℃条件下静置培养1 h、2 h、3 h时,分别取定量样品进行梯度稀释,涂布计数,用平板计数法计算活菌数,测定菌株在肠中的耐受性。以MRS 培养基为空白对照,计算耐胆盐试验菌株存活率[19]。
乙醇耐受性试验:控制菌株种子液的OD600 nm值为0.6,将每株菌的种子液分别接入含有2%、4%、6%、8%和10%(V/V)乙醇的MRS液体培养基中进行胁迫,37 ℃静置培养12 h后对菌液进行梯度稀释,涂布计数,使用平板计数法计算活菌数并根据公式(2)计算不同体积分数的乙醇胁迫下菌株存活率[20]。
人工模拟胃肠液耐受性试验:取16.4 mL稀盐酸,加入800 mL水和10 g胃蛋白酶,摇匀后加水稀释至1 000 mL,制得人工模拟胃液;取6.8 g磷酸二氢钾溶于500 mL水,用0.1 moI/L NaOH溶液调节pH值至6.8,取胰蛋白酶10 g加适量水溶解,混合后加水稀释至1 000 mL,制得人工模拟肠液。将菌株活化后得到的菌悬液,4 500 r/min离心10 min,用磷酸盐缓冲液(phosphate buffer solution,PBS)洗涤两次后调整菌体浓度,制得OD600 nm值约为1.0的菌悬液。取适量菌悬液进行梯度稀释后涂布培养,记录菌株初始活菌数N0。取1 mL菌悬液接种于9 mL人工模拟胃液中,37 ℃静置孵育3 h后取菌液进行稀释涂布,用平板计数法计算活菌数N1,按式(3)计算人工模拟胃液中菌株存活率,测定菌株在酸性胃液条件下的耐受性。将1 mL菌悬液接种于9 mL人工模拟肠液中,在37 ℃下静置培养4 h后取定量菌悬液进行梯度稀释,涂布计数,用平板计数法计算活菌数N2,按式(4)计算人工模拟肠液中菌株存活率[21]。
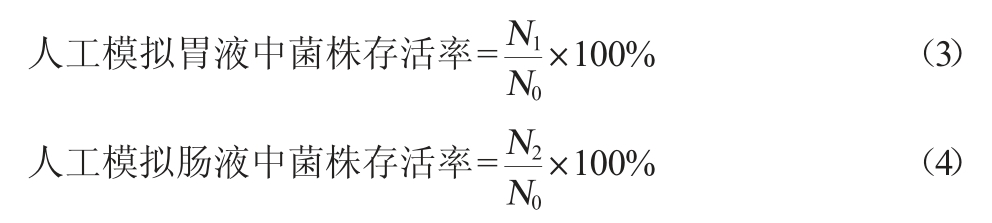
式中:N0为菌株初始活菌数,CFU/mL;N1为菌株在人工胃液中孵育3 h后的活菌数,CFU/mL;N2为人工胃液消化的菌悬液在人工肠液中孵育4 h后的活菌数,CFU/mL。
1.3.6 优势乳酸菌的抑菌能力测定
乳酸菌生长过程中,会代谢产生乳酸、乙酸等大量有机酸,它们通过牛津杯在培养基中扩散,利用增加细菌外膜通透性、改变胞内渗透压等方式来抑制有害微生物的生长。因此,乳酸菌所产有机酸越多,抑菌能力越强,抑菌圈直径越大[22]。将优势乳酸菌菌株37 ℃培养24 h,12 000 r/min离心2 min后收集发酵上清液,以大肠杆菌、枯草芽孢杆菌和金黄色葡萄球菌为指示菌,采用牛津杯双层平板法,向牛津杯中加入各株菌的发酵上清液150 μL,以MRS液体培养基作为对照,置于37 ℃下静置培养,观察是否有抑菌圈,并用十字交叉法测量记录抑菌圈直径。
2 结果与分析
2.1 自然发酵玉米青贮中的细菌群落结构分析
细菌分类学分析共鉴定得到16个菌门、206个菌属。在门水平上,优势细菌门(相对丰度>1%)变形菌门(Proteobacteria)(77.38%)、厚壁菌门(Firmicutes)(19.04%)、拟杆菌门(Bacteroides)(2.72%),其中,变形菌门的占比最多,其次为厚壁菌门。在属水平,优势细菌属(相对丰度>1%)为醋酸杆菌属(Acetobacter)(73.03%)、乳杆菌属(Lactobacillus)(11.19%)、拟杆菌属(Bacteroides)(1.91%)、芽孢杆菌属(Bacillus)(1.66%),其中醋酸杆菌属占据优势地位,其次为乳杆菌属。畜牧业是内蒙古地区农业经济的主导产业,由于地区的自然气候原因,家畜面临“秋肥冬瘦”的现状,青贮技术的研究和推广可有效缓解问题。玉米青贮饲料在反刍动物饲料中使用较为广泛,其发酵是由多种微生物组成的微生态系统驱动的过程,不同地区的自然条件不同,青贮玉米的微生物组成有所不同。顾娴等[23]研究发现,内蒙古包头、赤峰、呼和浩特部分产地的玉米青贮微生物组成最丰富的是厚壁菌门,其次为变形菌门,且主要是乳杆菌属主导发酵,也有少部分产地醋酸杆菌主导发酵。青贮中的厚壁菌门和变形菌门的丰度变化随发酵时间的延长呈现动态变化,厚壁菌门的丰度随着发酵时间的延长增加,变形菌门的相对丰度与之相反。本研究的玉米青贮中变形菌门的丰度较厚壁菌门更高,醋酸杆菌的相对丰度要比乳酸菌高,可能是由于当地发酵玉米青贮的时间大概在10月中旬开始,此时当地气温偏低且昼夜温差较大,虽为自然发酵60 d采集的样本,发酵并未结束,导致发酵周期延长。因此,为了能将青贮更快投入饲喂,在发酵时非常有必添加外源饲用发酵剂来缩短发酵时间。
2.2 优势产酸菌株的筛选
根据菌株在MRS-CaCO3平板上的生长情况,分离纯化得到35株有溶钙圈的菌株,分别编号为Ym1~Ym35。通过过氧化氢接触实验,初步筛选出26株疑似乳酸菌菌株。通过测定26株菌的发酵液的pH,筛选产酸速率较快、产酸能力较强的菌株,结果见图1。
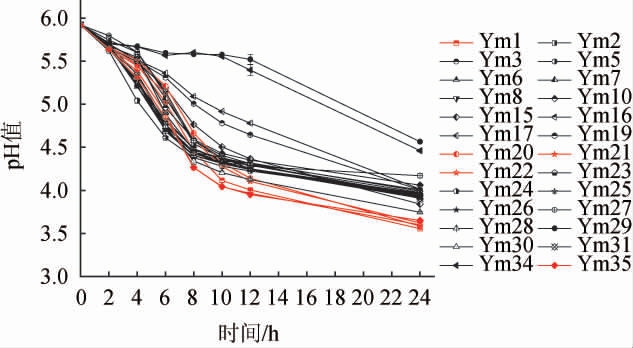
图1 筛选菌株的产酸速率
Fig.1 Acid production rates of screened strains
由图1可知,26株菌均具有产酸能力,在发酵时间0~12 h时,菌株Ym1、Ym2、Ym3、Ym5、Ym6、Ym7、Ym8、Ym10、Ym15、Ym16、Ym20、Ym21、Ym22、Ym23、Ym24、Ym25、Ym26、Ym27、Ym28、Ym30、Ym31 和Ym35 产 酸 速 度 较快,pH能快速下降,均可降至4.5以下,其中菌株Ym35发酵12 h时pH最低,为3.95。菌株Ym17和Ym19产酸较慢,发酵至12 h,pH可下降至4.5~5.0,分别为4.78和4.65。菌株Ym29和Ym34的产酸最慢,发酵12 h时pH可下降到5.5左右,Ym29产酸性能最差,发酵液pH为5.52。当发酵时间为24 h时,菌株Ym1、Ym20、Ym21、Ym22和Ym35的发酵液pH较低,可低至3.5左右,分别为3.56、3.59、3.62、3.60、3.65。因此,筛选得到5株优势产酸菌株:Ym1、Ym20、Ym21、Ym22和Ym35,进一步对其进行鉴定。
2.3 优势产酸菌株的鉴定
2.3.1 形态学观察
5株优势产酸菌株的菌落形态及细胞形态见图2。由图2可知,5株优势产酸菌均为革兰氏阳性菌,其中菌株Ym1、Ym21菌落颜色为乳白色、不透明、边缘不整齐、菌落光滑、扁平,菌株Ym20菌落颜色为乳白色、不透明、边缘不整齐、菌落光滑、凸起,菌株Ym22菌落颜色为乳白色、不透明、边缘整齐、菌落光滑、凸起,菌株Ym35菌落呈淡黄色、不透明、边缘整齐、光滑、凸起。
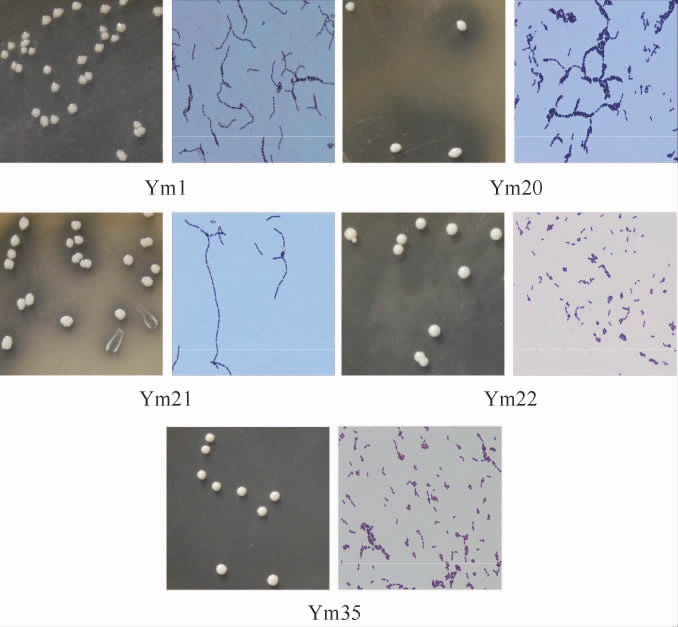
图2 优势产酸菌株的菌落形态及细胞形态
Fig.2 Colony and cell morphology of dominant acid-producing strains
2.3.2 分子生物学鉴定
将优势产酸菌株的16SrRNA测序结果与NCBIGenBank数据库进行同源性对比,结果见表1,系统发育树结果见图3。
表1 优势产酸菌株的测序结果比对
Table 1 Comparison of sequencing results of dominant acid-producing strains
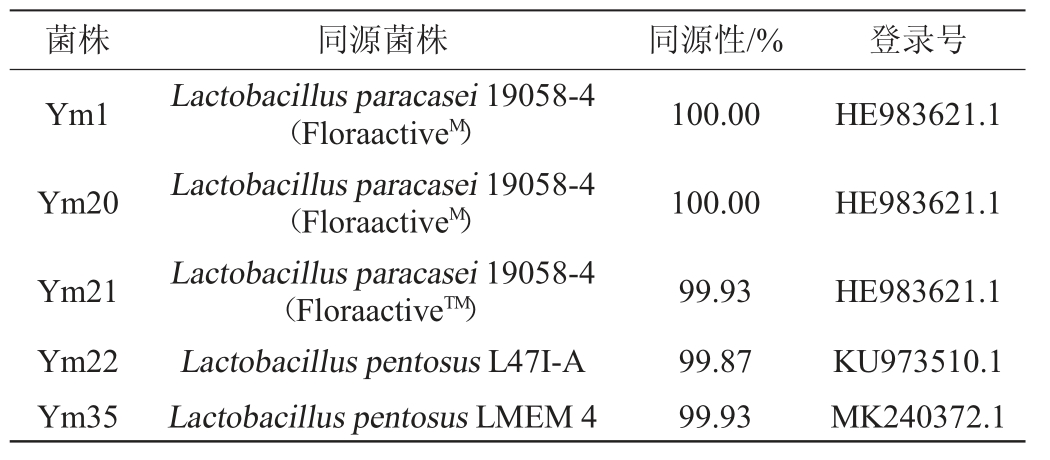
菌株 同源菌株 同源性/% 登录号Ym1 Ym20 Ym21 Ym22 Ym35 Lactobacillus paracasei 19058-4(FloraactiveM)Lactobacillus paracasei 19058-4(FloraactiveM)Lactobacillus paracasei 19058-4(FloraactiveTM)Lactobacillus pentosus L47I-A Lactobacillus pentosus LMEM 4 100.00 100.00 99.93 99.87 99.93 HE983621.1 HE983621.1 HE983621.1 KU973510.1 MK240372.1
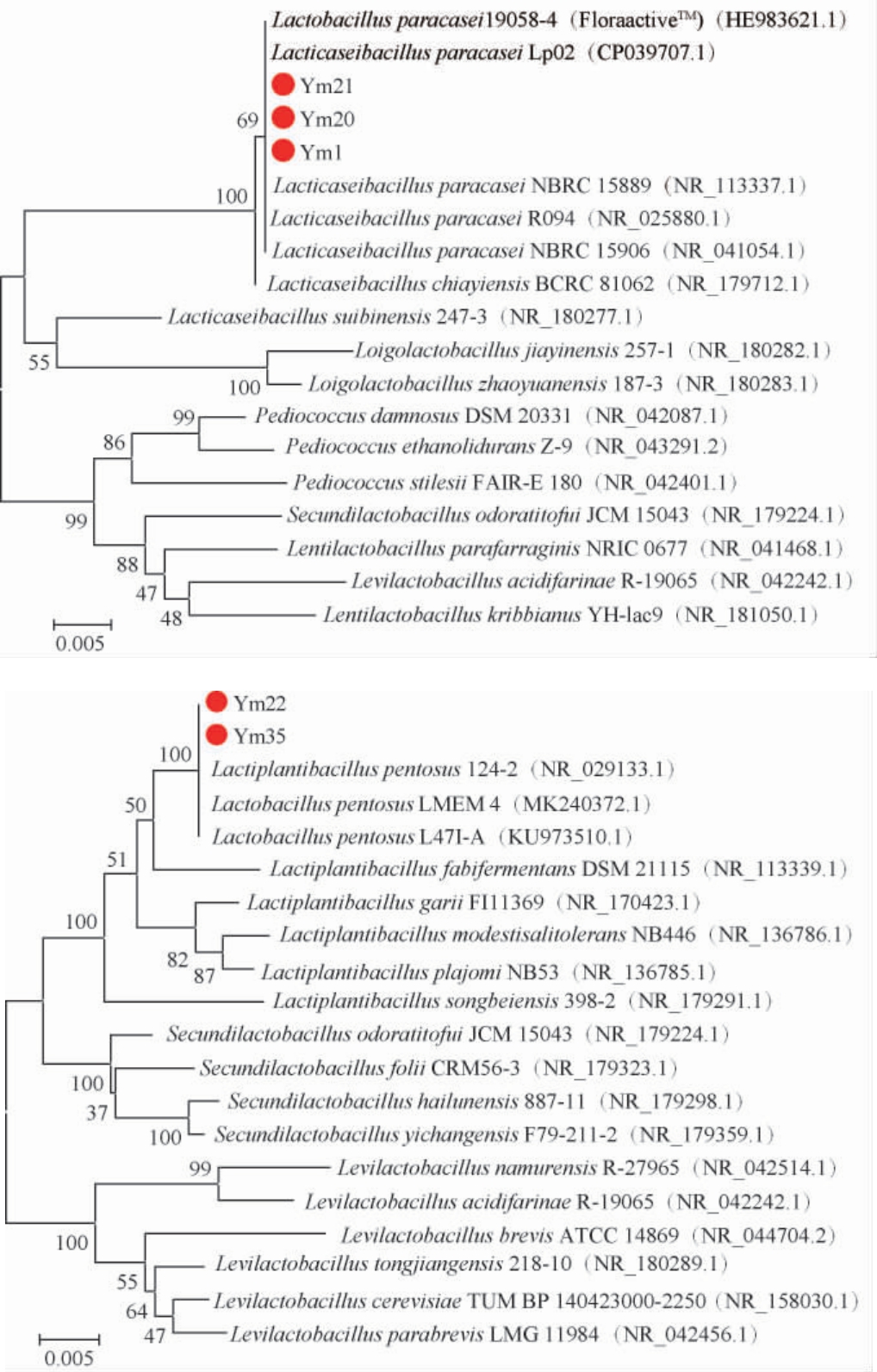
图3 基于16S rRNA基因序列的优势产酸菌株的系统发育树
Fig.3 Phylogenetic tree of dominant acid-producing strains based on 16S rRNA gene sequences
由表1及图3可知,菌株Ym1、Ym20、Ym21与副干酪乳杆菌(Lactobacillusparacasei)同源性分别为100.00%、100.00%、99.93%,聚于同一分枝,亲缘关素最近;菌株Ym22、Ym35与戊糖乳杆菌(Lactobacillus pentosus)同源性分别为99.87%、99.93%,聚于同一分枝,亲缘关素最近。因此,菌株Ym1、Ym20、Ym21被鉴定为副干酪乳杆菌(Lactobacillus paracasei),菌株Ym22、Ym35被鉴定为戊糖乳杆菌(Lactobacillus pentosus)。
2.4 优势产酸乳酸菌的生长情况以及最适生长pH和温度
5株优势产酸乳酸菌的生长曲线如图4所示,5株优势产酸菌均经过4 h的延滞期后进入对数期,其中菌株Ym35在4~12 h时生物量呈对数上升,最快进入稳定期,12 h后繁殖速度减慢,基本处于稳定期,其余四株菌在4~16 h时以较恒定的速度分裂增殖,16 h后基本处于生长稳定期,其中菌株Ym22生长力最强,进入稳定期OD600nm值>8.0,菌株Ym1、Ym21和Ym22的增殖能力较弱,进入稳定期时OD600nm值>5.0。在发酵过程中5株菌在延滞期和对数生长前期产酸较快,在对数生长后期生长较快但产酸速率缓慢,在生长稳定期几乎不再生长,5株菌的生长状况与菌液的pH值变化趋势相符合。
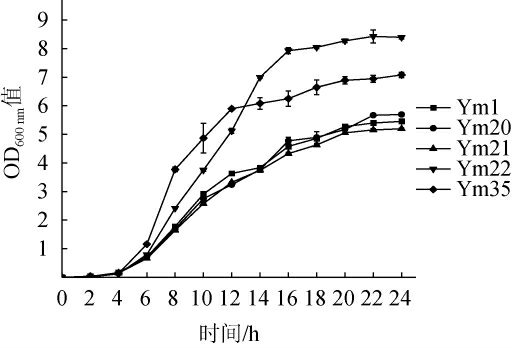
图4 优势产酸乳酸菌株的生长曲线
Fig.4 Growth curves of dominant acid-producing strains of lactic acid bacteria
培养基pH值及温度对优势产酸乳酸菌株生物量的影响结果见图5。
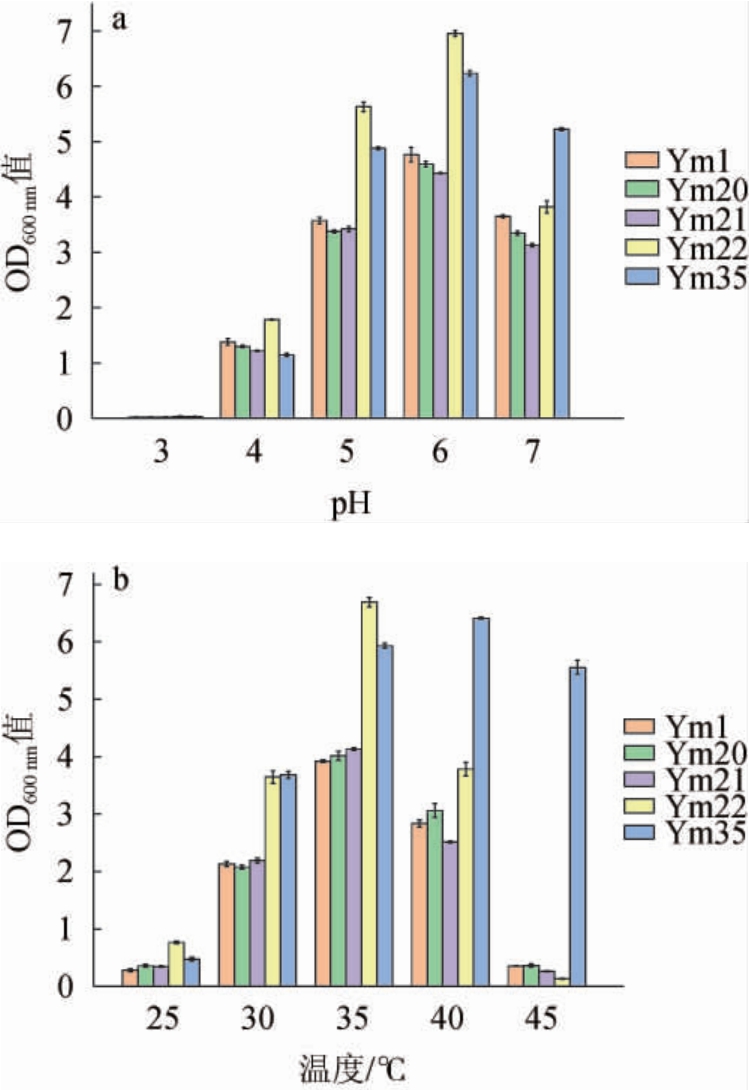
图5 培养基初始pH值(a)及温度(b)对优势产酸乳酸菌株生物量的影响
Fig.5 Effects of initial pH value of medium (a) and temperature (b)on biomass of dominant acid-producing strains of lactic acid bacteria
由图5a可知,在初始pH为3.0的条件下,5株菌的生物量很低,菌株基本不生长,随着初始pH值的升高,5株菌的生物量呈现先增加后降低的趋势,在pH为6.0时菌体生物量均达到最高,菌株Ym1、Ym20、Ym21、Ym22和Ym35的OD600 nm值分别为4.76、4.59、4.43、6.95、6.23,其中Ym22的生物量最高。当初始pH升高至7.0时,5株菌的生物量都有不同程度的降低,菌株Ym35的生物量明显高于其余4株菌,OD600 nm值为5.22,说明其在中性条件下生长力较强,菌株Ym22的降低程度最明显。因此,5株菌最适培养基初始pH均为6.0。
由图5b可知,随着温度的升高,5株菌的生物量呈现先增长后降低的趋势,菌株Ym1、Ym20、Ym21和Ym22在培养温度为35 ℃时生物量最高,OD600 nm值分别为3.92、4.02、4.13、6.69,菌株Ym35在40 ℃时生物量最高,OD600 nm值为6.41。当培养温度升高至45 ℃时,菌株Ym1、Ym20、Ym21和Ym22四株乳酸菌较其他温度培养时的生物量最低,说明其在温度较高时生长能力较弱,而菌株Ym35的生物量明显高于其他菌株且较40 ℃培养时生物量降幅不大,说明其较其他菌株的具有较高温度的生长潜力。因此,菌株Ym1、Ym20、Ym21和Ym22的最适生长温度为35 ℃,菌株Ym35的最适生长温度40 ℃。
2.5 优势产酸乳酸菌的耐受性
2.5.1 酸耐受性
耐酸性能是评价青贮用乳酸菌的另一重要标准。良好的耐酸能力有助于乳酸菌适应青贮中的低pH环境,直接影响青贮后期的发酵效果[24]。本研究在初始pH 3.0条件下,分别将5株乳酸菌处理1、2、3 h研究其耐酸性能,结果见图6。
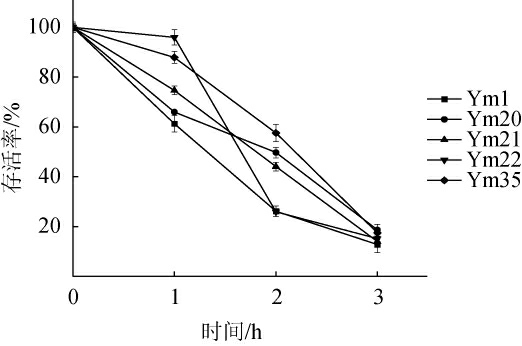
图6 优势产酸乳酸菌株酸耐受性
Fig.6 Acid tolerance of dominant acid-producing strains of lactic acid bacteria
由图6可知,在初始pH 3.0条件下,随着处理时间的延长,5株菌的存活率均呈现降低趋势。在处理1 h时,存活率均能达到60%以上,耐酸能力从大到小依次为菌株Ym22>Ym35>Ym21>Ym20>Ym1,耐酸能力最好的菌株Ym22的存活率为96%,说明其在短时间内对pH=3的酸性环境有较强的耐受性。当处理2h时,5株菌的存活率均能达到20%以上,耐酸能力从大到小依次为菌株Ym35>Ym20>Ym21>Ym1>Ym22,耐酸性能最好的菌株Ym35,存活率为57.6%。处理时间延长至3 h时,5株菌的存活率在15%左右,耐酸性能最好的菌株Ym20,存活率为18.7%,且5株菌的耐酸性能没有显著性差异。观察3 h内5株菌的存活率趋势变化可以看出,菌株Ym1、Ym20、Ym21和Ym35存活率下降速率相对稳定,Ym22虽然在1 h时存活率高达96%,表现出较强的耐酸性,但在1~2 h之间存活率下降过快。整体而言,菌株Ym35的存活率相对其他四株菌较高,耐酸性能相对较好。可以看到,酸性条件下5株乳酸菌生长程度不同,即对酸的耐受性不同,乳酸菌在酸性条件下会启动信号调节机制,通过质子泵及产生碱性物质来维持细胞内外酸碱平衡,在此过程中,细胞膜组成成分也会发生变化,体现在不饱和脂肪酸含量的增加,这对提升乳酸菌的耐酸性有重要意义[25]。但这些菌株源于玉米青贮表面,并非本身处于酸性环境,调节机制有限,酸耐受性会随着时间延长而降低。
2.5.2 乙醇耐受性
将5株菌分别接入无水乙醇体积分数为2%、4%、6%、8%和10%的MRS液体培养基,胁迫生长12 h,测其OD600 nm值研究其乙醇耐受能力,结果见图7。
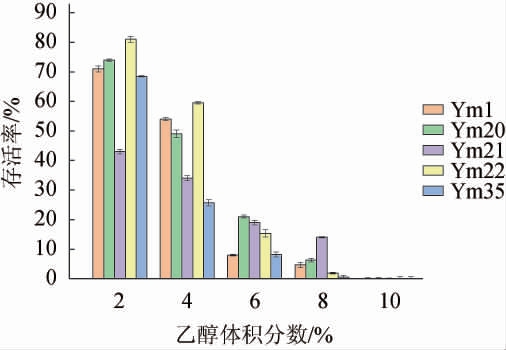
图7 优势产酸乳酸菌株乙醇耐受性
Fig.7 Ethanol tolerance of dominant acid-producing strains of lactic acid bacteria
由图7可知,5株菌在不同体积分数的无水乙醇胁迫下均有不同程度的生长,且随着无水乙醇体积分数的增大,菌株的存活率均在降低,不同菌株在无水乙醇胁迫下存活率存在一定差异。在体积分数为2%的乙醇胁迫下,菌株均可存活,耐受能力从大到小依次为菌株Ym22>Ym20>Ym1>Ym35>Ym21,其中Ym22的存活率最高,为81.0%,菌株Ym21的存活率最低,为43.0%。在体积分数为4%的乙醇胁迫下,耐受能力从大到小依次为菌株Ym22>Ym1>Ym20>Ym21>Ym35,菌株Ym22的存活率最高,为59.5%,菌株Ym35的存活率最低,为25.7%。在体积分数为6%的乙醇胁迫下,耐受能力从大到小依次为菌株Ym20>Ym21>Ym22>Ym35>Ym1,菌株Ym20的存活率最高,为21.0%,菌株Ym1的存活率最低,为8.0%。乙醇体积分数增加到8%时,耐受能力从大到小依次为菌株Ym21>Ym20>Ym1>Ym22>Ym35,菌株Ym21的存活率最高,为14.0%,菌株Ym35的存活率最低,为0.6%。当体积分数为10%的乙醇胁迫下,5株菌几乎不生长。因此,5菌株最高可耐受体积分数为8%的乙醇,在此条件下菌株Ym21的耐受能力较好;在乙醇体积分数为6%时,菌株Ym20的耐受能力最好;在乙醇体积分数为2%和4%时,菌株Ym22的耐受能力最好。在菌株生长过程中,乙醇会改变菌体细胞膜通透性,影响菌体的生理活性和生长代谢[27],随着乙醇体积分数的增加,菌株存活率会持续降低。金丹等[20]研究发现,乙醇体积分数为9%时,会导致部分菌株死亡,与本研究结果一致。
2.5.3 胆盐耐受性
本研究在牛胆盐含量为0.1%、0.2%和0.3%条件下,分别将5株乳酸菌处理1 h、2 h、3 h研究其胆盐耐受能力,结果见表2。
表2 优势产酸乳酸菌株在不同胆盐浓度下的生长情况
Table 2 Growth situation of dominant acid-producing strains of lactic acid bacteria under different bile salt concentrations
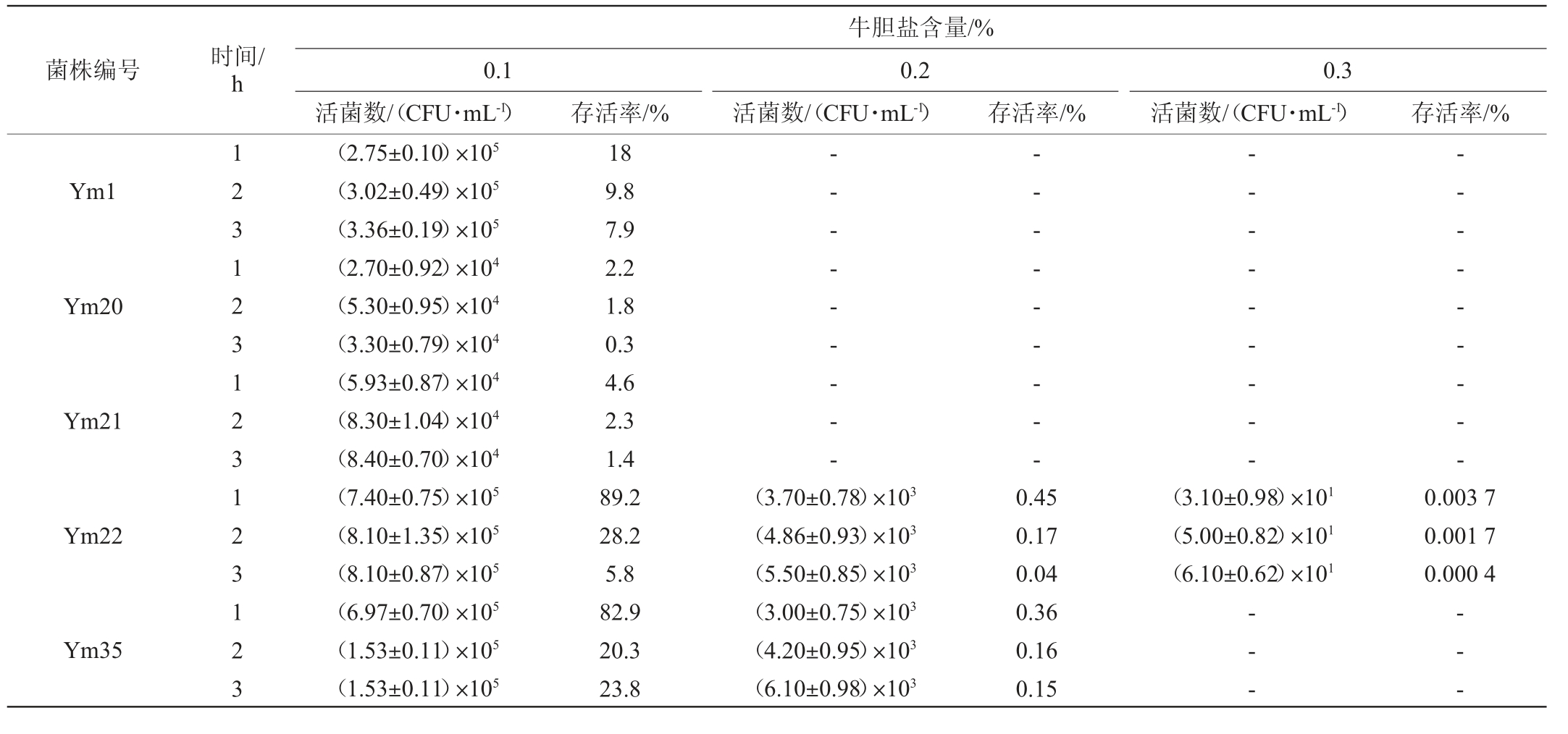
菌株编号 时间/h牛胆盐含量/%0.1活菌数/(CFU·mL-1)0.2活菌数/(CFU·mL-1)存活率/% 存活率/%0.3活菌数/(CFU·mL-1) 存活率/%Ym1 Ym20 Ym21 Ym22 Ym35 123123123123123(2.75±0.10)×105(3.02±0.49)×105(3.36±0.19)×105(2.70±0.92)×104(5.30±0.95)×104(3.30±0.79)×104(5.93±0.87)×104(8.30±1.04)×104(8.40±0.70)×104(7.40±0.75)×105(8.10±1.35)×105(8.10±0.87)×105(6.97±0.70)×105(1.53±0.11)×105(1.53±0.11)×105 18 9.8 7.9 2.2 1.8 0.3 4.6 2.3 1.4 89.2 28.2 5.8 82.9 20.3 23.8-- - - - - - - -(3.70±0.78)×103(4.86±0.93)×103(5.50±0.85)×103(3.00±0.75)×103(4.20±0.95)×103(6.10±0.98)×103-- - - - - - - -0.45 0.17 0.04 0.36 0.16 0.15-- - - - - - - -(3.10±0.98)×101(5.00±0.82)×101(6.10±0.62)×101-- --- - - - - - - -0.003 7 0.001 7 0.000 4-- -
由表2可知,随着胆盐含量的增加,5菌株的存活率均降低。在0.1%的胆盐含量下,5株菌都有不同程度的存活,当处理1 h时,耐受能力从大到小依次为菌株Ym22>Ym35>Ym1>Ym21>Ym20,其中菌株Ym22存活率最高,为89.2%,说明其在短时间内耐胆盐性较强,菌株Ym20的存活率最低,为2.2%;处理2 h后,5株菌的耐受性能和1 h处理一致,菌株Ym22存活率最高,为28.2%,菌株Ym20的存活率最低,为1.8%;处理3 h后,胆盐耐受能力从大到小依次为菌株Ym35>Ym1>Ym22>Ym21>Ym20,菌株Ym35的存活率最高,为23.8%,且较处理2h时的存活率下降不显著。在胆盐含量为0.2%的条件下,菌株Ym1、Ym20和Ym21完全不存活,菌株Ym22和Ym35存活率很低,处理1 h、2 h、3 h后Ym22存活率分别为0.45%、0.17%、0.04%,菌株Ym35处理1 h、2 h、3 h的存活率分别为0.36%、0.16%、0.15%,随着处理时间的延长其存活率呈下降趋势。当胆盐含量增加到0.3%时,菌株Ym22仍能存活但存活率极低,但菌株Ym35存活率为0。综合分析,在不同胆盐含量下处理不同的时间,5株乳酸菌中菌株Ym22和Ym35的胆盐耐受能力更好。在胆盐胁迫下,乳酸菌可以分泌胆盐水解酶,同时部分乳酸菌含有表层蛋白,形成保护屏障,降低胆盐的危害[26]。但胆盐本身具有的毒性作用会严重损伤乳酸菌的细胞膜和DNA,因此5株菌在胆盐胁迫下耐受程度有限。
2.5.4 人工胃肠液耐受性
分别将5株优势产酸乳酸菌进行人工胃液和人工肠液处理,计算不同条件处理后的菌体存活率,研究其人工胃肠液耐受性,结果见表3。由表3可知,在人工胃液环境中,菌株耐受性从大到小依次为:菌株Ym20>Ym22>Ym35>Ym1>Ym21,菌株Ym20的存活率最高,为62.25%,菌株Ym21的存活率最低,为0.23%。在人工肠液环境下,菌株的耐受力从大到小依次为:菌株Ym35>Ym21>Ym22>Ym20>Ym1,耐受性最好的菌株Ym35存活率为54.76%,耐受性最差的菌株Ym1存活率为1.76%。因此,菌株Ym20的人工胃液耐受能力较强,菌株Ym35的人工肠液耐受能力较好。本研究中菌株Ym1、Ym20和Ym22在人工胃液和人工肠液中存活率持续降低,可能是胃蛋白酶和胰蛋白酶破坏了菌株细胞膜,造成菌株死亡[27];而菌株Ym21和Ym35经人工模拟肠液处理后,存活率相较于胃液处理呈现上升趋势,可能是菌株被膜成分不易与胰蛋白酶作用,这与雷雪艳等[26]研究结果一致。
表3 优势产酸乳酸菌株在人工胃肠液环境下的生长情况
Table 3 Growth situation of dominant acid-producing strains of lactic acid bacteria under artificial gastroenteric fluid
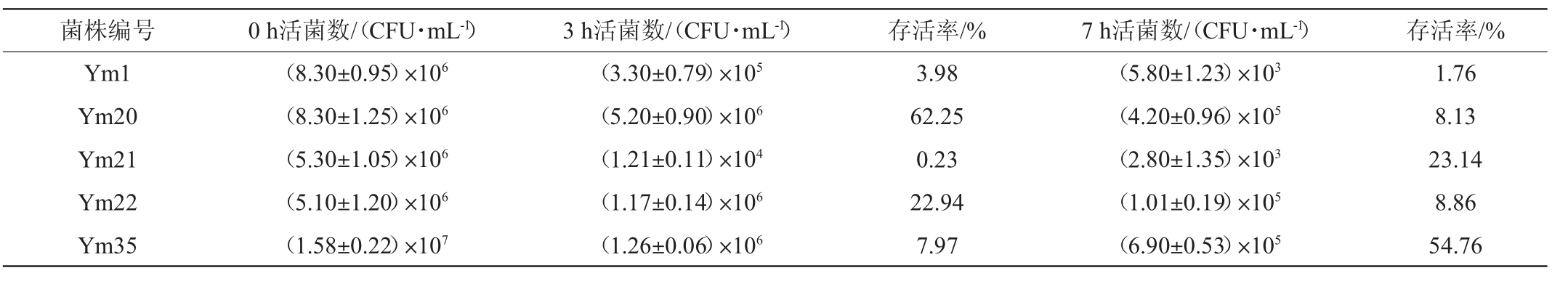
菌株编号 0 h活菌数/(CFU·mL-1) 3 h活菌数/(CFU·mL-1) 存活率/% 7 h活菌数/(CFU·mL-1) 存活率/%Ym1 Ym20 Ym21 Ym22 Ym35(8.30±0.95)×106(8.30±1.25)×106(5.30±1.05)×106(5.10±1.20)×106(1.58±0.22)×107(3.30±0.79)×105(5.20±0.90)×106(1.21±0.11)×104(1.17±0.14)×106(1.26±0.06)×106 3.98 62.25 0.23 22.94 7.97(5.80±1.23)×103(4.20±0.96)×105(2.80±1.35)×103(1.01±0.19)×105(6.90±0.53)×105 1.76 8.13 23.14 8.86 54.76
2.6 乳酸菌的抑菌性能分析
以大肠杆菌、枯草芽孢杆菌和金黄色葡萄球菌为指示菌,采用双层平板法研究了5株乳酸菌上清液的抑菌能力,结果见表4。由表4可知,5株乳酸菌对大肠杆菌、枯草芽孢杆菌和金黄色葡萄球菌均有抑制能力,对大肠杆菌的抑制作用从大到小依次为:菌株Ym22>Ym20>Ym1>Ym21>Ym35,抑制能力最强的菌株Ym22的抑菌圈直径为(15.83±0.29)mm,抑制能力最弱的菌株Ym35的抑菌圈直径为(12.33±1.44)mm;对枯草芽孢杆菌的抑制作用从大到小依次为:菌株Ym1>Ym21>Ym20>Ym35>Ym22,抑制能力最强的菌株Ym1的抑菌圈直径为(15.67±0.29)mm,抑制能力最弱的菌株Ym22的抑菌圈直径为(14.83±0.58)mm;对金黄色葡萄球菌的抑制作用从大到小依次为:菌株Ym1>Ym22>Ym35>Ym21>Ym20,抑制能力最强的Ym1的抑菌圈直径为(18.17±0.29)mm,抑制能力最弱的菌株Ym20的抑菌圈直径为(16.83±0.76)mm。因此,对大肠杆菌抑制能力最好的菌株为Ym22,对枯草芽孢杆菌抑制能力最好的菌株为Ym1,对金黄色葡萄球菌抑制能力最好的菌株为Ym1。
表4 优势产酸乳酸菌株对3株指示菌的抑菌活性
Table 4 Bacteriostatic activities of dominant acid-producing strains of lactic acid bacteria against 3 indicator strains
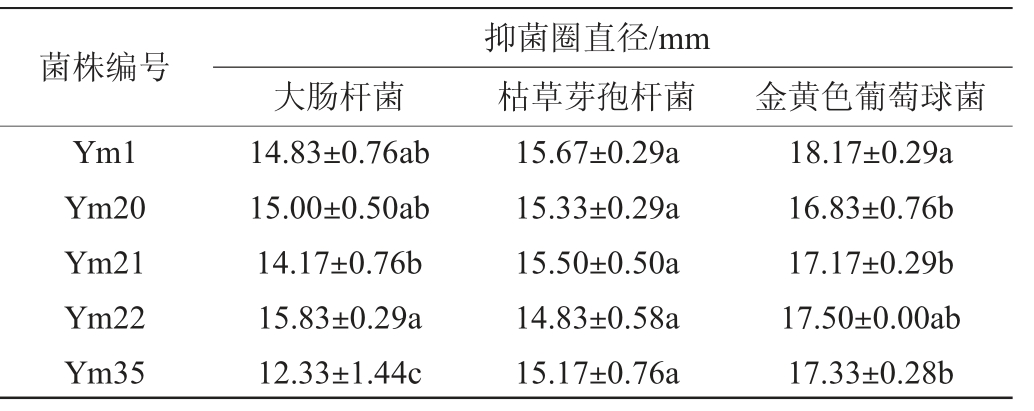
注:不同小写字母表示各处理组差异显著(P<0.05)。
菌株编号Ym1 Ym20 Ym21 Ym22 Ym35大肠杆菌抑菌圈直径/mm枯草芽孢杆菌 金黄色葡萄球菌14.83±0.76ab 15.00±0.50ab 14.17±0.76b 15.83±0.29a 12.33±1.44c 15.67±0.29a 15.33±0.29a 15.50±0.50a 14.83±0.58a 15.17±0.76a 18.17±0.29a 16.83±0.76b 17.17±0.29b 17.50±0.00ab 17.33±0.28b
3 结论
在我国的畜牧养殖业中,乳酸菌作为主要益生菌添加到青贮饲料中,可调节动物肠道的微生态平衡,促进其对营养物质的吸收,从而改善肉类品质。本研究从自然发酵的玉米青贮中筛选获得5株优势产酸菌,其中菌株Ym1、Ym20、Ym21被鉴定为副干酪乳杆菌(Lactobacillus paracasei),菌株Ym22、Ym35均被鉴定为戊糖乳杆菌(Lactobacillus pentosus)。5株菌的最适生长初始pH均为6.0,最适培养温度除菌株Ym35为40 ℃外,其余均为35 ℃。分析比较5株菌的耐受性结果,发现菌株Ym22胆盐耐受性较高;菌株Ym35人工肠液耐受性较好;菌株Ym20人工胃液耐受性较好;菌株Ym21可耐受的乙醇体积分数最高。5株菌均可以抑制大肠杆菌、枯草芽孢杆菌和金黄色葡萄球菌。该研究结果为提高玉米青贮品质提供了复合乳酸菌发酵剂资源。
[1]王晓武,安贵,赵亮,等.高产优质粮饲兼用型玉米品种显丰1136与示范推广[J].中国种业,2024(4):158-162.
[2]NIDERKORN V, MARTIN C, LE MORVAN A, et al.Associative effects between fresh perennial ryegrass and white clover on dynamics of intake and digestion in sheep[J].Grass Forage Sci,2017,72(4):691-699.
[3]兰孝宇,周常艳,董中辉.玉米秸秆裹包青贮技术研究[J].种子科技,2022,40(19):62-64.
[4]SI B W,TAO H,ZHANG X L,et al.Effect of Broussonetia papyrifera L.(paper mulberry) silage on dry matter intake, milk composition, antioxidant capacity and milk fatty acid profile in dairy cows[J].Asian Austral J Animal,2018,31(8):1259-1266.
[5]KIM D,LEE K D,CHOI K C.Role of LAB in silage fermentation:Effect on nutritional quality and organic acid production-An overview[J].AIMS Agr Food,2021,6(1):216-234.
[6]吴涛,柳永丽,赵芳芳.不同添加剂对菊芋茎叶青贮品质及营养价值的影响[J].草业科学,2022,39(4):770-777.
[7]LI D X,NI K K,ZHANG Y C,et al.Influence of lactic acid bacteria,cellulase, cellulase-producing Bacillus pumilus and their combinations on alfalfa silage quality[J].J Integr Agr,2018,17(12):2768-2782.
[8]王金飞.全株玉米青贮比例对杂种育肥羔羊生产性能、消化代谢、瘤胃发育及血液指标的影响[D].晋中:山西农业大学,2021.
[9]柯文灿.不同调控措施影响苜蓿青贮发酵品质的作用机制研究[D].兰州:兰州大学,2021.
[10]张慧杰,玉柱,王林,等.青贮饲料中乳酸菌的分离鉴定及优良菌株筛选[J].草地学报,2011,19(1):137-141.
[11]ROSSI F,DELLAGLIO F.Quality of silages from Italian farms as attested by number and identity of microbial indicators[J]. J Appl Microbiol,2007,103(5):1707-1715.
[12]于佳弘,罗红霞,杨新建,等.玉米青贮中乳酸菌的分离鉴定及特性研究[J].食品工业,2015,36(9):199-203.
[13]韦庆旭,张建鹏,梁煜晨,等.青贮用乳酸菌的分离鉴定及生物学特性评价[J].动物营养学报,2022,34(7):4737-4749.
[14]何江波,姚志芳,吴国芳,等.羊瘤胃源乳酸菌的分离鉴定及其生物学特性分析[J].动物营养学报,2021,33(6):3365-3379.
[15]韦票.瘤胃源饲用微生物的筛选及复合菌剂发酵中药渣效果的研究[D].杨凌:西北农林科技大学,2021.
[16]席琳乔,吴书奇,史卉玲,等.青贮玉米优良乳酸菌的分离与筛选[J].贵州农业科学,2016,44(3):102-105.
[17]白长胜.禽用乳酸菌SR1发酵条件优化[J].发酵科技通讯,2022,51(1):15-18.
[18]余萍,曹蓝,矫艳平,等.副干酪乳杆菌HCS17-040的筛选鉴定及其益生特性[J].食品与机械,2021,37(11):28-33,129.
[19]印伯星.副干酪乳杆菌的分离鉴定及肠道耐受性研究[J].中国乳品工业,2019,47(5):4-7.
[20]金丹,蒋艾廷,乔传丽,等.新疆酸马奶中乳酸菌的乙醇耐受性及蛋白酶性质研究[J].食品工业科技,2017,38(13):136-139,152.
[21]范洪臣,茜琳,韩雪,等.黏豆包发酵液中乳酸菌分离鉴定及其益生性能[J].食品研究与开发,2023,44(23):161-167.
[22]李元元,李鑫,何泽纯,等.牛源乳酸菌的分离鉴定及体外益生特性研究[J].动物营养学报,2024,36(1):626-636.
[23]顾娴,李晓敏,王国栋,等.北方地区青贮玉米优良乳酸菌筛选以及初步应用[J].甘肃畜牧兽医,2020,50(6):44-48.
[24]胡锦超,沈文琦,徐超业,等.微生物酸胁迫耐受性能强化的研究进展[J].生物技术通报,2023,39(11):137-149.
[25]周帆顺.直投式发酵黄姜生产技术研究[D].南昌:南昌大学,2023.
[26]雷雪艳,赵丽霞,李瑜,等.内蒙古地区自然发酵乳中乳酸菌的分离鉴定及优良菌株筛选[J/OL].食品与发酵工业:1-9[2024-06-27].https://doi.org/10.13995/j.cnki.11-1802/ts.038251.
[27]马新淼,魏敏敏,张左利,等.新疆哈萨克酸马奶中功能性乳酸菌株的筛选、鉴定及功能评价[J].食品安全质量检测学报,2024,15(7):151-159.