亚健康是影响现代人生活质量的一大健康问题。临床表现有疲劳、睡眠紊乱、注意力不集中等方面,若不及时加以干预,将进一步发展为疾病[1]。流行病学调查显示,我国亚健康人群为55%~75%,发达地区占比更高[2]。目前治疗失眠主要是化学类药物,这些药物均会发挥镇静催眠作用,但易产生成瘾性和药物依赖性等副作用[3]。因此,开发天然、安全、高效的功能因子受到了研究者的青睐。
甾醇分布广泛,在机体生长、物种繁育以及代谢调控等方面,发挥着难以取代的生理功能。天然甾体及其衍生物被广泛用于抗炎、抗癌和神经系统等领域,是疾病甚至是危重疾病的“刚需药”和“救命药”。在前期研究中,LIU W L等[4]从辣木籽中分离提取甾醇类活性成分,发现β-谷甾醇(100 mg/kg)和豆甾醇(50 mg/kg)通过激活γ-氨基丁酸(gamma-aminobutyric acid,GABA)能系统均能显著延长小鼠睡眠时间。UM M Y等[5]研究米糠提取物对睡眠-觉醒的影响,发现其主要活性成分β-谷甾醇和豆甾醇能通过组胺能系统改善睡眠作用。莲子是一种老少皆宜的滋补佳品,莲子芯中的β-谷甾醇具有良好的改善睡眠作用[6]。目前生产甾醇的主要原料为植物油加工副产物和一些天然植物,生产方法主要包括有机溶剂提取、超临界流体萃取、分子蒸馏和发酵法等[7-10]。其中微生物发酵产甾醇的成本较低、产量较大,更容易进行工业化生产。赵丽华[11]利用热带假丝酵母(Candida tropicalis)1253发酵花生油脱臭馏出物使甾醇含量由14.9%增加到28.43%。赵国群等[12]以大豆油脱臭馏出物为唯一碳源,研究了高产甾醇的热带假丝酵母1253细胞的培养条件,在优化发酵条件下,酵母细胞中甾醇含量为8.83%。刘红彦[13]利用热带假丝酵母1253发酵油酸产甾醇,对菌体中的甾醇采用酸热法进行提取,其总提取率为80.16%。
调制乳是以不低于80%的生牛(羊)乳或复原乳为原料,添加其他原料或食品添加剂或营养强化剂,经杀菌或灭菌等工艺制成的液体产品。相关研究表明,当甾醇、甾醇酯添加到谷物食品中时,可提升食物的酥脆感;当添加到低脂乳制品如酸奶中会增加酸奶的浓郁口感[14-15]。朱亿竹等[16]以葡萄甾醇为功能性成分,研制了富含甾醇的功能性咖啡调制乳。甾醇在功能性产品的开发和应用中起着越来越重要的作用,添加甾醇的功能性食品正形成一股新兴的健康热潮。
本研究以脱脂奶粉和核桃油为主要原料,以高产甾醇热带假丝酵母(Candida tropicalis)1253、保加利亚乳杆菌(Lactobacillus bulgaricus,Lb)及嗜热链球菌(Streptococcus thermophilus,St)为发酵菌种制备甾醇冻干粉,并在此基础上制备富含甾醇调制乳。以甾醇产量为评价指标,通过单因素试验和响应面试验优化菌株1253发酵工艺,对富含甾醇调制乳品质和营养进行综合性评价,并分析其关键差异代谢物及代谢通路。旨在为富含甾醇调制乳的研制及产业化开发提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料和菌种
脱脂乳粉、白砂糖、米糠油、大豆油、核桃油、红花籽油:市售。
21株云南原生代植物乳植杆菌(Lactiplantibacillus plantarum)(编号分别为Y肉-A-07、B-038-A-03、B024-A-01、A136-A-07、B052-A-02、B072-A-01、B074-A-07、E003-A-01、C068-A-01、E005-A-05-5、B102-A-08、E017-A-03、M021-A-05-1、h058-A-02、B127-B-04、D152-B-11、Y 肉-A-10、h003-A-12、E005-A-11、E047-B-05、E020-A-03):本实验室前期自云南高、中、低海拔地区的少数民族食品、动物粪便、母乳等样品中分离鉴定;5株产甾醇菌株(热带假丝酵母(Candida tropicalis)1253、酿酒酵母(Saccharomyces cerevisiae)1002、扣囊腹膜孢酵母(Saccharomycopsis fibuligera)31630、康宁木霉(Trichoderma koningii)40108、白地霉(Geotrichum candidum)31202):中国工业微生物菌种保藏管理中心(China Center of Industrial Culture Collection,CICC);嗜热链球菌(Streptococcus thermophilus,St)、保加利亚乳杆菌(Lactobacillus bulgaricus,Lb):科汉森(中国)有限公司。
1.1.2 试剂
双乙酰酒石酸单双甘油酯、麦芽糊精:市售;浓磷酸、浓硫酸、六水三氯化铁、无水乙醇、琼脂:天津市风船化学试剂科技有限公司;豆甾醇标准品(纯度>98%)、吐温-80:上海源叶生物科技有限公司。试验所用试剂均为分析纯或生化试剂。
1.1.3 培养基
麦芽汁培养基、MRS液体培养基:美国Sigma-Aldrich公司。
1.2 仪器与设备
SW-CJ-IF型单人双面超净无菌操作台、GMSX-280型高压蒸汽灭菌室:苏州江东精密仪器有限公司;ZQLY-180S型立式全温振荡培养箱:上海知楚仪器有限公司;DHP-9052型电热恒温培养箱:上海博讯实业有限公司;TGL20M型高速冷冻离心机:湖南湘立科学仪器有限公司;FD-1A-50型冷冻干燥机:上海比郎仪器制造有限公司;Synergy H1型全波长荧光酶标仪:美国Biotek公司;GJJ-0.06/70型高压均质机:上海诺尼轻工机械有限公司;Easy-nLC 1000型液相色谱仪、7890B型气相色谱仪:赛默飞世尔(中国)科技有限公司。
1.3 实验方法
1.3.1 菌株活化
植物乳植杆菌:取活化后的菌悬液(从-80 ℃冰箱取出保藏的植物乳植杆菌,接种1 mL到装有100 mL MRS液体培养基的锥形瓶中,37℃静置培养24h),按1%的接种量接种至MRS液体培养基中,于37 ℃静置培养24 h活化3代后备用。
霉菌、酵母菌:取活化后的菌悬液(从-80 ℃冰箱取出保藏的霉菌和酵母菌,接种1 mL到装有100 mL麦芽汁培养基的锥形瓶中,30 ℃、200 r/min振荡培养48 h),将酵母菌和霉菌以1%的接种量接种至装液量为100 mL/250 mL麦芽汁培养基中,于30 ℃、200 r/min振荡培养48 h活化3代后备用。
1.3.2 甾醇含量的测定
菌体甾醇含量的测定:甾醇含量的测定采用磷硫铁法[10]。将植物乳植杆菌、霉菌和酵母菌株发酵液放置于离心机中5 000 r/min离心10 min,弃去上清液。所得菌体水洗3次,精确称量湿菌体0.01~0.10 g,用无水乙醇定容至25 mL,并测定总甾醇含量。分别取样品1 mL,无水乙醇1 mL,加入磷硫铁显色剂2 mL,置于10 mL的试管中,摇匀;显色15 min后于波长520 nm处测定其吸光度值。以吸光度值(x)为横坐标,豆甾醇质量浓度(y)为纵坐标,绘制豆甾醇标准曲线,得到标准曲线回归方程y=328.19x-0.796 1,相关系数R2=0.997 1。菌体甾醇含量(以豆甾醇计)计算公式如下:
式中:W为甾醇含量,%;c为样品吸光度在标准曲线上相对应的豆甾醇质量浓度,mg/mL;V为定容体积,mL;B为稀释倍数4,m为菌体质量,mg。
调制乳中甾醇含量的测定:称取调制乳样品30 g,加入三氯甲烷75 mL,超声处理30 min,取滤液,减压回收至干,残渣加入10%氢氧化钠-体积分数为95%乙醇溶液回流2 h,取出冷却,分别加入45 mL水、50 mL正己烷,充分振荡10 min后静置2 h,收集上层有机溶剂相,旋转蒸发并收集提取物,按照标准曲线回归方程测定样品中总甾醇(以豆甾醇计)含量。
1.3.3 高产甾醇菌株的筛选
将植物乳植杆菌、霉菌和酵母菌活化后的菌悬液按4%(V/V)的接种量分别接种至MRS液体培养基和麦芽汁培养基中,植物乳植杆菌37 ℃静置培养24 h,霉菌和酵母菌30 ℃、200 r/min振荡培养48 h,得到菌株发酵液,以甾醇产量为评价指标,筛选高产甾醇菌株。
1.3.4 高产甾醇菌株发酵工艺条件优化
(1)单因素试验
通过单因素试验考察底物种类(大豆油、米糠油、核桃油、红花籽油)、培养温度(20 ℃、25 ℃、30 ℃、35 ℃、37 ℃、40 ℃)、培养时间(48 h、60 h、72 h、84 h、96 h、108 h)、菌种接种量(2%、4%、6%、8%、10%、12%)、底物添加量(1%、2%、4%、6%、8%、10%)对目标菌株产甾醇量的影响,以确定目标菌株高产甾醇的最佳发酵工艺条件。在进行单因素时,其他培养条件固定为培养温度30 ℃、培养时间96 h、菌种添加量10%、底物添加量4%,转速200 r/min。
(2)响应面试验
在单因素试验基础上,以培养温度(A)、培养时间(B)、菌种接种量(C)为自变量,以甾醇产量(Y)为响应值,采用Design-Expert 11.0软件设置3因素3水平的Box-Behnken响应面试验。Box-Behnken试验因素与水平见表1。
表1 发酵工艺优化Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken experiments for fermentation process optimization
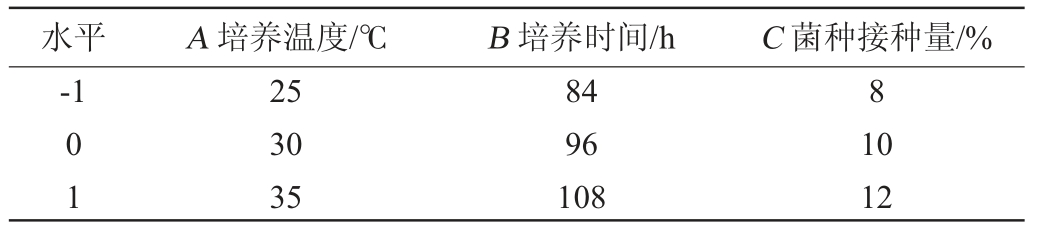
水平 A 培养温度/℃ B 培养时间/h C 菌种接种量/%-1 8 01 25 30 35 84 96 108 10 12
1.3.5 富含甾醇调制乳的制备
甾醇冻干粉的制备:以脱脂奶粉及4%核桃油作为发酵底物,接入菌种(保加利亚乳杆菌、嗜热链球菌和热带假丝酵母1253混菌,1∶1∶3,V/V)4%,白砂糖添加量8%,置于30 ℃恒温培养箱中培养8 h,结束后将甾醇发酵乳进行真空冷冻干燥(-45 ℃,5 d),即得甾醇冻干粉。
富含甾醇调制乳制备工艺流程:
12%脱脂乳粉液→预热(60 ℃,5 min)→添加辅料(10%甾醇冻干粉,8%白砂糖,2%稀奶油,2 mL玫瑰花原浆,1%麦芽糊精)→均质(20 MPa,55 ℃,10 min)→杀菌(63 ℃,30 min)→冷却(42 ℃)→灌装→富含甾醇调制乳成品
1.3.6 富含甾醇调制乳的品质分析
(1)感官评价
参照国标GB 25191—2010《调制乳》[17]对富含甾醇调制乳进行感官评价。采用百分制评分法,由10位专业评估人员进行感官评定,在通风良好,宽敞明亮,无异味的环境中进行,结果以平均值表示。其感官评分标准见表2。
表2 富含甾醇调制乳的感官评定标准
Table 2 Sensory evaluation standards of sterol-rich modified milk
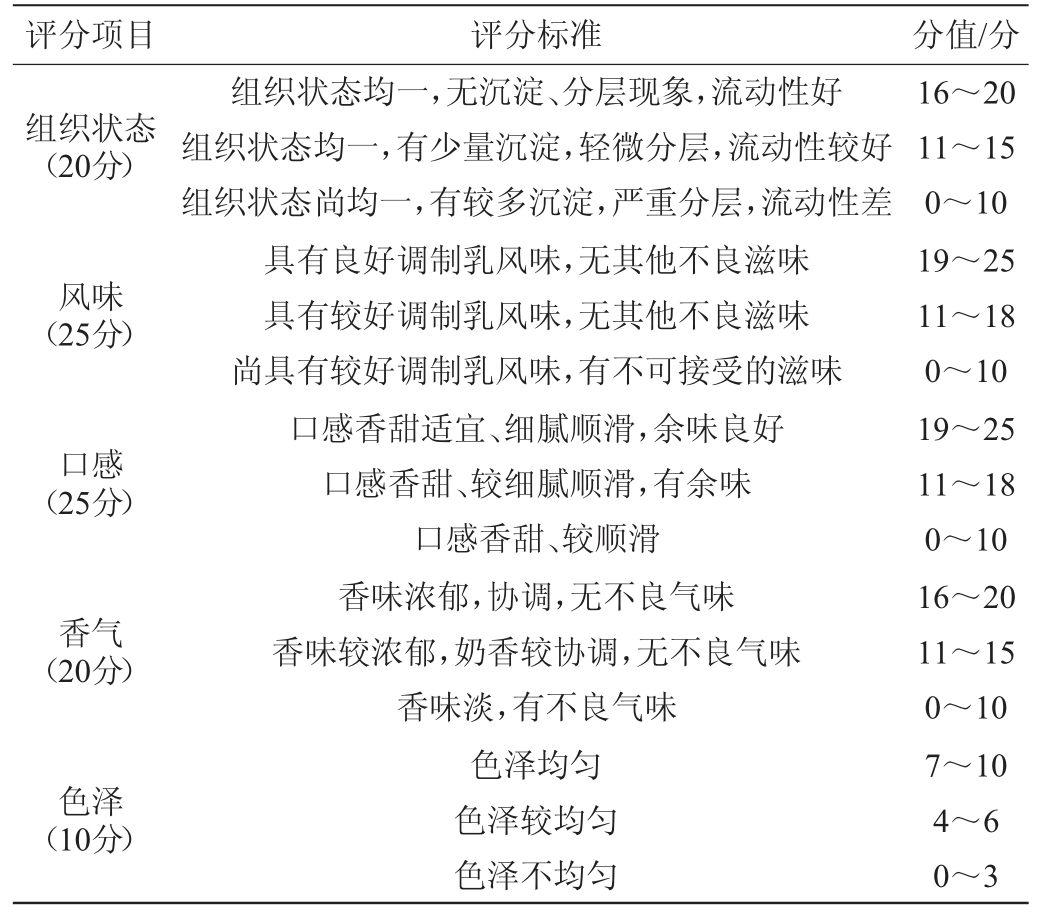
评分项目 评分标准 分值/分组织状态(20分)风味(25分)口感(25分)香气(20分)组织状态均一,无沉淀、分层现象,流动性好组织状态均一,有少量沉淀,轻微分层,流动性较好组织状态尚均一,有较多沉淀,严重分层,流动性差具有良好调制乳风味,无其他不良滋味具有较好调制乳风味,无其他不良滋味尚具有较好调制乳风味,有不可接受的滋味口感香甜适宜、细腻顺滑,余味良好口感香甜、较细腻顺滑,有余味口感香甜、较顺滑香味浓郁,协调,无不良气味香味较浓郁,奶香较协调,无不良气味色泽(10分)香味淡,有不良气味色泽均匀色泽较均匀色泽不均匀16~20 11~15 0~10 19~25 11~18 0~10 19~25 11~18 0~10 16~20 11~15 0~10 7~10 4~6 0~3
(2)理化指标
参照国标GB 5009.6—2016《食品中脂肪的测定》[18]测定脂肪含量;参照GB 5009.5—2016《食品中蛋白质的测定》[19]凯氏定氮法测定蛋白质含量。
(3)微生物指标
菌落总数的测定参照GB 4789.2—2022《食品微生物学检验菌落总数测定》[20];大肠菌群、金黄色葡萄球菌(Staphylococcusaureus)、沙门氏菌(Salmonella)分别参照GB4789.3—2016《食品微生物学检验 大肠菌群》平板计数法[21]、GB 4789.10—2016《食品微生物学检验金黄色葡萄球菌检验》[22]、GB 4789.4—2024《食品微生物学检验沙门氏菌检验》[23]。
1.3.7 富含甾醇调制乳差异代谢物分析
富含甾醇调制乳差异代谢物分析采用超高效液相色谱-质谱(ultra high performance liquid chromatography-mass spectrometry,UHPLC-MS)法。分别取调制乳LBST-1253-PM(保加利亚乳杆菌、嗜热链球菌和热带假丝酵母1253混菌发酵甾醇冻干粉制备的调制乳)3份(编号为C1、C2、C3)和LBST-PM(保加利亚乳杆菌、嗜热链球菌混菌发酵甾醇冻干粉制备的调制乳)3份(编号为D1、D2、D3)。
样品前处理:LBST-1253-PM和LBST-PM样品冻干粉分别称取20 mg,加入1 000 μL提取液(甲醇∶乙腈∶水=2∶2∶1(V/V),含同位素标记内标混合物);35 Hz研磨处理4 min,超声(1 s脉冲模式,200 W,30 μm)5 min(冰水浴);重复步骤2~3次;-40 ℃静置1 h;将样品4 ℃、12 000 r/min条件下离心15 min;取上清于进样瓶中上机检测。
UHPLC条件:Waters ACQUITY UPLCBE h Amide色谱柱(2.1 mm×100 mm,1.7 μm),A相为水相(含25 mmol/L乙酸铵和25 mmol/L氨水),B相为乙腈。样品盘温度4 ℃,进样体积2 μL。
MS条件:选择QEHFX质谱仪,采用电喷雾离子(electron spray ionization,ESI)源,在正离子和负离子模式下采集数据。正离子模式下喷雾电压为3 600 kV;负离子模式下喷雾电压为-3 200 kV。鞘气体流量为30 Arb;辅助气体流量为25 Arb;毛细管温度为350 ℃;全MS分辨率为60 000,MS/MS分辨率为7 500;NCE模式碰撞能量为10/30/60 eV。
1.3.8 富含甾醇调制乳的差异代谢物代谢通路分析
代谢通路分析是将分析数据结果结合具体的生物代谢系统进行生物学意义的解释。对筛选出的差异代谢物富集,通过京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)Pathway数据库通路分析、聚类分析等手段进行分析。
1.3.9 数据处理
所有数据重复3次,结果均以“平均值±标准差”表示。使用Design-Expert 11.0进行Box-Behnken响应面设计。使用SIMCA 15.0.2进行多元统计分析,包括主成分分析(principal component analysis,PCA)、正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLSDA),使用Microsoft Excel 2019、SPSS 19.0进行数据方差分析,当P<0.05时,表示差异显著,采用Origin 2022绘制图表。
2 结果与分析
2.1 高产甾醇菌株的筛选
将植物乳植杆菌、霉菌和酵母菌活化后的菌悬液按4%(V/V)的接种量分别接种至MRS液体培养基和麦芽汁培养基中,植物乳植杆菌分别于37 ℃静置培养24 h,霉菌和酵母菌于30 ℃、200 r/min振荡培养48 h,测定其发酵液中甾醇产量,结果见图1。由图1A可知,5株产甾醇菌株中,热带假丝酵母1253的甾醇产量最高,为0.30 mg/g,显著高于其他菌株(P<0.05),其次是酿酒酵母(0.28 mg/g),白地霉产量最差(0.02 mg/g)。由图1B可知,植物乳植杆菌的甾醇产量较高,但在实验过程中发现,植物乳杆菌离心后的菌体沉淀均不能溶解于无水乙醇中。综上所述,选择热带假丝酵母1253进行后续发酵工艺优化。
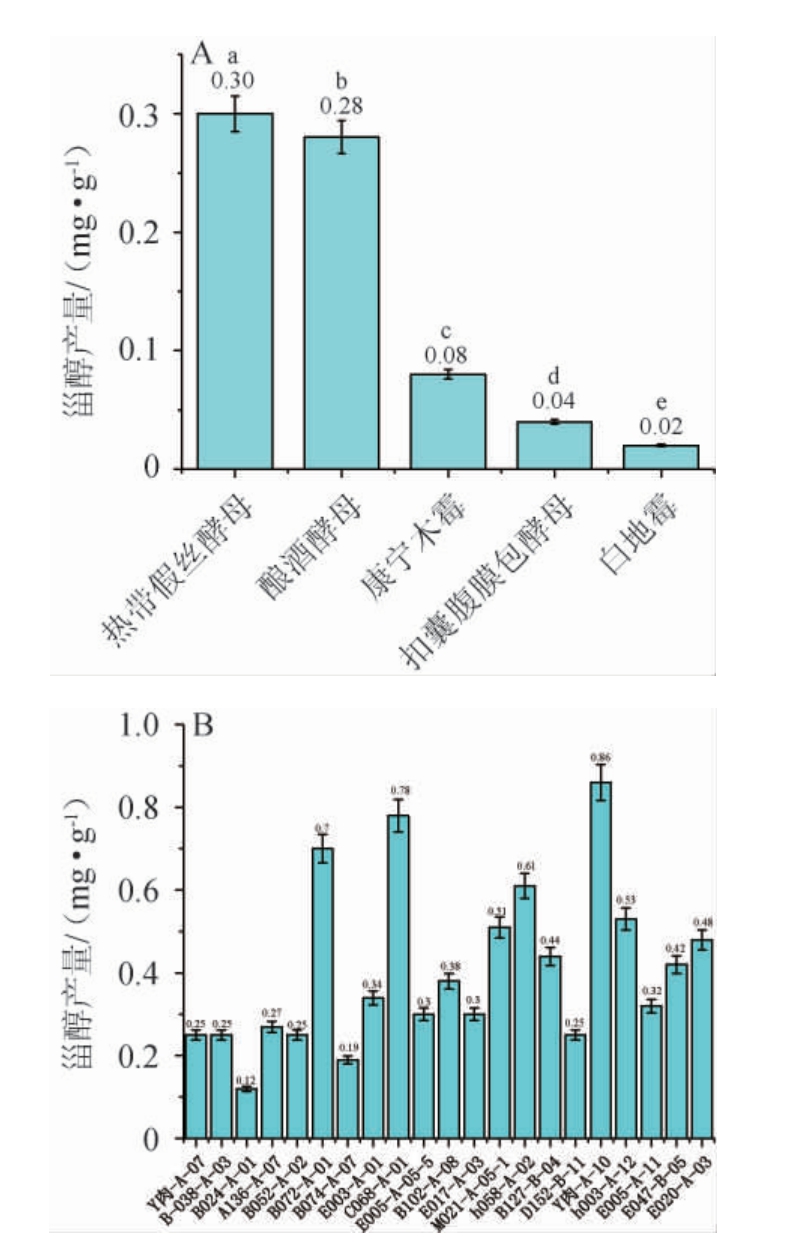
图1 产甾醇霉菌、酵母菌(A)和植物乳植杆菌(B)菌株的筛选
Fig.1 Screening of sterol-producing strains of molds, yeasts (A) and Lactiplantibacillus plantarum (B)
不同字母表示差异显著(P<0.05)。下同。
2.2 热带假丝酵母1253发酵工艺优化单因素试验
2.2.1 底物种类对菌株1253甾醇产量的影响
不同种类底物对甾醇产量的影响见表3。由表3可知,当核桃油作为底物时,甾醇产量最高,达到0.66 mg/g,显著高于其他底物(P<0.05)。当培养基中加入米糠油作为底物时,甾醇产量最少为0.38 mg/g。因此,选择核桃油作为发酵底物。
表3 不同的底物种类对菌株发酵产甾醇的影响
Table 3 Effect of different substrate types on sterol yield by strain fermentation
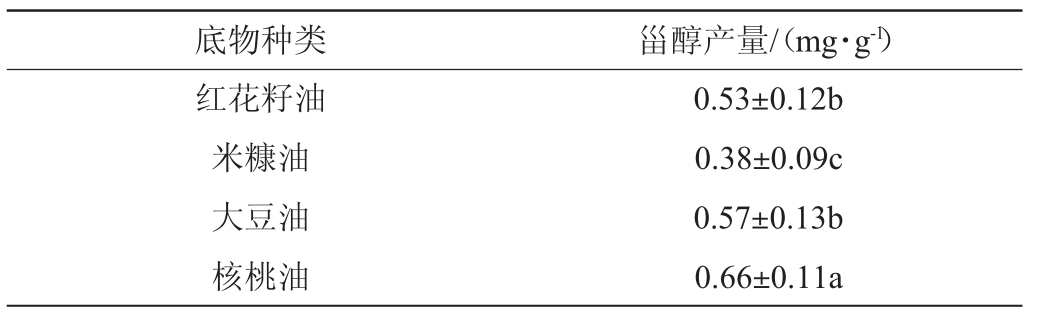
注:同一行小写字母不同表示差异显著(P<0.05)。下同。
底物种类 甾醇产量/(mg·g-1)红花籽油米糠油大豆油核桃油0.53±0.12b 0.38±0.09c 0.57±0.13b 0.66±0.11a
2.2.2 核桃油添加量对甾醇产量的影响
核桃油添加量对甾醇产量的影响见图2。由图2可知,当核桃油添加量在1%~4%时,甾醇产量随核桃油添加量增加而增加;当核桃油添加量为4%时,甾醇产量达到峰值1.04 mg/g;当核桃油添加量>4%之后,甾醇产量迅速下降后逐渐放缓。由于底物核桃油为油相,将其加入到发酵培养基前对其进行了乳化处理,以便菌株能更好的吸收和利用。但底物过多时,会影响菌株对氧气的吸收,进而使甾醇产量降低。因此,最适核桃油添加量为4%。
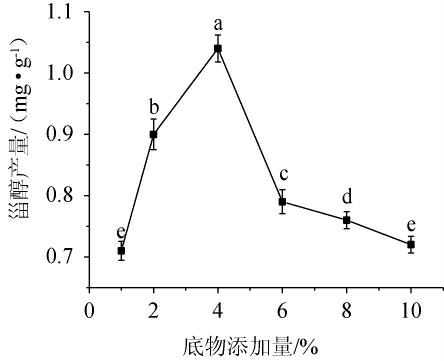
图2 不同核桃油添加量对甾醇产量的影响
Fig.2 Effect of different walnut oil addition on sterol yield
2.2.3 菌种接种量对甾醇产量的影响
不同菌种接种量对甾醇产量的影响见图3。由图3可知,甾醇产量随菌种接种量的增加呈先增加后降低的趋势。当菌种接种量在6%~8%时,甾醇产量随接种量增加而增加显著(P<0.05);当菌种接种量为10%时,甾醇产量最高,为0.74 mg/g;当菌种接种量>10%之后,甾醇产量呈现下降趋势。可能是由于接种量过多使培养基中的氧气供应不足,从而使热带假丝酵母1253的生长受到抑制而影响甾醇产量。因此,最适菌种接种量为10%。
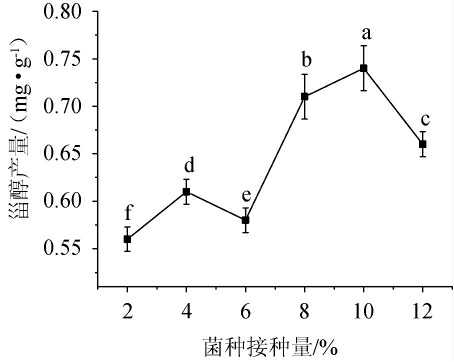
图3 不同菌种接种量对甾醇产量的影响
Fig.3 Effect of different inoculum on sterol yield
2.2.4 培养温度对甾醇产量的影响
不同培养温度对甾醇产量的影响见图4。由图4可知,当培养温度在20~30 ℃时,甾醇产量随温度升高而增大;当培养温度在30 ℃时,甾醇产量最高,为0.95 mg/g;当发酵温度>30 ℃之后,甾醇产量呈下降趋势。这是由于酵母菌对氧气的要求较高,氧气量增大有利于甾醇的积累。因此,最适培养温度为30 ℃。
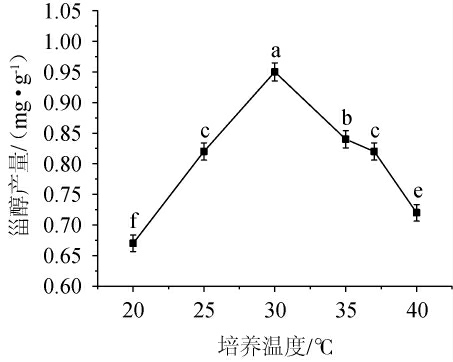
图4 不同培养温度对甾醇产量的影响
Fig.4 Effect of different culture temperature on sterol yield
2.2.5 培养时间对甾醇产量的影响
培养时间对甾醇产量的影响见图5。由图5可知,甾醇产量随培养时间的变化可分为三个阶段。首先第一阶段(培养时间48~72 h),随着热带假丝酵母1253菌株的迅速生长繁殖,甾醇产量也迅速增多;第二阶段(培养时间72~96 h),热带假丝酵母1253菌株的生长逐渐放缓,甾醇产量增长也随之放缓,并于培养时间为96 h时,甾醇产量达到峰值,为0.69 mg/g;第三阶段(培养时间>96 h),甾醇产量出现下降趋势。其原因可能是培养基中底物及营养成分有限,导致菌株的生长繁殖受到限制,进而造成甾醇产量降低。因此,最适培养时间为96 h。
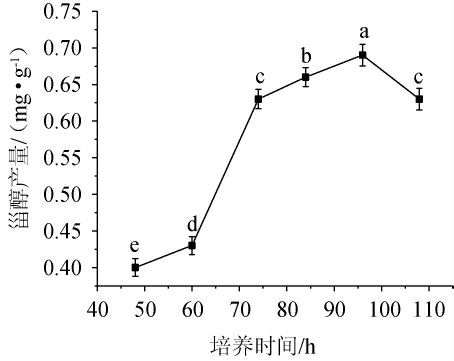
图5 不同培养时间对甾醇产量的影响
Fig.5 Effects of different culture time on sterol yield
2.3 热带假丝酵母1253发酵工艺优化响应面试验
2.3.1 Box-Behnken试验设计及结果
根据单因素试验的结果,以培养温度(A)、培养时间(B)、菌种接种量(C)为自变量,以甾醇产量(Y)为响应值,采用Design-Expert 11.0软件设计3因素3水平Box-Behnken试验,优化热带假丝酵母1253发酵工艺条件,Box-Behnken试验设计及结果见表4,方差分析结果见表5。
表4 发酵工艺优化Box-Behnken试验设计及结果
Table 4 Design and results of Box-Behnken experiments for fermentation process optimization
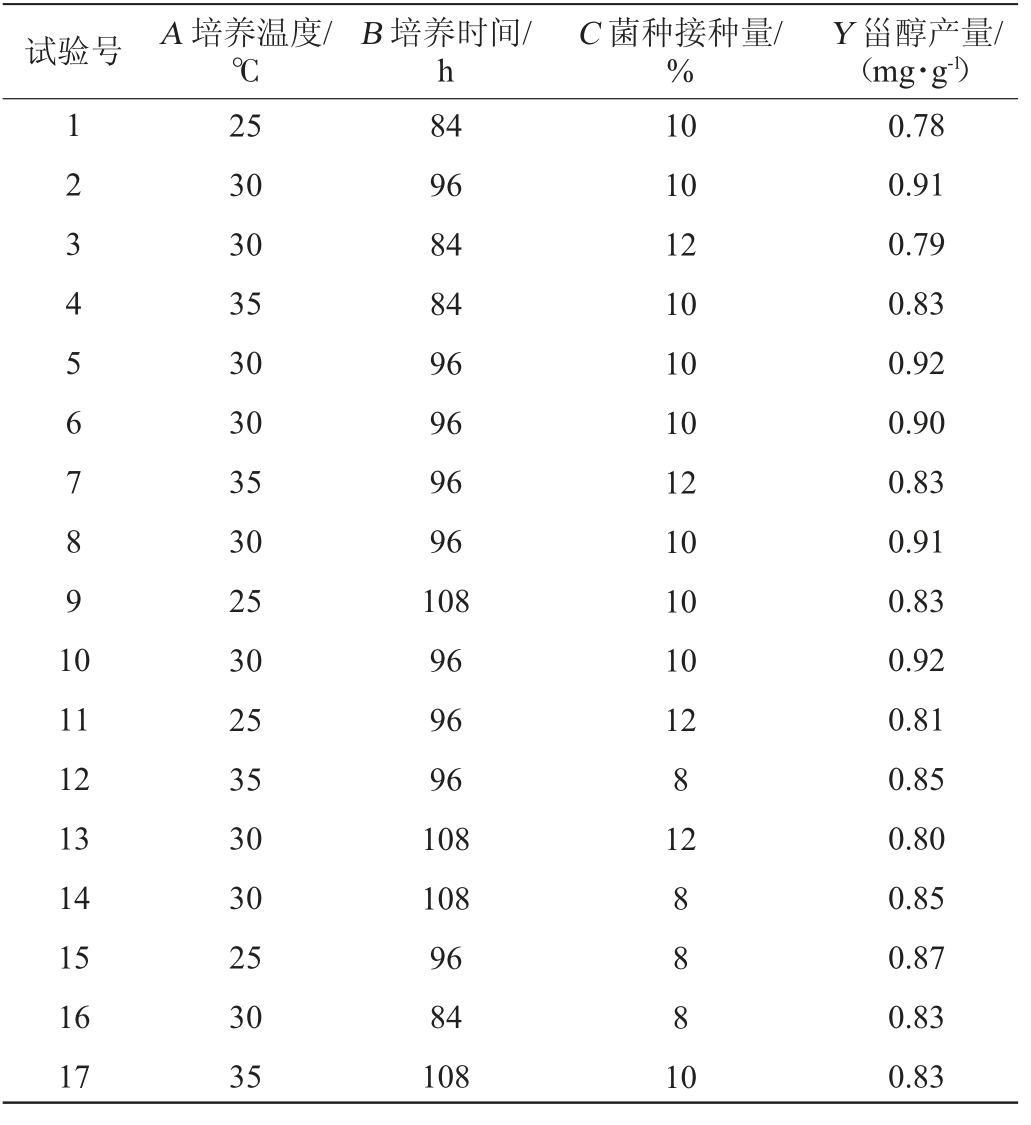
试验号 A 培养温度/℃B 培养时间/h C 菌种接种量/%Y 甾醇产量/(mg·g-1)1 2 3 4 5 6 7 8 9 1 0 11 12 13 14 15 16 17 25 30 30 35 30 30 35 30 25 30 25 35 30 30 25 30 35 84 96 84 84 96 96 96 96 108 96 96 96 108 108 96 84 108 10 10 12 10 10 10 12 10 10 10 12 8 12 8 8 8 1 0 0.78 0.91 0.79 0.83 0.92 0.90 0.83 0.91 0.83 0.92 0.81 0.85 0.80 0.85 0.87 0.83 0.83
表5 回归模型方差分析
Table 5 Variance analysis of regression model
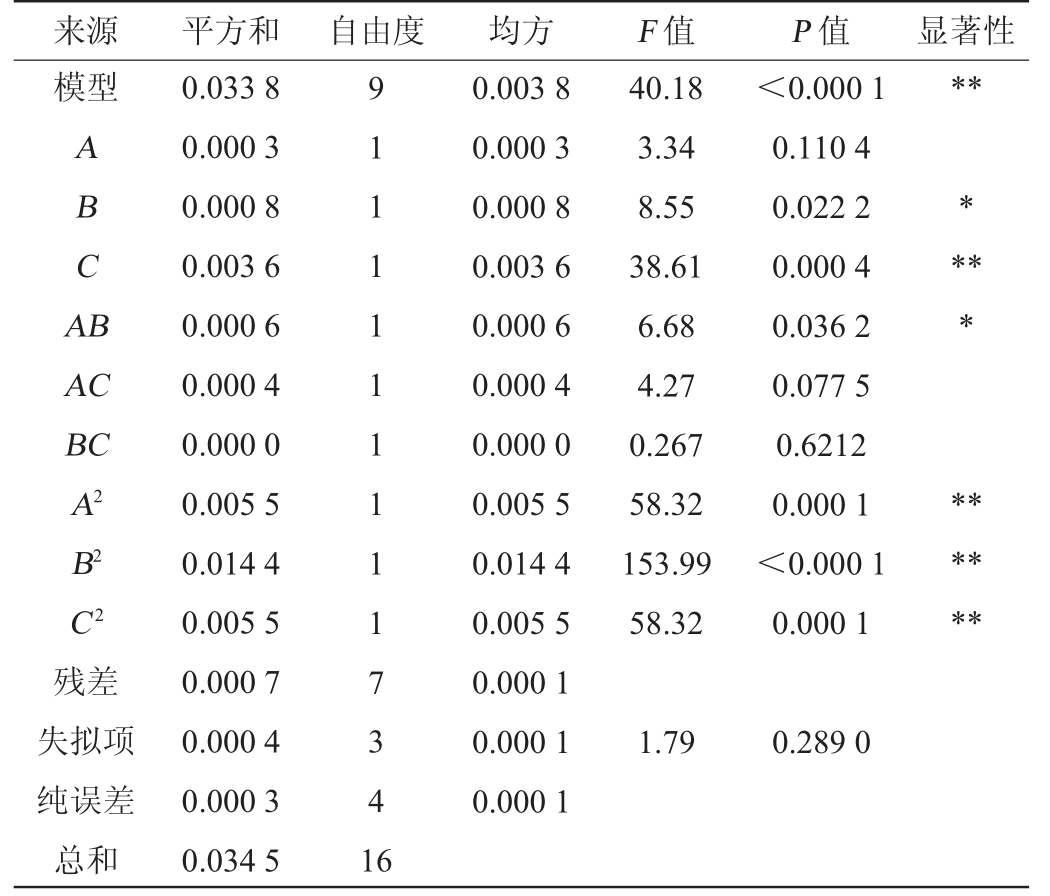
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
来源 平方和 自由度 均方 F 值 P 值 显著性模型**ABCA B****AC BC A2 B2 C2残差失拟项纯误差总和0.033 8 0.000 3 0.000 8 0.003 6 0.000 6 0.000 4 0.000 0 0.005 5 0.014 4 0.005 5 0.000 7 0.000 4 0.000 3 0.034 5 9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 0.003 8 0.000 3 0.000 8 0.003 6 0.000 6 0.000 4 0.000 0 0.005 5 0.014 4 0.005 5 0.000 1 0.000 1 0.000 1 40.18 3.34 8.55 38.61 6.68 4.27 0.267 58.32 153.99 58.32<0.000 1 0.110 4 0.022 2 0.000 4 0.036 2 0.077 5 0.6212 0.000 1<0.000 1 0.000 1******1.79 0.289 0
利用Design-Expert 11.0软件表4数据进行多元回归拟合,得到热带假丝酵母1253甾醇产量与培养温度、培养时间、菌种添加量的二次回归方程为:Y=0.912 0+0.006 2A+0.0100B-0.0212C-0.0125AB+0.0100AC-0.0025BC-0.0360A2-0.0585B2-0.0360C2。
由表5可知,模型P<0.001,决定系数R2=98.10,失拟项P值为0.289 0>0.05,信噪比=16.612 7,这表明方程的拟合度和可信度均很高。由P值可知,一次项C,二次项A2、B2、C2对结果影响极显著(P<0.01);一次项B,交互项AB对结果影响显著(P<0.05)。由F值可知,各因素对热带假丝酵母1253甾醇产量影响的顺序为:菌种接种量(C)>培养时间(B)>培养温度(A)。
2.3.2 各因素间交互作用分析
各因素间交互作用对甾醇产量影响的响应面及等高线见图6。由图6可知,AB响应面陡峭,等高线为椭圆形,交互作用显著(P<0.05),对热带假丝酵母1253甾醇产量影响较大。AC、BC之间交互作用响应面平缓,等高线近似圆形,交互作用不显著(P>0.05)。该结果与方差分析结果一致。
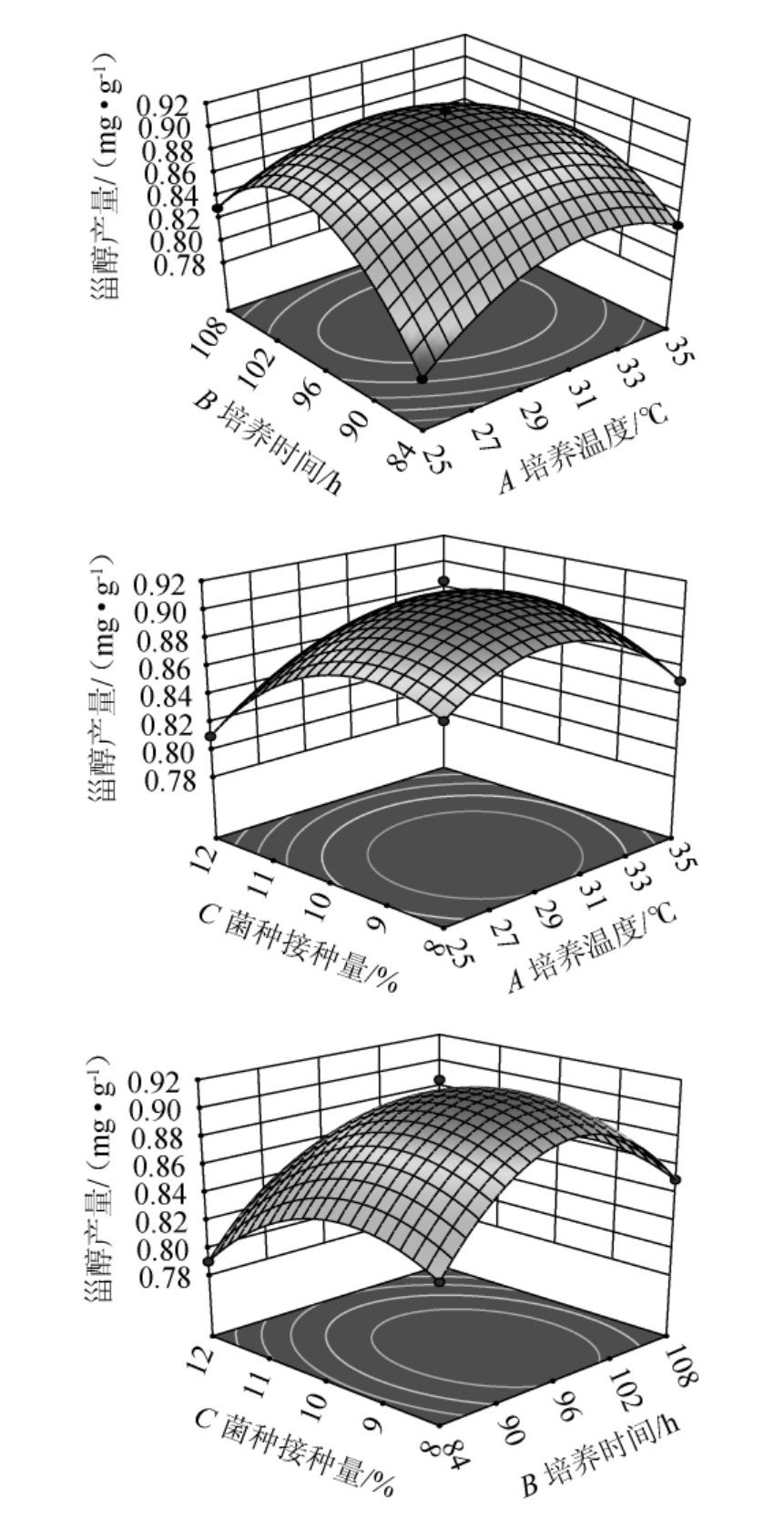
图6 各因素间交互作用对甾醇产量影响的响应面及等高线
Fig.6 Response surface plots and contour lines of effects of interaction between various factors on sterol yield
2.3.3 回归模型的验证和最佳条件的确定
利用Design-Expert 11.0软件对回归方程进行计算,预测热带假丝酵母1253产甾醇最佳发酵工艺为培养时间97.067 h,培养温度30.151 ℃,菌种接种量9.412%。在此条件下,甾醇产量预测值为0.916 mg/g;考虑实际操作情况,修正最佳发酵工艺条件为:培养时间97 h,培养温度30 ℃,菌种接种量9.5%。在此优化条件下进行6次重复试验,热带假丝酵母1253甾醇产量实际值为0.903 mg/g,与预测值接近,表明模型准确可行。
2.4 富含甾醇调制乳品质分析
2.4.1 感官评价
富含甾醇调制乳色泽均匀一致,无沉淀、分层现象,流动性良好;风味良好,无其他不良的滋味;口感香甜适宜、细腻顺滑余味良好;香味协调,无不良气味,整体色泽均匀。LBST-PM调制乳的感官评分为(84.23±1.34)分,而LBST-1253-PM的感官评分为(86.44±2.06)分,二者不存在显著差异(P>0.05)。
2.4.2 理化指标
由表6可知,富含甾醇调制乳LBST-1253-PM的脂肪含量(3.33 g/100 g)、蛋白质含量(2.57 g/100 g)与LBST-PM调制乳(3.25 g/100 g、2.62 g/100 g)差异不显著(P>0.05),但甾醇含量(300.45 mg/g)显著高于LBST-PM调制乳(93.87 mg/g)(P<0.05),均符合GB 5009.6—2016《食品中脂肪的测定》[18]和GB 5009.5—2016《食品中蛋白质测定》[19]限量标准,说明热带假丝酵母1253的添加能明显提高调制乳中的甾醇含量,这不仅符合甾醇作为新资源功能成分的限量标准,还能对镇静、抗焦虑、改善睡眠状况起到促进作用[24]。LIU W L等[4]从辣木籽中分离提取甾醇类活性成分,发现β-谷甾醇(100 mg/kg)和豆甾醇(50 mg/kg)通过激活GABA能系统发挥改善小鼠睡眠作用。
表6 富含甾醇调制乳理化指标测定结果
Table 6 Determination results of physicochemical indexes of sterol-rich modified milk
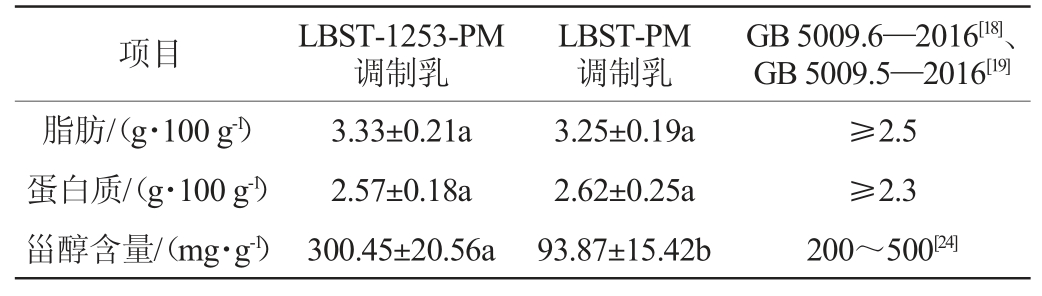
项目 GB 5009.6—2016[18]、GB 5009.5—2016[19]脂肪/(g·100 g-1)蛋白质/(g·100 g-1)甾醇含量/(mg·g-1)LBST-1253-PM调制乳LBST-PM调制乳3.33±0.21a 2.57±0.18a 300.45±20.56a 3.25±0.19a 2.62±0.25a 93.87±15.42b≥2.5≥2.3 200~500[24]
2.4.3 微生物指标
由表7可知,在两组样品中,大肠杆菌、金黄色葡萄球菌、沙门氏菌均未检出,菌落总数皆小于106 CFU/mL,均符合国家标准GB 4789.2—2022《食品微生物学检验菌落总数测定》[20]、GB 4789.3—2016《食品微生物学检验大肠菌群计数》[21]、GB 4789.10—2016《食品微生物学检验金黄色葡萄球菌检验》[22]、GB 4789.4—2024《食品微生物学检验沙门氏菌检验》[23]要求。
表7 富含甾醇调制乳微生物指标测定结果
Table 7 Determination results of microbiological indicators of sterol-rich modified milk
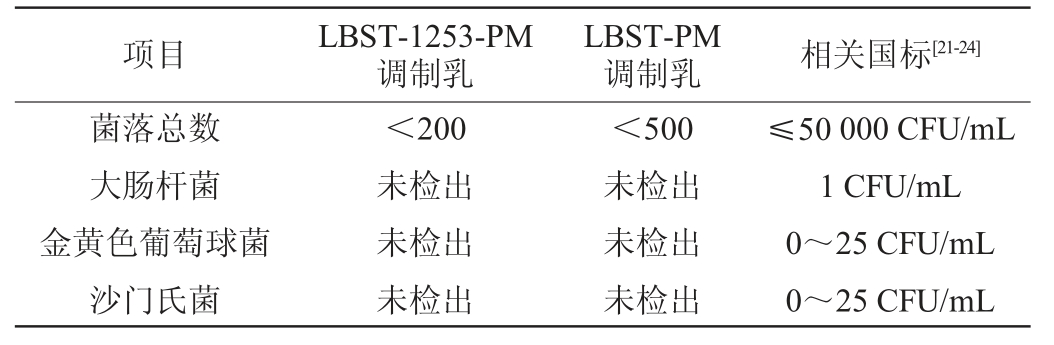
项目 LBST-1253-PM调制乳LBST-PM调制乳 相关国标[21-24]菌落总数大肠杆菌金黄色葡萄球菌沙门氏菌<200未检出未检出未检出<500未检出未检出未检出≤50 000 CFU/mL 1 CFU/mL 0~25 CFU/mL 0~25 CFU/mL
2.5 富含甾醇调制乳特征营养物质分析
2.5.1 主成分分析(PCA)和正交偏最小二乘法判别分析(OPLS-DA)
PCA主要用于研究样本分布、偏差特征和共同趋势,能够降低数据处理的复杂程度[25],其中,R2X代表模型对X变量的解释性,当它的值大于0.4时,说明此模型可靠,能够用于解释样品之间的差异。采用PCA对两组样品进行多元统计分析,结果如图7A所示,PCA模型的第一和第二主成分方差贡献率分别为59.8%和11.7%,累计方差贡献率为71.5%,解释能力R2X=0.82,因此该模型拟合性较好,表明两种样品之间的代谢物存在差异。与PCA相比,OPLS-DA能更好的对数据进行可视化,从而更加准确地识别代谢物的差异[26]。由图7B和7C可知,两组样品分布在置信区间的左右两侧,表明两个样品成分存在显著差异,该结果与PCA一致。对模型进行200次置换检验,模型累计预测能力Q2=0.994,解释能力R2X=0.743,Q2<0,更加说明该模型有效,可进一步筛选差异代谢物。
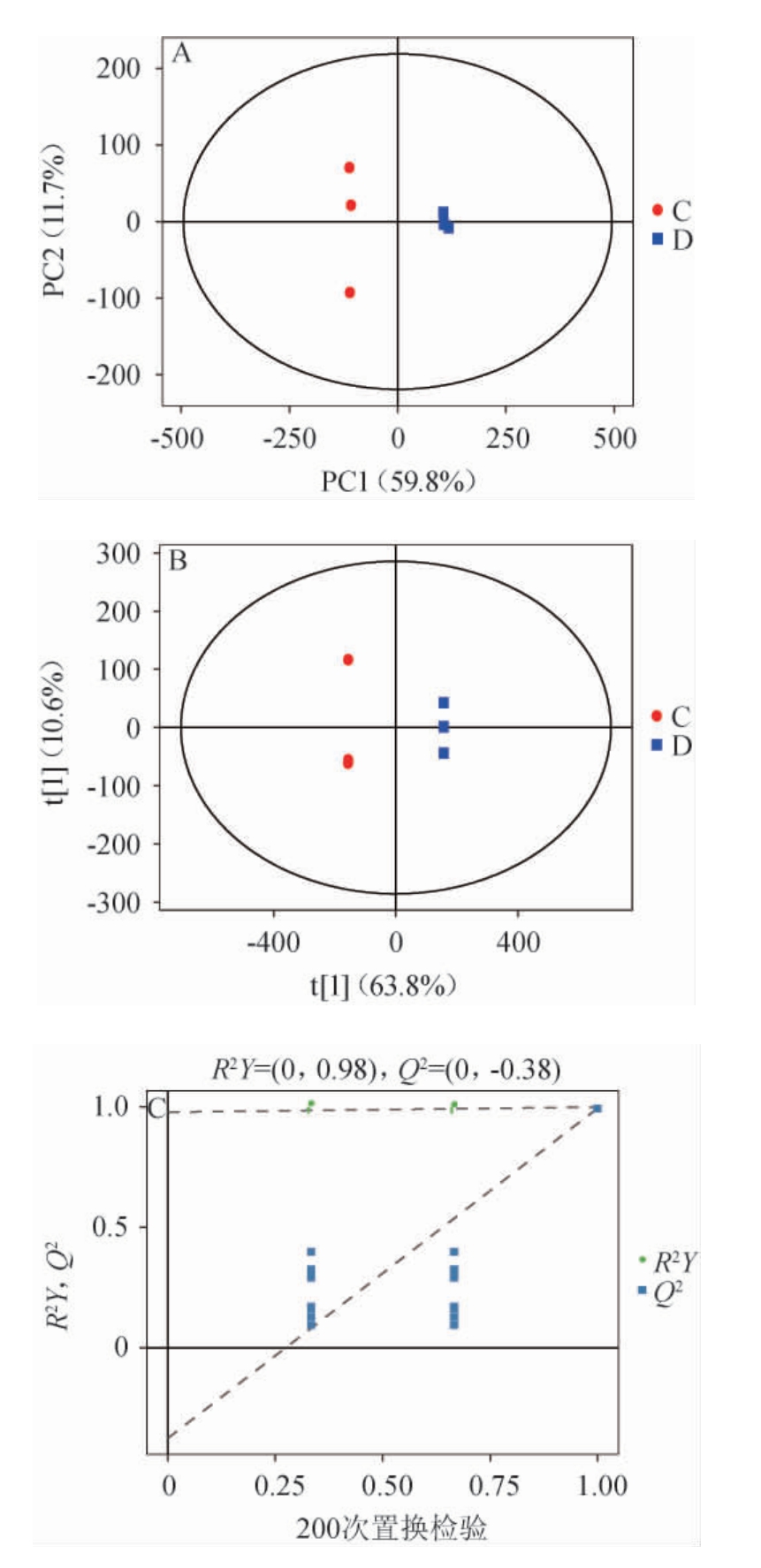
图7 富含甾醇调制乳的主成分分析得分图(A),正交偏最小二乘法判别分析结果(B)及置换检验结果(C)
Fig.7 Principal component analysis score plots (A), orthogonal partial least squares discriminant analysis results (B) and permutation test results (c) of sterol-rich modified milk
2.5.2 LBST-1253-PM和LBST-PM关键差异代谢物
基于OPLS-DA结果,采用UHPLC-MS对LBST-1253PM和LBST-PM进行代谢物分析,结果见表8。由表8可知,共得到703个差异代谢物。根据变量重要性投影(variable importance in the projection,VIP)值>1.2,P值<0.001筛选出两组样品中关键差异代谢物(64种)。这些代谢物主要包括氨基酸及肽类衍生物、芳香类化合物及其衍生物、脂肪酸及衍生物、糖类及其他类化合物。
表8 LBST-1253-PM和LBST-PM的关键差异代谢物
Table 8 Key differential metabolites of LBST-1253-PM and LBST-PM
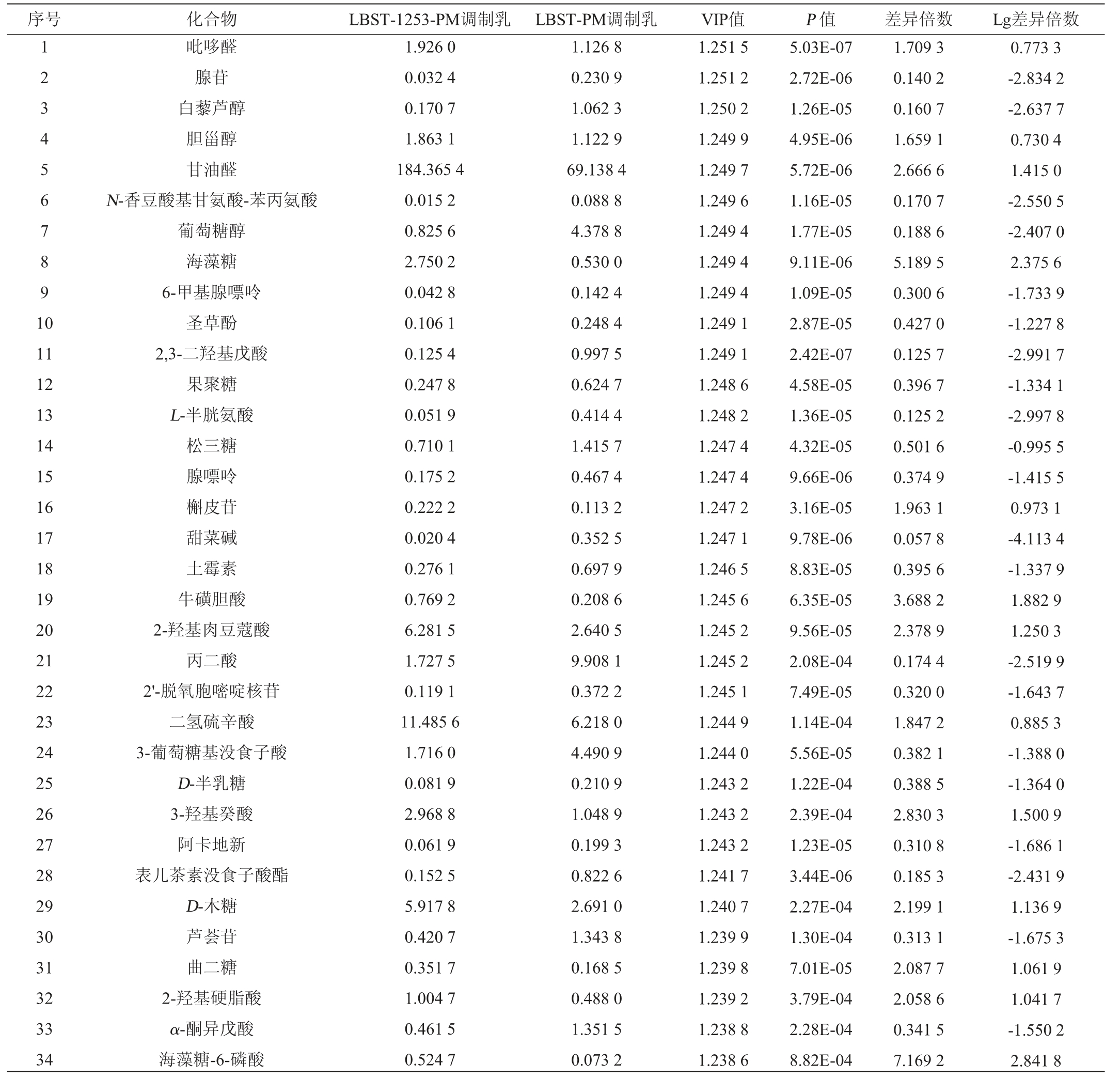
序号 化合物 LBST-1253-PM调制乳 LBST-PM调制乳 VIP值 P 值 差异倍数 Lg差异倍数1 2 3 4 5 6 7 8 9 1 0 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34吡哆醛腺苷白藜芦醇胆甾醇甘油醛N-香豆酸基甘氨酸-苯丙氨酸葡萄糖醇海藻糖6-甲基腺嘌呤圣草酚2,3-二羟基戊酸果聚糖L-半胱氨酸松三糖腺嘌呤槲皮苷甜菜碱土霉素牛磺胆酸2-羟基肉豆蔻酸丙二酸2'-脱氧胞嘧啶核苷二氢硫辛酸3-葡萄糖基没食子酸D-半乳糖3-羟基癸酸阿卡地新表儿茶素没食子酸酯D-木糖芦荟苷曲二糖2-羟基硬脂酸α-酮异戊酸海藻糖-6-磷酸1.926 0 0.032 4 0.170 7 1.863 1 184.365 4 0.015 2 0.825 6 2.750 2 0.042 8 0.106 1 0.125 4 0.247 8 0.051 9 0.710 1 0.175 2 0.222 2 0.020 4 0.276 1 0.769 2 6.281 5 1.727 5 0.119 1 11.485 6 1.716 0 0.081 9 2.968 8 0.061 9 0.152 5 5.917 8 0.420 7 0.351 7 1.004 7 0.461 5 0.524 7 1.126 8 0.230 9 1.062 3 1.122 9 69.138 4 0.088 8 4.378 8 0.530 0 0.142 4 0.248 4 0.997 5 0.624 7 0.414 4 1.415 7 0.467 4 0.113 2 0.352 5 0.697 9 0.208 6 2.640 5 9.908 1 0.372 2 6.218 0 4.490 9 0.210 9 1.048 9 0.199 3 0.822 6 2.691 0 1.343 8 0.168 5 0.488 0 1.351 5 0.073 2 1.251 5 1.251 2 1.250 2 1.249 9 1.249 7 1.249 6 1.249 4 1.249 4 1.249 4 1.249 1 1.249 1 1.248 6 1.248 2 1.247 4 1.247 4 1.247 2 1.247 1 1.246 5 1.245 6 1.245 2 1.245 2 1.245 1 1.244 9 1.244 0 1.243 2 1.243 2 1.243 2 1.241 7 1.240 7 1.239 9 1.239 8 1.239 2 1.238 8 1.238 6 5.03E-07 2.72E-06 1.26E-05 4.95E-06 5.72E-06 1.16E-05 1.77E-05 9.11E-06 1.09E-05 2.87E-05 2.42E-07 4.58E-05 1.36E-05 4.32E-05 9.66E-06 3.16E-05 9.78E-06 8.83E-05 6.35E-05 9.56E-05 2.08E-04 7.49E-05 1.14E-04 5.56E-05 1.22E-04 2.39E-04 1.23E-05 3.44E-06 2.27E-04 1.30E-04 7.01E-05 3.79E-04 2.28E-04 8.82E-04 1.709 3 0.140 2 0.160 7 1.659 1 2.666 6 0.170 7 0.188 6 5.189 5 0.300 6 0.427 0 0.125 7 0.396 7 0.125 2 0.501 6 0.374 9 1.963 1 0.057 8 0.395 6 3.688 2 2.378 9 0.174 4 0.320 0 1.847 2 0.382 1 0.388 5 2.830 3 0.310 8 0.185 3 2.199 1 0.313 1 2.087 7 2.058 6 0.341 5 7.169 2 0.773 3-2.834 2-2.637 7 0.730 4 1.415 0-2.550 5-2.407 0 2.375 6-1.733 9-1.227 8-2.991 7-1.334 1-2.997 8-0.995 5-1.415 5 0.973 1-4.113 4-1.337 9 1.882 9 1.250 3-2.519 9-1.643 7 0.885 3-1.388 0-1.364 0 1.500 9-1.686 1-2.431 9 1.136 9-1.675 3 1.061 9 1.041 7-1.550 2 2.841 8
续表
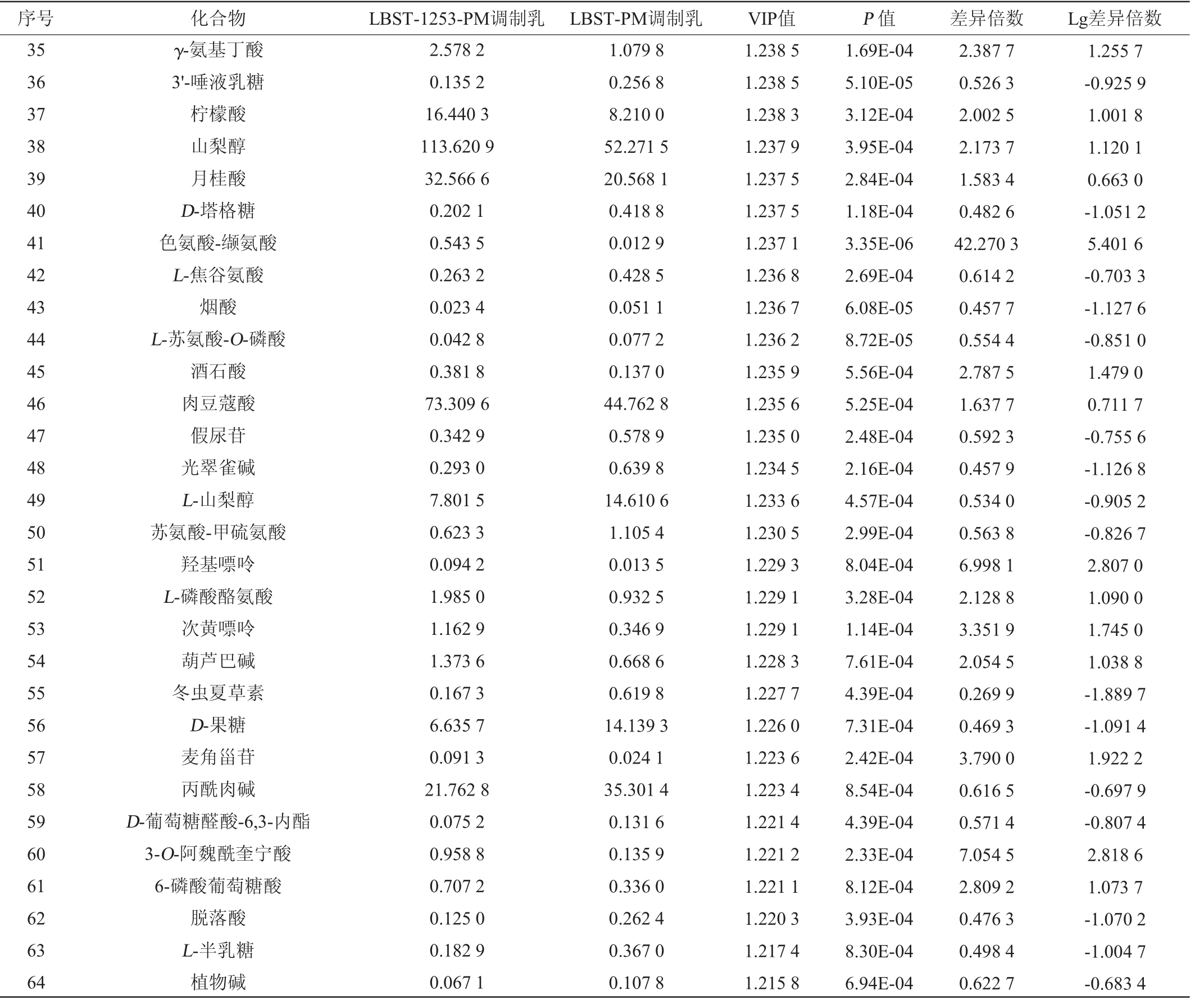
注:Lg差异倍数的“+”、“-”分别表示与LBST-PM调制乳相比,LBST-1253-PM调制乳中代谢物的相对含量上调、下调情况。
序号 化合物 LBST-1253-PM调制乳 LBST-PM调制乳 VIP值 P 值 差异倍数 Lg差异倍数35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 γ-氨基丁酸3'-唾液乳糖柠檬酸山梨醇月桂酸D-塔格糖色氨酸-缬氨酸L-焦谷氨酸烟酸L-苏氨酸-O-磷酸酒石酸肉豆蔻酸假尿苷光翠雀碱L-山梨醇苏氨酸-甲硫氨酸羟基嘌呤L-磷酸酪氨酸次黄嘌呤葫芦巴碱冬虫夏草素D-果糖麦角甾苷丙酰肉碱D-葡萄糖醛酸-6,3-内酯3-O-阿魏酰奎宁酸6-磷酸葡萄糖酸脱落酸L-半乳糖植物碱2.578 2 0.135 2 16.440 3 113.620 9 32.566 6 0.202 1 0.543 5 0.263 2 0.023 4 0.042 8 0.381 8 73.309 6 0.342 9 0.293 0 7.801 5 0.623 3 0.094 2 1.985 0 1.162 9 1.373 6 0.167 3 6.635 7 0.091 3 21.762 8 0.075 2 0.958 8 0.707 2 0.125 0 0.182 9 0.067 1 1.079 8 0.256 8 8.210 0 52.271 5 20.568 1 0.418 8 0.012 9 0.428 5 0.051 1 0.077 2 0.137 0 44.762 8 0.578 9 0.639 8 14.610 6 1.105 4 0.013 5 0.932 5 0.346 9 0.668 6 0.619 8 14.139 3 0.024 1 35.301 4 0.131 6 0.135 9 0.336 0 0.262 4 0.367 0 0.107 8 1.238 5 1.238 5 1.238 3 1.237 9 1.237 5 1.237 5 1.237 1 1.236 8 1.236 7 1.236 2 1.235 9 1.235 6 1.235 0 1.234 5 1.233 6 1.230 5 1.229 3 1.229 1 1.229 1 1.228 3 1.227 7 1.226 0 1.223 6 1.223 4 1.221 4 1.221 2 1.221 1 1.220 3 1.217 4 1.215 8 1.69E-04 5.10E-05 3.12E-04 3.95E-04 2.84E-04 1.18E-04 3.35E-06 2.69E-04 6.08E-05 8.72E-05 5.56E-04 5.25E-04 2.48E-04 2.16E-04 4.57E-04 2.99E-04 8.04E-04 3.28E-04 1.14E-04 7.61E-04 4.39E-04 7.31E-04 2.42E-04 8.54E-04 4.39E-04 2.33E-04 8.12E-04 3.93E-04 8.30E-04 6.94E-04 2.387 7 0.526 3 2.002 5 2.173 7 1.583 4 0.482 6 42.270 3 0.614 2 0.457 7 0.554 4 2.787 5 1.637 7 0.592 3 0.457 9 0.534 0 0.563 8 6.998 1 2.128 8 3.351 9 2.054 5 0.269 9 0.469 3 3.790 0 0.616 5 0.571 4 7.054 5 2.809 2 0.476 3 0.498 4 0.622 7 1.255 7-0.925 9 1.001 8 1.120 1 0.663 0-1.051 2 5.401 6-0.703 3-1.127 6-0.851 0 1.479 0 0.711 7-0.755 6-1.126 8-0.905 2-0.826 7 2.807 0 1.090 0 1.745 0 1.038 8-1.889 7-1.091 4 1.922 2-0.697 9-0.807 4 2.818 6 1.073 7-1.070 2-1.004 7-0.683 4
为了更清楚的看出两种样品中代谢物的差异,对64种关键差异代谢物进行聚类热图分析,结果如图8所示。与LBSTPM样品相比,LBST-1253-PM样品中有21种关键差异代谢物上调,43种关键差异代谢物下调。其中,吡哆醛、胆甾醇、GABA、麦角甾苷和柠檬酸5种物质与富含甾醇调制乳密切相关,可作为特征代谢产物。
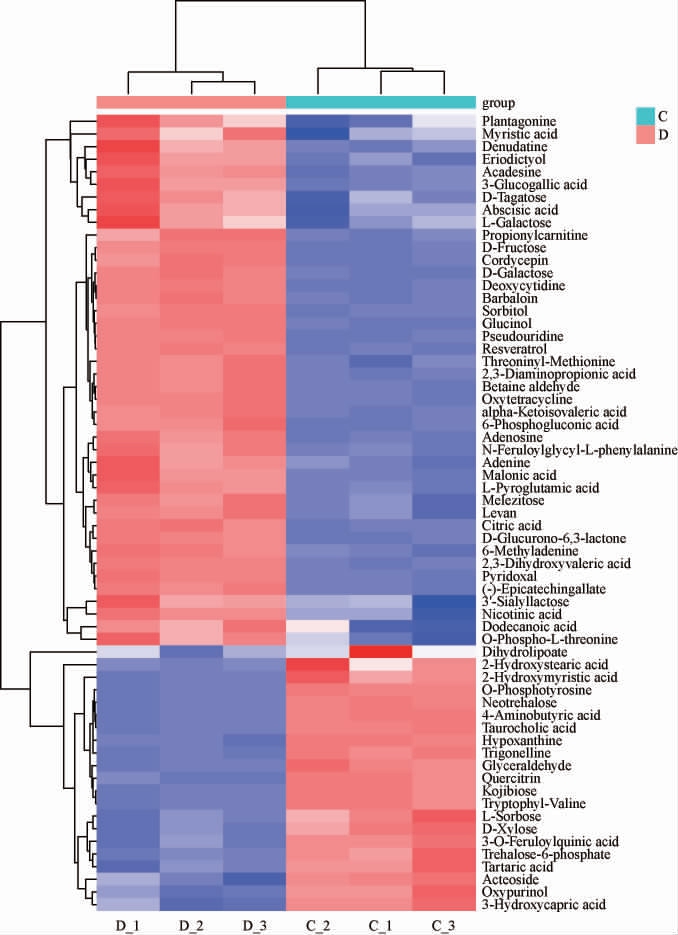
图8 关键差异代谢物聚类分析热图
Fig.8 Heat map of clustering analysis of key differential metabolites
有研究表明,游离氨基酸的种类和数量与营养品质密切相关。在LBST-1253-PM样品中GABA、L-磷酸酪氨酸相对含量较高。它们不仅对LBST-1253-PM样品的滋味具有较大贡献,作为挥发性化合物的前体物质,从而提升LBST-1253-PM样品风味。GABA是哺乳动物中枢神经系统中重要的抑制性神经递质,具有改善抑郁、睡眠,降血压、降血糖,提高免疫力等多种生理功能[27]。莫小叶等[28]研究发现,富含GABA酸奶通过增加小鼠脑内抑制性递质GABA及甘氨酸含量发挥促进小鼠睡眠的作用。因此,LBST-1253-PM样品中GABA含量增多,更有助于改善睡眠问题。然而,L-磷酸酪氨酸是L-酪氨酸的一种衍生物,能促进儿茶酚胺和黑色素的生物合成,对人和动物的生长发育新陈代谢起重要的作用[29]。
LBST-PM样品与LBST-1253-PM样品相比,共有12种糖类及其衍生物的相对含量差异显著(P<0.05),主要是甘油醛、葡萄糖醇、海藻糖、果聚糖、松三糖、D-半乳糖、D-木糖、曲二糖、3'-唾液乳糖、D-塔格糖、D-果糖、L-半乳糖、山梨醇等,其中6-磷酸葡萄糖酸、甘油醛、葡萄糖醇、D-半乳糖、D-木糖、曲二糖含量增加极显著(P<0.01)。甘油醛是有机物合成的中间体,常用于生化研究或作为营养剂使用。由于人体摄入葡萄糖醇后,对血糖浓度上升有轻微的影响,常被推荐为糖尿病人代替普通糖类摄入的一种糖类[29]。
LBST-PM样品和LBST-1253-PM样品中的芳香类化合物及其衍生物,包括白藜芦醇、圣草酚、槲皮苷、表儿茶素没食子酸酯、芦荟苷,其中槲皮苷在两组样品中的含量显著增加,槲皮甙具有较好的有抗炎、抗肿瘤、抗氧化、降血脂、神经保护等生物活性[30]。白藜芦醇是一种天然多酚类化合物,在心血管系统疾病、神经系统疾病等方面有积极治疗作用[31]。白藜芦醇还可通过抑制谷氨酸的兴奋作用和增强γ-氨基丁酸(GABA)的抑制作用,实现镇静作用[32]。圣草酚广泛存在于蔬菜、水果及中药中,具有抗氧化、抗炎及神经保护等多种药理活性[33]。
此外,核苷酸是生物大分子核酸的基本结构单位。LBST-1253-PM样品中的羟基嘌呤和次黄嘌呤含量高于对照组。吡哆醛是维生素B6的成分之一,是氨基酸转氨基的关键辅酶[34]。烟酸也是两组样品中差异显著的维生素,主要生理功能为抗“3D”症[35]。综上所述,LBST-1253-PM和LBSTPM样品中都含有功能性氨基酸、二肽、糖类、有机酸以及维生素等小分子代谢物,对改善产品的滋味具有积极作用。
2.5.3 差异代谢物通路富集分析
根据京都基因与基因组百科全书(KEGG)中的Pathway数据库,检索到差异代谢物参与的15条代谢通路为:牛磺酸和次牛磺酸的代谢,嘌呤代谢,抗坏血酸和醛酸代谢,维生素B6代谢,戊糖和葡萄糖醛酸的相互转化,磷酸戊糖途径,乙氧基化物和二甲酸酯代谢,果糖和甘露糖代谢,柠檬酸循环,淀粉和蔗糖代谢,半乳糖代谢,甘氨酸、丝氨酸和苏氨酸代谢,氨基酸糖和核苷酸糖代谢,嘧啶代谢,初级胆汁酸生物合成。由图9可知,富含甾醇调制乳富集了维生素B6代谢、磷酸戊糖途径、乙氧基化物和二甲酸酯代谢、果糖和甘露糖代谢、柠檬酸循环5条代谢途径。综上,富含甾醇调制乳的显著差异代谢物主要与氨基酸代谢、柠檬酸循环和糖代谢有关。
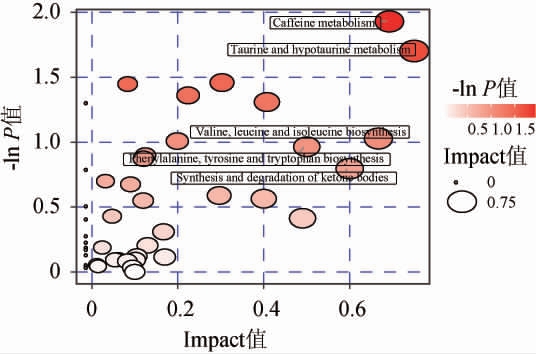
图9 关键差异代谢物代谢通路
Fig.9 Metabolic pathways of key differential metabolites
3 结论
该研究以脱脂奶粉及核桃油为主要原料,以高产甾醇热带假丝酵母(Candida tropicalis)1253、保加利亚乳杆菌(Lactobacillus bulgaricus)及嗜热链球菌(Streptococcus thermophilus)为发酵菌种制备甾醇冻干粉,并在此基础上研制富含甾醇调制乳。以甾醇产量为评价指标,通过单因素试验和响应面试验菌株1253发酵工艺,对富含甾醇调制乳品质和营养进行综合性评价,并分析其关键差异代谢物及代谢通路。结果表明,最佳发酵工艺为培养时间97 h,培养温度30 ℃,菌种接种量9.5%,底物核桃油添加量4%。在此优化条件下,甾醇产量为0.903 mg/g。调制乳色泽均匀,无沉淀、分层现象,流动性良好,口感香甜适宜、细腻顺滑、风味良好,香味协调,感官评分为(86.44±2.06)分。理化指标和微生物指标均符合相关国家标准。吡哆醛、胆甾醇、GABA、麦角甾苷和柠檬酸5种物质是富含甾醇调制乳的特征代谢物,主要富集了维生素B6代谢、磷酸戊糖途径、乙氧基化物和二甲酸酯代谢、果糖和甘露糖代谢和柠檬酸循环等途径改善调制乳的品质和风味。本研究为富含甾醇的个性化营养食品的开发奠定了基础。
[1]丁爽.亚健康人群失眠的研究进展[J].世界睡眠医学杂志,2019,6(10):1480-1482.
[2]ZHAO J,LIAO X,ZHAO H,et al.Evaluation on effectiveness and safety of Chinese herbs in treatment of sub-health:A systematic review and metaanalysis of randomized controlled trials[J].Chin J Integr Med,2019,25(6):471-480.
[3]龙盼,胡晓霞,胡琦兰,等.天麻素对氯苯丙氨酸(PCPA)致失眠小鼠的镇静催眠作用研究[J].中药药理与临床,2021,37(5):33-38.
[4]LIU W L,WU B F,SHANG J H,et al.Moringa oleifera lam seed oil augments pentobarbital-induced sleeping behaviors in mice via gabaergic systems[J].J Agr Food Chem,2020,68(10):3149-3162.
[5]UM M Y,KIM S,JIN Y H,et al.A novel neurological function of rice bran:a standardized rice bran supplement promotes non-rapid eye movement sleep in mice through histamine H1 receptors[J]. Mol Nutr Food Res,2017,61(11):1700316.
[6]吴芳彤,肖贵平.莲子的营养保健价值及其开发应用[J].亚热带农业研究,2012,8(4):274-278.
[7]王呈馨.翅果油提取工艺及其抗氧化能力的研究[D].无锡:江南大学,2019.
[8]周丽莹.厚朴种子油的超临界CO2萃取及抗氧化活性研究[D].哈尔滨:东北农业大学,2019.
[9]康荷笛.杜香精油酶辅助-水蒸气蒸馏提取工艺及体外活性评价[D].哈尔滨:东北林业大学,2022.
[10]王子朝.微生物发酵法辅助提取植物甾醇的初步研究[D].石家庄:河北科技大学,2019.
[11]赵丽华.微生物发酵脱臭馏出物生产甾醇的研究[D].石家庄:河北科技大学,2018.
[12]赵国群,刘红彦,刘金龙.高甾醇含量热带假丝酵母细胞的培养条件研究[J].中国酿造,2017,36(2):49-53.
[13]刘红彦.脂肪酸为碳源微生物甾醇发酵工艺及其高产机理初步研究[D].石家庄:河北科技大学,2017.
[14]BACCHETTI T, MASCIANGELO S, BICCHIEGA V, et al.Phytosterols,phytostanols and their esters:from natural to functional foods[J].Med J Nutr Met,2011,4(3):165-172.
[15]NZEKOUE F K, ALESI A, VITTORI S, et al.Development of a functional whey cheese(ricotta) enriched in phytosterols: Evaluation of the suitability of whey cheese matrix and processing for phytosterols supplementation[J].LWT-Food Sci Technol,2020,139:110479.
[16]朱亿竹,张也,李景明.葡萄甾醇功能咖啡调制乳研究[J].中国酿造,2012,31(9):175-179.
[17]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 25191—2010 食品安全国家标准调制乳[S].北京:中国标准出版社,2010.
[18]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 5009.6—2016 食品安全国家标准食品中脂肪的测定[S].北京:中国标准出版社,2016.
[19]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 5009.5—2016 食品安全国家标准食品中蛋白质的测定[S].北京:中国标准出版社,2016.
[20]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 4789.2—2022 食品安全国家标准食品微生物学检验菌落总数测定[S].北京:中国标准出版社,2022.
[21]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 4789.3—2016 食品安全国家标准食品微生物学检验大肠菌群计数[S].北京:中国标准出版社,2016.
[22]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 4789.10—2016 食品安全国家标准食品微生物学检验金黄色葡萄球菌检验[S].北京:中国标准出版社,2016.
[23]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 4789.4—2024 食品安全国家标准食品微生物学检验沙门氏菌检验[S].北京:中国标准出版社,2024.
[24]MOREAU R A,WHITAKER B D,HICKS K B.Phytosterols,phytostanols,and their conjugates in foods:Structural diversity,quantitative analysis,and health-promoting uses[J].Prog Lipid Res,2002,41(6):457-500.
[25]LUBES G,GOODARZI M.Analysis of volatile compounds by advanced analytical techniques and multivariate chemometrics[J]. Chem Rev,2017,117(9):6399-6422.
[26]HUANG B M, ZHA Q L, CHEN T B, et al.Discovery of markers for discriminating the age of cultivated ginseng by using UHPLC-QTOF/MS coupled with OPLS-DA[J].Phytomedicine,2018,45(1):8-17.
[27]刘鸷驹,张东星,晏仁义,等. γ-氨基丁酸的生物活性研究进展[J].现代药物与临床,2022,37(9):2167-72.
[28]莫小叶,骆鹏飞,俞兰秀,等.富含γ-氨基丁酸酸奶对小鼠睡眠的促进作用[J].现代食品科技,2020,36(11):29-35,129.
[29]陈丹丹,邹嘉佳,杜传荣,等.L-酪氨酸衍生物的合成及其与人血清白蛋白的相互作用[J].化学通报,2016,79(7):623.
[30]徐勇亮,徐军伟.灵芝不同菌株胞外多糖的单糖组成和抗氧化活性分析[J].菌物学报,2022,41(5):792-801.
[31]陈燕,詹羽姣,李晨阳,等.异槲皮苷的生物活性研究进展[J].中国现代中药,2018,20(12):1579-1582,1592.
[32]郭野,陈美霓,李家萱.白藜芦醇的临床应用研究进展[J].新乡医学院学报,2023,40(3):290-294.
[33]LI Z,YOU Z Y,LI M,et al.Protective effect of resveratrol on the brain in a rat model of epilepsy[J].Neurosci Bull,2017,33(3):273-280.
[34]SUJOL G, DOCQUIER A, BOULAHTOUF A, et al.Vitamin B6 and cancer: from clinical data to molecularly mechanisms[J]. B Cancer,2011,98(10):1201-1208.
[35]赵姝.花生中烟酸的提取及功能特性的研究[D].长春:吉林农业大学,2018.