纤维素是构成植物细胞壁的重要成分[1]。在单胃动物饲粮中补充木质纤维素能改善饲料营养物质消化率,促进胃肠道发育,使动物机体健康生长[2]。秸秆纤维素是农作物秸秆的主要成分[3]。秸秆饲料化可利用纤维素酶制剂将难以利用的纤维素大分子分解为小分子多糖,并通过菌体生物量的增长提高饲料的蛋白含量[4]。秸秆类饲料可有效弥补畜牧业饲料的短缺,纤维素类作为添加剂用于畜禽饲料中有着良好运用前景,支持草食畜牧业的可持续发展[5]。添加纤维素酶可提高动物机体对饲粮纤维的消化利用率,饲粮纤维已经成为当下部分家禽饲料和猪饲料中重要的组成部分,在单胃动物饲粮中添加纤维素酶可降解纤维素生成寡糖、D-葡萄糖和纤维二糖,从而提高动物的生产性能,改善动物肠道健康,同时极大程度提高饲粮纤维利用率[6]。木质纤维素在不占用日粮营养空间的条件下给动物提供优质日粮纤维,作为一种新型饲料原料现在被越来越多的应用于动物营养中[2]。
纤维素酶系主要有葡聚糖内切酶、葡聚糖外切酶、β-葡萄糖苷酶三类:葡聚糖外切酶沿着纤维素两端由外向里有序水解β-1,4-糖苷键,释放葡萄糖或纤维二糖;葡聚糖内切酶分解纤维素分子内部的非结晶区,纤维素分子内的β-1,4-糖苷键被随机水解,产生短的纤维素链;β-葡萄糖苷酶将可溶性纤维寡糖及纤维二糖水解释放可发酵的葡萄糖分子,一定程度消除纤维寡糖和纤维二糖对葡聚糖外切酶和葡聚糖内切酶的反馈抑制作用[7-8]。纤维素酶的添加可提高肉鸡蛋白质利用率、能量利用率和饲料表观消化率代谢能值,加入纤维素酶可提高肉鸡的质量增加和饲料利用率[9-10]。黄芩茎叶经鸡源产β-葡萄糖苷酶菌群发酵后能够提高黄羽肉鸡表观消化率并增强机体免疫功能,可有效改善鸡的生长性能、提高饲料利用率,对鸡肉质和营养成分的提升具有明显促进作用[11]。
在饲料中添加纤维素酶可提高饲料利用率和消化率、改善饲料营养价值以促进动物生长等[12]。添加纤维素酶可以提高甘蔗梢和玉米秆混合青贮的品质,提升营养品质和饲用价值[13]。添加布氏乳杆菌(Lactobacillus buchneri)和纤维素酶均能改善葡萄渣发酵全混合日粮营养成分、感官品质和发酵品质,能提高其有氧稳定性[14]。纤维素结构复杂,不易降解,导致其利用率极低,因此筛选出高产纤维素酶的降解菌对提升畜牧产业的发展具有现实意义[15]。
本研究从原始森林腐木下的土壤取样,筛选高产β-葡萄糖苷酶菌株,利用蔗渣固体发酵产β-葡萄糖苷酶,对其酶学性质进行研究,旨在为β-葡萄糖苷酶进一步的开发应用提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
土样采自凭祥市的中国林科院热带林业实验中心;蔗渣:宜州博庆制糖有限责任公司。
1.1.2 试剂
NaCl、(NH4)2SO4、KH2PO4、MgSO4·7H2O(均为分析纯):上海化学试剂有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(分析纯):上海如吉生物科技发展有限公司;三氯化铁、氯化钠、苯酚、柠檬酸(均为分析纯):汕头市西陇化工厂有限公司;酒石酸钾钠(分析纯):国药集团化学试剂有限公司;七叶苷、水杨苷(均为分析纯):上海晶纯试剂有限公司;葡萄糖(分析纯):广州化学试剂厂;蛋白胨、琼脂(均为生化试剂):北京陆桥技术有限责任公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基[16]:马铃薯200 g,葡萄糖22 g,琼脂18 g,蒸馏水1 000 mL,121 ℃灭菌20 min。
筛选培养基[17]:0.1 g七叶苷,0.03 g三氯化铁,琼脂1.8 g,蒸馏水100 mL,121 ℃灭菌20 min。
牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨5 g,NaCl 5 g,琼脂18 g,蒸馏水1 000 mL,121 ℃灭菌20 min。
固体发酵复筛培养基[18-19]:6 g蔗渣,4 g麸皮,加入30 mL Mandels盐液,121 ℃灭菌20 min,冷却备用。
1.2 仪器与设备
xMark酶标仪:美国Bio-Rad公司;WFZUV-2082型紫外分光光度计:尤尼柯(上海)仪器有限公司;BX51显微镜:日本Olympus Corporation公司;BCD-216SDX海尔冰箱:青岛海尔股份有限公司;TDL-5-A型大容量低速台式离心机:上海安亭科学仪器厂;SW-CJ-IF型紫外线超净工作台:苏净集苏州安泰空气技术有限公司;JA2003B电子分析天平:上海越平科学仪器有限公司;PXY-DHS-400BS型隔水式电热恒温培养箱:上海跃进医疗器械有限公司。
1.3 实验方法
1.3.1 土样采集
确定合适的采样地点,除去地面植被和枯枝落叶,去除表层5 cm土壤,取5~25 cm的土壤,将土样装入无菌袋中,在袋上注明采集地点、日期、土样号。
1.3.2 β-葡萄糖苷酶产生菌的分离纯化
磨碎1 g土样,再加入9 mL无菌水,20 min振荡分散菌块,按10倍梯度稀释法,制成10-1~10-6的土壤稀释液。各取100 μL稀释度为10-1~10-6土壤稀释液均匀涂布于筛选培养基上,30 ℃恒温培养[20],待长出菌落后,挑取培养基背面变黑的菌株进一步划线,重复实验3~4次获得单菌落,根据单菌落的表面形态初步判断是真菌、细菌,挑取真菌转接至PDA培养基斜面,挑取细菌至牛肉膏蛋白胨培养基斜面,30 ℃培养箱培养。
1.3.3 高产β-葡萄糖苷酶菌的筛选
初筛:利用七叶苷被葡萄糖苷酶水解后产生黑色物质的原理,取纯化后的菌株接种于筛选培养基,37 ℃培养24 h,观察培养基上菌落周围的颜色变化。挑选在培养基生长产生黑色圈的菌株,判断其产β-葡萄糖苷酶。
复筛:用10 mL生理盐水洗下本实验筛选获得菌株的斜面菌种制成孢子液,取1 mL孢子(107个)转入固体发酵培养基,30 ℃培养4 d;加入无菌水50 mL,30 ℃恒温摇床1 h提酶,4层纱布过滤杂质,4 000 r/min离心10 min,粗酶液为上清液,4 ℃保存备用,测定粗酶液的β-葡萄糖苷酶酶活[21],筛选高产β-葡萄糖苷酶菌株。
1.3.4 高产β-葡萄糖苷酶菌株的鉴定
形态学观察:菌株30 ℃培养于牛肉膏蛋白胨培养基平板,观察菌落形态,用光学显微镜观察革兰氏染色后菌种的形态结构。
分子生物学鉴定:利用Biospin 细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒提取筛选菌株的基因组DNA,采用2%琼脂糖凝胶电泳检测提取结果。利用通用引物扩增16S rDNA基因片段,上游引物为27F(5'-AGAGTTTGATCCTGGCTAG-3'),下游引物1492R(5'-GGTTACCTTGTTACGACT-3')[22]。PCR扩增体系(40 μL):2×Phanta Max Master Mix 20 μL,27F 1 μL,1492R 1 μL,模板DNA 1 μL,双蒸水(ddH2O)17 μL。PCR扩增条件:95 ℃预变性3 min;95 ℃变性15 s,56 ℃退火15 s,72 ℃延伸30 s,共35个循环;72 ℃延伸5 min。用2%的琼脂糖凝胶电泳检测PCR结果。将回收的PCR扩增产物,在广州擎科生物技术有限公司进行双向测序。测序结果通过进入美国国家生物技术信息中心(national center for biotechnology information,NCBI)进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对,下载相似度及同源性高的序列,利用MEGA11.0软件中的邻接法(neighbor-joining,NJ)构建系统进化树[18-19]。
1.3.5 β-葡萄糖苷酶酶活测定
采用0.02 mol/L柠檬酸-柠檬酸钠缓冲液(pH4.8)配制1%水杨苷溶液为底物,0.05 mL适当浓度的酶液和1 mL 1%水杨苷溶液底物混匀,37 ℃条件下反应30 min,添加3 mL 3,5'-二硝基水杨酸(DNS)试剂终止反应,沸水浴6 min然后20 ℃冷水浴30 min。采用紫外分光光度计在波长540 nm条件下测吸光度值,按照葡萄糖标准曲线回归方程计算酶活。β-葡萄糖苷酶酶活定义:1 mL粗酶液每分钟产生1 μmol葡萄糖的酶量为1个酶活单位(U/mL)[23]。
相对酶活定义:在该实验项目下,某一个条件下得到的最高酶活设为100%,相对酶活为其他条件下的酶活性与最高酶活性的比值。
1.3.6 β-葡萄糖苷酶酶学性质研究[24]
最适反应温度的测定:以温度40 ℃为基础,以5 ℃的梯度逐步增加至75 ℃,在各个梯度温度下按常规3,5-二硝基水杨酸比色法测定β-葡萄糖苷酶的酶活力,并计算相对酶活,确定β-葡萄糖苷酶最适反应温度。
温度稳定性的研究:将酶液置于上述各温度下各保温1 h,在最适温度和pH 4.8条件下测定其残余酶活力,并计算相对酶活,探究温度对酶稳定性的影响。
最适反应pH的测定:为了确定酶的最佳pH,配制50 mmol/L的磷酸氢二钠-柠檬酸缓冲液(pH 3.0~7.0)和Tris-HCl缓冲液(pH 7.5~8.0),在最适温度和不同pH值条件下测定酶活,并计算相对酶活,确定β-葡萄糖苷酶的最适反应pH。
pH稳定性的研究:将酶液置于上述各pH的缓冲液中,4 ℃下储存24 h,在最适温度下保温3 h,在最适温度和最适pH条件下测定酶活,并计算相对酶活,探究pH对酶稳定性的影响。
金属离子对β-葡萄糖苷酶活性的影响:粗酶液中添加浓度为1 mmol/L的金属离子Ca2+、Zn2+、Mg2+、Co2+、Cu2+、Fe2+,同时在最适温度下保温1 h后,在最适温度和最适pH值下测β-葡萄糖苷酶酶活力,以未加金属离子测得的酶活为100%,计算相对酶活,比较不同金属离子对酶活的影响。
1.3.7 数据分析
所有实验重复3次,采用Excel 2016计算平均值并制图。
2 结果与分析
2.1 β-葡萄糖苷酶产生菌的初筛
本实验筛选得到13株在筛选培养基生长产生黑色圈的产β-葡萄糖苷酶菌株,对这13株菌进行复筛,测定其酶活力。
2.2 高产β-葡萄糖苷酶菌株复筛
产β-葡萄糖苷酶菌株酶活力测定结果见表1。由表1可知,菌株PX14A的β-葡萄糖苷酶酶活最高,为4.92 U/mL,其次为菌株PX9A,酶活为4.62 U/mL。由于菌株PX14A的β-葡萄糖苷酶酶活最高,且明显高于其他菌株,因此后续主要对菌株PX14A进行研究。
表1 产β-葡萄糖苷酶菌株酶活力测定结果
Table 1 Determination results of enzyme activities of β-glucosidase produced by strains
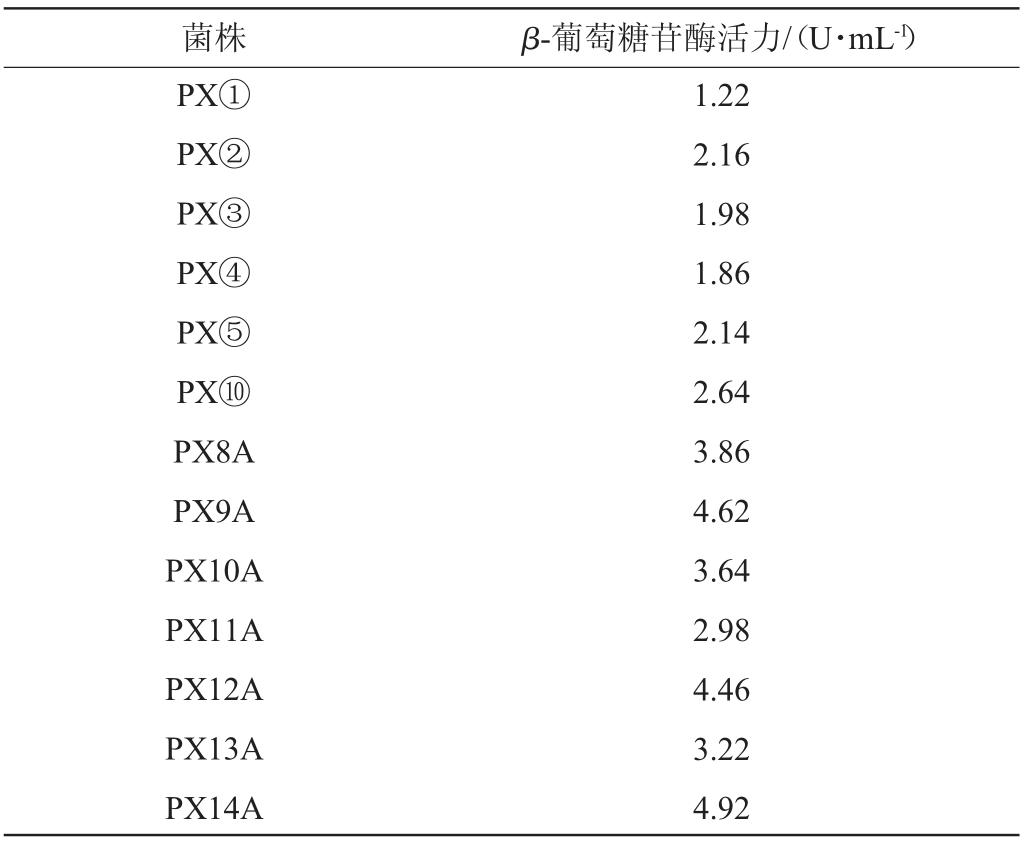
菌株 β-葡萄糖苷酶活力/(U·mL-1)PX①PX②PX③PX④PX⑤PX⑩PX8A PX9A PX10A PX11A PX12A PX13A PX14A 1.22 2.16 1.98 1.86 2.14 2.64 3.86 4.62 3.64 2.98 4.46 3.22 4.92
2.3 菌株PX14A的鉴定
2.3.1 形态学观察
菌株PX14A的菌落和菌丝形态观察结果见图1。由图1可知,菌株PX14A的菌落呈白色或带黄的白色、不透明,表面干燥、光滑,中间隆起,边缘不整齐,老化后菌落边缘呈放射状,易挑取,革兰氏呈阳性,有芽孢,芽孢呈椭圆形,菌体细胞呈杆状,常成链,初步鉴定菌株PX14A为芽孢杆菌属(Bacillus)[25-26]。
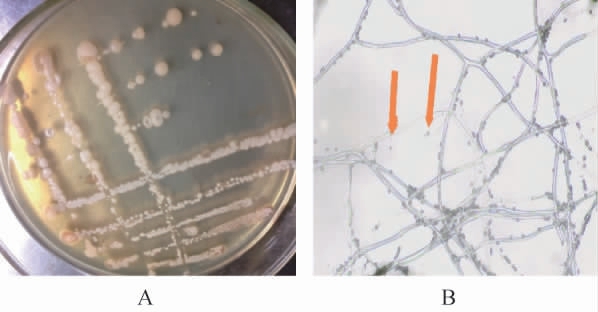
图1 菌株PX14A的菌落(A)和菌丝(B)形态
Fig.1 Colony (A) and mycelial (B) morphology of strain PX14A
2.3.2 分子生物学鉴定
将测序结果通过NCBI进行BLAST比对,下载相似度及同源性高的序列利用MEGA11软件构建系统进化树[18-19],结果见图2。由图2可知,菌株PX14A的16S rDNA序列与枯草芽孢杆菌(Bacillus subtilis)strain PRO134最相近,相似度为99%,因此鉴定其为枯草芽孢杆菌(Bacillus subtilis)。
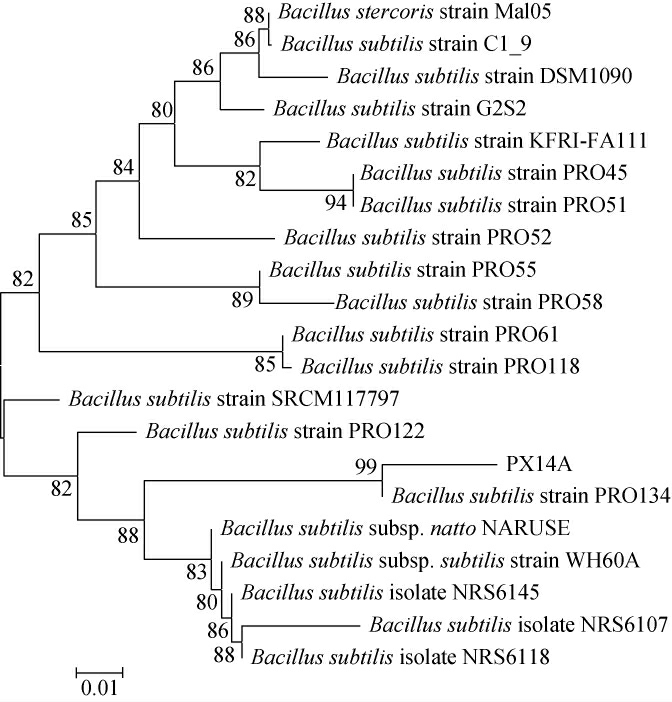
图2 菌株PX14A基于16SrDNA基因序列的系统发育树
Fig.2 Phylogenetic tree of strain PX14A based on 16S rDNA gene sequences
2.4 β-葡萄糖苷酶的酶学性质研究
2.4.1 β-葡萄糖苷酶的最适反应温度和温度稳定性
β-葡萄糖苷酶的最适反应温度和热稳定性测定结果见图3。
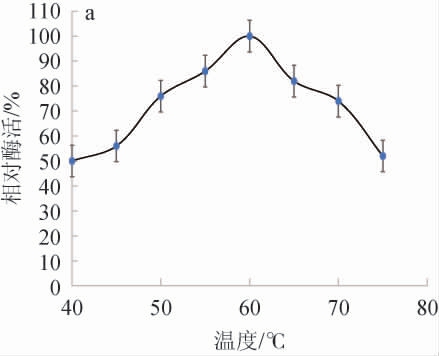
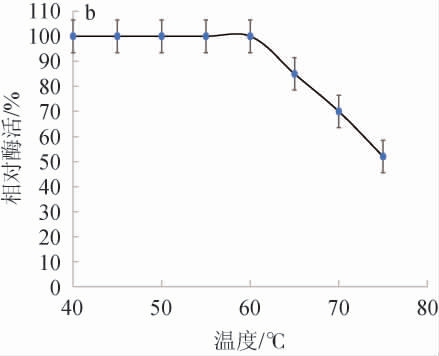
图3 菌株PX14A所产β-葡萄糖苷酶的最适温度(a)及热稳定性(b)
Fig.3 Optimal reaction temperature (a) and thermal stability (b) of β-glucosidase produced by strain PX14A
由图3a可知,菌株PX14A的β-葡萄糖苷酶温度低于60 ℃时酶活力随温度的升高而增大,但温度高于60 ℃时,随温度的升高酶活力反而降低,反应温度到达70 ℃时,酶活力仅为最佳酶活力的70%,因此,确定酶的最适反应温度是60 ℃。由图3b可知,温度稳定性测定结果显示温度在40~65 ℃范围内酶活稳定,温度超过65 ℃,酶活将会下降。
2.4.2 β-葡萄糖苷酶的最适反应pH和pH稳定性
β-葡萄糖苷酶的最适反应pH和pH稳定性测定结果见图4。
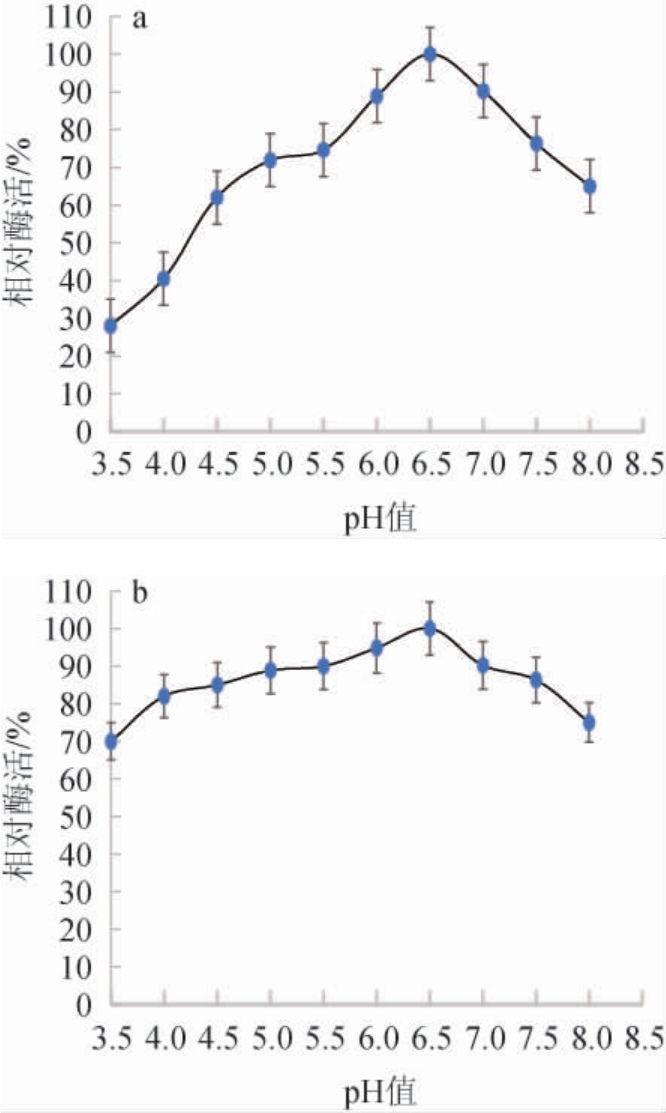
图4 菌株PX14A产β-葡萄糖苷酶的最适反应pH(a)及pH稳定性(b)
Fig.4 Optimal reaction pH (a) and pH stability (b) of β-glucosidase produced by strain PX14A
由图4a可知,相对酶活随着pH的升高先升高后降低,在pH 3.5~6.5时,相对酶活逐渐升高,当pH为6.5时,β-葡萄糖苷酶酶活达到最高,pH在6.5~8.0时相对酶活逐渐降低,因此,确定最适反应pH为6.5;由图4b可知,pH稳定性测定结果显示β-葡萄糖苷酶活力在pH4.0~7.5稳定性较好,相对酶活均>80%。
2.4.3 金属离子对酶活的影响
将浓度为1 mmol/L的不同金属离子加入反应体系中,同时在最适温度下保温1 h后,在酶的最适温度和最适pH值下测β-葡萄糖苷酶酶活力,未加金属离子测得的酶活为100%,结果见表2。由表2可知,Mg2+和Fe2+对酶活性有激活作用,而Co2+、Cu2+对酶活性有一定的抑制作用,Ca2+、Zn2+则对酶活性影响不明显。
表2 金属离子对β-葡萄糖苷酶活性的影响
Table 2 Effect of metal ions on β-glucosidase activities

金属离子 相对酶活力/%空白对照Ca2+Zn2+Co2+Mg2+Cu2+Fe2+100 92 96 63 155 76 143
3 结论
本实验从原始森林腐木下的土壤取样,筛选得到一株高产β-葡萄糖苷酶酶活的菌株PX14A,其β-葡萄糖苷酶活力为4.9 U/mL,通过形态特征和分子生物学鉴定其为枯草芽孢杆菌(Bacillus subtilis)。菌株PX14A粗酶液的β-葡萄糖苷酶最适反应温度为60 ℃,在65 ℃以下温度稳定性较好,最适反应pH值为6.5,在pH值4.0~7.5范围内较稳定,相对酶活均>80%,浓度为1 mmol/L的Mg2+和Fe2+对酶活性有较好的激活作用。
[1]ZANGIABADI M,ZHAO Y.Synergistic hydrolysis of cellulose by a blend of cellulase-mimicking polymeric nanoparticle catalysts[J]. J Am Chem Soc,2023,37:17110-17119.
[2]谈婷,陈祥兴,陈珍珍,等.木质纤维素的作用及其在单胃动物上的应用[J].饲料工业,2020(19):46-50.
[3]SONG H,JIA H,WANG Q,et al.A new environmentally-friendly system for extracting cellulose from corn straw: The low temperature laccase system[J].Materials,2020,13(2):437.
[4]任亚琼,张巧娥,陶然,等.菌酶协同发酵秸秆类饲料的研究进展[J].饲料研究,2022,45(12):134-138.
[5]梁运祥,胡宝娥,陈宏声,等.利用生物技术,加快秸秆“高值饲料化”转化,促进草食畜牧业发展[J].饲料工业,2022,43(12):1-9.
[6]邓圣庭,陈清华,马杰,等.饲粮纤维的消化特性及纤维素酶在单胃动物中的应用[J].饲料研究,2019(6):100-104.
[7]SARANGTHEM I,RAJKUMARI L,NGASHANGVA N,et al.Isolation and characterization of bacteria from natural hot spring and insights into the thermophilic cellulase production[J].Curr Microbiol,2023,80:64.
[8]JUNGHARE M,MANAVALAN T,FREDRIKSEN L,et al.Biochemical and structural characterisation of a family GH5 cellulase from endosymbiont of shipworm P.megotara[J]. Biotechnol Biofuels Bioprod, 2023,16:61.
[9]王秋凡,赵国先,李茜,等.玉米-小麦-豆粕型饲粮中添加纤维素复合酶对蛋鸡生产性能、蛋品质、养分表观代谢率和肠道食糜黏度的影响[J].动物营养学报,2023,35(11):1-11.
[10]韩占兵,吕兴东,杨朋坤,等.日粮添加枸杞渣对蛋鸡生产性能与蛋品质的影响[J].中国家禽,2020,42(1):53-56.
[11]胡会玲,武怡荷,陈书明,等.鸡源产β-葡萄糖苷酶混合菌群发酵黄芩茎叶的制备及其对肉鸡消化和免疫功能的影响[J].黑龙江畜牧兽医,2021(12):107-113.
[12]吴永杰,丁浩,邵涛,等.酶制剂对水稻秸秆青贮发酵品质及体外消化特性的影响[J].草业学报,2022,31(8):167-177.
[13]邓宗澳,邓芳松,蒋金娟,等.纤维素酶对甘蔗梢与玉米秆混合青贮品质的影响[J].草学,2023(2):40-46.
[14]高巧仙,朱万清,李晓梅,等.添加纤维素酶和布氏乳杆菌对葡萄渣全混合日粮发酵品质及有氧稳定性的影响[J].中国饲料,2022(13):28-33.
[15]LI F,XIE Y,GAO X,et al.Screening of cellulose degradation bacteria from Min pigs and optimization of its cellulase production[J].Electr J Biotechnol,2020,48:29-35.
[16]沈萍,陈向东.微生物学实验[M].北京:高等教育出版社,2007:241-244.
[17]KWON K,LEE J,KANG H G,et al.Detection of β-glucosidase activity in polyacrylamide gels with esculin as substrate[J]. Appl Environ Microbiol,1994,12:4584-4586.
[18]QIN Y L,HE H Y,LI N,et al.Isolation of a thermostable cellulase-producing Fusarium chlamydosporum and characterization of the cellulolytic enzymes[J].World J Microb Biot,2010,26(11):1991-1997.
[19]HE H Y,QIN Y L,CHEN G G, et al.Two-step purification of a novel β-glucosidase with high transglycosylation activity and another hypothetical β-glucosidase in Aspergillus oryzae HML366 and enzymatic characterization[J].Appl Biochem Biotechnol,2013,169(3):870-884.
[20]KWON K,LEE J,KANG H G,et al.Detection of β-glucosidase activity in polyacrylamide gels with esculin as substrate[J]. Appl Environ Microbiol,1994,12:4584-4586.
[21]QIN Y L,QIN B S,ZHANG J,et al.Purification and enzymatic properties of a new thermostable endoglucanase from Aspergillus oryzae HML366[J].Int Microbiol,2023,26:579-589.
[22]SHOEMAKER S P, BROWN R D.Characterization of endo-1,4-beta-D-glucanases purified from Trichoderma virid[J].Biochim Biophys Acta,1978,523:147-161.
[24]何海燕,黄琦琦,黄智娴,等.芽枝霉菌Lcxs9产两种耐热β-葡萄糖苷酶的快速纯化及酶学特性研究[J].中国酿造,2022,41(7):76-81.
[25]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:43-64.
[26]布坎南R E,吉本斯N E.伯杰细菌鉴定手册(第八版)[M].北京:科学出版社,1984:729-796.