华容芥菜作为地方特色品种,以传统腌制和接种发酵结合方式腌制,形成了具有独特的风味、酥脆的质地、美味的口感及开胃、促食欲等特点,深受消费者喜爱[1-2]。然而,芥菜传统发酵过程中会产生亚硝酸盐导致潜在的安全性问题[3]。亚硝酸盐摄入人体后在胃酸环境下可与蛋白质反应生成N-亚硝胺,其具有较强的基因毒性,可极大地增加胃癌、肝癌、食肠癌等疾病患病风险[4-5]。
目前,控制亚硝酸盐的方法主要有物理降解法[6]、化学降解法[7]、生物降解法[8]等,其中微生物降解法因高效、安全而备受关注。乳酸菌作为发酵食品中一种重要的益生菌,其具有安全、可食用等特点被广泛应用于食品加工领域[9-12],许多研究表明乳酸菌具有降解亚硝酸盐的性能[13-18]。郭志华等[14]从红茶菌中筛选出3株降解亚硝酸盐的乳酸菌,经鉴定为植物乳植杆菌(Lactiplantibacillus plantarum)和干酪乳杆菌(Lactobacillus casei),这两株菌株发酵至27 h,亚硝酸盐降解率均>93%;胡此海等[19]从萝卜泡菜母水中筛选出5株降解亚硝酸盐的优良乳酸菌,经鉴定为植物乳植杆菌(Lactiplantibacillus plantarun)、布氏乳杆菌(Lactobacillus buchneri)、短乳杆菌(Lactobacillus brevis)、鼠李糖乳酪杆菌(Lacticaseibacillus rhamnosus)和乳酸片球菌(Pediococcus acidilactici),其降解亚硝酸盐的能力均>90%;郦萍等[20]从发酵制品中筛选出1株降解亚硝酸盐能力较强的植物乳植杆菌ZJ316,将其应用于榨菜汁中发现对亚硝酸盐的降解率达95.23%。因此,筛选出降解亚硝酸盐能力优良的乳酸菌菌株,对于开发低亚硝酸盐发酵蔬菜制品,提高产品质量和安全性具有重要意义。
本研究采用传统培养分离法从自然发酵芥菜中分离纯化乳酸菌,从中筛选产酸且降解亚硝酸盐性能的优良乳酸菌,并对其进行形态观察及分子生物学鉴定,研究其生长特性、耐亚硝酸盐、耐酸和耐胆盐性能及抑菌能力,评估其发酵特性,挖掘具有高发酵性能和潜在益生特性的优质菌株,以期为开发传统发酵蔬菜的优质菌剂提供理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
发酵芥菜样品:分别取自华容腌制池(KKSD)、发酵坛(KKSX)和实验室发酵坛(SYS)。
金黄色葡萄球菌(Staphylococcus aureus)ATCC29213、大肠杆菌(Escherichiacoli)ATCC43888、沙门氏菌(Salmonella)ATCC19945:北京中科质检生物技术有限公司。
1.1.2 试剂
胃蛋白酶(3 000~3 500 U/mg)、盐酸、对氨基苯磺酸、盐酸萘乙二胺、亚铁氰化钾、硼酸、乙酸锌、氢氧化钠、氯化钠、酚酞、猪胆盐(均为分析纯):国药集团化学试剂有限公司;革兰氏染色试剂盒:北京索莱宝科技有限公司;引物(27F和1492R):北京擎科生物科技有限公司;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技有限公司。其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
MRS液体培养基、MRS固体培养基、LB液(固)体培养基:海博生物科技有限公司。
1.2 仪器与设备
FB223分析天平:上海舜宇恒平科学仪器有限公司;TGL-16M高速台式冷冻离心机:湖南湘仪实验室仪器开发有限公司;DH-36电热恒温培养:北京中兴伟业仪器有限公司;UV-2600紫外可见分光光度计:尤尼柯(上海)仪器有限公司;SW-CJ-1D超净工作台:苏州净化设备有限公司;621BR27884梯度聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:美国BIO-RAD公司;FE28 pH计:梅特勒-托利多仪器有限公司。
1.3 试验方法
1.3.1 乳酸菌菌株的分离与纯化
参考胡此海等[19]的方法略作修改,取1 mL芥菜发酵液,按10倍梯度稀释至10-5,取0.1 mL稀释液涂布于添加2%CaCO3的MRS固体培养基上,37 ℃倒置培养48 h。挑取具有明显透明溶钙圈的乳白色单菌落进行分离纯化,将分离纯化得到的菌株进行革兰氏染色和过氧化氢酶实验,选取革兰氏阳性与过氧化氢酶阴性菌株为疑似乳酸菌菌株,采用20%甘油进行冻存。
1.3.2 优良乳酸菌菌株的筛选
(1)降解亚硝酸盐能力的测定
参考郦萍等[20]的方法略作修改,将分离纯化的菌株接种于MRS液体培养基,37 ℃条件下活化2次,以3%(V/V)的接种量接种于5 mL己灭菌的含有200 μg/mL NaNO2的MRS液体培养基中,37 ℃培养24 h。取发酵液,4 ℃条件下5 000 r/min离心10 min,吸取1 mL上清液,在波长538 nm处测定吸光度值,以未接种的培养基为对照,根据标准曲线回归方程(y=0.016 3x-0.001 9)计算亚硝酸盐含量,并计算亚硝酸盐降解率,其计算公式见式(1)。
式中:X表示亚硝酸盐降解率,%;N1表示接入菌株的培养基中亚硝酸盐的含量,μg/mL;N2表示未接菌株的培养基中亚硝酸盐的含量,μg/mL。
(2)产酸能力分析
将活化的菌株按3%(V/V)的接种量接种于MRS液体培养基中,37 ℃培养24 h,采用pH计测定发酵液的pH,参照国标GB 12456—2021《食品安全国家标准食品中总酸的测定》第一法酸碱指示剂滴定法测定总酸含量。
1.3.3 筛选乳酸菌菌株的鉴定
形态学观察:参照《常见细菌系统鉴定手册》[21]对菌落的生长状况及形态特征进行初步判定。
分子生物学鉴定:采用细菌基因组DNA提取试剂盒提取筛选菌株的基因组DNA,以其为模板,使用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')聚合酶链式反应(PCR)扩增16S rDNA基因序列[22-23]。PCR扩增产物经1%琼脂糖凝胶电泳检测合格后委托北京擎科生物科技有限公司进行测序。利用软件ContigExpress v3.0.0对测序结果进行拼接,将测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对检索,并采用MEGA 7.0软件中的邻接法(neighbor-joining,NJ)构建系统发育树。
1.3.4 生长曲线及产酸速率测定
采用无菌生理盐水调节活化菌液浓度为1.0×108CFU/mL,按3%(V/V)的接种量接种于MRS液体培养基中,37 ℃培养36 h,每2 h取2 mL菌液在波长600 nm处测定吸光度值(OD600nm值)及pH值,绘制生长曲线及产酸曲线。
1.3.5 耐受性分析
亚硝酸盐耐受性分析:参考郭志华等[14]的方法略作修改,将活化好的菌液浓度调整为1.0×108CFU/mL,以3%(V/V)的接种量接种于NaNO2质量浓度分别为0、50mg/L、100mg/L、150 mg/L、200 mg/L、300 mg/L、400 mg/L的MRS液体培养基中,37 ℃培养24 h,取发酵0 h和24 h的发酵液,在波长600 nm处测定吸光度值[14]。以不添加NaNO2的培养基作为对照。
胃液耐受性分析:将活化好的菌液按3%(V/V)的接种量接种于MRS液体培养基中,37 ℃培养24 h后,离心(4 ℃,6 000 r/min,5 min),收集菌体。采用无菌生理盐水将菌液浓度调整为1.0×108 CFU/mL,取1 mL菌悬液分别与9 mL pH为1.5、2.5和3.5的无菌人工胃液混匀,37 ℃培养3 h,采用平板计数法测定活菌数[24],并计算耐酸存活率,其计算公式见式(2)。
式中:N1表示培养0 h的活菌数,CFU/mL;N2表示培养3 h的活菌数,CFU/mL。
胆盐耐受性分析:将活化好的菌液按3%(V/V)的接种量分别接入含有0.1%、0.2%、0.3%无菌猪胆盐的MRS液体培养基中,37 ℃培养4 h,采用平板计数法测定活菌数[25],计算耐胆盐存活率,其计算公式见式(3)。
式中:N0代表培养0 h的活菌数,CFU/mL;N1表示培养4 h的活菌数,CFU/mL。
1.3.6 抑菌性能的测定
将大肠杆菌、沙门氏菌、金黄色葡萄球菌分别接种于LB液体培养基中,37 ℃、170 r/min条件下培养24 h,无菌生理盐水调整菌体浓度为1.0×106 CFU/mL。将筛选菌株按3%(V/V)的接种量接种于MRS液体培养基,37 ℃条件下培养24 h,无菌生理盐水调整菌液浓度为1.0×108 CFU/mL后,离心(4 ℃,6 000 r/min,5 min),收集上清液。采用牛津杯扩散法测定抑菌能力[26]:取200 μL指示菌液均匀涂布于LB固体培养基平板表面,向孔洞中加入150 μL发酵上清液,以等体积的生理盐水为对照,37 ℃倒置培养48 h,采用游标卡尺测量抑菌圈直径大小。
1.3.7 数据分析与处理
每个实验重复3次,采用SPSS 26.0对实验数据进行统计分析,结果以“平均值±标准差”表示;采用邓肯法进行差异显著性分析;采用Origin 2021和MEGA 7.0绘制图表。
2 结果与分析
2.1 乳酸菌的分离与纯化
采用传统培养分离技术从发酵芥菜中共分离得到28株革兰氏阳性、过氧化氢酶阴性,表面光滑且颜色为乳白或淡黄色的疑似乳酸菌,分别标记为KKSX-1~KKSX-12、KKSD-1~KKSD-7、SYS-1~SYS-9。
2.2 优良乳酸菌的筛选
28株疑似乳酸菌菌株的亚硝酸盐降解率及发酵液的pH和总酸含量见表1。
表1 28株疑似乳酸菌菌株的产酸及亚硝酸盐降解能力测定结果
Table 1 Determination results of acid production and nitrite degradation ability of 28 suspected lactic acid bacteria strains

菌株编号 pH值 总酸含量/(g·100 mL-1)亚硝酸盐降解率/%菌株编号 pH值 总酸含量/(g·100 mL-1)亚硝酸盐降解率/%KKSX-1 KKSX-2 KKSX-3 KKSX-4 KKSX-5 KKSX-6 KKSX-7 KKSX-8 KKSX-9 KKSX-10 KKSX-11 KKSX-12 KKSD-1 KKSD-2 4.19±0.02 3.99±0.01 3.97±0.00 3.88±0.02 4.04±0.02 3.86±0.01 3.83±0.03 4.08±0.01 3.87±0.01 3.88±0.01 3.85±0.01 4.00±0.02 4.23±0.01 4.30±0.01 10.88±0.28 12.60±0.18 13.13±0.11 16.43±0.18 11.48±0.18 16.88±0.18 17.48±0.28 11.33±0.21 16.50±0.38 16.35±0.11 17.10±0.18 12.00±0.11 10.35±0.18 9.30±0.11 81.58±0.43 85.71±0.04 86.21±0.13 86.28±0.12 85.07±0.61 67.29±0.69 90.44±0.10 89.63±0.08 91.00±0.14 89.54±0.28 90.34±0.29 90.13±0.05 89.43±0.17 89.71±0.14 88.53±0.24 88.77±0.32 90.14±0.16 89.09±0.10 88.48±0.16 86.90±0.24 90.32±0.12 88.65±0.19 90.29±0.03 79.65±0.16 89.83±0.12 82.44±0.47 79.72±0.54 76.23±0.26 KKSDX-3 KKSD-4 KKSD-5 KKSD-6 KKSD-7 SYS-1 SYS-2 SYS-3 SYS-4 SYS-5 SYS-6 SYS-7 SYS-8 SYS-9 4.36±0.01 4.31±0.02 4.25±0.01 4.20±0.01 4.33±0.01 3.92±0.03 3.80±0.02 3.82±0.02 3.87±0.01 3.90±0.01 3.89±0.01 3.83±0.03 4.13±0.02 3.95±0.03 8.55±0.18 9.53±0.11 10.58±0.18 10.80±0.18 9.08±0.11 13.73±0.18 18.68±0.18 17.70±0.11 16.50±0.28 14.03±0.28 16.20±0.18 17.25±0.21 10.95±0.42 13.88±0.11
由表1可知,28株疑似乳酸菌对亚硝酸盐均具有一定的降解能力,降解率在(67.29±0.69)%~(91.00±0.14)%范围内,4株菌株的亚硝酸盐降解率<80%,7株菌株的亚硝酸盐降解率>90%,其中菌株SYS-4以及SYS-2对亚硝酸盐的降解能力最好,降解率分别高达(91.00±0.14)%和(90.44±0.10)%,此外,这2株菌株在培养24 h后,发酵液的pH值均<4,总酸含量较高,分别达到(18.68±0.18)g/100 mL、(16.50±0.28)g/100 mL。因此,确定菌株SYS-4、SYS-2为产酸及降解亚硝酸盐性能优良的菌株。
2.3 筛选乳酸菌菌株的鉴定
2.3.1 形态学观察
菌株SYS-2和SYS-4的菌落及细胞形态见图1。由图1可知,菌株SYS-2和SYS-4的菌落均呈乳白色凸起,表面光滑且细密,细胞均呈杆状。

图1 菌株SYS-2和SYS-4的菌落(A、B)及细胞(a、b)形态
Fig.1 Morphology of colony (A, B) and cell (a, b) of strains SYS-2 and SYS-4
2.3.2 分子生物学鉴定
基于16S rRNA基因序列构建菌株SYS-2和SYS-4的系统发育树,结果见图2。

图2 基于16S rRNA基因序列菌株SYS-2及SYS-4的系统发育树
Fig.2 Phylogenetic tree of strains SYS-2 and SYS-4 based on 16S rRNA gene sequences
由图2可知,2株菌株均与植物乳植杆菌(Lactiplantibacillus plantarum)聚于一支,亲缘关系最高,同源性>99%。结合形态学特征,菌株SYS-2和SYS-4均被鉴定为植物乳植杆菌(Lactiplantibacillus plantarum)。
2.4 优良乳酸菌发酵特性研究
2.4.1 生长曲线及产酸性能测定
植物乳植杆菌SYS-2及SYS-4的生长曲线及产酸曲线见图3。由图3a可知,2株植物乳植杆菌的生长曲线皆呈典型的“S”型,具有明显的菌株生长延滞期、对数生长期和稳定期。在培养4 h时,菌株SYS-2和SYS-4均进入对数生长期,此时细菌生长旺盛;菌株SYS-2在培养18 h进入稳定期,菌株SYS-4在培养20 h进入稳定期。在芥菜发酵过程中,以乳酸菌为主导的核心菌群会产生乳酸、乙酸等有机酸,丰富产品风味的同时,降低环境中pH,抑制杂菌的生长[27]。由图3b可知,2株植物乳植杆菌的产酸能力相近,随着培养时间的延长,发酵液的pH呈先下降后趋于稳定的趋势,当培养2~18 h时,活菌数大量增加,有机酸累积,pH值大幅度降低,其中培养6 h时,菌株产酸速率最快。菌株SYS-2和SYS-4分别在培养22 h和26 h时,达到pH最低值(3.76),此后趋于稳定。
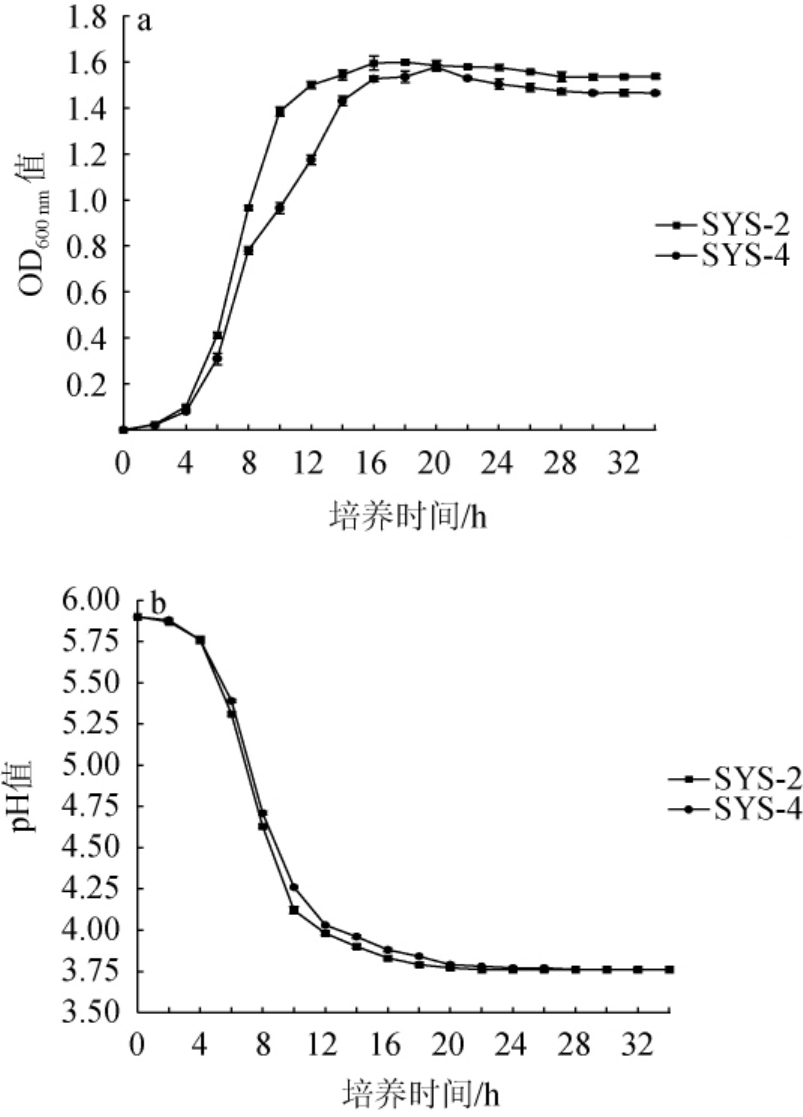
图3 植物乳植杆菌SYS-2和SYS-4的生长曲线(a)及产酸曲线(b)
Fig.3 Growth curves (a) and acid production curves (b) of Lactiplantibacillus plantarum SYS-2 and SYS-4
2.4.2 亚硝酸盐耐受性分析
芥菜发酵初期常伴随亚硝酸盐水平升高的问题,因此,接种的乳酸菌必须对亚硝酸盐有一定的耐受性[28]。植物乳植杆菌SYS-2及SYS-4对亚硝酸盐的耐受性见图4。由图4可知,菌株SYS-2和SYS-4在含有200 μg/mL NaNO2的培养基中培养24 h时,菌株生长繁殖受影响较小;随着NaNO2质量浓度的增加,菌株生长受到明显抑制;当NaNO2质量浓度达到600 μg/mL时,菌株SYS-2及SYS-4的OD600 nm值分别为0.377±0.014、0.489±0.017。由此得出,菌株SYS-2和SYS-4对NaNO2≤200 μg/mL具有较强耐受能力,对高质量浓度NaNO2(300~600 μg/mL)具有一定耐受能力,且菌株SYS-4的耐受性高于菌株SYS-2。

图4 植物乳植杆菌SYS-2及SYS-4对亚硝酸盐的耐受性
Fig.4 Tolerance of Lactiplantibacillus plantarum SYS-2 and SYS-4 to nitrite
不同字母表示同一菌株在不同条件下的OD600 nm值差异显著(P<0.05)。下同。
2.4.3 耐酸性分析
胃部条件的存活是最重要的益生菌属性之一,高胃酸环境与胃蛋白酶可使细胞表层蛋白变性,导致乳酸菌失活,而pH 3.0是益生菌在体内保持活力的最低限度[29]。植物乳植杆菌SYS-2及SYS-4在模拟胃液环境中的存活率见图5。
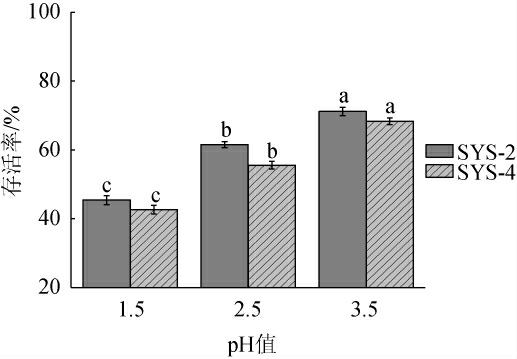
图5 植物乳植杆菌SYS-2及SYS-4对人工胃液的耐受性
Fig.5 Tolerance of Lactiplantibacillus plantarum SYS-2 and SYS-4 to artificial gastric juices
由图5可知,2株菌株在模拟胃液环境中都可生长,在pH为1.5条件下培养3 h后,菌株SYS-2和SYS-4的存活率分别为(45.42±1.32)%、(42.66±1.31)%,均>40%;在pH为2.5的条件下培养3 h后,菌株SYS-2和SYS-4的存活率分别为(61.53±0.35)%、(55.55±1.11)%,均>50%;在pH为3.5的条件下培养3 h后,菌株SYS-2和SYS-4的存活率分别为(71.15±1.21)%、(68.31±0.09)%,均>60%;说明2株菌株在人工胃液酸性环境中都表现出较好的耐酸性。
2.4.4 胆盐耐受性分析
益生菌在体内除了面临胃部的酸性环境挑战外,还需具备耐受肠道中胆盐所形成的高渗透环境的能力,从而在保持活性的同时顺利通过胃肠道特殊环境到达益生部位发挥作用[12]。植物乳植杆菌SYS-2及SYS-4的耐胆盐能力见图6。由图6可知,菌株SYS-2和SYS-4在不同浓度的胆盐溶液中均有耐受性,但活菌数随胆盐含量的增加而降低,在0.1%的胆盐溶液中生长良好,培养3 h后的存活率分别为(77.87±3.07)%、(82.29±2.60)%;在0.3%的胆盐溶液中培养3h后,存活率仍>50%。人体小肠内胆盐含量通常在0.03%~0.3%[30],由此来看,2株菌在不同浓度胆盐环境中的存活率虽存在一定差异,但都表现出较强的胆盐耐受性。

图6 植物乳植杆菌SYS-2及SYS-4对胆盐的耐受性
Fig.6 Tolerance of Lactiplantibacillus plantarum SYS-2 and SYS-4 to bile salt
2.4.5 抑菌能力研究
有研究表明,植物乳植杆菌产生的有机酸(乙酸和乳酸等)以及植物乳杆菌素均有一定的抑菌活性[31],选用金黄色葡萄球菌、大肠杆菌和沙门氏菌作为指示菌,采用牛津杯扩散法对植物乳植杆菌SYS-2及SYS-4的抑菌性能进行测定,结果见表2。
表2 植物乳植杆菌SYS-2和SYS-4对常见致病菌的抑菌圈直径
Table 2 Inhibition circle diameters of Lactiplantibacillus plantarum SYS-2 and SYS-4 to common pathogen
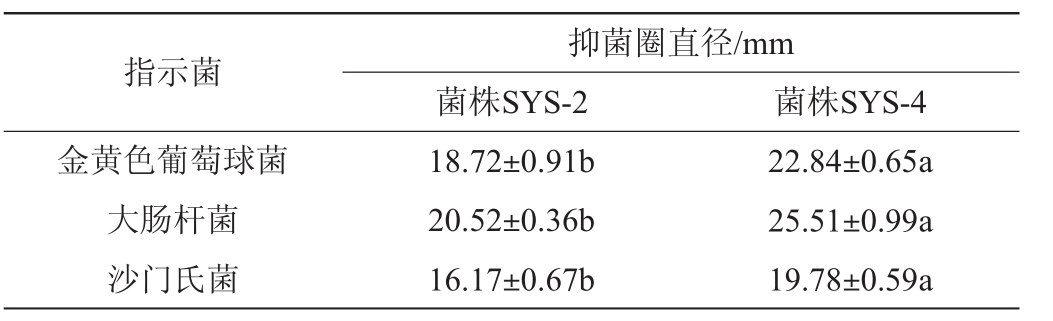
注:同行小写字母不同表示差异显著(P<0.05)。
指示菌金黄色葡萄球菌大肠杆菌沙门氏菌抑菌圈直径/mm菌株SYS-2 菌株SYS-4 18.72±0.91b 20.52±0.36b 16.17±0.67b 22.84±0.65a 25.51±0.99a 19.78±0.59a
由表2可知,菌株SYS-2和SYS-4的发酵液对金黄色葡萄球菌[(18.72±0.91)mm、(22.84±0.65)mm]、大肠杆菌[(20.52±0.36)mm、(25.51±0.99)mm]和沙门氏菌[(16.17±0.67)mm、(19.78±0.59)mm]均能产生抑菌圈,说明这2株菌对3种常见致病菌均具有一定的抑制能力。其中,菌株SYS-4对3种指示菌的抑菌圈直径均显著大于菌株SYS-2(P<0.05),说明菌株SYS-4对致病菌的抑菌能力更强。
3 结论
本研究从发酵芥菜中共分离出28株疑似乳酸菌,经亚硝酸盐降解能力及产酸能力分析,筛选出2株产酸及降亚硝酸盐性能优良的乳酸菌,编号分别为SYS-2、SYS-4。通过形态学观察及分子生物学技术鉴定菌株SYS-2和SYS-4均为植物乳植杆菌(Lactiplantibacillus plantarum)。2株乳酸菌菌株培养24 h后,亚硝酸盐降解率均>90%,pH值均降至4.00以下,总酸含量分别达18.68 g/100 mL、16.50 g/100 mL;对NaNO2(≤200 μg/mL)具有较强耐受能力,在模拟人工胃液(pH 2.5)和0.3%胆盐溶液消化3 h后存活率均>50%;2株乳酸菌对致病菌均有一定的抑制效果,其中,菌株SYS-4的抑菌效果较好,对金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli)、沙门氏菌(Salmonella)的抑菌圈直径分别为22.84 mm、25.51 mm、19.78 mm。植物乳植杆菌SYS-2和SYS-4具有较强降解亚硝酸盐的能力以及良好的发酵特性,可为发酵芥菜优质益生菌种的选择提供参考,为后续生产低亚硝酸盐发酵芥菜提供安全优质菌剂。
[1]唐蓉,陈骏飞,杨海泉,等.乳酸菌与酵母菌联合发酵对芥菜理化性质及保藏期品质的影响[J].食品工业科技,2024,45(10):141-148.
[2]赵杰,唐琴丽.发酵蔬菜研究进展[J].食品工业,2023,44(8):225-230.
[3]王蕾,田方,孙志栋,等.芥菜传统腌制发酵工艺优化研究进展[J].食品与发酵工业,2022,48(1):324-329.
[4]范智义,邓维琴,李雄波,等.四川泡菜发酵早期亚硝酸盐生成转化途径的初探[J/OL].食品与发酵工业,1-9[2024-06-26].https://doi.org/10.13995/j.cnki.11-1802/ts.037606.
[5]隋雨萌,王家旺,马子涵,等.东北自然发酵酸菜细菌多样性及其与生物胺的关系研究[J].食品科学技术学报,2024,42(2):131-141.
[6]王康泓,王勇.温度及细菌对芹菜中亚硝酸盐含量的影响[J].食品安全质量检测学报,2019,10(5):1284-1289.
[7]皮佳婷,刘冬敏,王建辉,等.乳酸菌降解泡菜中亚硝酸盐的机制及应用研究现状[J].食品与发酵工业,2021,47(24):301-307.
[8]曹佳璐.传统四川泡菜盐水乳酸菌多样性的研究[D].北京:中国农业大学,2017.
[9]黎蓓蓓,冯书珍,李德军,等.果菜类蔬菜混合发酵菌种筛选及其发酵特性研究[J/OL].食品与发酵工业,1-12[2024-06-26].https://doi.org/10.13995/j.cnki.11-1802/ts.038385.
[10]吕欣然,佟鑫瑶,顾娜泥,等.酱腌菜中酵母菌对高产AI-2信号分子乳酸菌发酵特性的影响[J].中国食品学报,2024,24(3):65-74.
[11]王涛.山羊原奶中可培养乳酸菌多样性及菌株的体外益生特性分析[J/OL].食品工业科技,1-12[2024-06-26].https://doi.org/10.13386/j.issn1002-0306.2023110244.
[12]张志红,陈志健,王舒瑜,等.乳酸菌发酵对荞麦壳多酚组成及胃肠消化、酵解特性的影响[J].中国食品学报,2024,24(4):54-68.
[13]陈曦,周彤,许随根,等.贵州酸肉中具有高亚硝酸盐降解和耐受能力乳酸菌的筛选与鉴定[J].中国食品学报,2018,18(2):256-264.
[14]郭志华,王聪,陈红玲.红茶菌中降解亚硝酸盐乳酸菌的筛选、鉴定及其功能特性[J].中国食品学报,2021,21(8):309-316.
[15]曾令州,周青青,顾青,等.益生乳酸菌筛选及其对草石蚕汁发酵特性的影响[J].中国食品学报,2021,21(5):212-220.
[16]SHEN X W, XIE S S, ZHANG H X, et al.Effects of Persimmon(Diospyros kaki L.cv.Mopan)polysaccharide and their carboxymethylated derivatives on lactobacillus strains proliferation and gut microbiota:A comparative study[J].Int J Mol Sci,2023,24(21):15730.
[17]RIBEIRO M,MACIEL C,CRUZ P,et al.Exploiting potential probiotic lactic acid bacteria isolated from Chlorella vulgaris photobioreactors as promising vitamin B12 producers[J].Foods,2023,12(17):3277.
[18]YANG X Z,HU W Z,XIU Z L,et al.Microbial dynamics and volatilome profiles during the fermentation of Chinese northeast sauerkraut by Leuconostoc mesenteroides ORC 2 and Lactobacillus plantarum HBUAS 51041 under different salt concentrations[J].Food Res Int,2020,130:108926.
[19]胡此海,杨絮,郭全友,等.萝卜泡菜母水中乳酸菌分离鉴定与发酵特性比较[J].食品与发酵工业,2023,49(23):111-119.
[20]郦萍,陈晓镇,周青青,等.降亚硝酸盐乳酸菌筛选及榨菜汁发酵性能评价[J].中国食品学报,2020,20(8):140-146.
[21]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:153-158.
[22]李雪菲,潘琼,罗慧婷,等.传统发酵酸肉中微生物的分离鉴定及其益生潜力评价[J/OL].食品科学,1-14[2024-06-26].http://kns.cnki.net/kcms/detail/11.2206.TS.20240308.1133.026.html.
[23]SKOTNICZNY M,SATORA P.Molecular detection and identification of plant-associated Lactiplantibacillus plantarum[J].Int J Mol Sci,2023,24(5):4853.
[24]李宏洋,张通化,罗丽蓉,等.泡椒汁中耐受辣椒素乳酸菌的筛选及其耐受性研究[J].食品与发酵工业,2024,50(4):110-117.
[25]经玉洁,黄小倩,田璐毅,等.多轮次筛选选育高酚酸耐受性丁醇生产菌[J].农业工程学报,2023,39(7):236-243.
[26]杨智源,金日天,梁铎,等.源自蜡样芽孢杆菌抗菌肽DB16的筛选及其对金黄色葡萄球菌的抑菌机制[J].食品科学,2024,45(10):126-134.
[27]赵山山,杨园园,周玉岩,等.贵州泡菜中乳酸菌的分离鉴定及其在泡菜发酵中的应用[J].中国酿造,2020,39(12):113-119.
[28]熊蝶,袁岚玉,李媛媛,等.陕西泡菜中降解亚硝酸盐乳酸菌的筛选及其发酵特性与耐受性研究[J].食品与发酵工业,2021,47(6):139-144.
[29]熊涛,宋苏华,黄锦卿,等.植物乳杆菌NCU116在模拟人体消化环境中的耐受力[J].食品科学,2011,32(11):114-117.
[30]史梅莓,伍亚龙,杨恺,等.四川泡菜中潜在益生性植物乳杆菌的筛选及安全性评价[J].食品工业科技,2022,43(22):165-172.
[31]王璐,蒋沙沙,李德海,等.乳酸菌对果蔬产品的抑菌机理及应用[J].中国食品学报,2024,24(2):432-441.