L-乳酸作为一种食品酸味剂[1-2],被广泛应用于调味品、果汁、酸奶、乳制品等食品中。然而,作为同分异构体的D-乳酸却会导致人体中毒,造成代谢性酸血症、肠道屏障受损等危害[3]。因此,需要尽可能避免L-乳酸中D-乳酸的存在,即保证L-乳酸的高光学纯度。
采用微生物法发酵产L-乳酸的过程中,主要通过两个方面保证L-乳酸的高光学纯度。一方面,对于不具有D-乳酸合成途径的菌株,如米根霉(Rhizopus oryzae)等,主要通过减少琥珀酸等其他副产物的产生,从而提高L-乳酸的纯度[4];另一方面,对于具有D-乳酸合成途径的菌株,如鼠李糖乳杆菌(Lactobacillus rhamnosus)等,在减少其他副产物产生的同时,还需遏制D-乳酸的生成,从而保证L-乳酸的高光学纯度[5-6]。以上两个方面主要针对菌株在发酵过程中不产生内源性副产物来保证L-乳酸的高光学纯度,但如何解决外源性D-乳酸(往往由发酵原料带入)的存在而导致L-乳酸光学纯度降低的问题却鲜有研究报道。在工业化发酵生产时,为降低成本,通常选用玉米浆、葡萄糖结晶废糖液等廉价发酵原料,由于其加工过程和保存条件较为粗放,会含有D-乳酸,进而影响发酵终产物L-乳酸的光学纯度。
厌氧诱导型启动子,如丙酮酸甲酸裂解酶基因的启动子pflBp6[7-8]、亚硝酸盐还原酶(还原型烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH))大亚基基因的启动子pnirB[9-10]等,能够通过对厌氧环境的内源性响应进行调控,实现对基因的转录与翻译进行控制,这种调控机制不需要添加额外的诱导剂,进而减少发酵步骤,降低发酵成本。因此,本研究通过构建带有不同厌氧诱导启动子(pflBp6、pnirB、pflBp6-pnirB)的D-乳酸脱氢酶基因(dld)的表达质粒,并分别转化至产L-乳酸的大肠杆菌(Escherichia coli)HBUT-L中,加强其在L-乳酸发酵过程中消除外源D-乳酸的能力。通过装液量与转速的单因素试验筛选最优的厌氧诱导启动子及其表达条件,并在无机盐培养基与玉米浆培养基中进行发酵验证。在微生物发酵产L-乳酸时,通过该方法可保证发酵产物L-乳酸的质量与纯度,进而扩大产物应用范围,对L-乳酸相关产业的发展具有积极的推动作用。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株、质粒与引物
产L-乳酸工程菌大肠杆菌(Escherichia coli)HBUT-L[11](E.coli W,△frdBC,△adhE,△pflB,△ldhA::ldhL)、菌株HBUT-L2(E.coli W,△frdBC,△adhE,△pflB,△ldhA::ldhL,pUC19-pflBp6-dld)、菌株HBUT-L3(E.coli W,△frdBC,△adhE,△pflB,△ldhA::ldhL,pUC19-pnirB-dld)、菌株HBUT-L4(E.coli W,△frdBC,△adhE,△pflB,△ldhA::ldhL,pUC19-pflBp6-pnirB-dld)。E.coli DH5α、质粒pUC19:宝日医生物技术(北京)有限公司。本研究所用引物见表1。
表1 本研究所用引物
Table 1 Primers used in this study
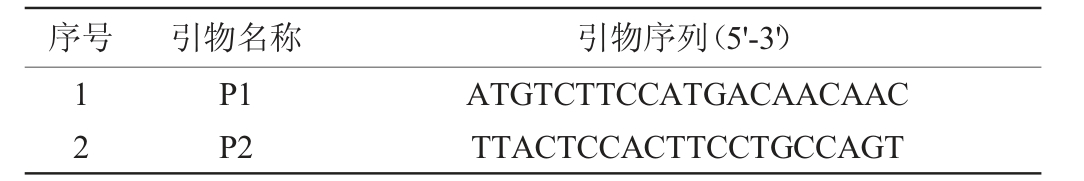
序号 引物名称 引物序列(5'-3')12 P1 P2 ATGTCTTCCATGACAACAAC TTACTCCACTTCCTGCCAGT
续表

序号 引物名称 引物序列(5'-3')3 4 5 6 7 8 9 1 0 11 12 13 14 15 16 17 18 19 P3 P4 P5 P6 P7 P8 P9 P10 P11 P12 P13 P14 P15 P16 P17 P18 P19 GGCCCGTAACTCGCATGGTTCAGTCACGACGTTGTAAAAC ACTGGCAGGAAGTGGAGTAACTCCTTACGCATCTGTGCGG AACCATGCGAGTTACGGGCC GTTGTTGTCATGGAAGACATACTAACTCTCTCTTTATTAAGTCGG CCTTAATGGGTATATTGCTGCAGTCACGACGTTGTAAAAC ACTGGCAGGAAGTGGAGTAATTTTCTCCTTACGCATCTGT CAGCAATATACCCATTAAGG GTTGTTGTCATGGAAGACATTTTTGCCTCGATTTCTTTTC CCTTAATGGGTATATTGCTGCAGTCACGACGTTGTAAAAC GGCCCGTAACTCGCATGGTTTTTTGCCTCGATTTCTTTTC GGCCCGTAACTCGCATGGTTTTTTGCCTCGATTTCTTTTC AAGCCAGGCGAGATATGATC GTAAAAACGCTTTGCTGCCT TTACATCAATAAGCGGGGTT ACACGATGATCCAATCACTG CAATAAGCGGGGTTGCTGAA TACTGCAAAGACCGCCAGCT
1.1.2 主要试剂
氨苄青霉素钠(分析纯)、磷酸缓冲盐溶液(phosphate buffered saline,PBS)、黄素腺嘌呤二核苷酸二钠盐(flavin adenine dinucleotide disodium salt hydrate,FAD-2Na)(纯度95%)、四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)(纯度≥97%):上海麦克林生化科技股份有限公司;Primer STAR脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶、T5核酸外切酶:宝日医生物技术(北京)有限公司;葡萄糖结晶废糖液:山东潍坊盛泰药业有限公司;玉米浆干粉(蛋白质含量≥40.0%):上海阿拉丁生化科技股份有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
LB固体培养基[12]:10 g/L蛋白胨、10 g/L酵母粉、5 g/L氯化钠、15 g/L琼脂粉。LB液体培养基中不添加琼脂粉。
氨青苄霉素抗性筛选平板:LB固体培养基中加入50 mg/L氨苄青霉素。
改良M9培养基[13]:3.5 g/L KH2PO4,5 g/L K2HPO4,3.5 g/L(NH4)2HPO4,0.25 g/L MgSO4·7H2O,15 mg/L CaCl2·2H2O,2 g/L酵母粉。
无机盐培养基:改良M9培养基中添加20 g/L葡萄糖、1 g/L D-乳酸钠。
玉米浆培养基[14]:玉米浆和葡萄糖结晶废糖液的混合液,使得培养基中玉米浆含量为10g/L,葡萄糖含量为80g/L。
以上培养基均在121 ℃下高压蒸汽灭菌20 min。
1.2 仪器与设备
My Cycler聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Bio-Rad公司;Agilent 1200series反相高效液相色谱(high performance liquid chromatography,HPLC)仪:美国安捷伦科技公司;UV/VIS-2802PC紫外可见分光光度计:尤尼柯(上海)仪器有限公司。
1.3 方法
1.3.1 重组质粒的构建
以Escherichia coli HBUT-L的基因组DNA为模板,以P1和P2为引物进行PCR扩增,获得dld基因片段;以质粒pUC19为模板,以P3和P4为引物进行PCR扩增,获得线性化的pUC19质粒片段;以EscherichiacoliDH5α的基因组DNA为模板,以P5和P6为引物进行PCR扩增,获得pflBp6基因片段。将dld基因片段、线性化的pUC19质粒片段、pflBp6片段分别进行琼脂糖凝胶回收纯化。
在冰上,将纯化后的dld基因片段、线性化的pUC19质粒片段、pflBp6片段按摩尔比为3∶1∶3的比例混匀,加入1 U的T5核酸外切酶后,静置5 min[15]。将处理后的混合片段通过CaCl2法转化至Escherichia coli DH5α中[16]。经过含有氨苄青霉素(50 mg/L)的LB固体平板筛选后获得重组质粒pUC19-pflBp6-dld。
同理,通过引物P7和P8、P1和P2、P9和P10分别扩增pnirB基因片段、dld基因片段、线性化的pUC19质粒片段,分别纯化后构建重组质粒pUC19-pnirB-dld。通过引物P7和P8、P1和P2、P9和P13、P5和P6分别扩增pnirB基因片段、dld基因片段、线性化的pUC19质粒片段、pflBp6片段,分别纯化后构建重组质粒pUC19-pflBp6-pnirB-dld。
1.3.2 重组质粒的转化
通过CaCl2法将三种重组质粒分别转化至工程菌株Escherichia coli HBUT-L中,得到工程菌株Escherichia coli HBUT-L2(pUC19-pflBp6-dld)、Escherichia coli HBUT-L3(pUC19-pnirB-dld)、EscherichiacoliHBUT-L4(pUC19-pflBp6-pnirB-dld)。
1.3.3 重组质粒表达条件的探究
将工程菌株Escherichia coli HBUT-L、Escherichia coli HBUT-L2、Escherichia coli HBUT-L3、Escherichia coli HBUTL4接种至50 mL含50 mg/L氨苄青霉素的LB液体培养基中,在37 ℃、200 r/min条件下过夜培养,即为种子液。
装液量的优化:将4种工程菌株按1%(V/V)的接种量分别接种至装液量为50 mL/250 mL、125 mL/250 mL、200 mL/250 mL的LB液体培养基中,在37 ℃、200 r/min条件下发酵,每隔6 h测定菌株的OD600 nm值与D-乳酸脱氢酶酶活[17-18]。
转速的优化:将4种工程菌株按1%(V/V)的接种量接种至装液量为200 mL/250 mL的LB液体培养基中,分别在转速为100 r/min、150 r/min和200 r/min,温度为37 ℃的条件下发酵,每隔6 h测定菌株的OD600nm值与D-乳酸脱氢酶酶活。
1.3.4 D-乳酸脱氢酶活力的测定
将菌体收集后,采用15 mL缓冲液(137 mmol/L NaCl、2.7 mmol/L KCl、10 mmol/L Na2HPO4、1.8 mmol/L KH2PO4、0.5%TritonX-100,pH7.2)进行重悬,超声破碎(功率为150 W,频率为20 kHz,超声10 s,停歇10 s,循环30次)后获得细胞裂解液,在12 000 r/min条件下离心5 min后收集上清液即为粗酶液。采用双吡啶甲酸(bicinchoninic acid,BCA)法检测粗酶液的总蛋白含量[19],参照文献[20-21]测定D-乳酸脱氢酶活力。单位酶活力的定义:在37 ℃,pH 7.0条件下每分钟还原1 μmol MTT所需的酶量为1个酶活力单位(U),每克蛋白所具有的酶活力单位为U/g。
1.3.5 发酵验证
无机盐培养基的发酵验证:将工程菌株Escherichia coli HBUT-L与Escherichia coli HBUT-L4的种子液按1%(V/V)的接种量接种于装液量为200 mL/250 mL的无机盐培养基中,添加40 g/L CaCO3作为中和剂,在37 ℃、150 r/min条件下发酵,每隔6 h进行取样,检测样品中的L-乳酸含量、D-乳酸含量,并计算L-乳酸的光学纯度。
玉米浆培养基的发酵验证:将工程菌株Escherichia coli HBUT-L与Escherichia coli HBUT-L4的种子液按1%(V/V)的接种量接种于装液量为200 mL/250 mL的玉米浆培养基中,添加80 g/L CaCO3作为中和剂,在37 ℃、150 r/min条件下发酵,每隔12 h进行取样,检测样品中的L-乳酸含量、D-乳酸含量,并计算L-乳酸的光学纯度。
1.3.6 分析检测
菌体浓度OD600nm值的测定:采用分光光度计检测法,测定菌液在波长600 nm处的吸光度值。
L-乳酸、D-乳酸含量的测定:采用高效液相色谱法检测[22-23]。
L-乳酸的光学纯度的计算公式如下:
式中:Y为L-乳酸的光学纯度,%;A为L-乳酸的含量,g/L;B为D-乳酸的含量,g/L。
1.3.7 数据处理
通过SPSS 26.0进行显著性分析,通过WPS Office Excel 12.1.0 进行数据统计与处理,通过Origin 2017进行图表绘制。
2 结果与分析
2.1 重组质粒的构建与验证
以pUC19质粒为载体,将β-半乳糖苷酶区域分别替换为带有启动子pnirB、pflBp6、pflBp6-pnirB的dld基因,构建带有不同厌氧启动子的dld基因表达质粒,质粒图谱见图1。
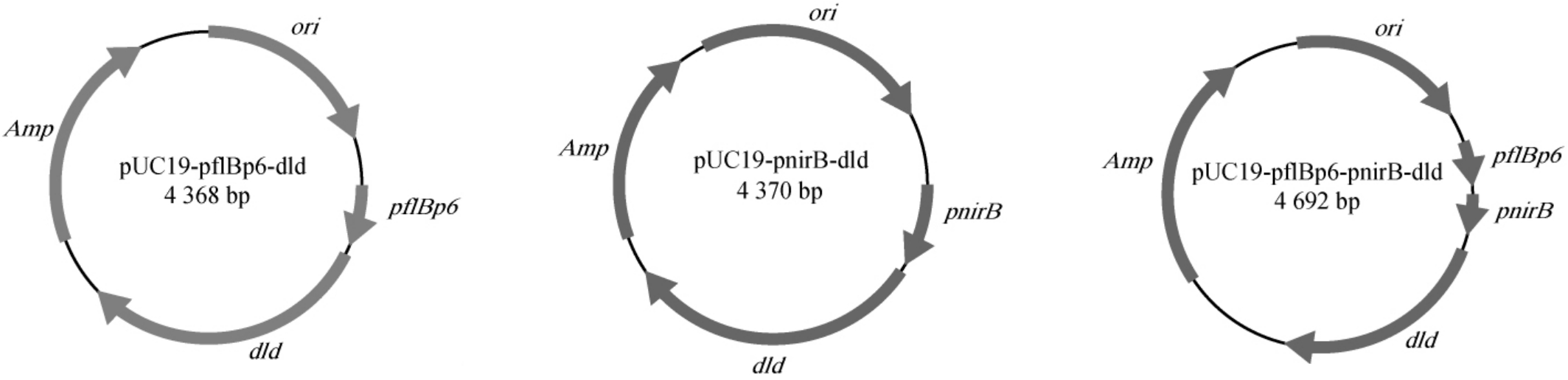
图1 带有不同厌氧启动子的dld基因的3种重组质粒图谱
Fig.1 Map of 3 recombinant plasmids of the dld gene with different anaerobic promoters
采用1%琼脂糖凝胶电泳对重组质粒进行PCR验证,结果见图2。由图2可知,通过引物P14和P15、P16和P17、P18和P19分别对重组质粒pUC19-pflBp6-dld、pUC19-pnirB-dld、pUC19-pflBp6-pnirB-dld进行PCR扩增,理论片段大小依次为1385bp、505 bp、1 149 bp,电泳结果与预期一致,说明重组质粒构建成功。将重组质粒pUC19-pflBp6-dld、pUC19-pnirB-dld、pUC19-pflBp6-pnirB-dld分别转化至出发菌株Escherichia coli HBUT-L中得到工程菌株Escherichia coli HBUT-L2、Escherichia coli HBUT-L3、Escherichia coli HBUT-L4。
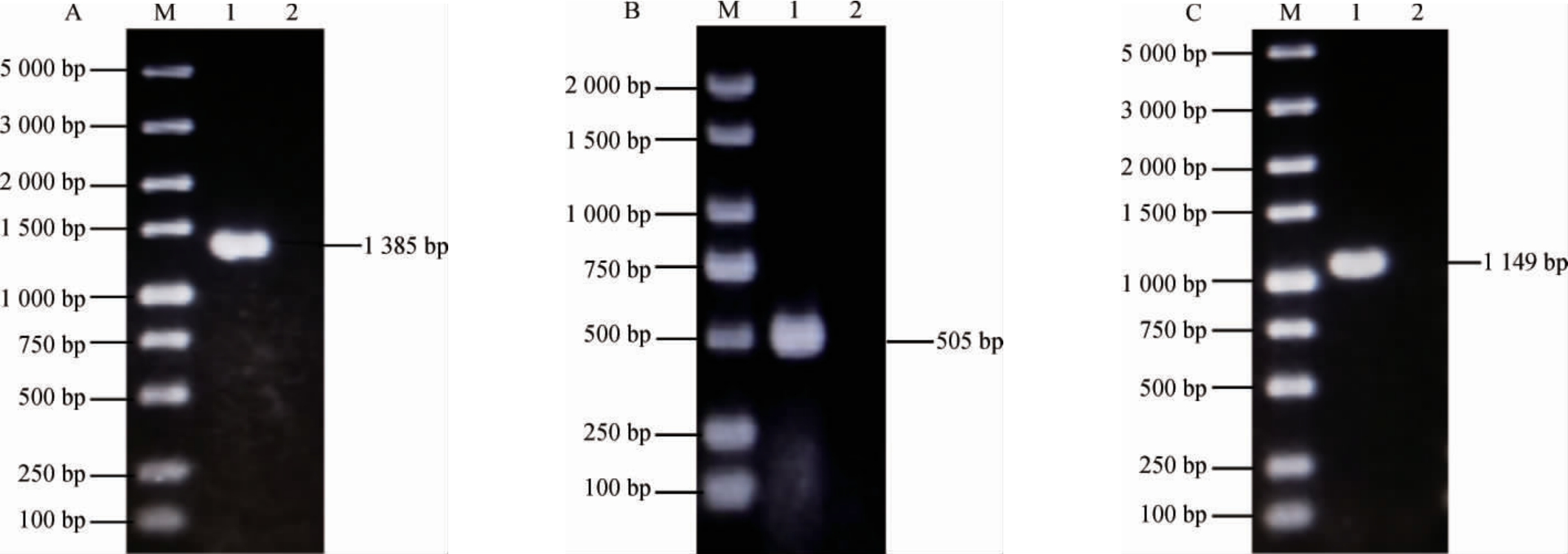
图2 重组质粒的PCR验证结果
Fig.2 PCR validation results of recombinant plasmid
A为质粒pUC19-pflBp6-dld的验证结果,B为质粒pUC19-pnirB-dld的验证结果,C为质粒pUC19-pflBp6-pnirB-dld的验证结果,M为DNA Marker。
2.2 重组质粒表达条件的探索
2.2.1 装液量对D-乳酸脱氢酶活力的影响
不同装液量对菌株生长量与D-乳酸脱氢酶活力的影响分别见图3和图4。
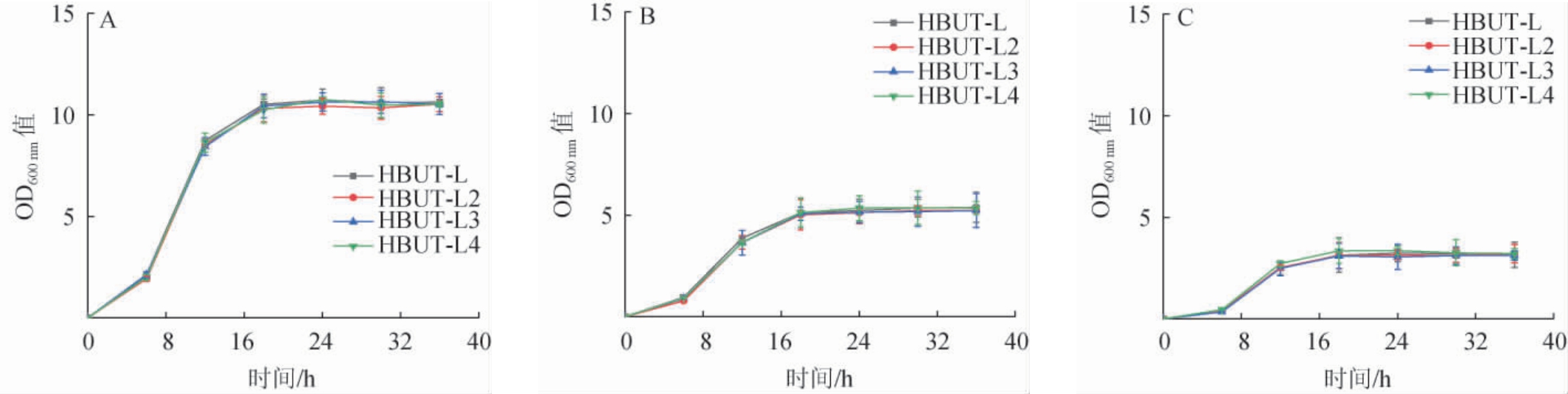
图3 装液量对菌株生长情况的影响
Fig.3 Effect of liquid loading volume on the growth of strains
A:装液量为50 mL/250 mL,B:装液量为125 mL/250 mL,C:装液量为200 mL/250 mL。图4同。
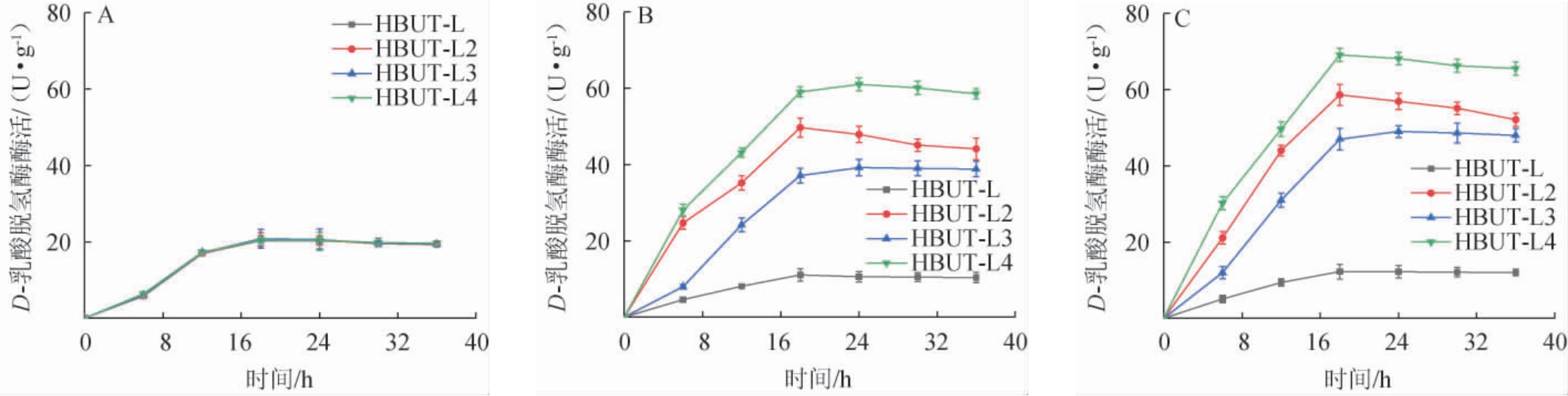
图4 装液量对菌株D-乳酸脱氢酶活力的影响
Fig.4 Effect of liquid loading volume on the D-lactate dehydrogenase activities of strains
由图3可知,在同一装液量下,3株工程菌株与出发菌株的生长趋势相似,无明显区别。结果表明,重组质粒对于菌株的生长无明显影响。随着装液量的升高,4株菌株的OD600nm值均呈减小趋势。由图4可知,当装液量为50 mL/250 mL时,工程菌株HBUT-L2、HBUT-L3、HBUT-L4与出发菌株HBUT-L的D-乳酸脱氢酶酶活无明显差异,最大D-乳酸脱氢酶活力分别为20.6U/g、20.8U/g、20.3U/g、20.5U/g,表明低装液量下重组质粒未能有效表达。当装液量为125mL/250mL和200 mL/250 mL时,工程菌株HBUT-L2、HBUT-L3、HBUT-L4的D-乳酸脱氢酶活力从大到小均依次为菌株HBUT-L4、菌株HBUT-L2、菌株HBUT-L3,最大D-乳酸脱氢酶活力分别为49.7 U/g和58.6 U/g、39.2 U/g和49.0 U/g、61.0 U/g和69.1 U/g,且相对于出发菌株HBUT-L(11.1 U/g和12.2 U/g)均有显著提升(P<0.05),表明厌氧诱导启动子能有效提高D-乳酸脱氢酶酶活。对于工程菌株HBUT-L4而言,其在装液量为200 mL/250 mL时D-乳酸脱氢酶活力最大,且最大D-乳酸脱氢酶活力比装液量125 mL/250 mL和50 mL/250 mL分别提高13.28%、237.07%。
2.2.2 转速对D-乳酸脱氢酶活力的影响
不同转速对菌株的生长量与D-乳酸脱氢酶活力的影响分别见图5和图6。
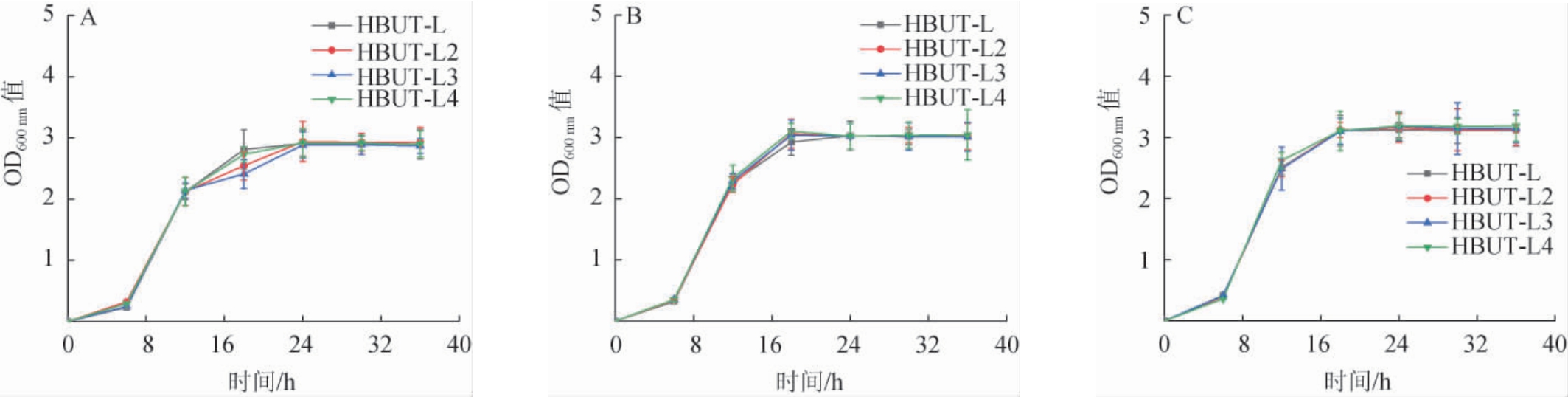
图5 转速对菌株生长情况的影响
Fig.5 Effect of rotational speed on the growth of strains
A:转速为100 r/min,B:转速为150 r/min,C:转速为200 r/min。图6同。
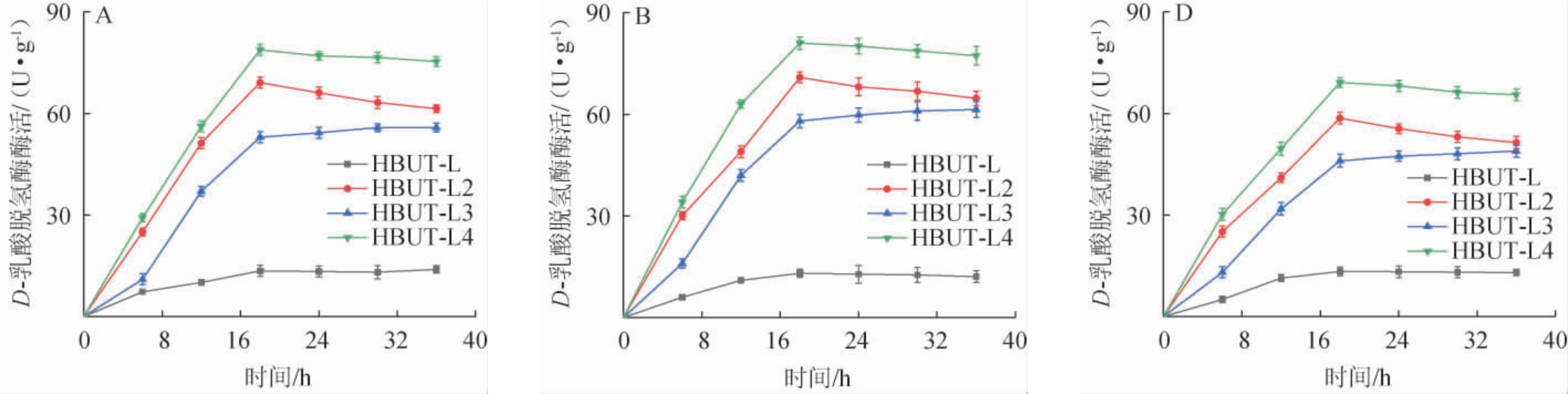
图6 转速对菌株D-乳酸脱氢酶活力的影响
Fig.6 Effect of rotational speed on the D-lactate dehydrogenase activities of strains
由图5可知,在同一转速下,4株菌株的生长趋势相似,表明重组质粒对于菌株的生长无明显影响。当转速分别为100 r/min、150 r/min、200 r/min时,出发菌株HBUT-L的最大OD600nm值分别为2.91、3.03、3.12,工程菌株HBUT-L2的最大OD600nm值分别为2.94、3.06、3.15,工程菌株HBUT-L3的最大OD600nm值分别为2.89、3.04、3.18,工程菌株HBUT-L4的最大OD600 nm值分别为2.92、3.10、3.18,随着转速的升高,生长量呈现上升趋势,结果表明,随着转速的升高,有利于菌株的生长。由图6可知,在不同转速下,D-乳酸脱氢酶活力从大到小均依次为菌株HBUT-L4、菌株HBUT-L2、菌株HBUT-L3,当转速分别为100 r/min、150 r/min、200 r/min时,工程菌株HBUT-L2的最大D-乳酸脱氢酶活力分别为69.1U/g、70.9U/g、58.6 U/g,工程菌株HBUT-L3的最大D-乳酸脱氢酶活力分别为55.8U/g、61.4 U/g、48.9 U/g,工程菌株HBUT-L4的最大D-乳酸脱氢酶活力分别为78.8 U/g、81.1 U/g、69.1U/g,相对于出发菌株HBUT-L(13.9U/g、13.1U/g、13.3U/g)均有显著提升(P<0.05)。对于工程菌株HBUT-L4而言,其在转速为150 r/min时D-乳酸脱氢酶活力最大,且最大D-乳酸脱氢酶活力比转速为100 r/min、200 r/min时分别提高了2.92%、17.37%。
综上,在装液量为200 mL/250 mL、转速为150 r/min的条件下,带有启动子pflBp6-pnirB重组质粒的工程菌株HBUT-L4的D-乳酸脱氢酶活力最高。因此,选择此条件对工程菌株HBUT-L4进行发酵验证试验。
2.3 发酵验证试验
2.3.1 无机盐培养基的发酵验证
采用出发菌株HBUT-L和工程菌株HBUT-L4在含有1 g/LD-乳酸钠的无机盐培养基中进行发酵,测定乳酸含量,结果见图7。由图7可知,在发酵36 h时,出发菌株HBUT-L消耗了0.29 g/L D-乳酸,D-乳酸的消耗速率为0.008 g/(L·h),生产了18.6 g/L L-乳酸,L-乳酸的生产速率为0.517 g/(L·h),L-乳酸的光学纯度为96.32%;工程菌株HBUT-L4基本消耗完D-乳酸,D-乳酸的消耗速率为0.028 g/(L·h),生产了19.3 g/L L-乳酸,L-乳酸的生产速率为0.536 g/(L·h),L-乳酸的光学纯度为99.95%。相对于出发菌株HBUT-L,工程菌株HBUT-L4的L-乳酸的产量提高了3.8%,D-乳酸的消耗速率提升了250%,L-乳酸的光学纯度从96.32%提升至99.95%。结果表明,厌氧启动子pflBp6-pnirB能有效提高发酵液中L-乳酸的光学纯度。

图7 出发菌株HBUT-L和工程菌株HBUT-L4在无机盐培养基中发酵产乳酸的情况
Fig.7 Lactic acid production by fermentation of original strain HBUT-L and engineered strain HBUT-L4 in inorganic salt medium
2.3.2 玉米浆培养基的发酵验证
在微生物工业化生产L-乳酸时,为考虑到成本问题,碳、氮源通常会采用相对廉价且来源丰富的原料。工业化生产过程中常被用作碳、氮源的是玉米浆、葡萄糖结晶废糖液[24-25]。因此,本研究通过高效液相色谱法测定玉米浆与葡萄糖结晶废糖液中的D-乳酸含量,结果显示,玉米浆中D-乳酸含量为1.404 g/100 g,葡萄糖结晶废糖液中D-乳酸含量为0.908 g/100 g。在工业化生产过程中,玉米浆或葡萄糖结晶废糖液由于其加工过程与保存条件较为粗放[26],会含有D-乳酸,从而影响终产物L-乳酸的光学纯度。
以出发菌株HBUT-L和工程菌株HBUT-L4为发酵菌株,在玉米浆培养基中进行发酵,测定乳酸含量,结果见图8。由图8可知,在发酵0 h时,D-乳酸含量为0.9 g/L,发酵48 h时,出发菌株HBUT-L消耗了0.29 g/L D-乳酸,D-乳酸的消耗速率为0.006 g/(L·h),生产了39.4 g/L L-乳酸,L-乳酸的生产速率为0.821 g/L,L-乳酸的光学纯度为98.48%;工程菌株HBUT-L4基本消耗完D-乳酸,D-乳酸的消耗速率为0.019 g/(L·h),生产了40.5 g/L L-乳酸,L-乳酸的生产速率为0.844 g/(L·h),L-乳酸的光学纯度为99.98%。相对于出发菌株HBUT-L,工程菌株HBUT-L4的D-乳酸消耗速率提升了217%,L-乳酸的光学纯度从98.48%提升至99.98%。结果表明,厌氧启动子pflBp6-pnirB能有效提高发酵液中L-乳酸的光学纯度。
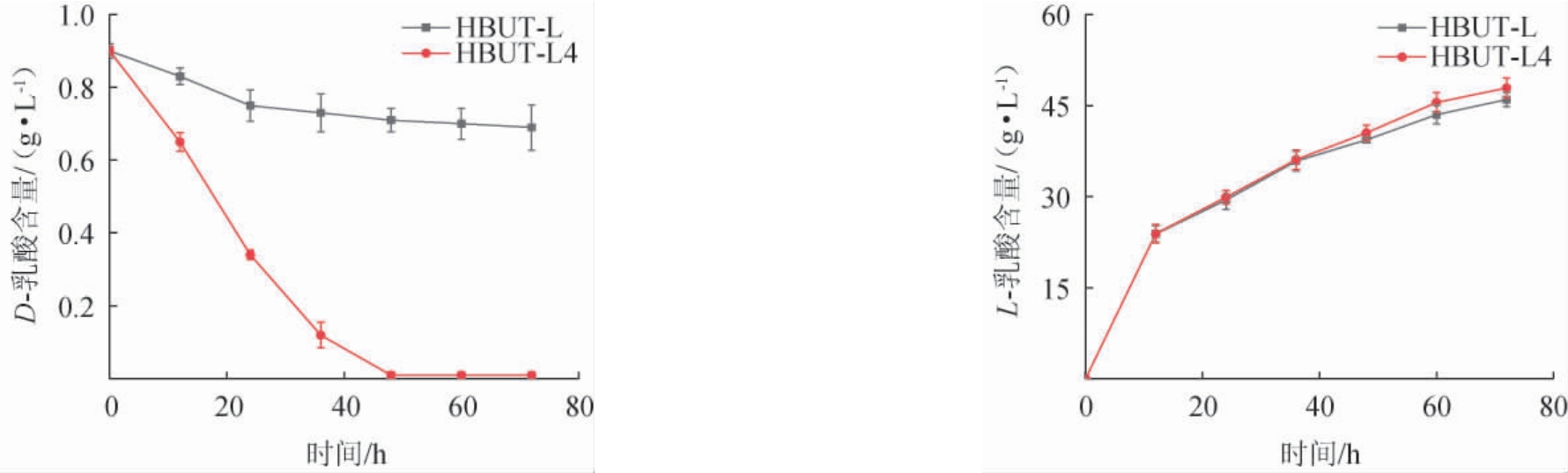
图8 出发菌株HBUT-L和工程菌株HBUT-L4在玉米浆培养基中发酵产乳酸情况
Fig.8 Lactic acid production by fermentation of original strain HBUT-L and engineered strain HBUT-L4 in corn pulp medium
3 结论
本研究成功构建了带有不同厌氧诱导启动子(pflBp6、pnirB、pflBp6-pnirB)的dld基因的表达质粒,并转化至产L-乳酸的大肠杆菌HBUT-L中。通过装液量与转速的单因素试验确定在装液量为200 mL/250 mL、转速为150 r/min的条件下,含有启动子pflBp6-pnirB的表达质粒的工程菌株HBUT-L4发酵18 h时的D-乳酸脱氢酶活力最高,为81.1 U/g,相对于出发菌株HBUT-L提升了519.08%。在无机盐培养基与玉米浆培养基中进行发酵时,相对于出发菌株HBUT-L,菌株HBUT-L4的D-乳酸消耗速率分别提高250%、217%,L-乳酸的光学纯度分别从96.32%、98.48%提升至99.95%、99.98%。
在微生物工业化发酵产L-乳酸过程中,带有厌氧诱导启动子pflBp6-pnirB的dld基因表达质粒能有效提高菌株对外源D-乳酸的消耗能力,从而保证发酵终产物L-乳酸的质量与纯度,对L-乳酸相关产业的发展具有积极的推动作用。
[1]杨登峰,关妮,潘丽霞,等.微生物发酵L-乳酸的研究进展[J].中国酿造,2009,28(5):1-3.
[2]刘汝婷,张倩,郭西鹏,等.ptsG/mglB双基因敲除对大肠杆菌发酵混合糖产L-乳酸的影响[J].中国酿造,2021,40(9):82-86.
[3]高伟波.乳酸性酸中毒与危重症[J].疑难病杂志,2011,10(2):161-163.
[4]尹丰伟,孙小龙,付永前,等.一种驯化米根霉的方法及生产乳酸的方法:CN112501107A[P].2023-03-14.
[5]许黎明,成春燕,吕军.鼠李糖乳杆菌D-乳酸脱氢酶基因ldhD的敲除[J].基因组学与应用生物学,2016,35(6):1421-1427.
[6]许黎明,蒋国凤,黄东,等.一种产高光学纯L-乳酸的鼠李糖乳杆菌基因工程菌的构建方法:CN114875079A[P].2022-08-09.
[7]MUNJAL N,JAWED K,WAJID S,et al.A constitutive expression system for cellulase secretion in Escherichia coli and its use in bioethanol production[J].PLoS One,2015,10(3):e0119917.
[8]SAWERS R G.Differential turnover of the multiple processed transcripts of the Escherichia coli focA-pflB operon[J].Microbiology,2006,152(8):2197-2205.
[9]CHENG J, TU W Y, CAO R Q, et al.High-efficiency production of 5-aminovalerate in engineered Escherichia coli controlled by an anaerobically-induced nirB promoter[J].Biochem Biophys Res Commun,2021,552:170-175.
[10]HUANG M H, CHENG J, CHEN P, et al.Efficient production of succinic acid in engineered Escherichia coli strains controlled by anaerobically-induced nirB promoter using sweet potato waste hydrolysate[J]. J Environ Manage,2019,237:147-154.
[11]赵锦芳,薛葳蕤,张晓敏,等.大肠杆菌工程菌利用甘蔗糖蜜发酵产L-乳酸研究[J].湖北农业科学,2016,55(24):6541-6545.
[12]王灿,潘海亮,梁泉喜,等.大肠杆菌工程菌mglB基因的敲除及水稻秸秆水解液发酵L-丙氨酸[J].安徽农业科学,2020,48(7):113-117.
[13]田甜.高效利用蔗糖产D-乳酸工程菌的构建及其发酵研究[D].武汉:湖北工业大学,2013.
[14]李坤朋,许雅洁,赵锦芳,等.大肠杆菌工程菌利用玉米浆发酵产L-乳酸的研究[J].中国酿造,2012,31(12):64-67.
[15]唐梅,蔡松,付声亮,等.UdhA和博伊丁假丝酵母xylI基因共表达对木糖醇发酵的影响[J].安徽农业科学,2022,50(1):106-109.
[16]唐梅,蔡松,杨东成,等.不依赖IPTG诱导产木糖醇大肠杆菌工程菌的构建[J].中国酿造,2021,40(9):173-179.
[17]KOHN L D,KABACK H R.Mechanisms of active transport in isolated bacterial membrane vesicles.XV.Purification and properties of the membrane-bound D-lactate dehydrogenase from Escherichia coli[J]. J Biol Chem,1973,248(20):7012-7017.
[18]FUTAI M,KIMURA H.Inducible membrane-bound L-lactate dehydrogenase from Escherichia coli.Purification and properties[J].J Biol Chem,1977,252(16):5820-5827.
[19]李政,高健磊,闫怡新.一种快速测定污泥滤液中蛋白质含量的方法[J].给水排水,2022,58(S1):30-33.
[20]SUN Y,GAO G S,CAI T.Enzymatic characterization of D-lactate dehydrogenase and application in alanine aminotransferase activity assay kit[J].Bioengineered,2021,12(1):6459-6471.
[21]KACZOROWSKI G,KOHN L D,KABACK H R.Purification and properties of D-lactate dehydrogenase from Escherichia coli ML 308-225[J].Method Enzymol,1978,53(1):519-527.
[22]ZHOU S, YOMANO L P, SHANMUGAM K T, et al.Fermentation of 10% (w/v) sugar to D: (-)-lactate by engineered Escherichia coli B[J].Biotechnol Lett,2005,27(23):1891-1896.
[23]文瑶.大肠杆菌工程菌HBUT-L的耐乳酸盐驯化及其发酵产L-乳酸的研究[D].武汉:湖北工业大学,2016.
[24]雷永伟,洪元芳,安艳霞,等.玉米精深加工及副产物的开发与综合应用[J].粮食与饲料工业,2022(6):33-36,39.
[25]马鑫,张子桐,孟鑫岩,等.响应面法优化ε-聚赖氨酸产生菌的发酵培养基[J].中国调味品,2022,47(5):15-21,38.
[26]顾珂珂,成俊林,何贝贝,等.玉米加工副产物饲用价值提升技术研究进展[J].饲料研究,2023,46(21):170-174.