中国白酒作为世界六大蒸馏酒之一,占有重要的地位,白酒香型众多,共有浓香、酱香、清香、米香、特香、凤香、兼香、芝麻香、馥郁香、豉香、老白干香、药香等十二大香型,其中浓香型白酒分布最为广泛,其产量和销量占白酒总量的70%以上[1],以浓香型白酒为代表的主要有五粮液、洋河、泸州老窖、剑南春等。在白酒的酿造过程中,以酒曲作为糖化发酵剂进行发酵是白酒酿造工艺的典型特征,经过不断实践,酒曲的发展多种多样,按种类可分为大曲、小曲、麸曲、麦曲、红曲等,其中应用最为广泛的是大曲。大曲是利用自然网罗环境中的微生物和控制生产工艺条件,以小麦(或高粱、大麦、豌豆等)为原料,生产的微生态产品[2]。根据制作过程中达到的最高温度,可分为高温大曲(最高品温65 ℃)、中高温大曲(最高品温62 ℃)、中温大曲(最高品温58 ℃)和低温大曲(最高品温52 ℃)4种主要类型,其中中高温大曲、中温大曲是酿造浓香型白酒的主要原料。大曲依据香型的不同分为酱香型大曲、浓香型大曲和清香型大曲;依据生产工艺差异可将大曲分为传统大曲、强化大曲和纯种大曲。不同类型大曲发酵的原料不同,糖化能力也有所区别,酿造的浓香型白酒的风味、口感、微量成分等特有的品质指标也截然不同。因此,曲为酒之骨,好曲酿好酒,发酵所用的大曲与浓香型白酒的品质有着密不可分的关系。本文综述浓香型白酒大曲在发酵过程中的主要微生物来源、不同发酵阶段微生物变化规律、重要功能微生物的作用及微生物群落分析方法,旨在为浓香型大曲生产工艺优化及白酒质量提高提供科学依据。
1 大曲的简介及浓香型大曲的制作工艺
大曲是一种微生物发酵剂,其中富含大量微生物、酶类(蛋白酶、淀粉酶、纤维素酶等)以及风味物质(醇、酸、醛、酯等),具有糖化发酵、生香等功能,在白酒酿造过程中发挥着重要作用。
将小麦和大麦等原料润料后将其破碎,加入一定比例的水润湿进行拌和,再将其制成大小相同的曲块,置于曲房中发酵一定时间,检验合格后在库房中存放几个月即为成熟大曲。浓香型大曲的制作工艺如下:
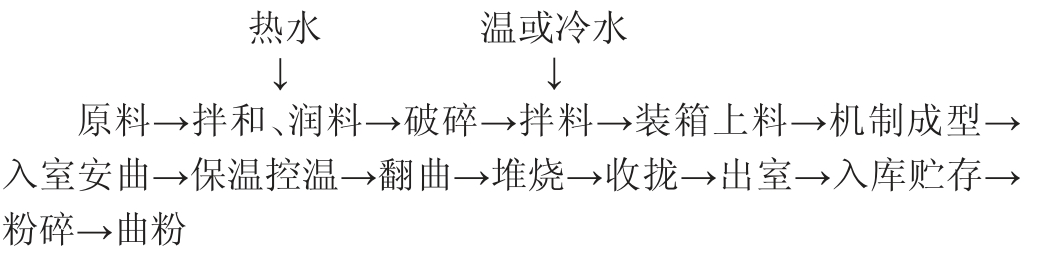
目前浓香型大曲多以自然接种方式进行发酵,通过人工翻曲、揭盖草帘、开关门窗等方式对曲块进行温度和湿度的调节,从而获得丰富的微生物资源。大曲发酵共分为升温、高温和降温期三个阶段,通过控制不同时期的温度,达到曲胚成熟的目的。因此,大曲质量的高低,不仅取决于制曲工艺环节的把控,曲房内的温度、湿度等环境参数也是一个重要的因素[3]。
2 浓香型大曲中的主要微生物
2.1 微生物的主要来源
大曲从发酵到储存的过程中,在环境中富集了大量微生物,这些微生物的群落演替和进化影响着白酒发酵过程的特性。由于大曲采用开放式培养,因此原料和培养环境是微生物的主要来源(见图1),通过自然培养、不断富集等过程,形成浓香型大曲的独特微生物菌系[4-6]。

图1 浓香型白酒大曲制作过程中微生物来源
Fig.1 Sources of microorganisms in the production of strong-flavor Baijiu Daqu
首先是原料,主要包括制曲原料和水,研究表明,大曲起始发酵时89.3%的细菌来自于制曲原料[7]。其次是培养环境,由于曲块是在开放的曲房中培养,环境中的空气、公用器具、草席等都是微生物的重要来源,其中工具表面和室内地面是大曲真菌群落的重要来源[6]。LIU S P等[8]研究发现,室内空气、管道和设备表面分布着许多功能微生物(如醋酸杆菌、乳酸菌和酵母菌),它们构成了大曲初始细菌/真菌组成(71.62%/28.47%)和成熟大曲粉(21.1%/61.65%)的菌群。另外有研究表明,发酵开始时,室内草席贡献了5.6%的细菌,室外地面贡献了53.7%的真菌,室内屋顶贡献了23.0%的真菌[7]。除此之外,制曲工人身上也携带着大量微生物,为大曲的发酵提供了部分微生物来源。因此,形成了以细菌、霉菌、酵母菌、放线菌为主的大曲微生物群系,其中细菌的种类和数量最多,其次是霉菌,然后是酵母菌,放线菌最少几乎难以检出[9-10]。
2.2 浓香型大曲生产不同阶段微生物变化规律
浓香型大曲发酵阶段主要分为4段,即前缓期的快速升温阶段、前缓期的慢速升温阶段、中挺期和后缓落期,不同阶段因其温度和湿度的不同,大曲中微生物群系的种类和菌体数量呈动态变化规律。与真菌相比,细菌更具耐热性,真菌在早期较为活跃,而细菌在中后期较为活跃,在最高温度和温度下降阶段相对丰富[7,11-12]。ZHU M等[12]研究发现,在大曲发酵阶段中,细菌属以芽孢杆菌属(Bacillus)、魏斯氏菌属(Weissella)、高温放线菌属(Thermoactinomyces)和乳杆菌属(Lactobacillus)为主;真菌属以嗜热子囊菌属(Thermoascus)、嗜热真菌属(Thermomyces)、柯达酵母属(Kodamaea)和曲霉属(Aspergillus)为主。刘能等[13]研究发现,酵母菌、醋酸菌、乳酸菌数量在发酵过程中先上升后下降,在发酵后期数量较少;霉菌、芽孢杆菌数量较为波动,在发酵后期数量较多。发酵初期适宜的环境有利于酵母菌和部分霉菌的生长,在高温阶段,许多微生物类群可能受到大曲孵化过程中产生的内源性生物热的抑制,从而影响了热敏真菌的生长繁殖,最终耐热性微生物属占主导地位,如嗜热子囊菌属(Thermoascus)、嗜热真菌属(Thermomyces)[12,14-16]。KANG J M等[17]对中温大曲研究发现,随着生产温度的升高,糖多孢菌属(Saccharopolyspora)、芽孢杆菌属(Bacillus)和高温放线菌属(Thermoactinomyces)成为优势属。大曲微生物群落的演替具有时间依赖性和阶段性,随着温度和时间的改变而发生变化,并且环境不同其生长微生物也不尽相同,由于地域及发酵坏境差异,最终导致发酵温度和湿度不同,其在相同阶段的主要优势微生物也存在相应差别。刘仕洋等[18]采用Illumina MiSeq高通量测序技术对临沂和周口地区中高温大曲中的真菌类群进行研究,α及β多样性分析表明,大曲菌群在整体上存在明显差异,临沂地区大曲真菌类群丰富度极显著低于周口地区(P<0.01)。刘婷等[19]研究不同生产环境对特香型大曲的影响,结果表明采用相同大曲配料和工艺,发酵位置不同,微生物多样性及优势微生物也截然不同。张作仪等[20]对内蒙古中温大曲研究发现,由于地理位置不同,微生物群落丰富度和多样性存在显著差异。不同浓香型大曲在发酵阶段的优势微生物变化规律总结见表1。
表1 不同浓香型白酒大曲在发酵过程中优势微生物变化
Table 1 Changes of dominant microorganisms in different strong-flavor Baijiu Daqu during fermentation process

大曲 优势微生物变化规律 文献中温大曲 0~4 d霉菌数量稀少,酵母菌和细菌生长迅速;4~8 d酵母菌和细菌数量迅速减少,霉菌数量有所上升;8~12 d细菌和酵母菌数量缓慢增长;12 d并房后酵母菌、细菌、霉菌数量减少,后期酵母菌数量稀少或者没有。 [21]
续表

大曲 优势微生物变化规律 文献中高温大曲中高温大曲中高温大曲中温大曲中高温大曲中温大曲中温大曲中温大曲/中高温大曲中温大曲中高温大曲中高温大曲中温大曲0 d以乳杆菌属(Lactobacillus)、肠杆菌科(Enterobacteriaceae)、魏斯氏菌属(Weissella)为主;5 d以魏斯氏菌属(Weissella)、乳杆菌属(Lactobacillus)、明串珠菌属(Leuconostoc)为主;9 d以乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)为主;15 d以魏斯氏菌属(Weissella)为主;21 d芽孢杆菌属(Bacillus)占据绝对优势,兼有一定占比的魏斯氏菌属(Weissella);35 d出房时则以魏斯氏菌属(Weissella)、乳杆菌属(Lactobacillus)、葡萄球菌属(Staphylococcus)、肠杆菌科(Enterobacteriaceae)为主。细菌多样性在发酵第5天最高,乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)、葡萄球菌属(Staphylococcus)和明串珠菌属(Leuconostoc)为优势菌属;真菌多样性在第5天达到最高,曲霉属(Aspergillus)、伊萨酵母属(Issatchenkia)、粉状米勒酵母属(Millerozyma)和嗜热子囊菌属(Thermoascus)为优势菌属。酵母菌、醋酸菌、乳酸菌、芽孢杆菌的数量均呈现先上升后下降的趋势,霉菌的数量整体上升。细菌多样性增加,优势细菌为乳杆菌属(Lactobacillus)、芽孢杆菌属(Bacillus)、魏斯氏菌属(Weissella)、醋酸杆菌属(Acetobacter)、泛菌属(Pantoea)、片球菌属(Pediococcus)。发酵开始到结束,细菌群落的多样性增加,真菌群落的多样性降低。开始时细菌以魏斯氏菌属(Weissella)为主,结束时以乳杆菌属(Lactobacillus)为主;在发酵开始和结束时真菌以曲霉属(Aspergillus)和根霉属(Rhizopus)为主。第5天以霉菌为主;第7天大多是细菌,其次是霉菌,然后是酵母;在高温期(第10天),以酵母菌为主,其次为霉菌,细菌数量较少;在大曲制作周期结束时,以酵母菌为主,其次是霉菌。魏斯氏菌属(Weissella)呈先升高后降低的趋势,并在发酵中期(第16天)达到峰值(86.01%);乳杆菌属(Lactobacillus)在发酵前期较多,随着发酵的进行逐渐减少;高温放线菌属(Thermoactinomyces)出现在发酵后期(第30天)。真菌方面,优势真菌为嗜热子囊菌属(Thermoascus)、毕赤酵母属(Pichia)、根霉属(Rhizopus)和曲霉属(Aspergillus),嗜热子囊菌属(Thermoascus)在发酵中期(第12~23天)保持较高的相对丰度;毕赤酵母属(Pichia)在发酵初期丰度较高(第4天),随着发酵时间的延长而逐渐降低;曲霉属(Aspergillus)先升高后降低,发酵中期比例最高(第16天),后期比例逐渐降低。曲霉属(Aspergillus)是发酵阶段的优势真菌。罗伊氏粘液乳杆菌属(Limosilactobacillus)、葡萄球菌属(Staphylococcus)、毕赤酵母属(Pichia)、根霉属(Rhizopus)和横梗霉属(Lichtheimia)在早期代谢活跃,在高温期和发酵末期,多种耐热丝状真菌生长旺盛。前缓期的快速升温阶段主要是酵母菌属(Saccharomyces)、根霉属(Rhizopus)、芽孢杆菌属(Bucillus)、魏斯氏菌属(Weissella)、乳酸杆菌属(Lactobacillus);慢速升温阶段主要是嗜热子囊菌属(Thermoascus)、酵母菌属(Saccharomyces)、芽孢杆菌属(Bacillus)、魏斯氏菌属(Weissella)、乳酸杆菌属(Lactobacillus);在顶火期主要是嗜热子囊菌属(Thermoascus)、芽孢杆菌属(Bacillus)和高温放线菌属(Thermoactinomyces);后缓落期中主要是嗜热子囊菌属(Thermoascus)、嗜热真菌属(Thermomyces)、芽孢杆菌属(Bucillus)、魏斯氏菌属(Weissella)、高温放线菌属(Thermoactinomyces)。发酵末期,细菌主要以魏斯氏菌(Weissella)、乳杆菌属(Lactobacillus)、泛菌属(Pantoea)为主,真菌主要以嗜热真菌属(Thermomyces)、嗜热子囊菌属(Thermoascus)、根霉属(Rhizopus)为主。魏氏菌属(Weissella)、明串珠菌属(Leuconostoc)和乳杆菌属(Lactobacillus)在整个发酵过程中处于优势地位,芽孢杆菌属(Bacillus)在发酵10天后成为主要的优势菌群。高温放线菌属(Thermoactinomyces)在发酵10 d后,其相对丰度超过1.0%。[22][3][13][11][7][23][24][25][26][27][28][29]
2.3 重要功能微生物及其作用
2.3.1 细菌
细菌主要产蛋白酶以及香味物质,其中一些细菌在高温条件下能够分解大曲原料中的蛋白质,产生酚类、酯类、醛类等挥发性风味物质,赋予大曲特别的曲香味[9],常见的细菌有芽孢杆菌、乳酸菌、醋酸菌等。
芽孢杆菌的数量最多,种类最丰富,是整个生产过程中的优势菌,产香效果较好,其中以枯草芽孢杆菌(Bacillus subtilis)产香最佳,表现为浓郁的甜酱香味[9,30]。芽孢杆菌具有耐热孢子,能承受发酵过程中的高温,最高可达60~62 ℃[12]。同时,芽孢杆菌属(Bacillus)还可以产生α-淀粉酶、糖化酶、脂肪酶、蛋白酶以及乙偶姻、四甲基吡嗪等风味物质[31-32]。HE G Q等[33]研究发现,大曲中接种枯草芽孢杆菌(Bacillus subtilis)之后,其重要酯类和芳香化合物等风味物质含量明显提升。乳酸菌主要包含乳酸杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)和片球菌属(Pediococcus),可以提供大量乳酸、乙酸、乳酸乙酯等风味化合物及其前体,从而增强白酒的醇厚特性[6,26]。乳酸菌能够有效促进白酒发酵,其代谢产物可以降低白酒的刺激感,增加回甜风味,但是乳酸菌含量过高则会影响酒质,形成乳酸乙酯含量过高、已乳倒挂的现象,并使酒体出现酸涩[2,34]。醋酸菌对大曲产酸发挥着至关重要的作用,醋酸菌能够氧化葡萄糖和乙醇产生醋酸,与醇发生缩合反应生成酯类。但醋酸菌含量过多时,会使酒味变异,同时还会抑制酵母菌的生长和作用[35-36]。刘延波等[37]从浓香型白酒大曲中找到一株高产酯化酶菌株,结合形态学鉴定、生理生化试验及分子生物学技术鉴定,最终确定该菌株为表皮葡萄球菌(Staphylococcus epidermidis)。LIU Y B等[38]从中温大曲中筛选出一株高产蛋白酶菌株,经形态学观察、生理生化试验及16S rDNA序列分析,确定该菌株为贝莱斯芽孢杆菌(Bacillus velezensis)。YANG Y等[39]对中温大曲进行研究发现,乳酸菌主要是魏斯氏菌属(Weissella)、乳酸杆菌属(Lactobacillus)、片球菌属(Pediococcus);毛霉菌主要是横梗霉属(Lichtheimia);散囊菌主要是曲霉属(Aspergillus)、Rasamsonia、丝衣霉属(Byssochlamys),负责在中温大曲中产生裂解酶和风味前体/化合物,乳酸杆菌属(Lactobacillus)和衣原体属(Chlamydia)的分解代谢活性可能有助于微生物群的有效自我培养。
2.3.2 霉菌
霉菌主要影响浓香型大曲糖化力、液化力和酯化力[40],较高的糖化和液化能力可以提高原料中淀粉和纤维素向葡萄糖的转化[17]。霉菌群落作为优势菌群在参与发酵过程中能产生大量的胞外酶(如糖化酶、脂肪酶、蛋白酶和水解酶)和增香产物,可分解大曲中的大分子物质,在大曲中产生风味物质及其前体,是大曲发酵过程中良好的糖化剂、发酵剂和生香剂[3,41]。浓香型大曲中的霉菌以毛霉、曲霉和根霉为主,霉菌种类不同,其作用也各异。贺奕森[42]通过分子鉴定和形态学观察,对浓香型大曲霉菌进行鉴定,发现高产糖化酶菌株为黑曲霉,高产酸性蛋白酶菌株为米曲霉,高产酯化酶菌株为红曲酶。
毛霉具有较强的蛋白质分解能力,同时能糖化淀粉并生成少量乙醇,毛霉是产生菌丝的主要微生物,霉菌菌丝向大曲内部生长促进气体交换,使曲胚发酵均匀,并且曲表毛霉能够增加曲坯表面的保湿性能,促进霉菌生长,因此少量的毛霉对大曲的综合能力有益[13,43]。但是毛霉孢子很快成熟,颜色由白转黑对大曲外观产生不利影响,同时毛霉数量过多会对其他微生物的生长产生抑制。曲霉是大曲中产酶能力较强的一类微生物,能够分泌淀粉酶、蛋白酶、糖化酶等多种酶类,其在白酒的酿造过程中主要作用于发酵前期淀粉糖化,分解酿造原料中淀粉等大分子物质[2]。其中米曲霉(Aspergillus oryzae)和大豆曲霉(A.sojae)产生的蛋白质水解酶和其他水解酶将不溶性大豆和小麦化合物转化为水溶性肽、糖、游离氨基酸和其他降解产物[10]。根霉是一种嗜热真菌,与挥发性化合物的形成有关,通过分泌乳酸、酸性蛋白酶、葡聚糖酶和酒精脱氢酶来促进白酒独特风味的形成[10,12]。除此之外,还存在一种特殊的霉菌——青霉菌,青霉菌一般被认为是大曲发酵过程中的有害菌,会使麸曲和酒母的质量降低,最终降低白酒出酒率,并对风味产生不利的影响,使白酒呈现苦味[44]。但是少量的青霉菌并不会对大曲整体质量产生太大影响,并且适当浓度的青霉素不仅能够抑制有害杂菌的生长繁殖,还有利于酵母发酵产酒精[45]。目前,研究者们一般通过调整工艺措施来控制大曲表面霉菌生长过度,如王西等[46]通过调节安曲方式、稻草厚度、翻曲时间等,结果表明曲坯表面霉菌生长面积可降至50%。
2.3.3 酵母菌
酵母菌是一种重要的菌群,在发酵过程中将淀粉降解为糊精、麦芽糖和葡萄糖,这些糊精是酿酒酵母菌和许多其他参与白酒发酵的细菌的营养来源[47];酵母菌具有产酯、产醇和生香的作用,是影响白酒发酵产酒的主要菌类,大曲中的酵母菌主要有产酒酵母、产酯酵母以及假丝酵母等[3,26,41]。产酒酵母是酒曲中主要的产酒功能菌,能够将糟醅中的糖发酵为酒精;产酯酵母又称为生香酵母,在发酵过程中能够将糖、醇等转化为醛、酯等芳香物质,形成浓香型白酒的特征风味[9,48]。唐涛[49]从浓香型白酒大曲中分离纯化出汉逊酵母(Ogataea polymorpha)、酿酒酵母(Saccharomyces cerevisiae)、毕赤酵母(Komagataella pastoris),具有产气性能优良且耐酸、耐乙醇、耐高温的特性。PU S C等[50]从浓香型大曲中分离得到16种酵母,其中酿酒酵母(Saccharomyces cerevisiae)生产乙醇的能力较强,但产生的挥发性化合物的数量相对较少;异常威克汉姆酵母(Wickerhamomyces anomalus)发酵效率相对较差,但产生大量挥发性化合物。
2.3.4 放线菌
放线菌水解淀粉、蛋白质和纤维素,为其他微生物在发酵过程中产生风味成分提供前体,并产生重要的白酒风味化合物,如己酸乙酯和丁酸乙酯[51]。浓香型大曲中的放线菌较单一,目前研究发现主要有链霉菌和高温放线菌[9,26]。链霉菌能够产生链霉素,可以抑制真菌和致病菌的生长[51]。高温放线菌能够分泌淀粉酶、酯酶、纤维素酶、果胶酶和磷酸酶以及多种耐热性细胞外蛋白酶(如碱性蛋白酶、谷氨酰内肽酶和羧肽酶)[52-53],最适生长温度为50~55 ℃,其菌丝能使大曲结构松弛,有利于水分的蒸发[13]。LIU W H等[26]对泸州老窖中温大曲进行研究,发现高温放线菌是高温时期的优势菌,但在整个过程中相对丰度较低。苑建伟等[54]从宋河大曲中分离得到5株放线菌,经鉴定为链霉菌属(Streptomyces)和拟诺卡氏菌属(Nocardiopsis),5株放线菌均抑制大曲酵母菌的生长但并不抑制其产酒力,同时对芽孢杆菌的生长和产淀粉酶能力具有一定影响。
2.4 微生物群落分析方法
对大曲微生物的相关研究方法主要分为两大类,一类是基于传统的培养依赖分析法,另一类则是借助分子生物学的非培养依赖分析法。基于传统的培养依赖分析法可以从大曲中分离和鉴定微生物,但无法对大量微生物进行研究,且自然界中能实现纯种培养的微生物占少数,这导致了各种非培养方法的实施,即基于分子生物学的非培养依赖分析法。
基于分子生物学的非培养依赖分析法主要有高通量测序技术(包括扩增子测序、宏基因组学和宏转录组学)和宏蛋白组学技术,如宏基因组学及代谢组学技术[55]、非靶向代谢组学技术[41]、定量元蛋白组学技术[56]、聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)技术[57]、非靶标测序技术[58]等多种分析方法,目前已在大曲中得到了广泛应用,通过对优势微生物群落、风味相关微生物群和其他微生物群进行研究,从而进一步探索了大曲发酵和白酒酿造过程中的核心功能菌群。孙亮霞等[59]通过MiSep高通量测序技术对中温大曲贮存过程中微生物群落进行多样性分析,发现大曲的微生物丰富度和多样性均先降低再回升。曾波等[60]通过高通量测序技术解析了浓香型白酒酒醅微生物群落在发酵过程中的动态变化,并对不同发酵节点的微生物群落与理化指标的相关性进行了分析。
3 总结与展望
大曲作为糖化发酵剂对白酒的风味和品质有重要影响,其中的微生物种类和数量决定着白酒的出酒率、酒质和风味成分。大曲中微生物菌群结构揭示、功能微生物及特殊产香菌等的发现,为大曲品质的提升及功能曲、强化曲的研究提供了技术支撑,同时也为研究大曲微生物对白酒风格风味的影响奠定了基础。因此,对大曲微生物群落结构的研究有利于更深层次地认识大曲微生物群落结构与功能,揭示固态发酵机理。现有对大曲微生物研究技术主要是基于现代组学技术,如扩增子测序、宏基因组学、宏转录组学、宏蛋白组学、代谢组学等多种组学技术,相较于传统可培养分析方法具有高效、灵敏等多种分析优势。但越来越多的研究表明,使用单一的组学技术并不能完整解析大曲群落微生物多样性,且对环境中特定微生物的研究仍然存在一定不足。因此,未来对大曲的研究方法可采用传统培养方式与非培养方式相结合、多种组学技术相结合的方式进行,为深入挖掘大曲微生物群落结构变化特点、提高大曲质量提供帮助。
[1]张会敏,邢新会,王越,等.浓香型白酒发酵体系中己酸菌的研究进展[J].食品科学,2024,45(9):314-321.
[2]陶敏,李正涛,吴卫宇,等.浓香型大曲微生物群落结构及功能微生物研究进展[J].中国酿造,2023,42(3):8-12.
[3]毛晶晶.浓香型大曲微生物多样性的研究[D].洛阳:河南科技大学,2022.
[4]申孟林,张超,王玉霞.白酒大曲微生物研究进展[J].中国酿造,2016,35(5):1-5.
[5]丁子元,陈玉红,孙玉婷,等.白酒大曲的微生物多样性及其酶类研究进展[J].食品科技,2023,48(3):17-23.
[6]ZHOU Q F,MA K,SONG Y,et al.Exploring the diversity of the fungal community in Chinese traditional Baijiu Daqu starters made at low-,medium-and high-temperatures[J].LWT-Food Sci Technol,2022,162:113408.
[7]周天慈,何宏魁,周庆伍,等.基于高通量扩增子测序技术解析中高温大曲微生物来源[J].食品与发酵工业,2021,47(16):66-71.
[8]LIU S P,ZHOU Y,MA D N,et al.Environment microorganism and mature Daqu powder shaped microbial community formation in mechanically strong-flavor Daqu[J].Food Biosci,2023,52:102467.
[9]张新红,张源.浓香型大曲质量影响因素研究进展[J].生物化工,2020,6(4):118-122.
[10]ZHENG X,TABRIZI M R,NOUT M J R,et al.Daqu-A traditional Chinese liquor fermentation starter[J].J I Brewing,2011,117(1):82-90.
[11]唐清兰,张奶英,徐姿静,等.剑南春酒曲培养过程细菌群落结构变化规律的研究[J].酿酒,2021,48(6):35-41.
[12]ZHU M,ZHENG J,XIE J,et al.Effects of environmental factors on the microbial community changes during medium-high temperature Daqu manufacturing[J].Food Res Int,2022,153:110955.
[13]刘能,何朝玖,陈杰,等.浓香型大曲培菌期主要微生物变化及挥发性风味物质合成影响因素研究[J].酿酒科技,2023(9):17-25,32.
[14]XIAO C,LU Z M,ZHANG X J,et al.Bio-heat is a key environmental driver shaping the microbial community of medium-temperature Daqu[J].Appl Environ Microbiol,2017,83(23):e01550-17.
[15]高志远,程伟,马玉磊,等.金种子浓香型中高温大曲培菌制曲工艺分析与探讨[J].酿酒科技,2016(11):41-45.
[16]YANG Y,WANG S T,LU Z M,et al.Metagenomics unveils microbial roles involved in metabolic network of flavor development in mediumtemperature Daqu starter[J].Food Res Int,2021,140:110037.
[17]KANG J M,CHEN X X,HAN B Z,et al.Insights into the bacterial,fungal, and phage communities and volatile profiles in different types of Daqu[J].Food Res Int,2022,158:111488.
[18]刘仕洋,王玉荣,李学思,等.临沂和周口地区中高温大曲真菌类群比较分析[J].中国酿造,2023,42(11):147-151.
[19]刘婷,陈可丹,黄冰静,等.不同生产环境对特香型大曲的影响[J].中国酿造,2019,38(7):80-84.
[20]张作仪,陈忠军,姜文云,等.内蒙古地区不同中温大曲理化指标与微生物多样性差异研究[J/OL].食品与发酵工业:1-11[2024-06-03].https://doi.org/10.13995/j.cnki.11-1802/ts.039113.
[21]李涛,万自然,刘宇,等.浓香型大曲生产过程中微生物及温度变化规律的研究分析[J].酿酒科技,2023(2):53-56.
[22]杨勇,葛向阳,张龙云,等.基于高通量测序技术解析中高温制曲细菌群落的演替规律[J].酿酒科技,2022(8):34-41.
[23]YANG J G,DOU X,HAN P J,et al.Microbial diversity in Daqu during production of Luzhou flavored liquor[J].J Am Soc Brew Chem,2018,75(2):136-144.
[24]HE M W, JIN Y, ZHOU R Q, et al.Dynamic succession of microbial community in Nongxiangxing Daqu and microbial roles involved in flavor formation[J].Food Res Int,2022,159:111559.
[25]ZENG H W,JIANG X J,WANG Z Q,et al.Environmental and physicochemical characterization and fungal community of two batches of Chinese Luzhou-flavored Daqu[J]. J Am Soc Brew Chem, 2023, 81(1):190-197.
[26]LIU W H,CHAI L J,WANG H M,et al.Bacteria and filamentous fungi running a relay race in Daqu fermentation enable macromolecular degradation and flavor substance formation[J].Int J Food Microbiol,2023,390:110118.
[27]王浩.浓香型大曲发酵过程中微生物群落演替及推动因素研究[D].宜宾:四川轻化工大学,2021.
[28]夏玙.浓香型大曲主发酵阶段微生物群落结构变化及与挥发性化合物的相关性研究[D].宜宾:四川轻化工大学,2019.
[29]肖辰.泸型酒中温大曲微生物群落的演替及其对酒醅发酵的贡献[D].无锡:江南大学,2018.
[30]陈桂芳,王晓慧,赵琦,等.洋河浓香型大曲产香细菌的筛选、鉴定及香气成分分析[J].酿酒科技,2022(5):30-34.
[31]ZHU B F,XU Y,FAN W L.High-yield fermentative preparation of tetramethylpyrazine by Bacillus sp.using an endogenous precursor approach[J].J Ind Microbiol Biot,2010,37(2):179-186.
[32]LI R Y,ZHENG X W,ZHANG X,et al.Characterization of bacteria and yeasts isolated from traditional fermentation starter(Fen-Daqu)through a 1H NMR-based metabolomics approach[J].Food Microbiol,2018,76:11-20.
[33]HE G Q,HUANG J,WU C D,et al.Bioturbation effect of fortified Daqu on microbial community and flavor metabolite in Chinese strong-flavor liquor brewing microecosystem[J].Food Res Int,2020,129:108851.
[34]李兵,张超,王玉霞,等.白酒大曲功能微生物与酶系研究进展[J].中国酿造,2019,38(6):7-12.
[35]赖登燡,林东,王久明,等.浓香型白酒“增己降乙”与酿酒工艺的关联性研究[J].酿酒,2021,48(1):3-11.
[36]刘冉,周英昊,邵玲智.酱香型白酒大曲中微生物菌群分析[J].中国食品工业,2022(6):97-99.
[37]刘延波,唐艳彦,赵志军,等.张弓老酒大曲中高产酯化酶细菌的分离筛选及产酶条件优化[J].甘肃农业大学学报,2021,56(2):150-159.
[38]LIU Y B,FU J Y,WANG L L,et al.Isolation,identification,and wholegenome sequencing of high-yield protease bacteria from Daqu of Zhang Gong Laojiu[J].PLOS One,2022,17(4):e264677.
[39]YANG Y,WANG S T,LU Z M,et al.Metagenomics unveils microbial roles involved in metabolic network of flavor development in mediumtemperature Daqu starter[J].Food Res Int,2021,140:110037.
[40]梁敏华,赵文红,白卫东,等.白酒酒曲微生物菌群对其风味形成影响研究进展[J].中国酿造,2023,42(5):22-27.
[41]LIU Y B, LI X, LI H D, et al.Taorong-type Baijiu starter: Analysis of fungal community and metabolic characteristics of middle-temperature Daqu and high-temperature Daqu[J].PLOS One,2022,17(10):e274881.
[42]贺奕森.浓香型白酒大曲中霉菌的分离鉴定及应用[D].邯郸:河北工程大学,2023.
[43]雷少楠,徐柏田,林培,等.特香型大曲表面毛霉对大曲与基酒质量的影响[J].中国酿造,2020,39(6):111-114.
[44]严伟,吴生文,刘建文,等.染青霉菌大曲对特香型白酒质量和产量影响的研究[J].酿酒科技,2013(11):40-43.
[45]刘鸿.青霉和链霉菌在浓香型大曲酒发酵中作用的研究[D].武汉:湖北工业大学,2011.
[46]王西,邓小鹏,万倩,等.中高温大曲表面霉菌分离鉴定与控制研究[J].中国酿造,2024,43(3):90-94.
[47]WANG J W,HAN P J,HAN D Y,et al.Genetic diversity and population structure of the amylolytic yeast Saccharomycopsis fibuligera associated with Baijiu fermentation in China[J].J Microbiol,2021,59(8):753-762.
[48]凌荔,牟飞燕,袁萌,等.清香型白酒大曲研究进展[J].酿酒,2022,49(6):17-22.
[49]唐涛.浓香型白酒大曲中酵母菌的分离鉴定及强化大曲的制备[D].邯郸:河北工程大学,2023.
[50]PU S C, ZHANG Y, LU N, et al.Yeasts from Chinese strong flavour Daqu samples: isolation and evaluation of their potential for fortified Daqu production[J].AMB Express,2021,11(1):176.
[51]CHEN C,YANG H Q,LIU J,et al.Systematic review of actinomycetes in the Baijiu fermentation microbiome[J].Foods,2022,11(22):3551.
[52]WANG Y R,CAI W C,WANG W P,et al.Analysis of microbial diversity and functional differences in different types of high-temperature Daqu[J].Food Sci Nutr,2021,9(2):1003-1016.
[53]HUANG Y H,YI Z L,JIN Y L,et al.New microbial resource:microbial diversity, function and dynamics in Chinese liquor starter[J]. Sci Rep,2017,7(1):14577.
[54]苑建伟,崔梦娇,侯小歌,等.宋河大曲放线菌的分离鉴定及其混菌作用[J].食品工业,2023,44(3):172-175.
[55]ZHANG Q M,DU G C,CHEN J,et al.Systematic analysis of Baobaoqu fermentation starter for Wuliangye Baijiu by the combination of metagenomics and metabolomics[J].Front Microbiol,2022,13:1062547.
[56]ZHAO J Z, YANG Y, CHEN L Q, et al.Quantitative metaproteomics reveals composition and metabolism characteristics of microbial communities in Chinese liquor fermentation starters[J]. Front Microbiol,2023,13:1098268.
[57]ZHAO J,GAO Z F.Analysis of the Physicochemical properties and microbial composition of Fenjiu Daqu during Daqu making processes[J].J Biobased Mater Bio,2022,16(6):848-857.
[58]REN H W,SUN Y F,YANG Y F,et al.Unraveling the correlations between microbial communities and metabolic profiles of strong-flavor Jinhui Daqu with different storage periods[J].Food Microbiol,2024,121:104497.
[59]孙亮霞,王生艳,林一心,等.中高温大曲贮存期间理化指标及微生物群落动态分析[J/OL].食品与发酵工业:1-9[2024-06-03].https://doi.org/10.13995/j.cnki.11-1802/ts.039052.
[60]曾波,饶家权,邹永芳,等.浓香型白酒酒醅发酵过程中微生物群落结构演替及其与理化指标相关性[J].食品科学,2024,45(7):111-118.