红曲色素是经红曲霉菌发酵而成的天然色素,主要包括:红色调的红斑红曲胺(rubropunctamine)和红曲玉红胺(monascorubramine);黄色调的红曲素(monascin)和安卡黄素(ankaflavin);橙色调的红斑红曲素(rubropunctatin,O1)和红曲玉红素(monascorubrin,O2);皆为醇溶性红曲色素[1]。目前,已有一百余种红曲色素成分被报道[2]。在食品工业中,作为性质优良的着色剂得到广泛使用;同时,红曲色素被认为是食品添加剂亚硝酸盐更安全的替代品,广泛应用于肉制品等食品的生产过程中,具有历史悠久、消费者接受度高等优势[3]。
红曲中含有多种有效成分,具有不同的功能效用[4-6];我国《天工开物》一书中提到,以红曲薄涂于鱼与肉表面,可在短时间内保证其品质,防止腐败。可见,红曲中存在能抑制微生物生长的有效成分。2011年,赵树欣等[7]对红曲中抑菌物质的种类进行阐述,提到红曲中存在的具有抑菌功效的成分,例如红曲色素、桔霉素以及糖肽类物质等。关于红曲色素抑菌的研究性文献报道,可追溯到WONG H C等[8-9]研究发现,Monascidin A的抑菌能力,其文中简略地提到一种未知的橙色素具有相比于Monascidin A较微弱的抑菌活性;而Monascidin A后被证实是具有肾毒性的桔霉素[10-12],因此,关于红曲发酵产品的抑菌活性评价研究需要排除桔霉素的存在;研究表明排除桔霉素存在的红曲色素仍存在较显著的抑菌效果。MUKHERJEE G等[13]从紫红曲霉(Monascuspurpureus)NFCCI1756培养液中分离纯化得到一种新的红曲色素组分,发现其对枯草芽孢杆菌(Bacillus subtilis)在内的革兰氏阳性菌有抑制活性,而对伤寒沙门氏菌(Salmonella typhi)和大肠杆菌(Escherichia coli)在内的革兰氏阴性菌不能抑制。另外,基于红曲橙色素的嗜氮酮结构,其与伯胺可发生胺化反应,形成红曲橙色素衍生色素[14]。VENDRUSCOLO F等[15]通过红色红曲霉(Monascus ruber)CCT 3802液态发酵获得红曲橙色素和红色素,并利用橙色素与甘氨酸反应制备橙色素衍生色素,抑菌结果可见,橙色素、红色素以及衍生色素皆可抑制金黄色葡萄球菌(Staphy lococcus aureus)的生长,但对肠炎沙门氏菌(Salmonella enteritidis)均无抑制效果。可见,各实验室对红曲色素抑菌活性的评价结果存在差异;由于红曲色素生产受发酵菌株及发酵条件的影响较大[16];在不能分离纯化单一抑菌物质的条件下进行抑菌实验,不能保证不同实验室所使用的红曲色素成分一致;从复杂的红曲色素混合物中分离并纯化色素单体,定量评价其抑菌活性,才能为进一步定向开发高活性、高安全性的抑菌色素分子奠定基础。
经过发酵、提取和纯化所得的橙色素与含氮化合物进行非酶催化的胺化反应,可得到稳定性较好的红色调的红曲橙色素衍生物[17]。因此,本研究选择结构相对简单的伯胺化合物——乙醇胺,与2种经典的红曲橙色素进行胺化反应,形成红曲橙色素乙醇胺衍生色素,通过制备型薄层色谱(preparative thin-layer chromatography,PTLC)对两种衍生物进行分离纯化,经高效液相色谱(high-performance liquid chromatography,HPLC)、液相色谱-质谱联用(liquid chromatography-mass spectrometry,LC-MS)、核磁共振(nuclear magnetic resonance,NMR)技术分析两种衍生色素的相对分子质量、分子式及分子结构,并通过抑菌圈法评价了橙色素和两种衍生色素的抑菌活性,以期对红曲色素抑菌方面的研究产生启发和推动。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
红曲橙色素—红斑红曲素(O1)和红曲玉红素(O2):实验室自行发酵、提取纯化所得。
金黄色葡萄球菌(Staphylococcus aureus)ATCC 25923、单核细胞增生李斯特菌(Listeria monocytogenes)ATCC 19115、肠炎沙门氏菌(Salmonella enteritidis)BNCC103134、大肠杆菌(Escherichia coli)ATCC 8739、鲁氏酵母(Saccharomyces rouxii):天津科技大学食品科学与工程学院发酵食品与新资源开发实验室保藏。
1.1.2 试剂
无水乙醇、氯化钠(均为分析纯):天津市江天化工技术有限公司;乙腈(色谱纯):天津市康科德科技有限公司;甲酸(色谱纯):天津市光复精细化工研究所;超纯水由Milli-Q超纯水系统净化处理所得;氘代氯仿、氘代甲醇(均为分析纯):美国Sigma公司;乙醇胺(分析纯)、胰蛋白胨、酵母浸粉、琼脂粉(均为生化试剂)、二甲基亚砜(分析纯):北京索莱宝科技有限公司。
1.1.3 培养基
LB肉汤培养基:胰蛋白胨10 g/L,酵母浸粉5 g/L,NaCl 10 g/L,蒸馏水1 000 mL。121 ℃高压蒸汽灭菌20 min。LB固体培养基:在LB肉汤培养基中添加琼脂15 g/L。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基:酵母浸粉10 g/L,蛋白胨20 g/L,蒸馏水950 mL;另配制40%葡萄糖水溶液50 mL,需与上述物质分开灭菌,待使用时混合。
YPD固体培养基:YPD液体培养基中加入琼脂15 g/L,121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
RE-2000A旋转蒸发器:上海亚荣生化仪器厂;Agilent 8453 紫外可见分光光度计、Agilent 1200高效液相色谱仪:安捷伦科技(中国)有限公司;LCMS-IT-TOF液相色谱质谱联用仪:日本岛津科技公司;AVANCE III HD 400M核磁共振波谱仪:瑞士布鲁克科技公司;DGG-101-2BS电热鼓风干燥箱:天津市天宇实验仪器有限公司;DSX-30L-I手提式高压蒸汽灭菌器:上海申安医疗器械厂;SW-CJ-1FD型单人单面净化工作台:苏州净化设备有限公司;ZHWY-100C恒温摇床:上海智城分析仪器制造有限公司;BSM-220.3S电子天平:上海卓精电子科技有限公司。
1.3 实验方法
1.3.1 红曲橙色素衍生物的转化和制备方法
取红曲橙色素—红斑红曲素(O1)和红曲玉红素(O2)各20 mg溶于少量乙腈中,超声促进溶解。色素与乙醇胺摩尔比1∶1计算乙醇胺用量,添加至橙色素溶液中,超声促进混合,于常温下反应;期间使用薄层色谱(thin-layer chromatography,TLC)监测反应进程。
反应结束之后,将反应物置于烘箱中50 ℃干燥,使用甲醇复溶,以制备型薄层色谱(PTLC)进行分离纯化,展开剂为二氯甲烷∶甲醇=25∶1(V/V)。待色素展开后,刮取硅胶板上目的条带,料液比1∶20(g∶mL)用丙酮数次提取至硅胶无颜色,离心得到上层提取液,40 ℃旋蒸浓缩,转移至棕色玻璃小瓶中,常温挥干有机溶剂,得到红曲橙色素乙醇胺衍生色素:O1与乙醇胺反应生成的衍生色素简称为RA,O2与乙醇胺反应衍生色素简称为RB。
1.3.2 衍生色素的结构表征
高效液相色谱分析衍生色素的纯度及光谱特征。HPLC色谱条件如下:COSMOSIL Cholester色谱柱(4.6 mm×250 mm,5 μm);二极管阵列检测器(diode array detector,DAD);流动相:A相(0.1%甲酸水)和B相(乙腈);进样量20 μL,流速1.0 mL/min;柱温25 ℃;梯度洗脱程序见表1。
表1 高效液相色谱洗脱程序
Table 1 Elution procedure of high performance liquid chromatography

时间/min A相 B相0~12 12~25 25~27 27~30 40%40%~10%10%10%~40%60%60%~90%90%90%~60%
液相色谱-质谱联用分析衍生色素的相对分子质量以及预测分子式。LC-MS色谱条件如下:ZORBAX Eclipse Plus-C18色谱柱(4.6 mm×150 mm,3.5 μm);流动相:A相(0.1%甲酸水)和B相(乙腈);二极管阵列检测器(DAD);检测方法:梯度洗脱方法同高效液相色谱分析方法。
核磁共振波谱分析衍生色素的分子结构:以氘代甲醇(MeOD)和氘代氯仿(CDCl3)为溶剂,以四甲基硅烷(tetramethylsilane,TMS)为内标,利用核磁共振波谱仪对制备的两种衍生色素进行扫描,得到相关的氢谱(1H NMR)和碳谱(13C NMR),NMR数据使用MestReNova 14.0进行分析。
1.3.3 抑菌活性评价
采用抑菌圈法测定O1、O2及2种衍生色素的抑菌活性。取保存菌种斜面于LB平板划线分离得到单菌落,挑取单菌落接种于LB肉汤培养基中37 ℃、180 r/min条件下振荡培养24 h得到培养菌液,以无菌水梯度稀释培养菌液得到不同浓度的菌悬液。取100 μL各浓度菌悬液均匀涂布于数个LB平板,37 ℃静置培养24 h后记录菌落生长数,确定合适的稀释倍数。
使用LB琼脂培养基倒入90 mm培养皿中制备检测平板。在培养皿的琼脂表面接种100 μL试验菌的无菌水悬浮液。用直径8 mm牛津杯于平板制4孔,其中3孔各添加100 μL的1 mg/mL色素的二甲基亚砜(dimethyl sulfoxide,DMSO)样品溶液,1孔添加100 μL的DMSO做空白对照,并置于恒温培养箱37 ℃下培养24 h。培养结束后,取出测量记录抑菌圈直径,抑菌圈直径包括孔的直径;以抑菌圈直径>12 mm表明抑菌活性较强[18]。
测试2种衍生色素对鲁氏酵母抑菌活性时,上述方法所用LB琼脂培养基替换为YPD固体培养基。
2 结果与分析
2.1 红曲橙色素衍生色素的结构分析
由于红曲橙色素特殊的嗜氮酮结构,在接触伯胺化合物时,发生胺化反应,产生红曲橙色素衍生物[2,14,19]。早在1992年LIN T F等[20]就通过生物和化学半合成法制备了红曲橙色素的谷氨酸、甘氨酸及亮氨酸的水溶性红曲色素,并提出形成橙色素氨基酸衍生物的反应步骤。LIU L J等[21-23]阐述了红曲橙色素与含氮化合物的化学半合成反应过程。红曲橙色素—红斑红曲素(O1)和红曲玉红素(O2)分别与乙醇胺反应获得了两种衍生色素RA和RB,反应过程见图1。
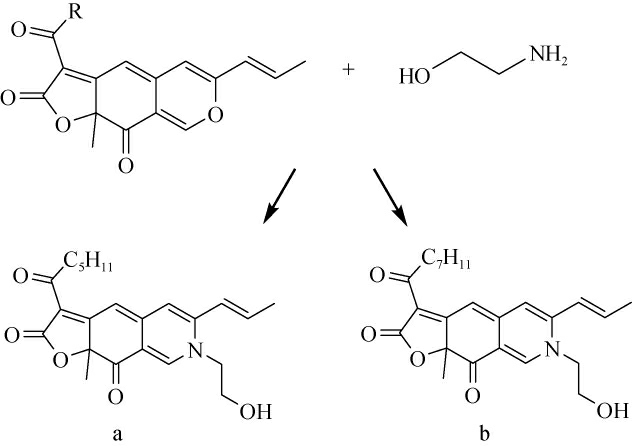
图1 红曲橙色素与乙醇胺反应过程
Fig.1 Reaction process of Monascus orange pigments with ethanolamine
R=C5H11,O1;R=C7H15,O2;(a)为RA结构;(b)为RB结构。
由图1可知,常温下,红曲橙色素与乙醇胺发生化学反应,且速度较快,肉眼可见反应溶液由橙红色转变为红色;且制备所得的RA、RB均为红色无定形固体、醇溶性色素,水溶性较差。
由图2可知,经HPLC检测,RA与RB的保留时间分别为5.464 min与9.068 min;两衍生色素均在波长300 nm、420 nm及530 nm附近有特征吸收峰,符合红曲红色素的特征吸收光谱特点[3,18]。
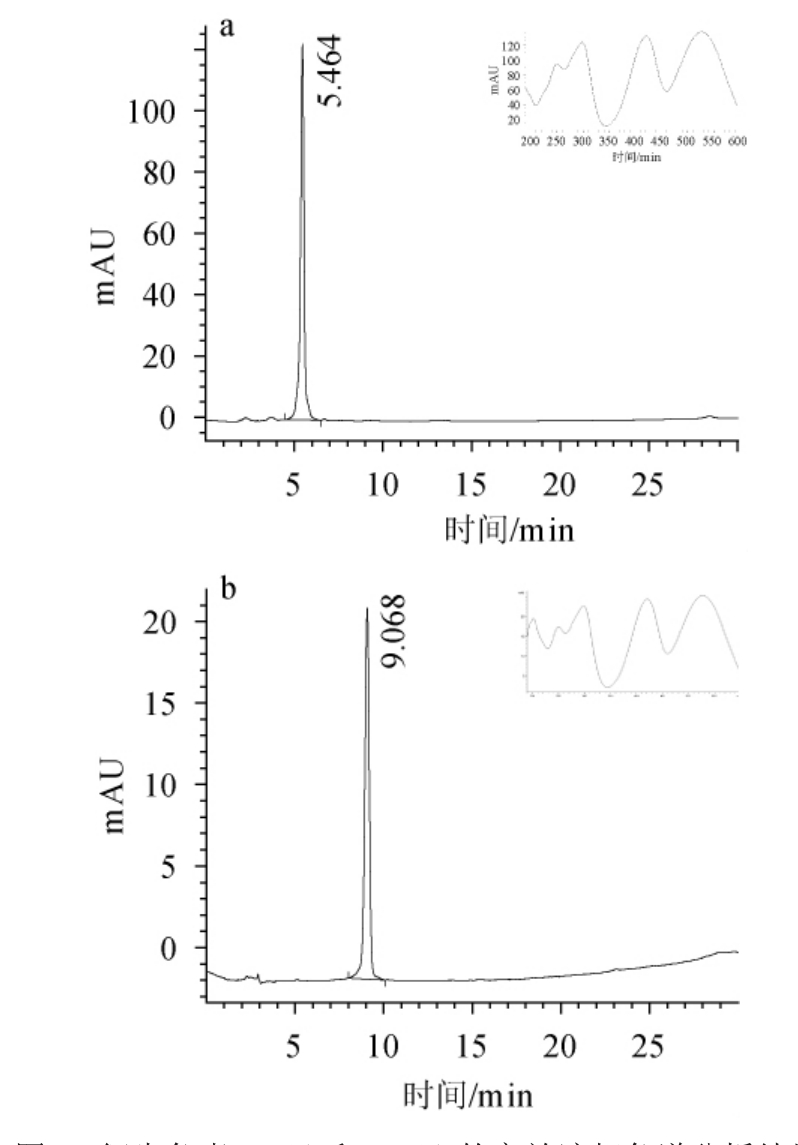
图2 衍生色素RA(a)和RB(b)的高效液相色谱分析结果
Fig.2 High performance liquid chromatography analysis results of derived pigments RA (a) and RB (b)
高分辨质谱能够以非常高的精确度测定待分析物质的离子质荷比(m/z),提供分子的精确质量信息,从而可预测待分析物质的分子式[24-25]。衍生色素RA(a)和RB(b)一级正离子质谱信息见图3。由图3可知,离子源为电喷雾电离(electrosprayionization,ESI),正离子离子化模式获得的高分辨质谱检测数据显示:RA的分子离子加氢峰[M+H]+为m/z 398.196 0,预测其分子式为C23H27NO5,分子质量为397 Da;RB的分子离子加氢峰[M+H]+为m/z 426.227 6,预测其分子式为C25H31NO5,分子质量为425 Da。
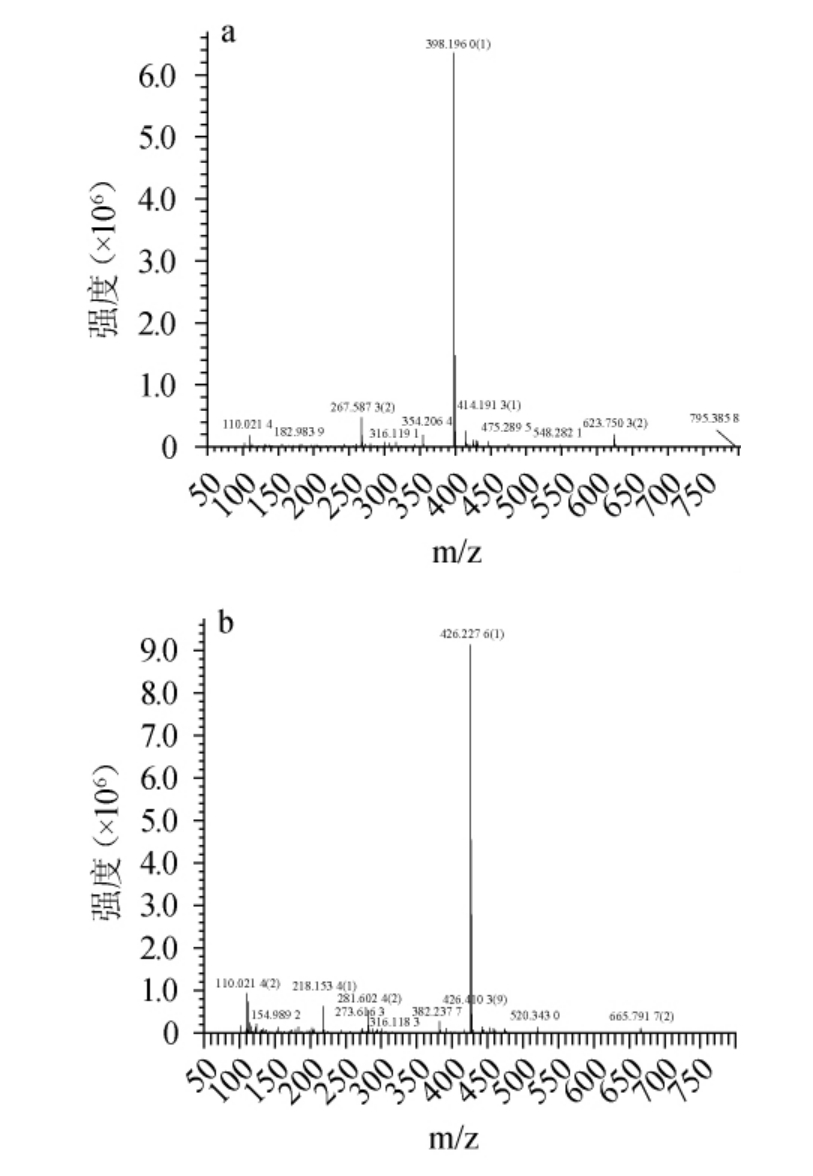
图3 衍生色素RA(a)和RB(b)的质谱图
Fig.3 Mass spectra of derived pigments RA (a) and RB (b)
化合物RA与RB的1H NMR和13C NMR结果见图4。由图4a可知,RA:1H NMR(400 MHz,MeOD)δ 8.21(1H,s),7.11(1H,s),6.75-6.60(3H,m),4.27-4.28(2H,m),3.83-3.85(2H,m),3.58-3.63(1H,m),2.78-2.83(2H,m),2.00(3H,d,J=5.6 Hz),1.63(3H,s),1.58-1.62(2H,m),1.30-1.36(4H,m),0.86(3H,t,J=6.8 Hz);13C NMR(100 MHz,CD3OD)δ 198.71,196.22,173.74 153.56,152.14,144.65,141.71,123.30,119.33,118.92,102.2,98.95,86.90,60.97,58.13,41.26,32.89,30.61,26.03,23.60,19.21,16.87,14.34。
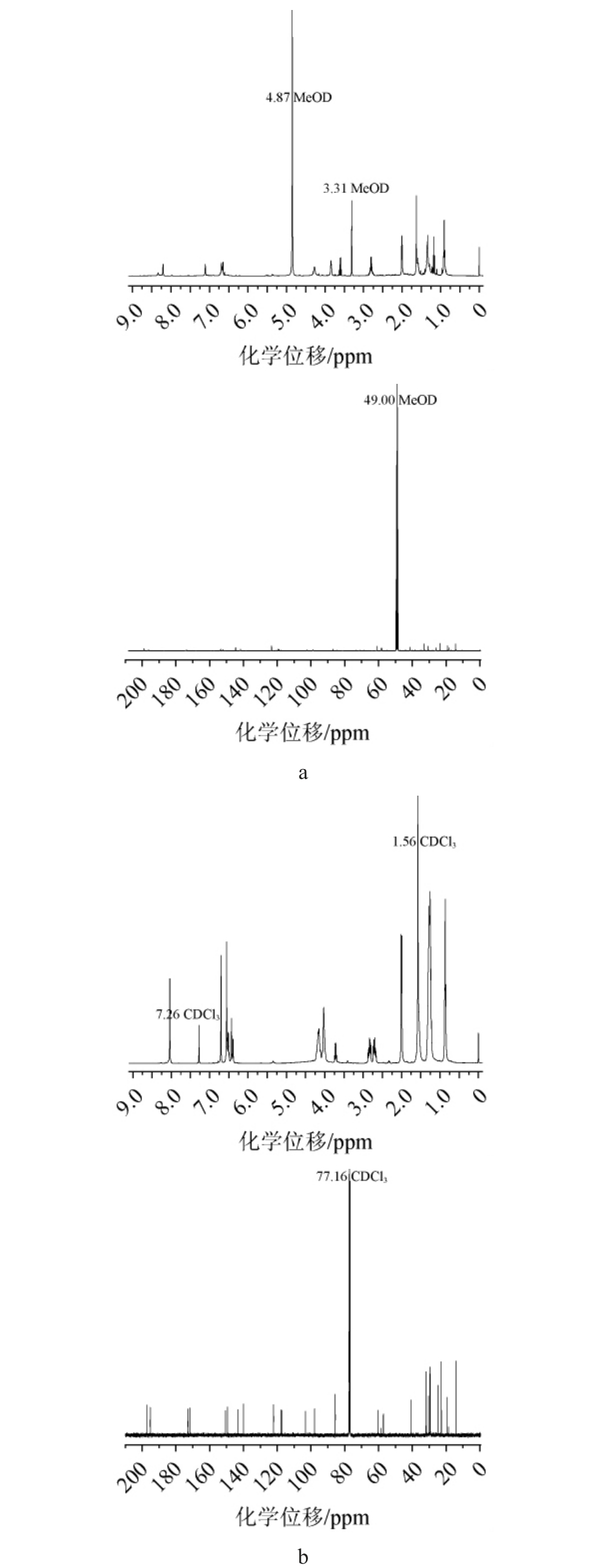
图4 衍生色素RA(a)和RB(b)的氢谱图与碳谱图
Fig.4 1H and 13C NMR spectra of derived pigments RA(a)and RB(b)
由图4b可知,RB:1H NMR(400 MHz,CDCl3)δ 8.03(1H,s),6.70(1H,s),6.60-6.38(3H,m),4.14-4.19(2H,m),4.00-4.04(2H,m),3.70-3.74(1H,m),2.68-2.85(2H,m),2.00(3H,dd,J=1.4,6.7 Hz),1.58(3H,s),1.52-1.54(2H,m),1.24-1.31(8H,m),0.86(3H,t,J=7.1 Hz);13C NMR(100 MHz,CD3OD)δ 196.98,195.10,172.76,171.55,150.61,149.32,143.00,139.94,122.07,117.79,117.18,103.18,97.81,85.54,60.30,57.05,40.72,31.79,30.25,29.53,29.28,24.72,22.66,19.23,14.12。
结合文献[26]关于橙色素的NMR的记录,比较RA与O1的氢谱数据差异在于,RA增加了三组氢化学位移信息:δ 4.27-4.28(2H,m),3.83-3.85(2H,m),3.58-3.63(1H,m);RB比O2的氢谱数据同样也增加了三组氢化学位移信息:δ 4.14-4.19(2H,m),4.00-4.04(2H,m),3.70-3.74(1H,m)。RA和RB较O1和O2增加的三组氢化学位移代表了胺化反应后接枝上的乙醇胺残基的5个氢核磁信号。因此,O1、O2与乙醇胺发生胺化反应形成的RA、RB,其结构表征与推测结构一致。
GUO X Y等[27]从红曲霉菌中分离得到两种红色素R-3与R-4,经比较,是与RA、RB结构相同的色素成分。此结果说明,RA与RB是可由红曲霉菌合成产生的天然色素。通过红曲橙色素与乙醇胺发生胺化反应,化学半合成方法获得的RA和RB是天然等同的红色素。
2.2 抑菌活性比较
橙色素及其衍生色素的抑菌结果如表2所示,在1mg/mL的质量浓度下,除RA外,橙色素及RB对革兰氏阳性(G+)菌金黄色葡萄球菌和单增李斯特菌展现了较强的抑制活性,而将RA试样的质量浓度增加至4 mg/mL时,才对上述两种G+菌产生了抑制性(结果未展示);说明O1与乙醇胺的衍生色素抑菌活性大幅降低。同时,橙色素及衍生色素都对革兰氏阴性(G-)菌肠炎沙门氏菌、大肠杆菌以及真菌鲁氏酵母没有抑制效果;这与VENDRUSCOLO F等[15]对橙色素抑菌评价的研究结果基本一致。但该研究所用的橙色素质量浓度为10 mg/mL时才对金黄色葡萄球菌产生抑制,且对肠炎沙门氏菌和大肠杆菌无抑制活性。推测此橙色素可能不是单一的O1或O2成分,有效的抑菌物质含量较低。
表2 橙色素O1、O2、衍生色素RA、RB对供试菌的抑菌活性评价结果
Table 2 Evaluation results of antimicrobial activities of orange pigment O1 and O2, derived pigments RA and RB against the tested microorganisms
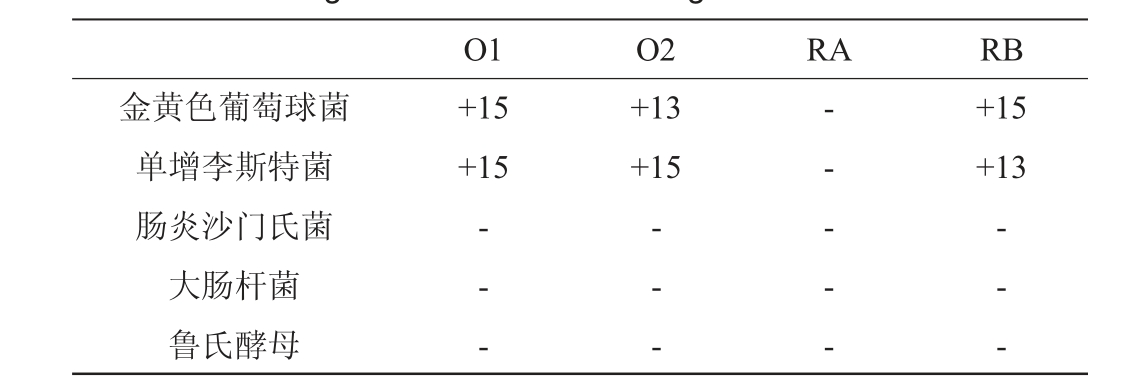
注:“-”表示无抑菌圈,“+”表示存在明显抑菌圈,数字为抑菌圈直径,单位为mm。
O1 O2 RA RB金黄色葡萄球菌单增李斯特菌肠炎沙门氏菌大肠杆菌鲁氏酵母+15+15+13+15+15+13-- --- --- - - --- -
此外,研究人员还通过橙色素与甘氨酸反应获得了橙色素衍生色素,在比较橙色素和衍生色素的抑菌活性时发现,橙色素对金黄色葡萄球菌的抑制能力更强,而衍生色素抑制能力较弱,最低抑菌浓度(minimum inhibitory concentration,MIC)为40mg/mL。但以大肠杆菌为供试菌时,橙色素无抑菌性,衍生色素的MIC为20 mg/mL。该研究结果显示橙色素对金黄色葡萄球菌的抑制活性强于其衍生红色素,但衍生红色素的抑菌范围更大。MARTÍNKOVÁ L等[28]使用橙色素与氨、赖氨酸分别反应获得衍生色素,并与橙色素抑菌活性进行比较,结果发现,橙色素的抑菌活性最强,氨衍生色素次之,而赖氨酸衍生色素则无抑制活性。
KIM C等[29]采用发酵法制备了39种L型和D型氨基酸红曲色素衍生色素,发现含有L-Phe、D-Phe、L-Tyr和D-Tyr残基的衍生色素对G+菌和G-菌均表现出高活性,MIC值在4~8 μg/mL的范围内;含L-Asp、D-Asp、L-Tyr和D-Tyr残基的衍生色素对黑曲霉、桔青霉和白色念珠菌也有较好的抑制作用。Nisin被公认为是一种革兰氏阳性菌的抑制剂,实验以乳酸链球菌素(Nisin)作为阳性对照,对革兰氏阴性菌、酵母菌及霉菌几乎或根本不具有活性[30-31];而该文献中关于Nisin抑菌结果显示其对大肠杆菌等G-菌的MIC值在16~32 μg/mL范围内。因此,关于该文献报道的红曲衍生色素表现出的高抑菌活性和广泛的抑菌谱结果值得进一步推敲验证。
关于红曲色素是如何作用于细菌而发挥抑菌活性的,KIM C等[29]研究认为,色素衍生物的抑菌活性与被色素吸附的细胞的氧气利用率降低有关;MAJHI S等[32]研究认为,红曲色素提取物的抑菌活性是由于其对菌体细胞膜的破坏。综上所述,受限于研究深度、不同实验室使用的色素成分以及实验用菌的不同,关于红曲色素的抗菌机理仍不十分清晰。
随着人们对健康问题的日益关注,化学防腐剂在市场上逐渐不受欢迎,传统的天然防腐剂的优势十分明显[33]。红曲的食用历史悠久,安全性高,作为着色剂,GB 2760—2024《食品安全国家标准食品添加剂使用标准》关于红曲的添加量在大部分应用场景无严格的限定(按生产需要适量使用),但在焙烤食品馅料及表面挂浆应用时限定了其最大使用量低于1 mg/kg,使用原则上强调达到预期效果的前提下,尽量降低其使用量。鉴于红曲色素良好的着色功能,在挖掘其抑菌活性功能时,必需同时兼顾其着色能力可能限制其添加量的实际应用问题。因此,本研究在红曲色素RA和RB的抑菌活性评价剂量上选择1 mg/mL作为起始筛选浓度。虽然红曲橙色素抑菌活性较高,但由于其与伯胺容易发生非酶催化的胺化反应,若开发其作为食品防腐剂使用时,由于其嗜氮酮的特殊结构会与食材中丰富的游离氨基酸、肽等含氮化合物反应,生成的部分衍生色素可能丧失了抑菌活性,导致防腐效果的下降。以本研究的RA为例,其抑菌活性远低于O1。
红曲橙色素与各种伯胺化合物发生胺化反应,可大量合成多种类的红曲色素衍生色素,且此类衍生色素很可能天然存在于红曲发酵制品中[23-24]。针对此类衍生色素库进行抑菌活性评价,分析其抑菌能力及抑菌谱,对母核进行一定的结构修饰,有望发现抑菌活性更强的红曲衍生色素,并将其开发成兼具着色和防腐活性的功能色素,应用于食品行业。
3 结论
本研究针对红曲橙色素的嗜氮酮结构特性,使用红斑红曲素(O1)、红曲玉红素(O2)与乙醇胺发生胺化反应,合成了两个衍生红色素—RA与RB;通过结构表征分析,确定了RA与RB化学式分别为C23H27NO5、C25H31NO5,分子质量分别为397 Da、425 Da,结构差异只存在于烷基链上,RA与RB也存在于天然红曲发酵产物中,是天然等同红色素。抑菌活性评价结果显示,1 mg/mL的O1、O2与RB的抑菌能力较强,RA的抑菌能力显著降低,说明分子结构较小的差异即会引起抑菌能力的显著变化。因此,以红曲橙色素O2为先导化合物,通过与乙醇胺发生非酶催化的定向胺化反应,生产抑菌活性较高的RB,可克服红曲橙色素直接应用于食材中,由于不定向胺化可能导致的抑菌活性降低的后果。
[1]FENG Y L, SHAO Y C, ZHOU Y X, et al. Monascus pigments[J].Ind Biotech Vitam, Biopigments, Antioxidants,2016:497-535.
[2]DUAN Y L,JIA L L,PEI X L,et al.An efficient microbial-based method for production of high-purity Monascus azaphilones pigments[J].LWTFood Sci Technol,2022,170:114053.
[3]CHEN W P,CHEN R F,LIU Q P,et al.Orange,red,yellow:biosynthesis of azaphilone pigments in Monascus fungi[J].Chem Sci,2017,8:4917-4925.
[4]周香珍,林书发,何书华.红曲药学评价研究进展[J].中国现代中药,2016,18(7):6.
[5]NING S L, WANG C C, ZHAO L, et al.Lecithin/chitosan nanoparticle drug carrier improves anti-tumor efficacy of Monascus pigment rubropunctatin[J].Int J Biol Macromol,2023,242(3):125058.
[6]HUANG Y F, FU R Y, YIN W X, et al.Metabolites analysis and new bioactive pigments from a Monascus purpureus strain with low citrinin[J].Microchem J,2023,195:109441.
[7]赵树欣,张建玲.红曲抑菌物质研究的现状与展望[J].中国酿造,2011,30(3):5-8.
[8]WONG H C, BAU Y S.Pigmentation and antibacterial activity of fast neutron-and X-ray-induced strains of Monascus purpureus Went[J].Plant Physiol,1977,60(4):578-581.
[9]WONG H C, KOEHLER P E, Production and isolation of an antibiotic from Monascus purpureus and its relationship to pigment production[J].J Food Sci,1981,46(2):589-592.
[10]BLANC P J,LAUSSAC J P,BARS J L,et al.Characterization of monascidin A from Monascus as citrinin[J].Int J Food Microbiol,1995,27(2-3):201-213.
[11]SHI J,QIN X L,ZHAO Y R,et al.Strategies to enhance the production efficiency of Monascus pigments and control citrinin contamination[J].Process Biochem,2022,117:19-29.
[12]QIN X L,XIE B,ZONG X L,et al.Selective production,relationship and controversy between Monascus pigments and citrinin[J].Food Biosci,2023,56:103233.
[13]MUKHERJEE G, SINGH S K.Purification and characterization of a new red pigment from Monascus purpureus in submerged fermentation[J].Process Biochem,2011,46(1):188-192.
[14]HUANG Y L,LIU L J,ZHENG G W,et al.Efficient production of red Monascus pigments with single non-natural amine residue by in situ chemical modification[J].World J Microb Biot,2019,35(1):13.
[15]VENDRUSCOLO F,TOSIN I,GIACHINI A J,et al.Antimicrobial activity of Monascus pigments produced in submerged fermentation[J].J Food Process Preserv,2014,38(4):1860-1865.
[16]TONG A J, LU J Q, HUANG Z R, et al.Comparative transcriptomics discloses the regulatory impact of carbon/nitrogen fermentation on the biosynthesis of Monascus kaoliang pigments[J].Food Chem,2022,13:100250.
[17]HE L M,LIU C,CHEN S,et al.Precursor-directed production of watersoluble red Monascus pigments with high thermal stability via azaphilic addition reaction-based semi-synthesis[J].Food Chem,2023,20:100940.
[18]张雪静,牛红红,苗欣宇,等.自然发酵玉米液中乳酸菌的分离、鉴定及益生特性研究[J].中国酿造,2023,42(8):129-134.
[19]XIE H X, HUANG Z F, SHI K, et al.Color vibrancy enhancement of water-soluble Monascus yellow pigments through a two-step derivation with double sulfonic groups[J].Food Biosci,2024,58:103653.
[20]LIN T F,YAKUSHIJIN K,BÜCHI G H,et al.Formation of water-soluble Monascus red pigments by biological and semi-synthetic processes[J].J Ind Microbiol Biot,1992,9(3-4):173-179.
[21]LIU L J, ZHENG J W, ZHANG X H, et al.Interfacing a phosphate catalytic reaction with a microbial metabolism for the production of azaphilone alkaloids[J].React Chem Eng,2020,5(11):2048-2052.
[22]WU S,LIU L J,ZHANG X H, et al.Submerged culture of Penicillium sclerotiorum for production of rotiorin alkaloids by using biosynthetic and chemical catalytic cascade reactions[J].Process Biochem,2021,104:10-18.
[23]XUE Y X, WANG L, ZHANG X H, et al.Terminal carboxylation of branched carbon chain contributing to acidic stability of azaphilone pigments from a new isolate of Talaromyces amestolkiae[J].Food Chem,2023,424:136338.
[24]YUAN D D,BAI G H,LIU Y H,et al.A novel edible colorant lake prepared with CaCO3 and Monascus pigments: Lake characterization and mechanism study[J].Food Chem,2023,410(2):135408.
[25]LIU L J,WU S,WANG W,et al.Sulfonation of Monascus pigments to produce water-soluble yellow pigments[J].Dyes Pigments,2020, 173:107965.
[26]许雅雯.红曲Monascus purpureus NTU 568 发酵产物中防癌及其相关活性成分之研究[D].台北:国立台湾大学,2011.
[27]GUO X Y,ATEHLI D,CHEN M H,et al.A Zn(II)(2)Cys(6)transcription factor MPsGeI suppresses pigment biosynthesis in Monascus[J].Int J Biol Macromol,2023,233:123504.
[28]MARTÍNKOVÁ L, ZLOVÁ P J, VESELY′ D.Biological activity of polyketide pigments produced by the fungus Monascus[J].J Appl Microbiol,1995,79(6):609-616.
[29]KIM C,JUNG H,KIM Y O,et al.Antimicrobial activities of amino acid derivatives of Monascus pigments[J].Fems Microbiol Lett,2006,264(1):117-124.
[30]MAACZEWSKA J, KACZOREK-ŁUKOWSKA E.Nisin-A lantibiotic with immunomodulatory properties: A review[J].Peptides, 2021, 137:170479.
[31]李津津,匡珍,徐春霞,等.Nisin Z复配剂对常见食源性致病菌的协同抑菌作用[J].中国食品学报,2021,21(4):114-121.
[32]MAJHI S,DHALE M A,PUTTANANJAIAH M H.Inhibitory effect of Monascus purpureus pigment extracts against fungi and mechanism of action[J].Front Sustain Food Syst,2023,7:1100961.
[33]SHEN N,REN J N,LIU Y X,et al.Natural edible pigments:A comprehensive review of resource,chemical classification,biosynthesis pathway,separated methods and application[J].Food Chem,2023,403:134422.