大曲是白酒生产的糖化剂、发酵剂和生香剂,高温大曲在酱香型白酒发酵中起着关键作用,决定了最终产品的质量[1]。酱香型高温大曲是以小麦为原料,经粉碎拌水后压制成砖块状的曲坯,在曲房进行发酵培养,期间需要控温控湿,出仓后储存一段时间后才能用于白酒酿造[2]。在酱香型高温大曲生产过程中,不同的发酵微环境对大曲的微生态有很大的影响,从而影响其发酵性能和代谢[3]。传统的高温大曲制作主要采用人工操作,存在劳动强度大、生产成本高、生产效率低等缺点,加之由于人工踩曲的开放性,必然会受到操作因素的影响,使得大曲质量难以稳定。近年来,随着传统酿造技术的不断提升,高温大曲机械化制曲进程也在不断推进,机械制曲通过模仿人工脚掌踩曲动作,采用独创气缸两阶段多次踩曲技术代替传统人工脚掌踩曲的操作,大大提高了高温大曲质量稳定性及生产效率,降低了劳动强度及生产成本,大曲机械化生产虽提高了产量,但质量也有待提高[4]。
目前,对机械化和人工制曲的研究还较少。郭敏[5]通过高通量测序技术对某酱香型企业人工及机械制曲从入仓曲到出仓曲整个阶段的微生物及理化因子进行研究,结果表明,传统和机械化制曲在微生物层面没有明显的差异。谭映月等[6]应用聚合酶链式反应-变性梯度凝胶电泳(polymerase chainreaction-denaturinggradient gel electrophoresis,PCR-DGGE)技术分析酱香白酒酒曲中的微生物多样性,结果表明,其微生物群落组成存在明显差异。WANG X D等[7]利用高通量测序对酱香型珍酒酿造用高温大曲的细菌菌群多样性进行研究,结果从3个大曲样品中共检测到35个细菌科。SU Y等[8]利用16S rDNA克隆文库独立方法研究大曲发酵过程中细菌菌群多样性变化,结果表明,随着发酵时间的延长,细菌种类逐渐增多。LI H等[9]对茅台酒酿造用大曲中的细菌菌群多样性进行研究,结果发现,放线菌门(Actinobacteria)和厚壁菌门(Firmicutes)为优势菌门。ZHANGL等[10]利用巢式PCR-DGGE对汾酒、泸州老窖、郎酒3种白酒酿造大曲微生物群落结构进行研究,结果发现,3种大曲微生物多样性差异显著。ZHENG X W等[11]使用免培养克隆方法研究南北方大曲细菌的群落组成,结果表明,南方大曲和北方大曲的细菌菌落分布存在差异性。然而,关于酱香型高温大曲人工制曲和机械制曲的微生物的群落组成及其差异研究相对较少[12-14]。
基于此,本研究基于高通量测序技术分析人工和新、旧机械制曲车间酱香型高温大曲发酵过程和储存过程中微生物群落结构及差异,以期为机械制曲代替人工制曲建立提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酱香型高温大曲样品取自贵州某酿酒有限公司酱香型高温大曲制曲车间2023年正常生产的曲样,在入仓曲、一次翻曲、二次翻曲、出仓曲、存一月曲、存二月曲、存三月曲7个时间段分别进行取样;每次取样时分别取发酵曲房靠窗、靠门及中间的上、中、下三层大曲各500 g曲样,粉碎,将曲房靠窗、靠门的上、中、下三层曲样充分混合为综合样,所取曲样置于-20 ℃冰柜保存,备用。样品编号及来源见表1。
表1 酱香型高温大曲样品编号及来源
Table 1 Number and source of sauce-flavor high-temperature Daqu samples
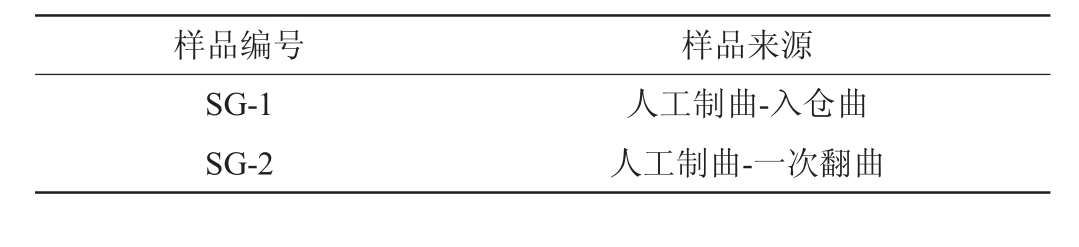
样品编号 样品来源SG-1 SG-2人工制曲-入仓曲人工制曲-一次翻曲
续表

样品编号 样品来源SG-3 SG-4 SG-5 SG-6 SG-7 XA-1 XA-2 XA-3 XA-4 XA-5 XA-6 XA-7 XB-1 XB-2 XB-3 XB-4 XB-5 XB-6 XB-7人工制曲-二次翻曲人工制曲-出仓曲人工制曲-储存1月曲人工制曲-储存2月曲人工制曲-储存3月曲新机械制曲-入仓曲新机械制曲-一次翻曲新机械制曲-二次翻曲新机械制曲-出仓曲新机械制曲-储存1月曲新机械制曲-储存2月曲新机械制曲-储存3月曲旧机械制曲-入仓曲旧机械制曲-一次翻曲旧机械制曲-二次翻曲旧机械制曲-出仓曲旧机械制曲-储存1月曲旧机械制曲-储存2月曲旧机械制曲-储存3月曲
1.1.2 试剂
E.Z.N.A.R soil脱氧核糖核酸(deoxyribonucleic acid,DNA)Kit:美国Omega BioTek公司;AxyPrep DNA凝胶回收试剂盒:美国AXYGEA公司;rTaq DNA聚合酶试剂盒、DNA Marker:北京全式金生物技术有限公司;引物:生工生物工程(上海)股份有限公司。其他试剂均为国产分析纯或生化试剂。
1.2 仪器与设备
Eppendorf Centrifuge 5424常温离心机:上海巴玖实业有限公司;Microfuge R 22R Centrifuge冷冻离心机:德京科技(北京)有限公司;WH-861 Vortex Shaker旋涡振荡仪:上海精密仪器仪表有限公司;DK-8D三温三控恒温水浴锅:上海博迅实业有限公司;A300快速梯度PCR仪:杭州朗基科学仪器有限公司;DYY-8C型电泳仪:北京六一仪器厂;JS-680C凝胶成像仪:上海培清科技有限公司;DW-HL388超低温冷冻储存箱:中科美菱低温科技有限责任公司;Agilent2100生物分析仪:美国Agilent公司;Illumina Novaseq 6000平台:杭州联川生物计数股份有限公司。
1.3 方法
1.3.1 样品预处理及总DNA提取
分别取各样品综合样10 g,放入50 mL灭菌的0.1 mol/L磷酸盐缓冲液(phosphate buffer solution,PBS)中,再加入3~5颗玻璃珠后摇床振荡30 min,4 000 r/min离心5 min,弃上清,收集沉淀,使用E.Z.N.A.R soil DNA Kit提取样品中微生物的宏基因组DNA,并通过0.5%琼脂糖凝胶电泳检测DNA质量,同时,采用紫外分光光度计对DNA进行定量。
1.3.2 PCR扩增及高通量测序
以提取的宏基因组DNA为模板,细菌使用引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对16S rDNA V3~V4区基因序列进行PCR扩增,真菌采用引物ITS3(5'-GCATCGATGAAGAACGCAGC-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')对ITS高变区进行PCR扩增。PCR扩增程序:98 ℃预变性10 s;98 ℃变性10 s,54 ℃退火30 s,72 ℃延伸45 s,共循环35次;72 ℃终延伸10 min。PCR扩增体系:Phusion Hot start flex 2×Master Mix 12.5 μL,上下游引物各2.5 μL,模板DNA 50 ng,加双蒸水(ddH2O)至25 μL。为保证后续数据分析的准确性及可靠性,每个样本3个重复,将同一样本的PCR扩增产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrep DNA凝胶回收试剂盒切胶回收PCR扩增产物[15],委托杭州联川生物计数股份有限公司基于Illumina NovaSeq 6000测序平台进行高通量测序。
1.3.3 高通量测序结果分析
根据barcode信息采用seqtk_demultiplex软件对测序获得的双端数据进行数据拆分,并去除接头和barcode序列[16];采用cutadapt(v1.9)软件去除RawData的引物序列和平衡碱基序列,采用PEAR(v0.9.6)软件将每一对paired-end reads根据overlap区拼接合并成一条更长的tag,采用fqtrim软件对测序reads进行窗口法质量扫描,扫描窗口默认为100 bp,当窗口内平均质量值<20时,将reads从窗口起始到3'终止的部分截掉,去除截短后碱基长度<100 bp的序列,去除截短后N(不确定模糊碱基)的含量在5%以上的序列,最后采用Vsearch(v2.3.4)软件去除嵌合体序列[17]。将序列按照97%的相似性划分操作分类单元(operational taxonomic units,OTU),并绘制稀释曲线。通过qiime dada2 denoise-paired调用DADA2进行长度过滤和去噪,获得扩增子序列变异体(amplification singletons variants,ASVs)特征序列及其丰度表,并去除singletons ASVs[18]。基于ASV特征序列和丰度进行Alpha多样性分析和Beta多样性分析。根据ASV特征序列文件采用RDP数据库以unite数据库进行物种注释,并根据ASV特征序列丰度表对各物种在各样本中的相对丰度进行统计。
1.3.4 数据处理
采用Microsoft Office Excel 2021进行数据计算和分析。基于Illumina NovaSeq 6000测序平台,利用R语言、Origin 2024软件、QIIME 2软件、SIMCA 14.1绘图。
2 结果与分析
2.1 高通量测序质量分析
稀释性曲线可直接反映测序数据量的合理性[19],3个车间酱香型高温大曲制备过程中微生物菌群的稀释曲线见图1。由图1可知,随着抽取序列数量的增加,稀释曲线逐渐趋于平缓,证明测序数据量足够充分,测序结果能真实反映不同车间、不同时期酱香型高温大曲样品细菌和真菌群落结构的多样性。

图1 不同车间酱香型高温大曲制曲过程中细菌(a)和真菌(b)菌群的稀释曲线
Fig.1 Dilution curves of bacteria (a) and fungi (b) during sauceflavor high-temperature Daqu production in different workshops
2.2 不同车间酱香型高温大曲制备过程中微生物群落的多样性分析
2.2.1 α多样性分析
人工制曲车间及新、旧机械制曲车间酱香型高温大曲制曲过程中微生物菌群α多样性指数的动态变化见图2。由图2可知,不同车间酱香型高温大曲发酵及储存过程中细菌菌群的丰富度和多样性变化趋势与真菌菌群不同。由图2a可知,大曲入仓开始发酵到出仓的整个发酵过程,3个车间大曲细菌菌群的Shannon指数和Chao1指数整体均呈先上升后下降的趋势,说明酱香高温大曲在发酵过程中进行了细菌的大量富集,并在二次翻曲时细菌菌群的多样性和丰富度达到最大值。从出仓到储存3个月整个储存过程中,3个车间大曲细菌菌群的Shannon指数和Chao1指数整体均呈现先降低后升高的趋势,说明酱香型高温大曲细菌菌群多样性及丰富度在储存前期有所下降,储存后期会有细菌的富集进而增加细菌菌群多样性和丰富度,同时也间接证明了酱香型高温大曲要储存一定时间后才能用于生产[20]。
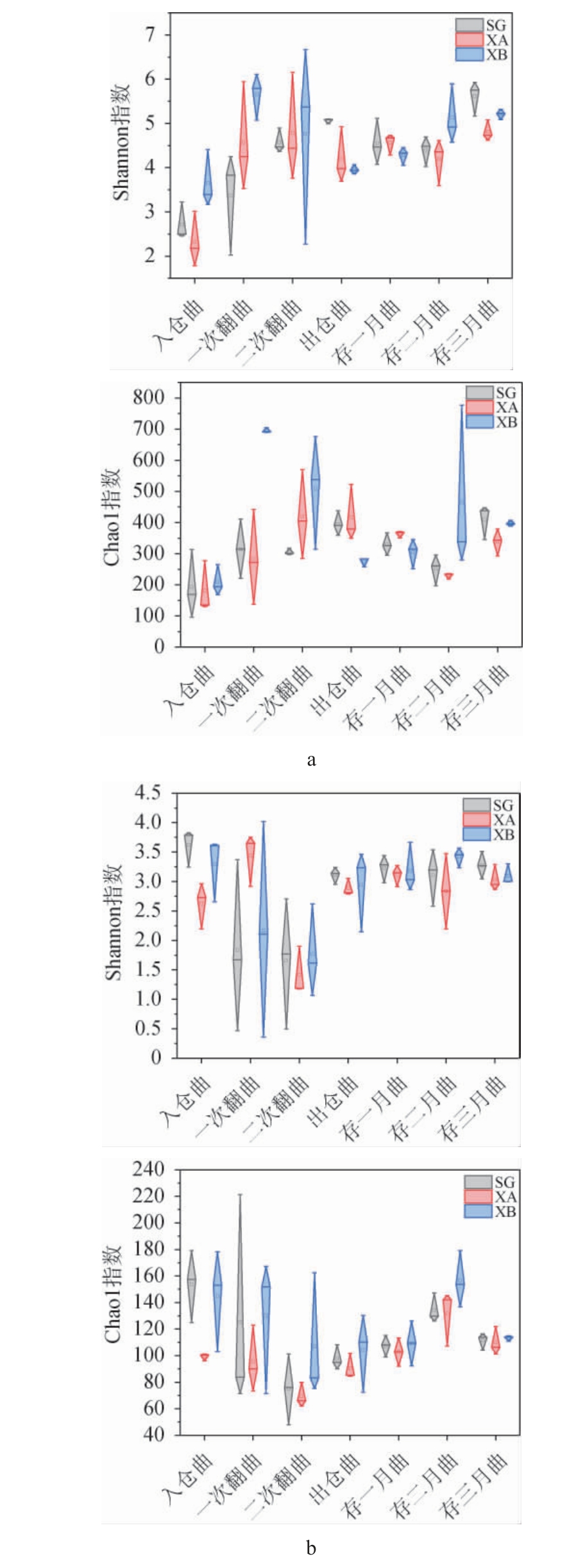
图2 不同车间酱香型高温大曲制曲过程中细菌(a)和真菌(b)菌群的α多样性指数箱型图
Fig.2 Box diagram of the α diversity index of bacteria (a) and fungi (b) during sauce-flavor high-temperature Daqu production in different workshops
由图2b可知,与细菌菌群不同的是,从大曲入仓开始发酵到出仓的整个发酵过程中,3个车间大曲真菌菌群的Chao1指数和Shannon指数整体均呈现先降低后增加的趋势,说明在酱香型高温大曲发酵前期真菌菌群多样性和丰富度均会减少,且在第二次翻曲时达到最低值。从出仓到储存3个月整个储存过程中,3个车间大曲真菌菌群的Shannon指数和Chao1指数整体均呈现先上升后趋于稳定的趋势,说明酱香型高温大曲在储存过程中真菌少量富集且真菌菌群丰富度和多样性趋于稳定。
2.2.2 β多样性分析
基于细菌属和真菌属ASVs对不同制曲车间的大曲样品进行主成分分析,结果见图3。
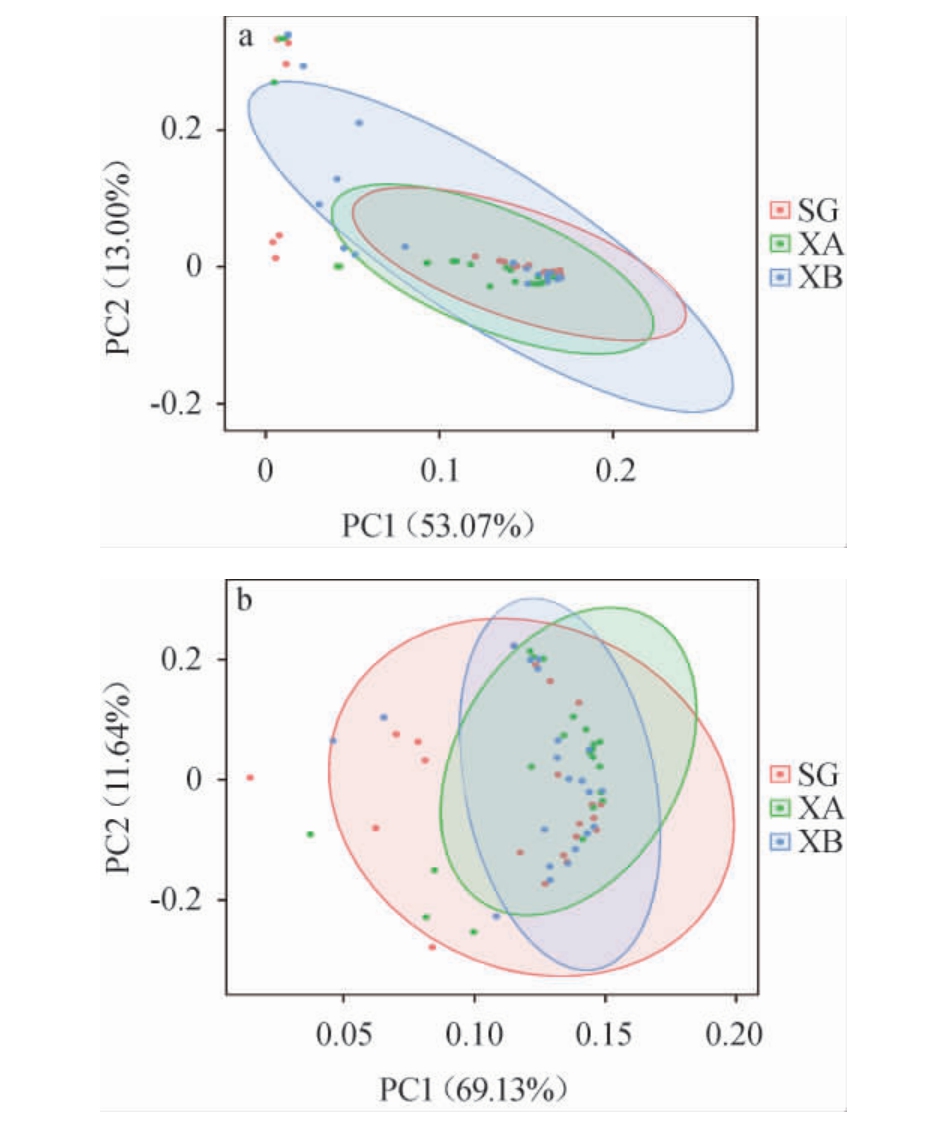
图3 基于细菌属(a)和真菌属(b)ASVs不同车间酱香型高温大曲样品的主成分分析结果
Fig.3 Principal component analysis results of sauce-flavor hightemperature Daqu samples produced in different workshops based on bacterial genera(a)and fungal genera(b)ASVs
由图3a可知,主成分1和主成分2的方差贡献率分别为53.07%和13.00%,累计方差贡献率为66.07%,说明该结果包含了66.07%的原始信息,结果可信。人工制曲车间和新机械制曲车间大曲样品的细菌群落相似性更高,旧机械制曲车间大曲样品的细菌群落基本覆盖且超出人工制曲车间和新机械制曲车间大曲样品的细菌群落,说明3个制曲车间大曲样品的细菌菌群多样性差异较小,且旧机械制曲车间大曲样品的细菌群落多样性大于人工制曲和新机械制曲车间大曲样品。由图3b可知,主成分1和主成分2的方差贡献率分别为69.13%和11.64%,累计方差贡献率为80.77%,说明该结果包含了80.77%的原始信息,结果可信。新机械制曲车间和旧机械制曲车间大曲样品的真菌群落相似性更高,人工制曲车间大曲样品的真菌群落基本覆盖且超出新、旧机械制曲车间大曲样品的真菌群落,说明3个制曲车间大曲样品的真菌菌群多样性差异性较小,人工制曲车间大曲样品的真菌菌群多样性大于机械制曲车间大曲样品。结果表明,3个制曲车间酱香型高温大曲样品的微生物群落结构在细菌和真菌菌群上都具有一定的差异,但差异较小,其中旧机械制曲车间大曲样品的细菌群落结构最为丰富,人工制曲车间大曲样品的真菌群落结构更为丰富。
2.3 不同车间酱香型高温大曲制曲过程中微生物群落结构分析
2.3.1 细菌群落结构分析
基于门水平(平均相对丰度排名前5)和属水平(平均相对丰度排名前10)对3个车间酱香型高温大曲制曲过程中的细菌菌群结构进行分析,结果见图4。
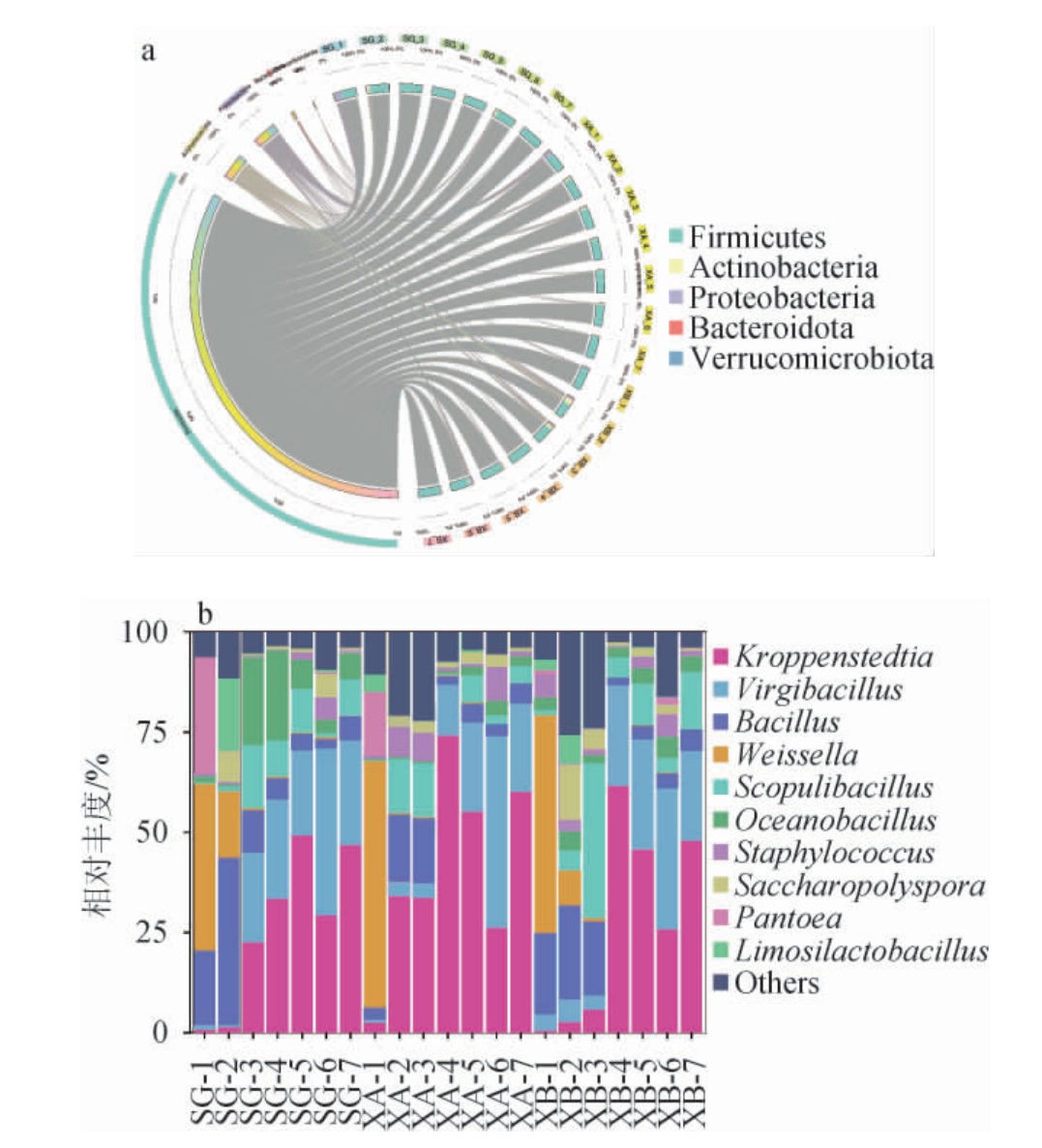
图4 基于门(a)和属(b)水平不同车间酱香型高温大曲制曲过程细菌菌群结构
Fig.4 Bacterial community structure of sauce-flavor hightemperature Daqu samples during production in different workshops based on phylum (a) and genus (b) levels
others:平均相对丰度排名10之后的细菌属。
由图4a可知,3个车间制曲过程中的细菌菌群均以厚壁菌门(Firmicutes)(65.90%~97.68%)、放线菌门(Actinobacteria)(0.11%~22.81%)和变形菌门(Proteobacteria)(0.11%~33.09%)为主,其中厚壁菌门是整个制曲过程中的主要菌门,变形菌门主要出现在入仓阶段,放线菌门主要出现在第一次翻曲。
由图4b可知,人工制曲车间大曲入仓发酵时主要细菌属有魏斯氏菌属(Weissella)(41.53%)、泛菌属(Pantoea)(29.09%)和芽孢杆菌属(Bacillus)(18.66%),第一次翻曲时主要细菌属有Bacillus(41.98%)、Weissella(16.50%)和粘液乳杆菌属(Limosilactobacillus)(18.15%),第二次翻曲时主要细菌属有克罗彭斯特菌属(Kroppenstedtia)(22.47%)、枝芽孢菌属(Virgibacillus)(22.51%)、大洋芽胞杆菌属(Oceanobacillus)(21.95%)和大曲岩石芽胞杆菌属(Scopulibacillus)(15.92%),出仓时主要细菌属有Kroppenstedtia(33.46%)、Virgibacillus(24.76%)和Oceanobacillus(22.50%);储存1~3月时主要细菌属均为Kroppenstedtia(49.28%、29.32%、46.73%)和Virgibacillus(21.15%、41.54%、46.73%)。新机械制曲车间大曲入仓发酵时主要细菌属为Weissella(61.58%)和Pantoea(15.84%),第一次和第二次翻曲时主要细菌属均为Kroppenstedtia(34.06%、33.70%)、Bacillus(16.99%、16.35%)和Scopulibacillus(13.63%、13.49%),出仓及储存1~3月时主要细菌属均为Kroppenstedtia(74.14%、55.08%、26.14%、60.13%)和Virgibacillus(12.67%、22.38%、47.87%、22.07%)。旧机械制曲车间大曲入仓发酵时主要细菌属有Bacillus(20.23%)和Weissella(54.47%),第一次翻曲时主要细菌属有Bacillus(23.61%)、Weissella(8.50%)和糖多孢菌属(Saccharopolyspora)13.84%,第二次翻曲时主要细菌属有Bacillus(18.71%)和Scopulibacillus(38.72%),出仓及储存1~3月时主要细菌属均为Kroppenstedtia(61.49%、45.72%、25.76%、48.03%)和Virgibacillus(25.20%、27.47%、35.25%、22.25%)。
综上,3个车间共有的主要细菌属包括Weissella、Bacillus、Kroppenstedtia、Virgibacillus、Scopulibacillus。人工制曲车间大曲样品特有的主要细菌属有Limosilactobacillus和Oceanobacillus;旧机械制曲车间大曲样品特有的主要细菌属为Saccharopolyspora。综上,无论是人工制曲还是机械制曲,大曲的主要细菌属组成相对一致,主要包括魏斯氏菌属、芽孢杆菌属、克罗彭斯特菌属、枝芽孢菌属、大曲岩石芽胞杆菌属、大洋芽孢杆菌属、糖多孢菌属、泛菌属和粘液乳杆菌属等。
2.3.2 真菌群落结构分析
基于门水平(平均相对丰度排名前5)和属水平(平均相对丰度排名前10)对3个车间酱香型高温大曲制曲过程中的真菌菌群结构进行分析,结果见图5。
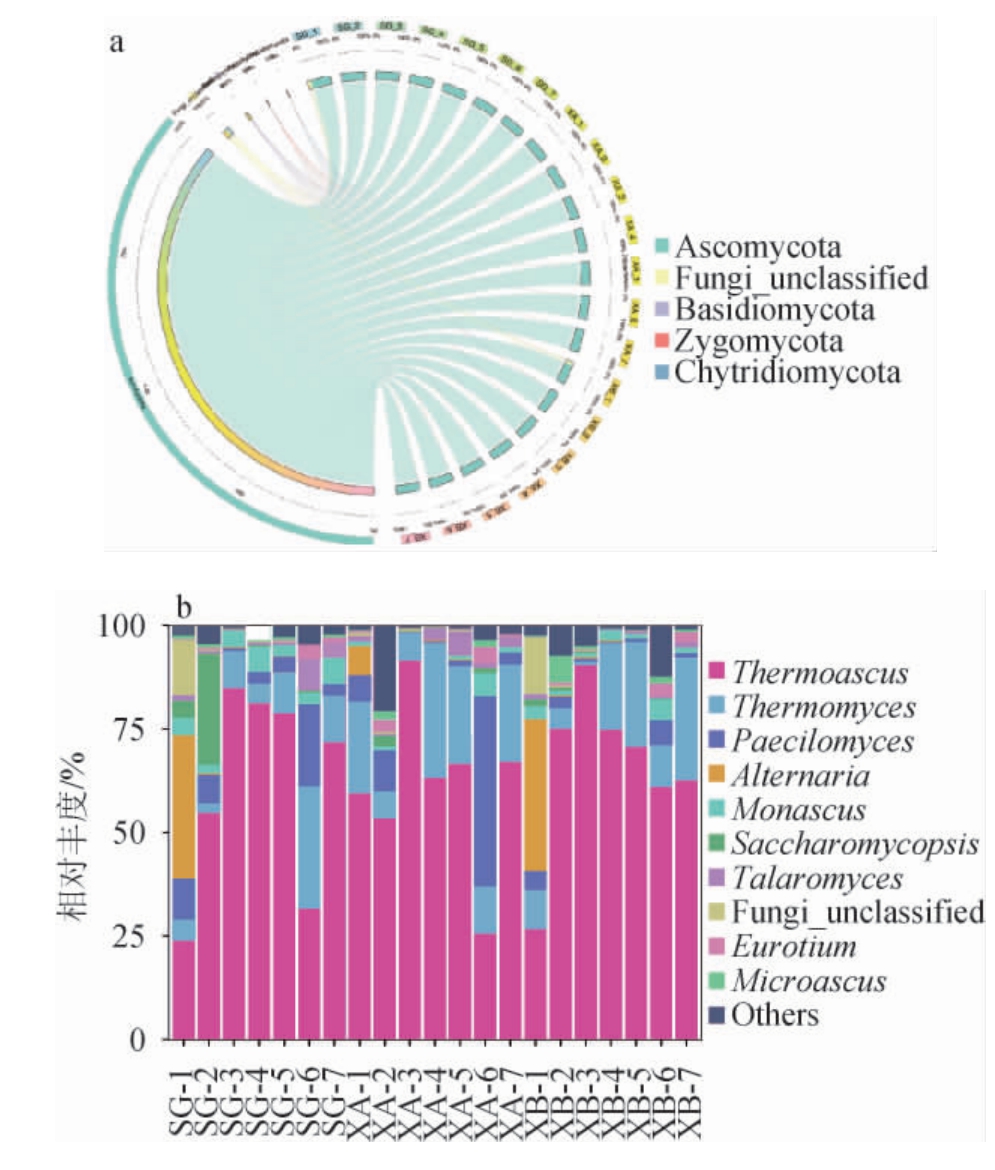
图5 基于门(a)和属(b)水平不同车间酱香型高温大曲制曲过程真菌菌群结构
Fig.5 Fungal community structure of sauce-flavor high-temperature Daqu samples during production in different workshops based on phylum (a) and genus (b) levels
others:平均相对丰度排名10之后的真菌属。
由图5a可知,3个车间制曲过程中的真菌菌群均以子囊菌门(Ascomycota)(86.05%~99.93%)为主,其次为未分类真菌(Fungi_unclassified),主要出现在人工制曲车间和旧机械制曲车间入仓阶段,其平均相对丰度分别是13.41%和13.67%。
由图5b可知,人工制曲车间入仓发酵时主要真菌属有嗜热子囊菌属(Thermoascus)(23.92%)、拟青霉属(Paecilomyces)(10.00%)、链格孢属(Alternaria)(34.68%)和未分类真菌(Fungi_unclassified)(13.41%),第一次翻曲时主要真菌属有Thermoascus(54.74%)、复膜孢酵母属(Saccharomycopsis)(27.02%)和Paecilomyces(7.01%),第二次翻曲时主要真菌属有Thermoascus(84.95%)和嗜热真菌属(Thermomyces)(8.89%),出仓时主要真菌属有Thermoascus(81.26%)和红曲霉属(Monascus)(6.23%);储存1月和3月时主要真菌属均为Thermoascus(78.91%、71.89%)和Thermomyces(9.79%、11.18%),储存2月时主要真菌属为Thermoascus(31.58%)、Thermomyces(29.63%)和Paecilomyces(19.86%)。新机械制曲车间入仓发酵时主要真菌属有Thermoascus(59.55%)、Thermomyces(22.05%)、Paecilomyces(6.34%)和Alternaria(7.10%),第一次翻曲时主要真菌属有Thermoascus(53.49%)、Thermomyces(6.34%)、Paecilomyces(10.07%),第二次翻曲、出仓及储存1月和3月时主要真菌属均为Thermoascus(91.64%、63.13%、66.72%、67.19%)和Thermomyces(6.65%、32.73%、23.50%、23.45%),储存2月时主要真菌属为Thermoascus(25.70%)、Thermomyces(11.21%)和Paecilomyces(46.01%)。旧机械制曲车间入仓发酵时主要真菌属有Thermoascus(26.64%)、Alternaria(36.70%)和Fungi_unclassified(13.67%),第一次翻曲及第二次翻曲时主要真菌属均为Thermoascus(75.16%、90.40%),出仓及储存1~3月时主要真菌属均为Thermoascus(74.85%、70.64%、61.08%、62.70%)和Thermomyces(20.99%、25.41%、10.02%、29.52%)。
综上,3个车间共有的主要真菌属包括Thermoascus、Thermomyces、Alternaria,人工制曲车间大曲样品特有的主要真菌属有Saccharomycopsis、Monascus,说明无论是人工制曲还是机械制曲,大曲的主要真菌属组成也是相对一致的,主要包括嗜热子囊菌属、嗜热真菌属、拟青霉属、链格孢属、红曲霉属、复膜孢酵母属。
杨晨等[21]采用高通量测序技术对茅台镇某酒厂高温大曲微生物菌群多样性进行解析,结果表明,6份高温大曲中细菌以芽孢杆菌属、克罗彭斯特菌属、慢生芽孢杆菌属、海洋芽孢杆菌属、糖多孢菌属、岩石芽孢杆菌属和高温放线菌属等为主;真菌以嗜热真菌属、曲霉菌属、踝节菌属(Talaromyces)、复膜孢酵母属和丝衣霉属(Byssochlamys)等为主。王国峥等[22]使用宏基因组测序技术对3个轮次大曲微生物群落进行解析,物种注释结果显示,象牙色克罗彭斯特德菌(Kroppenstedtia eburnea)为优势菌种,多种芽孢杆菌共同为亚优势种,下沙与1轮次群落多样性水平无显著差异。郑亚伦等[23]采用Illumina MiSeq高通量测序技术对数字化高温大曲和传统高温大曲进行微生物群落多样性解析,结果表明,两种高温大曲在发酵过程中微生物群落结构均有显著变化;发酵结束时两种高温大曲的细菌都以克罗彭斯特菌属、糖多孢菌属、芽孢杆菌属、魏斯氏菌属和乳酸杆菌属(Lactobacillus)为主要优势菌属,真菌以嗜热子囊菌属、嗜热真菌属和曲霉菌属为主;非度量多维尺度分析和层级聚类分析结果表明,相同时间时两种大曲的微生物组成大体相似。何猛超等[24]基于高通量测序技术对优质曲、普通曲、黄曲、黑曲、白曲中的微生物群落结构进行分析,结果显示,优质曲中优势细菌为芽孢杆菌属、高温放线菌属、Unidentified Mitochondria,且它们分别是黄曲、白曲和黑曲中的优势菌;优势真菌为热子囊菌属,且它是黄曲、白曲和黑曲共有的优势真菌。席德州[25]通过与传统酿造酱香型白酒相比,机械化酿造过程的主要细菌属和真菌属在丰度上存在较大的相似性,表明酱香型白酒的机械化酿造在微生物菌群结构层面上是完全可行的;但部分属类在机械化酿造与传统酿造中的群落结构组成上也存在一定的差异性(如Troulaspora、不动杆菌属(Acinetobacter)等),推测这可能与机械工程及设备性能、发酵参数控制等有关联。与以往对传统酱香大曲和机械大曲微生物的研究结果对比分析,对酱香型白酒机械化酿造与传统酿造微生物层面的研究结果都表明机械化制曲和机械化酿酒都具有可行性,本研究结果与前人的研究结果具有一致性,机械化制曲与传统人工制曲在微生物层面上具有较高的相似性,后期会结合会结合微生物、大曲风味、大曲理化指标等多个维度为两种制曲方式进行比较分析,以期为机械化制曲取代人工制曲提供一定的理论基础。
3 结论
本研究通过高通量测序技术对酱香型高温大曲在人工制曲车间、新机械制曲车间和旧机械制曲车间的发酵过程及储存过程中的微生物群落结构进行了深入分析。研究结果揭示了不同制曲方式下大曲中微生物群落的多样性和动态变化。无论是人工制曲还是机械制曲,大曲的主要微生物属组成相对一致,但在各微生物属的相对丰度上存在差异。这表明制曲方法对微生物群落的组成有一定的影响,但并未改变其基本结构。在发酵过程中,细菌属以克罗彭斯特菌属、枝芽孢菌属、芽孢杆菌属、魏斯氏菌属、大曲岩石芽胞杆菌属、大洋芽孢杆菌属、糖多孢菌属、泛菌属和粘液乳杆菌属为主,真菌属以嗜热子囊菌属、嗜热真菌属、拟青霉属、链格孢属、红曲菌属和复膜孢酵母属为主;储存过程中,细菌属以克罗彭斯特菌属和枝芽孢菌属为主,真菌属以嗜热子囊菌属、嗜热真菌和拟青霉属为主。综上,在微生物层面上,机械化制曲能够达到与传统人工制曲相似的效果。本研究揭示了酱香型高温大曲在不同制曲方式下的微生物群落结构,未来可以结合微生物、大曲风味、大曲理化指标等多个维度,为两种制曲方式进行更深入的比较分析。
[1]吴玉轩,王文洁,张梦梦,等.芝麻香型高温大曲制曲过程中理化生化与细菌DGGE指纹图谱的探究[J].酿酒,2024,51(1):63-67.
[2]唐佳代,赵益梅,冉光耀,等.基于第三代测序与理化指标评价不同压曲工艺酱大曲品质[J].中国酿造,2022,41(12):74-78.
[3]LIANG Y,WENLAI F,YAN X.Metaproteomics insights into traditional fermented foods and beverages[J].Compr Rev Food Sci Safety,2020,19(5).
[4]张明.机械制曲过程中影响小麦粉碎度的因素探究及调控[J].酿酒科技,2019(1):76-80,
[5]郭敏.基于高通量测序对酱香大曲制曲微生态多样性的研究[D].贵阳:贵州大学,2018.
[6]谭映月,胡萍,谢和.应用PCR-DGGE技术分析酱香型白酒酒曲细菌多样性[J].酿酒科技,2012(10):107-111.
[7]WANG X D, BAN S D, HU B D, et al.Bacterial diversity of Moutaiflavour Daqu based on high-throughput sequencing method[J].J I Brewing,2017,123(1):138-143.
[8]SU Y,YANG L,HUI L,et al.Bacterial communities during the process of high-temperature Daqu production of roasted sesame-like flavour liquor[J].J I Brewing,2015,121(3):440-448.
[9]LI H,LIAN B,DING Y,et al.Bacterial diversity in the central black component of Maotai Daqu and its flavor analysis[J].Ann Microbiol,2014,64(4):1659-1669.
[10]ZHANG L,WU C,DING X,et al.Characterisation of microbial communities in Chinese liquor fermentation starters Daqu using nested PCRDGGE[J].World J Microbiol Biotechnol,2014,30(12):3055-3063.
[11]ZHENG X W,YAN Z,NOUT M J,et al.Characterization of the microbial community in different types of Daqu samples as revealed by 16S rRNA and 26S rRNA gene clone libraries[J].World J Microbiol Biotechnol,2015,31(1):199-208.
[12]YANG Y,WANG S,LU Z,et al.Metagenomics unveils microbial roles involved in metabolic network of flavor development in medium-temperature Daqu starter[J].Food Res Int,2021,140:110037.
[13]ZUO Q C,HUANG Y G,GUO M.Evaluation of bacterial diversity during fermentation process:a comparison between handmade and machinemade high-temperature Daqu of Maotai-flavor liquor[J].Ann Microbiol,2020,70(1):1-10.
[14]ZHU C,CHENG Y,ZUO Q,et al.Exploring the impacts of traditional crafts on microbial community succession in Jiang-flavored Daqu[J].Food Res Int,2022,158:111568.
[15]LOGUE J B,STEDMON C A,KELLERMAN A M,et al.Experimental insights into the importance of aquatic bacterial community composition to the degradation of dissolved organic matter[J].ISME J,2016,10:533-545.
[16]WALTERS W,HYDE E R,BERGLYONS D,et al.Improved bacterial 16S rRNA gene (V4 and V4-5) and fungal internal transcribed spacer marker gene primers for microbial community surveys[J].Msystems,2015,1(1):e00009-15.
[17]TAKAI K,HORIKOSHI K.Rapid detection and quantification of members of the archaeal community by quantitative pcr using fluorogenic probes rapid detection and quantification of members of the archaeal communityby quantitative pcr using fluorogenic probes[J].Appl Environ Microbiol,2000,66:5066-5072.
[18]TAKAI K,HORIKOSHI K.Rapid detection and quantification of members of the archaeal community by quantitative PCR using fluorogenic probes[J].Appl Environ Microbiol,2000,66(11):5066-5072.
[19]韩晓伟,张小波,严玉平,等.16S rRNA基因高通量测序法分析黄河太岁细菌的多样性[J].微生物学通报,2018,45(4):866-874.
[20]胡宝东,王晓丹,王婧,等.酱香型大曲生产工艺与大曲品质的关系研究[J].食品工业,2016,37(2):260-264.
[21]杨晨,杨栩松,郭壮,等.茅台镇某酒厂高温大曲微生物多样性与感官品质关联性分析[J].中国酿造,2023,42(11):48-53.
[22]王国峥,陈笔,卢建军,等.基于宏基因组学测序技术分析3个轮次高温大曲微生物群落[J].食品科学,2023,44(16):220-227.
[23]郑亚伦,赵婷,王家胜,等.数字化高温大曲发酵过程中微生物群落结构的变化[J].食品科学,2022,43(12):171-178.
[24]何猛超,任义平,熊林,等.茅台地区不同高温大曲微生物群落结构解析[J].中国酿造,2022,41(6):51-57.
[25]席德州.酱香型白酒机械化酿造过程中的微生物群落结构研究[D].贵阳:贵州大学,2018.