葡萄酒的发酵环境是一个由多种微生物组成的复杂微生物生态体系,受地理、气候环境、品种等多种因素影响。不同的微生物群系通过复杂的代谢网络和相互作用,赋予了葡萄酒多元化的风味及感官享受[1-2]。其中,酵母是葡萄汁转化为葡萄酒的关键微生物,对于葡萄酒的发酵进程调控及风格塑造都有着重要作用[3-4]。目前的研究认为,本土野生酵母菌群更适应葡萄酒的发酵环境,在表现葡萄酒的典型风味特征更具优势[5],也是葡萄酒微生物领域的研究热点。
贺兰山东麓产区是我国最具代表性的葡萄酒产区之一,产区土壤沙化贫瘠、热量条件适宜、昼夜温差较大[6]。这些优良的风土特点赋予了贺兰山东麓丰富的葡萄酒相关微生物资源,使其成为了国内发酵微生物研究的热点区域。WEI R T等[7]通过研究贺兰山东麓产区赤霞珠葡萄酒自然发酵过程中真菌群落的多样性,表征了有孢汉逊酵母属(Hanseniaspora)、假丝酵母属(Starmerella)及念珠菌属(Candida)对于葡萄酒品质塑造的重要作用。薛蓓等[8]分析了贺兰山东麓4个子产区赤霞珠及霞多丽葡萄的微生物多样性,结果发现,不同品种和子产区间的微生物组成在属水平上存在明显差异。此外,有更多的研究也表明了即使在同一区域内,不同品种的葡萄自然发酵过程中微生物的群落多样性也具有较明显的差异性[9-11]。
维欧尼(Viognier)是贺兰山东麓产区新引进的酿酒白葡萄品种,其酿造的葡萄酒具有果香馥郁的特点[12]。优良的品种特性使该品种在贺兰山东麓产区的干白葡萄酒中取得了较高评价,表现出极大的发展潜力[13]。在“风土”这一概念提出之后,本土野生酵母菌群迅速成为国内外研究的热点[14-15]。目前的研究更多是基于高通量测序技术的方式,解析葡萄酒发酵过程中的微生物群落多样性及演替规律[16-18]。这种大规模测序技术虽然能够较为便捷全面地解构微生物的群系组成,但对于物种水平的鉴定结果并不够精细,仍需与培养组的研究结果相互印证[19-20]。因此,本研究基于可培养的方法,对贺兰山东麓产区维欧尼葡萄酒自然发酵体系中的酵母菌群进行分离鉴定,解析其发酵过程中酵母种群的多样性及动态演替。并结合Interdelta聚合酶链式反应(polymerase chain reaction,PCR)指纹图谱技术,进一步表征了发酵体系中酿酒酵母基因型的多样性。旨在增强对贺兰山东麓产区维欧尼自然发酵体系中关键酵母菌群的认识,进而为贺兰山东麓产区维欧尼葡萄酒的发展提供理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
维欧尼(Viognier)葡萄,采自宁夏贺兰山东麓产区夏木酒庄,采收时间为2023年8月下旬,原料含糖量为228 g/L。
1.1.2 化学试剂
无水乙醇、甘油、氯化钠、苯酚、三氯甲烷、异戊醇(均为分析纯):天津市科密欧化学试剂有限公司;氯霉素(100mg):北京博奥拓达科技有限公司;琼脂糖、GenGreen核酸染料、2×Rapid Taq Master Mix:美国Fermentas公司;乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)(均为分析纯):国药集团化学试剂有限公司;曲拉通X-100(TrionX-100)(分析纯):上海麦克林生化科技股份有限公司;Tris-HCl(分析纯):北京索莱宝科技有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
沃勒斯坦实验室营养(Wallerstein laboratory nutrient,WLN)琼脂培养基:青岛高科技工业园海博生物技术有限公司,灭菌后的培养基降温到50~60 ℃时,加入100 mg/L的氯霉素。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基:10 g/L酵母浸粉,20 g/L蛋白胨,20 g/L葡萄糖,121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
FRESCO17型高速冷冻离心机:美国Thermo公司;SWCJ-2FD型超净工作台:苏州安泰空气技术有效公司;FB-K20型恒温培养箱:上海枫岭生物技术有限公司;DW-FL-270型低温冰箱(-40 ℃):中科美菱低温科技有限公司;C1000型PCR扩增仪:美国BIO-RAD公司;DYYY-10C型电泳仪:北京六一仪器厂;GBOX-EF型凝胶成像系统:英国Syngene公司。
1.3 方法
1.3.1 维欧尼葡萄自然发酵
在10 t的不锈钢发酵罐中加入8 t经过除梗破碎后的维欧尼葡萄醪(装液量为80%),除不接种发酵剂外的其余工艺与工业水平的生产酿造工艺相同[21]。
1.3.2 取样方法
基于对葡萄酒(汁)还原糖及比重的测定结果,分别在葡萄汁时期(I,未添加SO2的葡萄汁)、发酵启动时期(II)、发酵旺盛期(III,原料糖含量消耗1/4)、发酵后期(IV,原料糖含量消耗3/4)及发酵末期(V,残糖量<2 g/L)取混匀的葡萄酒(汁)样品1 mL用于微生物的分离培养。
1.3.3 酵母菌株的分离
将采集到的样品用无菌水做梯度稀释(I时期稀释至10-2、10-3、10-4,II~V时期稀释至10-4、10-5、10-6),分别选取3个合适的梯度稀释液涂布于WLN琼脂培养基(加入100 mg/L氯霉素)上,每个梯度进行3个重复,放入28 ℃培养箱中培养3~4 d。选取菌落数在30~300之间的3个培养基进行计数和拍照记录。挑取培养基上所有长势良好的单菌落,分别保存在灭菌的甘油管中(1 mL 40%甘油和1 mL YPD液体培养基),冻存于-20 ℃冰箱中。
1.3.4 酵母菌株的鉴定
采用石英砂破壁法[22]提取酵母菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA),以其为模板,采用引物NL1(5'-GCATATCAATAAGCGGAGGAAAAG-3')和NL4(5'-GGTCCGTGTTTCAAGACGG-3')PCR扩增26S rDNA D1/D2区基因序列。PCR扩增体系:2×RapidTaqMasterMix 12.5 μL,引物NL1和NL4各1 μL,模板DNA(100 ng/μL)1 μL,双蒸水(ddH2O)补充至20 μL。PCR扩增条件:95 ℃预变性3 min;95 ℃变性10 s,52 ℃退火1 min,72 ℃延伸90 s,共循环35次;72 ℃再延伸10 min。取2.5 μL PCR扩增产物于1%琼脂糖凝胶中进行电泳(电压110 V,电流90 mA,时间40 min),电泳结果在紫外成像仪中观察。将大小合适和条带清晰的PCR扩增产物委托生工生物工程(上海)股份有限公司进行测序分析。将测序结果提交至美国国家生物技术信息中心(nationalcenterforbiotechnologyinformation,NCBI)的GenBank数据库中,进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性比对分析。
1.3.5 酿酒酵母的Interdelta PCR指纹图谱表征
以基因组DNA为模板,使用优化的Interdelta引物delta12(5'-TCAACAATGGAATCCCAAC-3')及delta21(5'-CATCTTAACACCGTATATGA-3')进行PCR扩增。PCR扩增体系:2×Rapid Taq Master Mix 12.5 μL,引物delta12和delta21各1 μL,模板DNA(100 ng/μL)1 μL,灭菌去离子水补充至25 μL。PCR扩增条件95 ℃预变性3 min;95 ℃变性15 s,46 ℃退火45 s,72 ℃延伸为90 s,共循环35次;72 ℃再延伸5 min。将PCR扩增产物加入1%琼脂糖凝胶中进行电泳(电压130 V,电流90 mA,时间30 min);在紫外成像仪上观察、照相。根据清晰条带的位置及数量,区分不同基因分型的酿酒酵母单菌,利用NTSYSPC2.10e软件的UPGMA法进行聚类分析。
1.3.6 数据处理
采用MicrosoftExcel2021软件进行数据整理;采用Origin Pro 2024和R-4.3.0软件绘图。
2 结果与分析
2.1 酵母菌的分离与鉴定
从维欧尼葡萄酒自然发酵体系的不同发酵时期共分离得到1 513株酵母菌,根据酵母菌在WLN培养基上的菌落形态,将分离所得菌株初步分为14种类型(A~N),结果见图1,初步分离及鉴定结果具体见表1。由图1及表1可知,类型A~C的菌落呈奶油色,中心为浅绿色或浅黄色,有球状或乳头状突起,初步鉴定为酵母属(Saccharomyce sp.);类型D~H的菌落呈深绿色、蓝绿色或墨绿色,外圈为淡绿色、白色或奶油色,多数扁平无突起,表面光滑有光泽,初步鉴定为有孢汉逊酵母属(Hanseniaspora sp.);类型I的菌落呈奶油色,中心为淡红色,有水泡状突起,初步鉴定为梅奇酵母属(Metschnikowia sp.);类型J的菌落呈白色,边缘粗糙有褶皱,中心呈火山状突起,初步鉴定为毕赤酵母属(Pichia sp.)。类型K的菌落呈抹茶绿色,整体突起,中心呈湖泊状,表面光滑;类型L的菌落呈白色,整体呈鸟巢状,四周有褶皱,中心光滑;类型M的菌落呈浅绿色,边缘为白色,表面有菌丝覆盖,扁平;类型N的菌落整体呈珊瑚状,四周为白色褶皱,中心为蓝绿色,这些类型的菌株无法根据形态做出鉴定,需结合26SrDNA序列分析结果获得。其中,类型A在启动发酵后菌落统计比例迅速增高,并保持70%以上的占比直至发酵结束,可以认为是维欧尼葡萄酒自然发酵体系中的主导菌群。类型B、C和D在前四个时期中均能在WLN培养基上生长,可以认为是维欧尼葡萄酒自然发酵体系中的优势菌群,参与了发酵。
表1 维欧尼葡萄酒自然发酵过程中分离酵母菌的形态描述及其在不同发酵时期的分离菌株占比
Table 1 Morphological description of yeasts isolated from spontaneous fermentation of Viognier wine and the proportion of isolated strains in different fermentation periods

菌落类型 形态描述 初步鉴定结果 不同时期菌落统计比例/%I II III IV V ABCDEFGH奶油色,中心为浅绿色,有球状突起奶油色,中心为黄绿色,有球状突起奶油色,中心为浅绿色,呈乳头状突起深绿色,外圈为鲜绿色,扁平无突起,表面光滑深绿色,外圈为淡绿色,扁平无突起,表面光滑有光泽蓝绿色,外圈为白色,扁平无突起,表面光滑墨绿色,边缘为奶油色,中心呈山脊状突起鲜绿色,扁平无突起,表面光滑Saccharomyce sp.Hanseniaspora sp.17.2 7.4 6.6 0.6 1.6 0.3 0.3 66.8 15.4 13.2 3.3 0.7 0.4 0.2 72.2 21.2 5.4 1.3 77.4 17.6 4.5 0.5 87.2 12.8
续表

注:“*”表示无法依据菌落形态鉴定菌种,需结合26S rDNA序列分析结果获得。
菌落类型 形态描述 初步鉴定结果 不同时期菌落统计比例/%I II III IV V IJKLMN奶油色,中心为淡红色,呈水泡状突起白色,边缘粗糙有褶皱,中心呈火山状突起抹茶绿色,整体突起,中心呈湖泊状,表面光滑白色,整体呈鸟巢状,四周有褶皱,中心光滑浅绿色,边缘为白色,表面有菌丝覆盖,扁平整体呈珊瑚状,四周为白色褶皱,中心为蓝绿色Metschnikowia sp.Pichia sp.** * *3.2 1.6 0.6 2.6 0.3 54.3
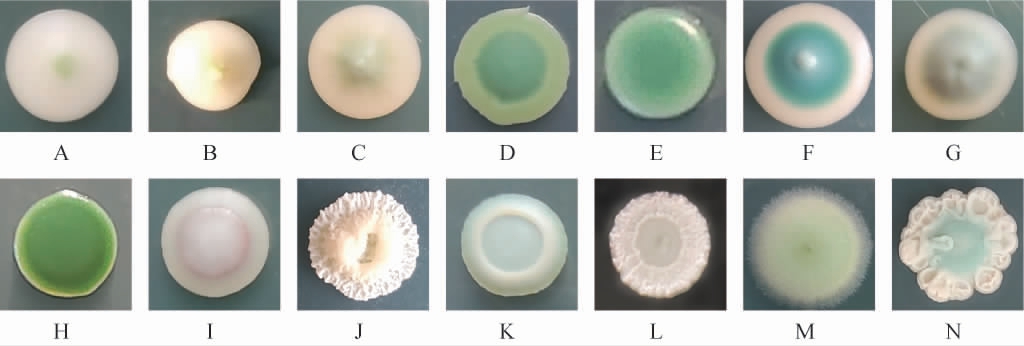
图1 维欧尼葡萄酒自然发酵过程中分离酵母菌在WLN培养基上的菌落形态
Fig.1 Colony morphology of yeasts on WLN medium isolated from spontaneous fermentation of Viognier wine
从每个时期所保藏的菌株中挑选不同类型的代表菌株进行26S rDNA基因序列分析,每种类型挑选3株。选取序列比对相似性>99%的模式菌株作为供试菌株的鉴定结果,每种类型菌株的鉴定结果见表2(每种类型仅列出了一个相似度最高的鉴定结果以供参考)。
表2 维欧尼葡萄酒自然发酵过程中分离酵母菌菌株的26S rDNA序列比对结果
Table 2 Results of 26S rDNA sequence comparison of isolated yeasts during spontaneous fermentation of Viognier wine
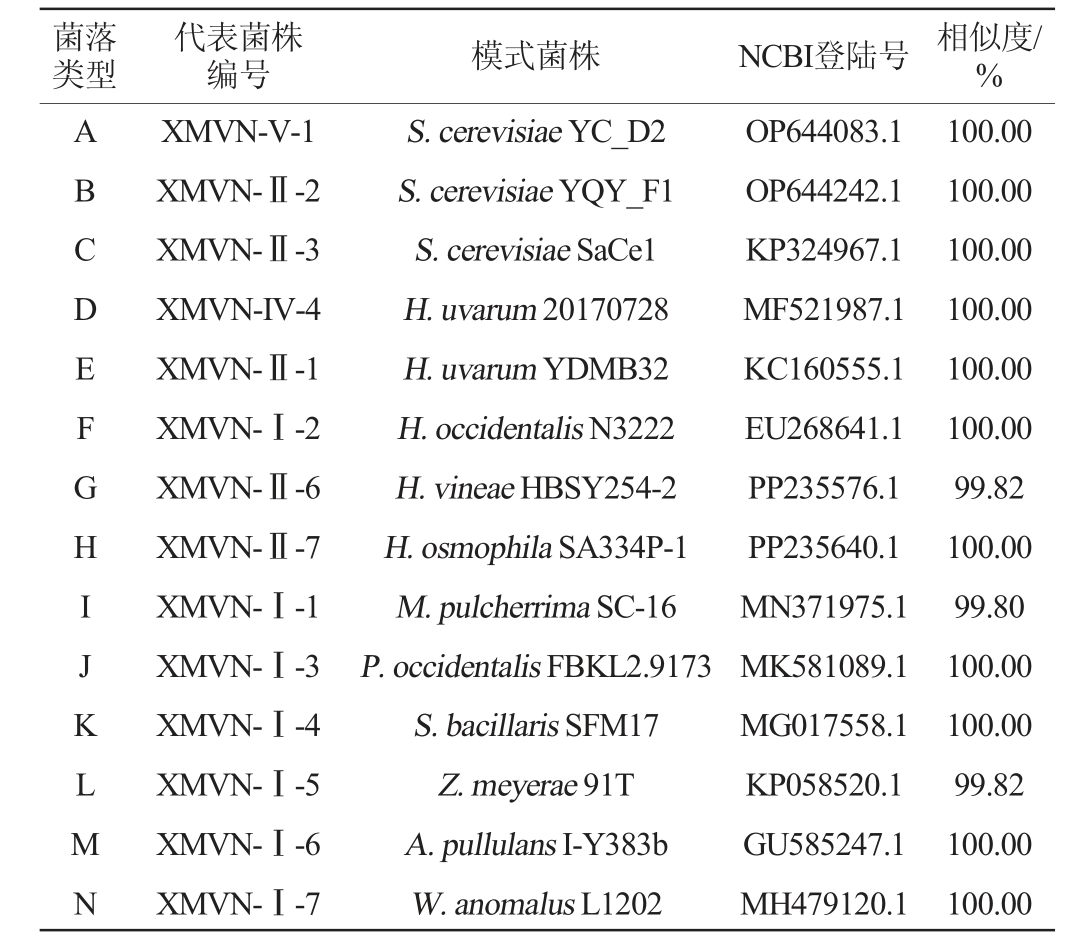
注:菌株编号中XM表示夏木酒庄;VN表示维欧尼(Viognier);I~V表示发酵时期。
菌落类型代表菌株编号 模式菌株 NCBI登陆号 相似度/%100.00 100.00 100.00 100.00 100.00 100.00 99.82 100.00 99.80 100.00 100.00 99.82 100.00 100.00 ABCDEFGHIJKLMN XMVN-V-1 XMVN-Ⅱ-2 XMVN-Ⅱ-3 XMVN-IV-4 XMVN-Ⅱ-1 XMVN-Ⅰ-2 XMVN-Ⅱ-6 XMVN-Ⅱ-7 XMVN-Ⅰ-1 XMVN-Ⅰ-3 XMVN-Ⅰ-4 XMVN-Ⅰ-5 XMVN-Ⅰ-6 XMVN-Ⅰ-7 S.cerevisiae YC_D2 S.cerevisiae YQY_F1 S.cerevisiae SaCe1 H.uvarum 20170728 H.uvarum YDMB32 H.occidentalis N3222 H.vineae HBSY254-2 H.osmophila SA334P-1 M.pulcherrima SC-16 P.occidentalis FBKL2.9173 S.bacillaris SFM17 Z.meyerae 91T A.pullulans I-Y383b W.anomalus L1202 OP644083.1 OP644242.1 KP324967.1 MF521987.1 KC160555.1 EU268641.1 PP235576.1 PP235640.1 MN371975.1 MK581089.1 MG017558.1 KP058520.1 GU585247.1 MH479120.1
由表2可知,14种不同类型的酵母菌分属于8个属11个种。其中,类型A~C被鉴定为酿酒酵母(Saccharomyces cerevisiae),类型D~E被鉴定为葡萄汁有孢汉逊酵母(Hanseniaspora uvarum),类型F~H分别被鉴定为有孢汉逊酵母属的罕见有孢汉逊酵母(Hanseniasporaoccidentalis)、葡萄酒有孢汉逊酵母(Hanseniasporavineae)、嗜高压有孢汉逊酵母(Hanseniaspora osmophila),类型I~N分别被鉴定为美极梅奇酵母(Metschnikowia pulcherrima)、西方毕赤酵母(Pichia occidentalis)、斯塔梅拉假丝酵母(Starmerella bacillaris(Candida zemplinina))、梅氏接合酵母(Zygoascus meyerae)、黑酵母菌(Aureobasidium pullulans)、异常威克汉姆酵母(Wickerhamomyces anomalus)。其中,W.anomalus除了应用于葡萄酒的发酵,近年来也更多应用于白酒、黄酒及其他果酒的发酵中[23]。其他菌种也常见于葡萄园、葡萄汁或葡萄酒的发酵过程中,对改善葡萄酒感官特性或促进发酵进程有相应贡献。例如,A.pullulans在发酵初期能够产生活性果胶酶,从而提高葡萄汁的澄清和浸渍效率;H. occidentalis和H.osmophila能够促进发酵过程中的乙酸酯类生成,改善葡萄酒香气的复杂性[24];Z.meyerae对青霉菌(Penicillium glabrum)有较强的拮抗作用,能够显著降低葡萄青霉病的发病率[25]。此外,相比于同类型基于实验室规模进行发酵微生物多样性的研究,本研究基于工业生产规模的方式进行实验,分离得到了更多种类的菌群[26-27]。同样的,何娟等[28]基于工业生产规模从贵人香冰酒的发酵过程中分离得到了9属10种酵母菌,显著多于同类型基于实验室规模研究的实验结果。这表明,基于工业生产方式进行葡萄酒发酵微生物多样性的研究结果更具可靠性,在说明产区发酵微生物群系组成时更具代表性。
2.2 维欧尼葡萄酒自然发酵过程中酵母菌菌群的动态演替分析
结合菌落计数和菌株鉴定结果,统计并计算得到了夏木酒庄维欧尼葡萄酒自然发酵不同时期酵母菌群的相对丰度,结果见图2。

图2 维欧尼葡萄酒自然发酵过程中的酵母菌群结构分析结果
Fig.2 Analysis results of yeast community structure during spontaneous fermentation of Viognier wine
由图2可知,在葡萄汁阶段,酵母菌菌群多样性最为丰富。进入发酵启动时期后,酿酒酵母迅速增殖并占据发酵体系的主导地位,这一结果与GAO P P等[29]的研究结论一致。此外,有孢汉逊酵母属的H. occidentalis、H.osmophila和H.uvarum在II时期后也能够通过培养获得。尤其是H.uvarum,能够与酿酒酵母共生至发酵的IV时期,表现出了对于发酵环境的极大适应性。而P.occidentalis、S.bacillaris、Z.meyerae及W.anomalus在葡萄汁中能够大量存在,但在启动发酵后的任一时期,都难以通过培养获得,这可能是它们的生长受到了酒精发酵过程中乙醇的抑制,或酿酒酵母的拮抗作用[30]。
2.3 酿酒酵母菌株的基因型鉴定
为进一步表征夏木酒庄维欧尼葡萄酒自然发酵体系中酿酒酵母菌株的遗传多样性,并筛选优势的本土野生酿酒酵母菌株,依据酵母菌26S rDNA序列的分析结果,从保藏的1 106株酿酒酵母中随机挑选30株代表菌株(每个时期选取6株)进行Interdelta PCR指纹图谱表征,以区分不同基因型的野生酿酒酵母菌株,酿酒酵母基因型的区分及分布结果见图3。
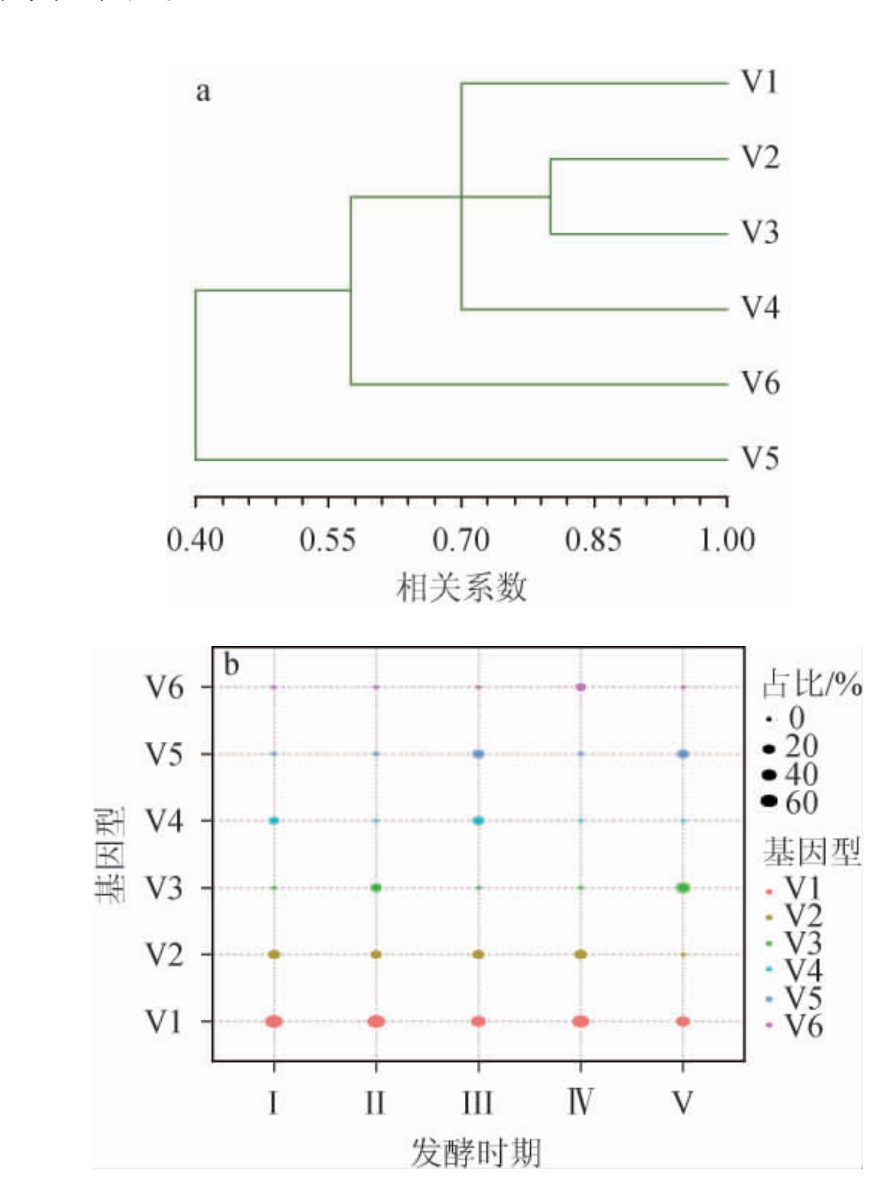
图3 供试酿酒酵母的基因型UPGMA聚类结果(a)及分布气泡图(b)
Fig.3 UPGMA clustering results (a) and distribution bubble map (b)of test Saccharomyces cerevisiae genotypic
由图3可知,从30株酿酒酵母中,区分出了6种不同的基因型(V1~V6)。其中,基因型为V1的酿酒酵母有10株,在发酵的各阶段均存在,是维欧尼葡萄酒自然发酵体系中的优势菌株,可能主导着发酵的进行。基因型为V2的酿酒酵母菌株数量仅次于V1,在发酵的前4个时期中均能够被发现,只在V时期中没有被发现,对葡萄酒的发酵有一定贡献。其他4种基因型的菌株,都只有2~3株被检测到,并只存在于一个时期或两个时期,对于葡萄酒发酵的参与程度不高。
3 结论
本研究采用可培养技术从工业生产规模下维欧尼葡萄酒自然发酵体系的不同发酵时期共分离得到1 513株酵母菌,通过形态观察及26S rDNA基因序列分析鉴定为8个属11个种。其中,Zygoascus meyerae、Aureobasidium pullulans和Wickerhamomyces anomalus在葡萄酒领域报道频率较低。大多数非酿酒酵母都只能在发酵初始阶段培养获得,仅Hanseniaspora uvarum表现出了较强的环境适应性,能够与酿酒酵母共存至发酵后期。通过进一步对1 106株酿酒酵母遗传多样性进行表征,获得了6种不同基因型的酿酒酵母。其中基因型为V1的酿酒酵母在发酵的各阶段均存在,推测其可能为维欧尼自然发酵体系的主导菌株。H.uvarum能够与酿酒酵母共生至IV时期(发酵后期),表现出对复杂发酵环境的较强适应能力。本研究较为系统地认识了贺兰山东麓产区维欧尼自然发酵体系中的酵母菌群多样性及演替规律,并为优良菌种的筛选奠定了基础,这对维欧尼葡萄酒风格的塑造具有潜在重要作用。
[1]LIU P T, LU L, DUAN C Q, et al.The contribution of indigenous non-Saccharomyces wine yeast to improved aromatic quality of Cabernet Sauvignon wines by spontaneous fermentation[J].LWT-Food Sci Technol,2016,71:356-363.
[2]DRUMONDE-NEVES J, FRANCO-DUARTE R, VIEIRA E, et al.Differentiation of Saccharomyces cerevisiae populations from vineyards of the Azores archipelago:geography vs ecology[J].Food Microbiol,2018,74:151-162.
[3]徐超,胡文效,陈明光,等.葡萄酒发酵香气物质调控研究进展[J].中外葡萄与葡萄酒,2024(1):81-93.
[4]程思琦,叶冬青,孙悦.功能微生物对葡萄酒风味的影响研究进展[J].生态学杂志,2023,42(11):2756-2766.
[5]LI H,JIANG D,LIU W,et al.Comparison of fermentation behaviors and properties of raspberry wines by spontaneous and controlled alcoholic fermentations[J].Food Res Int,2019,128:108801.
[6]胡宏远,张磊,李红英,等.2020年贺兰山东麓产区酿酒葡萄气象条件分析及气候品质评价[J].浙江农业科学,2022,63(11):2627-2632.
[7]WEI R T, CHEN N, DING Y T, et al.Correlations between microbiota with physicochemical properties and volatile compounds during the spontaneous fermentation of Cabernet Sauvignon (Vitis vinifera L.) wine[J].LWT-Food Sci Technol,2022,163:113529.
[8]薛蓓,于佳俊,杨帆,等.基于高通量测序技术的宁夏贺兰山东麓产区酿酒葡萄微生物多样性的研究[J].食品与发酵工业,2022,48(14):75-83,92.
[9]ZHANG S, CHEN X, ZHONG Q, et al.Microbial community analyses associated with nine varieties of wine grape Carposphere based on highthroughput sequencing[J].Microorganisms,2019,7(12):668.
[10]XU X,MIAOY,WANG H, et al.Analysis of microbial community diversity on the epidermis of wine grapes in Manasi's Vineyard,Xinjiang[J].Foods,2022,11(20):3174.
[11]CHARALAMBIA-EIRINI B, IOANNA C, IOANNIS M, et al.The effect of vine variety and vintage on wine yeast community structure of grapes and ferments[J].J Appl Microbiol,2022,132(5):3672-3684.
[12]杨文忠,徐国前.新引酿酒葡萄品种在宁夏贺兰山东麓产区的表现及评价[J].江苏农业科学,2023,51(20):179-185.
[13]王佳薇,李映龙,金悦,等.贺兰山东麓四个品种干白葡萄酒香气成分比较分析[J].农业科学研究,2023,44(2):90-96.
[14]SURANSKA H,VRANOVA D,OMELKOVA J.Isolation,identification and characterization of regional indigenous Saccharomyces cerevisiae strains[J].Braz J Microbiol,2016,47:181-190.
[15]ZARRAONAINDIA I,OWENS S M,WEISENHORN P,et al.The soil microbiome influences grapevine-associated microbiota[J].mBio,2015,6(2):e02527-14.
[16]LIANG L,MA Y W, JIANG Z Z, et al.Dynamic analysis of microbial communities and flavor properties in Merlot wines produced from inoculation and spontaneous fermentation[J].Food Res Int,2023,164:112379.
[17]MIROSLAV B,DAVID S,KATARINA Z,et al.Comparison of microbial diversity during two different wine fermentation processes[J].FEMS Microbiol Lett,2020,367:18.
[18]STEFANINI I, ALBANESE D, CAVAZZA A, et al.Dynamic changes in microbiota and mycobiota during spontaneous 'Vino Santo Trentino'fermentation[J].Microbial Biotech,2016,9:195-208.
[19]MASAYUKI T,TAMI O,KAZUO M,et al.Evaluation of microbial diversity in sulfite-added and sulfite-free wine by culture-dependent and-independent methods[J].J Biosci Bioeng,2014,117(5):569-575.
[20]COSTANTINI A,VAUDANO E, PULCINI L, et al.Yeast biodiversity in vineyard during grape ripening: Comparison between culture dependent and NGS analysis[J].Processes,2022,10(5):901.
[21]崔艳,梁丽雅,尹吉泰,等.低温结合超声波工艺酿造低醇甜白葡萄酒的研究[J].保鲜与加工,2018,18(6):89-94,99.
[22]周小玲,沈微,饶志明,等.一种快速提取真菌染色体DNA的方法[J].微生物学通报,2004(4):89-92.
[23]谢再斌,王太玉,王茜,等.异常威克汉姆酵母在白酒酿造中的应用研究[J].中国酿造,2022,41(5):18-22.
[24]BADURA J, KIENE F, BREZINA S, et al.Aroma profiles of Vitis vinifera L.cv.Gewürztraminer must fermented with co-cultures of Saccharomyces cerevisiae and seven Hanseniaspora spp.[J].Fermentation,2023,9:109.
[25]CABANAS C M, HERNANDEZ A, MARTINEZ A, et al.Control of Penicillium glabrum by indigenous antagonistic yeast from vineyards[J].Foods,2020,9:1864.
[26]杨慧敏,任晓娜,秦义.四川甘孜州高山葡萄酒产区酵母菌多样性分析[J].微生物学通报,2022,49(7):2673-2685.
[27]CHEN Y,JIANG J,SONG Y,et al.Yeast diversity during spontaneous fermentations and oenological characterisation of indigenous Saccharomyces cerevisiae for potential as wine starter cultures[J].Microorganisms,2022,10(7):1455.
[28]何娟,曹培鑫,黄英子,等.贵人香冰酒大生产过程中酵母菌群结构及动态变化[J].中国酿造,2014,33(5):30-33.
[29]GAO P P, PENG S, SAM F E, et al.Indigenous non-Saccharomyces yeasts with β-Glucosidase activity in sequential fermentation with Saccharomyces cerevisiae:A strategy to improve the volatile composition and sensory characteristics of wines[J].Front Microbiol,2022,13:845837.
[30]HUANG R,JIANG J,SU Y,et al.Microbial community succession and volatile compounds changes during spontaneous fermentation of Cabernet Sauvignon(Vitis vinifera L.)under rain-shelter cultivation[J].Food Chem,2023,17:100618.