山西老陈醋独具“酸、甜、绵、香、鲜”的特色[1],其发酵过程主要由霉菌、酵母菌、醋酸菌、乳酸菌等微生物共发酵,在发酵过程中形成了有机酸、挥发性香味物质、氨基酸等独特的风味物质[2]。众多学者对食醋发酵过程中的微生物群落多样性进行研究。WU J等[3]采用传统可培养技术对四川麸醋发酵过程中乳酸菌菌群多样性进行探究,结果共分离出34株乳酸菌,主要为耐久肠球菌(Enterococcus durans)、柠檬明串珠菌(Leuconostoc citreum)、乳酸乳球菌(Lactococcuslactis)和植物乳植杆菌(Lactiplantibacillusplantarum)等,其中,清酒乳杆菌(Lactobacillus sake)在谷物醋中首次被发现;王宗敏[4]对镇江香醋醋酸发酵过程中的微生物动态演替规律进行探究,结果发现,乳杆菌属(Lactobacillus)和醋酸杆菌属(Acetobacter)为主要优势细菌属,且在醋酸发酵过程中优势细菌属由乳酸菌逐渐演替为醋酸菌并成为主要产酸菌;HOU Z等[5]采用高通量测序技术对醋曲及山西老陈醋酿造过程中微生物的多样性进行分析,结果发现,大曲中主要细菌属为芽孢杆菌属(Bacillus)、Lactobacillus和魏斯氏菌属(Weissella),在酒精发酵阶段前期魏斯氏菌属为优势菌属,乳酸杆菌属在酒精发酵后期成为优势菌属,在醋酸发酵阶段,优势细菌属从最初的乳酸杆菌属演替为醋酸杆菌属;聂志强等[6]对天津独流老醋醋酸发酵阶段微生物多样性进行探究,结果表明,在醋酸发酵过程中乳酸菌为丰度最高的细菌,主要为乳杆菌属和魏斯氏菌属。
乳酸菌在固态食醋发酵过程中,主要与有机酸及挥发性风味物质的形成有关。乳酸菌主要通过同型乳酸发酵、专性异型乳酸发酵和兼性异型乳酸发酵3种代谢途径生成乳酸及各种有机酸[7],生成的乳酸和琥珀酸等不挥发性酸,可以缓解醋酸剌激的酸味,改善口感,同时还可以与醇类等物质发生酯化反应形成各种酯类物质,增加食醋香气[8]。刘凯凤等[9]从山西老陈醋发酵过程中分离纯化得到1株优良乳酸菌,该菌株生成的有机酸总量为1 225.79 mg/100 mL,产生的风味物质共计23种,其中酯类物质最为丰富。邓永建等[10]将10株不同乳酸杆菌应用于液态米醋发酵,结果表明,乳酸菌可增加液态发酵米醋中乳酸质量浓度,其中短乳杆菌(Lactobacillus brevis)L-02、L-03和罗伊氏乳杆菌(Lactobacillus reuteri)L-05对米醋中挥发性风味物质种类和含量的提升效果明显。此外,乳酸菌在发酵过程中还具有一些其他作用,如在酒精发酵阶段,乳酸杆菌与酿酒酵母(Saccharomyces cerevisiae)共发酵可提高彼此的环境适应性和生物量[11-12]。多数乳酸菌在代谢过程中会分泌多种抗菌肽、细菌素等,具有一定的杀菌、抑菌作用,同时乳酸菌创造的酸性环境,可抑制腐败菌和致病菌的生长,提高发酵质量[13]。乳酸菌在发酵过程中还会生成γ-氨基丁酸等功能性物质,提升食醋的保健功能[14]。然而,目前关于山西老陈醋发酵过程中乳酸菌菌群多样性及其动态的研究并不全面。
本研究采用Illumina Miseq高通量测序技术和传统可培养技术研究山西老陈醋大曲、酒醪和醋醅中的乳酸菌菌群结构,解析山西老陈醋发酵过程中乳酸菌菌群演替规律,并通过传统培养分离技术从中分离筛选产酸性能优良的乳酸菌菌株,考察其在MRS培养基、大麦豌豆培养基、高粱汁培养基和模拟醋醅培养基中的风味代谢特征,为进一步开发老陈醋专用大曲,酒精发酵、醋酸发酵分阶段强化菌剂和功能曲提供数据支持,进而提升山西老陈醋的发酵效率、稳定性和营养风味品质。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
分别采集山西老陈醋集团有限公司生产车间大曲成曲,酒精发酵0、1 d、2 d、3 d、5 d、7 d、9 d、11 d、13 d、15 d的酒醪和醋酸发酵0、1 d、3 d、5 d、7 d、9 d、11 d的醋醅样品。等距离(5 m)、等量(100 mL)从3个酒精发酵缸内共采集约300 mL的酒醪样品于灭菌的广口瓶中并混匀;等距离(5 m)、等量(100 g)从3个醋酸发酵缸中,距醋醅表面30 cm处,选取4个点共采集约300 g左右的醋醅样品于无菌自封袋中混匀带回实验室。采集的样品保存于-80 ℃冰箱,备用。
1.1.2 化学试剂
乳酸、乙酸、草酸、酒石酸、苹果酸、丙酮酸、柠檬酸、琥珀酸(均为色谱纯):天津市光复精细化工研究所;4-甲基-2-戊醇(色谱纯):美国Sigma-Aldrich公司;溶菌酶(酶活≥20 000 U/mg)、三羟甲基氨基甲烷(Tris)、乙二胺四乙酸-钠(ethylene diamine tetraacetic acid-sodium,EDTA-Na)(分析纯):天津市恒兴试剂有限公司;细菌基因组提取试剂盒:北京索莱宝科技有限公司;其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
MRS液(固)体培养基、大麦豌豆培养基、高粱汁培养基、模拟醋醅培养基:参考李雅茹[15]的方法配制。
1.2 仪器与设备
U3000高效液相色谱(high performance liquid chromatography,HPLC)仪、Trace 1300气相色谱(gas chromatography,GC)-ISQ质谱(mass spectrometer,MS)仪:赛默飞世尔科技有限公司;DYY-6C型琼脂糖凝胶电泳仪:北京六一仪器厂;5417R型高速冷冻离心机:德国Eppendorf公司;NanoDrop2000微量紫外可见光分光光度计:BJ-CD型超净工作台:上海跃进医疗器械厂;T100-聚合酶链式反应(polymerase chain reaction,PCR)仪、Universial Hood Ⅱ凝胶成像系统:美国Bio-Rad公司。
1.3 方法
1.3.1 高通量测序
参考王佳丽[16]提取样品的宏基因组脱氧核糖核酸(deoxyribonucleic acid,DNA),采用微量紫外-可见光分光光度计检测宏基因组DNA质量,当OD260nm值/OD280nm值维持在1.8~2.0范围内,表明宏基因组质量合格,可用于后续测序。以提取的宏基因组DNA为模板,加入特异性引物(515F和806R)、PCR Master Mix对细菌16S rDNA V4区基因序列进行PCR扩增,采用1%琼脂糖凝胶检测PCR扩增产物的完整性和纯度,送至深圳华大基因研究院进行文库构建及测序,测序平台为Illumina MiSeq 2000。
1.3.2 乳酸菌菌株的分离纯化及鉴定
采用稀释涂布法将大曲、酒醪、醋醅样品涂布于含有1%CaCO3的MRS固体培养基平板上,于37 ℃培养箱中培养48 h。挑取产生碳酸钙溶解圈的单菌落按三区划线法划线于MRS固体培养基进行菌种纯化,将革兰氏染色阳性、过氧化氢酶阴性的菌株初步判定为乳酸菌,将菌株接种至甘油管中于-80 ℃长期保存。参照文献[15]对分离得到的乳酸菌菌株进行分子生物学鉴定。
1.3.3 高产总酸、不挥发酸优良乳酸菌的筛选
将分离纯化得到的乳酸菌菌株接种至MRS液体培养基中,37 ℃条件下活化培养24 h,取发酵液,8 000 r/min离心5 min,弃上清液,加入无菌水制成菌悬液,调整菌体浓度为1×106 CFU/mL,以2%(V/V)的接种量接种于100 mL MRS液体培养基中,于37 ℃静置培养24 h,发酵结束后,取发酵液,8 000 r/min离心5 min,取上清液,采用氢氧化钠滴定法测定总酸含量[17],采用单沸式蒸馏法测定不挥发酸含量[18],筛选总酸、不挥发性酸含量高的优良乳酸菌。
1.3.4 优良乳酸菌菌株风味代谢特征分析
将方法1.3.3中的菌悬液(菌体浓度为1×106 CFU/mL)按2%(V/V)的接种量分别接种于MRS液体培养基、高粱汁培养基、大麦豌豆培养基和模拟醋醅培养基中,于37 ℃静置培养5 d。采用高效液相色谱法测定有机酸含量[19],采用顶空固相微萃取(headspace solid phase microextraction,HS-SPME)-GC-MS法测定挥发性风味物质[20]。
1.3.5 数据处理
使用FLASH v1.2.7软件,通过overlap关系对各样品的reads进行拼接,即可得到原始Tags数据(Raw Tags),使用Trimmomatic v0.33软件,对拼接得到的Raw Tags进行过滤,得到高质量的Tags数据(Clean Tags),再使用UCHIME v4.2软件,鉴定并去除嵌合体序列,得到最终有效数据(Effective Tags),最终按照97%的序列相似度划分操作分类单元(operational taxonomic units,OTU)。基于OTU信息进行多样性分析并对测序深度进行检测;采用Greengene datebase(http://greengenes.secondgenome.com/)和RDPdatebase(http://rdp.cme.msu.edu/)数据库对OTU进行注释后得到各水平分类学信息,在各个分类水平上进行群落结构及物种聚类等统计学分析。
2 结果与分析
2.1 山西老陈醋大曲、酒醪及醋醅中乳酸菌菌群结构分析
采用Illumina Miseq高通量测序技术和可培养技术对山西老陈醋大曲、酒精发酵及醋酸发酵过程中的乳酸菌菌群结构进行分析,结果见图1。
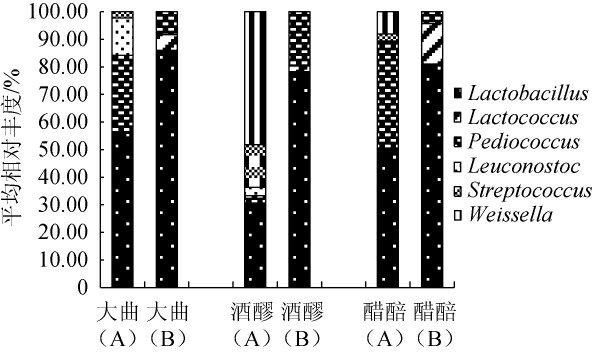
图1 山西老陈醋大曲、酒醪及醋醅中乳酸菌群落结构分析结果
Fig.1 Analysis results of the community structure of lactic acid bacteria of Daqu, fermented mash and Cupei of Shanxi aged vinegar during the fermentation process
A为高通量测序分析结果;B为传统可培养技术分析结果。
由图1可知,高通量测序结果显示,乳杆菌属(56%)、片球菌属(Pediococcus)(28%)、明串珠菌属(Leuconostoc)(13.63%)和链球菌属(Streptococcus)(2.23%)为大曲中的主要乳酸菌属。相似的,传统可培养技术分析结果也显示,乳杆菌属平均相对丰度最高(86%),其次为片球菌属(8%)。HUANG X N等[21]从大曲中共分离到59株乳酸菌菌株,隶属于4种乳酸菌属,分别为乳杆菌属、片球菌属、魏斯氏菌属和肠球菌属(Enterococcus)。杨勇等[22]研究发现,乳杆菌属与大曲水分和糖化力呈正相关;魏斯氏菌属、明串珠菌属、片球菌属则与酸度呈正相关,乳酸菌属对大曲中相关理化指标具有积极影响。刘文虎等[23]采用宏基因组学技术研究发现,大曲中魏斯氏菌属、伴生乳杆菌属(Companilactobacillus)产α-葡萄糖苷酶,黏液乳杆菌属(Limosilactobacillus)、明串珠菌属(Leuconostoc)和未分类乳杆菌目(unclassified Lactobacillales)等生成的乙醇脱氢酶及糠乳杆菌属(Furfurilactobacillus)、伴生乳杆菌属生成的羧酸酯酶对大曲糖化力、发酵力及酯化力的提升具有重要贡献。
酒精发酵阶段,高通量测序结果显示,魏斯氏菌属(48.21%)和乳杆菌属(30.12%)的平均相对丰度较高,与大曲相比,乳杆菌属平均相对丰度降低,魏斯氏菌属为新检测到的乳酸菌属。相似的,传统可培养技术分析结果也显示,乳杆菌属在酒精发酵阶段的平均相对丰度降低,由大曲中的85.95%下降到78.25%。魏斯氏菌属具有高产乳酸、胞外多糖等特性[24],同时魏斯氏菌属具有产β-葡糖苷酶的特性,也有助于原辅料中纤维素的降解[25-26]。WU J J等[27]对山西老陈醋发酵过程中微生物组成进行研究,结果表明,在酒精发酵过程中,乳杆菌属和魏斯氏菌属为主要优势细菌,与本实验结果一致。此外,高通量测序结果亦显示,片球菌属的平均相对丰度由大曲中的28.00%下降到2.70%;明串珠菌属平均相对丰度由大曲中的13.26%下降到3.08%,链球菌属(15.41%)平均相对丰度有所提高,乳球菌属为新检测到的乳酸菌属,平均相对丰度仅为0.48%。其中,明串珠菌属为典型异性发酵乳酸菌,主要利用葡萄糖产生乳酸、乙醇和乙酸等物质[27]。
醋酸发酵阶段,高酸环境下魏斯氏菌属(8.14%)、链球菌属(2.47%)和明串珠球菌属(0.41%)逐渐衰退,乳杆菌属(50.44%)、片球菌属(38.47%)逐步成为醋酸发酵过程中的优势菌属。传统可培养技术分析结果显示,在醋酸发酵阶段,乳杆菌属(81.02%)为主要优势菌属,乳球菌属(0.07%)在醋酸发酵阶段虽被检测到,但平均相对丰度很低。结果表明,乳杆菌属为食醋酿造过程中主要优势乳酸菌属。有研究发现,乳杆菌属在pH 3.0的环境中仍然能生存,耐酸力较强[28]。寇蓉等[29]研究发现,山西老陈醋醋酸发酵阶段的优势乳酸菌属为乳杆菌属和魏斯氏菌属等,这与本研究结果一致。
传统可培养技术具有局限性,在食醋酿造过程中仅检测到3种乳酸菌属,传统可培养技术仅能培养出样品中一小部分的微生物,无法全面真实地反映老陈醋的微生物群落演替规律。高通量测序在食醋酿造过程中共检测到6种乳酸菌属,具有高效、结果准确、生物信息全面等优点,但是许多微生物不能分离培养出来[19,30]。培养组学(culturomics)是采用多种培养条件,结合快速鉴定技术,培养、分离和鉴定细菌种属的方法,培养组学的出现恰好弥补宏基因组学技术的弊端,因此,进一步采用培养组学技术分离出更多菌株,丰富微生物多样性,从而筛选出更多适用于食醋酿造优良的菌株。
2.2 优良乳酸菌菌种的分离纯化及筛选
通过传统培养分离技术从大曲、酒醪和醋醅样品中共分离纯化出100株乳酸菌,其中从大曲样品中共分离出27株乳酸菌,酒醪样品中共分离出35株乳酸菌,醋醅样品中共分离出38株乳酸菌。通过对其发酵特性进行筛选,共筛选出10株总酸和高产不挥发性酸含量高的优良乳酸菌菌株,其产酸特性见表1。
表1 10株优良乳酸菌菌株产总酸和不挥发性酸含量测定结果
Table 1 Determination results of total acid and non-volatile acid contents produced by 10 strains of excellent lactic acid bacteria
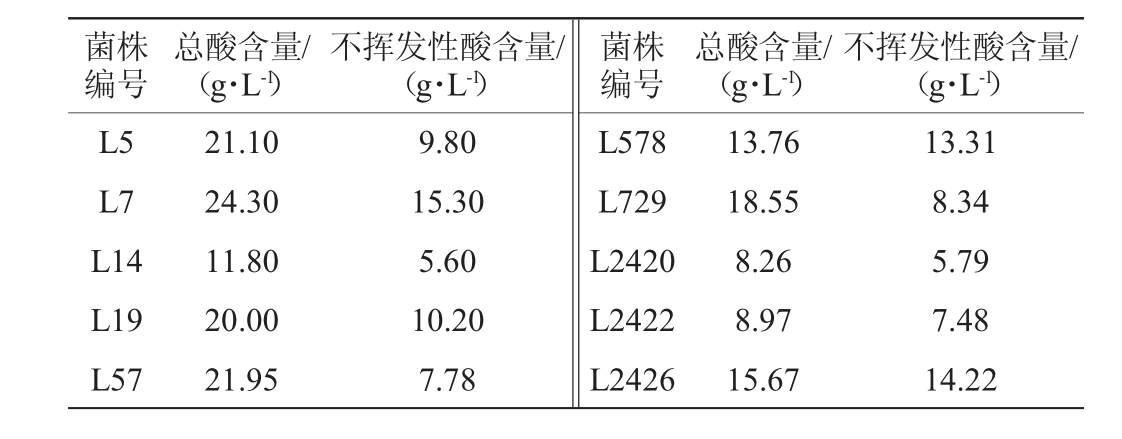
菌株编号总酸含量/(g·L-1)不挥发性酸含量/(g·L-1)菌株编号总酸含量/(g·L-1)不挥发性酸含量/(g·L-1)L5 L7 L14 L19 L57 21.10 24.30 11.80 20.00 21.95 9.80 15.30 5.60 10.20 7.78 L578 L729 L2420 L2422 L2426 13.76 18.55 8.26 8.97 15.67 13.31 8.34 5.79 7.48 14.22
由表1可知,10株优良乳酸菌菌株产总酸含量在8.26~24.30g/L范围内,产不挥发性酸含量在5.60~15.3g/L范围内。
2.3 优良乳酸菌菌株的分子生物学鉴定
采用分子生物学技术对10株优良乳酸菌菌株进行鉴定,结果见表2。
表2 10株优良乳酸菌菌株的鉴定结果
Table 2 Identification results of 10 strains of excellent lactic acid bacteria
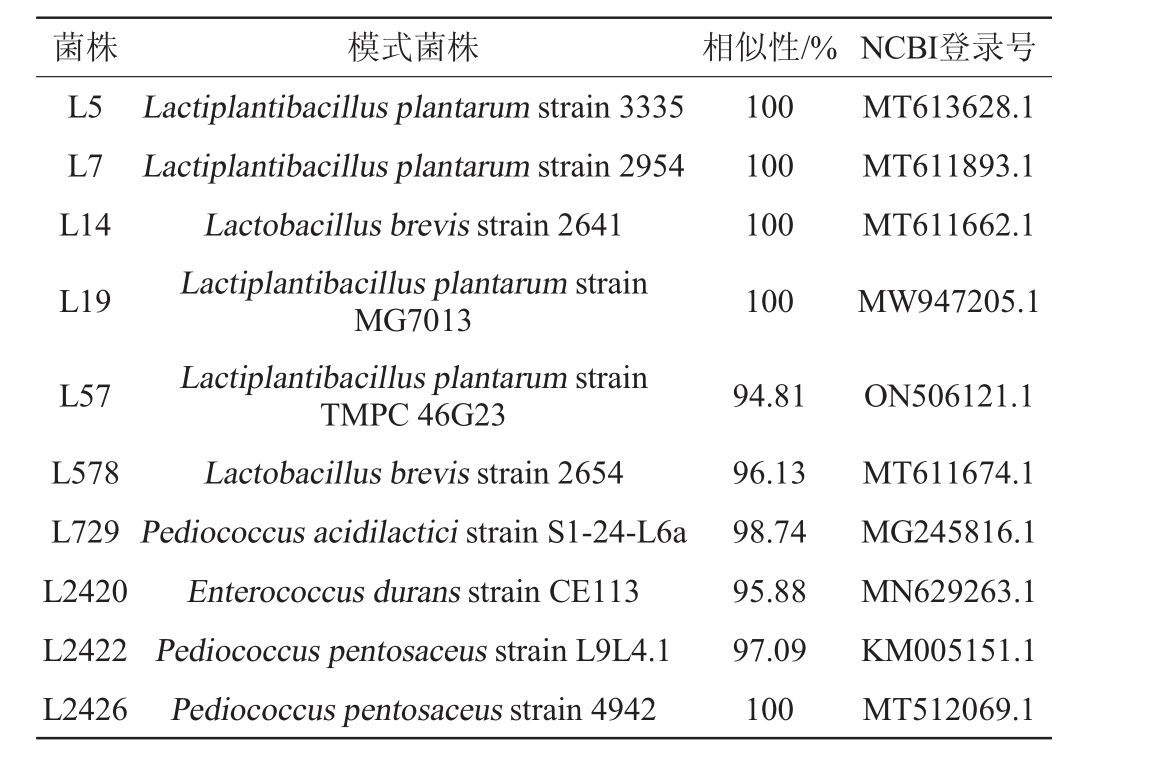
菌株 模式菌株 相似性/% NCBI登录号L5 L7 L14 L19 100 100 100 100 MT613628.1 MT611893.1 MT611662.1 MW947205.1 L57 L578 L729 L2420 L2422 L2426 Lactiplantibacillus plantarum strain 3335 Lactiplantibacillus plantarum strain 2954 Lactobacillus brevis strain 2641 Lactiplantibacillus plantarum strain MG7013 Lactiplantibacillus plantarum strain TMPC 46G23 Lactobacillus brevis strain 2654 Pediococcus acidilactici strain S1-24-L6a Enterococcus durans strain CE113 Pediococcus pentosaceus strain L9L4.1 Pediococcus pentosaceus strain 4942 94.81 96.13 98.74 95.88 97.09 100 ON506121.1 MT611674.1 MG245816.1 MN629263.1 KM005151.1 MT512069.1
由表2可知,菌株L5、L7、L19、L57均与植物乳植杆菌(Lactiplantibacillus plantarum)亲缘关系最近,因此,鉴定其为植物乳植杆菌(Lactiplantibacillus plantarum)。菌株L14、L578分别与短乳杆菌(Lactobacillus brevis)strain 2641、Lactobacillus brevis strain 2654亲缘关系最近,因此,鉴定其为短乳杆菌(Lactobacillus brevis)。菌株L2422、L2426分别与戊糖片球菌(Pediococcus pentosaceus)strain L9L4.1、Pediococcus pentosaceus strain 4942亲缘关系最近,因此,鉴定其为戊糖片球菌(Pediococcus pentosaceus)。菌株L729与乳酸片球菌(Pediococcus acidilactici)strain S1-24-L6a亲缘关系最近,因此,鉴定其为乳酸片球菌(Pediococcus acidilactici)。菌株L2420与耐久肠球菌(Enterococcus durans)strain CE113聚于一支,亲缘关系最近,因此,鉴定其为耐久肠球菌(Enterococcus durans)。
2.4 优良乳酸菌菌株在不同培养基中的风味代谢特征
2.4.1 优良乳酸菌菌株在不同培养基中产有机酸特征
采用HPLC法对10株优良乳酸菌菌株在4种模拟培养基中代谢产生的有机酸含量进行研究,并绘制热图,结果见图2。
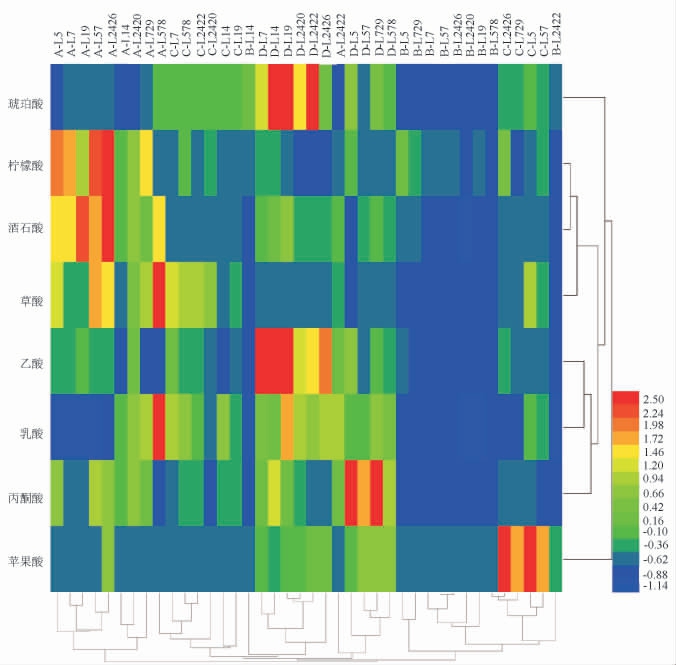
图2 10株优良乳酸菌菌株在不同培养基中有机酸含量热图
Fig.2 Heat map of organic acid contents produced by 10 strains of excellent lactic acid bacteria in different culture media
A:MRS液体培养基;B:大麦豌豆培养基;C:高粱汁培养基;
D:模拟醋醅培养基。
由图2可知,10株优良乳酸菌菌株生成的有机酸最终聚为两大支,即MRS液体培养基中8株乳酸菌菌株代谢产生的有机酸图谱聚为一支,而另外3种模拟培养基10株乳酸菌菌株及MRS液体培养基中菌株L578和L2422代谢产生的有机酸图谱聚为另一大支。在MRS液体培养基与模拟醋醅培养基中,10株乳酸菌菌株代谢产生的有机酸总量及乳酸含量均高于大麦豌豆培养基和高粱汁培养基。分析原因可能是,MRS液体培养基为成品培养基,有丰富的碳源、氮源及各种矿物质,营养条件丰富,更有利于乳酸菌的生长。在MRS液体培养基中,短乳杆菌L578和戊糖片球菌L2426代谢产生的有机酸总量最高,分别为4.43 g/100 g和3.44 g/100 g。其中,短乳杆菌L578代谢产生的乳酸、琥珀酸含量最高,分别为1.54 g/100 g和0.05 g/100 g。在模拟醋醅培养基中,植物乳植杆菌L19和植物乳植杆菌L7代谢产生的有机酸总量较高,分别为3.35 g/100 g和2.88 g/100 g,其中,植物乳植杆菌L19代谢产生的乳酸和琥珀酸含量较高,分别为0.98 g/100 g和0.22 g/100 g。
综上所述,短乳杆菌L578在MRS液体培养基中代谢产生的有机酸及乳酸含量最高,植物乳植杆菌L19在模拟醋醅培养基中代谢产生的有机酸及乳酸含量最高,说明短乳杆菌L578和植物乳植杆菌L19具有良好的代谢产生有机酸的特性,可进一步开发其生产潜力,将其应用于山西老陈醋醋酸发酵阶段,增加山西老陈醋醋酸发酵阶段有机酸含量,从而提升食醋整体品质。
2.4.2 优良乳酸菌菌株在不同培养基中产挥发性风味代谢特征
采用HS-SPME-GC-MS测定10株优良乳酸菌菌株在4种模拟培养基中代谢产生的挥发性风味物质,结果共检测到100种挥发性风味物质,包括酯类26种、酸类14种、醇类17种、醛类12种、酮类13种、吡嗪类3种及其他类15种,其总含量见图3。
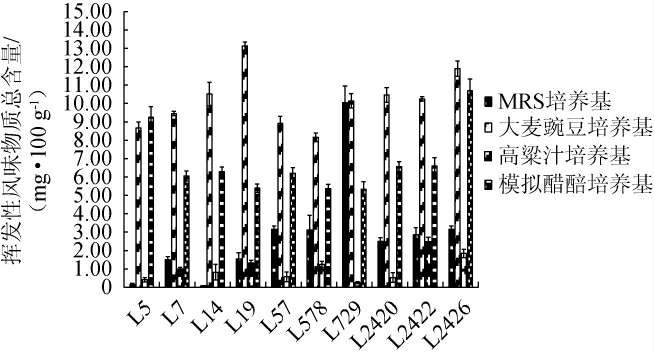
图3 10株优良乳酸菌菌株在不同培养基中挥发性风味物质总量
Fig.3 Total contents of volatile flavor compounds produced by 10 strains of excellent lactic acid bacteria in different culture media
由图3可知,在大麦豌豆培养基和模拟醋醅培养基中,除乳酸片球菌L729外,剩余9株乳酸菌菌株代谢产生的挥发性风味物质总量均高于MRS液体培养基和高粱汁培养基。
食醋中重要酯类物质主要包括乳酸乙酯、乙酸乙酯、乙酸苯乙酯、乙酸异戊酯等,其中,乳酸乙酯具有朗姆酒、水果和奶油的香气,乙酸异戊酯具有香蕉味,乙酸乙酯具有水果香气,乙酸苯乙酯具有甜蜜香味;醇类物质主要包括乙醇、苯乙醇、2,3-丁二醇等,其中,苯乙醇具有玫瑰花香和香甜蜂蜜味;醛类物质主要包括糠醛、苯甲醛和苯乙醛等,其中,苯甲醛和苯乙醛具有杏仁香气;2-庚酮是主要的酮类物质[31-33]。2,3-丁二酮(乙偶姻)是生成山西老陈醋功能性物质川芎嗪的前体物质,对食醋风味有重要贡献,2,3,5,6-四甲基吡嗪(川芎嗪)为山西老陈醋特征性功能物质,在发酵过程中由糖和氨基酸生成,主要在熏醅和陈酿阶段大量积累[34]。基于此,选取30种主要挥发性风味物质,进一步对10株优良乳酸菌菌株在不同模拟培养基中主要挥发性风味物质代谢特征进行研究,结果见图4。
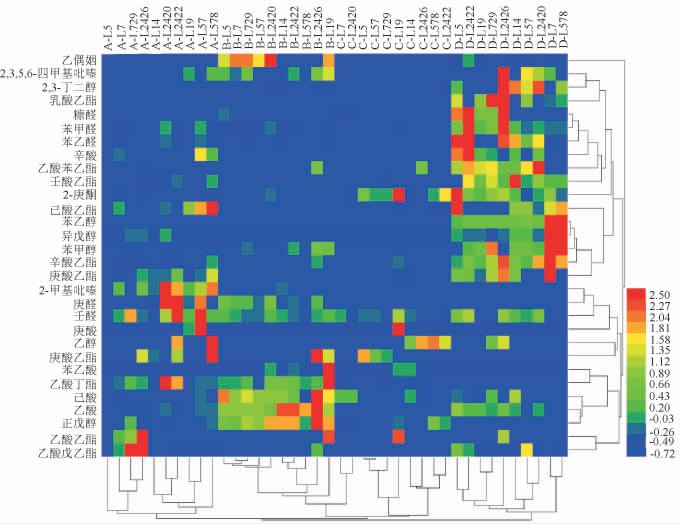
图4 10株优良乳酸菌菌株在不同培养基中挥发性风味物质含量热图
Fig.4 Heat map of volatile flavor compounds contents produced by 10 strains of excellent lactic acid bacteria in different culture media
由图4可知,10株乳酸菌菌株代谢产生的挥发性风味物质最终聚为两大支,即模拟醋醅培养基中10株乳酸菌菌株代谢产生的挥发性风味物质图谱聚为一支,而另外3种模拟培养基中乳酸菌菌株代谢产生的挥发性风味物质聚为另一大支。
在大麦豌豆培养基中,植物乳植杆菌L19及戊糖片球菌L2426代谢产生的挥发性风味物质总含量较高,分别为13.13 mg/100 g、11.89 mg/100 g。植物乳植杆菌L19代谢产生的酯类、吡嗪类物质总含量最高,分别为1.00 mg/100 g、0.04 mg/100 g,其中乙酸乙酯含量高达0.88 mg/100 g;戊糖片球菌L2426代谢产生的醇类物质、酸类物质总含量最高,分别为0.50 mg/100 g和11.00 mg/100 g。总体上,乙酸、苯乙酸、己酸在大麦豌豆培养基中含量明显高于其他培养基,其中戊糖片球菌L2426在大麦豌豆培养基代谢产生的乙酸含量最高,为10.90 mg/100 g。结果表明,植物乳植杆菌L19和戊糖片球菌L2426更适应与大曲发酵,可将其作为优良菌株强化大曲发酵,对大曲增香具有一定指导意义。
在模拟醋醅培养基中,植物乳植杆菌L5及戊糖片球菌L2426代谢产生的挥发性风味物质总含量最高,分别为9.25 mg/100 g、10.25 mg/100 g。戊糖片球菌L2426代谢产生的酯类物质总含量最高,为2.11 mg/100 g,且其代谢产生乳酸乙酯能力(1.14 mg/100 g)明显高于其他3种模拟培养基;植物乳植杆菌L7、短乳杆菌L578和戊糖片球菌L2426代谢产生的醇类物质总含量较高,分别为4.53 mg/100 g、4.86 mg/100 g、4.31 mg/100 g,其中,植物乳植杆菌L7代谢产生的异戊醇和苯乙醇含量最高,分别为1.72 mg/100 g、2.66 mg/100 g,戊糖片球菌L2426代谢产生的2,3-丁二醇及乙醇含量最高,分别为2.89 mg/100 g、0.534 mg/100 g;植物乳植杆菌L5、戊糖片球菌L2426代谢产生的酸类物质总含量较高,分别为5.80 mg/100 g、3.77 mg/100 g;戊糖片球菌L2426代谢产生的吡嗪类物质总含量最高,为0.09 mg/100 g。
在模拟醋醅培养基中,戊糖片球菌L2426代谢产生的乳酸乙酯、2,3-丁二醇、糠醛、苯甲醛、苯乙醛和2,3,5,6-四甲基吡嗪含量较高;耐久肠球菌L2420代谢产生的乙酸苯乙酯能力明显强于其他3种培养基;植物乳植杆菌L7、短乳杆菌L578代谢产生的苯乙醇能力明显强于其他3种模拟培养基;戊糖片球菌L2422代谢产生的糠醛、苯甲醛和苯乙醛能力明显强于其他3种模拟培养基。综上,戊糖片球菌L2426在模拟醋醅培养基中代谢产生的主要挥发性风味物质总量最高,且生成酯类、酸类、醇类及吡嗪类物质含量也较高,说明其在模拟醋醅培养基中生成挥发性风味物质能力更强,可作为优良菌株强化山西老陈醋醋酸发酵阶段,提高食醋中挥发性风味物质种类和含量,从而提升食醋整体品质。
在高粱汁培养基中,所有菌株代谢产生的挥发性风味物质都比较少,其中,戊糖片球菌2422、戊糖片球菌2426代谢产生的挥发性风味物质含量最高,仅为2.49 mg/100 g、1.84 mg/100 g。在MRS液体培养基中,乳酸片球菌L729代谢产生的挥发性风味物质含量最高,为10.05 mg/100 g,其余乳酸菌产挥发性香气总量在0.08~3.16 mg/100 g之间。
综上,乳酸菌菌株发酵大麦豌豆培养基中酸类总量较高,发酵模拟醋醅培养基中酯类、醛类、醇类总量较高;植物乳植杆菌L19、戊糖片球菌L2426代谢产生的挥发性风味物质含量较高,可作为优良乳酸菌应用于食醋酿造过程,提升食醋整体风味。
3 结论
本研究通过Illumina Miseq高通量测序技术及传统分离手段相结合的手段解析了山西老陈醋发酵过程中的乳酸菌菌群结构,高通量测序共检测到6种乳酸菌属,传统可培养技术仅检测到3种乳酸菌属,大曲的主要乳酸菌属为乳杆菌属(Lactobacillus)和片球菌属(Pediococcus),酒精和醋酸发酵阶段主要乳酸菌属为魏斯氏菌属(Weissella)、乳杆菌属和片球菌属。进一步从大曲、酒醪和醋醅中筛选出高产酸(8.26~24.30 g/L)、高产不挥发性酸(5.60~15.3 g/L)优良菌株10株,经分子生物学鉴定,4株为植物乳植杆菌(Lactiplantibacillus plantarum),2株为短乳杆菌(Lactobacillus brevis),2株为戊糖片球菌(Pediococcus pentosaceus),1为株乳酸片球菌(Pediococcus acidilactici)和1株为耐久肠球菌(Enterococcus durable)。通过HPLC及HS-SPMEGC-MS探究10株优良乳酸菌菌株在不同模拟培养基中的风味代谢特征,结果表明,10株乳酸菌菌株在MRS液体培养基与模拟醋醅培养基中代谢产生的有机酸总量及乳酸含量较高,其中,短乳杆菌L578在MRS液体培养基中代谢产生的有机酸(4.43 g/100 g)及乳酸含量(1.54 g/100 g)最高,植物乳植杆菌L19在模拟醋醅培养基中代谢产生的有机酸含量(3.35 g/100 g)及乳酸含量(0.98 g/100 g)最高,说明短乳杆菌L578和植物乳植杆菌L19具有良好的代谢产生有机酸的特性,可作为优势菌株强化山西老陈醋醋酸发酵,增加食醋中有机酸含量。从4种模拟培养基中共检测出100种挥发性风味物质,大部分乳酸菌菌株在大麦豌豆培养基和模拟醋醅培养基中代谢产生的挥发性风味物质总含量较高,其中,植物乳植杆菌L19和戊糖片球菌L2426分别在大麦豌豆培养基、模拟醋醅培养基中代谢产生的挥发性风味物质总含量较高,分别为13.13mg/100g、10.25mg/100 g,说明植物乳植杆菌L19、戊糖片球菌L2426代谢产生的挥发性风味物质含量较高,可作为优势乳酸菌应用于食醋酿造过程提升食醋整体风味。综上,植物乳植杆菌L19具有优良风味代谢特性。本研究结果为开发强化大曲,制作直投式发酵菌剂奠定基础,同时可提高食醋发酵过程产酸和产风味物质能力,从而提升食醋整体品质。
[1]陈旭峰,朱丹,郭宏萍,等.山西老陈醋酿造过程中理化指标动态变化及新淋醋品质分析[J].中国酿造,2021,40(12):52-57.
[2]尹俊玲.传统手工和现代工业化生产镇江香醋风味组成的比较研究[D].镇江:江苏大学,2016.
[3]WU J,LI Q,HU K D,et al.Microbial characterization of Sichuan Baoning vinegar:lactic acid bacteria,acetic acid bacteria and yeasts[J].Arch Microbiol,2024,206:59.
[4]王宗敏.镇江香醋醋酸发酵阶段菌群结构变化与风味物质组成之间的相关性研究[D].无锡:江南大学,2016.
[5]HOU Z, ZHANG J, DANG L, et al.Correlation analysis of microbial community changes and physicochemical characteristics in aged vinegar brewing[J].Foods,2023,12(18):3430.
[6]聂志强,韩玥,郑宇,等.宏基因组学技术分析传统食醋发酵过程微生物多样性[J].食品科学,2013,34(15):198-203.
[7]曹珊.山西老陈醋醋酸发酵阶段乳酸菌乳酸合成代谢分析[D].天津:天津科技大学,2018.
[8]许女,贾瑞娟,李雅茹,等.老陈醋来源乳酸菌的益生特性筛选及安全评价[J].中国食品学报,2020,20(10):23-33.
[9]刘凯凤,杨丽,郑胜蓝,等.山西老陈醋中优势产酸菌的分离纯化及功能分析[J].食品工业科技,2020,41(6):124-130.
[10]邓永建,陆震鸣,张晓娟,等.不同乳酸菌对液态发酵米醋总酸及风味物质的影响[J].食品科学,2020,41(22):97-102.
[11]高丽.传统发酵食品中乳酸菌和酵母菌互作机制分析[J].食品安全导刊,2023(21):172-174,178.
[12]FAN Y,HUANG X N,CHEN J Y,et al.Formation of a mixed-species biofilm is a survival strategy for unculturable lactic acid bacteria and Saccharomyces cerevisiae in Daqu, a Chinese traditional fermentation starter[J].Front Microbiol,2020,11:510900.
[13]张小凤.传统食醋发酵过程潜在抗菌肽基因及其与微生物演替的关系分析[D].天津:天津科技大学,2022.
[14]山西梁汾醋业有限司.高γ-氨基丁酸食醋的研究开发[EB/OL].[2014-09-23].https://www.1633.com/tec/zuuuuulgu.shtml.
[15]李雅茹.山西老陈醋源优良酵母菌和乳酸菌的筛选、互作及应用研究[D].晋中:山西农业大学,2019.
[16]王佳丽.山西老陈醋大曲制备过程中微生物群落动态变化及优良霉菌的筛选[D].晋中:山西农业大学,2019.
[17]中华人民共和国卫生部,中国国家标准化管理委员会.GB/T 5009.41—2003 食醋卫生标准的分析方法[S].北京:中国标准出版社,2003.
[18]国家质量技术监督局.GB/T 18187—2000 酿造食醋[S].北京:中国标准出版社,2000.
[19]张天震.山西老陈醋微生物酿造机理及四大名醋指纹图谱差异性研究[D].晋中:山西农业大学,2019.
[20]孙晓琪,王宏霞,张慧如,等.山西老陈醋陈酿过程中挥发性香气物质和功能物质的变化规律[J].中国酿造,2023,42(3):34-40.
[21]HUANG X N, FAN Y, MENG J, et al.Laboratory-scale fermentation and multidimensional screening of lactic acid bacteria from Daqu[J].Food Biosci,2021,40:100853.
[22]杨勇,葛向阳,张龙云,等.基于高通量测序技术解析中高温制曲细菌群落的演替规律[J].酿酒科技,2022(8):34-41.
[23]刘文虎,柴丽娟,张立强,等.基于宏基因组学解析不同质量等级中温大曲微生物组的异质性[J].微生物学报,2023,63(11):4383-4398.
[24]谷新晰,王晨笑,于宏伟,等.壳寡糖对泡菜品质、微生物多样及演替规律的影响[J].中国食品学报,2021,21(10):125-132.
[25]黄倩,梁安健,朱鹏程,等.魏斯氏菌胞外多糖在发酵食品中的应用进展[J].食品科学,2024,45(4):352-359.
[26]王海娟,戴雨珂,潘渠.魏斯氏菌的研究现状[J].成都医学院学报,2014,9(6):747-750.
[27]WU J J,MA Y K,ZHANG F F,et al.Biodiversity of yeasts,lactic acid bacteria and acetic acid bacteria in the fermentation of Shanxi aged vinegar,a traditional Chinese vinegar[J].Food Microbiol,2012,30(1):289-297.
[28]陈进,陈萍,谭光迅,等.浓香型白酒酿造过程中酒醅微生物区系变化特征分析[J].酿酒科技,2023(8):17-23.
[29]寇蓉,董弘毅,何永吉,等.山西陈醋酿造微生物群落结构及其互作网络分析[J].中国酿造,2022,41(4):59-64.
[30]王晓彬.基于培养组学的食醋发酵过程微生物分离培养[D].天津:天津科技大学,2022.
[31]许女,张天震,樊玮鑫,等.山西老陈醋酿造过程中香气成分的动态变化[J].中国食品学报,2018,18(11):198-210.
[32]郭鑫磊,王宏霞,施明丽,等.不同陈酿年份四大名醋有机酸及挥发性风味物质比较分析[J].中国酿造,2023,42(7):58-64.
[33]胡航伟,刘凌霄,张文萌,等.谷物醋酿造过程中微生物多样性及挥发性风味物质变化研究进展[J].中国调味品,2023,48(7):42-48.
[34]谢三款.山西老陈醋四甲基吡嗪形成机制及代谢调控[D].天津:天津科技大学,2021.