酱香型白酒是我国白酒四大基础香型酒之一,具有“四高两长”的特点,即高温制曲、高温堆积、高温发酵、高温馏酒、生产周期长、原酒贮存时间长等[1]。其中高温堆积发酵是酱香型白酒不同于其他白酒生产的独特工艺,它的主要作用是网络堆积环境中的微生物进行生长繁殖,为后续的窖内发酵富集重要的微生物、酶、风味物质及前体物质。堆积效果的质量与轮次基酒的产质量直接相关,因此堆积工艺又被称为酱香型白酒生产的“二次制曲”[2]。目前,判断堆积发酵质量的好坏主要依靠两点:一是检测堆子表面的堆积温度,二是观察堆子周围的白色霉菌是否分布均匀[3]。这种方法很大程度上依赖酒师的个人经验,不利于现代化酱香型白酒的酿造。酱香型白酒酒醅在堆积过程中,会受到理化因素与微生物因素的双重影响,只有各项影响因素保持在一定数值范围内,各项指标达到最优的关联状态,酒醅发酵才能达到最佳效果[4]。
目前对酱香型白酒发酵过程的检测主要有理化指标与微生物指标。其中对酒醅理化指标的研究大多数是针对酒醅的水分、酸度、淀粉含量、还原糖含量和酒精度等理化指标的变化[5-6];对微生物的研究主要是通过高通量测序[7]、宏基因组检测[8]、荧光定量聚合酶链式反应(fluorescent quantitative polymerase chain reaction,fqPCR)检测[9]、传统可培养法[10]等方法,确定其发酵过程中的优势菌株或关键菌株的数量变化。其中,荧光定量PCR检测技术通过设计特异性引物有效地检验样品中的微生物[11]。与其他技术相比,荧光定量PCR具有快速、高效的特点[12]。目前荧光定量聚合酶链式反应技术在白酒生产中已完成了链霉菌、产甲烷菌、放线菌、乳杆菌的定量检测[13-16]。
本实验完成了对下沙到四轮次堆积终点酒醅样品的生物指标与非生物指标的检测。非生物指标包括水分、酸度、葡萄糖、乙醇、淀粉、L-乳酸、温度,生物指标包括发酵力、糖化酶活力、酵母菌总数、酵母菌活菌率、酿酒酵母(Saccharomyces cerevisiae)数量、拜尔接合酵母(Zygosaccharomyces bailii)数量。通过对各轮次检测的指标与各轮次酒的基酒产量与基酒品质的相关性分析,为堆积入窖的终点判断提供了更多的数据支持,为酱香型白酒堆积工艺的改进提供了重要的参考价值。
1 材料与方法
1.1 材料与试剂
样品采集自贵州国台酒庄公司制酒车间下沙至4轮次堆积终点的发酵酒醅。
D-山梨醇(分析纯)、RNase A酶(10 U/μL)、Lyticase溶壁酶:北京索莱宝科技有限公司;AceQR Universal SYBR聚合酶链式反应(PCR)Master Mix:南京诺唯赞生物科技股份有限公司;酵母基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司;PCR引物:美国AZENTA公司。
1.2 仪器与设备
M-100生物传感器分析仪:深圳市希尔曼科技有限公司;T117温度探头:深圳市拓尔为电子科技有限公司;CX33光学显微镜:ACHILLES公司;FQD-96A荧光定量聚合酶链反应(realtime fluorescence quantitative PCR,Q-PCR)检测系统:广州博日生物科技有限公司;F-0105福洋牌超声波清洗机:深圳福洋科技集团有限公司。
1.3 方法
1.3.1 样品处理
选取贵州国台酒庄有限公司一、二、八车间共52个堆子,在堆积发酵终点时期进行取样,取样位置选取堆子距地面高1.3 m,距堆表层15 cm平面内均匀的五个点,将五点混合后的样品作为待测样品,具体取样方案见图1。每个堆子取样约500 g,使用无菌袋将待测酒醅置于-80 ℃冰箱保存,用于后续的荧光定量PCR检测以及相关理化指标、酶活力的检测。
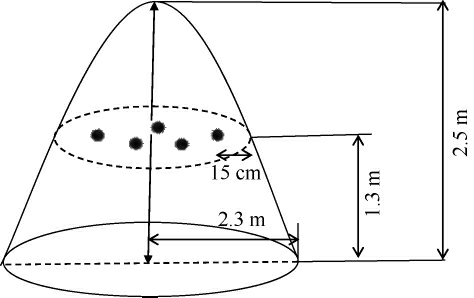
图1 取样示意图
Fig.1 Schematic diagram of sampling
1.3.2 分析检测
(1)理化指标与温度的测定
采用地方标准DB 34/T 2264—2014《固态发酵酒醅分析方法》对酒醅进行水分含量、酸度、淀粉含量测定进行检测;根据冯海燕等[17]的方法采用生物传感器对L-乳酸、乙醇、葡萄糖含量进行检测。
将温度探头插入距地面1.3 m高度的堆子中,对不同深度(15 cm、50 cm、100 cm、180 cm)的堆积终点酒醅进行温度监测。
(2)糖化力及发酵力的测定
酒醅中糖化力、发酵力的测定,参照QB/T 4257—2011《酿酒大曲通用分析方法》。
(3)酵母总数与活菌率检测
采用血球计数板计数的方法对酵母总数进行检测,采用美兰染色的方法测定酵母活菌数,并对酵母活菌率进行计算。
(4)酒醅中酿酒酵母与拜尔结合酵母的检测
酒醅中酿酒酵母与拜尔结合酵母通过荧光定量PCR(Q-PCR)的方法进行检测。该实验方法主要分为三步,分别是酒醅样品前处理、DNA提取、fqPCR检测。
对酒醅样品进行前处理:取5 g酒醅于离心管中,加入25 mL无菌水,于超声波清洗机中超声7 min,恒温振荡培养箱中振荡30 min,1 000×g离心5 min,取1 mL上清液用于DNA提取。
DNA提取:采用酵母基因组DNA提取试剂盒提取样本酵母菌DNA,具体操作流程见试剂盒说明书。酿酒酵母采用引物SC-F(5'-ACATATGAAGTATGTTTCTATATAACGGGTG-3')和SC-R(5'-TGGTGCTGGTGCGGATCTA-3'),拜尔接合酵母采用引物ZB-F(5'-CATGGTGTTTTGCGCC-3')和ZB-R(5'-CGTCCGCCACGAAGTGGTAGA-3')。
fqPCR检测:反应程序为95 ℃预变性5 min;95 ℃变性10 s;60 ℃退火30 s;40 次循环;PCR扩增体系为2(AceQ为GCCACGAAGTGGTAGAATAAMaster Mix 10 μL;正向与反向引物各0.5 μL;DNA模板2 μL;使用双蒸水(ddH2O)补齐体系至20 μL。
(5)基酒产量与品质数据的采集
基酒感官数据由贵州国台酒庄品酒班提供,品酒员均具有国家二级品酒师及以上资质。每一份酒样根据品酒班评定基酒等级若干指标以及权重来评定打分,评分权重见表1。
表1 各轮次基酒感官品评打分权重
Table 1 Weight of sensory rating of each round of base liquor

酱香/分焦香/分粮香/分酸涩味/分醇和度/分持久度/分干净度/分合计/分造沙一轮次二轮次三轮次四轮次20 20 20 30 15 15 20 20 10 10 10 20 20 20 10 10 10 10 10 40 40 40 40 40 100 100 100 100 100
1.3.3 数据处理
各轮次酒醅堆积终点的指标通过Mintab软件对数据进行单值控制并得出其标准区间;采用SPSS 26.0软件对各数据进行相关性统计分析;将所得数据应用Origin Pro 2022软件作图分析。
2 结果与分析
2.1 各轮次酒醅堆积终点温度的研究
堆子在同一时期不同空间的酒醅温度不一致[14],因此为了更好的确定堆积终点的温度特征,选择了堆积终点时期,深度15 cm、50 cm、100 cm、180 cm的酒醅为研究对象,通过其空间位点的温度来确定最佳堆积终点的温度检测点,结果见图2。
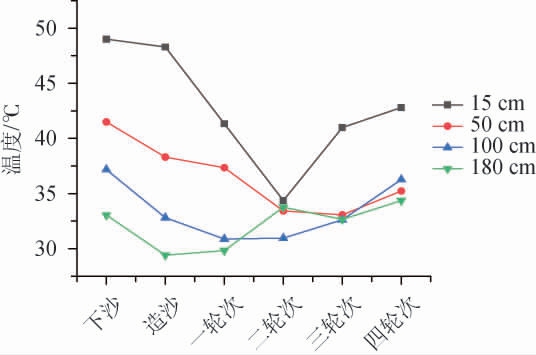
图2 不同深度下不同轮次堆积终点酒醅的温度
Fig.2 Temperature of fermented grains at the end of different rounds of accumulation at different depths
由图2可知,从空间位置分析,堆积终点时期,酒醅温度变化幅度随着深度的增加而减小,深度15 cm处温度变化幅度最大,其次是50 cm,最后是100 cm、180 cm。其中深度15 cm处酒醅的温度比其他位置的酒醅温度高,与其他位置的酒醅温度存在显著性差异(P<0.05)。推测出现这一现象的原因是表层更接近空气,更容易接触环境中的微生物,含氧量也较为充足,因此微生物数量偏多,代谢活动旺盛,生物热带动了堆子温度的上升[18];从发酵时期分析,四个空间位点的温度变化趋势大致分三类,一类是15 cm位点的酒醅温度,它在下、造沙时期温度变化不大,从下沙后温度开始明显下降直到二轮次后又开始上升;第二类是50 cm和100 cm处的酒醅,它们的温度从下沙开始下降到二、三轮次时开始上升;第三类是180 cm处酒醅,它的温度从下沙开始下降,在造沙时期后开始上升,直到二轮次又下降,三轮次又上升。其中180 cm酒醅在二、三轮次之间的温度下降幅度不大。整体来看,四个不同空间点位的堆积终点时期的酒醅温度变化都是先下降后上升。其中,越接近表面,其温度下降时间越晚。造成这一现象的原因可能是下、造沙时期属于酱香型白酒生产过程中的前准备阶段,酸度低、淀粉含量高、水分含量适中,使得微生物可以大量繁殖生长[19]。随着轮次的增加,酸度、水分增加,淀粉含量减少,堆积酒醅开始逐渐不适应大部分微生物的生长需要,因此堆积聚集到的微生物含量变少。随着轮次的增加,水分、酸度、淀粉等条件的进一步变化,酒醅的状态逐渐满足了另一批微生物的生长需要,因此微生物又开始逐渐增加。
2.2 各轮次堆积终点理化指标的研究
为研究各轮次酒醅理化指标在堆积终点时期的特征,对52口窖池的数据进行质控分析,其中每个区间的数据表示的是52口窖池中复合质控参数的数据。水参与酱香型白酒发酵的所有生化反应,微生物的生长和代谢与其存在的微环境的物质循环、能量流动和信息传递的“三流运转”离不开水的直接或间接参与[20]。不同轮次堆积终点的理化指标质控结果见图3。
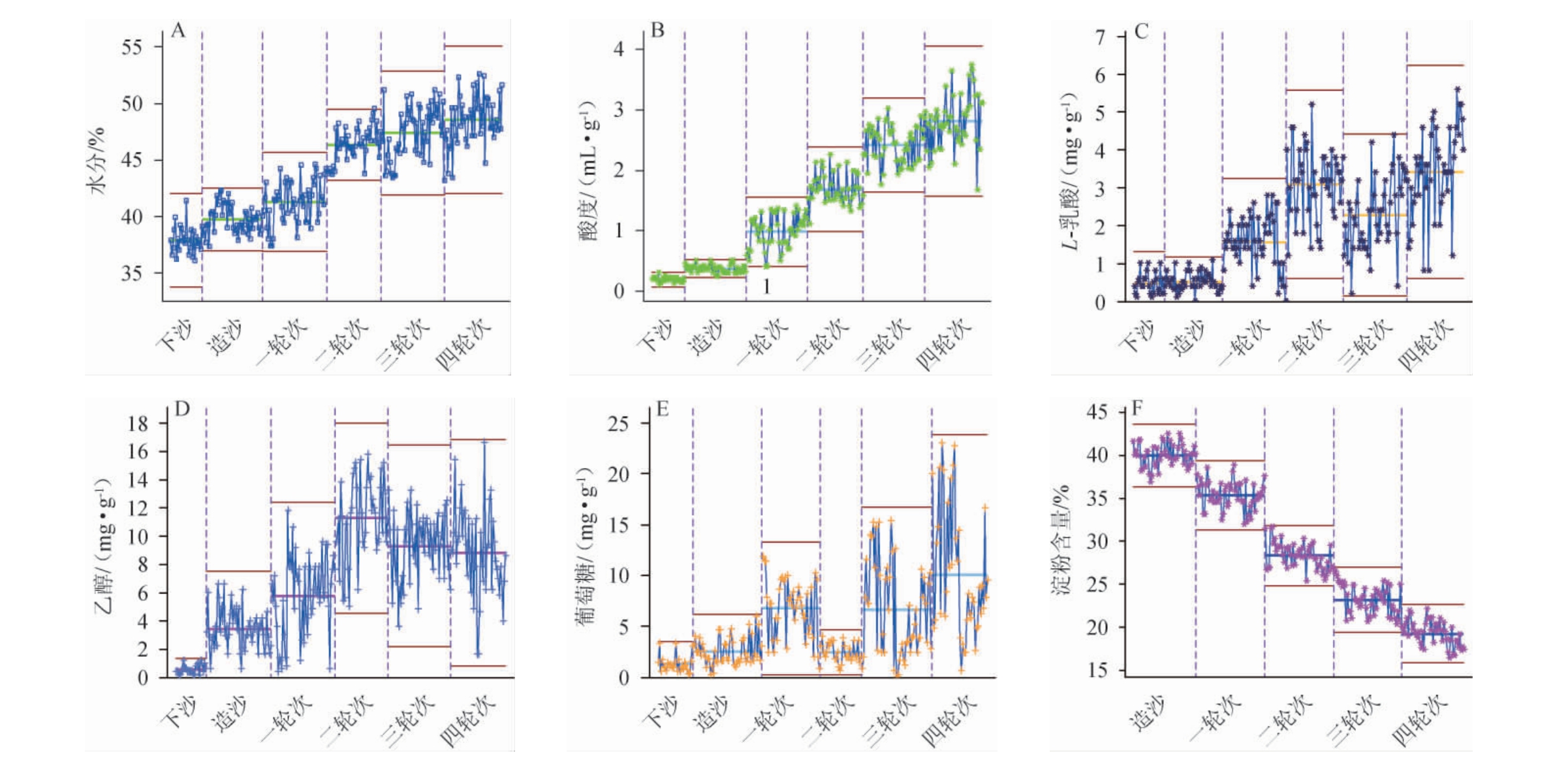
图3 不同轮次堆积终点酒醅的理化指标质控图
Fig.3 Quality control map of physicochemical indexes of fermented grains at the end of different rounds of accumulation
由图3A可知,堆积酒醅终点的水分随着轮次的增加呈现逐渐上升的趋势。出现这一现象的原因有三点:一是下造沙时期的酒醅表面较为完整,疏松性较好,在堆积过程中容易散失水分;随着轮次的增加,酒醅经过多次蒸煮变得更加软化,酒醅疏松性变差,水分不易散失。二是随着多次发酵,酒醅中微生物大量代谢产生了更多的水;三是人为的控制水分,进行补水操作,这是后期水分增大的主要影响因素之一;堆积过程中酸度的积累主要源于产酸菌的代谢,适宜的酸度可以抑制杂菌的生长,为各种酯类物质的合成提供前体,为其他微生物的正常生长提供良好的环境[21]。由图3B可知,堆积终点的酸度随着轮次的增加,呈现逐渐上升的趋势,这主要是窖内发酵产酸多,随着轮次的增加,这些酸逐渐累积增加;乳酸是酱香型白酒中的主要酸类成分之一,其酯化物乳酸乙酯是酱香型白酒中的主要酯类物质之一,也是酒体重要的呈香物质[22]。由图3C可知,随着轮次的增加,堆积终点酒醅中的L-乳酸含量呈先上升后下降又上升的趋势,除了三轮次外,L-乳酸含量整体呈上升趋势。李欣等[23]研究发现乳酸菌是酱香型白酒堆积糟醅中主要优势菌群,糟醅中的乳酸只由乳酸菌产生。因此乳酸含量整体上升的原因可能是前面几个轮次乳酸菌数量偏少,但随着酸度的积累,后续几个轮次的环境更适合乳酸菌等微生物的生长,导致乳酸菌数量上升,乳酸含量也随之上升;由图3D可知,不同轮次堆积终点的乙醇含量特征表现为先快速上升后不变的趋势。乙醇的产生主要源于酵母菌的代谢,而酵母菌只在无氧条件下代谢产生乙醇,所以下、造沙时期乙醇含量偏低,在后续一、二轮次中,由于经过前面几轮的窖内发酵,乙醇含量得到了极大的增加,在三轮次后,乙醇的产出与消耗达到动态平衡,所以乙醇含量变化不大;由图3E可知,不同轮次堆积终点的葡萄糖含量变化趋势为先上升后下降又上升的趋势,葡萄糖是微生物的碳源,也是淀粉等多糖物质的分解产物,因此在堆积过程中葡萄糖含量始终处于一种动态变化中,随着轮次的增加,堆积终点酒醅的葡萄糖含量变多,说明前期的糖化力较高,随着轮次的增加,有大量的淀粉等多糖物质被分解成葡萄糖;淀粉是微生物生长繁殖的主要营养源,根据淀粉的消耗情况可以对酒醅的发酵情况进行一定程度的判别。由图3F可知,不同轮次堆积终点的淀粉含量呈下降趋势。酒醅中的淀粉主要来源于高粱,前期由于刚投入生粮且微生物数量较少,所以酒醅淀粉含量较高[24]。后期随着轮次的增加,高粱糊化度逐渐加深,淀粉转化为还原糖的速率加快,使得后期淀粉消耗变大,淀粉含量减少。
对52个窖池的各指标质控图数据进行整理,得到不同 轮次堆积终点的理化指标特征区间,结果见表2。
表2 不同轮次堆积终点酒醅理化指标均值及区间
Table 2 Average and interval of physicochemical indexes of fermented grains at the end of different rounds of accumulation
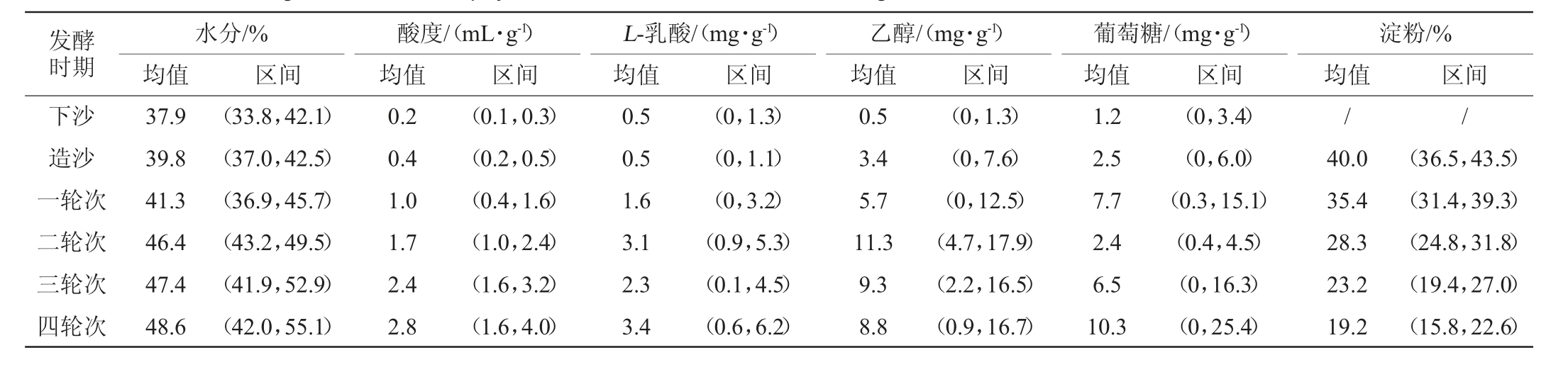
发酵时期下沙造沙一轮次二轮次三轮次四轮次水分/%均值酸度/(mL·g-1)均值L-乳酸/(mg·g-1)均值乙醇/(mg·g-1)均值葡萄糖/(mg·g-1)均值37.9 39.8 41.3 46.4 47.4 48.6区间 区间 区间 区间 区间(33.8,42.1)(37.0,42.5)(36.9,45.7)(43.2,49.5)(41.9,52.9)(42.0,55.1)0.2 0.4 1.0 1.7 2.4 2.8(0.1,0.3)(0.2,0.5)(0.4,1.6)(1.0,2.4)(1.6,3.2)(1.6,4.0)0.5 0.5 1.6 3.1 2.3 3.4(0,1.3)(0,1.1)(0,3.2)(0.9,5.3)(0.1,4.5)(0.6,6.2)0.5 3.4 5.7 11.3 9.3 8.8(0,1.3)(0,7.6)(0,12.5)(4.7,17.9)(2.2,16.5)(0.9,16.7)1.2 2.5 7.7 2.4 6.5 10.3(0,3.4)(0,6.0)(0.3,15.1)(0.4,4.5)(0,16.3)(0,25.4)淀粉/%均值 区间//40.0 35.4 28.3 23.2 19.2(36.5,43.5)(31.4,39.3)(24.8,31.8)(19.4,27.0)(15.8,22.6)
由表2可知,随着轮次的增加,堆积终点时期酒醅中水分含量均值最小的是下沙期37.9%,最大值是四轮次的48.6%。水分含量的快速增长发生于二轮次,增长了12%。酸度均值的最小值是下沙期的0.2 mL/g,最大值是四轮次的2.8 mL/g,酸度快速增长发生于一轮次,增长了150%。L-乳酸含量最小均值为下沙期的0.5 mg/g,最大值是四轮次的3.4 mg/g,快速增长期是一轮次,增长了220%。乙醇含量均值的最小值是下沙期的0.5 mg/g,最大值是二轮次的11.3 mg/g,快速增长期是二轮次,增长了102%。葡萄糖含量均值最小值是下沙期的1.2 mg/g,最大值是四轮次的10.3 mg/g,快速增长期为一轮次,增长了208%,且其在二轮次有一个快速下降期,减少了69%。淀粉含量均值最大值是一轮次的40%最小值是四轮次的19.2%,快速减少期发生于二轮次,减少了20%。根据理化指标的快速上升期和下降期的结果,发现下沙到造沙的6个轮次中,一、二轮次的理化指标变化最为明显。其中,乙醇含量的快速增长与淀粉、葡萄糖含量的快速减少统一发生于一轮次窖内期到二轮次堆积终点时期。
2.3 各轮次堆积终点发酵力及糖化力的研究
不同轮次堆积终点酒醅的发酵力和糖化力测定结果见图4。
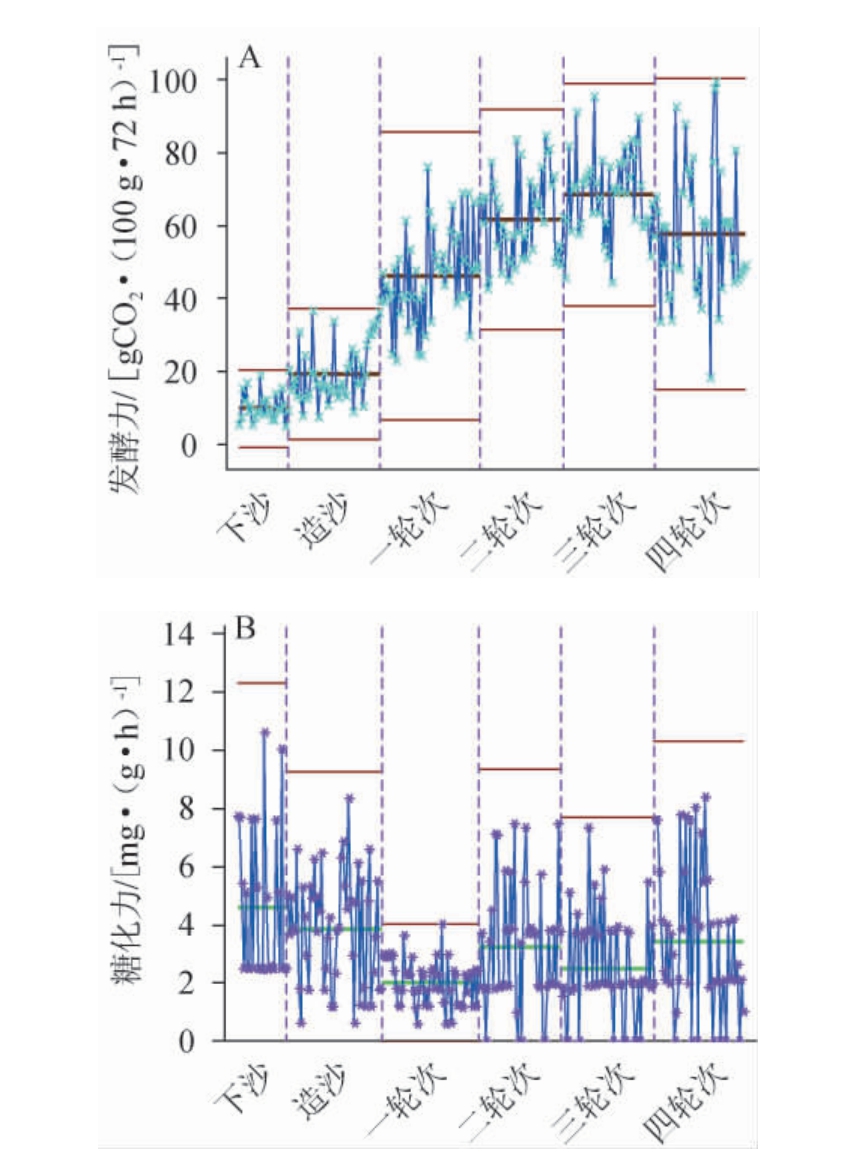
图4 不同轮次堆积终点酒醅发酵力(A)及糖化力(B)测定结果
Fig.4 Determination results of fermentation power (A) and saccharification power (B) of fermented grains at the end of different rounds of accumulation
由图4可知,堆积终点酒醅的发酵力随着轮次的增加呈现逐渐上升的趋势。该现象表明随着轮次的增加,微生物也在一直增加,直到达到某一个范围后开始水平波动。糖化酶的主要功能是将淀粉或其他多糖转化为葡萄糖。堆积终点的糖化力变化趋势为先下降后波动;一般而言糖化酶主要由霉菌和酵母代谢产生[25]。因此,糖化力下降的原因推测是下沙、造沙时期的糖化酶主要来源于大曲中,堆积过程中产生的糖化酶较少,消耗的偏多,因此糖化力持续降低;后续随着轮次的进行,水分、酸度逐渐增加,酵母菌数量达到一定规模,使得糖化酶的产出变多。
对52个窖池的质控图数据进行整理分析,得出不同轮次酒醅堆积终点时期发酵力及糖化力的特征区间,结果见表3。由表3可知,发酵力均值最小值是下沙时期的9.8 gCO2/(100 g·72 h),最大值是三轮次的68.4 gCO2/(100 g·72 h),发酵力快速增长时期为一轮次,增长了140%。糖化力均值最大值是下沙时期的4.6 mg/(g·h),最小值是一轮次的2.0 mg/(g·h)。其中,糖化力下降速率最快的是一轮次,减少了48%。发酵力与糖化力的快速变化时期表明了造沙到一轮次的窖内期和堆积期终点过程中微生物活动剧烈。
表3 不同轮次堆积终点酒醅的发酵力和糖化力均值及区间
Table 3 Average and intervals of fermentation power and saccharification power of fermented grains at the end of different rounds of accumulation
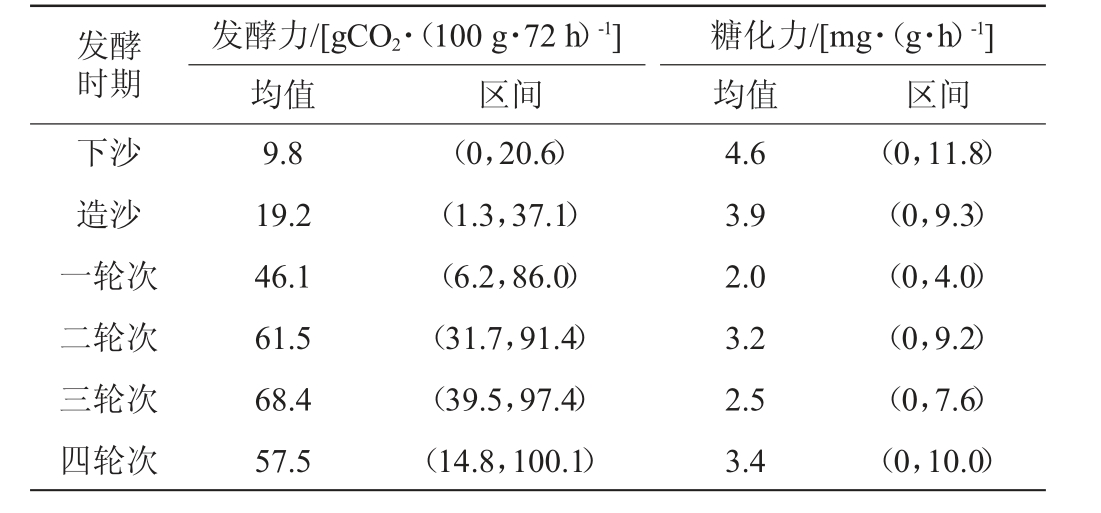
发酵时期下沙造沙一轮次二轮次三轮次四轮次发酵力/[gCO2·(100 g·72 h)-1]均值区间糖化力/[mg·(g·h)-1]均值 区间9.8 19.2 46.1 61.5 68.4 57.5(0,20.6)(1.3,37.1)(6.2,86.0)(31.7,91.4)(39.5,97.4)(14.8,100.1)4.6 3.9 2.0 3.2 2.5 3.4(0,11.8)(0,9.3)(0,4.0)(0,9.2)(0,7.6)(0,10.0)
2.4 酒醅堆积终点酵母菌的研究
2.4.1 酵母菌总数与活菌率
根据酵母菌形态特征,记录血球计数板方法中观察到的酵母数量与美兰染色实验检测到的活菌率,得到不同轮次酒醅堆积终点酵母总数与活菌率,结果见图5。由图5A可知,血球计数板观测到的堆积终点的酵母菌总数整体变化不大,呈水平趋势。该结果表明每个轮次堆积过程中富集到的酵母菌数量无较大差异;由图5B可知,活菌率呈先上升后水平的趋势,表明随着轮次的增加,堆积过程中酵母菌多样性指数发生变化,酵母菌群结构发生变化[26]。因此推测活菌率的上升,可能是前期富集到的酵母菌菌群的环境适应力没有后期富集的酵母菌群能力强,即两类酵母菌群的组成结构不同。
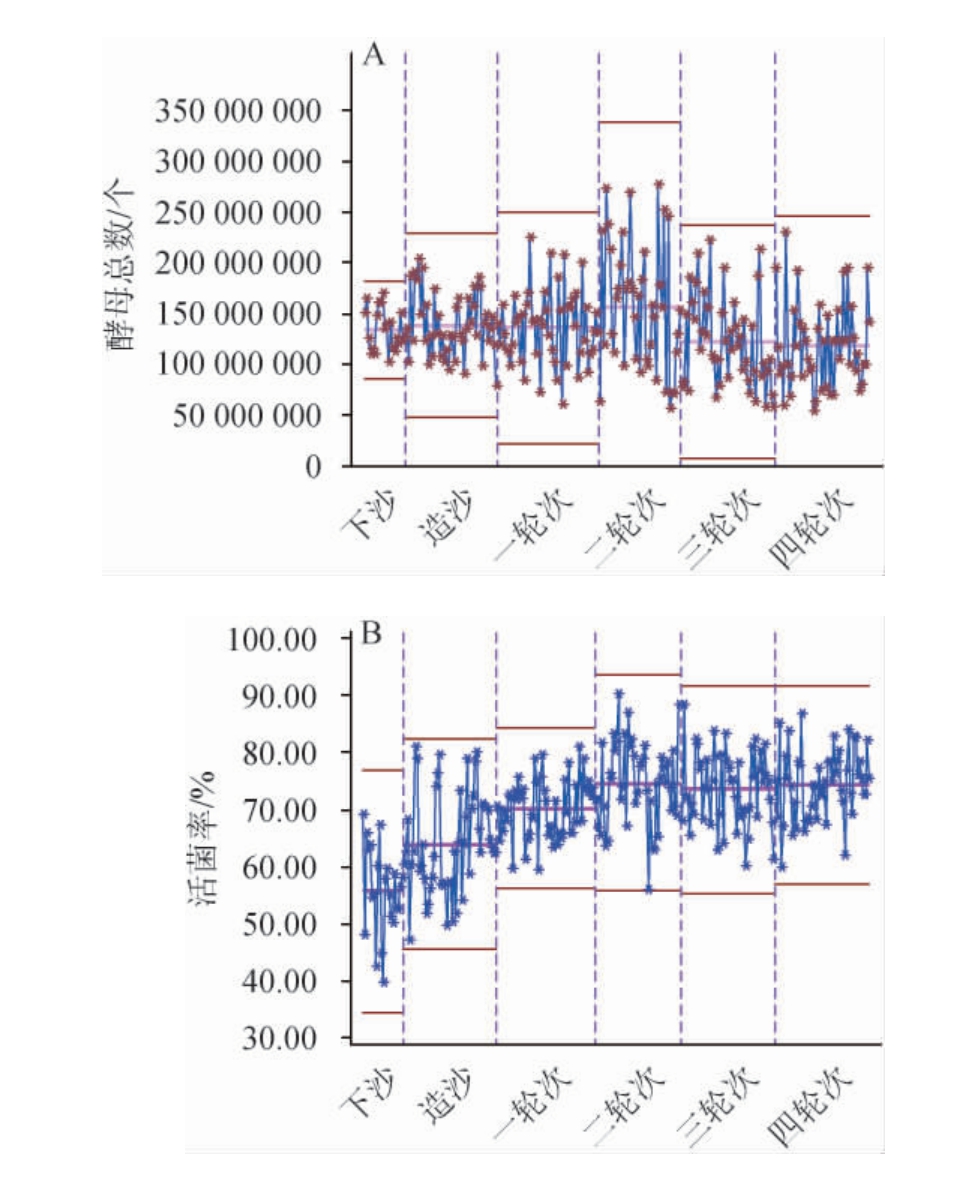
图5 不同轮次堆积终点酒醅酵母总数(A)与活菌率(B)测定结果
Fig.5 Determination results of total yeast count (A) and viable bacteria rate (B) of fermented grains at the end of different rounds of accumulation
2.4.2 酵母菌fqPCR检测
研究表明,不同时期酒醅中的酵母种类与数量存在明显差异,其中,酒醅堆积时期优势酵母有拜尔接合酵母(Zygosaccharomyces bailii)和酿酒酵母(Saccharomyces cerevisiae)[27]。因此,为了更好的研究堆积终点的酵母菌特征,对酿酒酵母和拜尔接合酵母进行fqPCR检测。前期试验表明本次实验中酿酒酵母和拜尔结合酵母的引物特异性良好。可以用于荧光定量PCR检测。通过对每一轮次堆积终点酒醅的fqPCR检测,得到堆积终点时期酿酒酵母与拜耳结合酵母的定量测定结果见图6。
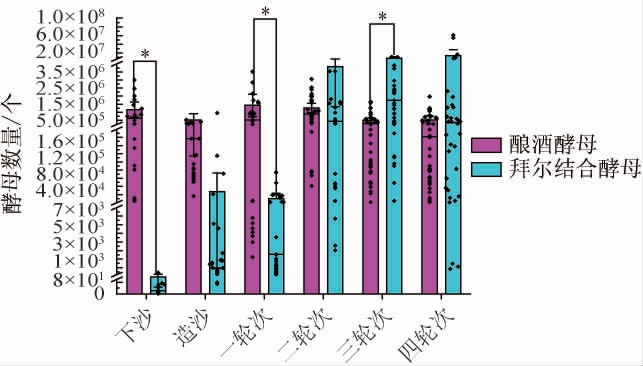
图6 不同轮次堆积终点酒醅酿酒酵母与拜尔结合酵母数量
Fig.6 Number of Saccharomyces cerevisiae and Zygosaccharomyces bailii of fermented grains at the end of different rounds of accumulation
由图6可知,酿酒酵母数量从下沙至四轮次变化不大;拜尔接合酵母从下沙到四轮次呈增长趋势,其中,下沙阶段拜尔接合酵母数量最少。该发现与郝飞等[28]的研究结果一致,Z.bailii在下沙、造沙轮次占比较低,而到二轮次其占比达50%以上,成为数量占比最高的酵母菌。庄孝洁等[29]研究发现酱香型白酒堆积过程中聚集的拜尔接合酵母,部分具有高环境耐受力、高效发酵的特点,具有产生多种风味物质的能力,这种能力可以使它更好地适应白酒酿造过程中高温、高酸、高乙醇的环境。这种能力可能是拜尔接合酵母在后续的堆积终点中处于优势菌株的原因。
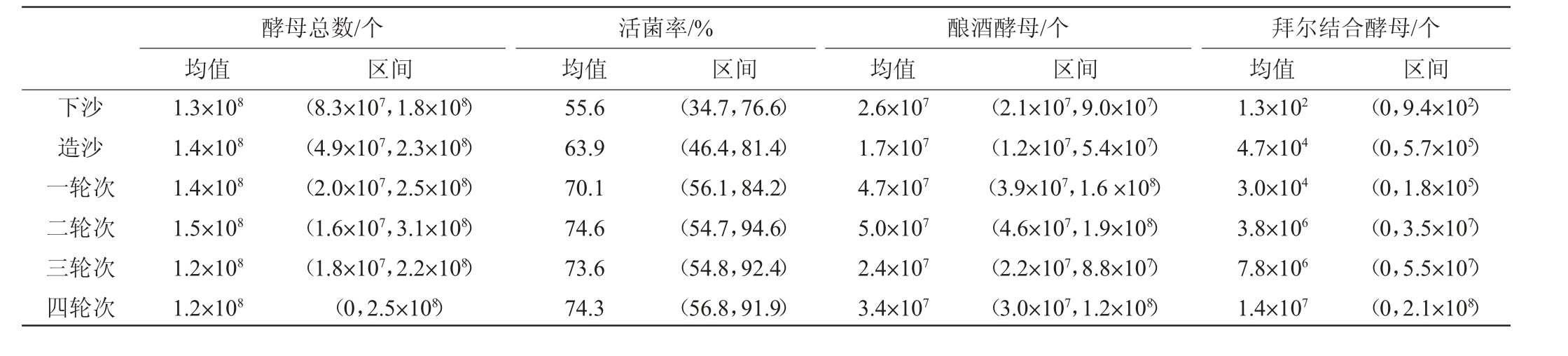
对每一轮次酒醅酵母菌的微生物数据进行质控分析,得到不同轮次酒醅堆积终点酵母菌数量特征,结果见表4。由表4可知,酵母总数从下沙到四轮次酒醅,其数量变化都在108的数量级上,且每一轮次相差不大,说明在下沙到四轮次的堆积过程对酵母总数的影响不大。活菌率均值最小值是下沙时期的55.6%,最大值是二轮次的74.6%,数据变化最明显的是造沙和一轮次阶段,都是7%的差值,说明造沙和一轮次的酵母组成变化明显。酿酒酵母均值从下沙到四轮次的数量级均为107,说明从下沙到四轮次酒醅中酿酒酵母的数量变化不大。拜尔结合酵母的均值数量最小值是下沙时期的1.3×102个,最大值是四轮次的1.4×107个。数量快速增长期为造沙和二轮次,都是100倍增加。活菌率和拜尔结合酵母的数量变化说明,活菌率的增长可能是由于拜尔结合酵母数量的增加,进一步证明了不同轮次酵母菌群结构不同。
表4 不同轮次堆积终点酒醅酵母菌数量特征
Table 4 Characteristics of yeast numbers of fermented grains at the end of different rounds of accumulation
?
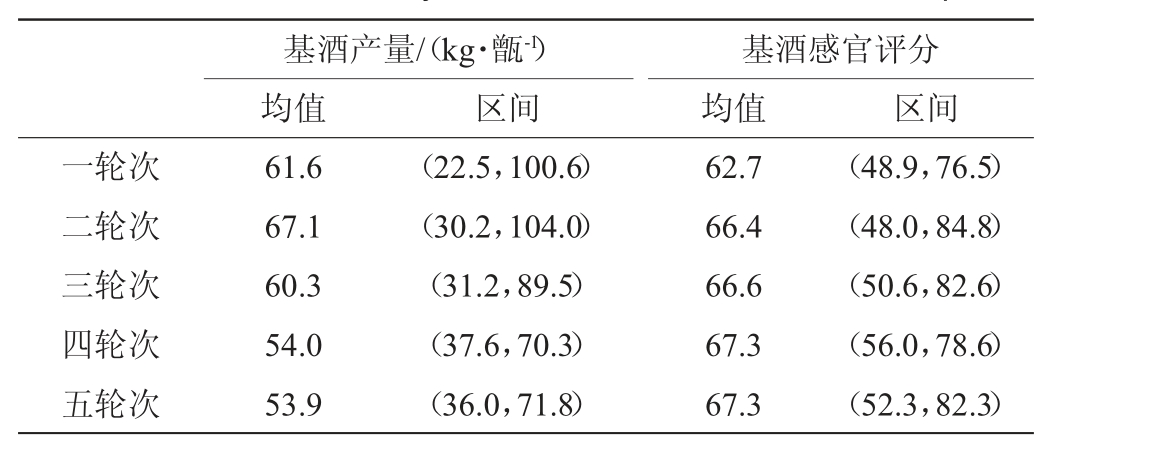
2.5 各轮次基酒数据
酱香型白酒生产过程中,下沙、造沙阶段不产酒。因此收集并整理一到五轮次基酒的产量和感官评分数据,结果见表5。由表5可知,基酒产量均值的最大值是二轮次的67.1 kg/甑,最小值是五轮次的53.9 kg/甑,并且从二轮次后,基酒产量逐渐减少。基酒感官评分均值的最大值是四、五轮次的67.3分,最小值是一轮次的62.7分,其中基酒产量的变化趋势是先上升后减少,基酒感官评分呈上升趋势。前期基酒产量增加由于初期发酵不完全,随着轮次的增加,发酵程度加深,基酒产量增加,后期随着酒醅中淀粉等糖源物质的减少,基酒产量逐渐下降;基酒感官评分上升说明,随着轮次的增加,酒质逐渐稳定,酒体中香气物质逐渐丰富。
表5 不同轮次基酒产量和感官评分结果
Table 5 Yield and sensory scores of different rounds base liquor
基酒产量/(kg·甑-1)均值区间基酒感官评分均值 区间一轮次二轮次三轮次四轮次五轮次61.6 67.1 60.3 54.0 53.9(22.5,100.6)(30.2,104.0)(31.2,89.5)(37.6,70.3)(36.0,71.8)62.7 66.4 66.6 67.3 67.3(48.9,76.5)(48.0,84.8)(50.6,82.6)(56.0,78.6)(52.3,82.3)
2.6 各轮次堆积终点指标与基酒产量相关性特征
通过SPSS 26.0软件对各轮次堆积终点的各项检测指标分别进行显著性分析和相关性分析,结果见图7。
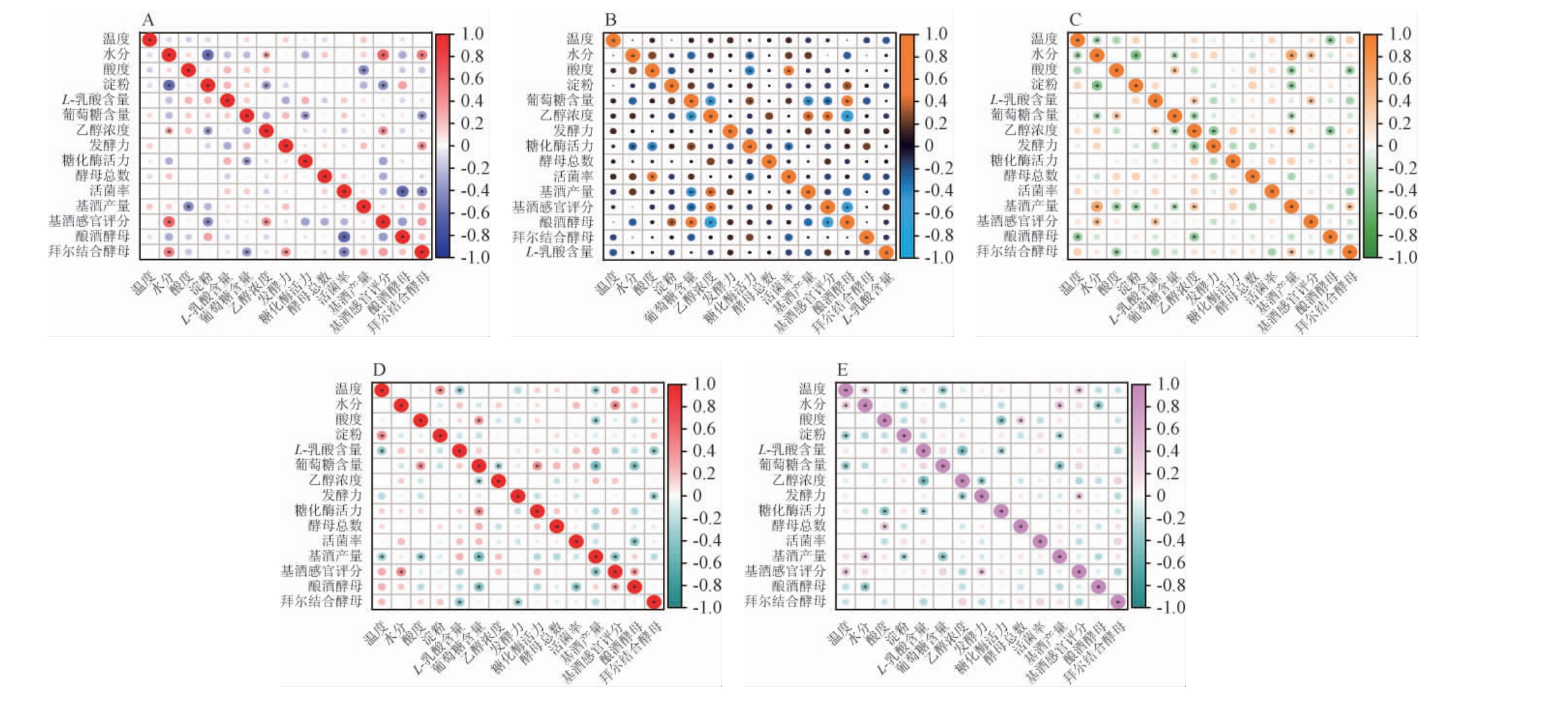
图7 不同轮次堆积终点酒醅理化指标及微生物指标与基酒的相关性分析
Fig.7 Correlation analysis of physicochemical indexes and microbial indexes of fermented grains and base wine at the end of different rounds of accumulation
“*”表示影响显著,P<0.05。A:造沙轮次,B:一轮次,C:二轮次,D:三轮次,E:四轮次。
各轮次酒醅堆积终点的指标仅能影响下一轮次的产酒,因此将一轮次的基酒数据与造沙轮次各指标关联分析,后续轮次类推。由图7A可知,在造沙阶段,基酒产量与酸度呈显著负相关(P<0.05)。基酒感官评分与水分、乙醇含量存在显著正相关(P<0.05),与淀粉含量存在显著负相关(P<0.05);由图7B可知,一轮次基酒产量与葡萄糖含量存在显著负相关(P<0.05),与乙醇含量存在正相关(P<0.05)。基酒感官评分与乙醇含量存在显著正相关(P<0.05),与葡萄糖含量、酿酒酵母数量存在显著负相关(P<0.05);由图7C可知,在二轮次中,基酒产量与水分、乙醇含量、拜尔接合酵母数量存在显著正相关(P<0.05),与酸度、淀粉、葡萄糖含量存在显著负相关(P<0.05)。基酒感官评分与水分、L-乳酸含量存在显著正相关(P<0.05);由图7D可知,三轮次堆积终点相关性分析中,基酒产量与温度、酸度、葡萄糖含量、基酒感官评分存在显著负相关(P<0.05)。基酒感官评分与水分、酿酒酵母数量存在显著正相关(P<0.05),与基酒产量存在显著负相关(P<0.05);由图7E可知,四轮次中,基酒产量与淀粉、葡萄糖含量存在显著负相关(P<0.05),与水分存在显著正相关(P<0.05)。基酒感官评分与温度、发酵力存在显著正相关(P<0.05)。
综上所述,各指标与基酒产量有显著正相关关系的有3个指标,分别乙醇含量、水分、拜尔接合酵母数量;与基酒产量有显著负相关关系的有5个指标,分别是酸度、葡萄糖、淀粉、温度、基酒感官评分。各轮次指标与基酒感官评分有显著正相关关系的有4个指标,分别是水分、乙醇含量、L-乳酸含量、酿酒酵母数量;与基酒感官评分有显著负相关关系的指标有6个,分别是淀粉、葡萄糖含量、酿酒酵母数量、基酒产量、温度、发酵力。其中各轮次中的水分和乙醇含量对基酒的影响多是正相关,葡萄糖对基酒的影响多是负相关。因此可以参考每一个轮次堆积终点的水分、乙醇含量、葡萄糖含量的数据来推断下一轮次的基酒产量与品质。
3 结论
本研究通过对酱香型白酒堆积终点的温度、水分、酸度、葡萄糖、淀粉、L-乳酸、乙醇、发酵力、糖化力、酵母总数、酵母活菌率、酿酒酵母数量、拜尔结合酵母数量的检测,确定了这13个指标在各个轮次堆积终点的变化区间,并且在从下沙到四轮次这六个阶段中,发现一、二轮次的理化指标变化明显,其中造沙到一轮次的酸度、L-乳酸、葡萄糖、发酵力、糖化力的指标变化显著,一轮次到二轮次的水分、淀粉、乙醇含量、葡萄糖含量、发酵力、拜尔结合酵母数量的指标变化显著。这些数据变化为后续对一、二轮次的发酵机理研究提供宝贵的参考价值。下沙至四轮次时期酵母总数和酿酒酵母的数量变化不大,但活菌率和拜尔结合酵母的数量有明显变化。通过对各个指标与基酒数据的相关性分析,发现水分、乙醇含量、葡萄糖含量这三个数据对基酒的影响较大,因此,后续判定堆积终点时,可以参考水分、乙醇含量、葡萄糖含量这三个数据。
[1]崔利,唐智.酱香型白酒“四高两长”酿酒理论与“12355 99789”数字编码酱酒传统工艺的关系[J].酿酒,2023,50(4):1-5.
[2]李喆,冯海燕,吴德光,等.酱香型白酒堆积发酵过程中不同空间位置酒醅差异性比较[J].中国酿造,2023,42(3):58-64.
[3]杜新勇,范志勇,赵殿臣,等.北方酱香型白酒生产过程微生物及温度变化规律分析[J].酿酒科技,2013(5):51-55.
[4]熊子书.酱香型白酒酿造[M].北京:中国轻工业出版社,1994:1-10.
[5]黄治国,侯海波,罗惠波,等.浓香型白酒酒醅发酵过程中淀粉和还原糖的变化规律研究[J].中国酿造,2012,31(7):107-110.
[6]周瑞平,游玲,陈云宗,等.多粮浓香型白酒发酵过程中糟醅生物及非生物因子的变化规律[J].食品与发酵工业,2012,38(8):53-57.
[7]吴成,杨龙飞,胡峰,等.酱香型白酒造沙轮次堆积发酵微生物及理化指标演替规律[J].食品科技,2023,48(6):9-15.
[8]麻颖垚,胡萍,孙利林,等.宏基因组学分析酱香型白酒窖内发酵优势菌与代谢功能的相关性[J].现代食品科技,2020,36(6):128-136.
[9]张媛,廖卫芳,缪礼鸿,等.采用实时荧光定量PCR法检测白酒酿造系统中的重要功能菌株Lactobacillus jinshani[J].食品与发酵工业,2022,48(6):270-275.
[10]王小平,黄永光,周文美.酱香型白酒大曲细菌菌群结构及功能研究进展[J].中国酿造,2020,39(2):19-25.
[11]刘津,刘二龙,谢力,等.数字聚合酶链式反应技术在食品安全检测领域的研究应用进展[J].食品科学,2016,37(17):275-280.
[12]牛犇,洪斌,穆丽丽,等.荧光定量PCR在预测微生物学中的应用[J].食品工业科技,2019,40(5):275-282.
[13]LU H,DU H,XU Y,et al.The application of real-time PCR for quantify TDMTDL producing micobes in liquor brewing process[J].Microbiol China,2014,41(4):786-792.
[14]罗青青,刘超兰,吴正云,等.不同年份窖泥中主要产甲烷菌的荧光定量PCR研究[J].酿酒科技,2013(12):17-20.
[15]裴乐乐,罗青青,刘超兰,等.不同年份窖泥中主要产甲烷菌的荧光定量PCR研究[J].酿酒科技,2015(3):1-4.
[16]杜如冰,吴群,徐岩,等.基于三步荧光定量PCR 技术揭示不同产区白酒酿造系统中Lactobacillus sp.的分布特征[J].微生物学通报,2020,47(1):1-12.
[17]冯海燕,卢君,陈竹君,等.酱香型白酒出入窖糟醅性能评价的技术研究[J].酿酒科技,2021(8):35-42.
[18]唐玉明,任道群,姚万春,等.酱香型酒糟醅堆积过程温度和微生物区系变化及其规律性[J].酿酒科技,2007(5):54-58.
[19]李昶志,潘忠成,翁婧,等.微生物发酵中溶氧浓度的控制研究[J].绿色科技,2019(6):214-215.
[20]何璇,高银涛,余博文,等.酱香型白酒发酵过程全周期跟踪分析[J].食品与发酵工业,2022,48(10):199-205.
[21]张维山,潘学森,刘民万,等.北方酱香酒酿造过程中入池水分与酸度、优级品率关系的初步研究[J].酿酒,2016,43(2):72-74.
[22]杨萍,胡萍,樊敏,等.酱香型酒曲及窖内酒醅挥发性成分的分析[J].中国酿造,2018,37(11):166-171.
[23]李欣,王彦华,林静怡,等.高通量测序技术分析酱香型白酒酒醅的微生物多样性[J].福建师范大学学报,2017,33(1):51-59.
[24]龚荣,李卫东,黄进,等.酱香型白酒下沙、糙沙过程中高粱淀粉糊化的影响因子及相关过程控制[J].酿酒科技,2019(12):36-39.
[25]戴奕杰,李宗军,田志强.酱香型白酒酒醅酶活性和轮次酒理化指标分析[J].中国酿造,2019,38(2):31-36.
[26]CHEN B, WU Q, XU Y.Filamentous fungal diversity and community structure associated with the solid state fermentation of Chinese Maotaiflavor liquor[J].Int J Food Microbiol,2014,179:80-84.
[27]LI X R,MA E B,YAN L Z,et al.Bacterial and fungal diversity in the traditional Chinese liquor fermentation process[J].Int J Food Microbiol,2011,146:31-37.
[28]郝飞,吕锡斌,吴耀领,等.酱香型白酒酿造酒醅中酵母菌多样性研究[J].菌物学报,2019,38(5):620-630.
[29]庄孝杰,吴群,徐岩.酱香型白酒酿造拜耳接合酵母生理代谢特征及其与地衣芽孢杆菌相互作用[J].微生物学通报,2017,44(2):251-262.