我国的水果资源丰富,利用水果发酵果酒可以减少粮食的使用量,还有助于解决我国水果滞销、过剩等问题。果酒的营养价值高,在保留了水果自身独特香气的基础上,其发酵过程中还产生了各种对人体有益的功能活性成分[1]。然而,目前我国果酒行业面临的最主要问题是发酵果酒中甲醇含量超标[2]。我国对果酒中甲醇含量有着严格的规定,如GB 2757—2012《食品安全国家标准蒸馏酒及其配制酒》中规定除以粮食为原料的蒸馏酒外,其他的蒸馏酒中甲醇含量应低于2.00 g/L(以酒精度换算到100%vol计)[3];GB/T 15037—2006《葡萄酒》中规定白、桃红葡萄酒中的甲醇含量≤0.25 g/L[4],红葡萄酒中的甲醇含量≤0.4 g/L[5]。尽管如此,市售果酒被检测出甲醇含量超标的现象仍层出不穷[6],如XIA Y N等[7]检测到红枣蒸馏酒中的甲醇含量达4 g/L。甲醇含量超标问题极大地限制了果酒行业的发展。
甲醇是一种无色透明且具有刺激性气味的有机化合物,甲醇及其代谢产物(甲醛和甲酸)都对人体有毒害作用。摄入5~10 mL的甲醇就会引起严重中毒,超过10 mL会导致失明,30 mL可致死[8]。此外,甲醇对果酒的风味和品质有着显著的影响。基于此,本文就果酒发酵过程中甲醇的形成机制、影响甲醇形成的因素以及调控方法进行综述,以期为控制发酵果酒中甲醇含量的进一步研究提供参考,促进果酒行业的发展。
1 果酒发酵过程中甲醇的形成机理
1.1 果胶分解代谢途径
果胶(pectin)是由不同酯化程度的D-半乳糖醛酸以α-1,4-糖苷键连接聚合而成的大分子杂多糖,常还含有L-鼠李糖、D-半乳糖、D-阿拉伯糖等组成的侧链,分子质量在25~360 kDa之间[9]。果胶广泛存在于高等植物的果实中,是植物细胞壁的组成成分。而果胶酶(pectase)是指能够分解果胶物质的酶类,包含多种组分的酶。根据作用底物和机理的不同,果胶酶可分为原果胶酶(protopectinase,PP)、聚半乳糖醛酸酶(polygalacturonase,PG)、果胶裂解酶(pectinlyases,PL)和果胶酯酶(pectinesterase,PE)。研究表明,PE(EC3.1.1.11)也称果胶甲酯酶(pectin methylesterase,PME),可特异性地作用于果胶分子中的多聚半乳糖醛酸甲酯,将半乳糖醛酸和C-6位上的甲氧基(-OCH3)之间的酯键水解,释放出甲醇和果胶酸(图1)[10-11]。也就是说,果胶分解代谢途径主要是指果胶分子在PME的作用下分解成果胶酸和甲醇。PME除内源性地存在于果实中外,还可以在发酵过程中由酵母或其他微生物代谢产生[12-14]。这使得在果酒发酵过程中天然地产生甲醇,而果胶分解代谢途径也是果酒发酵过程中甲醇产生的主要途径。如CABAROGLU T等[15]对164种葡萄酒中甲醇的含量进行了分析,证实了葡萄酒中甲醇的产生与其破碎时果实中果胶物质引入发酵过程有直接的关系。ZHAO Y等[16]对红枣中的内源性PME进行灭活处理后,枣酒中甲醇含量降低了1.5倍。这些研究结果均进一步证实了PME催化果胶分解形成甲醇的机理。
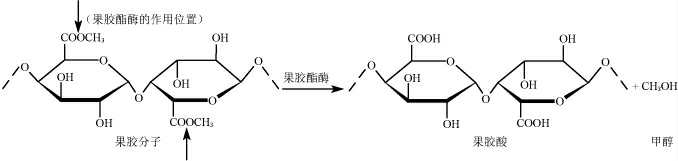
图1 果胶分解代谢产生甲醇的机制
Fig.1 Mechanism of pectin catabolism to produce methanol
1.2 甘氨酸代谢途径
除了果胶分解代谢途径,在富含蛋白质的水果(如红枣)中还存在另一个甲醇形成的途径就是甘氨酸代谢途径[7,17]。该代谢途径的机理是果实中的蛋白质在发酵过程中被降解成小分子甘氨酸,甘氨酸在酿酒酵母的甘基酸脱氨脱羧酶系的作用下脱去氨基和羧基,直接形成甲醇(图2A);或者甘氨酸通过甘氨酸脱羧酶先脱去羧基产生甲胺,甲胺再与果实中由于氮肥的使用而残留的亚硝酸盐反应生成甲醇(图2B)。
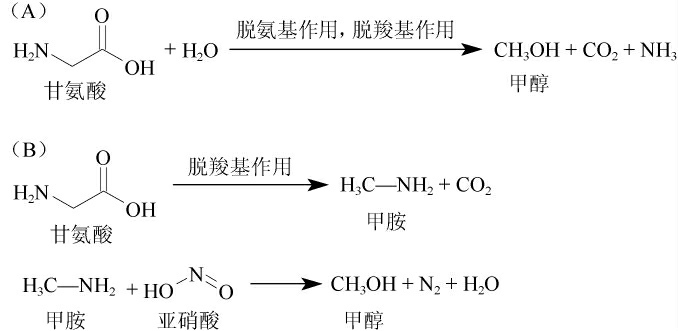
图2 甘氨酸脱氨脱羧途径(A)、甘氨酸脱羧亚硝酸化途径(B)代谢产生甲醇的机制
Fig.2 Mechanism of methanol production with glycine deamination decarboxylation pathway (A) and glycine decarboxynitrification pathway (B)
武晓娜等[18]研究发现,发酵液中外源添加甘氨酸的量(<0.9 g/L)越多,酿酒酵母产生甲醇的量也越多,并且甘氨酸的转化率达到了24.2%。该研究结果证实了甘氨酸的含量与甲醇的生成量有着密切的联系。此外,熊志钦[19]将酿酒酵母中甘氨酸脱羧酶系的基因进行敲除,发现甘氨酸代谢生成甲醇的途径被消除,并减少了甲醇的生成量(减少了19.76%)。
2 影响发酵果酒中甲醇含量的因素
2.1 发酵原料的选择和处理
2.1.1 水果中果胶含量和类型的影响
基于上述果胶分解代谢途径可知,果胶作为生成甲醇的底物,其在水果中的含量和类型直接影响果酒中甲醇的生成量。不同种类的水果由于其果胶含量不同,导致最终酿造的果酒中甲醇含量也有显著的差异。选择果胶含量相对较高的水果(如柿子、苹果、李子和桃子等)进行发酵,其相应果酒中也含有相对较高的甲醇。如梨、柿子和山楂中的果胶含量分别为0.23%~1.02%[20]、2%[21]和6.6%[22],它们酿造而成的酒中甲醇含量也依次增加,分别为78.3 mg/L[23]、>400 mg/L[24]和730 mg/L[25]。即使对于同一种水果的不同品种或同一品种水果的不同组分作为发酵原料也会影响相应果酒中甲醇的含量。HANG Y D等[14,26-27]分别证实了苹果品种对相应的苹果酒中甲醇的含量有显著的影响。夏娜等[28]证实了利用香梨的不同组分(香梨澄清汁、带肉果汁和果渣)进行发酵所产的梨酒中甲醇含量依次增加,并且与这3种原料中果胶含量依次增加有显著的相关性。刘文[29]测定了不同时期的中华寿桃中果胶的分子质量、分子质量分布以及酯化度,发现桃酒中甲醇的含量随着果胶分子质量的降低而降低,随着果胶分布指数的增大而减少,随着果胶酯化度的增大而增加。PME主要作用于半乳糖醛酸甲酯上的酯键,经水解后释放出甲醇。因此,酯化度越高的果胶,其制备的果酒中甲醇含量也会越高。这些研究结果表明降低原料中果胶的含量,特别是酯化度高的果胶含量,是降低发酵果酒中甲醇含量的重要策略之一。
2.1.2 果实品质、收获年份以及成熟度的影响
果实的品质、收获年份和成熟度也会间接影响果酒中甲醇含量。研究发现,由于灰霉菌(Botrytis cinerea)可以合成活性非常高的PME,当采用被B.cinerea污染的水果进行发酵会导致成品酒中甲醇含量显著升高[30]。此外,ADAM L等[31]在研究1978-1995年生产的巴氏梨酒时,发现1993年收获的巴氏梨酿造的果酒中甲醇含量最低。ZHANG H等[32]研究发现,3个梅子品种和3个收获年份(2008-2010年)酿制的梅子酒中甲醇含量存在显著的差异。POPOVIC′ B等[33]研究者也证实了这一结果。果实的成熟度也影响果酒中甲醇的含量。如早期收获的或者较硬的未成熟的梨作为发酵原料会导致相应梨酒中甲醇含量升高[34]。类似地,以成熟的桃子作为发酵原料可以获得更低的甲醇生产量,这是因为桃子中PME的活性和原果胶的含量随着成熟度的增加而降低[29]。然而,几项研究的结果却与这一发现相矛盾。ADAM L[31]报告了随着威廉斯梨成熟度的提高,其相应的梨酒中甲醇含量有所增加。KRAUT J A等[35]研究发现,使用成熟的杨梅果实酿造的酒中甲醇含量更高。严红光等[36]研究发现,青梅果酒中甲醇含量随着果实成熟度的提高,从未检出至显著增加至15.1 mg/L。这些研究者推测可能是PME的活性在成熟过程中增加,促进果胶的分解,从而导致甲醇含量增加[35]。在发酵前对水果的品质、收获年份和成熟度进行选择也可以控制相应果酒中甲醇的含量。
2.2 果胶酶种类及其酶活性的影响
在水果发酵醪中的果胶酶包括来源于果实自身的果胶酶和外源添加的果胶酶。内源性果胶酶会将水果中果胶物质进行分解,释放甲醇,从而导致果酒中甲醇含量升高。然而,内源性果胶酶并不能将水果自身中的果胶物质完全分解。果胶的存在会导致浑浊、出汁率低以及水果中的营养物质和风味物质难以溶出,从而影响果酒的品质和风味。外源添加果胶酶可以破坏水果的组织细胞,将水果中的大分子物质进行分解,澄清果汁或果酒,同时提高出汁率[37]。外源性果胶酶预处理虽然可以大大提高出酒率和水果中各种营养物质的溶出,但同时也会导致果酒中甲醇浓度显著增加。ZHANG H等[13]探究了外源果胶酶处理对苹果果酒中甲醇浓度的影响,发现经过果胶酶处理的苹果醪、苹果汁和苹果果渣酿制的果酒中甲醇浓度比未经果胶酶处理组的分别提高了6.1、7.7和3.3倍,且它们的甲醇含量均超过美国食品药品监督管理局(food and drug administration,FDA)对果酒中甲醇浓度的法定限值。何思鲁等[38]研究表明,随着果胶酶添加量的增加,红枣酒中甲醇含量的变化呈先增加后不变的趋势;当果胶酶添加量为0.08 mL时,果酒中甲醇含量(4.58 g/L)显著高于未添加果胶酶处理组(0.32 g/L)。刘晨等[39]探究了6种商业果胶酶制剂(果胶酶A、B、C、EX、EX-V、HC)中PG、PL、PE三种组分酶的酶活性对出酒率和甲醇含量的影响,发现添加果胶酶B既可提高出酒率又可使得甲醇的增加量最低,这主要是归因于果胶酶B中PG和PL的酶活性是这6种酶中最高的,而PE酶活性是最低的。刘文[29]也证实中华寿桃中PE的酶活性与桃酒中甲醇含量呈正相关。这些研究结果与PE催化果胶产生甲醇的机理相一致。
2.3 酵母菌的选择和发酵
发酵果酒中甲醇的另一个可能来源是发酵微生物,包括酿酒酵母和污染微生物。果酒的发酵主要以酿酒酵母(Saccharomyces cerevisiae)为主导,但其他微生物的存在会导致果酒中甲醇的产生。被污染的酵母菌或野生酵母菌已被证实会在发酵过程中产生甲醇[40]。通常,对酿酒所用的酵母菌株进行筛选可以使果酒中甲醇的含量降低20%以上[34]。此外,不同的纯种酵母菌株对果酒中生成的甲醇含量的影响也不同[41]。选择不同的酵母菌种进行发酵会对相应果酒中甲醇的含量有影响。研究证实,一些酵母菌在发酵过程中可以代谢产生果胶酶[42],所以在发酵过程中由酵母分泌产生的果胶酶会继续分解残存的果胶,释放甲醇。酵母菌的生长繁殖和自身代谢情况也会间接影响果酒中甲醇的含量。武晓娜等[43]证实了在无果胶质、甘氨酸和纤维素的影响下,酿酒酵母可以通过自身的生长代谢产生甲醇(44.4 mg/L)。这暗示着可能存在着与酵母菌生长代谢相关的甲醇形成的新机制,但仍需更为深入的研究。
2.4 发酵条件的影响
在发酵过程中,发酵温度在一定范围内越高,相应果酒中甲醇的含量就越高。颜雪辉等[44]发现随着发酵温度升高(20~30 ℃),柑橘果酒中甲醇含量也越高,当发酵温度为30 ℃时甲醇含量达到399.56 mg/L。郑升海等[45]也证实了桑葚果酒中甲醇的含量与发酵温度呈显著的正相关。在20~30 ℃范围内,酵母菌的发酵速度随着发酵温度的升高而加快,使得其过早地停止发酵,导致果酒中残糖量高而酒精度降低,从而影响酒体品质并伴随甲醇含量升高[46]。张宝善等[47]研究发现,当发酵温度升高10 ℃,主发酵期就会缩短6 d,从而导致红枣果酒中甲醇含量增加超过2倍。此外,BELTRAN G等[48]探究了发酵温度对酵母菌的发酵动力学和生长的影响,进一步证实发酵温度较低时(13 ℃)具有较低的发酵速率,并使得酵母菌生长缓慢(但其活力可保持恒定直至发酵结束)。另一方面,发酵温度还会影响果胶酶的活性。已有研究证实PME的活性与温度直接相关[49]。升高发酵醪的温度会提高PME分解果胶的速度,导致产生更多的甲醇,直到达到较高的温度水平(高于60 ℃),此时PME才开始逐渐变性失活[50]。夏娜等[28]研究发现,发酵温度与香梨酒中果胶含量、甲醇含量具有良好的线性相关性,发酵温度升高(高于20 ℃)能显著提高果胶酶活性,促进果胶分解,增加酒中甲醇含量。
延长发酵时间也会增加果酒中甲醇的浓度。GEROGIANNAKI-CHRISTOPOULOUM[51]探究了发酵时间对红、白葡萄酒中甲醇浓度的影响,发现在其他发酵条件相同的情况下,随着发酵时间的延长(10~40 d),这两种葡萄酒中甲醇含量也逐渐增加,大约增加了3~7倍。MILJIC′ D等[52]研究发现,将发酵时间延长至7 d时,梅子酒中甲醇的含量高达1 265 mg/L,远超法定限值(400 mg/L)的标准。
发酵过程中的pH值对相应果酒中甲醇含量也有显著的影响[53]。张倩茹等[2]研究发现,随着发酵液pH值的升高(4~9),甲醇含量呈先减少后增加再减少的趋势,推测发酵过程中的pH值是通过影响酿酒酵母的生长代谢进而影响甲醇形成的。此外,有研究发现,发酵液的pH值还会通过影响其他杂菌的污染进而影响果酒中甲醇的形成。GEROGIANNAKI-CHRISTOPOULOU M等[54]证实在发酵前对葡萄果渣喷洒柠檬酸水溶液(20 g/L),可以降低相应葡萄酒中的甲醇含量,推测可能是由于酸的加入降低了发酵过程中的pH值,增加了酸度,限制了细菌的生长,进而也延缓了甲醇的形成。
2.5 其他因素的影响
一些果酒通常需要放置在适当的容器中,并在其中保存一段时间,以改善其感官特征和提高其化学品质,这个过程称为“老熟”或“陈酿”[55]。陈酿以及所使用的贮酒容器均会影响果酒中甲醇含量的变化。研究发现,与新鲜的果酒相比,经过陈酿的果酒具有更低的甲醇含量,而这种减少主要是归因于果酒中甲醇氧化和随后的缩醛化反应,形成了二乙氧基甲烷[56-57]。事实上,PUECH J L等[58]在经过多年陈酿的酒中发现了大量的1,1-二乙氧基甲烷。而当使用不含有氧气的惰性容器陈酿苹果果酒时,果酒中的甲醇含量却没有发生变化[59]。这进一步证实了陈酿降低甲醇的机制。XIA Y N等[7]探究了3种材料的贮酒容器对甲醇含量的影响,发现在橡木桶中储存270 d的红枣果酒显著降低了其甲醇含量,而在塑料或不锈钢容器中则观察到较低甲醇含量的减少。张宝善等[47]也得到了类似的结果,采用橡木桶陈酿对降低果酒中甲醇含量的作用更为显著。这可能与果酒在橡木桶中发生的复杂的化学反应密切相关[60]。
3 控制果酒发酵过程中甲醇含量的方法
近年来,国内外的研究基本是围绕着原料、果胶酶、发酵微生物和发酵工艺等方面进行发酵果酒的降甲醇处理,部分控制方法见表1。
表1 发酵果酒中甲醇生成量的控制方法
Table 1 Control methods of methanol production in fermented fruit wine

控制对象 控制方法 参考文献果胶果胶酶酵母菌发酵工艺甲醇原料的筛选原料的预处理优质果胶酶的开发果胶酶的替代果胶酶酶活性的抑制酵母菌的直接筛选酵母菌的改造甲基营养酵母的使用发酵方式发酵条件甲醇的去除水果的品质、品种、收获年份、成熟度等的筛选去除果胶含量高的组分添加CaCl2、膨润土等吸附果胶原料的干制处理低产甲醇的果胶酶产生菌的筛选利用果胶裂解酶来替代果胶酶发酵醪的酸化(柠檬酸、硫酸等)、酶抑制剂的添加(单宁、多酚、阴离子表面活性剂等)、醪液的热处理(巴氏杀菌、热超声、微波加热、射频加热等)低产甲醇的商业酵母菌的筛选通过诱变育种、原生质体融合技术或基因敲除技术对酵母菌进行改造采用具有利用果胶中甲酯部分或甲醇能力的酵母菌(具有甲醇同化的酿酒酵母、甲醇毕赤酵母和博伊丁假丝酵母)采用半开放式发酵、固态发酵或热水提汁后发酵发酵温度、发酵时间和发酵液pH值的控制陈酿及陈酿中贮酒容器的选择光催化效应降低甲醇含量[26,30,34,36,61][13,28,62][63][47,64][65-66][34,67][16,68-70][2,41][71-73][74-76][77-78][46,52,79][60][80]
3.1 筛选无霉变、低果胶的果实作为原料以及原料的预处理
发酵原料的筛选是决定果酒品质和甲醇含量的关键因素。因此,应选择果胶含量较低的水果品种,并且避免使用富含果胶的变质原料。卢鹭滨等[61]在对金桔酒的工艺研究中,选用成熟度为70%、90%和100%的金桔果肉进行发酵,发现成熟度越高的金桔其果酒中甲醇含量越低。但考虑到成熟度过高的果实更容易霉变,霉菌中果胶酶的产生会导致甲醇生成量增加,故一般选择成熟度较高(90%)的鲜嫩无霉变果作为发酵原料。
此外,还可对原料进行预处理以降低其中果胶的含量,进而控制果酒中甲醇的生成量。由于果胶主要存在于果皮层中,因此在发酵前去除果皮也可显著降低甲醇的含量。在对香梨发酵酒的研究中发现,以去皮去渣的香梨澄清汁作为原料进行发酵,梨酒中甲醇含量降低了1.6倍[28]。除了果皮之外,果核和茎也含有大量的果胶,故选择去核的樱桃泥作为发酵原料也可降低甲醇的生成[62]。虽然直接去除果胶含量高的组分可以显著降低甲醇的生成,但对于大多数果酒的生产来说,这种方法在经济性上似乎是不可行的。为了提高水果的利用率,通过吸附剂对果胶的吸附也是降低果胶含量的一个策略。研究表明,Ca2+可以与果胶结合产生果胶钙凝胶沉淀,从而去除果胶[81]。因此,可以通过添加CaCl2降低原料中的果胶含量。CaCl2处理会增加PME的酶活力,从而促进甲醇的产生,但与其添加量有关[63]。夏娜等[28]证实添加CaCl2可显著降低香梨酒中甲醇的含量,并当添加量为0.25%时,甲醇含量比对照组的降低了230%。HAN Y Y等[82]证实了膨润土处理可显著降低苹果汁中的果胶含量(从86.89 mg/L降至69.85 mg/L),从而降低了果酒中甲醇含量(从6.77 mg/L降至1.41 mg/L)。黄孟阳[64]用烘干枣、半焦枣和焦枣进行发酵制备红枣酒,相应酒中甲醇含量依次降低,推测可能是对红枣干燥脱水时高温加快了果胶的分解,使得发酵原料中果胶含量降低,从而减少甲醇的生成。
3.2 果胶酶的开发、替代和酶活性的抑制
果胶酶是催化果胶分解产生甲醇的关键酶,故对果胶酶进行调控可以控制甲醇的形成,其方法主要包括:优质果胶酶的开发、果胶酶的替代以及果胶酶酶活性的抑制。
目前,常用的商品化果胶酶制剂主要是由黑曲霉菌株分泌产生的。为了开发低产甲醇的果胶酶,陈玮琳等[65]筛选到一株低产甲醇的果胶酶产生菌——黑曲霉A11,并证实该菌株所产的果胶酶在酶解红枣汁中产生的甲醇含量比市售7种果胶酶制剂的低3.63%。张惠玲等[66]将低PME产生菌与高产菌进行细胞融合,获得一株优良的低产甲醇的果胶酶产生菌Rh-12,该菌产生的果胶酶中PME水平较低,使得甲醇生成量减少,从而控制了枣酒中的甲醇含量。果胶酶包含PL和PME。PL可产生寡聚或单半乳糖醛酸,而PME产生甲醇和果胶酸[42]。因此,可通过PL来替代果胶酶以达到同时提高出酒率和控制甲醇生成的目的。李桂林等[67]采用一种特殊的低甲醇果胶酶对和田红枣果酒进行发酵前处理,发现该酶在提高出酒率的同时可有效抑制甲醇含量的增加。该研究中所使用的果胶酶正是一种PL酶,其可通过特有的反式消去作用裂解果胶,作用位点在C-4上的糖苷键和C-5处消去一个H从而产生一个不饱和产物,这有效地避免了单独切割甲酯化基团并将其游离于枣浆中带来高甲醇的风险[67]。BLUMENTHALP等[34]也证实了PL替代果胶酶进行原料的预处理可显著降低梅子酒和木瓜果酒中的甲醇含量(降低了40%~71%)。此外,PL似乎还会抑制内源性PME的活性,推测是因为PL切割后的果胶片段不能再作为PME的底物[34]。
通过物理或化学方法抑制果胶酶(特别是PME)的酶活性是控制果酒中甲醇形成的另一种策略,如发酵醪的酸化、醪液的热处理和酶活抑制剂的添加等。pH值是影响酶活性的重要因素之一。不同来源的PME其最适pH是不同的,如水果来源的最适pH在中性偏碱性附近、霉菌和酵母来源的最适pH在酸性范围[83]。GLATTHAR J等[84]探究了初始梨醪液的pH值对其甲醇形成动力学的影响,提出将发酵醪液的初始pH调整至2.5可抑制PME活性,进而抑制甲醇的形成。DENÈS J M等[85]将苹果发酵醪的初始pH值降低到4.5时,内源性PME的酶活性降低到原来的1%。这些研究结果表明水果发酵醪液的酸化可显著降低甲醇的生成。GEROGIANNAKI-CHRISTOPOULOU M等[54]使用柠檬酸对葡萄发酵醪进行酸化,可使果酒中甲醇含量减少了约15%。宿智聪等[70]建议使用无机酸硫酸来调节苹果汁的pH值以抑制PME的活性。虽然常见的酸化产品主要是有机酸(如苹果酸/羟基丙酸或乳酸等),但一些有机酸(如柠檬酸)在发酵过程中可被微生物代谢而消耗,从而无法确保发酵醪液pH值的长期稳定,故无机酸似乎更适合用于水果发酵醪液的酸化中。一些化学抑制剂也被证实对PME活性具有抑制作用,如亚硫酸盐、阴离子表面活性剂、抗坏血酸、酚酸和单宁[11,30,68]。物理法抑制酶活性比化学法更健康和安全,特别是在食品工业中用于果蔬的加工时。在物理法中,对发酵醪液进行热处理是抑制PME酶活性的常用手段。通常,当温度高于70 ℃时会造成PME失活[11]。HANGY D等[14]在发酵前对苹果汁进行巴氏杀菌(50 ℃杀菌30 min,后加热至85 ℃)使得甲醇含量降低了34%~46%。此外,热超声处理[86]、微波加热[87]、脉冲高压[88]和射频加热处理[16]等也都被证实可应用于PME的灭活处理中。
3.3 优质酵母菌的选育
杂菌的存在(如霉菌、细菌和野生酵母菌等)会导致甲醇含量显著增加[40],故必须使用纯种酵母进行发酵。另外,果酒中甲醇含量与所用的酵母菌种类有关,这归因于不同种类酵母菌分泌果胶酶的能力、分泌果胶酶的活力以及自身生长代谢不同[42,43]。武晓娜[72]利用常温室温等离子体技术(atmospheric room temperature plasma,ARTP)对酿酒酵母进行诱变,获得的突变菌株(ARTP-120s-3)在甘蔗酒中产生的甲醇含量为48.3 mg/L,比原始菌株降低了21.2%。紫外和硫酸二乙酯复合诱变的菌株产生的甲醇含量比原始菌株降低了27.8%。林小江等[73]利用原生质体融合技术对低产甲醇酿酒酵母与高产总酯酿酒酵母进行融合,选育出的融合菌株PF1不仅产生的甲醇含量更低(145.31 mg/L,比原始菌株降低了22.8%),而且能够产生更多的总酯(0.79 g/L,比原始菌株增加83.7%)。根据上述甘氨酸代谢途径可知,甘氨酸经甘氨酸裂解酶系催化反应可生成甲醇,而该酶系中的甘氨酸脱羧酶是由基因GCV2编码生成的P蛋白亚基。研究表明,基因敲除或基因沉默GCV2可以有效地阻断酵母代谢甘氨酸形成甲醇[89]。熊志钦等[71]利用基因敲除技术敲除酿酒酵母的基因GCV2,切断了甘氨酸代谢生成甲醇的途径,成功构建出低产甲醇的酿酒酵母工程菌L5,利用该工程菌的酿造酒中甲醇含量降低到131 mg/L,比原始菌株的降低了31%,并且该工程菌株还具有多次传代发酵性能的遗传稳定性。另一种控制果酒中甲醇形成的发酵微生物控制方法可能是甲基营养酵母的使用,例如具有甲醇同化能力的酿酒酵母[74]、甲醇毕赤酵母[75]和博伊丁假丝酵母[76]。这些甲基营养酵母已被证实具有利用果胶、果胶中的甲酯部分或甲醇的能力,从而避免了甲醇在发酵产物中的积累[42,74]。然而,这些微生物在发酵果酒中的应用还未得到证实,还需更多相关的研究。
3.4 发酵工艺的优化
3.4.1 发酵方式
通过对红枣果酒的发酵方式的探究发现,半开放式发酵更能实现降低甲醇生成的目的,而密闭式发酵则会促进果酒中甲醇产生[77]。这与酵母的生长特性相一致,在酵母活化后的前48 h发酵需要氧气进行生长代谢,此后才开始厌氧发酵产生酒精。故选择半开放式进行发酵有利于甲醇形成的控制。HERNÁNDEZ-GÓMEZ L F等[78]对比了甜瓜的固态发酵和液态发酵,发现将甜瓜切碎后直接进行固态发酵所产生的甲醇含量显著低于将甜瓜汁进行液态发酵所产生的甲醇含量。此外,张宝善等[47]研究发现,先利用果浆酶酶解提取红枣汁再进行发酵产生的甲醇含量是先利用热水提取红枣汁再进行发酵的7倍,推测可能是果浆酶酶解使得红枣中的果胶质、多糖等物质水解,产生大量的甲氧基和还原糖导致的。
3.4.2 发酵温度、时间和pH值
发酵温度、发酵时间和发酵液的pH值等都是在果酒发酵过程中控制甲醇生成的关键控制点。这些发酵条件均是通过影响果胶酶的活性或酵母菌的生长代谢从而影响甲醇生成的。而这些发酵条件的改变不仅影响着果酒中甲醇的含量,也影响着果酒的色泽和风味。考虑到不同果酒的酿造所需要的最适发酵温度、时间和pH值都不同,故需要对发酵条件进行单因素试验,结合响应面试验确定最佳的发酵工艺酿造出低甲醇和高品质的果酒。
3.5 脱甲醇处理
对果酒进行陈酿处理可以降低部分甲醇含量。多项研究证实,利用橡木桶进行陈酿降甲醇的效果最好[7,47,60]。因此,在陈酿过程中选择橡木桶作为贮酒容器。有研究还探究了橡木片的不同烘烤程度对降甲醇的影响,发现利用轻度、中度、重度烘烤的橡木片催陈的红枣果酒中甲醇含量均无明显变化[90]。此外,还可利用光催化效应降低酒体中的甲醇。田晓梅等[80]基于甲醇光催化氧化机理,将光催化剂应用于酒体中,在紫外光照射下进行光催化反应,0.5 h后酒中的甲醇含量降低了72%。然而,乙醇在紫外光的照射下也会发生氧化反应,即光催化反应在降低甲醇含量的同时,也会使得乙醇含量随之下降。因此,针对光催化氧化降低甲醇还需解决这一难题。
4 结语和展望
甲醇是影响果酒安全和品质的重要因素。果酒中甲醇的主要来源被认为是果胶分解代谢和甘氨酸代谢两个途径,酵母自身的生长代谢可能也参与了甲醇的产生。目前控制甲醇产生的方法主要是从原料、果胶酶、微生物和发酵工艺等方面入手,欠缺更为高效的手段。因此,未来的研究一方面要进一步解析甲醇产生的代谢途径和分子机制,明确影响甲醇水平的关键靶点,为甲醇高效控制手段的研发奠定理论基础;另一方面,可利用基因工程开发高效、精准的控制甲醇产生的技术手段,如低产甲醇酵母菌的定向筛选、甲醇代谢途径的靶向调控等。因此,在未来开发果酒甲醇控制技术的同时,还需要利用风味组学、代谢组学等多组学技术研究甲醇控制技术对果酒风味物质的种类、含量及形成机理的影响,以期在不对果酒风味产生不利影响的前提下,最大限度地降低甲醇的含量。
[1]CˇAKAR U,PETROVIC′ A,PEJIN B,et al.Fruit as a substrate for a wine:A case study of selected berry and drupe fruit wines[J].Scientia Horticult,2019,244:42-49.
[2]张倩茹,尹蓉,殷龙龙,等.果酒发酵过程影响甲醇含量的因素模拟分析[J].食品科技,2022,47(1):106-112.
[3]王家祺,孟镇,郑淼,等.GB 2757—2012《食品安全国家标准蒸馏酒及其配制酒》跟踪评价及分析[J].中国食品卫生杂志,2022,34(3):586-592.
[4]席静,凌莉,李志勇.中外葡萄酒品质安全监测指标比较研究[J].中国酿造,2014,33(11):122-126.
[5]镇银,陈晓东,沈洁,等.《食品安全国家标准发酵酒及其配制酒》(GB 2758—2012)跟踪评价分析及建议[J].中国卫生监督杂志,2019,26(1):49-52.
[6]袁婧威,张波,杨爽,等.市售葡萄酒,果酒甲醇含量风险监测结果分析[J].中国食品,2021(8):94-95.
[7]XIA Y N,MA Y L,HOU L J,et al.Studies of boil treatment on methanol control and pilot factory test of jujube Brandy[J].Int J Food Eng,2017,13(2):1-11.
[8]唐永芳,易新华.对国家标准GB 2757—1981中甲醇和铅的讨论[J].酿酒,2006,33(4):33-37.
[9]PAN X,ZHAO W T,WANG Y X,et al.Physicochemical and structural properties of three pectin fractions from muskmelon(Cucumis melo)and their correlation with juice cloud stability[J].Food Hydrocolloid,2022,124:107313.
[10]DOROKHOV Y L,SHESHUKOVA E V,KOMAROVA T V.Methanol in plant life[J].Front Plant Sci,2018,9:1623.
[11]JOLIE R P,DUVETTER T,VAN LOEY A M,et al.Pectin methylesterase and its proteinaceous inhibitor:a review[J].Carbohydr Res,2010,345(18):2583-2595.
[12]ZOCCA F, LOMOLINO G, CURIONI A, et al.Detection of pectinmethylesterase activity in presence of methanol during grape pomace storage[J].Food Chem,2007,102(1):59-65.
[13]ZHANG H,WOODAMS E E,HANG Y D.Influence of pectinase treatment on fruit spirits from apple mash,juice and pomace[J].Process Biochem,2011,46(10):1909-1913.
[14]HANG Y D,WOODAMS E E.Influence of apple cultivar and juice pasteurization on hard cider and eau-de-vie methanol content[J].Bioresource Technol,2010,101(4):1396-1398.
[15]CABAROGLU T.Methanol contents of Turkish varietal wines and effect of processing[J].Food Control,2005,16(2):177-181.
[16]ZHAO Y,YU X B,ZHAO W,et al.Inactivation of endogenous pectin methylesterases by radio frequency heating during the fermentation of fruit wines[J].Fermentation,2022,8(6):265.
[17]张香,秦丹,曾璐,等.发酵型果酒中甲醇和杂醇油的研究进展[J].中国酿造,2020,39(8):17-21.
[18]武晓娜,林小江,招淑英,等.甘氨酸与酿造酒中甲醇生成关系的研究[J].酿酒科技,2012(7):39-40.
[19]熊志钦.构建甘氨酸裂解酶系基因敲除的酿酒酵母及其应用[D].广州:华南理工大学,2015.
[20]霍宏亮,曹玉芬,田路明,等.不同梨品种果胶含量与品质特性相关性研究[J].保鲜与加工,2016,16(6):111-115.
[21]王西娜.柿子果酒酿造工艺及废弃物利用的研究[D].保定:河北农业大学,2015.
[22]侯玉婷,苏金芳,陈诗悦,等.不同方法提取的山楂果胶理化性质及体外抗糖化活性的对比[J].现代食品科技,2018,34(4):159-166.
[23]姚万欣.固态发酵法生产梨酒中甲醇的生成控制研究[D].泰安:山东农业大学,2016.
[24]刘秀华,刘永杰,王玉兰,等.不同柿子发酵酒工艺对比研究[J].酿酒科技,2019(5):103-105.
[25]崔同,李喜悦,王荣芳,等.山楂酒甲醇含量的测定及清除DPPH和ABTS自由基活性的研究[J].酿酒科技,2015(7):17-20.
[26]JANUSZEK M,SATORA P,TARKO T.Oenological characteristics of fermented apple musts and volatile profile of brandies obtained from different apple cultivars[J].Biomolecules,2020,10(6):853.
[27]VERSINI G,FRANCO M A,MOSER S,et al.Characterisation of apple distillates from native varieties of Sardinia island and comparison with other Italian products[J].Food Chem,2009,113(4):1176-1183.
[28]夏娜,张双霞,张莉,等.香梨酒中甲醇产生的原因及控制方法研究[J].中国食物与营养,2011,17(9):59-62.
[29]刘文.桃酒中甲醇形成机理及其影响因素[D].济南:齐鲁工业大学,2019.
[30]MILJIC′ U,PUŠKAŠ V,VUCˇUROVIC′ V.Investigation of technological approaches for reduction of methanol formation in plum wines[J].J I Brewing,2016,122(4):635-643.
[31]ADAM L.Possibilities of methanol reduction in Bartlett pear distillates using traditional methods of production[J].La Rivista di scienza dell'alimentazione,1995,24(3):417-425.
[32]ZHANG H,WOODAMS E E,HANG Y D.Factors affecting the methanol content and yield of plum brandy[J].J Food Sci,2012,77(4):79-82.
[33]POPOVIC′ B,GAVRILOVIC′-DAMNJANOVIC′ J,MITROVIC′ O,et al.Major volatile components and sensory characteristics of plum brandies produced from plum cultivars developed in Cˇacˇak[C]//I Balkan Symposium on Fruit Growing 825.2007:575-582.
[34]BLUMENTHAL P, STEGER M C, EINFALT D, et al.Methanol mitigation during manufacturing of fruit spirits with special consideration of novel coffee cherry spirits[J].Molecules,2021,26(9):2585.
[35]KRAUT J A,KURTZ I.Toxic alcohol ingestions: clinical features, diagnosis,and management[J].Clin J Am Soc Nephrol,2008,3(1):208-225.
[36]严红光,林莉,符洋,等.不同成熟度青梅果实发酵果酒品质分析[J].食品科技,2019,44(8):77-81.
[37]PARENICOVÁ L.Enzymes in fruit and vegetable processing[M].Enzymes in Fruit and Vegetable Processing:Chemistry and Engineering Applications,2010:341.
[38]何思鲁,迟超逸,王颉.果胶酶处理对红枣白兰地甲醇、乙醇和高级醇含量的影响[C].//大连:中国食品科学技术学会第十二届年会暨第八届中美食品业高层论坛论文集,2015:268-269.
[39]刘晨,赵树欣,张建玲,等.固态发酵苹果蒸馏酒中甲醇的生成控制研究[J].酿酒科技,2012(2):33-35.
[40]DATO M C F,PIZAURO J M,MUTTON M.Analysis of the secondary compounds produced by Saccharomyces cerevisiae and wild yeast strains during the production of"cachaça"[J].Brazil J Microbiol,2005,36:70-74.
[41]蒋成,赵江林,刘路,等.5种商业酵母对无花果酒质量的影响[J].基因组学与应用生物学,2019,38(11):5066-5072.
[42]OHIMAIN,E I.Methanol contamination in traditionally fermented alcoholic beverages:the microbial dimension[M].Ohimain:Springer,2016,5(1):1-10.
[43]武晓娜,康富帅,阎锐鸣,等.酿酒酵母与甘氨酸发酵生成甲醇关系的研究[J].安徽农业科学,2012,40(25):12642-12645.
[44]颜雪辉,吕梅,史路路,等.柑橘酒酿造工艺研究[J].中国酿造,2013,32(11):98-101.
[45]郑升海,田树林,王宇,等.响应面优化桑葚白兰地原料酒发酵工艺[J].食品研究与开发,2022,43(14):152-159.
[46]CONTRERAS A,HIDALGO C,HENSCHKE P A,et al.Evaluation of non-Saccharomyces yeasts for the reduction of alcohol content in wine[J].Appl Environ Microbiol,2014,80(5):1670-1678.
[47]张宝善,陈锦屏,杨莉,等.甲醇和杂醇油在红枣发酵酒中的变化及其控制研究[J].西北农林科技大学学报(自然科学版),2004,32(4):24-28.
[48]BELTRAN G,NOVO M,GUILLAMÓN J M,et al.Effect of fermentation temperature and culture media on the yeast lipid composition and wine volatile compounds[J].Int J Food Microbiol,2008,121(2):169-177.
[49]GONZALEZ S L,ROSSO N D.Determination of pectin methylesterase activity in commercial pectinases and study of the inactivation kinetics through two potentiometric procedures[J].Food Sci Technol,2011,31:412-417.
[50]SHEN Z Y, LI J M, YU Y, et al.Effects of Brew microorganisms and pectinase on the formation of methanol and fusel oil in wines[J].Ludong University Journal,2013,29(2):155-158.
[51]GEROGIANNAKI-CHRISTOPOULOU M.Evaluation of methanol concentration in Hellenic traditional alcoholic beverages after grape pomace fermentation at different conditions[J].J Food Technol,2008,6: 196-202.
[52]MILJIC′ D,PUŠKAŠ S.Influence of fermentation conditions on production of plum(Prunus domestica L.)wine:A response surface methodology approach[J].Hemijska industrija,2014,68(2):199-206.
[53]GÓMEZ L F H,U′BEDA J,BRIONE S A.Characterisation of wines and distilled spirits from melon(Cucumis melo L.)[J].Int J Food Sci Technol,2008,43(4):644-650.
[54]GEROGIANNAKI-CHRISTOPOULOU M,KYRIAKIDIS N V,ATHANASOPOULOS P E,et al.Effect of grape variety(Vitis vinifera L.)and grape pomace fermentation conditions on some volatile compounds of the produced grape pomace distillate[J].OENO One,2004,38(4):225-230.
[55]GRANJA-SOARES J,ROQUE R,CABRITA M J,et al.Effect of innovative technology using staves and micro-oxygenation on the odorant and sensory profile of aged wine spirit[J].Food Chem,2020,333:127450.
[56]PANOSYAN A G,MAMIKONYAN G V,TOROSYAN M,et al.Determination of the composition of volatiles in Cognac(Brandy)by headspace gas chromatography-mass spectrometry[J].J Anal Chem,2001,56(10):945-952.
[57]BALCEREK M,PIELECH-PRZYBYLSKA K,DZIEKON′SKA-KUBCZAK U,et al.Changes in the chemical composition of plum distillate during maturation with oak chips under different conditions[J].Food Technol Biotech,2017,55(3):333.
[58]PUECH J L,LEAUTÉ R,CLOT G,et al.Évolution de divers constituants volatils et phénoliques des eaux-de-vie de cognac au cours de leur vieillissement[J].Sciences des aliments,1984,4(1):65-80.
[59]MADRERA R R,VALLES B S,LOBO A P,et al.Chemical and sensory changes in fresh cider spirits during maturation in inert containers[J].J Scie Food Agr,2011,91(5):797-804.
[60]WEI X,FRANCOISE U,QIN M,et al.Effects of different fermentation and storage conditions on methanol content in Chinese spine grape(Vitis davidii Foex)wine[J].CYTA-J Food,2020,18(1):367-374.
[61]卢鹭滨,杨帆.低甲醇金桔蒸馏酒工艺的探究[J].食品工业,2019,40(2):148-151.
[62]SCHEHL B,SENN T,LACHENMEIER D W,et al.Contribution of the fermenting yeast strain to ethyl carbamate generation in stone fruit spirits[J].Appl Microbiol Biotechn,2007,74(4):843-850.
[63]HAN Y,DU J.Relationship of the methanol production,pectin and pectinase activity during apple wine fermentation and aging[J].Food Res Int,2022,159:111645.
[64]黄孟阳.红枣酒发酵过程中甲醇变化规律及控制研究[D].西安:陕西师范大学,2017.
[65]陈玮琳,张惠玲,周晓娟.一株低产甲醇的果胶酶菌种选育及产酶工艺优化[J].中国酿造,2013,32(10):66-73.
[66]张惠玲,范艳丽,剧柠,等.灵武长枣加工中专用低甲酯化果胶酶菌种选育与枣产品开发研究[Z].宁夏:宁夏大学,2016.
[67]李桂林,彭昕,李泽涵,等.降低和田红枣白兰地中甲醇含量的发酵前处理工艺优化[J].现代食品科技,2021,37(7):74-82.
[68]HOU C Y,LIN Y S, WANG Y T, et al.Addition of phenolic acids on the reduction of methanol content in wine[J].J Food Sci,2008,73(5):C432-C437.
[69]CHAIYASUT C, JANTAVONG S, KRUATAMA C, et al.Factors affecting methanol content of fermented plant beverage containing Morinda citrifolia[J].Afr J Biotechnol,2013,12(27):4356-4363.
[70]宿智聪,杜金华.皂土、硫酸处理对苹果汁发酵过程中果胶甲酯酶活性以及苹果蒸馏酒甲醇含量的影响[J].中国酿造,2022,41(8):149-155.
[71]熊志钦,周世水.基因敲除GCV2的酿酒酵母构建[J].安徽农业科学,2015(15):63-65.
[72]武晓娜.降低甘蔗蒸馏酒中甲醇生产量的研究[D].广州:华南理工大学,2012.
[73]林小江,周世水.原生质体融合法选育酵母菌株酿造低甲醇高总酯蒸馏酒[J].安徽农业科学,2014(13):4050-4054.
[74]ESPINOSA M I,GONZALEZ-GARCIA R A,VALGEPEA K,et al.Engineering and evolution of methanol assimilation in Saccharomyces cerevisiae[J].Bio Rxiv,2019:717942.
[75]NAKAGAWA T,YAMADA K,FUJIMURA S,et al.Pectin utilization by the methylotrophic yeast Pichia methanolica[J].Microbiology,2005,151(6):2047-2052.
[76]NAKAGAWA T, MIYAJI T, YURIMOTO H, et al.A methylotrophic pathway participates in pectin utilization by Candida boidinii[J].Appl Environ Microbiol,2000,66(10):4253-4257.
[77]张丽芝.发酵枣酒中的甲醇和杂醇油控制[J].酿酒科技,2013(8):36-39.
[78]HERNÁNDEZ-GÓMEZ L F,U′BEDA J,BRJONES A.Melon fruit distillates: comparison of different distillation methods[J].Food Chem,2003,82(4):539-543.
[79]LIU X,JIA B,SUN X,et al.Effect of initial pH on growth characteristics and fermentation properties of Saccharomyces cerevisiae[J].J Food Sci,2015,80(4):M800-M808.
[80]田晓梅,何翔,陈艳.利用光催化效应降低白酒中甲醇含量的研究[J].武汉科技学院学报,2006,19(8):69-73.
[81]HAN W,MENG Y,HU C,et al.Mathematical model of Ca2+concentration,pH,pectin concentration and soluble solids(sucrose)on the gelation of low methoxyl pectin[J].Food Hydrocolloids,2017,66:37-48.
[82]HAN Y Y, DU J H, WANG Y, et al.Effect of bentonite and calcium chloride on apple wine[J].J Sci Food Agr,2022,102(1):425-433.
[83]SATORA P,T TUSZYN′ SKI.Influence of indigenous yeasts on the fermentation and volatile profile of plum brandies[J].Food Microbiol,2010,27(3):418-424.
[84]GLATTHAR J,SENN T,PIEPER H J,et al.Investigations on reducing the methanol content in distilled spirits made of Bartlett pears[J].Deutsche Lebensmittel-Rundschau,2001,97(6):209-216.
[85]DENÈS J M, BARON A, RENARD C M G C, et al.Different action patterns for apple pectin methylesterase at pH 7.0 and 4.5[J].Carbohydr Res,2000,327(4):385-393.
[86]TEREFE N S,GAMAGE M,VILKHU K,et al.The kinetics of inactivation of pectin methylesterase and polygalacturonase in tomato juice by thermosonication[J].Food Chem,2009,117(1):20-27.
[87]TAJCHAKAVIT S.Microwave heating of fruit juices:kinetics of enzyme inactivationmicrobial destruction and evaluation of enhanced thermal effects[D].Canada:McGill University,1997.
[88]BASAK S, RAMASWAMY H S.Pulsed high pressure inactivation of pectin methyl esterase in single strength and concentrated orange juices[J].Canad Biosys Eng,2001,43:3.25-3.30.
[89]RIBEIRO O,GOMBERT A K,TEIXEIRA J A,et al.Application of the Cre-loxP system for multiple gene disruption in the yeast Kluyveromyces marxianus[J].J Biotechnol,2007,131(1):20-26.
[90]李桂林.新疆红枣白兰地低甲醇酿造工艺研究[D].乌鲁木齐:新疆农业大学,2021.