白酒是以谷物为原料,以酒曲为糖化发酵剂,经固态、半固态或液态发酵、蒸馏、贮存、勾兑而制得的蒸馏酒,其与白兰地、威士忌、伏特加、朗姆酒、金酒并称为“世界六大蒸馏酒”[1]。中国白酒最初是没有香型之分的,后来随着各地白酒的特色及风格出现差异,便形成了以酱香型、浓香型、清香型、米香型为基本的十二种香型白酒[2]。其中清香型白酒被视为中国白酒的起源,其全国市场占有率曾为75%左右[3],截至目前,清香型白酒仍有很大市场,主要集中于中国北方等地区,因其具有“清香纯正,醇甜柔和,自然谐调,余味爽净”的特点而深受消费者欢迎[4]。清香型白酒酿造中功能微生物的形成主要以酒曲微生物、酒醅微生物为主,环境微生物为辅,其复杂的微生物群落组成、核心微生物组成及相互作用和主要代谢风味物质形成了清香型白酒“清、正、甜、净、长”的风味特征[5-7]。为了更加全面的了解清香型白酒,该文对清香型白酒的酿造工艺、功能微生物的来源以及功能微生物在清香型白酒中的应用进行综述,并对清香型白酒功能微生物在白酒中的应用前景提出展望,为提升清香型白酒品质提供理论参考。
1 清香型白酒酿造工艺及酒曲简介
清香型白酒根据使用的酒曲成分的不同,可以分为三种类型,分别是:大曲清香、小曲清香、麸曲清香。高粱是清香型白酒酿造的主要原料,不同品种的高粱其粗蛋白、粗脂肪、支链淀粉、单宁组成与含量均不同,因此吸水率、膨胀率、糊化率等参数方面也有所差异,高粱的质量直接影响着白酒的品质[8-9]。清香型大曲酒的酿造工艺主要包括润糁、蒸糁、发酵、蒸馏等过程。首先选择品质较好的高粱和辅料进行“清蒸”处理,然后添加以大麦、豌豆混制的三种低温大曲为糖化发酵剂,首次蒸馏后的酒醅只加入大曲进行二次发酵,蒸酒结束后丢弃酒醅[3]。清香型大曲酒的主体香气成分乙酸乙酯和乳酸乙酯,其在成品酒总酯中的比例约以55∶45为宜,酿造工艺特点可归纳为“清蒸清烧、地缸发酵、清蒸二次清”,该工艺赋予了清香型大曲酒清香纯正、醇甜柔和、余味爽净的风味特征,其中汾酒为清香大曲酒的典型代表[10-11],清香大曲酒酿造工艺如下。
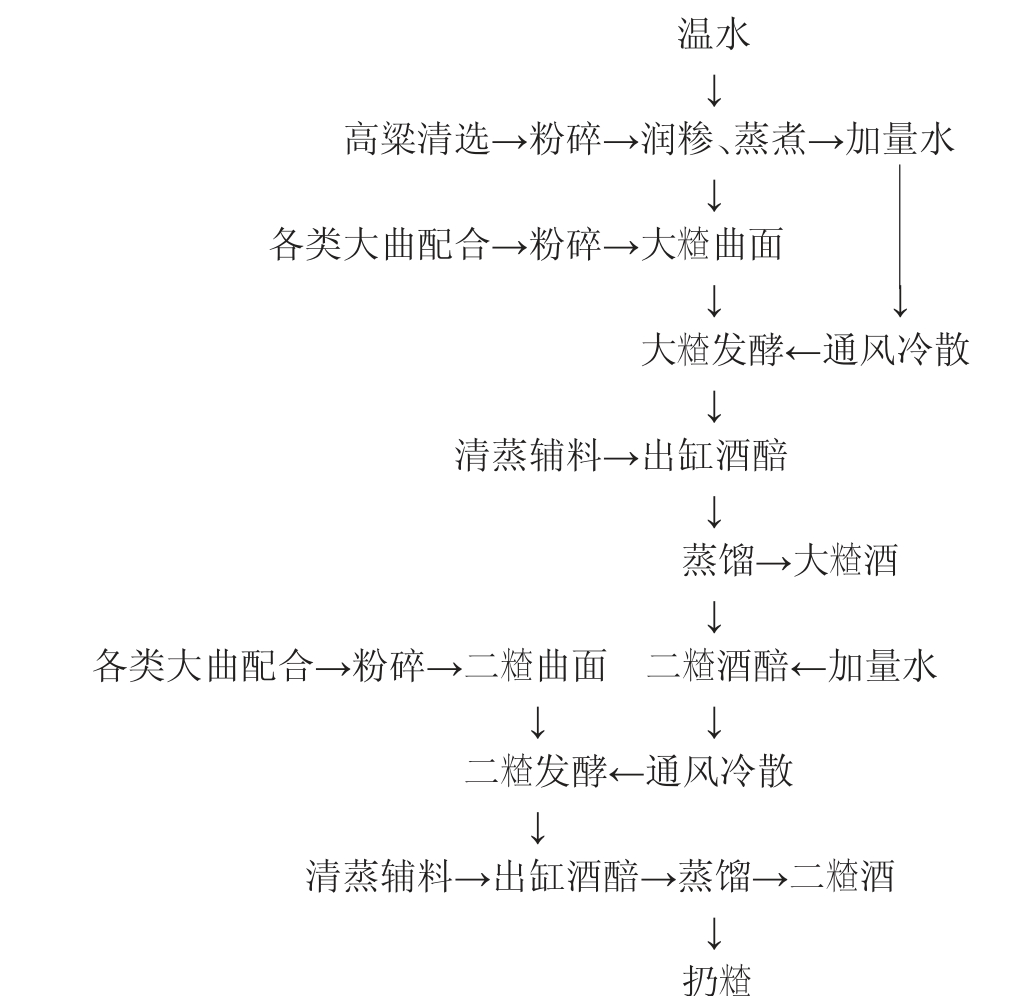
利用酒曲进行酿酒是中国白酒的特色,日本著名酿酒专家板口谨一郎先生曾评论:“中国发明酒曲酿酒,其影响之大,堪与中国四大发明相比”[12]。中国及东南亚地区的酒曲是一种具有糖化、发酵、生香等多功能的富含微生物菌系、酶系和曲香物质的微生态制品,其生产过程是依靠环境中的各种微生物在淀粉质原料中进行富集生长[13]。我国酒曲的分类主要分为大曲、小曲、麸曲,其中大曲因具有易培养、功能多、内涵复杂等特点,而受到众多名优白酒企业的使用[14]。各类复杂的微生物菌群在酿造过程中产生大量的代谢产物赋予了大曲白酒独特的风格特征[15]。清香型为代表的汾酒常采用大麦和豌豆为原料制得清茬曲、后火曲和红心曲,三种中低温大曲一般分别以3∶3∶4比例混合使用,其中清茬曲中酵母种类、曲霉多于其余两种曲,红心曲和后火曲中嗜热的放线菌和芽孢杆菌的数量较多。中低温大曲的差别之处在于制曲温度,清茬曲是小热大晾,其具有曲清香;后火曲是大热中晾,其具有曲清香、炒豌豆香;红心曲是中温小晾,其具有曲香味[3,16]。
2 清香型白酒酿造过程中功能微生物的来源
清香型白酒酿造主要采用地缸容器进行固态发酵,在清香型白酒酿造过程中功能微生物的来源主要是以酒曲微生物和酒醅微生物为主、环境微生物为辅[17-18]。酒曲是一种以大麦、小麦、麸皮等为原料,经粉碎、加压等步骤形成而形成的一种富含微生物菌系、酶系和曲香物质的微生态制品,其具有糖化、发酵、生香等功能[19-20]。清香型酒曲一般根据原料类型,可分为清香型大曲、清香型小曲以及清香型麸曲。酒醅则是粮食经过粉碎浸润蒸煮、冷散加水、加曲糖化后入窖发酵得到的产物,其中由于含有丰富的淀粉、糖分及水分,因此富集了大量的微生物菌群[21]。细菌、霉菌、酵母菌是清香型酒曲及酒醅中常见的微生物菌群。细菌以乳杆菌、芽孢杆菌等为代表,其主要作用是水解淀粉和蛋白质,同时能产生一些具有香味的代谢物[22]。霉菌以曲霉、根霉、毛霉等为代表,其主要作用是糖化淀粉和水解蛋白质,同时产生糖、氨基酸以及酯类物质等代谢物[23]。酵母菌则以假丝酵母、毕赤酵母、汉逊酵母等为代表,其主要作用是产生具有水果香气的酯类物质和酒精[14]。清香型白酒酿造过程中功能微生物的来源及在酿造中的主体作用见表1。
表1 清香型白酒酿造过程中微生物主要来源及在酿造中的主体作用
Table 1 Main sources of microorganisms in brewing process of light-flavor Baijiu and their main role in brewing
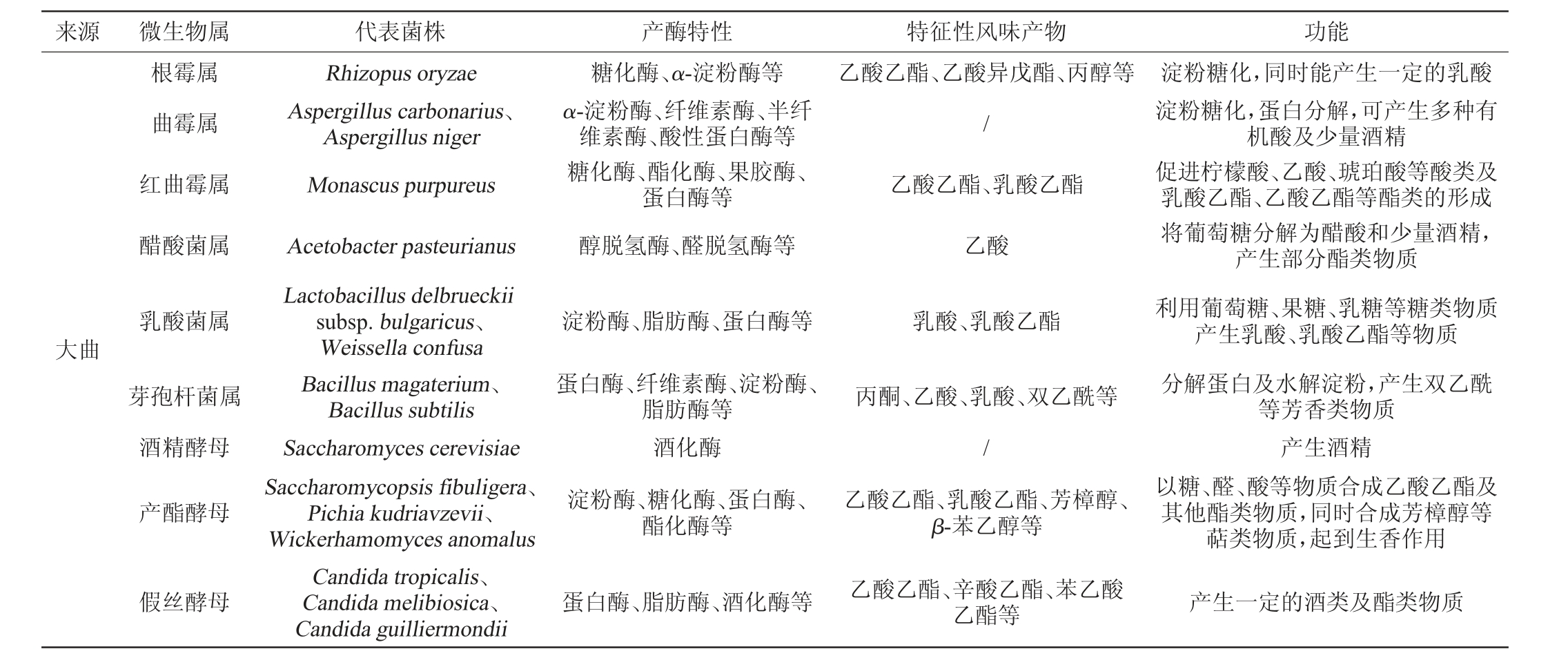
来源 微生物属 代表菌株 产酶特性 特征性风味产物 功能大曲根霉属曲霉属红曲霉属醋酸菌属淀粉糖化,同时能产生一定的乳酸淀粉糖化,蛋白分解,可产生多种有机酸及少量酒精促进柠檬酸、乙酸、琥珀酸等酸类及乳酸乙酯、乙酸乙酯等酯类的形成将葡萄糖分解为醋酸和少量酒精,产生部分酯类物质乳酸菌属Rhizopus oryzae Aspergillus carbonarius、Aspergillus niger Monascus purpureus Acetobacter pasteurianus糖化酶、α-淀粉酶等α-淀粉酶、纤维素酶、半纤维素酶、酸性蛋白酶等糖化酶、酯化酶、果胶酶、蛋白酶等醇脱氢酶、醛脱氢酶等乙酸乙酯、乙酸异戊酯、丙醇等/乙酸乙酯、乳酸乙酯乙酸Lactobacillus delbrueckii subsp.bulgaricus、Weissella confusa Bacillus magaterium、Bacillus subtilis利用葡萄糖、果糖、乳糖等糖类物质产生乳酸、乳酸乙酯等物质分解蛋白及水解淀粉,产生双乙酰等芳香类物质酒精酵母淀粉酶、脂肪酶、蛋白酶等乳酸、乳酸乙酯芽孢杆菌属蛋白酶、纤维素酶、淀粉酶、脂肪酶等丙酮、乙酸、乳酸、双乙酰等/产酯酵母酒化酶淀粉酶、糖化酶、蛋白酶、酯化酶等乙酸乙酯、乳酸乙酯、芳樟醇、β-苯乙醇等产生酒精以糖、醛、酸等物质合成乙酸乙酯及其他酯类物质,同时合成芳樟醇等萜类物质,起到生香作用假丝酵母Saccharomyces cerevisiae Saccharomycopsis fibuligera、Pichia kudriavzevii、Wickerhamomyces anomalus Candida tropicalis、Candida melibiosica、Candida guilliermondii蛋白酶、脂肪酶、酒化酶等乙酸乙酯、辛酸乙酯、苯乙酸乙酯等产生一定的酒类及酯类物质
续表

来源 微生物属 代表菌株 产酶特性 特征性风味产物 功能小曲酒醅根霉属酒精酵母产酯酵母霉菌属酵母属乳酸菌属芽孢杆菌属假单胞菌属Rhizopus tonkinensis、Rhizopus oryzae Saccharomyces cerevisiae Hansenula anomala Rhizopus oryzae Saccharomyces cerevisia、Pichia kudriavzevii、Saccharomycopsis fibuligera Lactobacillus plantarum、Lactobacillus brevis、Lactobacillus fermentum、Lactobacillus parabuchneri Bacillus stearothermophilus、Bacillus cereus、Bacillus amyloliquefacien Pseudomonas sp.糖化酶、α-淀粉酶等酒化酶酯化酶糖化酶、α-淀粉酶等淀粉酶、糖化酶、蛋白酶、酒化酶等淀粉酶、脂肪酶、蛋白酶等蛋白酶、纤维素酶、淀粉酶、脂肪酶等/乙酸乙酯、丙酸乙酯等/乙酸乙酯乙酸乙酯、乙酸异戊酯、丙醇等乙酸乙酯、乳酸乙酯等乙酸、乳酸、丁酸等丙酮、乙酸、乳酸等/淀粉糖化,同时能产生一定的乳酸产生酒精提升总酯淀粉糖化,同时能产生一定的乳酸产生酒精及酯类物质产生酸类物质,使酒体协调柔和有效降解蛋白和纤维等物质,提高原料利用率,同时提升酒体风味尚不明确
2.1大曲及大曲微生物
大曲是以大麦、小麦、豌豆为主要原料经粉碎而制成的形状较大的且含有多种菌类和酶类物质的曲块[24]。大曲按照品温可分为高温大曲、中温大曲、低温大曲;按照工艺可分为传统大曲、纯种大曲、接种的强化大曲;按照所作用原料生产的产品可分为酱香型大曲、浓香型大曲、清香型大曲、兼香型大曲[25]。大曲中含有丰富的菌系、酶系、物系,因此优质白酒绝大多数都使用大曲为糖化发酵剂。清香型白酒大曲中微生物类群主要是霉菌,其次是细菌和酵母[26]。
霉菌对清香型白酒大曲的酯化力、糖化力方面起着重要作用。霉菌的结构和形态独特,主要有毛霉、曲霉、根霉等,霉菌菌丝具有引水作用,孢子具有着色作用,因此使得大曲呈现五颜六色,同时大曲的质量很大程度上也由其颜色判定[27]。霉菌代谢产物不同,发挥的作用也不同,如米根霉是清香型大曲中主要的根霉,可将淀粉转化为糖类物质[28]。黑曲霉可产生α-淀粉酶、纤维素酶、半纤维素酶等酶类,同时也可产生少量酒精[29]。宋克伟等[30]从牛栏山清香型大曲中筛选分离出12株高产糖化酶的米根霉(Rhizopus oryzae),其中一株糖化酶活力可达2 657 U/g。同时,管健[31]从清香大曲中筛选出4株透明圈较大的霉菌,并对4株霉菌进行复筛,筛选出一株糖化力可达到1 782.5 U/g的黑曲霉(Aspergillus niger)。红曲霉能产生酯化酶、果胶酶、蛋白酶等酶类,这些酶类可以促进柠檬酸、乙酸、琥珀酸等酸类及乳酸乙酯、乙酸乙酯等酯类的形成,使白酒具有独特香味[32]。王佳丽等[33]从汾酒大曲中分离到紫红曲霉(Monascus ruber),其最高耐受酒精度可达到18%vol,最高耐受pH为2。
细菌是清香型大曲的生香的动力,清香型大曲中细菌种类繁多且复杂。ZHENG X W等[24]采用聚合酶链式反应-变性梯度凝胶电泳技术从汾酒大曲中分离并鉴定出109株细菌,发现主体菌为瑞士乳杆菌(Lactobacillus helveticus)、产气肠杆菌(Enterobacter aerogenes)和大型芽孢杆菌(Bacillusmagaterium)等。罗爱国等[34]采用高通量测序技术对清香型堡子酒酿酒大曲的微生物多样性进行解析,发现大曲中的细菌菌群丰富度、多样性和均匀程度均高于真菌,这些细菌主要隶属于变形菌门(Proteobacteria)和厚壁菌门(Firmicutes),优势细菌属主要为泛菌属(Pantoea)、乳杆菌属(Lactobacillus)、雀麦属(Bromus)等。醋酸菌、乳酸菌、芽孢杆菌等是清香型大曲中常见的细菌,它们在发酵过程中能够代谢产生各种呈香呈味物质或者是其前体物质。其中醋酸菌能将葡萄糖分解为醋酸和少量酒精,从而产生部分酯类物质;乳酸菌可利用葡萄糖、果糖、乳糖等糖类物质产生乳酸、乳酸乙酯等物质,乳酸的含量是反映大曲质量的一个重要指标;芽孢杆菌能够分解蛋白及水解淀粉,从而产生双乙酰等芳香类物质[35-36]。
清香型大曲中的酵母一般有酒精酵母、假丝酵母、产酯酵母等,其在白酒生产中起发酵、产酯、生香的作用。酒精酵母是清香型大曲中主要的酵母,具有较强的产酒能力;产酯酵母又称生香酵母,能以糖、醛、酸等物质合成乙酸乙酯及其他酯类物质,起到生香的效果;假丝酵母也具有一定的产酒及产酯能力,并常与扣囊复膜酵母(Saccharomycopsis fibuligera)共同存在于清香型大曲表面[37]。王薇等[38]考察了清茬、红心、后火三种典型清香型大曲的酵母种群结构变化,发现扣囊复膜酵母是三种大曲中相同的优势菌种,但三种大曲中的酵母结构组成差异较大,其中清茬曲含有最多的酵母数量和种类。周森等[39]应用高通量测序技术对来自不同地区的清香型大曲微生物进行解析,研究结果发现扣囊复膜酵母和库氏毕赤酵母(Pichia kudriavzevii)是大曲中主要的酵母组成,其中扣囊复膜酵母是大曲中优势酵母类群,其可占大曲样品的51.48%~98.32%。牟飞燕等[40]从清香型白酒大曲筛选分离得扣囊复膜酵母JM1-1与异常威克汉姆酵母(Wickerhamomyces anomalus)JM1-2,并对两株酵母的产淀粉酶、蛋白酶能力及产香特性进行了研究,发现菌株JM1-1既产淀粉酶(68.64 U/mL)又产蛋白酶(67.70 U/mL),菌株JM1-2只产淀粉酶(30.35 U/mL),并且在两种酵母的固态发酵产物中,发现酯类种类最多,相对占比最高,两株酵母的产酯生香能力均较强。
综上,清香型大曲中霉菌以毛霉、曲霉、根霉主;酵母以酒精酵母、假丝酵母、产酯酵母为主;细菌以乳杆菌、醋酸菌、芽孢杆菌为主;不同类型的清香型大曲中种属微生物之间存在差异。
2.2 小曲及小曲微生物
小曲,又称酒药、米曲、酒饼,通常是以米粉或米糠为原料,自然接种或接种曲母,或接种纯种根霉和酵母,然后培养而制成的体积较小的曲块[41]。清香型小曲中的主要微生物为霉菌和酵母,在发酵过程中均表现为前期快速增长,后期缓慢下降的趋势[42]。目前,对清香型小曲中的微生物研究较少,霉菌研究多体现根霉与曲霉[43]。朱丽萍等[44]为了解清香型小曲白酒酿造的主要霉菌种类及其主要特性和作用,对清香型小曲中的霉菌进行了分离筛选,发现所筛选出的17株霉菌中含有曲霉属、青霉属、根霉属、毛霉属、共头霉属、横梗霉属、篮状菌属、枝孢霉属共8个属,其中曲霉属为发酵过程中的优势菌种,此外,发现17株霉菌均能产生糖化酶和纤维素酶,仅部分霉菌可产生蛋白酶和果胶酶,且多数霉菌糖化酶和蛋白酶活力较高,纤维素酶和果胶酶的酶活力整体偏低。为进一步阐明清香型小曲白酒微生物菌群信息,提升发酵质量,朱丽萍等[45]从清香型小曲中分离出7株紫色红曲霉和2株红色红曲霉,并对其耐受性进行了研究,发现9株菌最低可耐受pH值为3,最高可耐受乙醇体积分数为25%,此外,将9株红曲霉制成了红曲米,并对糖化酶活、蛋白酶活和酯化力进行了检测,发现红曲T4蛋白酶活最高,红曲M2糖化酶活最高,红曲T2的酯化力最高。
2.3 酒醅及酒醅微生物
酒醅是粮食经蒸煮发酵后得到的产物,因其含有高淀粉、糖分、蛋白等营养成分,因此网络了环境中的大量微生物[46]。清香型白酒的风味与酒醅中的功能微生物菌群息息相关。清香型白酒酒醅中的微生物菌群主要有霉菌、酵母、细菌,其中霉菌主要有犁头霉、米曲霉、根霉、毛霉和红曲霉;酵母主要有酵母菌属、扣囊复膜酵母、汉逊酵母和假丝酵母;细菌主要有乳酸菌、醋酸菌、革兰氏阳性和革兰氏阴性芽孢细菌等[47]。
陈申习等[48]采用传统分离方法和现代分子技术对清香型小曲酒酒醅中优势微生物菌群进行了研究,发现酒醅微生物主要有4种酵母、6种细菌和2种霉菌,其中酵母菌主要为酿酒酵母和毕赤酵母,细菌主要为乳酸菌和芽孢杆菌,霉菌主要为米根霉。贾丽艳等[49]通过高通量测序技术对传统清香型白酒大米查和二米查发酵过程中的真菌群落结构、丰度及演替规律进行了研究,发现传统清香型白酒大米查和二米查真菌群落组成丰富,其中子囊菌纲的腹膜孢酵母属、酵母属、假丝酵母属、有孢汉逊酵母属和有孢圆酵母属是传统清香型白酒大米查或二米查发酵主要优势菌群。刘雪婷等[50]采用高通量测序技术对清香型白酒酒醅细菌群落结构进行了解析,结果表明酒醅中优势菌门分别为厚壁菌门、放线菌门和变形菌门;优势细菌属为乳酸杆菌属、栖热嗜油菌属和假单胞菌属。
清香型白酒酒醅中含有大量乳酸菌,乳酸的含量对白酒出酒率及酒体品质有很大影响。李锐等[51]从小曲清香型劲酒酒醅中分离到植物乳杆菌(Lactobacillus plantarum)、副干酪乳杆菌(Lactobacillus paracasei)、短乳杆菌(Lactobacillus brevis)、戊糖片球菌(Pediococcus pentosaceus)、发酵乳杆菌(Lactobacillus fermentum)、布氏乳杆菌(Lentilactobacillus buchneri)和类布氏乳杆菌(Lentilactobacillus parabuchneri)7种乳酸菌,其中植物乳杆菌和发酵乳杆菌可产乳酸。江威等[52]从不同季节清香型小曲白酒酒醅中分离出235株乳酸菌,鉴定为3属15种,包含植物乳杆菌(Lacto bacillus plantarum)、发酵乳杆菌(Lactobacillus fermentum)、类布氏乳杆菌(Lactobacillus parabuchneri)、短乳杆菌(Lactobacillus brevis)、纳格里乳杆菌(Lactobacillus nagelii)等。赵微等[53]从清香型白酒酒醅中分离出10株乳酸菌,同时从中筛选高产乳酸菌株,并对其产乳酸条件进行考察,发现植物乳杆菌(Lactobacillus plantarum)SL32-2为高产乳酸的菌株,其在高粱糖化液中产乳酸的最佳发酵温度和初始pH值分别为35 ℃和7.0,乳酸总得率可达51.12%。
3 功能微生物在清香型白酒酿造中的应用
3.1 产酯产香
在产香应用方面,张学林等[54]从清香型大曲中筛选分离出一株产β-苯乙醇酵母,经鉴定为库德里阿兹威(氏)毕赤酵母(Pichiakudriavzevii),同时将其应用于清香型白酒酿造,结果表明利用该菌株酿造的白酒中β-苯乙醇(15.11mg/L)、苯乙酸乙酯(5.35 mg/L)、乙酸异戊酯(23.76 mg/L)、乙酸乙酯(4.99 mg/L)和异丁醇含量(1.22 mg/L)分别提高12.83%、47.79%、3.66%、8.22%、29.06%,并使得酒体各种香气更加协调。许银等[55]从大曲中分离纯化出高产乙酸乙酯的酵母菌异常威克汉姆酵母Y87,同时将其制备为强化曲,发现利用强化曲酿造的白酒乙酸乙酯含量提高36.6%,杂醇含量降低7.1%,正丙醇含量降低16.1%,感官评分为90.7分,该白酒具有清香型小曲白酒的典型特征,酒质有所提高。杨强等[56]从酒曲中分离筛选出2株高产乙酸乙酯的产酯酵母,并将其制备为酵母麸皮种添加于酒曲中进行小曲酒酿造,发现添加菌株Y29和Y42的小曲酒出酒率均未受影响,酒体中乙酸乙酯含量分别为2.004 g/L、1.523 g/L,比对照组提高了99.4%和51.5%,正丙醇含量分别下降44.2%和42.7%。
3.2 健康因子
在健康因子应用方面,林斌等[57]从清香酒曲中筛选获得一株高产愈创木酚类物质菌株B257,其在高粱汁发酵液中可产愈创木酚类物质含量达9.7 mg/L,经鉴定该菌株为枯草芽孢杆菌(Bacillus subtilis)。与未添加菌株相比,在小曲中添加菌株B257进行粮食发酵能有效提升清香型小曲白酒中愈创木酚类物质含量,提升率达117%。马美荣等[58]从清香型大曲中筛选分离出一株高产四甲基吡嗪的枯草芽孢杆菌,并将其应用于原酒的酿造,发现所酿造的大曲酒中四甲基吡嗪含量达到10 mg/L以上,同时酒体风味也更为醇厚。刘新宇[59]在清香型白酒发酵中添加红曲霉M2,添加红曲霉M2的实验组酒体中四甲基吡嗪的前体物质乙偶姻含量达到8 mg/L,比对照组提高了167%。
3.3 高级醇
在高级醇应用方面,汪晗等[60]从6株酿酒酵母(Saccharomyces cerevisiae)菌株中筛选出一株低产高级醇的菌株,并将其与不同酵母菌株以一定比例混合发酵应用于小曲清香型白酒酿造中,发现与接种传统小曲相比,混合菌株制备酒样的乙醇含量提高了29.26%,乙酸乙酯含量提高了1957.91%,而总高级醇/乙醇的值比降低了4.24%。林斌等[61]从清香型酒曲中分离筛选得到一株低产正丙醇的酿酒酵母(Saccharomyces cerevisiae)Y19,该菌株在温度20~35 ℃、pH3~8、葡萄糖含量2%~25%以及乙醇体积分数0~12%的条件下生长良好,此外,与生产用曲相比,使用添加了酿酒酵母Y19强化曲的清香型白酒中正丙醇含量显著降低29.9%(P<0.05),乙酸乙酯含量显著升高28.8%(P<0.05)。毛豪等[62]从清香型酒醅中筛选一株低产高级醇的库德里阿兹威毕赤酵母(Pichia kudriavzevii),该菌株的异丁醇和异戊醇的总产量为199.09 mg/L,比对照菌株低22.50%。
4 总结与展望
酒曲微生物、酒醅微生物、环境微生物之间的相互作用,共同形成了清香型白酒“清、正、甜、净、长”的风味特征。该文对清香型白酒的酿造工艺、功能微生物的来源以及功能微生物在清香型白酒中的应用进行综述,为今后提升清香型白酒品质提供理论参考。清香型白酒在酿造过程中都体现在一个“清”字,即原料清蒸、辅料清蒸、清米查发酵、清蒸馏酒,其生产覆盖面广,是流派最多的香型。对于清香型白酒未来的研究与发展趋势做以下展望:
清香型白酒在酿造过程中,酒曲、酿酒原料本身具有大量挥发性香气化合物,蒸煮过程以及发酵过程都可生成白酒酒体中重要的风味物质或前体风味物质,这些风味化合物赋予了清香型白酒清香的独特风格特征,未来应将风味化合物于感官特征相结合,寻找风味化合物与感官特征间的相关性,探明决定不同感官特征的风味化合物。
清香型白酒酒曲、酒醅及环境中微生物结构复杂,微生物之间的相互作用以及产生相应风味物质的途径尚未明确,未来应当考虑利用宏基因组学、代谢组学、蛋白质组学等组学手段对酿酒环境及发酵过程中微生物的动态变化、相互作用和代谢产物进行研究,明确各种微生物的代谢途径与风味贡献之间的关系,从而针对性的提高清香型白酒的品质与风味。
目前白酒中的微量成分高达2 000多种,其中对人体健康有益的物质有200多种,以人民健康为核心,进行健康白酒的开发是未来研究的重点方向。因此,可通过现有技术手段筛选分离出具有产生天然健康因子的微生物,将其应用于清香型白酒酿造过程中,从而丰富清香型白酒的健康成分。
[1]LI W.Research trends in Jiang-flavor Baijiu fermentation:From fermentation microecology to environmental ecology[J].J Food Sci,2022,87(4):1362-1374.
[2]王传荣.白酒的香型及其风味特征研究[J].酿酒科技,2008(9):49-52.
[3]田德雨,闫子茹,危晶晶,等.清香型白酒酿造微生物和风味物质的研究进展[J].中国酿造,2021,40(4):20-25.
[4]PANG X N,HUANG X N,CHEN J Y,et al.Exploring the diversity and role of microbiota during material pretreatment of light-flavor Baijiu[J].Food Microbiol,2020,91:103514.
[5]WANG Z,WANG Y, ZHU T T, et al.Characterization of the key odorants and their content variation in Niulanshan Baijiu with different storage years using flavor sensory omics analysis[J].Food Chem,2022,376(15):131851.1.
[6]贾丽艳,郭晋田,刘帅,等.清香型白酒发酵过程中微生物及理化指标的变化规律[J].中国食品学报,2020,20(8):162-167.
[7]HOU Q C,WANG Y R,CAI W C,et al.Metagenomic and physicochemical analyses reveal microbial community and functional differences between three types of low-temperature Daqu[J].Food Res Int,2022,156(7):111167.1.
[8]毛洪川.整粒高粱酿造浓香型白酒的工艺开发及应用研究[D].绵阳:西南科技大学,2017.
[9]孙细珍,熊亚青,杜佳炜,等.不同品种高粱小曲白酒感官表征及重要风味物质对比分析[J].食品与发酵工业,2022,48(9):34-40.
[10]ZHENG X W,YAN Z,HAN B Z,et al.Complex microbiota of a Chinese"Fen"liquor fermentation starter(Fen-Daqu),revealed by culture-dependent and culture-independent methods[J].Food Microbiol,2012,31(2):293-300.
[11]王震,叶宏,朱婷婷,等.清香型白酒风味成分的研究进展[J].食品科学,2022,43(7):232-244.
[12]王鹏昊,关统伟,邓奥宇,等.酒曲中高产蛋白酶和α-淀粉酶霉菌菌株的筛选与分子鉴定[J].酿酒科技,2016(6):61-64,71.
[13]汪陈平,刘源才,刘胜华,等.低酒精度配制酒关键生产技术探讨[J].酿酒科技,2014(1):59-60.
[14]李兵,张超,王玉霞,等.白酒大曲功能微生物与酶系研究进展[J].中国酿造,2019,38(6):7-12.
[15]周晨曦,郑福平,李贺贺,等.白酒大曲风味物质研究进展[J].中国酿造,2019,38(5):6-12.
[16]曹苗文,相里加雄,杨凯环,等.清香型大曲白酒酿造中发酵微生物的分析研究[J].酿酒科技,2022(1):36-41,46.
[17]赵冠.酿酒高粱蒸煮品质及发酵特性研究[D].杨凌:西北农林科技大学,2021.
[18]陈丙友,韩英,张鑫,等.酒醅温度调控对清香型白酒发酵过程的影响[J].食品与发酵工业,2016,42(6):44-49.
[19]SAKANDAR H A, HUSSAIN R, KHAN Q F, et al.Functional microbiota in Chinese traditional Baijiu and Mijiu Qu(Starters):A Review[J].Food Res Int,2020,138(B):109830.
[20]SU C,ZHANG K Z,CAO X Z,et al.Effects of Saccharomycopsis fibuligera and Saccharomyces cerevisiae inoculation on small fermentation starters in Sichuan-style Xiaoqu liquor[J].Food Res Int,2020,137:109425.
[21]赵蒙,孙安,谭功全.白酒酒醅检测技术的研究进展与展望[J].食品科技,2022,47(12):250-257.
[22]梁栩煜,钱敏,白卫东,等.白酒酿造过程中的微生物研究进展[J].中国酿造,2020,39(7):11-15.
[23]蔡凤娇,蒋燕明,饶建军,等.白酒酿造微生物分析方法研究进展[J].食品研究与开发,2021,42(18):211-218.
[24]ZHENG X W,YAN Z,ROBERT M J,et al.Microbiota dynamics related to environmental conditions during the fermentative production of Fen-Daqu,a Chinese industrial fermentation starter[J].Int J Food Microbiol,2014,182-183:57-62.
[25]柯涛,周业皓,姜鹏,等.中高温强化大曲生产工艺及特性研究[J].中国酿造,2019,38(2):47-52.
[26]张双燕.清香型白酒风味物质形成与大曲微生物相关性研究[D].北京:北京理工大学,2016.
[27]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998,45-47.
[28]DUNG N T P,ROMBOUT F M,NOUT M J R.Defined fungal startergranules for purple glutinous rice wine[D].Wageningen: Wageningen University,2004.
[29]徐丹,孙秀兰,李永仙,等.黑曲霉对黄曲霉生长、产毒及黄曲霉毒素B1的影响[J].中国微生态学杂志,2011,23(6):490-492.
[30]宋克伟,胡建华,魏金旺,等.米根霉在牛栏山基酒生产中的应用[J].酿酒科技,2015(2):73-75.
[31]管健.大曲清香型白酒功能菌的筛选与应用[D].武汉:湖北工业大学,2018.
[32]申孟林,张超,王玉霞,等.白酒大曲微生物酶系研究进展[J].中国酿造,2018,37(4):7-11.
[33]王佳丽,韩建荣,赵景龙,等.汾酒大曲中红曲霉的分离和鉴定[J].山西大学学报(自然科学版),2009,32(2):289-293.
[34]罗爱国,杨牛恬,郑同庆,等.清香型白酒酿酒大曲微生物菌群多样性解析[J].中国酿造,2022,41(4):73-79.
[35]张龙,梁振荣,郝俊光,等.乳酸菌对米香型白酒发酵过程中乳酸和乳酸乙酯产生的影响研究[J].酿酒科技,2022(11):29-35.
[36]刘青阳,黄晓宁,陆玮,等.中高温大曲中芽孢杆菌多样性及代谢特征研究[J].中国酿造,2022,41(7):26-31.
[37]凌荔,牟飞燕,袁萌,等.清香型白酒大曲研究进展[J].酿酒,2022,49(6):17-22.
[38]王薇,吴群,徐岩.清香型白酒固态酿造过程中酵母种群结构和多样性分析[J].微生物学通报,2012,39(9):1272-1279.
[39]周森,胡佳音,崔洋,等.应用高通量测序技术解析清香型大曲微生物多样性[J].中国食品学报,2019,19(6):244-249.
[40]牟飞燕,凌荔,肖钧文,等.清香型白酒大曲中产酶酵母的筛选与发酵特性研究[J].酿酒科技,2023(2):48-52,64.
[41]王毅,罗惠波,王彩虹.小曲酒酿造微生物研究进展[J].酿酒科技,2014(4):78-82.
[42]吕义俊,孙齐,郭唐芳,等.清香型小曲酒糖化发酵过程微生物及色谱指标变化规律研究[J].酿酒科技,2022(3):31-34,46.
[43]FAN G S, SUN B G, XU D, et al.Isolation and identification of highyield ethyl acetate-producing yeast from Gujinggong Daqu and its fermentation characteristics[J].J Am Soc Brewing Chem, 2018, 76(2):117-124.
[44]朱丽萍,杨强,江威,等.清香型小曲白酒霉菌菌群解析与酶活特性研究[J].食品与发酵工业,2022,48(7):70-77.
[45]朱丽萍,杨强,刘源才,等.清香型小曲白酒生产中红曲霉的分离及发酵特性研究[J].酿酒科技,2021(10):133-139.
[46]赵蒙,孙安,谭功全.白酒酒醅检测技术的研究进展与展望[J].食品科技,2022,47(12):250-257.
[47]李增胜,任润斌.清香型白酒发酵过程中酒醅中的主要微生物[J].酿酒,2005,32(5):33-34.
[48]陈申习,唐洁,张龙,等.清香型小曲白酒机械化生产中微生物动态变化研究[J].中国酿造,2018,37(6):68-72.
[49]贾丽艳,田宇敏,王晓勇,等.传统清香型白酒发酵过程中真菌群落结构及其动态演替[J].中国食品学报,2020,20(10):303-308.
[50]刘雪婷,王子媛,刘继明,等.清香型白酒酒醅发酵菌株分离鉴定及细菌群落结构分析[J].中国酿造,2021,40(1):39-43.
[51]李锐,杨玉贤,杨强,等.劲酒传统发酵过程中可培养功能细菌群落的动态变化初步研究[J].湖北大学学报(自然科学版),2019,41(6):572-577.
[52]江威,王路瑶,张宗杰,等.清香型小曲白酒酒醅中乳酸菌的筛选鉴定及其发酵特性研究[J].中国酿造,2022,41(8):57-63.
[53]赵微,赵璇,崔美林,等.清香型白酒酒醅中乳酸高产菌株的筛选及乳酸的分离纯化[J].中国酿造,2022,41(6):63-68.
[54]张学林,季斌,许玲,等.清香型大曲中产β-苯乙醇酵母的分离、鉴定及在白酒酿造中的应用[J].中国酿造,2022,41(1):123-127.
[55]许银,杨强,张龙,等.高产乙酸乙酯酵母菌的筛选及其在清香型小曲白酒生产中的应用[J].中国酿造,2021,40(8):76-80.
[56]杨强,唐洁,杨生智,等.清香型小曲白酒产酯酵母的筛选及应用[J].酿酒科技,2016(1):78-80.
[57]林斌,杨强,宿智新,等.产愈创木酚类功能菌筛选及其在清香型小曲白酒中的应用[J].中国酿造,2022,41(9):74-79.
[58]马美荣,周林艳,王德斌,等.高产四甲基吡嗪芽孢杆菌的筛选及在清香型原酒生产中的应用研究[J].酿酒科技,2018(7):104-107.
[59]刘新宇.红曲霉的分离纯化及在清香型白酒中的应用[D].太原:山西师范大学,2014.
[60]汪晗,高瑞杰,杨团元,等.白酒酿造中低产高级醇酿酒酵母的筛选及应用研究[J].中国酿造,2023,42(8):78-83.
[61]林斌,唐洁,江威,等.低产正丙醇酵母菌的筛选及其在清香型白酒中的应用[J].中国酿造,2023,42(4):131-136.
[62]毛豪,朱澳迪,徐锦,等.低产高级醇酵母的筛选及其发酵特性研究[J].中国酿造,2023,42(5):165-170.