葡萄酒是以鲜葡萄或葡萄汁酿制而成的果酒[1-3],含有多种营养成分,具有美容、保护心脑血管、抗氧化、改善睡眠等功效[3-7]。随着经济的发展,保健养生逐渐被人们所重视,葡萄酒成为常用佐餐酒,消费量快速增长[8-11]。伴随出现的便是向葡萄酒中添加人工合成着色剂进行调色或以合成着色剂加香精勾兑葡萄酒的乱象,严重损害人民利益[10-12]。合成着色剂由苯、萘等有机试剂经化学反应制成,会在体内积蓄反应产生潜在致癌物,损害人体健康[11-15]。
人工合成着色剂的检测主要有质谱法、液相色谱法、气相色谱法、液相色谱-质谱法[11,13-18]。葡萄酒一般参照GB 5009.35《食品中合成着色剂的测定》执行,于2024年3月6日实施的版本中检测方法为液相色谱法,检测波长由单波长改为多波长,解决了因样品基质复杂、单波长检测分离度和灵敏度低等问题[11];前处理方法改为固相萃取柱法,也是目前文献报道中常用的前处理方法。但对于葡萄酒这种基质不太复杂的液体类样品,前处理方法使用固相萃取柱法存在步骤多、处理时间长以及进行色谱分析时个别着色剂灵敏度较低等问题。因此,建立葡萄酒中多种人工合成着色剂的快速处理并定量检测的方法,明确葡萄酒中是否添加合成着色剂及其含量具有重要意义。笔者前期以直接过滤法前处理、多波长检测实现了葡萄酒基质中9种合成着色剂的分离检测,但存在部分着色剂不能准确定量的问题[11]。本研究通过优化改进实验操作,以期实现葡萄酒中11种人工合成着色剂的快速处理、准确定量,为快速准确定量葡萄酒中多种人工合成着色剂提供技术支撑。
1 材料与方法
1.1 材料与试剂
葡萄酒:兰州当地市售。
偶氮玉红、专利蓝标准物质(纯度均≥98.0%):北京坛墨质检科技有限公司;柠檬黄、胭脂红、新红、日落黄、靛蓝、苋菜红、诱惑红、亮蓝、赤藓红标准溶液(1.00 mg/mL):北京海岸鸿蒙标准物质技术有限责任公司;乙酸铵(分析纯):天津科密欧有限公司;甲醇(色谱纯):美国赛默飞公司。
1.2 仪器与设备
Waters 2695高效液相色谱仪(high performance liquid chromatography,HPLC)(配2998 光电二极管阵列检测器(photo-diode array,PDA)):美国Waters公司;ZYC超纯水机:四川卓越有限公司;WirbelMixer涡旋混合器:阿斯曼尔科技有限公司;ME 204/02电子天平:梅特勒-托利多有限公司;H-2050R冷冻离心机:湖南湘仪实验室仪器开发有限公司;0.22 μm水系过滤器:青岛鸿谱生物有限公司。
1.3 方法
1.3.1 人工合成着色剂标准溶液的配制
偶氮玉红、专利蓝标准溶液(1.00 mg/mL):准确称取按纯度折算为100%质量的偶氮玉红、专利蓝标准物质各0.1 g(精确到0.000 1 g),水稀释定容至100.0 mL。
混合标准中间液(100.0 mg/L):吸取1.00 mg/mL的各着色剂标准溶液1.0 mL,水稀释定容至10.0 mL。
混合标准工作液:分别吸取0.010mL、0.025mL、0.050mL、0.10 mL、0.50 mL、1.0 mL、2.5 mL中间液于5.0 mL容量瓶中,水定容得质量浓度为0.2 mg/L、0.5 mg/L、1.0 mg/L、2.0 mg/L、10.0 mg/L、20.0 mg/L、50.0 mg/L的混合标准工作液。
1.3.2 样品前处理[11,19]
准确吸取2.0mL葡萄酒样品并准确称量(精确至0.001g),准确加入2.0 mL乙酸铵溶液(0.025 mol/L,pH=9.0)1∶1混合,涡旋2 min混匀,8 000 r/min离心5 min,0.22 μm滤膜过滤后上机测定。
1.3.3 色谱条件
色谱柱为Zorbax SB-C18柱(4.6 mm×250 mm,5 μm);检测波长:新红515 nm,靛蓝288 nm,其他着色剂检测波长同参考文献[11];流动相A:0.025 mol/L乙酸铵溶液,流动相B:甲醇;梯度洗脱程序:0 min,88%A→10 min,68%A→15 min,56%A→20 min,20%A→25 min,2%A。柱温35 ℃,流速1.0 mL/min,进样体积20 μL。
1.3.4 定性定量方法
参照文献[11],以色谱峰保留时间、光谱扫描图进行定性;采用外标法进行定量。
1.3.5 方法学的考察
(1)标准曲线的绘制
分别以各着色剂质量浓度(x)、峰面积(y)为横、纵坐标绘制标准曲线。
(2)检出限和定量限
参照GB/T 27417—2017《合格评定化学分析方法确认和验证指南》[18]中确定检出限(detection limit,LOD)和定量限(limit of quantitation,LOQ)的方法[19],配制系列不同浓度的加标样品,确定的方法处理检测,以3倍、10倍信噪比计算检出限和定量限。
(3)精密度试验
以空白葡萄酒样品为溶剂配制含量为20.0 mg/L的葡萄酒加标样品,按优化后的直接过滤法处理6次,以确定的色谱条件进样,计算11种合成着色剂的相对标准偏差(relative standard deviation,RSD)。
(4)加标回收率试验
以空白葡萄酒样品为溶剂,分别添加低(5 mg/L)、中(10 mg/L)、高(20 mg/L)3个水平加标样品溶液,按优化后的直接过滤法、固相萃取柱法进行处理,以确定的色谱条件进样,每个浓度2个平行,分别计算11种合成着色剂的加标回收率。
2 结果与分析
2.1 液相色谱条件的优化
2.1.1 流动相梯度的选择
本实验分别尝试了按照GB 5009.35—2016《食品安全国家标准食品中合成着色剂的测定》[20]与本实验的流动相梯度对进行洗脱。实验中发现,GB 5009.35—2016《食品安全国家标准食品中合成着色剂的测定》[20]方法流动相比例在短时间内快速变化,着色剂的出峰时间虽然有所缩短,但色谱图基线严重飘升,影响色谱峰的准确积分和定量。综合色谱图基线和各着色剂分离度情况,确定本实验选择的流动相洗脱条件为最佳条件,能较好的实现11种合成着色剂的有效分离。
2.1.2 检测波长的确定
通过对11种合成着色剂紫外波长扫描发现,在低波长范围内(200~260 nm)大多着色剂都有较大吸收值,但考虑到样品基质较复杂、很多物质在此波长处都有吸收,会对目标物色谱峰造成干扰,所以未选用低波长检测[11]。参照文献[11]及光谱扫描图,确定新红检测波长为515 nm,与文献[11]中苋菜红等合成着色剂归为一组;靛蓝在波长611.5 nm、287.8 nm处都有较大吸收,专利蓝、亮蓝的最大吸收波长分别为635.9 nm、628.5 nm,参考GB 5009.35—2023《食品中11种合成着色剂的测定》[21]将靛蓝与亮蓝、专利蓝归为一组,在波长610~630 nm处进行检测。但实验中发现,在波长610~630 nm处对这3种合成着色剂混合标准溶液进行检测时,靛蓝色谱峰响应值较小,加之靛蓝在波长611.5 nm处的吸光度值远不如波长287.8 nm处大,所以将靛蓝单独归为一组,检测波长选定为288 nm,在此波长条件下,靛蓝的色谱峰响应值得到明显的提升。11种合成着色剂混合标准溶液在不同波长(425 nm、515 nm、630 nm、288 nm)条件下的分离情况见图1。
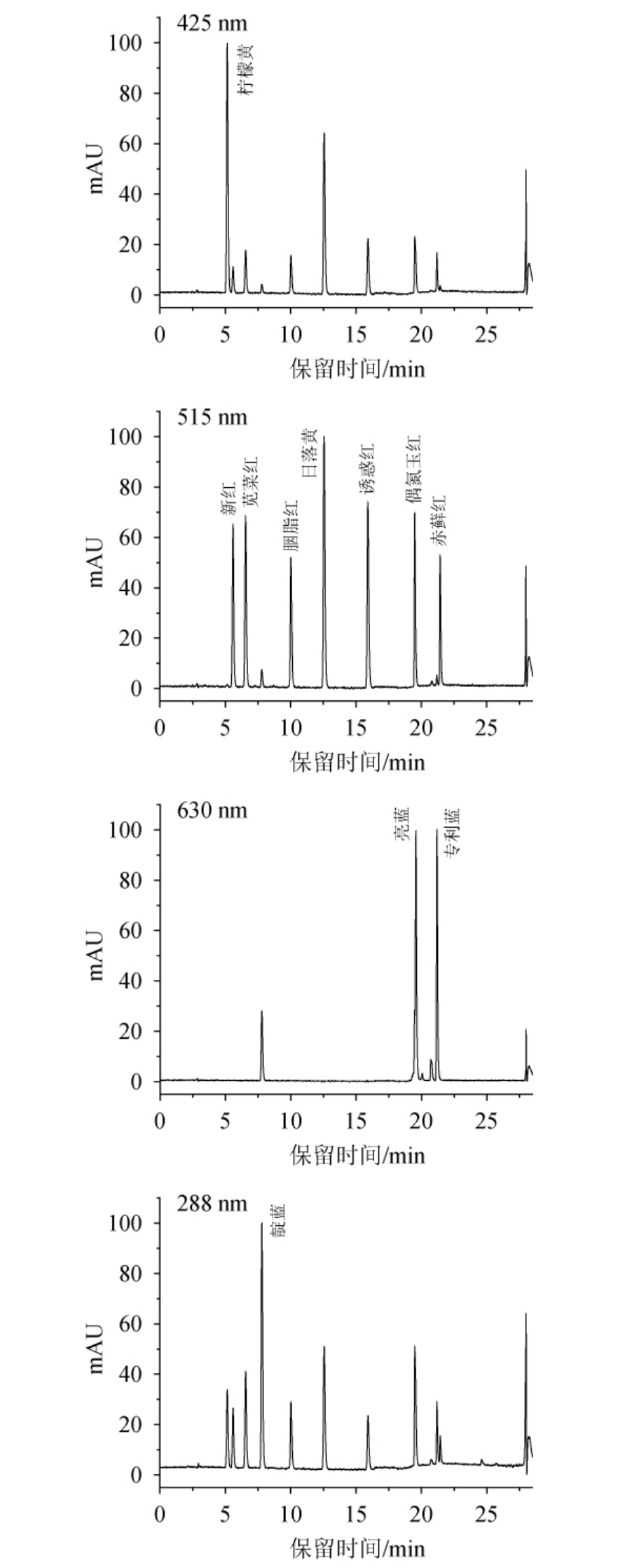
图1 11种人工合成着色剂混合标准溶液在波长425 nm、515 nm、630 nm、288 nm条件下的HPLC图
Fig.1 HPLC chromatograms of 11 kinds of synthetic colorants mixture standard solution at wavelength 425 nm, 515 nm,630nm and 288 nm
由图1可知,优化后的11种合成着色剂均得到了较好的分离和较高的峰响应值,且无相互干扰。
2.2 前处理方法的选择
对含有苋菜红着色剂的葡萄酒样品分别采用液-液分配法[18]、固相萃取柱法[19]、本实验的方法3种前处理,根据优化后的色谱条件进样,3种不同前处理后葡萄酒样的HPLC色谱图见图2。由图2可知,经3种前处理方法处理后,葡萄酒样品的苋菜红着色剂色谱峰响应值均较大,峰型较好;葡萄酒样品基质杂质未对目标色谱峰造成干扰。液-液分配法及固相萃取柱法对于葡萄酒类基质不太复杂的液体样品存在步骤过多、费时等问题,在色谱峰出峰均较为理想的情况下,本实验的前处理方法更为简单、省时、省力,可大量节省人工合成着色剂筛选、检测、定量时间。因此选择本实验的方法进行葡萄酒样品的前处理。
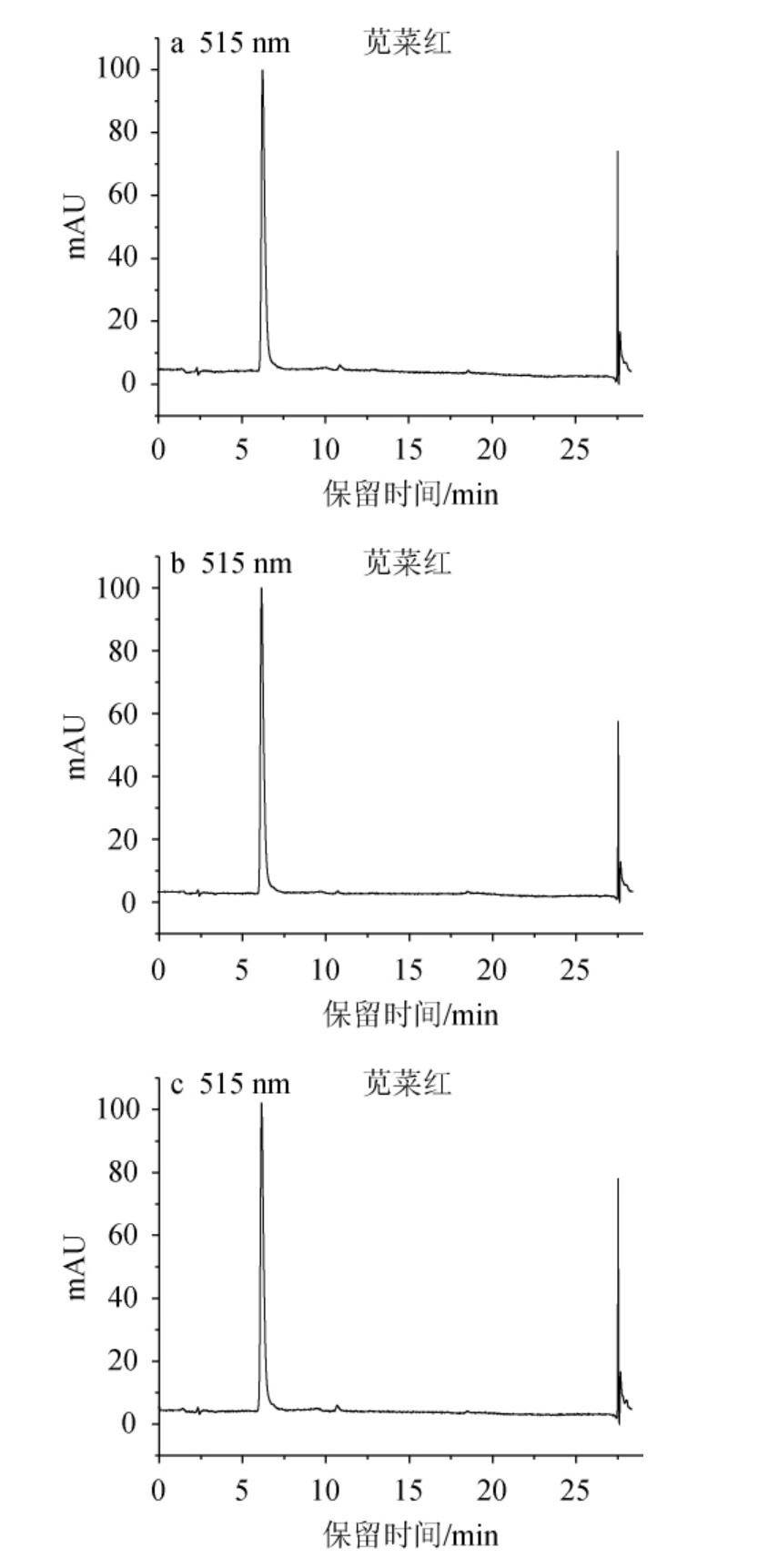
图2 不同前处理方法葡萄酒样品的HPLC色谱图
Fig.2 HPLC chromatogram of wine samples by different pretreatment
a.液液分配法;b.固相萃取柱法;c.本实验方法。
2.3 方法学考察
由表1可知,在0.20~50 mg/L范围内,11种人工合成着色剂线性良好,相关系数R均≥0.999 4,方法检出限为0.05 mg/L,定量限为0.15 mg/L,可满足分析需要。
表1 11种人工合成着色剂的检出限、定量限、线性范围、线性方程及相关系数
Table 1 Detection limit, quantitation limit, linear range, linear equation and correlation coefficient of 11 synthetic colorants
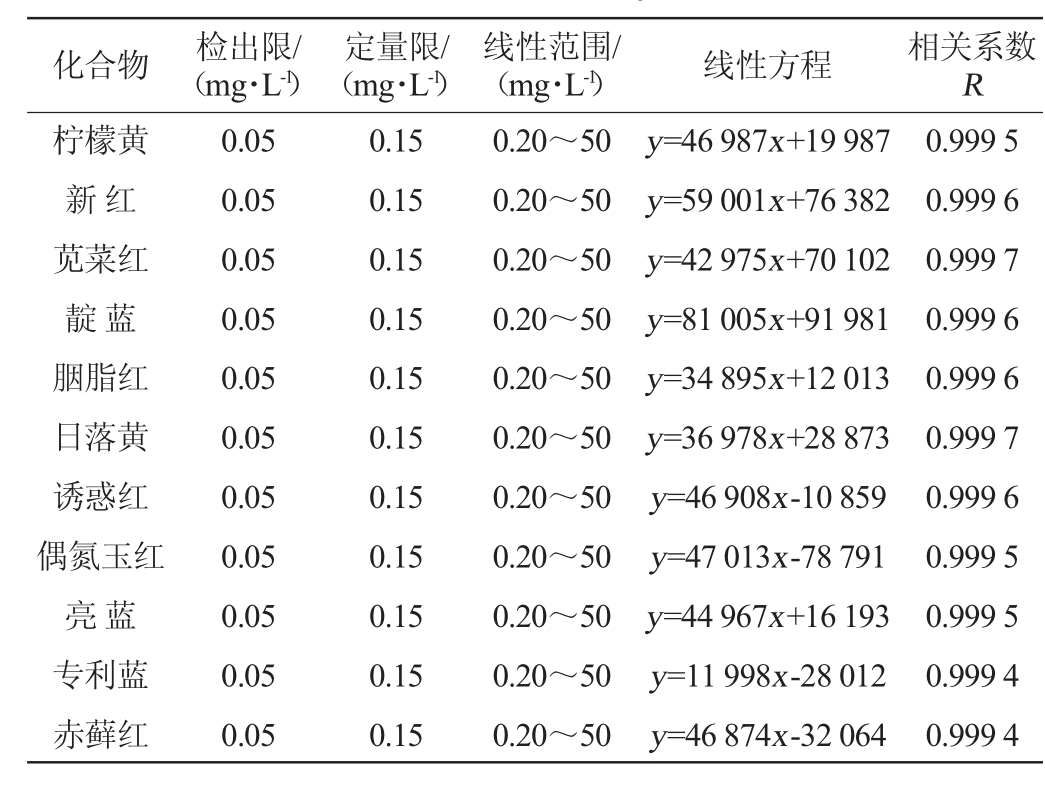
化合物 检出限/(mg·L-1)定量限/(mg·L-1)(mg·L-1) 线性方程 相关系数R线性范围/柠檬黄新红苋菜红靛蓝胭脂红日落黄诱惑红偶氮玉红亮蓝专利蓝赤藓红0.05 0.05 0.05 0.05 0.05 0.05 0.05 0.05 0.05 0.05 0.05 0.15 0.15 0.15 0.15 0.15 0.15 0.15 0.15 0.15 0.15 0.15 0.20~50 0.20~50 0.20~50 0.20~50 0.20~50 0.20~50 0.20~50 0.20~50 0.20~50 0.20~50 0.20~50 y=46 987x+19 987 y=59 001x+76 382 y=42 975x+70 102 y=81 005x+91 981 y=34 895x+12 013 y=36 978x+28 873 y=46 908x-10 859 y=47 013x-78 791 y=44 967x+16 193 y=11 998x-28 012 y=46 874x-32 064 0.999 5 0.999 6 0.999 7 0.999 6 0.999 6 0.999 7 0.999 6 0.999 5 0.999 5 0.999 4 0.999 4
由表2可知,将20.0 mg/L的加标样品处理6次上机测定,计算得各合成着色剂测定结果的相对标准偏差(RSD)为1.86%~2.61%。表明该方法精密度良好。
表2 11种人工合成着色剂的精密度试验结果
Table 2 Precision tests results of 11 synthetic colorants
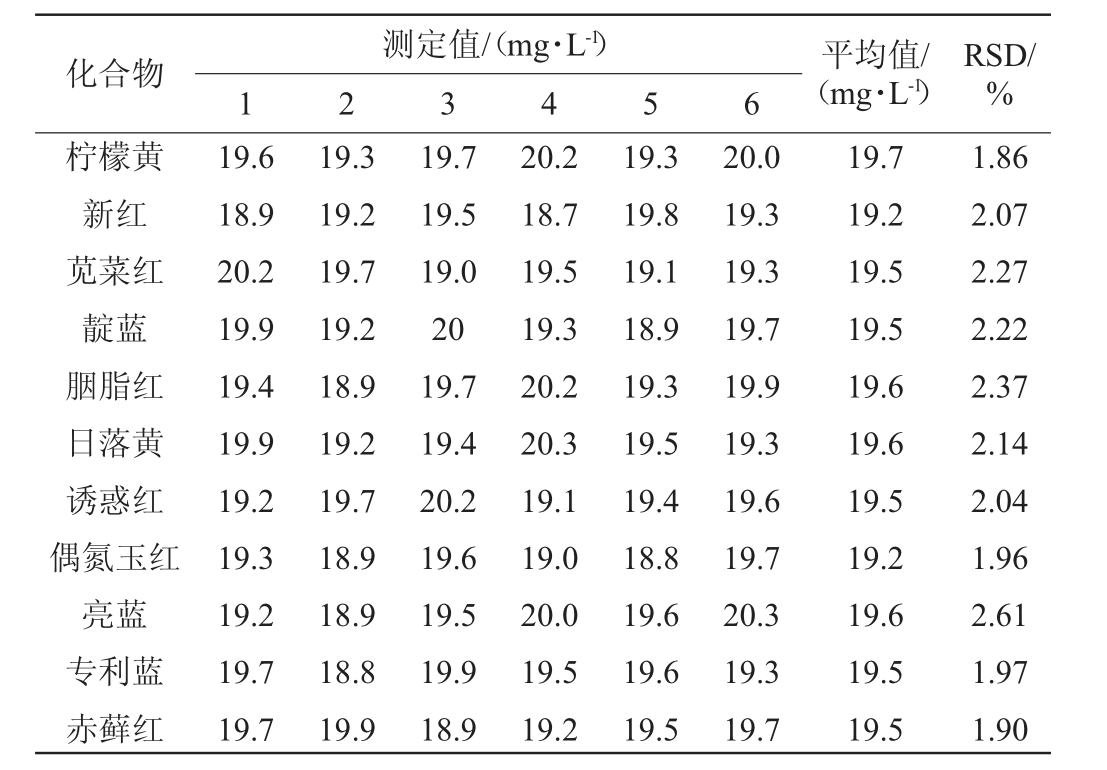
化合物 平均值/(mg·L-1)测定值/(mg·L-1)1 2 3 4 5 6 RSD/%柠檬黄新红苋菜红靛蓝胭脂红日落黄诱惑红偶氮玉红亮蓝专利蓝赤藓红19.6 18.9 20.2 19.9 19.4 19.9 19.2 19.3 19.2 19.7 19.7 19.3 19.2 19.7 19.2 18.9 19.2 19.7 18.9 18.9 18.8 19.9 19.7 19.5 19.0 20 19.7 19.4 20.2 19.6 19.5 19.9 18.9 20.2 18.7 19.5 19.3 20.2 20.3 19.1 19.0 20.0 19.5 19.2 19.3 19.8 19.1 18.9 19.3 19.5 19.4 18.8 19.6 19.6 19.5 20.0 19.3 19.3 19.7 19.9 19.3 19.6 19.7 20.3 19.3 19.7 19.7 19.2 19.5 19.5 19.6 19.6 19.5 19.2 19.6 19.5 19.5 1.86 2.07 2.27 2.22 2.37 2.14 2.04 1.96 2.61 1.97 1.90
由表3可知,优化后直接过滤法的加标回收率为93.0%~103.0%,固相萃取柱法的加标回收率为91.0%~102.0%,表明两种前处理方法的准确度良好,均符合方法学要求。
表3 11种人工合成着色剂的加标回收率试验结果
Table 3 Recovery tests results of 11 synthetic colorants
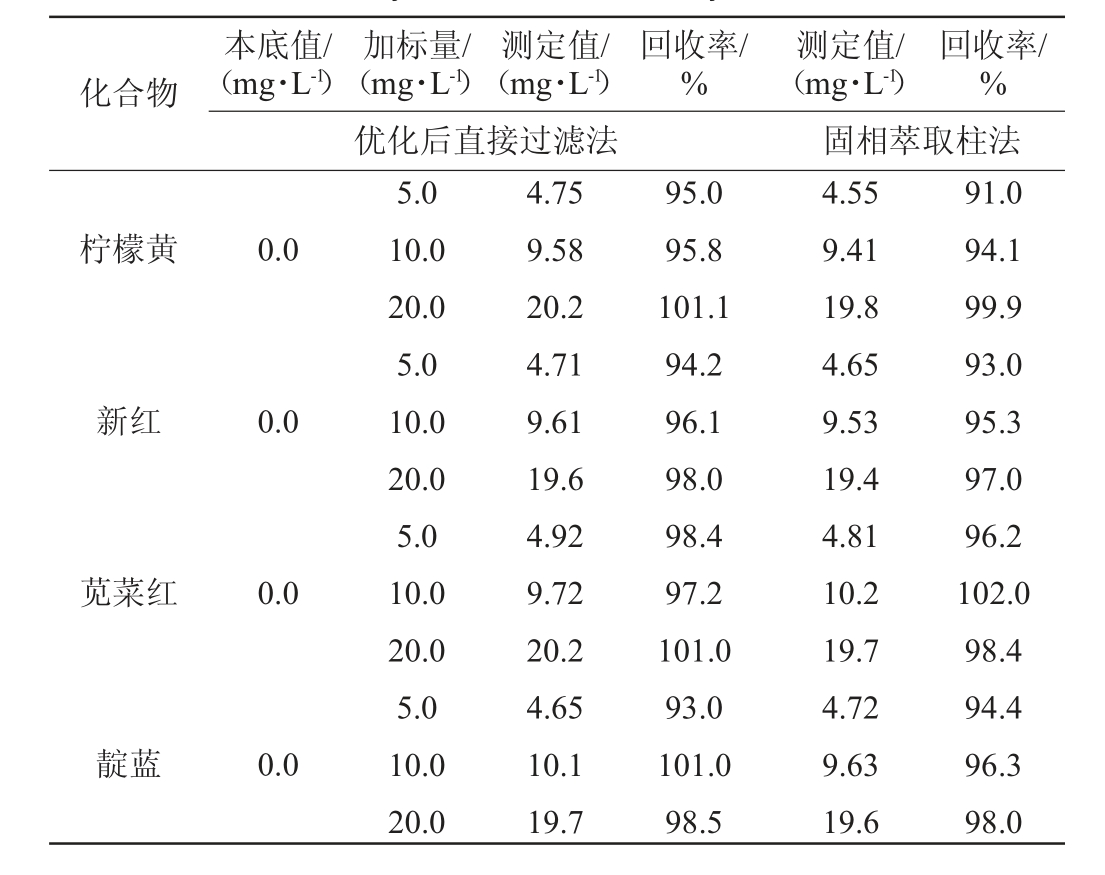
化合物本底值/(mg·L-1)加标量/(mg·L-1)测定值/(mg·L-1)回收率/%回收率/%优化后直接过滤法测定值/(mg·L-1)固相萃取柱法柠檬黄0.0新红0.0苋菜红0.0靛蓝0.0 5.0 10.0 20.0 5.0 10.0 20.0 5.0 10.0 20.0 5.0 10.0 20.0 4.75 9.58 20.2 4.71 9.61 19.6 4.92 9.72 20.2 4.65 10.1 19.7 95.0 95.8 101.1 94.2 96.1 98.0 98.4 97.2 101.0 93.0 101.0 98.5 4.55 9.41 19.8 4.65 9.53 19.4 4.81 10.2 19.7 4.72 9.63 19.6 91.0 94.1 99.9 93.0 95.3 97.0 96.2 102.0 98.4 94.4 96.3 98.0
续表
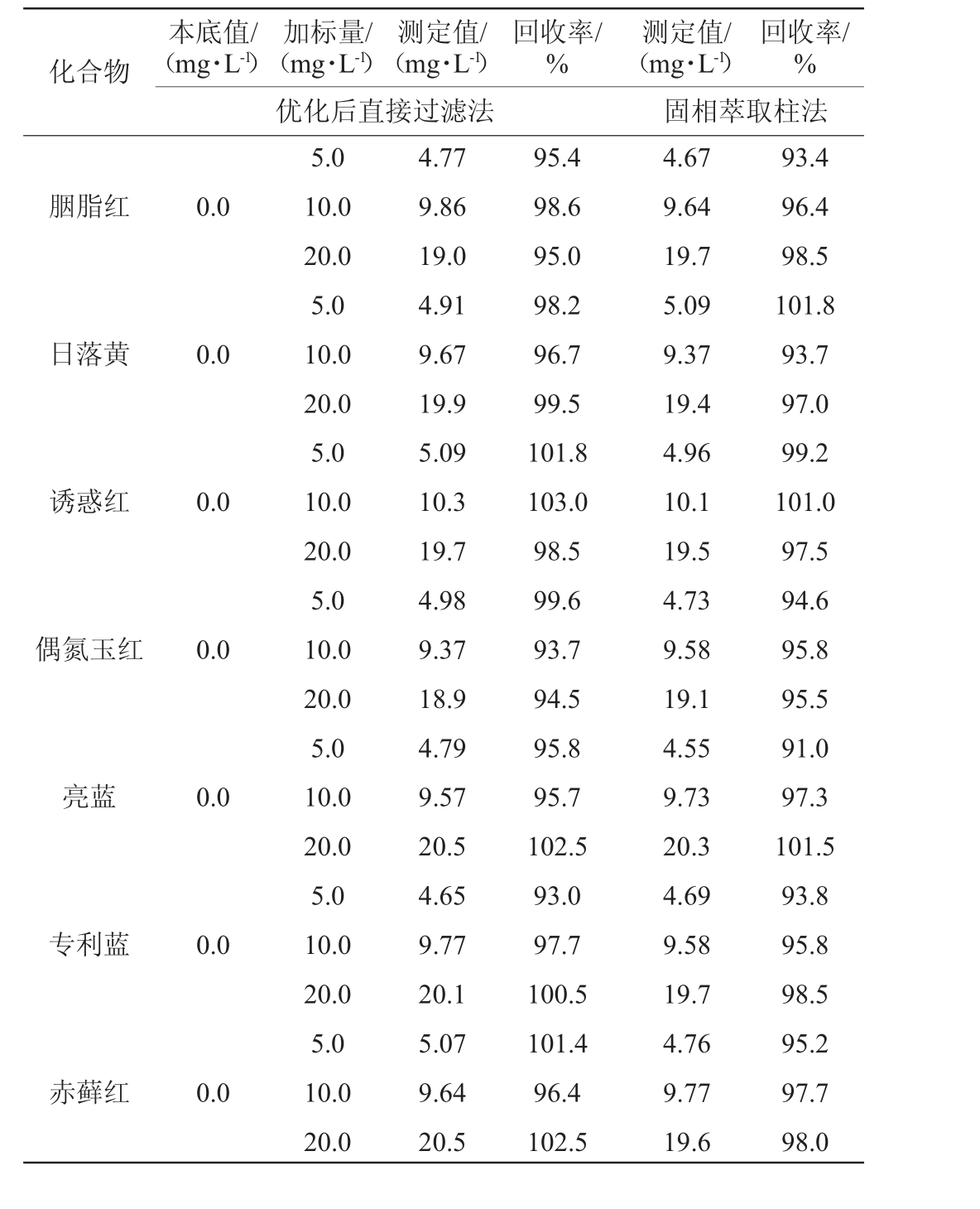
化合物本底值/(mg·L-1)加标量/(mg·L-1)测定值/(mg·L-1)回收率/%回收率/%优化后直接过滤法测定值/(mg·L-1)固相萃取柱法胭脂红0.0日落黄0.0诱惑红0.0偶氮玉红0.0亮蓝0.0专利蓝0.0赤藓红0.0 5.0 10.0 20.0 5.0 10.0 20.0 5.0 10.0 20.0 5.0 10.0 20.0 5.0 10.0 20.0 5.0 10.0 20.0 5.0 10.0 20.0 4.77 9.86 19.0 4.91 9.67 19.9 5.09 10.3 19.7 4.98 9.37 18.9 4.79 9.57 20.5 4.65 9.77 20.1 5.07 9.64 20.5 95.4 98.6 95.0 98.2 96.7 99.5 101.8 103.0 98.5 99.6 93.7 94.5 95.8 95.7 102.5 93.0 97.7 100.5 101.4 96.4 102.5 4.67 9.64 19.7 5.09 9.37 19.4 4.96 10.1 19.5 4.73 9.58 19.1 4.55 9.73 20.3 4.69 9.58 19.7 4.76 9.77 19.6 93.4 96.4 98.5 101.8 93.7 97.0 99.2 101.0 97.5 94.6 95.8 95.5 91.0 97.3 101.5 93.8 95.8 98.5 95.2 97.7 98.0
2.4 方法应用
采用优化后直接过滤法处理样品,以确定的色谱条件进样,在对近200余批次葡萄酒样品的检测中,分别检测到了苋菜红、亮蓝、专利蓝3种人工合成着色剂,含量分别为苋菜红26.5 mg/L、亮蓝1.48 mg/L、专利蓝0.659 mg/L。不符合GB/T 15037—2006《葡萄酒》中不得添加合成着色剂的规定。
3 结论
通过对GB 5009.35不同版本和文献[11]中的检测波长、洗脱梯度、前处理方法的比对优化,采用pH 9.0的乙酸铵缓冲液稀释、高速离心后过滤法处理葡萄酒样品,最大吸收波长检测,缓梯度洗脱,建立了葡萄酒基质中柠檬黄、新红等常用11种合成着色剂的准确定量检测方法。本方法前处理简单、省时,定性定量准确,线性范围宽,相关系数0.999 4以上,加标回收率高(93.0%~103.0%),方法精密度好(1.86%~2.61%),检出限(均为0.05 mg/L)、定量限(均为0.15 mg/L)低(n=6),流动相配比简单。该方法适用于葡萄酒中11种常用合成着色剂的快速、准确定性定量检测。
[1]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 15037—2006 葡萄酒[S].北京:中国标准出版社,2006.
[2]梅迪.武汉RP酒业公司的市场策略研究[D].武汉:华中科技大学,2012.
[3]邵志芳.葡萄酒品质分析方法研究进展[J].中国酿造,2015,34(4):17-20.
[4]王卫国,胡晓伟.葡萄酒中多酚及多酚氧化酶研究现状与展望[J].中国酿造,2017,36(8):16-19.
[5]张晓莉,李晓东,王国庆,等.河西走廊干红葡萄酒游离氨基酸的分析与评价[J].中国酿造,2023,42(7):202-208.
[6]赵青松,甘山亮.中国进口葡萄酒市场的国别分析及发展趋势[J].中国酿造,2020,39(10):216-219.
[7]王华,田雪林,杨晨露,等.葡萄酒与健康[J].中国酿造,2022,41(3):1-5.
[8]赵广河,胡梦琪,陆玺文,等.发酵果酒加工工艺研究进展[J].中国酿造,2022,41(4):27-31.
[9]马雪蕾,罗春凤,王舒伟,等.我国复合果酒研究现状及展望[J].酿酒科技,2018(10):81-84.
[10]宋志雪.复合果酒酿造中的氰化物、甲醇工艺研究及HACCP构建[D].贵阳:贵州大学,2020.
[11]李广,李琪,金丽琼,等.高效液相色谱法同时测定葡萄酒中9种人工合成色素[J].中国酿造,2013,32(11):132-135.
[12]张予林.高效液相色谱法检测葡萄酒中人工色素、防腐剂和甜味剂方法的研究[D].杨凌:西北农林科技大学,2011.
[13]李必斌.食用合成色素检测方法的研究进展[J].中国卫生检验杂志,2002(6):758-739.
[14]林子豪,毛新武,周庆琼,等.液相色谱串联质谱法同时测定调味酱中85种酸性合成色素[J].食品工业科技,2022,43(5):270-279.
[15]BONAN S,FEDRIZZI G,MENOTTA S,et al.Simultaneous determination of synthetic dyes in foodstuffs and beverages by high-performance liquid chromatography coupled with diode-array detector[J].Dyes Pigments,2013,99(1):36-40.
[16]中华人民共和国卫生部.GB/T 5009.35—1996 食品中着色剂的测定方法[S].北京:中国标准出版社,1996.
[17]中华人民共和国卫生部,中国国家标准化管理委员会.GB/T 5009.35—2003 食品中合成着色剂的测定[S].北京:中国标准出版社,2003.
[18]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 27417—2017 合格评定化学分析方法确认和验证指南[S].北京:中国标准出版社,2017.
[19]钮怡清.高效液相色谱法检测辣椒、花椒粉中五种合成色素[J].食品与发酵工业,2021,47(24):256-260.
[20]中华人民共和国国家卫生和计划生育委员会.GB 5009.35—2016 食品安全国家标准食品中合成着色剂的测定[S].北京:中国标准出版社,2016.
[21]中华人民共和国国家卫生健康委员会,国家市场监督管理总局.GB 5009.35—2023 食品安全国家标准食品中合成着色剂的测定[S].北京:中国标准出版社,2023.
[22]吴娜,谭婉清,沈颖仪,等.高效液相色谱法测定明胶胶囊中11种合成色素的方法研究[J].食品工业科技,2020,41(4):195-199.
[23]吴丽容.UPLC法测定食品中多种色素、抗氧化剂、防腐剂和甜味剂[D].厦门:集美大学,2016.
[24]冯文卿.高效液相色谱法测定液体乳中多种合成着色剂的研究[D].哈尔滨:东北农业大学,2018.
[25]林芳,李涛,王一欣,等.固相萃取-超高效液相色谱法同时测定蜜饯中9种合成色素[J].食品安全质量检测学报,2016,7(2):567-574.