猕猴桃(Actinidia chinensis)原产于湖北省宜昌市,现广泛分布于长江及淮河流域,《本草纲目》称其具备“止暴渴,解烦热,压丹石,下石淋”之功效,整株均可入药[1-2],是我国重要的经济作物之一。猕猴桃富含碳水化合物、不溶性膳食纤维、蛋白质、有机酸、维生素等营养成分,其维生素C在人体利用率高达94%[3-4]。现代化食品加工业常以猕猴桃制备果汁、果干、果酒[5]等,涉及工艺简单,多以猕猴桃果肉为原料。但随着消费市场的扩大和资源再生理念的提及,猕猴桃等农产品逐渐向精深加工制品转变,开始出现以富含维生素、膳食纤维、矿物质等的猕猴桃果渣、果皮为原料的加工制品,如猕猴桃益生菌饮料[6]、猕猴桃咀嚼片[7]及猕猴桃酵素[8]等。其中食用酵素是以果蔬为原料,经单一或多种微生物发酵制备而成的功能性食品。
酵素作为目前较为绿色的果蔬残渣处理方式之一,已被证实含有多种生物酶类、有机酸及多酚、黄酮类抗氧化活性物质等,在人体调节肠道菌群、清除自由基等方面具备一定效果。GUBITOSA J等[9]研究表明,经发酵处理的猕猴桃果渣对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)和2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS+)自由基有较高的清除率。此外,决定酵素功能性的重要因素是其原料和发酵菌种的选择,其中菌种的选择和搭配尤为重要。酵素常见发酵菌种有植物乳杆菌、双歧乳杆菌、保加利亚乳杆菌及酿酒酵母等。张海燕等[10]研究发现,复合酵母菌菌株与植物乳杆菌联合发酵可有效提高猕猴桃酵素的超氧化物歧化酶(superoxide dismutase,SOD)活力,其SOD酶活性最高可达2 206.67 U/mL。但目前植物酵素的多菌种联合发酵多倾向于选择酿酒酵母与植物乳杆菌,鲜少将酿酒酵母与植物乳杆菌和发酵乳杆菌联合用于酵素发酵,已有研究表明植物乳杆菌和发酵乳杆菌联合发酵复合果蔬汁饮料也可显著提升其制品对ABTS+·的清除率,且产品风味尚佳[11-12];故本研究以信阳猕猴桃为原料,通过接种酿酒酵母(Saccharomyces cerevisiae)、植物乳杆菌(Lactobacillus plantarum)和保加利亚乳杆菌(Lactobacillus bulgaricus)制备酵素,以乙醇、总酚含量及SOD酶活为主要评价指标,利用单因素试验、Plackett-Burman试验和响应面试验优化猕猴桃酵素混菌发酵工艺,并对比分析优化前后猕猴桃酵素的体外抗氧化活性变化,以期为猕猴桃资源的开发及精深加工利用提供理论基础。
1 材料与方法
1.1 材料与试剂
猕猴桃、白砂糖:市售;植物乳杆菌(Lactobacillus plantarum)JYLP-002:郑州百益宝生物技术有限公司;安琪果酒专用酿酒酵母(Saccharomyces cerevisiae)(RV100)、保加利亚乳杆菌(Lactobacillus bulgaricus):安琪酵母股份有限公司;福林酚:合肥博美生物科技有限责任公司;没食子酸(纯度>98%):天津市科密欧化学试剂有限公司;BC0170超氧化物歧化酶(SOD)活性检测试剂盒:北京索莱宝科技有限公司;DPPH标准品(纯度>98%):上海如吉生物科技发展有限公司;ABTS储备液:上海源叶生物科技有限公司;无水乙醇、水杨酸、碳酸钠、硫酸铁、过氧化氢、醋酸、氯化铁(均为分析纯):天津市大茂化学试剂厂。
1.2 仪器与设备
TDL-40B低速离心机:上海安亭科学仪器厂;CP214分析天平:奥豪斯仪器(上海)有限公司制造;A390紫外可见分光光度计:翱艺仪器(上海)有限公司;SHP生化培养箱:北京中兴伟业世纪仪器有限公司;HW远红外干燥箱:上海跃进医疗器械厂;YH-M3003电子天平:永康市五鑫衡器有限公司;CU-420恒温水浴锅:上海精密仪器仪表有限公司;SJ30榨汁机:浙江绍兴苏泊尔家居用品有限公司。
1.3 试验方法
1.3.1 猕猴桃酵素制备工艺流程与操作要点
猕猴桃→清洗切块→加水打浆→调糖→菌种活化→接种→密封发酵→过滤→成品操作要点:
原料预处理:选取七八分熟的新鲜无伤猕猴桃,清洗切块,按料液比30∶100(g∶mL)加蒸馏水打浆。
调糖:以猕猴桃浆液质量为基准,以11%的添加量添加白砂糖。
菌种活化:称取同等质量酿酒酵母、植物乳杆菌与保加利亚乳杆菌菌粉,加等体积无菌水依次37 ℃水浴活化30 min备用。
接种发酵[13]:分别将活化酿酒酵母菌、植物乳杆菌与保加利亚乳杆菌菌液按体积比3∶1∶1混合配制;以猕猴桃浆液质量为基准,确定混菌液接种量为0.2%,摇匀后以无菌酒精棉球擦拭瓶口,28 ℃密封发酵120 h。
过滤:以四层无菌纱布过滤,即得猕猴桃酵素成品。
1.3.2 单因素试验
制备猕猴桃酵素时,设置基础条件为猕猴桃与蒸馏水料液比30∶100(g∶mL)、白砂糖添加量11%、混菌液接种量0.2%、发酵时间120 h、发酵温度28 ℃,分别考察猕猴桃与蒸馏水的料液比(20∶100、25∶100、30∶100、35∶100、40∶100)(g∶mL)、白砂糖添加量(9%、10%、11%、12%、13%)、菌种接种量(0.05%、0.10%、0.20%、0.30%、0.40%)、发酵时间(72 h、96 h、120 h、144 h、168 h)和发酵温度(26 ℃、27 ℃、28 ℃、29 ℃、30 ℃)改变对猕猴桃酵素的乙醇含量、总酚含量、SOD酶活的影响。
1.3.3 Plackett-Burman试验
在单因素试验基础上,选取料液比(A)、菌种接种量(B)、白砂糖添加量(C)、发酵时间(D)与发酵温度(E)为自变量,分别设计低水平(-1)和高水平(+1)进行Plackett-Burman试验,筛选对猕猴桃酵素SOD酶活影响较大的因素,PB试验设计因素及水平见表1。
表1 Plackett-Burman试验设计因素与水平
Table 1 Factors and levels of Plackett-Burman tests
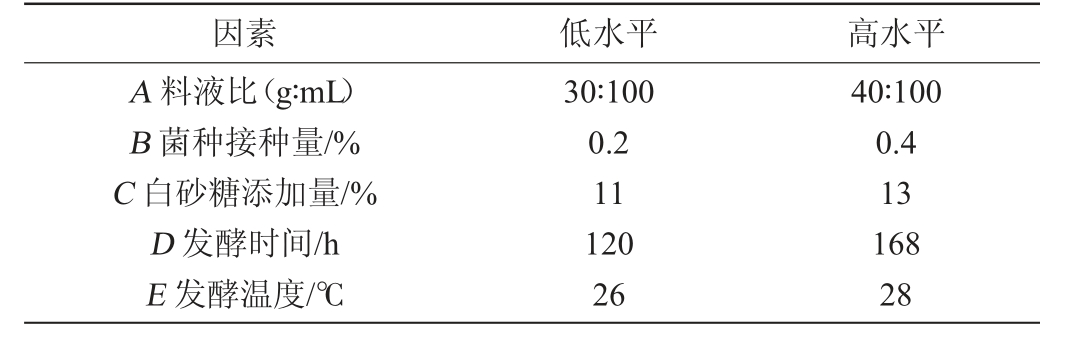
因素 低水平 高水平A 料液比(g∶mL)B 菌种接种量/%C 白砂糖添加量/%D 发酵时间/h E 发酵温度/℃30∶100 0.2 11 120 26 40∶100 0.4 13 168 28
1.3.4 最陡爬坡试验
根据PB试验筛选结果,确定正效应因素料液比(A)选取较高值,确定负效应因素菌种接种量(B)、发酵温度(C)选取较低值,通过最陡爬坡试验逼近最大因素的最佳水平。
1.3.5 响应面试验
以料液比(A)、菌种接种量(B)及发酵温度(E)为评价因素,以SOD酶活为响应值(Y),设计响应面优化试验,具体因素及水平见表2。
表2 猕猴桃酵素发酵工艺优化响应面试验因素与水平
Table 2 Factors and levels of response surface experiments for fermentaiton process optimization of kiwifruit Jiaosu
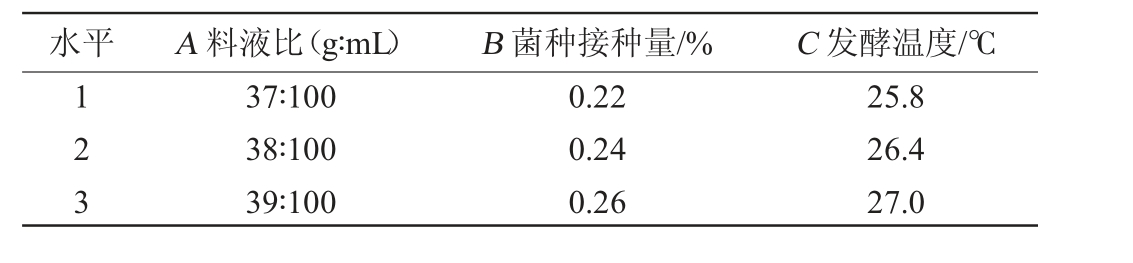
水平 A 料液比(g∶mL) B 菌种接种量/% C 发酵温度/℃123 37∶100 38∶100 39∶100 0.22 0.24 0.26 25.8 26.4 27.0
1.3.6 理化指标测定
乙醇含量参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》中密度瓶法进行测定;总酚含量以福林-酚比色法[15]测定;SOD酶活以SOD试剂盒法测定。
1.3.7 体外抗氧化能力测定
(1)DPPH自由基清除能力
取20 mL发酵完成的猕猴桃酵素于50 mL离心管,3 000 r/min离心10 min,保留上清液,取3 mL上清液参照DADWALV等[16]方法测定样品对DPPH自由基的清除能力。
(2)ABTS+自由基清除能力
参考杜灵敏[17]的方法配制7.4 mmol/L的ABTS+·溶液,而后分别取1 mL于2支试管,一支补加3 mL方法(1)制备的样品离心上清液,一支加3 mL无水乙醇作空白,混匀后常温避光反应10 min,取出在波长734 nm处测定吸光度值,按公式(1)计算猕猴桃酵素对ABTS+·的清除能力。
式中:A为试样对ABTS+·的清除率,%;a1为样品吸光度值;a2为空白组吸光度值。
(3)OH自由基清除能力
采用水杨酸法测定猕猴桃酵素对OH自由基的清除力,取方法(1)制备的样品离心上清液(试验组)和蒸馏水(空白组)各3 mL于2支15 mL容量瓶,各加2 mL 9 mmol/L的FeSO4和2 mL 9 mmol/L的水杨酸-乙醇溶液,摇匀后各加1 mL 8.8 mmol/L的H2O2,以蒸馏水定容,37 ℃水浴15 min取出避光冷却至室温,于波长510 nm处测定吸光度值,按公式(2)计算样品对OH自由基的清除能力。
式中:B为试样对·OH的清除率,%;b0为空白组吸光度值;b1为样品吸光度值。
(4)Fe3+相对还原能力
采用铁离子还原/抗氧化能力法(ferric reducing antioxidant power,FRAP),参考LI X C等[18]的方法计算猕猴桃酵素对Fe3+的相对还原能力,计算公式如下:
式中:C为式样对Fe3+的相对还原能力,%;A为样品在波长595 nm时的吸光度值,Amax为试验中的最大吸光度值;Amin为试验中的最小吸光度值。
1.3.8 数据处理
采用SPSS 25.0进行数据处理;Design Expert 10.0进行Plackett-Burman试验及响应面优化试验;Origin 2019进行图表绘制,每组试验均重复3次,求取平均值。
2 结果与分析
2.1 单因素试验
2.1.1 料液比对猕猴桃酵素品质的影响
料液比对猕猴桃酵素乙醇、总酚含量及SOD酶活的影响见图1。由图1可知,随着料液比的增加,猕猴桃酵素乙醇含量先升后降,总酚含量和SOD酶活均呈上升趋势。料液比增加促使初始发酵液中可被微生物利用的营养物质尤其是可发酵糖含量增加。当料液比增至35∶100(g∶mL),发酵罐内菌体代谢活跃,代谢产物除乙醇外,还存在大量的有机酸类[19],此时对应猕猴桃酵素的乙醇含量最高为0.44 g/100 g;有机酸营造的酸性环境在抑制杂菌生长的同时抑制部分酶类物质活性,导致被植物组织包裹的生物活性物质(如酚类、黄酮类等)无法释放至发酵液中[20]。故当料液比>35∶100(g∶mL)时,猕猴桃酵素的总酚含量及SOD酶活均下降。因此最佳料液比为35∶100(g∶mL)。
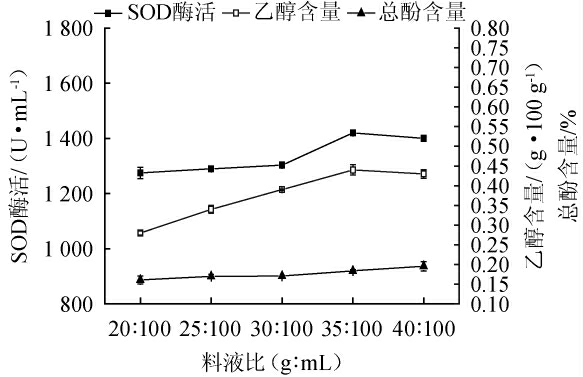
图1 不同料液比对猕猴桃酵素乙醇、总酚含量及超氧化物歧化酶酶活的影响
Fig.1 Effect of different solid to liquid ratio on ethanol, total phenol contents and superoxide dismutase activities of kiwifruit Jiaosu
2.1.2 菌种接种量对猕猴桃酵素品质的影响
菌种接种量对猕猴桃酵素乙醇、总酚含量及SOD酶活的影响见图2。
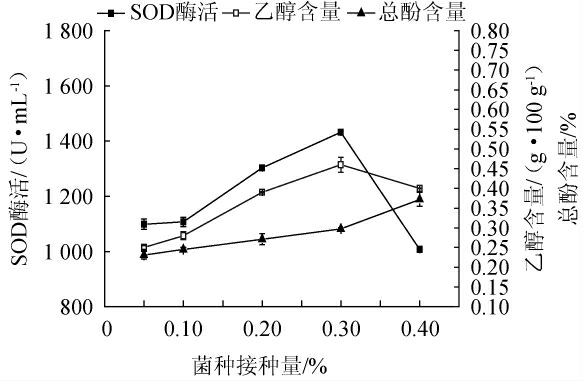
图2 不同菌种接种量对猕猴桃酵素乙醇含量、总酚及超氧化物歧化酶酶活的影响
Fig.2 Effect of different strains inoculum on ethanol, total phenol contents and superoxide dismutase activities of kiwifruit Jiaosu
由图2可知,随着菌种接种量的增加,猕猴桃酵素乙醇含量与SOD酶活均先升后降,总酚含量呈上升趋势;同一发酵周期内,当菌种接种量<0.3%时,发酵原料内可供微生物生长的营养物质充足,故随着菌种接种量的增加,发酵液乙醇含量、总酚含量及SOD酶活均上升。当菌种接种量>0.3%时,酵母菌与乳酸菌间可能存在相互竞争关系,快速生长的乳酸菌通过抑制酵母菌生长和酒精代谢降低猕猴桃酵素的乙醇含量,同时酵母菌生长产生的胞多糖(β-葡聚糖,甘露糖)可进一步促进乳酸菌生长[21],致使发酵后期产SOD酶的乳酸菌(尤其是植物乳杆菌)发酵占据优势,对应发酵液的乙醇含量略微下降,总酚稍有上升,SOD酶活急剧下降,这与梁鑫等[22]研究结论相一致。因此,最佳菌种(酿酒酵母菌、植物乳杆菌与保加利亚乳杆菌3∶1∶1)接种量为0.3%。
2.1.3 白砂糖添加量对猕猴桃酵素品质的影响
白砂糖添加量对猕猴桃酵素乙醇、总酚含量及SOD酶活的影响见图3。由图3可知,随着白砂糖添加量的增加,猕猴桃酵素乙醇含量和SOD酶活上升,总酚含量无明显变化。当白砂糖添加量<12%时,乳酸菌与酵母菌可利用碳水化合物充足[23],发酵液内有机酸和乙醇含量可快速增加;当白砂糖添加量>12%时,因高糖环境而脱水失活的菌体增加,发酵液的乙醇含量增速减缓甚至停滞[24],SOD酶活和总酚含量则无明显改变。JIN X等[25]研究发现,广泛存植物叶绿体及真核细胞的细胞质及线粒体中的SOD可因菌体自溶机制而得以释放。因此,最佳白砂糖添加量为12%。
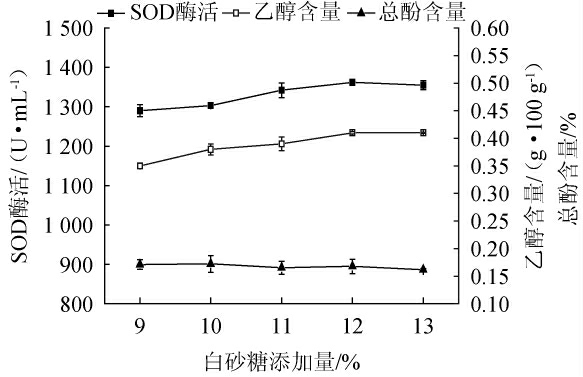
图3 不同白砂糖添加量对猕猴桃酵素乙醇、总酚含量及超氧化物歧化酶酶活的影响
Fig.3 Effect of different sugar addition on ethanol,total phenol contents and superoxide dismutase activities of kiwifruit Jiaosu
2.1.4 发酵时间对猕猴桃酵素品质的影响
发酵时间对猕猴桃酵素乙醇、总酚含量及SOD酶活的影响结果见图4。由图4可知,随着发酵时间的延长,猕猴桃酵素乙醇、总酚含量与SOD酶活均呈先升后降趋势。发酵初期(发酵时间<96 h)由于发酵液内氧气和营养物质(尤其是可发酵糖)储备充足,酵母菌群借有氧呼吸产能而快速生长繁殖,消耗氧气为后续酵母菌酒精发酵和乳酸菌厌氧发酵创造条件[26];发酵中期(发酵时间96~120 h)大多酵母菌和乳酸菌进入无氧呼吸阶段,此时的代谢产物除酒精、乳酸外,还有大量的纤维素酶、脂肪酶和蛋白酶等,这些酶类通过破坏猕猴桃果渣内蛋白质、不溶性膳食纤维等,释放包裹其中的酚类、黄酮类等生物活性物质和SOD酶、过氧化氢酶等[27],致使所得猕猴桃酵素的SOD酶活快速增加;而发酵后期(发酵时间120~168 h)因营养物质的消耗和代谢产物的积累,酵母菌和乳酸菌生长减缓甚至衰亡,猕猴桃酵素乙醇含量、总酚含量下降,同时菌体自溶作用释放的胞内SOD酶[28],SOD酶急剧上升,并在发酵时间144 h达到最高值。因此,最佳发酵时间为144 h。

图4 不同发酵时间对猕猴桃酵素的乙醇、总酚含量及超氧化物歧化酶酶活的影响
Fig.4 Effect of different fermentation time on ethanol, total phenol contents and superoxide dismutase activities of kiwifruit Jiaosu
2.1.5 发酵温度对猕猴桃酵素品质的影响
发酵温度对猕猴桃酵素乙醇、总酚含量及SOD酶活的影响结果见图5。
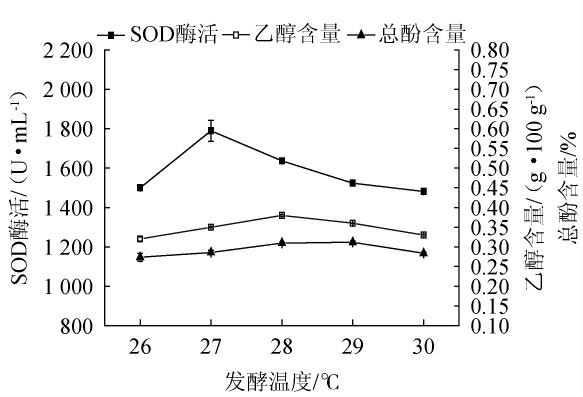
图5 不同发酵温度对猕猴桃酵素乙醇、总酚含量及超氧化物歧化酶酶活的影响
Fig.5 Effect of different fermentation temperature on ethanol, total phenol contents and superoxide dismutase activities of kiwifruit Jiaosu
由图5可知,随着发酵温度的升高,猕猴桃酵素的乙醇、总酚含量及SOD酶活均呈先升后降趋势,当发酵温度升至27 ℃,发酵液内乙醇、总酚含量及SOD酶活均有所上升,其中SOD酶活最高可达1 790 U/mL,对应总酚含量为0.291%,植物发酵饮料内酚类物质是决定其色泽稳定性及饮用舒适度的重要指标[29];随着发酵温度升至28 ℃时,猕猴桃酵素的乙醇含量与总酚含量分别升至0.36 g/100 g、0.315%;此时的酵母菌与乳酸菌代谢较为活跃,对应发酵液内酒精和有机酸等代谢产物快速积累,而SOD酶活因有机酸积累而降至1 637 U/mL;当发酵温度≥29 ℃时,菌体生长代谢放缓,猕猴桃酵素的乙醇含量、总酚含量与SOD酶活缓慢下降。因此,最佳发酵温度为27 ℃。
2.2 Plackett-Burman试验结果
在单因素试验结果的基础上,利用Plackett-Burman试验筛选显著影响猕猴桃酵素SOD酶活的因素,试验设计与结果见表3,显著性分析结果见表4。
表3 Placket-Burman试验设计
Table 3 Design of Placket Burman experiments
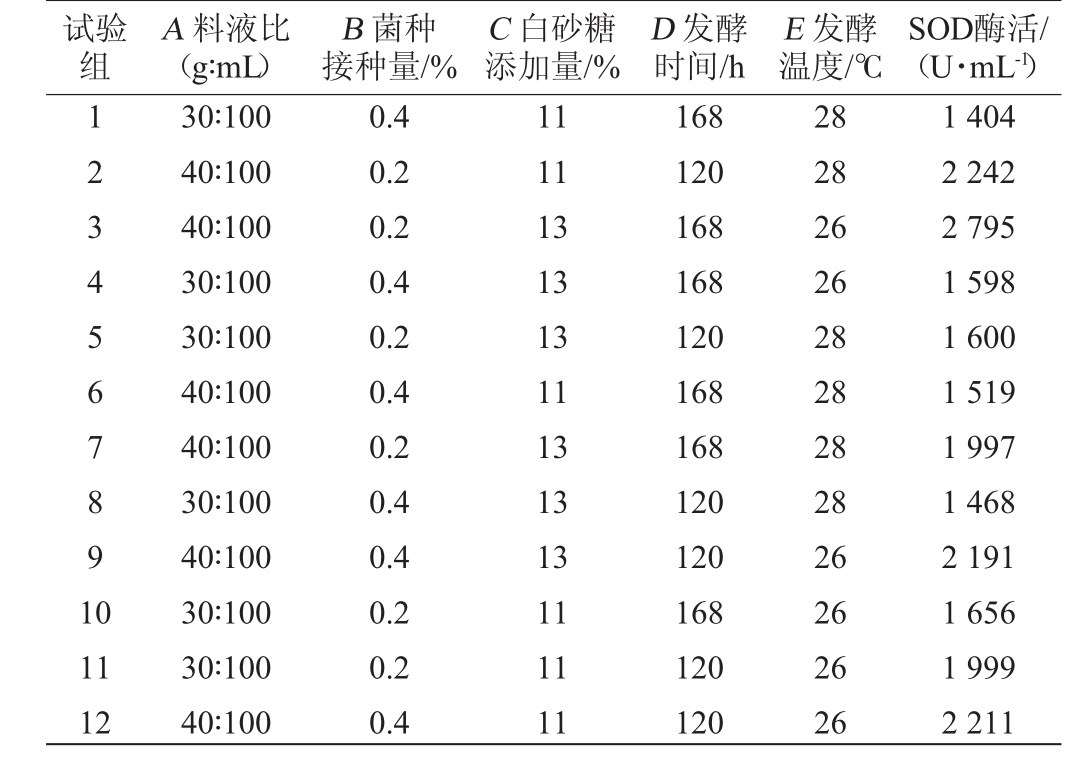
试验组A 料液比(g∶mL)B 菌种接种量/%C 白砂糖添加量/%D 发酵时间/h E 发酵温度/℃SOD酶活/(U·mL-1)1234567891 0 11 12 30∶100 40∶100 40∶100 30∶100 30∶100 40∶100 40∶100 30∶100 40∶100 30∶100 30∶100 40∶100 0.4 0.2 0.2 0.4 0.2 0.4 0.2 0.4 0.4 0.2 0.2 0.4 11 11 13 13 13 11 13 13 13 11 11 11 168 120 168 168 120 168 168 120 120 168 120 120 28 28 26 26 28 28 28 28 26 26 26 26 1 404 2 242 2 795 1 598 1 600 1 519 1 997 1 468 2 191 1 656 1 999 2 211
表4 Plackett-Burman试验显著性分析及效应评价
Table 4 Significance analysis and effect evaluation in Plackett Burman experiments
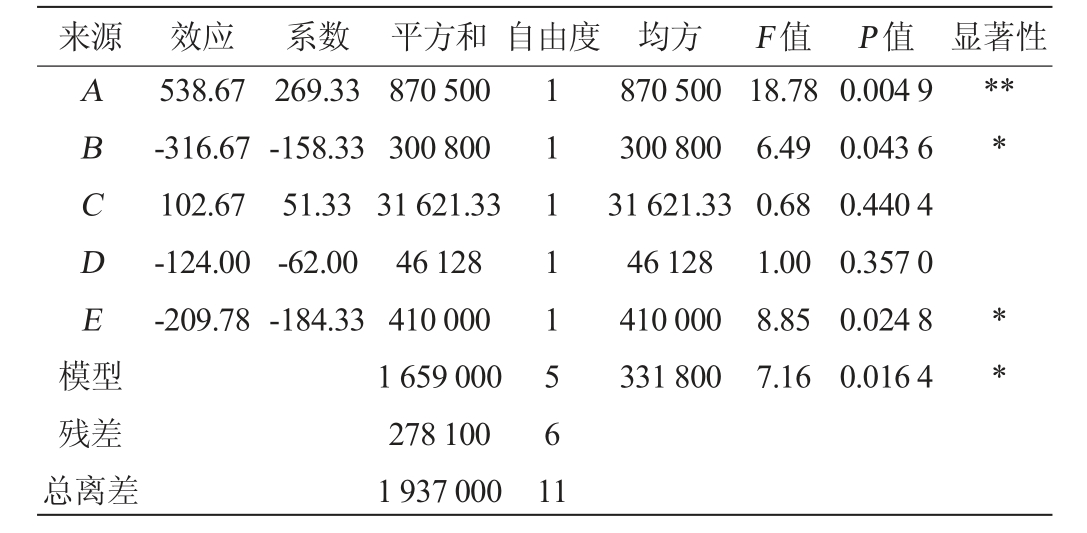
注:“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著
(P<0.01)。下同。
来源 效应 系数 平方和 自由度 均方 F 值 P 值 显著性ABCDE模型538.67-316.67 102.67-124.00-209.78 269.33-158.33 51.33-62.00-184.33 870 500 300 800 31 621.33 46 128 410 000 331 800 18.78 6.49 0.68 1.00 8.85 7.16 0.004 9 0.043 6 0.440 4 0.357 0 0.024 8 0.016 4*****残差总离差870 500 300 800 31 621.33 46 128 410 000 1 659 000 278 100 1 937 000 11111561 1
根据表3得知,各因素间回归方程为:Y=269.33A-158.33B+51.33C-62D-184.33E
由表4可知,构建模型极显著(P<0.01),表示Plackett-Burman试验工艺参数设置合理。菌种接种量(B)、发酵时间(D)与发酵温度(E)为负效应因素,料液比(A)、白砂糖添加量(C)为正效应因素;料液比对试验结果影响极显著(P<0.01),菌种接种量与发酵温度对试验结果影响显著(P<0.05),故选择液料比(A)进行正向爬坡试验,选择菌种接种量(B)、发酵温度(E)进行负向爬坡试验。
2.3 最陡爬坡试验结果
最陡爬坡试验参数设计及结果见表5。由表5可知,当试验组为第4组时,即料液比为38∶100(g∶mL),菌种接种量为0.24%,发酵温度为26.4 ℃时,猕猴桃酵素发酵的SOD酶活最高,为1 804 U/mL。故选择第4试验组的结果作为后续响应面试验的中心点。
表5 最陡爬坡试验设计及结果
Table 5 Design and results of the steepest climbing experiments
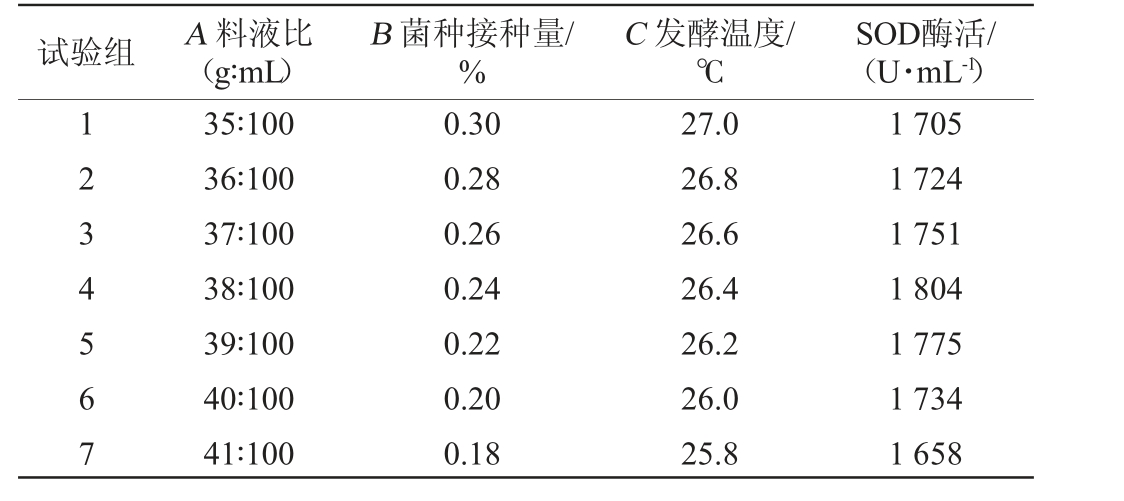
试验组 A 料液比(g∶mL)B 菌种接种量/%C 发酵温度/℃SOD酶活/(U·mL-1)1234567 35∶100 36∶100 37∶100 38∶100 39∶100 40∶100 41∶100 0.30 0.28 0.26 0.24 0.22 0.20 0.18 27.0 26.8 26.6 26.4 26.2 26.0 25.8 1 705 1 724 1 751 1 804 1 775 1 734 1 658
2.4 发酵条件优化响应面试验
2.4.1 模型建立
选取料液比(A)、菌种接种量(B)及发酵温度(C)为考察因素,遵循Box-Behnken设计建立数学模型,具体设计及结果见表6。
表6 猕猴桃酵素发酵工艺优化响应面试验结果与分析
Table 6 Results and analysis of response surface experiments for fermentaiton process optimization of kiwifruit Jiaosu
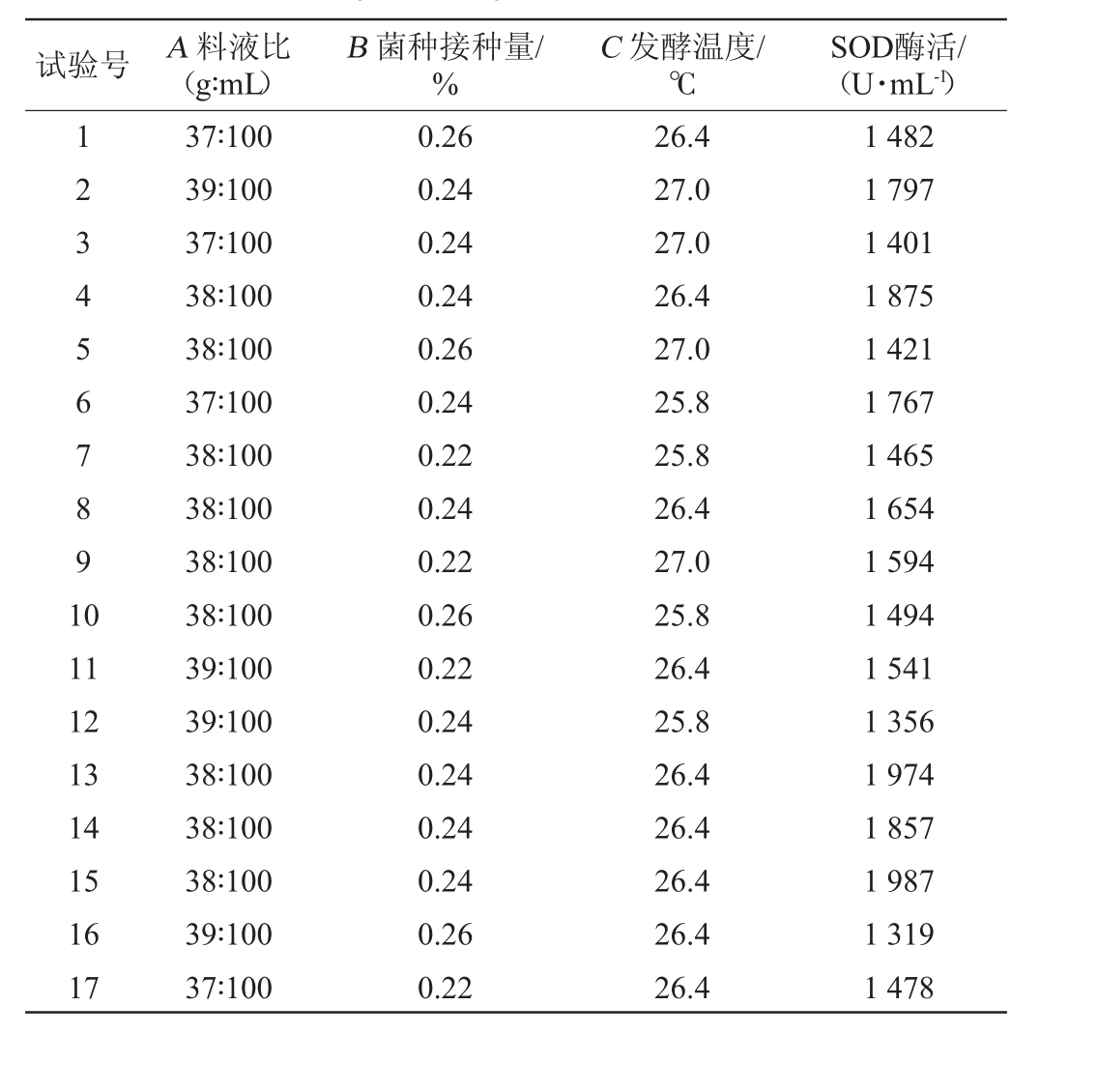
试验号 A 料液比(g∶mL)B 菌种接种量/%C 发酵温度/℃SOD酶活/(U·mL-1)1234567891 0 11 12 13 14 15 16 17 37∶100 39∶100 37∶100 38∶100 38∶100 37∶100 38∶100 38∶100 38∶100 38∶100 39∶100 39∶100 38∶100 38∶100 38∶100 39∶100 37∶100 0.26 0.24 0.24 0.24 0.26 0.24 0.22 0.24 0.22 0.26 0.22 0.24 0.24 0.24 0.24 0.26 0.22 26.4 27.0 27.0 26.4 27.0 25.8 25.8 26.4 27.0 25.8 26.4 25.8 26.4 26.4 26.4 26.4 26.4 1 482 1 797 1 401 1 875 1 421 1 767 1 465 1 654 1 594 1 494 1 541 1 356 1 974 1 857 1 987 1 319 1 478
以SOD酶活为响应指标,对试验数据进行回归拟合,得二次多项式回归模型:
2.4.2 响应面试验方差分析
响应面试验结果方差分析见表7。由表7可知,该模型显著(P<0.01),失拟项不显著(P>0.05),决定系数R2为0.905 1,表明该模型可解释90.51%的试验数据变化趋势,且该模型变异系数(coefficient of variation,CV)为6.32%,响应面模型构建成功,具备良好的统计学意义。此外,模型一次项A、B、C交互项AB、BC及二次项C2对结果影响不显著(P>0.05),二次项B2及交互项AC对结果影响极显著(P<0.01),二次项A2对结果影响显著(P<0.05)。
表7 响应面试验结果方差分析
Table 7 Variance analysis of response surface test results
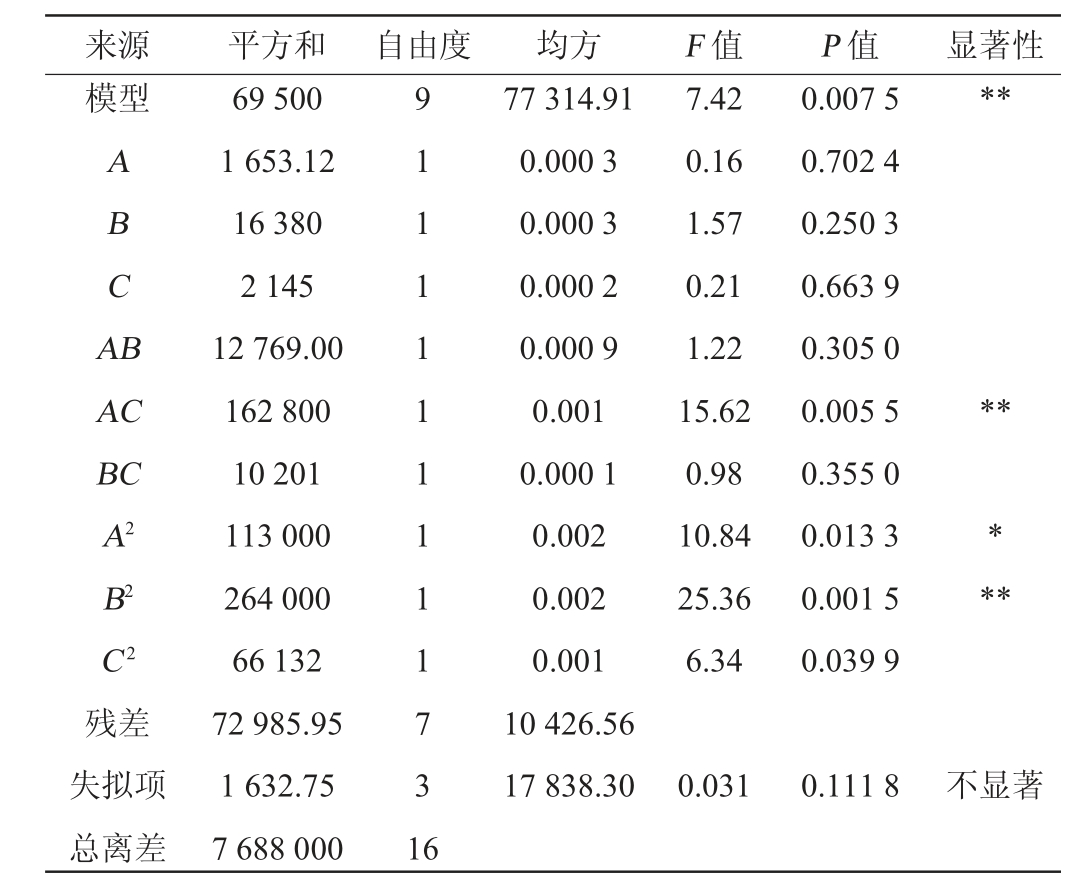
来源 平方和 自由度 均方 F 值 P 值 显著性模型**ABCA B AC BC A2 B2 C2残差失拟项总离差69 500 1 653.12 16 380 2 145 12 769.00 162 800 10 201 113 000 264 000 66 132 72 985.95 1 632.75 7 688 000 9 1 1 1 1 1 1 1 1 1 7 3 1 6 77 314.91 0.000 3 0.000 3 0.000 2 0.000 9 0.001 0.000 1 0.002 0.002 0.001 10 426.56 17 838.30 7.42 0.16 1.57 0.21 1.22 15.62 0.98 10.84 25.36 6.34 0.007 5 0.702 4 0.250 3 0.663 9 0.305 0 0.005 5 0.355 0 0.013 3 0.001 5 0.039 9*****0.031 0.111 8不显著
2.4.3 响应面图和等高线分析
料液比、菌种接种量、发酵温度之间交互作用的响应面结果见图6。由图6(a)可知,在A、B交互作用下,随着料液比的增加及菌种接种量的减少,猕猴桃酵素的SOD酶活呈先升后降趋势,但此时响应面四边较为陡峭,整体呈拱形;当菌种接种量固定为0.24%,对应料液比为38∶100(g∶mL)时,猕猴桃酵素的SOD酶活出现高点;图6(b)反映的是A、C交互作用,随着料液比及发酵温度的延长,猕猴桃酵素的SOD酶活先增后减,响应面最高点出现在料液比为37.5∶100~38.5∶100(g∶mL)之间;图6(c)则是B、C交互产生的响应面,随着菌种接种量的减少及发酵温度的增加,整体成陡峭斜坡状,当菌种接种量0.24%,发酵温度26.4 ℃时,猕猴桃酵素的SOD酶活出现最高值。
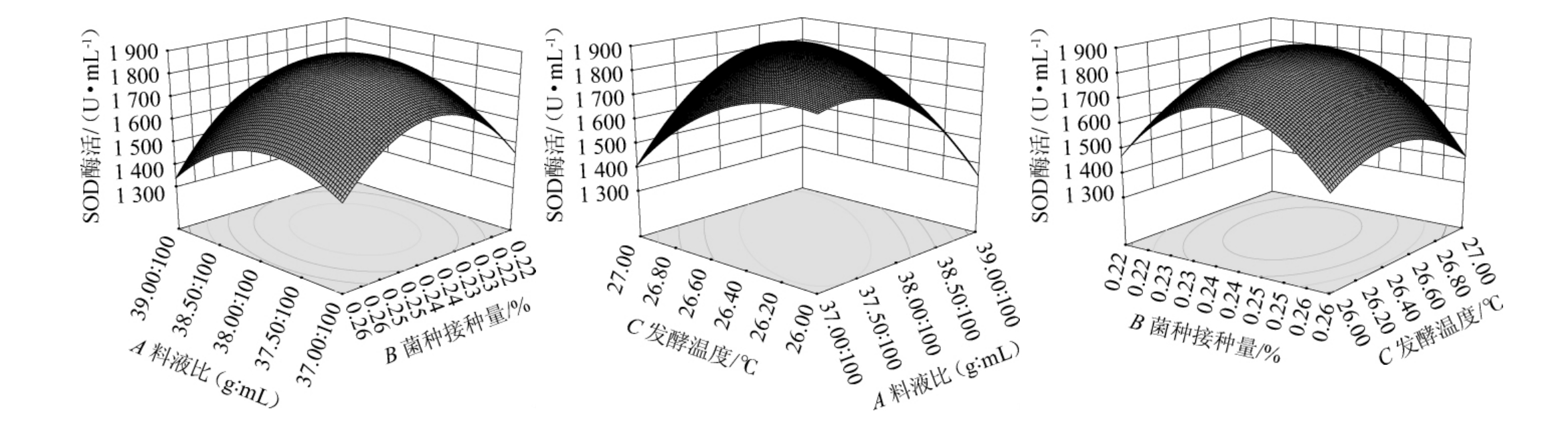
图6 各试验因素交互作用对猕猴桃酵素超氧化物歧化酶酶活影响的响应面及等高线
Fig.6 Response surface plots and contour lines of effect of interaction between various factors on superoxide dismutase activities of kiwifruit Jiaosu
2.4.4 最佳工艺的确定以及试验验证
以猕猴桃酵素的SOD酶活为响应值建立回归模型,获得猕猴桃酵素的最佳发酵条件为料液比38.06∶100(g∶mL),菌种接种量0.24%,发酵温度26.38 ℃。在此优化条件下,猕猴桃酵素SOD酶活预测值1 872.58 U/mL,综合考虑实际可行性,将猕猴桃酵素发酵条件调整为料液比38∶100(g∶mL),菌种接种量0.24%,发酵温度26.4 ℃,在此条件下开展3次平行试验,SOD酶活实际测定值为1 893.30 U/mL,两者间误差值仅为1.10%,故本次响应面模型建立成功且预测数据可靠。
2.5 猕猴桃酵素的抗氧化活性
猕猴桃酵素抗氧化活性测定结果见图7。
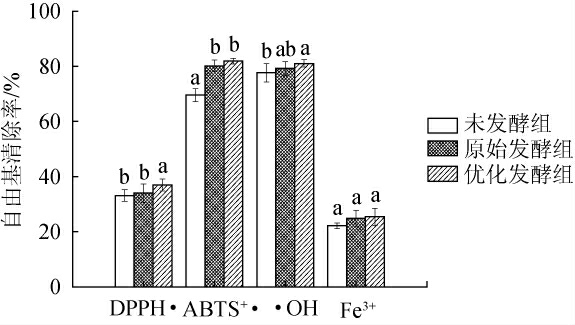
图7 猕猴桃酵素抗氧化活性的测定结果
Fig.7 Determination results of antioxidant activity of kiwifruit Jiaosu
不同字母表示差异显著(P<0.05)。
由图7可知,猕猴桃果浆经酵母菌联合乳酸菌发酵后,其抗氧活性有明显改善,相较于空白对照(未发酵猕猴桃果浆)(对DPPH·清除率为33.14%;ABTS+·清除率为69.54%;·OH清除率为77.69%;Fe3+相对还原能力为22.18%),原始发酵组和优化组对DPPH·清除率分别提升了0.74%、8.93%,对ABTS+·清除率分别提升了13.04%、16.70%,对·OH清除率分别增加了1.86%、4.83%,对Fe3+相对还原能力提升了9.70%、12.93%;相较于原始发酵组,优化发酵组的猕猴桃酵素对DPPH·、ABTS+·、·OH及Fe3+清除率分别提升了7.98%、2.50%、2.41%及3.58%。表明发酵处理可显著提升猕猴桃酵素的抗氧化活性(P<0.05)。
3 结论
该研究以猕猴桃为原料,接种酿酒酵母、植物乳杆菌及保加利亚乳杆菌(3∶1∶1)联合发酵制备猕猴桃酵素,通过改变其发酵工艺条件,探究发酵过程中猕猴桃酵素乙醇、总酚含量及SOD酶活变化趋势,并以猕猴桃酵素的SOD酶活为评价指标开展响应面优化试验,确定猕猴桃酵素最佳工艺为料液比38∶100(g∶mL)、菌种接种量0.24%、白砂糖添加量12%,发酵时间144 h,发酵温度26.4 ℃;该工艺条件下制备的猕猴桃酵素SOD酶活为1 893.30 U/mL,对DPPH·、ABTS+·、·OH清除率及Fe3+相对还原能力分别为37.2%、80.13%、79.01%及24.65%。该研究发现猕猴桃酵素生产工艺与其所含的生物活性成分含量及酶类物质活性存在密切关系,通过改善酵素生产工艺,可能会进一步提升酵素的附加价值。
[1]张翼钊,王宝刚,李文生,等.温度波动对贮藏猕猴桃品质劣变的影响[J].食品研究与开发,2023,44(19):43-48,103.
[2]ABEDI G E,ESHKVARIAN M K,SHIRI M A,et al.The effect of summer pruning time and severity on antioxidant capacity and storage quality of Hayward kiwifruit[J].J Berry Res,2023,23(3):175-193.
[3]朱克永,隋明.猕猴桃加工工艺及开发利用趋势[J].食品研究与开发,2018,39(22):220-224.
[4]SATPAL D, KAUR J, BHADARIYA V, et al. Actinidia deliciosa (kiwi fruit): A comprehensive review on the nutritional composition, health benefits, traditional utilization, and commercialization[J].J Food Proc Preserv,2021,45(6):15588.
[5]周清丽,周绍琴,周艳.自然发酵猕猴桃果酒中降苹果酸酵母的筛选与鉴定[J].中国酿造,2023,42(12):76-80.
[6]张丽萍,刘瑞玲,孟祥红,等.益生菌发酵猕猴桃果渣饮料及其营养品质与风味分析[J].食品工业科技,2022,43(20):252-262.
[7]冀冰.高膳猕猴桃咀嚼片的研制及其通便功能的研究[D].杨凌:西北农林科技大学,2021.
[8]蔡丽琴.猕猴桃酵素发酵过程中代谢产物变化规律研究[D].杭州:浙江工商大学,2023.
[9]GUBITOSA J,RIZZI V,MAGGI F,et al.From kiwi peels"end-of-life"to gold nanoparticles:the upcycling of a waste[J].Bio Nano Science,2023,13(4):1703-1725.
[10]张海燕,康三江,曾朝珍,等.响应面法优化沙棘酵素多菌种发酵工艺[J].中国酿造,2023,42(10):207-213.
[11]黄杰,韦璐,郑博强,等.香蕉胡萝卜复合果蔬汁的发酵工艺优化及抗氧化活性研究[J].中国酿造,2021,40(6):129-134.
[12]李金辉,翁贵英,朱淼,等.微波辅助提取猕猴桃果渣总黄酮及其抗氧化活性[J].食品研究与开发,2022,43(12):79-85.
[13]杨彬彦,党娅,黎坤怡.蓝莓酵素复合菌种发酵工艺优化及品质分析[J].中国酿造,2023,42(12):165-169.
[14]谢聪,古勉辉,钱晓兵,等.莲雾酵素的发酵工艺研究及其质量评价[J].食品安全导刊,2023(36):131-133,138.
[15]余祥英,郑佳楠,陈晓纯,等.不同干燥方式对陈皮中7种黄酮含量及抗氧化性的影响[J].食品安全质量检测学报,2022,13(7):2075-2083.
[16]DADWAL V,BHATT S,JOSHI R, et al.Development and characterization of controlled released polyphenol rich micro-encapsulate of Murraya koenigii bark extract[J].J Food Proc Preserv,2020,44(5): 214-338.
[17]杜灵敏.欧李果实花色苷提取、抑菌及抗氧化研究[D].晋中:山西农业大学,2022.
[18]LI X C,XIE Y L,XIE H,et al.π-π conjugation enhances oligostilbene's antioxidant capacity: evidence from α-viniferin and caraphenol A[J].Molecules,2018,23:694.
[19]MARGARETH D S R,NATIVIDAD S,ALEGRIA M,et al.Strawberry(Fragaria×ananassa)and kiwifruit (Actinidia deliciosa)extracts as potential radioprotective agents: relation to their phytochemical composition and antioxidant capacity[J].Appl Sci,2023,13(15):8996.
[20]VAIA S T,MICHAIL M,GEORGIA T,et al.Physiological and metabolic traits linked to kiwifruit quality[J].Horticulturae,2023,9(8):915.
[21]JOHNSON N A N,EKUMAH J N,MA Y,et al,Optimization of fermentation parameters for the production of a novel selenium enriched mulberry (Morus nigra) wine[J].LWT-Food Sci Technol, 2023, 178(1):114608.
[22]梁鑫,陈思雨,赵育,等.乳酸菌和酵母菌发酵红枣汁工艺优化及成分分析[J].食品与发酵工业,2021,47(7):175-182.
[23]刘毓锋,曾嘉锐,黄文琪,等.外源碳源对葡萄酵素微生物生长代谢及生物活性的调节作用[J].食品工业科技,2020,41(8):104-110,116.
[24]SHU Y L,YING N,YANG D,et al.Effects of pure and mixed koji cultures with Saccharomyces cerevisiae on apple homogenate cider fermentation[J].J Food Proc Preserv,2023,39(6):2421-2430.
[25]JIN X,LIU Z,WU W F,et al.POD,CAT and SOD enzyme activity of corn kernels as affected by low plasma pretreatment[J].Int J Food Prop,2023,23(1):28-48.
[26]VIKRANT K,JAIVIR S,SINGH B R,et al.Effect of physico-chemical characteristics of developed mixed fruits wine during fermentation process[J].J Exp Agr Int,2021,43(6):53-60.
[27]GSCHAEDLER A,INIGUEZ M L E,FLORES F N Y,et al.Use of non-Saccharomyces yeasts in cider fermentation:importance of the nutrients addition to obtain an efficient fermentation[J].Int J Food Microbiol,2021,347(2):109169.
[28]佟恩杰,李小燕,赵凯,等.酿酒酵母对无醇啤酒酿造特性及风味的影响[J].中国酿造,2023,42(10):32-38.
[29]费永涛,黄一鹤,屈春云,等.覆盆子乳酸菌饮料发酵工艺优化及挥发性风味物质分析[J].中国酿造,2023,42(7):214-220.