芽孢杆菌属(Bacillus sp.)是一类广泛存在于自然环境及生物体的细菌,在其非核糖体肽合成酶系(non-ribosomal peptide synthetases)作用下可合成脂肽类抗菌活性物质[1-2]。目前已发现90多种脂肽类抗菌活性物质,表面活性素(surfactin)、伊枯草菌素(iturin)、芬原素(fengycin)、杆菌霉素(bacillomycin)、多粘菌素(polymyxins)等是研究得最多的脂肽[3]。其中,伊枯草菌素具有广谱的抗真菌活性,芬原素对丝状真菌具有强烈抑制作用,而表面活性素则表现出细菌拮抗活性[4-5]。芽孢杆菌脂肽因其优异的广谱抗菌活性、低毒性和低耐药性风险而广受关注,在农业、食品和医药领域展示巨大应用潜力。近年来,芽孢杆菌脂肽已在食品防腐及果蔬采后贮藏保鲜中得到一定应用[6-7],如表面活性素用于即食米饭和面包的防腐,伊枯草菌素用于水产品的保鲜,芬原素用于采后水果的贮藏。
在芽孢杆菌属中,解淀粉芽孢杆菌(B.amyloliquefaciens)是研究深入程度仅次于枯草芽孢杆菌(B.subtilis)的脂肽产生菌[8-9]。多项基因组学研究表明,解淀粉芽孢杆菌含有编码伊枯草菌素、芬原素、表面活性素等多种脂肽物质的基因簇[10-12]。解淀粉芽孢杆菌是公认的安全级(generally recognized as safe,GRAS)菌株,其在采后水果保鲜中的应用备受认可。CHEN K等[13]从柑橘根际土壤中分离到一株解淀粉芽孢杆菌菌株DH-4,该菌株对柑橘病原菌指状青霉(Penicillium digitatum)表现出良好的抑菌活性;CALVO H等[14]报道了从桃子果皮表面分离的解淀粉芽孢杆菌BUZ-14,该菌株能有效减缓多种果实的采后腐烂现象;HAO W N等[15]从柑橘果实表面分离的解淀粉芽孢杆菌菌株HF-01,该菌株可有效降低柑橘果实贮藏过程中绿霉菌、蓝霉菌和酸腐病等病害的发生率。
目前已报道的大多数解淀粉芽孢杆菌分离自陆生环境,与陆生微生物相比,海洋微生物因其生长环境特殊而具备产独特结构与功能活性物质的潜力[16]。课题组先期从广东省湛江市北部湾海域海底淤泥样品中分离筛选到的一株脂肽产生菌解淀粉芽孢杆菌HY2-1,该菌所产的脂肽类物质主要包括芬原素A(C14-C19)和表面活性素(C14和C15)同系物[17],所产活性物质对指状青霉(P.digitatum)和意大利青霉(P.italicum)等主要的柑橘采后病原菌具有显著抑制作用,具有良好的水果采后贮藏保鲜应用潜力。脂肽类抗菌活性物质系典型的芽孢杆菌代谢次级产物,其产量受菌株特性和发酵条件影响[18]。
基于此,该研究采用单因素和响应面试验设计对解淀粉芽孢杆菌HY2-1产脂肽类物质的发酵培养基碳氮源及发酵条件进行了优化,以期为该菌株发酵高产脂肽类物质的应用提供研究基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
解淀粉芽孢杆菌(Bacillus amyloliquefaciens)HY2-1:课题组从广东省湛江市北部湾海域海底淤泥中分离筛选所得(菌种保藏号:CCTCC NO:M 20211637);指状青霉(Penicillium digitatum):由江西农业大学应用微生物研究所惠赠。
1.1.2 化学试剂
葡萄糖、蔗糖(均为分析纯):上海麦克林生化科技有限公司;浓硫酸、苯酚(均为分析纯):国药集团化学试剂有限公司;可溶性淀粉、无水乙醇(均为分析纯):西陇科学股份有限公司;酵母浸粉(生化试剂):Oxoid有限公司;牛肉膏(生化试剂)、蛋白胨(生化试剂):北京奥博星生物技术有限公司。
1.1.3 培养基
种子培养基:蛋白胨10 g,酵母浸粉5 g,MgCl2 2.0 g,MgSO4 4.0 g,KCl 1 g,CaCl2 1 g,NaCl 5 g,蒸馏水1 L,pH 7.0,121 ℃高压蒸汽灭菌20 min。
初始发酵培养基:葡萄糖30 g,蔗糖30 g,蛋白胨20 g,硫酸铵1.0 g,磷酸二氢钾1 g,硫酸镁1 g,硫酸锰0.01 g,硫酸锌0.01 g,蒸馏水1 L,pH 7.60,121 ℃高压蒸汽灭菌20 min。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g、葡萄糖20 g、琼脂20 g、蒸馏水1 L,pH自然,121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
SW-CJ-2D型双人单面净化工作台:苏州净化设备有限公司;3K15型SIGMA医用离心机:曦瑪离心机(扬州)有限公司;ZWYR-2102型恒温培养振荡器:上海智城分析仪器制造有限公司;HANNA-2210型酸度计:北京信立方科技发展股份有限公司;BPMJ-150F型霉菌培养箱:上海一恒科学仪器有限公司;YXQ-100A立式压力蒸汽灭菌锅:上海博迅医疗生物仪器股份有限公司。
1.3 方法
1.3.1 脂肽类物质的发酵制备
将200 μL冷冻保藏的菌株HY2-1(30%甘油,V/V)接种至装液量为40 mL/250 mL三角瓶的种子培养基中,30 ℃、160 r/min摇床活化培养24 h,获得种子液。吸取1.25%的种子液转接至装液量为40 mL/250 mL三角瓶的发酵培养基中,30 ℃、200 r/min条件下培养48 h,所得发酵液5 000 r/min、4 ℃下离心20 min,发酵上清液经滤头过滤(0.22 μm),制备获得无菌发酵上清液(cell-free supernatant,CFS),用于测定菌株HY 2-1发酵所产脂肽类物质的抗菌活性。
1.3.2 菌体量的测定
将取样发酵液充分摇匀,于波长600 nm下测定其光密度值(OD600nm),重复3次取平均值。
1.3.3 脂肽抑菌活性的测定
以指状青霉为指示菌,利用牛津杯法测定菌株HY 2-1所产脂肽的抑真菌活性[19],以菌株HY2-1发酵上清液对指状青霉的抑菌圈直径为评价指标,并根据抑菌圈直径大小判断菌株HY2-1脂肽的抑菌活性[20]。
1.3.4 发酵培养基碳氮源的优化
为探究菌株HY2-1利用单糖、双糖、多糖及复合碳氮源的能力,以指状青霉为指示菌,根据菌株HY2-1发酵上清液(CFS)的抑菌圈直径大小判断其脂肽抑菌活性[21-23]。
(1)碳源种类及添加量对HY2-1脂肽抑菌活性的影响
在初始发酵培养基的基础上,分别选用5%的葡萄糖、可溶性淀粉、蔗糖、葡萄糖+蔗糖(1∶1)、葡萄糖+可溶性淀粉(1∶1)为碳源,其他组分不变。发酵培养48 h后,测定菌体OD600 nm值和CFS抑菌圈直径,以确定发酵培养基的最佳碳源。选用最佳碳源,质量浓度分别设置为20g/L、40g/L、60g/L、80 g/L、100 g/L,测定不同碳源添加量下的菌体OD600nm值和CFS抑菌圈直径,确定发酵培养基的最佳碳源用量。
(2)氮源种类及添加量对HY2-1脂肽抑菌活性的影响
在最佳碳源种类及其添加量下,分别选用2%的牛肉膏、酵母浸粉、蛋白胨、酵母浸粉+蛋白胨(1∶1)、牛肉膏+蛋白胨(1∶1)、牛肉膏+酵母浸粉(1∶1)作为氮源,其他组分不变。发酵培养48 h后测定菌体OD600 nm值和抑菌圈直径,以确定发酵培养基的最佳氮源。选用最佳氮源,设置质量浓度分别为5 g/L、10 g/L、20 g/L、30 g/L、40 g/L和50 g/L,测定不同氮源添加量下的菌体OD600 nm值和CFS抑菌圈直径,确定发酵培养基的最佳氮源用量。
1.3.5 发酵条件优化
(1)发酵条件优化单因素试验
通过设置不同的摇床转速、发酵时间、发酵培养基装液量及接种量优化菌株HY2-1发酵条件,以提高菌株脂肽抑菌活性[24-26]。设置基础发酵条件为取菌株HY2-1的种子液摇匀,吸取1.25%接入培养基装量为40 mL/250 mL三角瓶中,发酵温度为30 ℃、转速为200 r/min条件下振荡培养48 h。分别改变单一变量,考察不同摇床转速(160 r/min、180 r/min、200 r/min、220 r/min)、发酵时间(0 h、12 h、24 h、36 h、48 h、72 h)、装液量(20 mL/250 mL、30 mL/250 mL、40mL/250mL、50mL/250mL、60mL/250mL、80mL/250mL)、接种量(0.5%、1%、2%、4%、8%)对菌体OD600 nm值和抑菌圈直径的影响。试验重复三次取平均值。
(2)发酵条件优化响应面试验
根据发酵条件单因素试验结果,以指状青霉为指示菌,CFS抑菌圈直径为响应值,选取装液量(A)、发酵时间(B)、接种量(C)为评价因素,进行3因素3水平的Box-Behnken响应面试验设计,响应面试验因素及水平见表1。
表1 发酵条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for fermentation conditions optimization
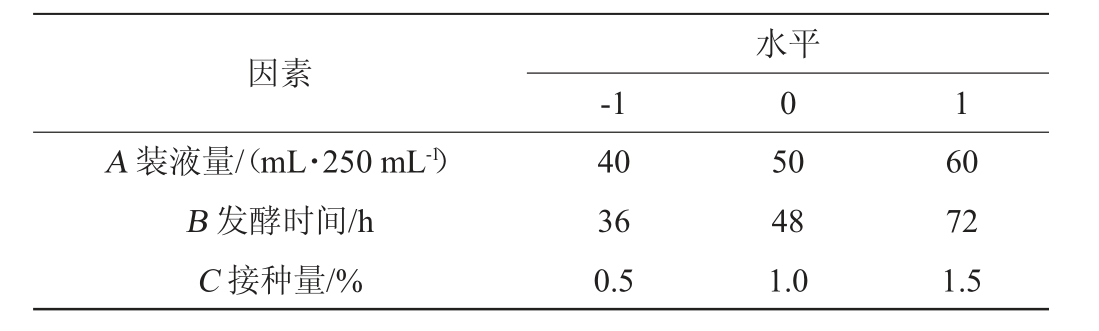
因素A 装液量/(mL·250 mL-1)B 发酵时间/h C 接种量/%-1水平0 1 40 36 0.5 50 48 1.0 60 72 1.5
1.3.6 数据分析
采用Origin 2021、Design Expert 13.0、Excel 2010等软件对试验数据进行分析处理及作图。
2 结果与分析
2.1 发酵培养基碳氮源种类及添加量的单因素试验优化
2.1.1 碳源种类及添加量对菌株HY2-1产抑菌活性物质的影响
由图1(a)可知,在测试的5种碳源组合中,可溶性淀粉作为碳源时所产脂肽物质抑菌圈直径达到了(16.7±1.5)mm,显著高于其他碳源(P<0.05),菌体生物量(OD600 nm值)也显著高于葡萄糖和蔗糖(1∶1)、葡萄糖的试验组(P<0.05),说明菌株HY2-1利用多糖的能力优于双糖、单糖,周靖怡[23]同样发现以可溶性淀粉作为碳源时能显著提高脂肽类物质的产量。因此,选择可溶性淀粉作为菌株HY2-1的碳源,不仅有利于菌株生长和抑菌物质合成且成本相对低廉。
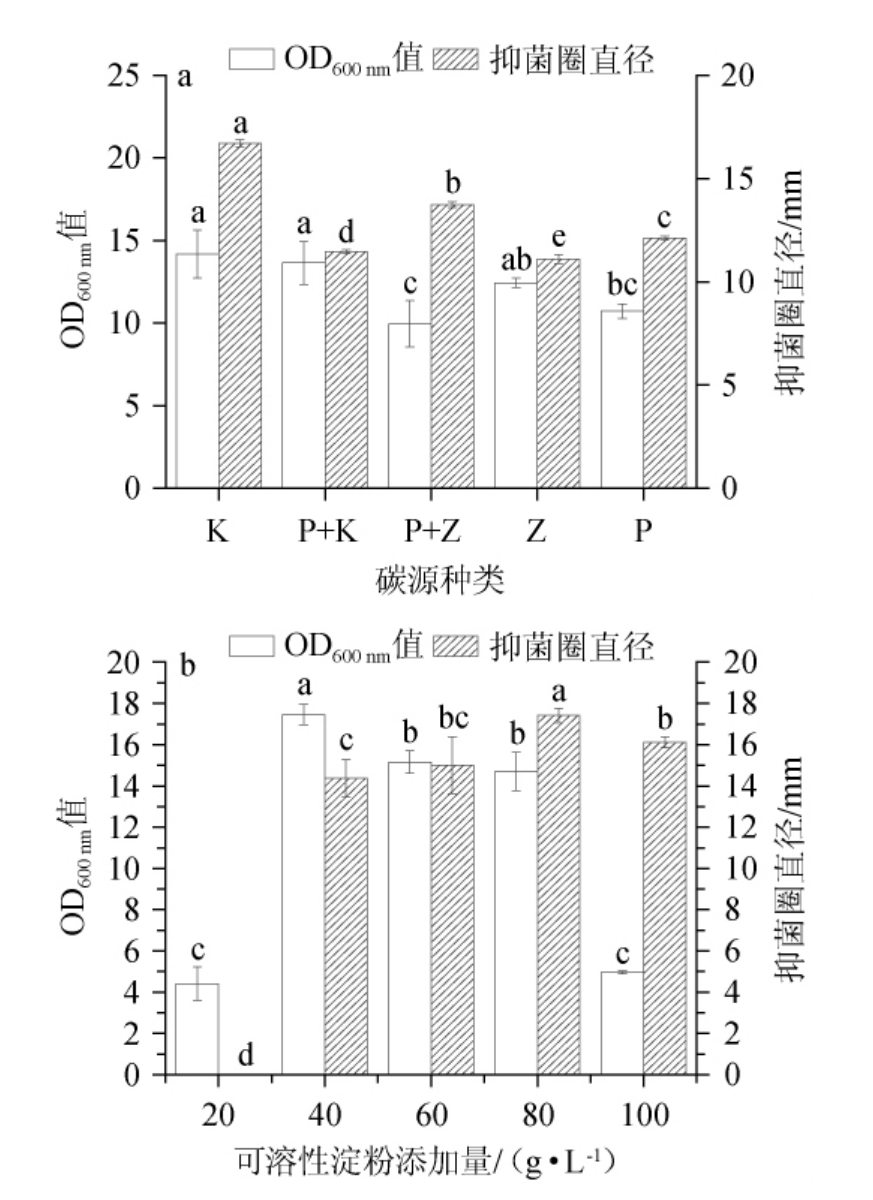
图1 碳源种类及添加量对HY2-1脂肽抑菌活性的影响
Fig.1 Effect of carbon source types and addition on the bacteriostatic activity of HY2-1 lipopeptides
图中小写字母不同表示差异显著(P<0.05);K、K+P、P+Z、Z、P代表可溶性淀粉、可溶性淀粉+葡萄糖(1∶1)、葡萄糖+蔗糖(1∶1)、蔗糖、葡萄糖。
由图1(b)可知,发酵液抑菌活性随可溶性淀粉用量增加而明显增强,与MOHANRASU K等[27]的研究结果一致,推测原因是芽孢杆菌发酵产脂肽类物质需要足够的碳源,较低碳源浓度不利于菌株进行必要代谢活动。可溶性淀粉添加量为80 g/L时,发酵液抑菌圈直径达到(17.4±0.4)mm,显著高于其他处理(P<0.05)。因此,从菌株HY2-1脂肽抑菌活性角度而言,选择最佳可溶性淀粉添加量为80 g/L。
2.1.2 氮源种类及添加量对HY2-1产抑菌活性物质的影响
由图2(a)可知,以酵母浸粉为单一氮源时,菌体量明显高于其他氮源处理,而且含有酵母浸粉的氮源组合(JD、JN)其菌体量显著高于不含酵母浸粉的氮源处理(P<0.05)。这说明酵母浸粉更有利于HY2-1菌株的生长,推测原因是酵母浸粉可以为菌株HY2-1的生长额外提供维生素、核酸、脂质等成分。以酵母浸粉和蛋白胨(1∶1)组合为氮源时,菌株HY2-1发酵上清液的抑菌圈直径为(19.9±0.4)mm,显著高于其他氮源处理(P<0.05),说明菌株HY2-1利用复合氮源的能力优于单一氮源。因此菌株HY2-1发酵培养基的氮源选用酵母浸粉和蛋白胨(1∶1)的组合。
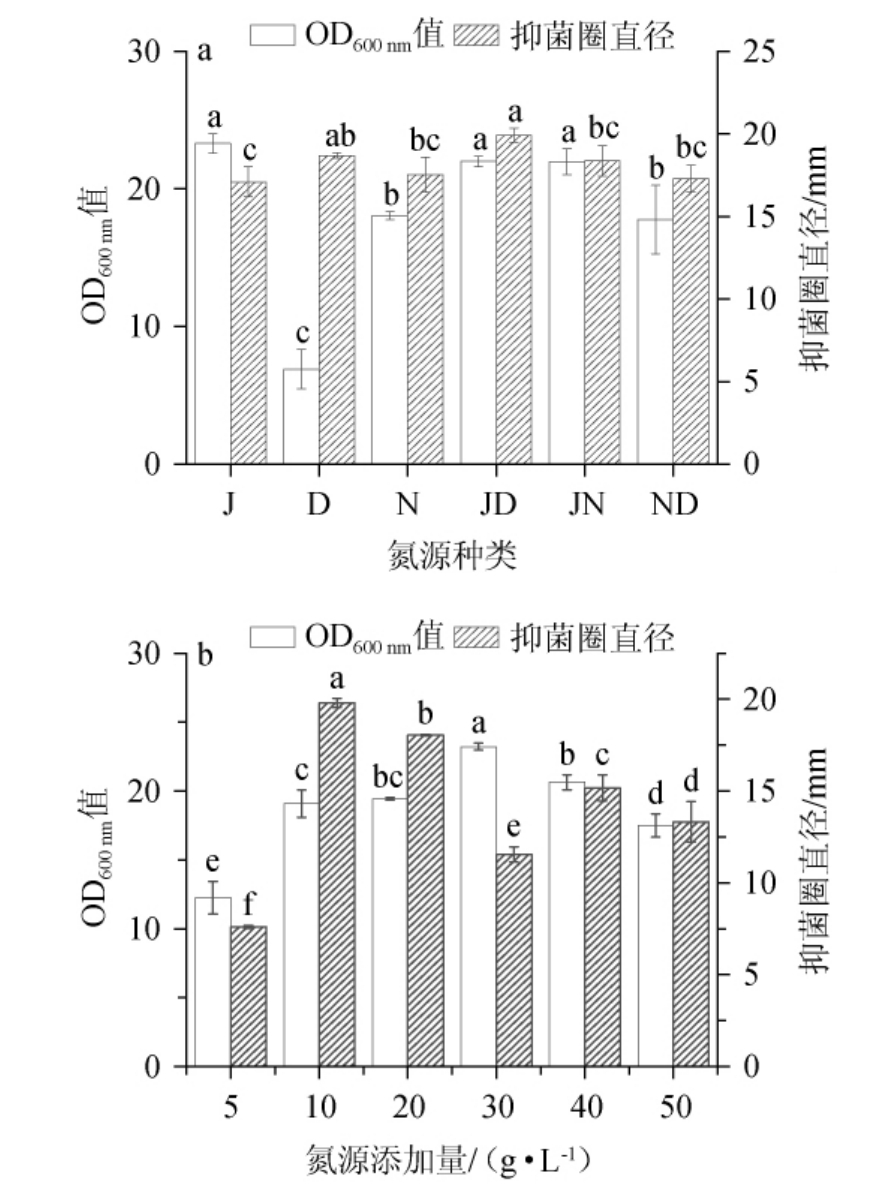
图2 氮源种类及添加量对HY2-1脂肽抑菌活性的影响
Fig.2 Effect of nitrogen source types and addition on the bacteriostatic activity of HY2-1 lipopeptides
小写字母不同表示差异显著(P<0.05);J、D、N、JD、JN、ND分别
代表酵母浸粉、蛋白胨、牛肉膏、酵母浸粉和蛋白胨(1∶1)、
酵母浸粉和牛肉膏(1∶1)、牛肉膏和蛋白胨(1∶1)。
由图2(b)所示,随着氮源添加量的增加,菌株HY2-1菌体量和脂肽抑菌活性呈现先上升后下降的趋势,以酵母浸粉和蛋白胨(1∶1)添加量为10 g/L时,发酵上清液的抑菌活性最强,其抑菌圈直径达到了(19.8±0.3)mm,可能原因是,氮源浓度过高,不利于细胞的生长,从而不利于菌株抑菌活性物质的合成,而氮源不足,菌体繁殖速度太慢,影响抑菌活性物质的合成。因此,从菌株HY2-1脂肽抑菌活性角度而言,选择最佳氮源添加量为10 g/L。
2.2 发酵条件优化单因素试验
不同发酵条件对菌体量和脂肽抑菌活性的影响见图3。由图3(a)可知,菌株HY2-1在160~200 r/min转速下发酵时,其菌体量没有显著性变化(P>0.05),随着转速的不断增加,抑菌活性逐渐增强,当转速为200 r/min时,抑菌圈直径达到最大值(18.9±0.8)mm,继续加大转速,抑菌活性显著下降(P<0.05),可能原因是转速过高导致菌体细胞壁破裂[28],从而影响了菌株HY2-1抑菌活性物质的产生,因此最佳转速为200 r/min。
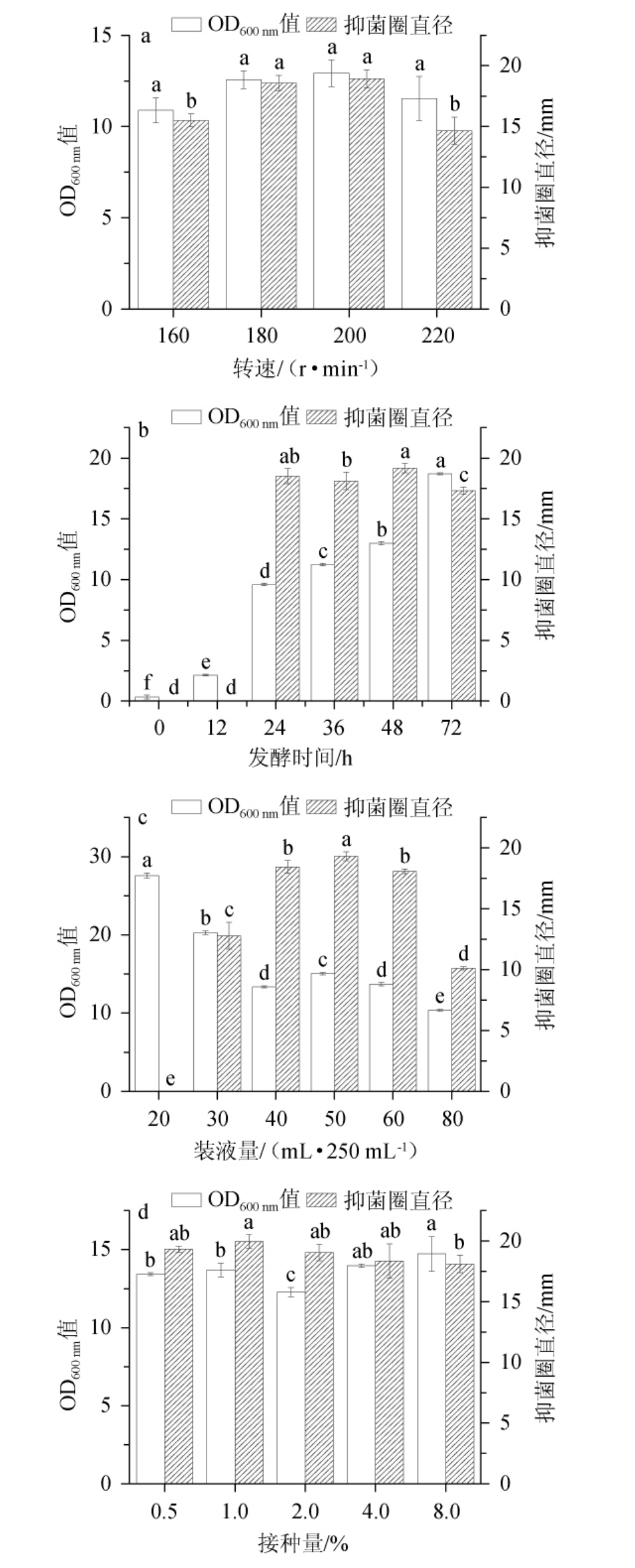
图3 发酵条件对HY2-1脂肽抑菌活性的影响
Fig.3 Effect of fermentation conditions on the antibacterial activity of HY2-1 lipopeptides
小写字母不同表示差异显著(P<0.05)。
由图3(b)可知,菌株HY2-1脂肽在发酵第0 h和12 h没有抑菌活力,在发酵24 h开始具有抑菌活力,随着发酵时间增加,菌体量不断增加,抑菌能力逐步加强,发酵到48 h菌株脂肽抑菌能力最强,对指状青霉的抑菌圈直径为(19.2±0.4)mm,48 h后抑菌活性显著下降(P<0.05),可能原因是长时间的发酵,使发酵培养基的营养物质消耗过大,不利于菌株次级代谢产物的合成。因此发酵时间为48 h。
由图3(c)可知,随着装液量的不断增加,菌株HY2-1的菌体量及脂肽的抑菌活性呈先上升后下降的趋势,可能原因是装液量少,营养物质不足,从而影响菌株抑菌物质的合成,装液量过多会导致培养基含氧量不足,从而影响菌株抑菌物质的合成。当装液量为50 mL/250 mL时,抑菌活性显著高于其他组别(P<0.05),此时抑菌圈直径为(19.3±0.4)mm,因此选择最佳装液量为50 mL/250 mL。
由图3(d)可知,随着接种量的增加,菌体量整体上没有明显的变化,抑菌活性呈现先缓慢增大,后缓慢减小的趋势,可能原因是,接种量过大时,菌株生长迅速,使培养液浓度增大,造成溶氧不足,不利于菌株抑菌活性物质的合成。当接种量为1%时抑菌圈直径最大,达到(20.0±0.6)mm,因此选择最佳接种量为1%。
2.3 发酵条件优化响应面试验结果与分析
2.3.1 回归模型建立及分析
根据表1中的试验因素水平,利用Design Expert 13进行试验设计,试验设计及结果见表2,对表2试验结果进行二次回归分析,得二次回归方程:Y=17.30-1.52A-0.975 0B-0.400 0C-1.20AB-0.750 0AC-0.100 0BC-1.08A2-0.625 0B2-1.32C2。
表2 发酵条件优化Box-Behnken试验结果与分析
Table 2 Results and analysis of Box-Behnken tests for fermentation conditions optimization
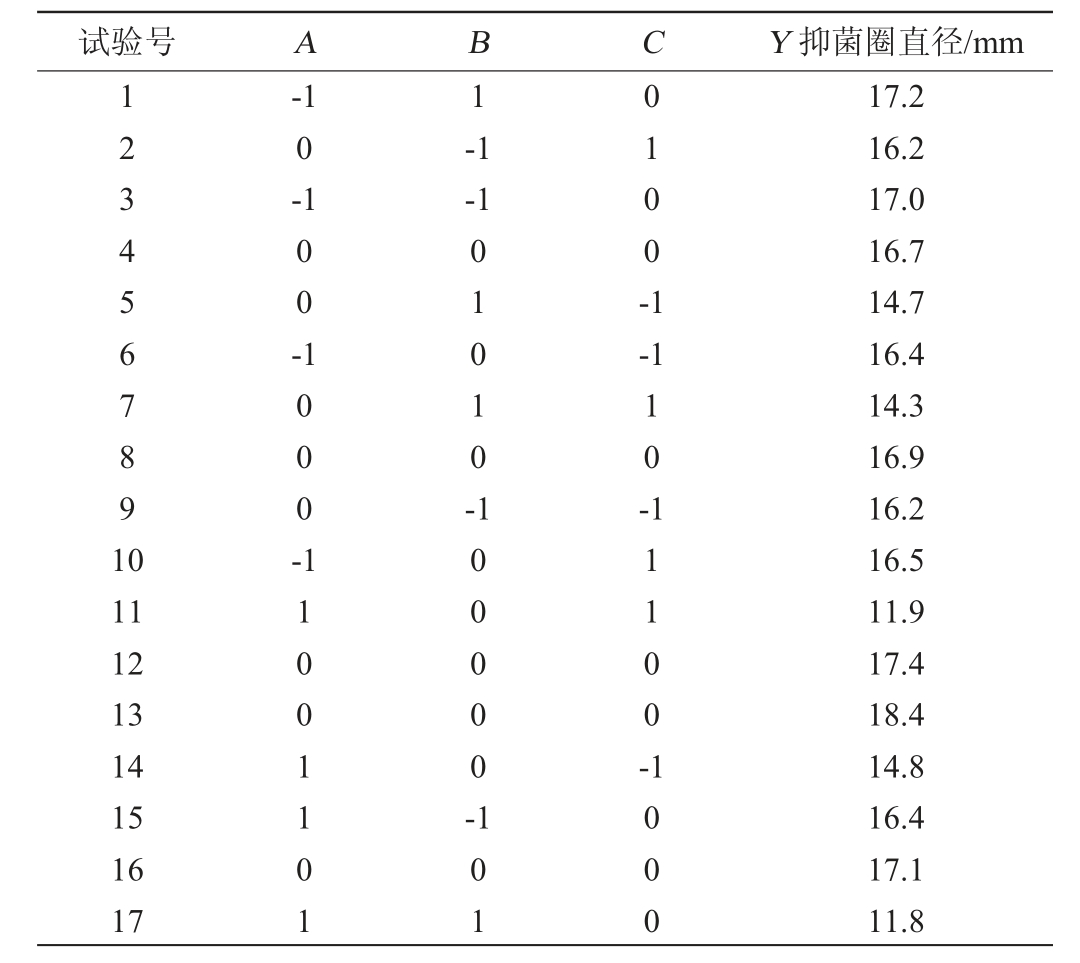
试验号 A B C Y 抑菌圈直径/mm 1234567891 0-1 0-1 1-1-1 00-0100-1 1000-01010--1 10-11 12 13 14 15 16 17 11001101 100000-11100-101 1000 17.2 16.2 17.0 16.7 14.7 16.4 14.3 16.9 16.2 16.5 11.9 17.4 18.4 14.8 16.4 17.1 11.8
二次回归模型方差分析见表3。由表3可知,模型极显著(P=0.000 9),失拟项不显著(P=0.629 7),决定系数R2=0.950 9,说明模型合理并且拟合较好;调整决定系数R2adj=0.887 7,说明该模型能解释88.77%的响应值改变。由P值可知,一次项A、B、二次项A2、C2和交互项AB对结果影响极显著(P<0.01),交互项AC对结果影响显著(P<0.05)。由F值可知,影响菌株HY2-1脂肽抑菌活性的因素主次顺序为A(装液量)>B(发酵时间)>C(接种量)。
表3 二次回归模型方差分析
Table 3 Variance analysis of quadratic regression model

注:“**”代表对结果影响极显著(P<0.01),“*”代表对结果影响显著
(P<0.05)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型*ABCA B****AC BC A2 B2 C2残差失拟项纯误差总离差50.90 18.60 7.60 1.28 5.76 2.25 0.040 0 4.87 1.64 7.39 2.63 0.850 0 1.78 53.53 91111111117341 6 5.66 18.60 7.60 1.28 5.76 2.25 0.040 0 4.87 1.64 7.39 0.375 7 0.283 3 0.445 0 15.05 49.52 20.24 3.41 15.33 5.99 0.106 5 12.95 4.38 19.67 0.000 9 0.000 2 0.002 8 0.107 4 0.005 8 0.044 3 0.753 7 0.008 8 0.074 7 0.003 0*******0.636 7 0.629 7相关系数R2=0.950 9,调整复相关系数R2adj=0.887 7
2.3.2 响应面数学模型分析
利用Design Expert 13.0软件对试验数据进行分析并绘制响应面图,结果见图4。以直观反映各因素对菌株HY2-1脂肽抑菌活性的交互作用。响应面的陡峭度和等高线的密集度越大,各因素对响应值的影响越显著,由图4可知,装液量和发酵时间响应曲面陡峭,等高线密集且呈现椭圆形趋势,说明装液量和发酵时间交互作用对菌株HY2-1脂肽抑菌活性影响较大;接种量和装液量交互作用的等高线也呈现椭圆形趋势,但其响应面陡峭度小于装液量和发酵时间;接种量和发酵时间交互作用的响应面陡峭度小于接种量和装液量;综上可知,接种量和装液量、接种量和发酵时间交互作用对菌株HY2-1脂肽抑菌活性的影响小于装液量和发酵时间的交互作用,这与方差分析结果一致。

图4 各因素间交互作用对抑菌圈直径影响的响应面及等高线图
Fig.4 Response surface plots and contour lines of effects of interaction between each factors on the diameter of the inhibition circle
2.3.3 模型验证
通过Design Expert 13.0软件计算得到解淀粉芽孢杆菌HY2-1发酵最佳条件:装液量49.39 mL/250 mL,发酵时间47.804 h,接种量0.971%,在此条件下,抑菌圈直径的预测值为17.9 mm,为了方便操作,修正发酵参数为装液量50 mL/250 mL,发酵时间48 h,接种量1%。经验证,试验所得的抑菌圈直径平均实际值为(18.6±0.1)mm,与预测值偏差3.69%,表明该模型能较好的预测菌株HY2-1脂肽抑菌活性,其所产脂肽类物质对指状青霉的抑菌圈直径较优化前(14.7±0.5)mm提高26.5%,说明菌株HY2-1脂肽抑菌活性得到明显提高。
3 结论
以前期从海底淤泥中筛选的脂肽类物质产生菌解淀粉芽孢杆菌(Bacillus amyloliquefaciens)HY2-1为研究对象,通过单因素和响应面优化试验确定最佳发酵培养基碳氮源为可溶性淀粉80 g/L、酵母浸粉和蛋白胨(1∶1)10 g/L,最佳发酵条件为装液量50 mL/250 mL、发酵时间48 h、接种量1%、转速200 r/min。在此优化条件下,发酵过程所产的脂肽类物质对指状青霉的抑菌效果显著提高,抑菌圈直径达到(18.6±0.1)mm,较优化前[(14.7±0.5)mm]提高26.5%。本研究通过优化培养基组分和发酵条件显著提高了菌株HY2-1发酵过程中的脂肽类物质抑菌活性,为该菌株后期的果蔬贮藏保鲜应用奠定了研究基础。
[1]ZHANG B, XU L, DING J, et al.Natural antimicrobial lipopeptides secreted by Bacillus spp.and their application in food preservation,a critical review[J].Trends Food Sci Technol,2022,127:26-37.
[2]郭蔓,张朝正,赵华.贝莱斯芽孢杆菌抑尖孢镰刀菌脂肽类物质的鉴定[J].中国酿造,2021,40(12):35-39.
[3]李道明,王瑛,陈超,等.芽孢杆菌几种重要抗菌脂肽研究进展[J].生物工程学报,2022,38(5):1768-1783.
[4]罗晓娇,孙静,陆颖健.解淀粉芽孢杆菌中脂肽的生物合成、抑菌机理及应用的研究进展[J].食品工业科技,2022,43(19):462-470.
[5]龚谷迪,周广田,郭阳,等.脂肽surfactin、iturin、fengycin性质鉴定的研究与展望[J].中国食品添加剂,2013(3):211-215.
[6]KONSTANTINA K, XAVIER G, NICHOLAS M, et al.Antimicrobial activity of lipopeptide biosurfactants against foodborne pathogen and food spoilage microorganisms and their cytotoxicity[J].Front Microbiol,2021,11:561060.
[7]ELSHAGHABEE F M F, ROKANA N, GULHANE R D, et al. Bacillus as potential probiotics:status,concerns,and future perspectives[J].Front Microbiol,2017,8:1490.
[8]O P R, S V L P, CRAIG F, et al. Bacillus lipopeptides as powerful pest control agents for a more sustainable and healthy agriculture:recent studies and innovations[J].Planta,2020,251(3):70.
[9]WOLDEMARIAMYOHANNES K,WAN Z,YU Q,et al.Prebiotic,probiotic, antimicrobial, and functional food applications of Bacillus amyloliquefaciens[J].J Agr Food Chem,2020,68(50):14709-14727.
[10]WANG Y,XU J,SHI J,et al.Draft genome sequence of a lipopeptideproducing Bacillus amyloliquefaciens strain isolated from wheat field soil with antagonistic activity against azole-resistant Fusarium graminearum[J].J Global Antimicrob Resist,2022,29:555-557.
[11]TRAN T D,HUYNH S,PARKER C T,et al.Complete genome sequences of three Bacillus amyloliquefaciens strains that inhibit the growth of Listeria monocytogenes in vitro[J].Genome Announc,2018:6,e00518-e00579.
[12]KOUMOUTSI A,CHEN X,HENNE A,et al.Structural and functional characterization of gene clusters directing nonribosomal synthesis of bioactive cyclic lipopeptides in Bacillus amyloliquefaciens strain FZB42[J].J Bacteriol,2004,186:1084-1096.
[13]CHEN K,TIAN Z,LUO Y,et al.Antagonistic activity and the mechanism of Bacillus amyloliquefaciens DH-4 against citrus green mold[J].Phytopathology,2018,108(11):1253-1262.
[14]CALVO H,MARCO P,BLANCO D,et al.Potential of a new strain of Bacillus amyloliquefaciens BUZ-14 as a biocontrol agent of postharvest fruit diseases[J].Food Microbiol,2017,63:101-110.
[15]HAO W N,LI H,HU M Y,et al.Integrated control of citrus green and blue mold and sour rot by Bacillus amyloliquefaciens in combination with tea saponin[J].Posth Biol Technol,2011,59(3):316-323.
[16]VOSER T M, CAMPBELL M D, CARROLL A R.How different are marine microbial natural products compared to their terrestrial counterparts[J].Nat Prod Report,2022,39(1):7-19.
[17]HUANG L, LING X, PENG S, et al.A marine lipopeptides-producing Bacillus amyloliquefaciens HY2-1 with a broad-spectrum antifungal and antibacterial activity and its fermentation kinetics study[J].World J Microbiol Biotechn,2023,39(8):196.
[18]ZHENG Y,ZHAO C,LI X,et al.Kinetics of predominant microorganisms in the multi-microorganism solid-state fermentation of cereal vinegar[J].LWT-Food Sci Technol,2022,159:113209.
[19]郝湘妹,王宇航,王媛,等.几种检测乳酸菌抑制真菌性能的方法比较[J].食品研究与开发,2020,41(9):45-49.
[20]周健平,谢云巧,廖雨虹,等.贝莱斯芽孢杆菌BR-01菌株高产抗菌肽培养基的优化及其抗菌肽的鉴定[J].广西科学,2023,30(4):693-705.
[21]孙力军,陆兆新,别小妹,等.培养基对解淀粉芽孢杆菌ES-2菌株产抗菌脂肽的影响[J].中国农业科学,2008,41(10):3389-3398.
[22]王洪强,何山,杨锐,等.一株海洋解淀粉芽孢杆菌(Bacillus amyloliquefaciens)生产Macrolactin B的发酵条件优化[J].海洋与湖沼,2013,44(6):1592-1596.
[23]周靖怡.一株具有抗菌活性芽孢杆菌的分离鉴定及其发酵条件优化[D].长沙:湖南农业大学,2020.
[24]WANG X,GAO J, GAO Y, et al.Analysis of surfactant production by Bacillus cereus GX7 and optimization of fermentation conditions[J].Colloids and Surfaces B: Biointerfaces,2024,233:113629.
[25]许曌昕,曾辉,曾德勇,等.响应面法优化解淀粉芽孢杆菌产中性蛋白酶发酵条件[J].中国酿造,2017,36(4):78-82.
[26]李鑫,郝林,马玲.解淀粉芽孢杆菌HRH(317)抑菌物质发酵条件的优化[J].中国酿造,2017,36(2):25-29.
[27]MOHANRASU K, RAO R G R, DINESH G H, et al.Optimization of media components and culture conditions for polyhydroxyalkanoates production by Bacillus megaterium[J].Fuel,2020,271:117522.
[28]张海燕,康三江,曾朝珍,等.响应面法优化沙棘酵素多菌种发酵工艺[J].中国酿造,2023,42(10):207-213.