葛根是豆科(Leguminosae)葛属(Pueraria)植物,享有“亚洲人参”的美誉,以地下根茎入药,是我国药食同源名录中一味重要的原料[1-2],其淀粉、碳水化合物、蛋白质、膳食纤维含量丰富,并富含铁、锌、铜、钙等微量元素,以及三萜类、黄酮类、生物碱类等生物活性物质[3],现代药理学研究表明,葛根具有保护心脑血管、抗炎、抗氧化等功效和作用[4-5]。因此,葛根以丰富的营养价值及保健功能成为“药食同源”领域的研究热点。目前,葛根主要加工成葛根醋[6]、葛根酒[7]和葛根茶[8]等产品,加工利用方式较为简单。
植物基发酵饮料是以植物、发酵菌等为原料,通过微生物发酵获得的特定生物活性成分制成的产品[9]。乳酸菌(lactic acid bacteria,LAB)是人体肠道微生物组的重要组成部分[10],可以调节机体胃肠道正常菌群、维持肠道微生态平衡[11]。乳酸菌发酵不仅赋予了食品独特的风味,而且可以增加食品的营养价值和保健作用[12-13]。其中,植物乳杆菌(Lactobacillus plantarum)适用于多种植物基食品的发酵[14],可以代谢植物基中的膳食纤维、蛋白质和维生素等化合物,从而提高植物基中化学物质的生物利用度和生物活性[15-16]。研究表明,在乳酸菌发酵前利用酶法处理药食同源植物原料,可以提高原料利用率、促进乳酸菌繁殖[17-18],具有简单高效、环境友好的优点。衡洋洋等[19]采用果胶酶和纤维素酶酶解黑枸杞,添加干酪乳杆菌(Lactobacillus casei)发酵黑枸杞饮料,不仅具有良好的风味,还明显提高了花青素和原花青素的保留率;周江伟[20]经果胶酶酶解桑椹后,添加益生菌发酵桑椹饮料,不仅改善了桑椹饮料的饮用口感,而且饮料具有较好的抗氧化活性,还富含活性乳酸菌;费永涛等[21]采用果胶酶酶解覆盆子,添加戊糖乳杆菌(Lactobacillus pentosus)和植物乳杆菌复合发酵覆盆子饮料,使其富含57种风味成分,其中醇类和萜烯类物质的含量较高,使得产品具有宜人的玫瑰花香和果香味。但目前以葛根为原料进行酶菌协同发酵的饮料鲜有报道。
该研究以葛根为原材料,以酶解率和异黄酮含量为考察指标,通过单因素试验和正交试验优化复合酶法处理葛根的酶解条件;以酶解液为发酵基质,植物乳植杆菌(Lactiplantibacillus plantarum)STDA5为发酵菌种,制备葛根乳酸菌饮料,通过单因素试验和响应面试验优化发酵工艺条件,并对其品质指标进行测定,以期研发富含活性乳酸菌和异黄酮的发酵葛根饮料,为葛根乳酸菌饮料规模化生产奠定基础。
1 材料与方法
1.1 材料与试剂
植物乳植杆菌(Lactiplantibacillus plantarum)STDA5:云南农业大学食品科学技术学院益生菌课题组自主分离,已经保藏于中国微生物菌种保藏管理委员会普通微生物中心(保藏号:CGMCC No.24574);葛根粉:昆明极木生物科技有限公司;MRS培养基:广东环凯微生物科技有限公司;α-淀粉酶(40 000 U/g)、果胶酶(30 000 U/g):山东隆科特酶制剂有限公司;无水柠檬酸(食品级):潍坊英轩实业有限公司;高纯果胶、羧甲酸纤维素钠(均为食品级):河南万邦实业有限公司;海藻酸钠(食品级):青岛明月海藻集团有限公司;白砂糖(食品级):云南滇王驿农业科技开发有限公司;葛根素标准品(纯度95.4%):北京索莱宝科技有限公司;氢氧化钠(分析纯):天津市风船化学试剂科技有限公司;磷酸(分析纯)、乙腈、甲醇(均为色谱纯):霍尼韦尔贸易有限公司。
1.2 仪器与设备
HP1100 高效液相色谱(high performance liquid chromatography,HPLC)仪:安捷伦科技有限公司;Multifuge X1R低温高速冷冻离心机:赛默飞世尔科技有限公司;UA-5100紫外分光光度计:云南塞恩斯试验设备有限公司;SB-5200DTD超声波清洗机:宁波新芝生物科技股份有限公司;BSA224S精密分析天平:北京赛多利斯天平有限公司;FE28 pH计:梅特勒-托利多有限公司;DHG-9245A电热恒温鼓风干燥箱:上海一恒科技有限公司;DEKW-4数显恒温水浴锅:上海力辰邦西仪器有限公司;PAL-1便携式数显折光仪:广州市爱拓科学仪器有限公司。
1.3 方法
1.3.1 葛根乳酸菌饮料的加工工艺流程及操作要点
干燥葛根粉→加水混匀→酶解→成分调整→离心→均质→巴氏灭菌→接种、发酵→成品
操作要点:
将干燥葛根粉按1∶10(g∶mL)的料液比加入饮用水,制备葛根发酵基液。于发酵基液加入1.2%的复合酶(α-淀粉酶和果胶酶比例为7∶3)[17]在60 ℃条件下酶解240 min。酶解结束后加入0.1%的稳定剂(果胶∶羧甲基纤维素钠∶海藻酸钠比例为1∶1∶1),采用柠檬酸调节发酵液的初始pH值为6.0。于4 ℃条件下离心(6 000 r/min、15 min)后取上清液加入9%的蔗糖,使用均质机进行均质(均质压力20~25 MPa,温度65~85 ℃),采用巴氏杀菌法杀菌(85 ℃、15 min)。接种1×105 CFU/mL活化植物乳植杆菌(将乳酸菌在MRS肉汤培养基中37 ℃条件下厌氧培养,按8 h的培养时间进行活化,活化3次,备用),在38 ℃发酵12 h,获得葛根乳酸菌发酵饮料成品。
1.3.2 葛根酶解条件优化
(1)单因素试验
在葛根固定酶解条件基础上,研究复合酶添加量(0.6%、0.8%、1.0%、1.2%、1.4%)、酶解pH(4.5、5.0、5.5、6.0、6.5)、酶解温度(50 ℃、55 ℃、60 ℃、65 ℃、70 ℃)和酶解时间(150 min、180 min、210 min、240 min、270 min)4个因素对葛根酶解率和异黄酮含量的影响。
(2)正交试验
在单因素试验结果的基础上,以综合评分(为指标隶属度之和,指标隶属度=F(X)=(X-Xmin)/(Xmax-Xmin),指标最大值隶属度为1,最小值为0[22])为考察指标,选择复合酶添加量(A)、酶解温度(B)、酶解时间(C)和酶解pH(D)为影响因素。采用L9(34)正交试验方案对葛根酶解条件进行优化,酶解条件优化正交试验因素与水平见表1。
表1 葛根酶解工艺优化正交试验因素与水平
Table 1 Factors and levels of orthogonal tests for Pueraria lobate enzymatic hydrolysis process optimization

水平 A 复合酶添加量/% B 酶解温度/℃ C 酶解时间/min D 酶解pH 1 2 3 1.0 1.2 1.4 55 60 65 180 210 240 5.5 6.0 6.5
1.3.3 葛根乳酸菌饮料发酵条件优化(1)单因素试验
在1.3.1中的发酵工艺条件基础上,分别考察乳酸菌接种量(1×105 CFU/mL、5×105 CFU/mL、1×106 CFU/mL、5×106 CFU/mL、1×107 CFU/mL)、发酵温度(35 ℃、37 ℃、39 ℃、41 ℃、43 ℃)、发酵时间(6 h、8 h、10 h、12 h、14 h)、蔗糖添加量(7%、8%、9%、10%、11%)对葛根乳酸菌饮料感官评分和pH值的影响,对葛根乳酸菌饮料的发酵条件进行优化。
(2)响应面试验
在单因素试验结果基础上,以感官评分(Y)为响应值,以接种量(A)、发酵温度(B)、发酵时间(C)和蔗糖添加量(D)为自变量,设计4因素3水平的Box-Behnken响应面试验。发酵条件优化响应面试验因素与水平见表2。
表2 发酵条件优化Box-Behnken试验设计因素与水平
Table 2 Factors and levels of Box-Behnken tests design for fermentation conditions optimization
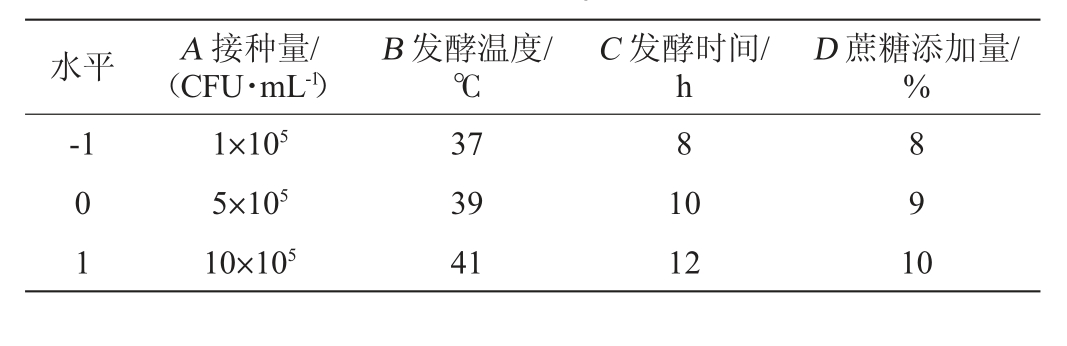
水平 A 接种量/(CFU·mL-1)D 蔗糖添加量/%-1 B 发酵温度/℃C 发酵时间/h 8 0 1 1×105 5×105 10×105 37 39 41 10 12 8 9 1 0
1.3.4 分析检测
(1)酶解率的测定
参照叶朋飞等[17]的方法,根据以下公式计算酶解率:
式中:m1为称取葛根粉质量,g;m2为离心沉淀物被干燥后的质量,g。
(2)异黄酮含量的测定
参考吕国红等[23]的方法测定异黄酮含量。分别配制质量浓度为0、0.004 mg/mL、0.008 mg/mL、0.012 mg/mL、0.016 mg/mL、0.020 mg/mL的葛根素溶液,以其质量浓度(X)为横坐标,波长251 nm处的吸光度值(Y)为纵坐标作标准曲线,得葛根素标准曲线回归方程为Y=73.779X-0.002 5,相关系数R2=0.999 4。吸取1 mL的酶解液或葛根乳酸菌饮料样品,稀释40倍,置于波长251 nm处测定吸光度值,按照回归方程计算异黄酮含量。
(3)离心沉淀率的测定
参照朱敏[24]的方法,称取20 g葛根乳酸菌饮料放入离心管,8 000 r/min离心15 min,称取沉淀质量,平行测定3次取平均值,根据以下公式计算离心沉淀率:
式中:m为沉淀物质量,g;M为葛根乳酸菌饮料质量,g。
(4)葛根素的测定
根据赵昱玮等[25]方法测定葛根素含量。
标准品溶液的制备:分别配制质量浓度分别为0.00、7.12 μg/mL、14.24 μg/mL、21.36 μg/mL、28.48 μg/mL、35.60 μg/mL的葛根素对照品工作液。
样品的制备:吸取乳酸菌发酵葛根饮料5 mL于25 mL的容量瓶中,用70%甲醇定容至刻度,超声处理(功率250 W,频率40 kHz)5 min,冷却至室温,过0.45 μm滤膜,进行色谱分析。
色谱条件:色谱柱C18 SionChromODS-BP柱(4.6 mm×250 mm,5 μm);进样量10 μL;柱温25 ℃;检测波长250 nm;流动相为乙腈-0.05%磷酸溶液(10∶90);流速1.0 mL/min。
定性定量分析:以保留时间定性,以峰面积定量。
(5)微生物指标
乳酸菌活菌数:参考GB 4789.2—2022《食品微生物学检验菌落总数测定》测定;沙门氏菌:GB 4789.4—2016《沙门氏菌检验》测定;大肠杆菌:参考GB 4789.3—2016《食品微生物学检验大肠菌群计数》测定;霉菌和酵母菌:参照GB 4789.15—2016《食品微生物学检验霉菌和酵母计数》;金黄色葡萄球菌:参考GB 4789.10—2016《食品微生物学检验金黄色葡萄球菌检验》。
(6)理化指标
pH:采用pH计测定;总酸:参照GB 12456—2021《食品中总酸的测定》;还原糖:参照GB 5009.7—2016《食品安全国家标准食品中还原糖的测定》的直接滴定法测定;可溶性固形物:参照GB/T 12143—2018《饮料通用分析方法》测定。
1.3.5 感官评价标准
采用描述性检验法[26],由10名经过培训的食品专业学生组成感官评定小组,从组织状态、口感、香味、色泽4个方面对乳酸菌发酵葛根饮料的质量进行评价,满分为100分,葛根乳酸菌饮料的感官评分标准见表3。
表3 葛根乳酸菌饮料感官评分标准
Table 3 Sensory score standards of Pueraria lobate lactic acid bacteria beverage
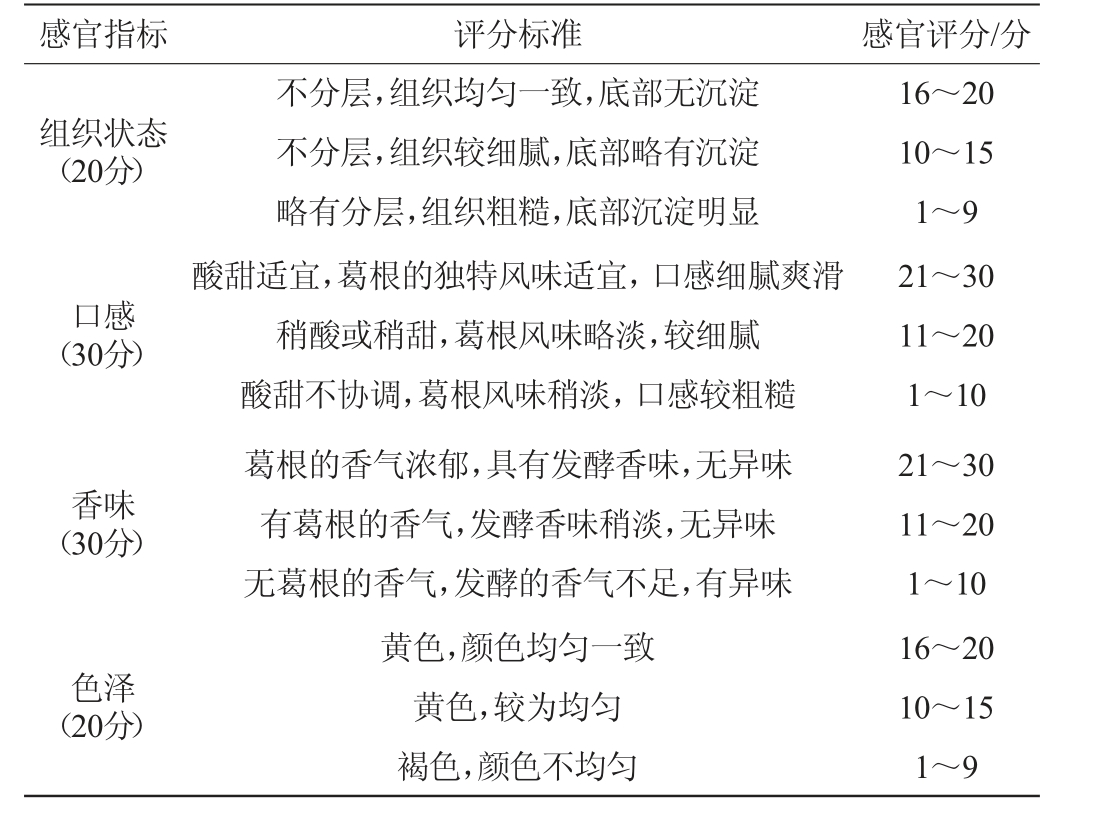
感官指标 评分标准 感官评分/分组织状态(20分)口感(30分)香味(30分)不分层,组织均匀一致,底部无沉淀不分层,组织较细腻,底部略有沉淀略有分层,组织粗糙,底部沉淀明显酸甜适宜,葛根的独特风味适宜,口感细腻爽滑稍酸或稍甜,葛根风味略淡,较细腻酸甜不协调,葛根风味稍淡,口感较粗糙葛根的香气浓郁,具有发酵香味,无异味有葛根的香气,发酵香味稍淡,无异味无葛根的香气,发酵的香气不足,有异味色泽(20分)黄色,颜色均匀一致黄色,较为均匀褐色,颜色不均匀16~20 10~15 1~9 21~30 11~20 1~10 21~30 11~20 1~10 16~20 10~15 1~9
1.3.6 数据处理与统计分析
利用SPSS Statistics 19软件对试验数据进行分析,采用One-way ANOVA进行方差分析和Design-Expert 8进行响应面试验设计及分析,数据采用Duncan多重比较进行各数据之间的显著性分析。
2 结果与分析
2.1 葛根酶解工艺条件优化
2.1.1 单因素试验
由图1(A)可知,当复合酶添加量为0.6%~1.2%时,酶解率呈平稳上升趋势,异黄酮含量呈先下降再上升的趋势;当复合酶添加总量为1.2%时,酶解率和异黄酮含量达到最高,分别为36.83%和0.844 g/L;当复合酶添加量>1.2%之后,酶解率和异黄酮含量有所下降。分析原因可能是:复合酶添加量低时酶解不充分,导致异黄酮含量较少;复合酶添加量过高时,底物被消耗,过剩的酶则会导致溶液体系黏度增加,进而限制酶解效率[27]。综合考虑,确定最佳复合酶添加量为1.2%。
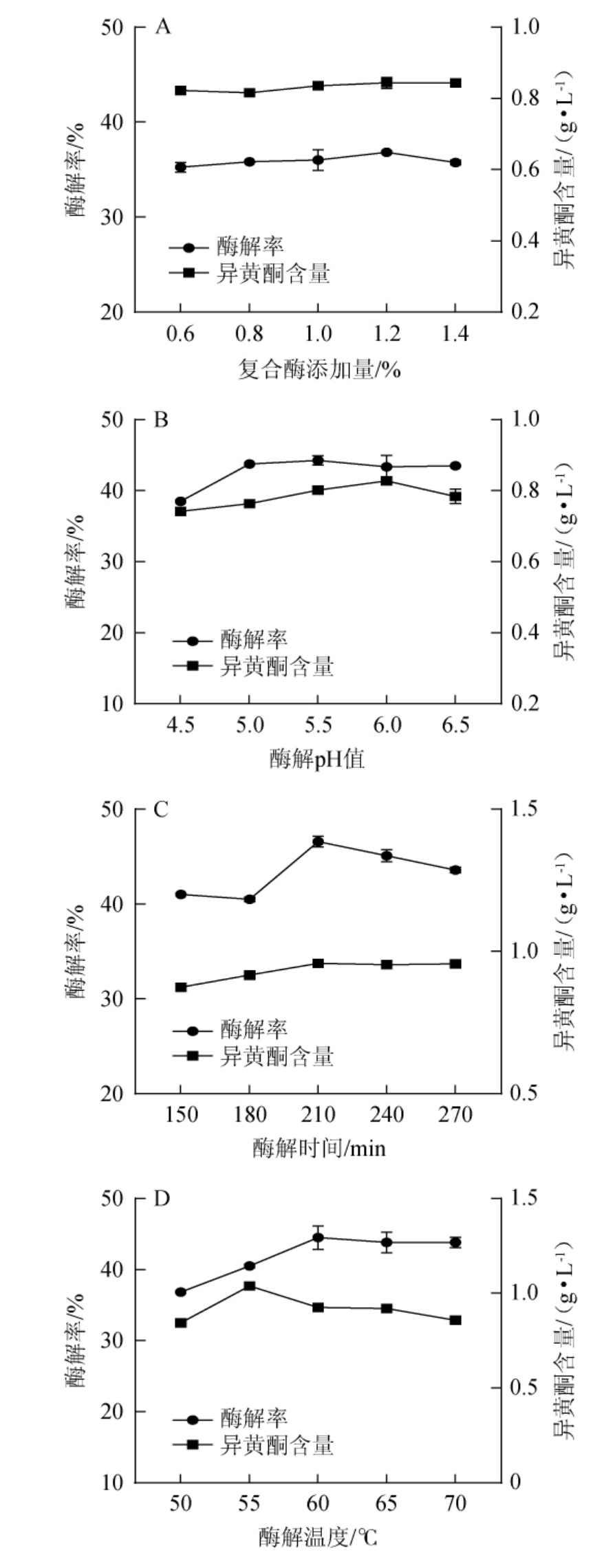
图1 葛根酶解工艺优化单因素试验结果
Fig.1 Results of single factor tests for Pueraria lobate enzymatic hydrolysis process optimization
由图1(B)可知,当pH为4.5~6.5时,酶解率及异黄酮含量呈先上升后下降的趋势;当酶解pH为5.5时,酶解率达到最大值,为44.25%;而酶解pH为6.0时,异黄酮含量达最高值,为0.827 g/L。综合考虑,确定最佳酶解pH值为6.0。
由图1(C)可知,随着酶解时间在150~270 min范围内的增加,酶解率及异黄酮含量呈现先上升后下降的趋势;当酶解时间为210 min时,异黄酮含量、酶解率均最高,为0.924 g/L、46.58%。其原因可能是因为酶解时间过长,导致酶的结构受损,活性降低,从而导致酶解率下降[28]。综合考虑,确定最佳酶解时间为210 min。
由图1(D)可知,当酶解温度为50~70 ℃时,酶解率及异黄酮含量呈现先上升后下降的趋势;当酶解温度分别为55℃、60℃时,异黄酮含量、酶解率最高,为1.038g/L、44.50%。其原因可能是,随着酶解温度的升高而增加,酶活性逐渐增强,酶解率提高;而当温度继续升高时,酶的稳定性降低,导致酶活性下降,酶解率也随之降低;温度升高,加快了分子运动速率,提高了异黄酮的溶解度,酶解液中异黄酮含量增加。而当温度过高,异黄酮易发生氧化或分解,导致其在酶解液中的含量降低[29-30]。综合考虑,确定最佳酶解温度为60 ℃。
2.1.2 正交试验
根据单因素试验结果,以复合酶添加量(A)、酶解温度(B)、酶解时间(C)和酶解pH(D)为影响因素,测定异黄酮含量和酶解率,并计算综合评分,并以综合评分作为评价指标,采用L9(34)正交试验设计优化葛根酶解工艺条件,正交试验结果与分析见表4。
表4 葛根酶解工艺条件优化正交试验结果及分析
Table 4 Results and analysis of orthogonal tests for Pueraria lobate enzymatic hydrolysis process optimization
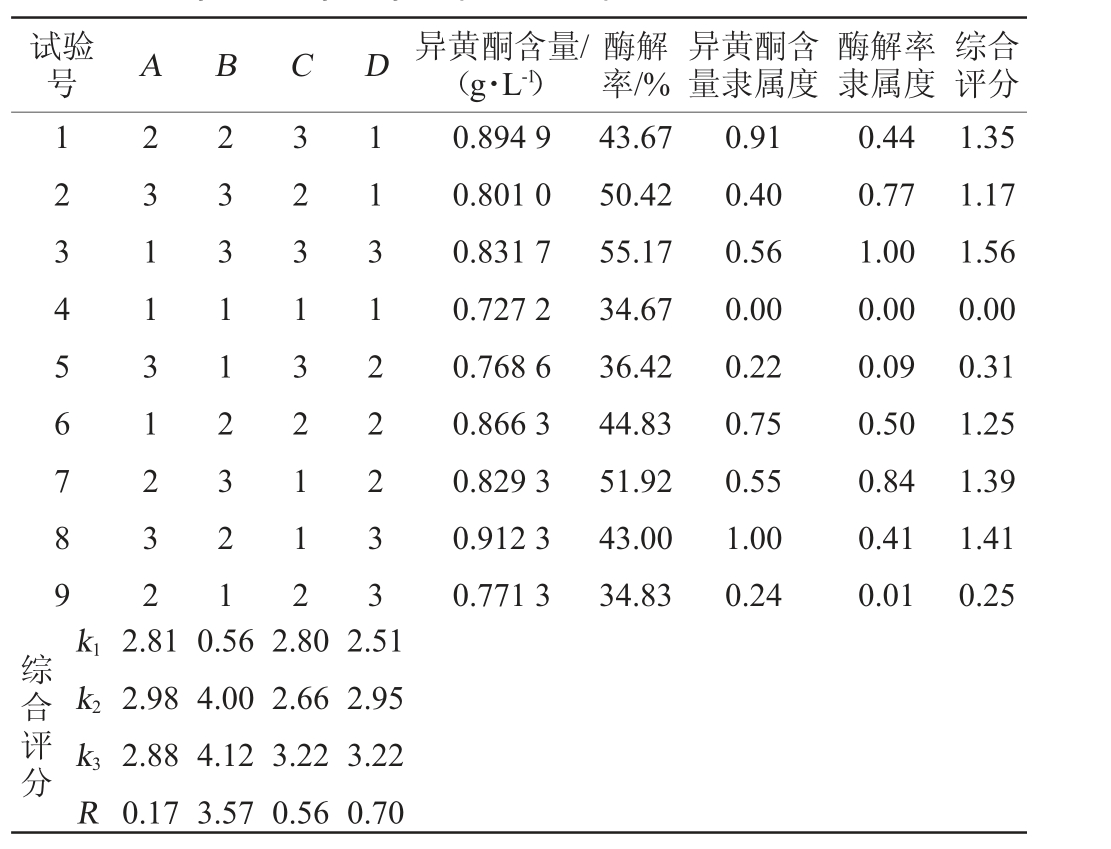
试验号 A B C D 异黄酮含量/(g·L-1)酶解率/%异黄酮含量隶属度酶解率隶属度综合评分123456789 231131232 233112321 323132112 113122233 0.894 9 0.801 0 0.831 7 0.727 2 0.768 6 0.866 3 0.829 3 0.912 3 0.771 3 43.67 50.42 55.17 34.67 36.42 44.83 51.92 43.00 34.83 0.91 0.40 0.56 0.00 0.22 0.75 0.55 1.00 0.24 0.44 0.77 1.00 0.00 0.09 0.50 0.84 0.41 0.01 1.35 1.17 1.56 0.00 0.31 1.25 1.39 1.41 0.25综合评分k1 k2 k3R 2.81 2.98 2.88 0.17 0.56 4.00 4.12 3.57 2.80 2.66 3.22 0.56 2.51 2.95 3.22 0.70
综合评分直观分析表明,各因素作用主次顺序为B>D>C>A,即酶解温度>酶解pH>酶解时间>复合酶添加量。根据综合评分的K值,得出理论最优酶解组合为A2B3C3D3,即复合酶添加量为1.2%,酶解温度为65 ℃,酶解时间为240min,酶解pH为6.5。而根据正交表中酶解率和异黄酮结合综合评分直观分析,得出最优的酶解组合是A1B3C3D3,即复合酶添加量为1.0%,酶解温度为65 ℃,酶解240 min,酶解pH为6.5。对酶解工艺的实际最优组合A1B3C3D3和理论最优组合A2B3C3D3进行验证试验,结果显示A1B3C3D3的酶解率、异黄酮含量分别为50.56%、0.918 3 g/L,A2B3C3D3的酶解率、异黄酮含量分别为51.19%、0.945 1 g/L,A2B3C3D3的综合评分比A1B3C3D3高,因此确定A2B3C3D3为最佳酶解组合,即复合酶添加量为1.2%,酶解温度为65 ℃,酶解时间为240 min,酶解pH 6.5。
2.2 葛根乳酸菌饮料发酵条件优化
2.2.1 单因素试验结果
pH是发酵过程中影响风味的重要参数,而在发酵期间pH值满足饮料的最佳pH范围(3.6~4.9),在这范围内,乳酸菌能正常生长且不影响产品品质[31]。由图2(A)可知,随着接种量的增加,感官评分呈先升高后降低的趋势,pH值呈现缓慢下降的趋势,当接种量为5×105 CFU/mL时,感官评分最高为78.95分,pH值为4.73;当接种量>5×105 CFU/mL时,乳酸菌生长繁殖旺盛,竞争增强,生长繁殖速率降低,这与汪云阳等[32]研究枸杞原浆进行发酵制成发酵枸杞饮料的乳酸菌添加量结果相似。因此,确定最佳接种量为5×105 CFU/mL。
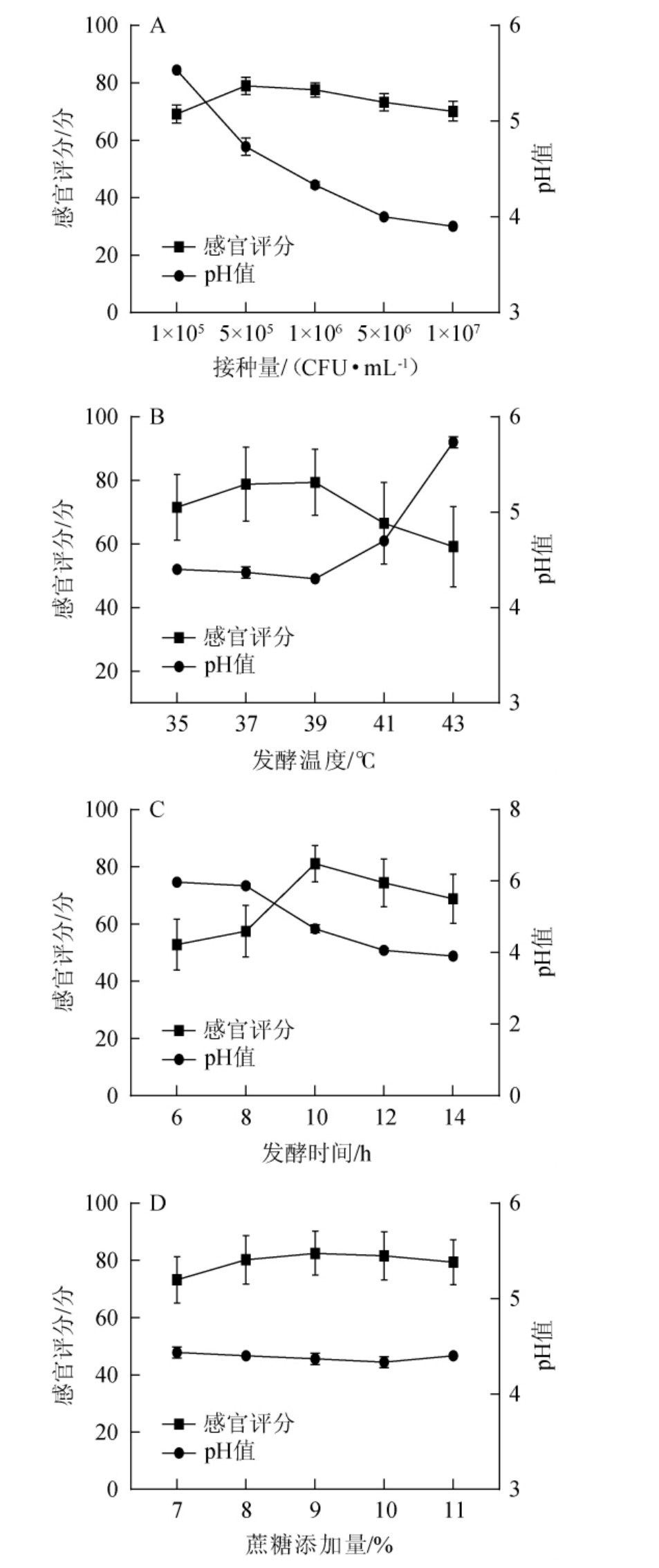
图2 乳酸菌发酵葛根饮料工艺优化单因素试验结果
Fig.2 Results of single factor tests for fermentation process optimization of Pueraria lobate lactic acid bacteria beverage
由图2(B)可知,随着发酵温度的升高,葛根乳酸菌饮料的pH值呈现出先轻微下降后升高趋势,而感官评分呈先升高后降低的趋势,当发酵温度为39 ℃时,感官评分达到最大值为79.4分,pH值为4.30;当发酵温度>39 ℃时,感官评分降低。分析原因可能是:发酵温度较低时,乳酸菌的生长繁殖速度较快,有机酸及风味物质等代谢产物丰富,从而使pH降低,感官评分较高;发酵温度过高时,不利于乳酸菌的生长,易产生不良风味物质的产生、pH的升高,这与杨春敏等[33]研究九月黄乳酸菌发酵饮料工艺优化的发酵温度相似。因此,确定最佳发酵温度为39 ℃。
由图2(C)可知,随着发酵时间的延长,感官评分呈先升高后降低的趋势,pH值呈现下降的趋势,当发酵时间为10 h时,感官评分达到最大值为81.1分,而pH为4.63。分析原因可能是:发酵时间过短,乳酸菌生长未达到稳定期,菌种数量偏低,葛根发酵不充分,口感较差;发酵时间过长,葛根发酵饮料中的有机酸浓度增加,pH继续下降,导致产品酸度过重。这与侯金丽[34]的植物乳杆菌发酵饮料的研制及其抗氧化作用的发酵时间结果相似。因此,确定最佳发酵时间为10 h。
由图2(D)可知,随着蔗糖添加量的增加,葛根乳酸菌饮料感官评分呈现先升高后降低的趋势,而pH值呈先平缓下降然后轻微上升的趋势。当蔗糖添加量为9%时,感官评分最高,为82.5分,pH为4.37。分析原因可能是:在发酵过程中,蔗糖不仅是菌种最适生长的碳源,还是饮料中甜味来源,蔗糖的添加量应使成品酸甜适当以不影响发酵菌的生长为宜[35-36]。过高的蔗糖添加量不仅不能促进乳酸菌的发酵能力和降低pH值,还会造成高渗透压环境,导致乳酸菌脱水死亡,使pH略有上升[37],从而导致发酵饮料酸甜不协调口感偏甜,感官品质下降。这与朱丰等[38]采用响应面法优化石花菜酸奶发酵工艺中的蔗糖添加量变化趋势相似。因此,确定最佳蔗糖添加量为9%。
2.2.2 响应面试验设计及结果
根据单因素试验结果,以接种量(A)、发酵温度(B)、发酵时间(C)、蔗糖添加量(D)为自变量,以葛根乳酸菌饮料的感官评分(Y)作为响应值,并根据中心复合试验设计原理,进行4因素3水平的响应面试验,葛根乳酸菌饮料发酵条件优化响应面试验设计及结果见表5,方差分析结果见表6。
表5 葛根乳酸菌饮料发酵条件优化的响应面试验设计与结果
Table 5 Design and results of response surface tests for fermentation process optimization of Pueraria lobate lactic acid bacteria beverage
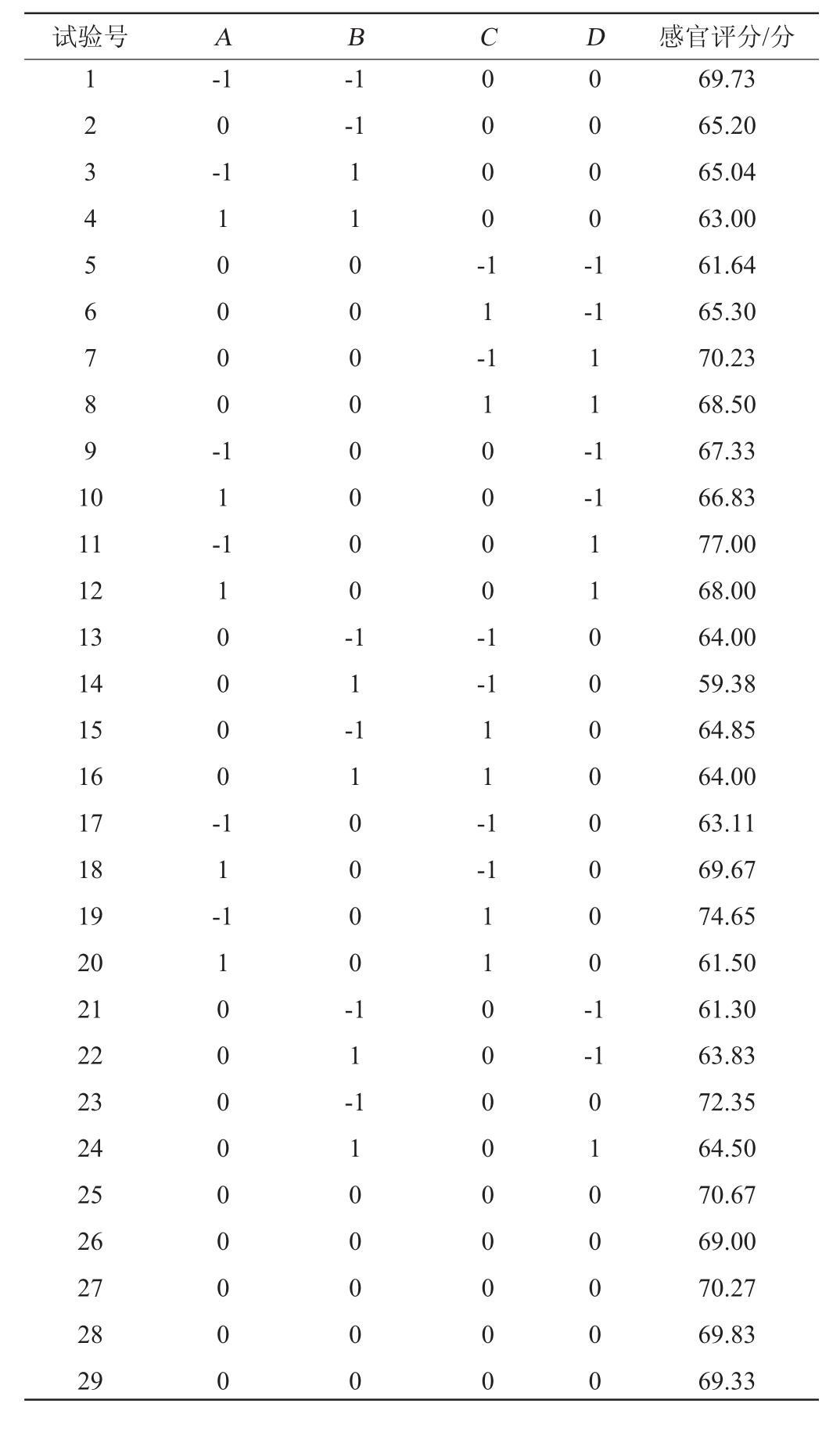
试验号 A B C D 感官评分/分1 2 3 4 5 6 7 8 9 1 0-1 0-1-1-1 1 0 0 0 0 -0 0 0 0 -1 1 -0 0 0 0 -1-1 1 1 -1-1 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 1 1 -1 1 0 0 0 0 -1 1 0 0 0 0 0 0 0 0 -1 1 -1 1 0 0 0 0 -1-1 1 1 -1 1 -1-1 1 1 0 0 0 0 0 0 0 0 0 1 1 0 0 0 0 -1 1 -1 1 0 0 0 0 0 0 0 0 -1-1 1 1 0 0 0 0 0 1 1 00 0 0 0 0 0 0 0 0 1 0 0 0 0 0 69.73 65.20 65.04 63.00 61.64 65.30 70.23 68.50 67.33 66.83 77.00 68.00 64.00 59.38 64.85 64.00 63.11 69.67 74.65 61.50 61.30 63.83 72.35 64.50 70.67 69.00 70.27 69.83 69.33
表6 回归模型方差分析
Table 6 Analysis of variance of regression model
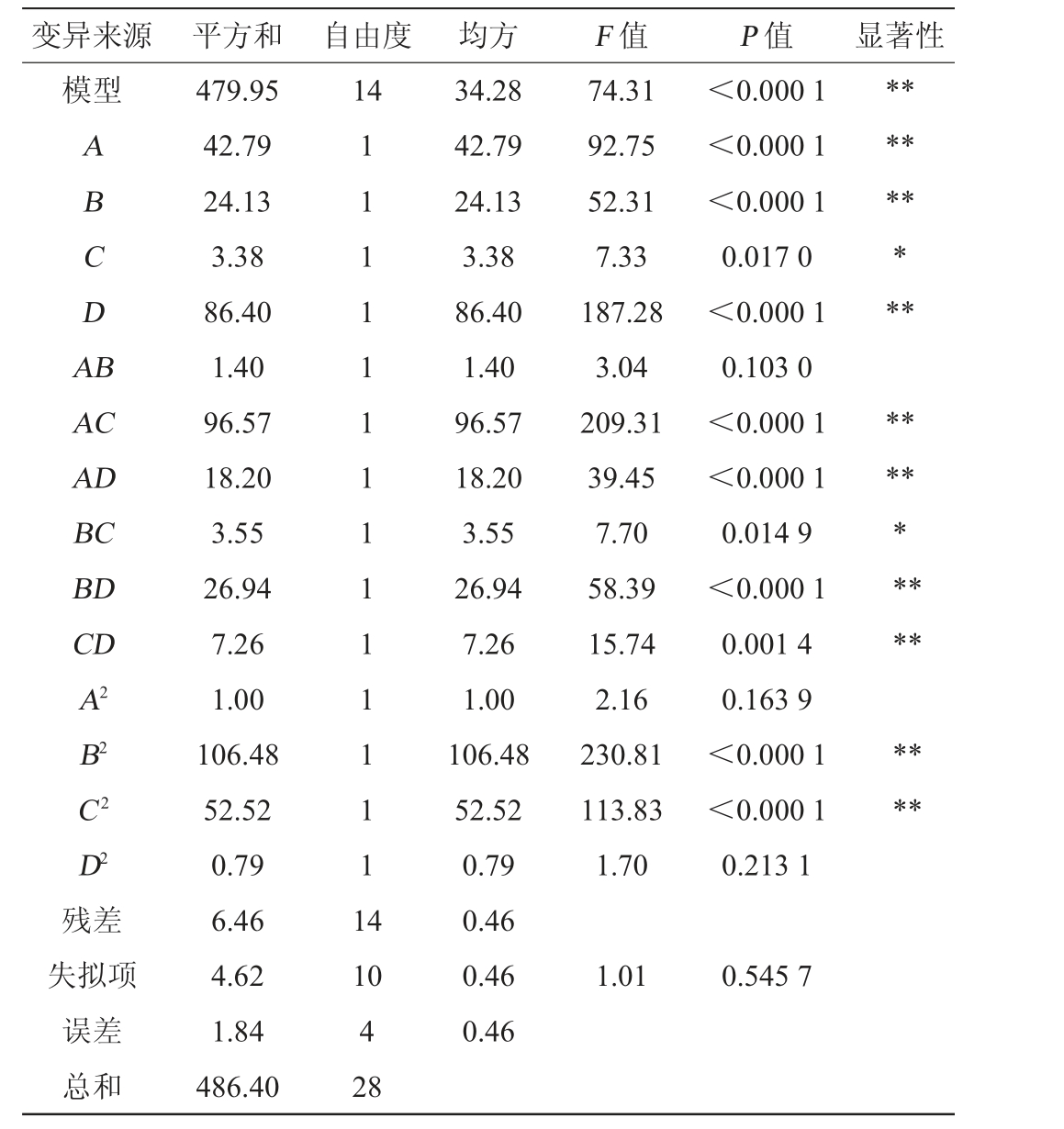
注:“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著
(P<0.01)。
变异来源 平方和 自由度 均方 F 值 P 值 显著性模型14 ABCDA B*********AC AD BC BD CD A2 B2 C2 D2残差失拟项误差总和479.95 42.79 24.13 3.38 86.40 1.40 96.57 18.20 3.55 26.94 7.26 1.00 106.48 52.52 0.79 6.46 4.62 1.84 486.40 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 4 74.31 92.75 52.31 7.33 187.28 3.04 209.31 39.45 7.70 58.39 15.74 2.16 230.81 113.83 1.70<0.000 1<0.000 1<0.000 1 0.017 0<0.000 1 0.103 0<0.000 1<0.000 1 0.014 9<0.000 1 0.001 4 0.163 9<0.000 1<0.000 1 0.213 1*************10 4 28 34.28 42.79 24.13 3.38 86.40 1.40 96.57 18.20 3.55 26.94 7.26 1.00 106.48 52.52 0.79 0.46 0.46 0.46 1.01 0.545 7
采用Design-Expert 8.0.6软件对表5试验结果进行二次多元回归拟合分析,得到葛根乳酸菌饮料感官评分对接种量、发酵温度、发酵时间及蔗糖添加量的二次回归方程为:
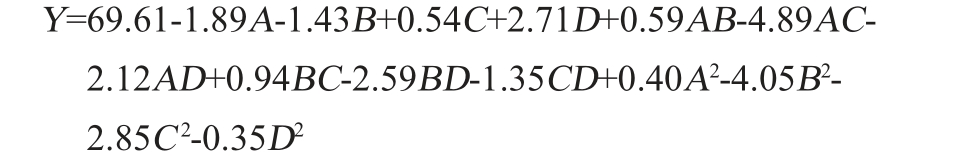
由表6可知,回归模型极显著(P值<0.000 1),失拟项不显著(P>0.05),说明此回归模型拟合度良好,可信度较高。模型决定系数R2=0.986 7,调整决定系数R2adj=0.973 4,说明该模型拟合程度较好,由P值可知,一次项A、B、D,交互项AC、AD、BD和CD,二次项B2和C2对结果影响极显著(P<0.01),一次项C、交互项BC对结果影响显著(P<0.05),其他项对结果影响不显著(P>0.05)。由F值可知,影响感官评分的各因素顺序为蔗糖添加量(D)>接种量(A)>发酵温度(B)>发酵时间(C)。
三维曲面坡度越陡且等高线呈椭圆形,说明各因素之间的交互作用越显著,对响应值影响越大。由图3可知,AC、AD、BD和CD的交互作用的响应曲面陡峭,说明其交互效应对葛根乳酸菌饮料影响极显著,而交互项BC交互作用的响应曲面较陡峭,说明其交互效应对结果影响显著,这与方差分析结果一致。
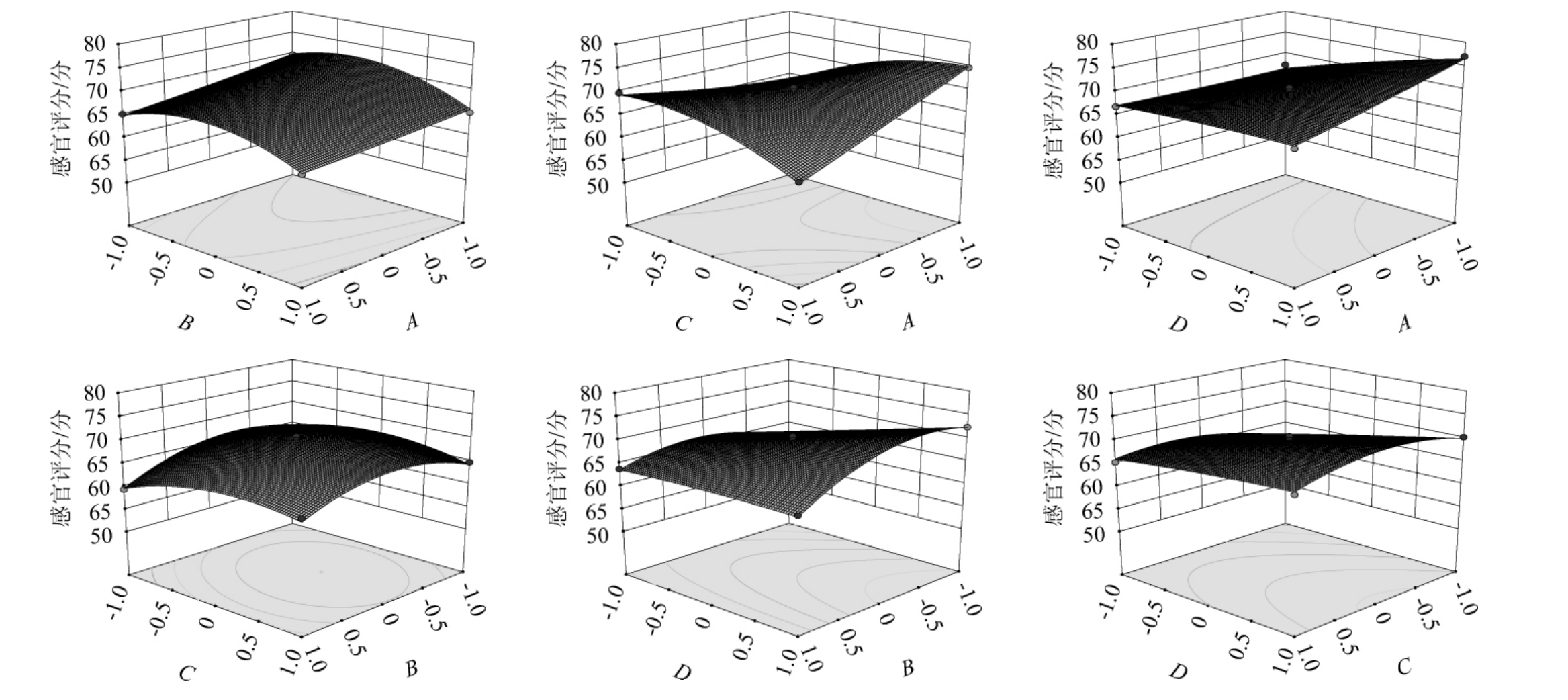
图3 各因素间交互作用对感官评分影响的响应曲面及等高线
Fig.3 Response surface plots and contour lines of effects of interaction between various factors on sensory score
通过Design-Expert 8.0.6软件分析,得到最佳发酵工艺条件为:接种量1.06×105 CFU/mL、发酵温度38.20 ℃、发酵时间11.74 h、蔗糖添加量9.70%,在此优化工艺条件下,感官评分预测值为77.32分。为了方便操作,将发酵工艺条件修正为:接种量1×105 CFU/mL、发酵温度38 ℃、发酵时间12 h、蔗糖添加量为10%。在此工艺条件下进行3次独立验证试验,得到的感官评分实际值为78.50分,与预测值基本吻合,说明模型很好地预测了实验结果。
2.3 葛根乳酸菌饮料发酵前后异黄酮和葛根素含量测定结果
未发酵和发酵葛根饮料中异黄酮含量分别为0.556 g/L和0.713 g/L,与未发酵相比,乳酸菌发酵葛根饮料异黄酮含量显著增加了28.24%(P<0.05);分析原因可能是植物乳植杆菌STDA5在发酵过程中以葛根中纤维质类等物质为营养源,将葛根中非异黄酮物质进行了降解,实现了葛根异黄酮的相对富集[39]。未发酵和发酵葛根饮料中葛根素含量分别为26.13 μg/mL、27.60 μg/mL,发酵前后无显著变化(P>0.05)。
2.4 葛根乳酸菌饮料品质指标检测结果
葛根乳酸菌饮料pH值为4.60,乳酸菌活菌数为6.89×108 CFU/mL,相比发酵前,乳酸菌活菌数增加了3.84 lg(CFU/mL),乳酸菌数符合GB 19302—2010《食品安全国家标准发酵乳》要求;还原糖含量为17.37 g/L,可溶性固形物含量为14.10%,总酸含量为43.5 g/L;菌落总数、大肠菌群、霉菌及酵母菌均符合GB 7101—2022《食品安全国家标准饮料》要求。
3 结论
本研究优化了葛根酶解工艺条件,得到葛根酶解最佳工艺条件为复合酶添加量1.2%、酶解pH 6.5、酶解温度65 ℃、酶解时间240 min。葛根乳酸菌饮料的最佳发酵工艺条件为:接种量1×105 CFU/mL、发酵温度38 ℃、发酵时间12 h、蔗糖添加量10%,口感具有葛根的特殊风味及发酵风味,酸甜适中,在此工艺条件下,葛根乳酸菌饮料pH为4.60,还原糖含量为17.37 g/L、可溶性固形物含量为14.10%,总酸含量为43.5 g/L,异黄酮含量为0.713 g/L、葛根素含量27.60 μg/mL,乳酸菌活菌数为6.89×108 CFU/mL。
[1]曾文燊,黄达荣,谢斯威,等.葛根异黄酮组成、结构及功效机制研究进展[J].食品科学,2023,44(1):353-361.
[2]翟宇,龙彦,黄佳琦,等.江西葛根资源的开发利用与产业化策略初探[J].光明中医,2022,37(5):906-909.
[3]WANG S G,ZHANG S M,WWANG S P,et al.A comprehensive review on Pueraria: Insights on its chemistry and medicinal value[J].Biomed Pharmacother,2020,131:110734.
[4]范春华,常磊.葛根的化学成分、生物活性及加工利用研究进展[J].中国果菜,2022,42(10):36-40,84.
[5]付旭冉,叶永丽,赵晓联,等.葛根功效活性及其在食品中的应用进展[J].食品研究与开发,2021,42(13):197-205.
[6]赵红年,赵芳,林汲,等.葛根高粱复合酿造山西老陈醋的工艺优化[J].中国调味品,2020,45(6):134-138.
[7]董琪,张后才,刘飞翔,等.浓醪发酵葛根酒的工艺研究[J].酿酒科技,2020(9):87-92.
[8]黄维安,蒙毅,赖祥椿,等.菊苣葛根袋泡茶的研制[J].农产品加工,2021(8):8-11.
[9]王紫琳,方冉,赵存朝,等.雪莲果植物乳杆菌发酵饮料的研制[J].中国酿造,2022,41(12):216-222.
[10]HAN M,SUN P,LI Y,et al.Structural characterization of a polysaccharide from Sargassum henslowianum, and its immunomodulatory effect on gastric cancer rat[J].Int J Biol Macromol,2018,108(1120):1120-1127.
[11]GARBACZ K.Anticancer activity of lactic acid bacteria[J].Semin Cancer Biol,2022,86(3):356-366.
[12]王超,林小晖,杜冰.乳酸菌发酵型饮料的研究现状与前景[J].饮料工业,2018,21(1):68-70.
[13]王鑫,马芙俊,李雅丽,等.清涧红枣乳酸菌发酵饮料工艺优化[J].食品工业科技,2020,41(10):95-100.
[14]FEI W H, NODA M, DAN N, et al.Dendrobium officinale extract fermented with Lactobacillus plantarum GT-17F enhances the protection of UV-mediated photoaging[J].Biol Pharm Bull,2023,46(10):1451-1460.
[15]KLAUDIA G,IWONA N,KAMILA R,et al.New insight into bacterial interaction with the matrix of plant-based fermented foods[J].Foods,2021,10(7):1603-1603.
[16]GARCIA C, GUERIN M, SOUIDI K, et al.Lactic fermented fruit or vegetable juices:past,present and future[J].Beverages,2020,6(1):8.
[17]叶朋飞,罗程,黄丝艳,等.乳酸菌发酵云参酵素的工艺优化及其功能研究[J].云南农业大学学报(自然科学),2019,34(5):896-905.
[18]陈来凤,倪琳钰,邓成林,等.乳酸菌发酵天麻口服液工艺优化[J].食品工业科技,2023,44(15):193-202.
[19]衡洋洋,周志磊,陈超,等.黑果枸杞乳酸菌发酵饮料生产工艺研究[J].食品与发酵工业,2023,49(15):114-121.
[20]周江伟.桑椹乳酸菌发酵饮料的工艺研究[D].济南:齐鲁工业大学,2023.
[21]费永涛,黄一鹤,屈春云,等.覆盆子乳酸菌饮料发酵工艺优化及挥发性风味物质分析[J].中国酿造,2023,42(7):214-220.
[22]李岚,黄教艳,许金蓉.丁香酚复合保鲜剂对鲜切藕片保鲜效果的影响[J].食品安全导刊,2023(10):128-131,135.
[23]吕国红,张江,李良.葛根植物饮料的研制[J].食品研究与开发,2009,30(8):62-66.
[24]朱敏.火麻仁浆发酵乳的研制[D].扬州:扬州大学,2020.
[25]赵昱玮,盛雪,唐超,等.高效液相色谱法测定保健食品五味子猴菇口服液中葛根素的含量[J].中国医药科学,2020,10(1):39-42.
[26]邹正平.薏苡仁红豆复合饮料的研制及其活性研究[D].长春:吉林大学,2018.
[27]马艳弘,田丽敏,孙小华,等.无花果酶解制汁工艺优化及抗氧化活性[J].食品研究与开发,2019,40(1):111-117.
[28]乌拉木别克·对谢喀德尔,杨琦,冯海月,等.牛角粉蒸汽闪爆处理及酶解效果筛选[J].西北民族大学学报(自然科学版),2021,42(3):50-57,68.
[29]金慧鸣,谭兴和,蔡文,等.响应面法优化藤茶总黄酮的提取工艺[J].食品安全质量检测报,2015,6(5):1575-1582.
[30]罗磊,张冰洁,朱文学,等.响应面试验优化超声辅助提取金银花叶黄酮工艺及其抗氧化活性[J].食品科学,2016,37(6):13-19.
[31]GUPTA S, COX S, ABU-GHANNAM N.Process optimization for the development of a functional beverage based on lactic acid fermentation of oats[J].Biochem Eng J,2010,52(2):199-204.
[32]汪云阳,单静博,陈亚楠,等.枸杞发酵饮料的工艺优化及其风味物质分析[J].食品研究与开发,2020,41(18):40-47.
[33]杨春敏,王燕云,黄建初.九月黄乳酸菌发酵饮料工艺优化研究[J].现代食品,2021,31(8):94-99.
[34]侯金丽.刺梨植物乳杆菌发酵饮料的研制及其抗氧化作用[J].食品科技,2022,47(2):140-146.
[35]姜薇,杨皖松,李梦蝶,等.枇杷红茶菌饮料发酵工艺研究[J].绍兴文理学院学报,2023,43(8):78-84.
[36]江洁,刘晓兰,薛振磊,等.乳酸菌和酵母菌共生发酵茶饮料的研制[J].食品科学,2001(1):44-46.
[37]吴君艳.HACCP体系在沙棘果酱酸奶中的应用[J].江苏调味副食品,2019(4):13-18.
[38]朱丰,刘施琳,李天骄,等.响应面法优化石花菜酸奶发酵工艺研究[J].中国酿造,2017,36(4):103-108.
[39]邬建国,朱之光,贾伟彦,等.葛根渣功能产品固态发酵菌株的筛选[J].食品与发酵工业,2009,35(1):27-30.