由细菌引起的食源性疾病污染是目前影响人类健康的重大因素之一,而金黄色葡萄球菌(Staphylococcus aureus)是目前国内外报道中引起人类肠道疾病、食物中毒次数仅次于大肠埃希氏菌(Escherichia coli)的菌株。在美国,每年医院有近500 000例感染金黄色葡萄球菌病例,有50 000人死于金黄色葡萄球菌[1]。近年我国对微生物引起食源性疾病的重视程度逐渐升高,菌落总数、霉菌和酵母菌总数、大肠菌群、金黄色葡萄球菌以及沙门氏菌(Salmonella)是多种食品的必检项目,均依据GB 4789系列食品安全国家标准进行检验。其中金黄色葡萄球菌检验依据GB 4789.10—2016《食品安全国家标准食品微生物学检验金黄色葡萄球菌检验》[2]进行检验,以7.5%氯化钠肉汤作为前增菌液,对食品样品进行选择性增菌,样品微生物在经过7.5%氯化钠肉汤的选择性增菌后,金黄色葡萄球菌可大量繁殖以便为后续检验提供大量检验样本,而不耐受高盐的菌株如大肠埃希氏菌、沙门氏菌等在经过选择性增菌后受到抑制[3]。
该培养基中主要成分为蛋白胨、牛肉粉、氯化钠[4]。有研究表明金黄色葡萄球菌在宿主细胞内需适应复杂的碳氮源进行代谢繁殖,菌株通过基因编码利用多种氨基酸进行大量的繁殖代谢。蛋白胨和牛肉粉作为天然物质经过酸解或酶解得到,可提供碳源、氮源及生长因子[5]。低浓度的氯化钠可以维持生长环境渗透压,而高浓度的氯化钠则可有效抑制不耐盐的微生物,金黄色葡萄球菌通过环二腺苷酸的信号分子调节作用使得其可以在高盐浓度下良好的代谢繁殖,当这种信号分子检测到位于高盐环境中时,它可附着到转运蛋白上从而指示其作出反应并得以保护[6]。金黄色葡萄球菌在多种基质中均为控制菌株,如食品、化妆品、药品,由于基质的不同对菌株增菌效果也有一定的影响[7]。一直以来众多培养基生产企业及科研机构专注研发特异性高、选择性更强的培养基[8]进行菌株的筛选,抑制剂的添加不免会降低目标菌株的促生长能力。有研究者通过寻找新型蛋白胨[9]或者优化蛋白胨生产工艺[10]的方法改善上述问题,但根据生产经验可知批次间仍然会有一定差异。在以往的能力验证[11]、金黄色葡萄球菌相关检验过程[12]及培养基验收过程[13]控制实验[14]也证实培养基对最终结果有直接作用[15],由此带来的差异大多与培养基原料的营养组分有很大的关系。
本研究通过在该培养基添加不同氨基酸[16]及根据金黄色葡萄球菌代谢原理筛选不同营养因子的方法,探索其对高盐环境下金黄色葡萄球菌的促生长能力,旨在提供一种稳定可靠的增菌培养基配方。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
金黄色葡萄球菌(Staphylococcus aureus)ATCC 25923、ATCC12600、ATCC 6538、CMCC(B)26003:中国医学菌种保藏中心;大肠埃希氏菌(Escherichia coli)ATCC 25922:美国菌种保藏中心。
1.1.2 试剂
18种氨基酸标准品(甘氨酸、L-甲硫氨酸、L-丙氨酸、DL-丝氨酸、L-异亮氨酸、L-半胱氨酸、L-赖氨酸、L-酪氨酸、L-缬氨酸、L-天冬氨酸、DL-苯丙氨酸、L-组氨酸、DL-丙氨酸、L-谷氨酸、DL-苏氨酸、L-胱氨酸、DL-缬氨酸、甘氨酸酐)(纯度均>99%):美国Sigma公司;甘露醇(分析纯):国药集团化学试剂有限公司;丙酮酸钠(分析纯):上海阿拉丁生化科技股份有限公司。
1.1.3 培养基
基础培养基为7.5%氯化钠肉汤培养基(蛋白胨10.0 g/L,牛肉粉5.0 g/L,氯化钠75.0 g/L)、平板计数琼脂、Baird-Parker琼脂培养基、胰蛋白胨大豆琼脂(trypticase soy agar,TSA)培养基:北京陆桥技术股份有限公司。
1.2 仪器与设备
BSA4202S电子天平:德国Sartorius公司;BIOTEK SYNERY4酶标仪:美国BIOTEK公司;GI54TR高压灭菌锅:致微(厦门)仪器有限公司;CLC-B2V-M生化培养箱:德国MMM公司;HSAQG-1CLASS Ⅱ型生物安全柜:新加坡ESCO公司。
1.3 培养基配方优化方法
1.3.1 单因素试验
(1)不同氨基酸对金黄色葡萄球菌增菌效果影响
分别在现有7.5%氯化钠肉汤培养基中添加18种不同氨基酸[17-18],添加量均为1.0 g/L[19],分装于试管中,10 mL/管。分别吸取10~100 CFU的四株金黄色葡萄球菌的菌悬液1 mL添加于不同培养基中,做三组平行,摇匀后分别吸取200 μL于无菌96孔板中,酶标仪设置温度为36 ℃,每隔2 h读取一次OD550 nm值的测定数值,培养至24 h[20-21],绘制金黄色葡萄球菌生长曲线[22]。
(2)L-丙氨酸添加量对金黄色葡萄球菌增菌效果影响
在现有7.5%氯化钠肉汤培养基中添加不同质量浓度的L-丙氨酸(0、0.2 g/L、0.4 g/L、0.6 g/L、0.8 g/L、1.0 g/L、1.2 g/L、1.4 g/L),分别分装于试管中,10 mL/管,36 ℃培养,测定菌株增菌18 h后OD550nm值[23]。
(3)甘露醇添加量对金黄色葡萄球菌增菌效果影响
在现有7.5%氯化钠肉汤培养基中添加不同质量浓度的甘露醇(0、2.0 g/L、4.0 g/L、6.0 g/L、8.0 g/L、10.0 g/L),分别分装于试管中,10 mL/管,36 ℃培养,测定菌株增菌18 h后OD550nm值。
(4)丙酮酸钠添加量对金黄色葡萄球菌增菌效果影响
在现有7.5%氯化钠肉汤培养基中添加不同质量浓度的丙酮酸钠(0、0.6 g/L、0.8 g/L、1.0 g/L、1.2 g/L、1.4 g/L)[24],分别分装于试管中,10 mL/管,36 ℃培养,测定菌株增菌18 h后OD550nm值。
1.3.2 培养基配方优化正交试验
按照单因素试验结果,以L-丙氨酸(A)、甘露醇(B)、丙酮酸钠(C)添加量为评价因素,以OD550 nm值为评价指标设计正交试验,优化培养基配方以增加金黄色葡萄球菌增菌效果,正交试验因素与水平见表1。
表1 培养基配方优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments for medium formula optimization

水平 A L-丙氨酸/(g·L-1) B 甘露醇/(g·L-1) C 丙酮酸钠/(g·L-1)1 2 3 0.8 1.0 1.2 4.0 6.0 8.0 0.8 1.0 1.2
1.3.3 菌株验证试验
(1)菌株选择:目标菌株选取金黄色葡萄球菌ATCC 6538、ATCC 12600、ATCC 25923、CMCC(B)26003;非目标菌选取大肠埃希氏菌ATCC 25922。
(2)菌株接种
混合菌的接种:按照GB 4789.28—2013《食品安全国家标准食品微生物学检验培养基和试剂质量要求》[25]中的选择性培养基半定量测试方法进行接种。在装有待测培养基的试管中分别接种0.5 mL(菌含量为10~100 CFU)的四株来源不同的金黄色葡萄球菌目标菌株稀释液,并接种0.5 mL(菌含量为1 000~5 000 CFU)的大肠埃希氏菌ATCC25922的稀释液,每组设置两个平行管,36 ℃培养18~24 h,观察增菌液浊度并依据GB 4789.28—2013标准进行浊度判定,并同时用酶标仪测定增菌液在OD550nm值的吸光度值,比较结果差异,同时将增菌液充分混匀,吸取10 μL经培养后的目标菌转接至Baird-Parker培养基。
非目标菌的接种:在装有待测培养基的试管中接种1 000~5 000 CFU的非目标菌ATCC 25922,接种量为1 mL,同时接种两个平行管,混匀。吸取10 μL经培养后的非目标菌培养液,均匀涂布接种TSA培养基上,36 ℃培养24 h并记录菌落数。
(3)计算与结果解释:分别用酶标仪测定在两种配方培养基中菌株培养18 h后的OD550nm值,依据GB 4789.28—2013标准,将目标菌金黄色葡萄球菌增菌后转接于Baird-Parker上生长的菌落数,应均>10 CFU,同时比较大肠埃希氏菌在培养基增菌后转接至TSA的生长差异,在TSA上菌落数应<100 CFU,则表示液体培养基选择性良好。
1.3.4 数据分析
数据录入、整理和分析采用Excel 2019,统计学处理采用SPSS 26.0,使用ORIGIN 2021软件绘图。
2 结果与分析
2.1 培养基配方优化单因素试验
2.1.1 不同氨基酸对金黄色葡萄球菌增菌效果影响
通过在国标配方的原始培养基中添加不同种类的氨基酸,以基础培养基作为对照,对四株金黄色葡萄球菌标准菌株的增菌效果进行分析,结果见图1。由图1可知,不同菌株对氨基酸的敏感程度不同。对于本身生长较弱的CMCC(B)26003和ATCC 25923两株菌,相对敏感的氨基酸种类较少,随着培养时间的延长,在20 h时可以看出,在含L-丙氨酸、DL-丙氨酸、DL-缬氨酸、甘氨酸的培养基中,株菌CMCC(B)26003表现出生长能力(见图1A);株菌ATCC 6538和ATCC12600在原始培养基中有较好的生长曲线,但是在添加了L-丙氨酸的培养基中也表现出了促生长能力,进入对数期的时间分别从16~18 h缩短至了12 h(见图1B、图1C)。ATCC 25923菌株培养12 h时,在含有L-丙氨酸、DL-丙氨酸、L-天冬氨酸的培养基中出现了生长(见图1D)。
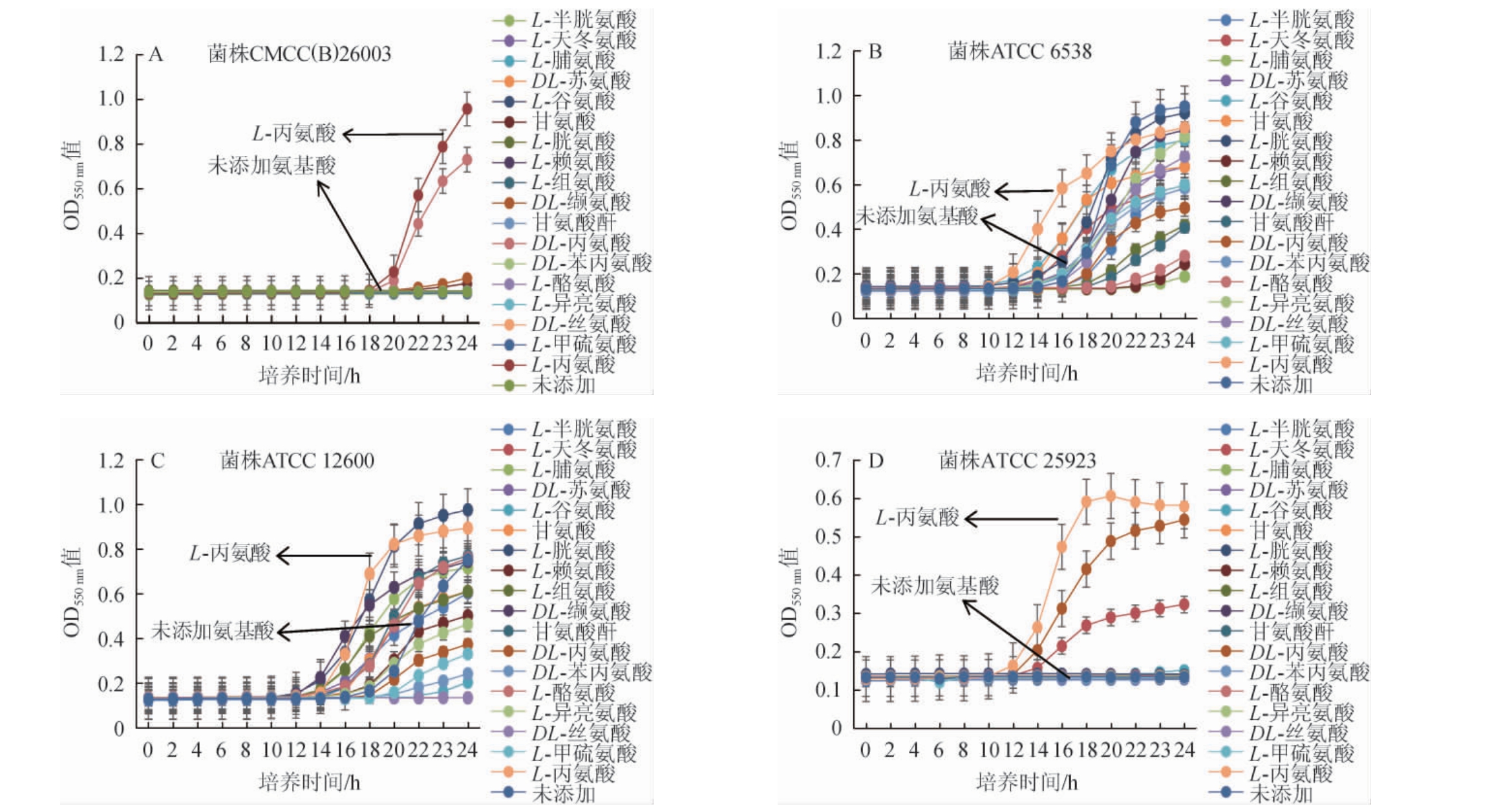
图1 不同金黄色葡萄球菌在添加不同氨基酸培养基中培养24 h生长曲线
Fig.1 Growth curve of different Staphylococcus aureus in the medium with different amino acids addition cultured for 24 h
综合四株标准菌株对不同氨基酸的反应,可以看出L-丙氨酸对四株标准菌株均能表现出促进生长的作用,且效果最佳。L-丙氨酸作为菌株体内底物,在dadX/B编码的丙氨酸消旋酶作用下转换为D-丙氨酸[26-27],而有研究表明,D-丙氨酸可参与细胞壁肽聚糖[28]和磷壁酸的合成[29],除此之外D-丙氨酸也可参与生物膜的形成与调节[30],这也给本研究结果提供了理论依据。故选择培养基中最佳氨基酸为L-丙氨酸。
2.1.2 氨基酸添加量的确定
通过添加不同质量浓度的L-丙氨酸,测定其在培养基中培养18 h后对四株标准菌株的促生长能力,结果见图2。由图2可知,与未添加L-丙氨酸相比,随着L-丙氨酸添加量的增加,四株菌浓度均表现出了增加的现象,但当L-丙氨酸添加量高于1.0 g/L时,四株菌并未表现出随浓度增加菌液终浓度提高的趋势,多数菌株的浓度趋于平稳,菌株CMCC(B)26003生物量反而出现下降趋势。所以确定L-丙氨酸最佳添加量为1.0 g/L。
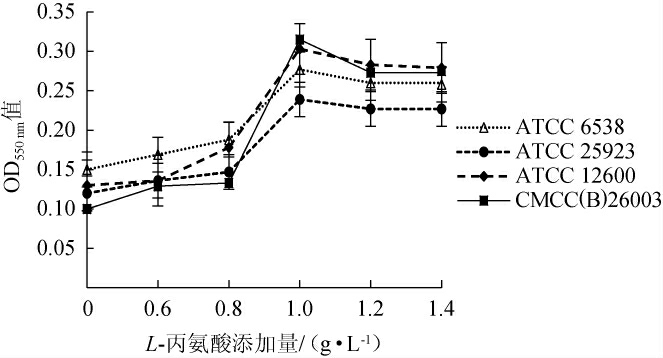
图2 L-丙氨酸添加量对金黄色葡萄球菌OD550 nm值的影响
Fig.2 Effect of L-alanine addition on OD550 nm value of Staphylococcus aureus
2.1.3 甘露醇添加量的确定
金黄色葡萄球菌可以利用甘露醇作为碳源进行菌体代谢反应,金黄色葡萄球在不同甘露醇添加量的培养基中培养18 h后的生物量测定结果见图3。由图3可知,在甘露醇添加量<6.0 g/L时,菌株的生长随着甘露醇的添加量的增加而上升,当甘露醇的添加量高于6.0 g/L时,菌株ATCC 25923生物量继续增加,但是处于较平缓的增长情况,其他菌株生物量出现稳定或下降趋势。综合四株菌的生长趋势可看出甘露醇最佳添加量为6.0 g/L。
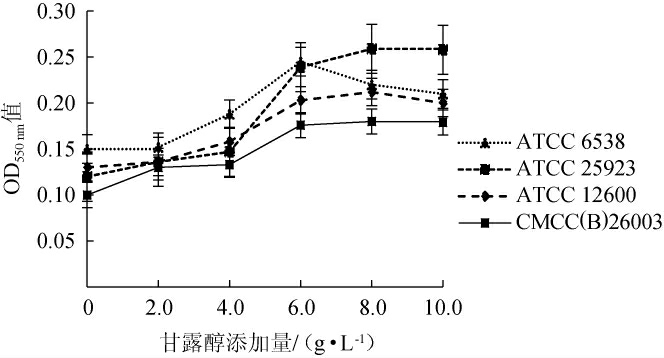
图3 甘露醇添加量对金黄色葡萄球菌OD550 nm值的影响
Fig.3 Effect of mannitol addition on OD550 nm value of Staphylococcus aureus
2.1.4 丙酮酸钠添加量的确定
丙酮酸钠可以作为三羧酸循环的代谢产物,并对细胞产生保护作用,所以在培养基中添加一定量的丙酮酸钠可促进菌株的生长,金黄色葡萄球在不同丙酮酸钠添加量的培养基中培养18 h后的生物量测定结果见图4。由图4可知,随着丙酮酸钠添加量的增加,菌株在培养至18 h时测定的OD550 nm值逐渐上升,但当丙酮酸钠添加量>1.0 g/L时促进效果出现稳定或下降趋势。丙酮酸钠的添加可在菌株生长代谢时提供所需的代谢底物促进菌株的生长,但丙酮酸钠添加量过高会在菌株生长代谢过程中起到一定的抑制作用,所以丙酮酸钠最佳添加量为1.0 g/L。
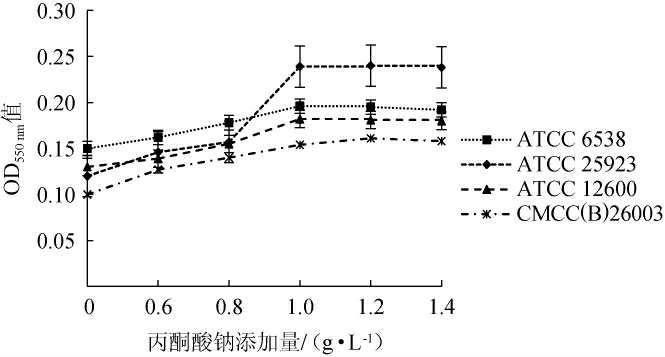
图4 丙酮酸钠添加量对金黄色葡萄球菌OD550 nm值的影响
Fig.4 Effect of pyruvic acid sodium salt addition on OD550 nm value of Staphylococcus aureus
2.2 培养基配方优化正交试验
根据单因素试验结果,以L-丙氨酸(A)、甘露醇(B)、丙酮酸钠(C)添加量为评价因素,由于四株标准菌株中CMCC(B)26003和ATCC 25923在初始培养基配方中生长较弱,所以选定以这两株菌的生物量为评价指标进行正交试验,从而确定最优培养基配方。培养基配方优化正交试验结果与分析见表2,方差分析结果见表3和表4。
表2 培养基配方优化正交试验结果与分析
Table 2 Results and analysis of orthogonal experiments for medium formula optimization
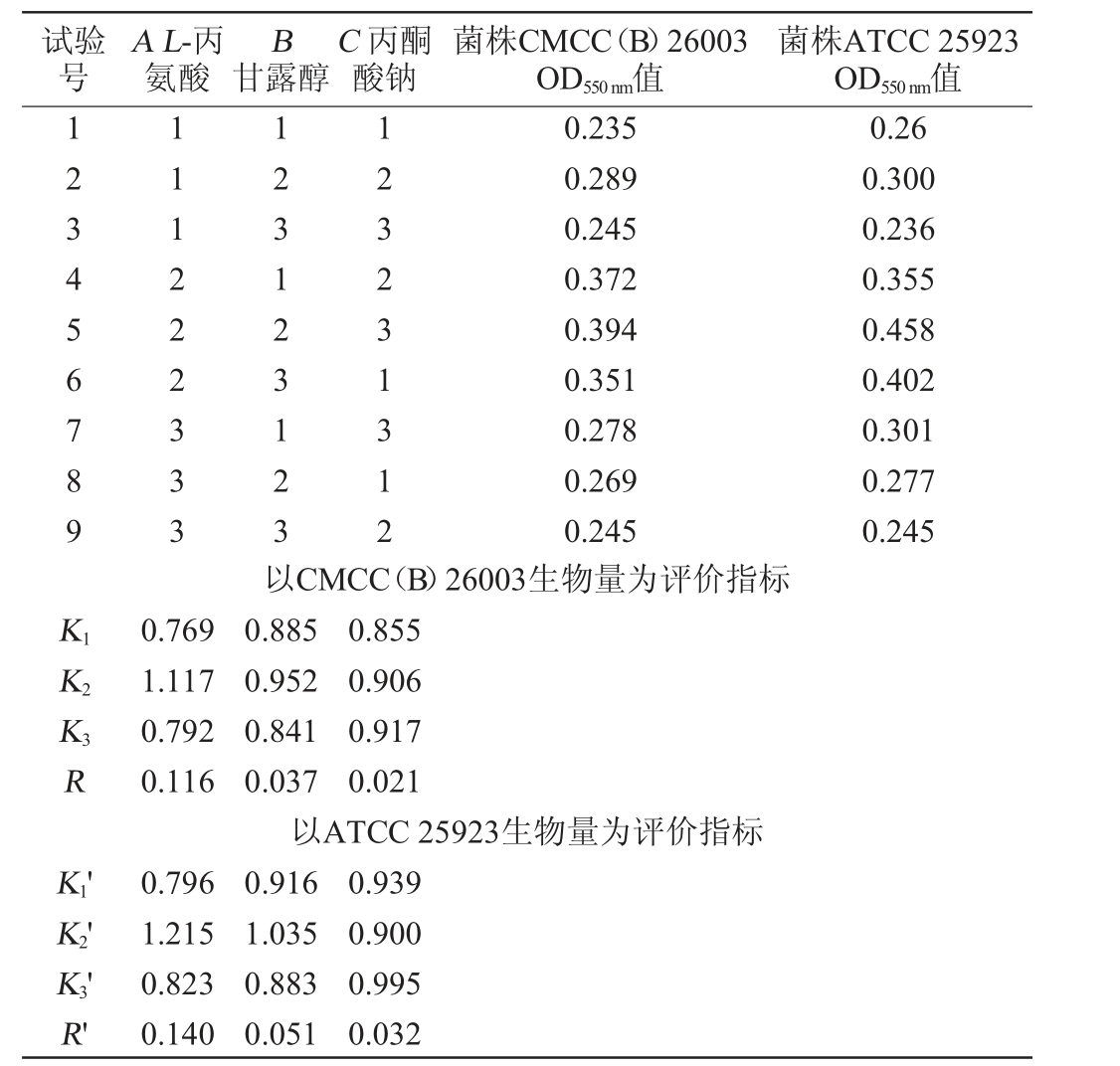
试验号A L-丙氨酸B甘露醇C 丙酮酸钠菌株CMCC(B)26003 OD550 nm值菌株ATCC 25923 OD550 nm值123456789 111222333 123123123 123231312 0.235 0.289 0.245 0.372 0.394 0.351 0.278 0.269 0.245 0.26 0.300 0.236 0.355 0.458 0.402 0.301 0.277 0.245以CMCC(B)26003生物量为评价指标K1K2K3R 0.769 1.117 0.792 0.116 0.885 0.952 0.841 0.037 0.855 0.906 0.917 0.021以ATCC 25923生物量为评价指标K1'K2'K3'R'0.796 1.215 0.823 0.140 0.916 1.035 0.883 0.051 0.939 0.900 0.995 0.032
表3 以金黄色葡萄球菌CMCC(B)26003生物量为评价指标的正交试验结果方差分析
Table 3 Variance analysis of orthogonal experiment results using Staphylococcus aureus CMCC(B)26003 biomass as evaluation index
注:“*”表示差异显著(P<0.05),下同。
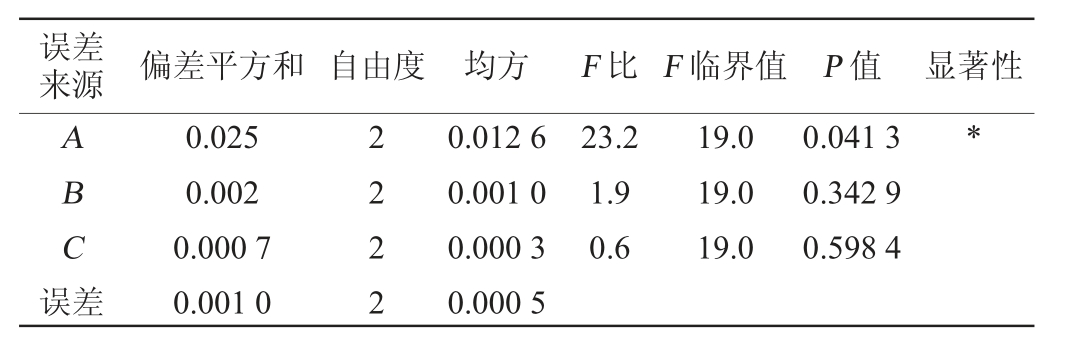
误差来源 偏差平方和 自由度 均方 F 比 F 临界值 P 值 显著性ABC误差0.025 0.002 0.000 7 0.001 0 2222 0.012 6 0.001 0 0.000 3 0.000 5 23.2 1.9 0.6 19.0 19.0 19.0 0.041 3 0.342 9 0.598 4*
表4 以金黄色葡萄球菌ATCC25923生物量为评价指标的正交试验结果方差分析
Table 4 Variance analysis of orthogonal experiment results using ATCC25923 biomass as evaluation index
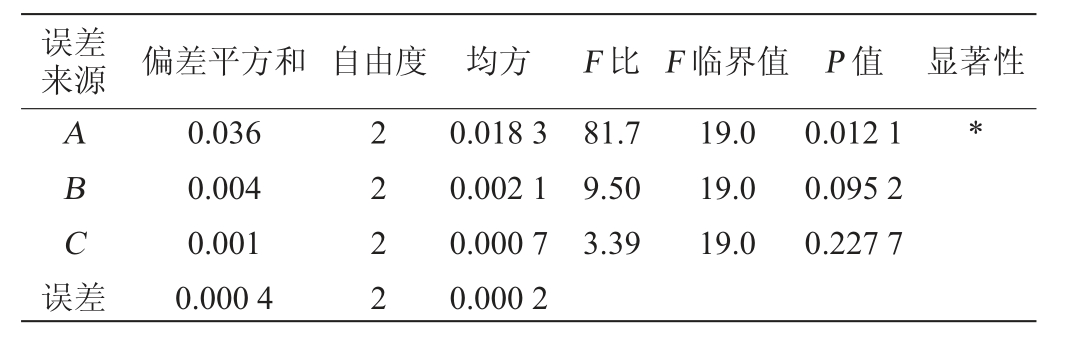
误差来源 偏差平方和 自由度 均方 F 比 F 临界值 P 值 显著性ABC误差0.036 0.004 0.001 0.000 4 2222 0.018 3 0.002 1 0.000 7 0.000 2 81.7 9.50 3.39 19.0 19.0 19.0 0.012 1 0.095 2 0.227 7*
由表2可知,各因素对金黄色葡萄球菌生物量的影响程度均为L-丙氨酸>甘露醇>丙酮酸钠,并且两株金黄色葡萄球菌极差分析结果表现一致,金黄色葡萄球菌的最佳增菌培养基配方均为A2B2C3,即L-丙氨酸添加量为1.0 g/L、甘露醇添加量为6.0 g/L、丙酮酸钠添加量为1.2 g/L。在此条件下,CMCC(B)26003菌液OD550 nm值从0.1可增长到0.39,ATCC25923菌液OD550nm值从0.12可增长到0.46。
由表3和表4的方差分析结果可知,L-丙氨酸添加量(A)对两株菌的增长具有显著性影响(P<0.05),而甘露醇和丙酮酸钠添加量对两株菌的增长无显著性影响(P>0.05)。在7.5%氯化钠肉汤原始配方的基础上添加L-丙氨酸、丙酮酸钠及甘露醇都会不同程度的提高金黄色葡萄球菌的增菌效果,最终确定最佳增菌培养基配方为蛋白胨10.0 g/L、牛肉粉5.0 g/L、氯化钠75.0 g/L、L-丙氨酸1.0 g/L、丙酮酸钠1.2 g/L、甘露醇6.0 g/L。
2.3 验证结果与分析
ATCC 6538菌液培养18 h及转接Baird-Parker培养基结果见图5,试验菌株增菌及转接Baird-Parker培养基后的计数结果见表5,菌液在优化前后的培养基配方下培养18 h的OD550nm值测定结果见图6。
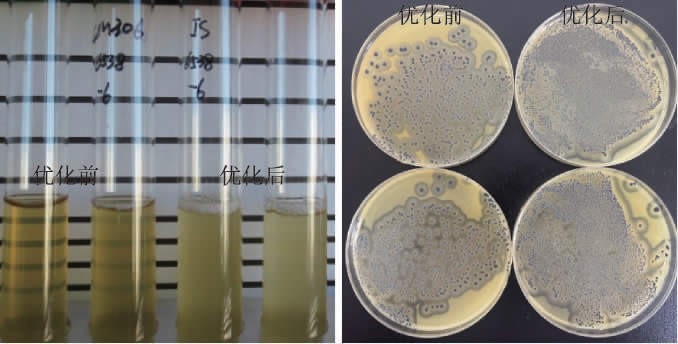
图5 ATCC 6538菌液培养18 h后浊度比对及转接Baird-Parker培养情况
Fig.5 Turbidimetric comparison of ATCC 6538 culture medium for 18 h and its transition to Baird-Parker culture
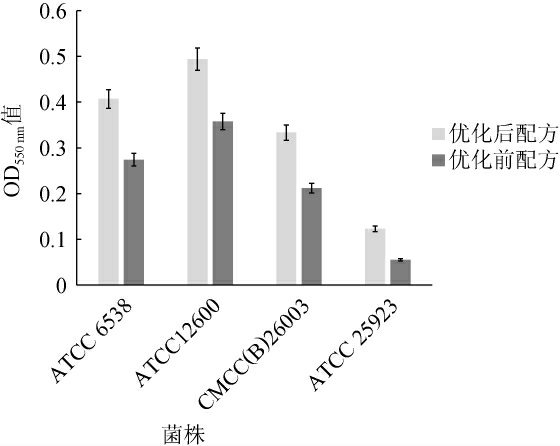
图6 优化前后四株不同来源金黄色葡萄球菌培养18 h的OD550 nm值
Fig.6 OD550 nm value of four strains of Staphylococcus aureus from different sources cultured within 18 h before and after optimization
表5 标准菌株验证结果
Table 5 Verification results of standard strains

注:(1)浊度计算:0表示无浑浊;1表示很轻微的浑浊;2表示严重浑浊,依据GB4789.28—2013评判标准进行判定;(2)ATCC 25923、ATCC 6538、ATCC 12600、CMCC(B)26003增菌后转接Baird-Parker计数;ATCC25922增菌后转接TSA计数。
菌株 接种量/CFU培养18 h的浊度优化前 优化后增菌液10 μL转接Baird-Parker(或TSA)结果/(CFU·mL-1)优化前 优化后ATCC 25923 ATCC 6538 ATCC 12600 CMCC(B)26003 ATCC 25922 26 58 34 42 4.4×103 11110 22220 26 6.0×102 6.8×104 436 0 5.6×103 7.2×104 2.2×105 6.4×104 0
由图5可知,从菌液浊度可以看出菌株在优化后的培养基中增菌18 h后浊度明显增加,按照GB 4789.28—2013方法判定菌液浊度由1增至2,且转接Baird-Parker平板后菌落计数结果明显增多,即可说明优化后的培养基的促生长能力较优化前有明显提高。由表5可知,四株金黄色葡萄球菌的浊度在优化后的培养基中均可表现出浊度2,相较优化前菌液浊度1更容易观察,菌液转接至Baird-Parker的菌落数也均有10~100倍的增长;而大肠埃希氏菌从增菌液浊度和转接至TSA的结果可以说明在优化前后的培养基中均可有效抑制。由图6可知,四株来源不同的金黄色葡萄球菌在原始培养基和优化后的培养基增菌18 h后生物量有了明显的差异,在优化后的培养基中菌液OD550 nm值均有38%~120%的提高。综上,增菌液吸取10 μL转接平板计数结果看均有数量级的增加。且非目标菌株大肠杆菌ATCC 25922的抑制性亦未受到影响。
3 结论
通过氨基酸的筛选,从18种氨基酸中确定了L-丙氨酸对于金黄色葡萄球菌的主要影响作用,经过单因素和正交试验法获得了较优的培养基配方为在7.5%肉汤培养基的基础上添加L-丙氨酸1.0 g/L、甘露醇6.0 g/L、丙酮酸钠1.2 g/L。优化后培养基的验收方式采用了GB 4789.28—2013中推荐的半定量接种方式,采用低含量目标菌和高含量的非目标菌混合接种,此种接种方式可有效模仿样品污染情况,保证目标菌生长的同时不受大肠埃希菌的干扰。此次实验除了标准要求菌株ATCC6538外,另外选择了来源不同的四株标准菌株按照GB4789.28要求进行质量验收,菌株CMCC(B)26003和ATCC25923虽然按照标准要求验收合格,但是浊度仅为1,经过优化后的培养基增菌后浊度有了明显提高,从转接至Baird-Parker的菌落计数可以得出阳性菌生长率有10~100倍的提高,同时OD550nm值的大幅度提升也更利于实验者结果的观察。本次试验提供了针对金黄色葡萄球菌的促生长的关键性因子,丙酮酸钠、甘露醇和丙氨酸均为纯化学物质,纯度相较于蛋白胨、牛肉粉、大豆胨等复合成分易于控制。该思路的提出旨在对系列金黄色葡萄球菌检验培养基的研发过程中给与更明确的指导方向。
[1]MARTIN M C,FUEYO J M,et al.Genetic procedures for identification of enterotoxigenic strains of Staphylococcus aureus from three food poisoning outbreaks[J].Int J Food Microbiol,2004,94(3):279-286.
[2]国家食品药品监督管理总局,国家计划和生育委员会.GB4789.10—2016食品安全国家标准食品微生物学检验金黄色葡萄球菌检验[S].北京:中国标准出版社,2016.
[3]国家食品药品监督管理总局科技和标准司.微生物检验方法食品安全国家标准实操指南[M].北京:中国医药科技出版社,2017.
[4]赵贵明.微生物培养基及其原材料质量控制[M].北京:中国质检出版社,2018.
[5]HALSEY C R,LEI S,WAX J K,et al.Amino acid catabolism in Staphylococcus aureus and the function of carbon catabolite repression[J].mBio,2017,8(1):01434-16.
[6]SCHUSTER C F,BELLOWS L E,TOSI T,et al.The second messenger c-di-AMP inhibits the osmolyte uptake system OpuC in Staphylococcus aureus[J].Sci Signal,2016,9(441):81-93.
[7]HAABER J, COHN M T, PETERSEN A, et al.Simple method for correct enumeration of Staphylococcus aureus[J].J Microbiol Meth,2016,125:58-63.
[8]黄汝添,吴清平,张菊梅,等.金黄色葡萄球菌显色培养基研究进展[J].中国卫生检验杂志,2007,17(6):1148-1150.
[9]曹亮亮,王康,马婧,等.酸解羽毛粉代替蛋白胨研制新型细菌培养基[J].微生物学通报,2014,41(11):2353-2361.
[10]石丹,王彩云,云战友,等.自制蛋白胨在乳酸菌培养中的应用[J].食品工业科技,2014,35(2):210-217.
[11]钟玮,张宁,刘玉萍,等.食品中金黄色葡萄球菌定量检测能力验证结果与分析[J].食品安全质量检测学报,2016,7(7):2758-2762.
[12]刘真真,林涛,李光伟,等.金黄色葡萄球菌不同培养基与反应条件对其血浆凝固酶的影响[J].检验检疫科学,2005,15(5):34-35.
[13]刘全生,陈礼忠,杨伟兴,等.显色培养基与传统培养基在金黄色葡萄球菌培养基的比较与分析[J].中国保健营养,2014(6):3012.
[14]宋莉.食品微生物检验中的培养基质量控制要点分析[J].现代食品,2019(20):73-75.
[15]赵薇,刘桂华,张炜煜.食品中菌落总数与金黄色葡萄球菌定量检测能力验证结果与分析[J].中国卫生工程学,2014,13(4):320-322.
[16]张露露,卫旭彪,李仲玄,等.单胃动物肠道细菌对氨基酸的代谢作用[J].中国畜牧杂志,2018,54(11):17-20.
[17]葛冬梅,朱笑梅,宗雯雯.酿造酱油中氨基酸成分的分析[J].徐州工程学院学报(自然科学版),2008(3):103-105.
[18]冯志强,周芳梅,黄永连,等.全自动氨基酸分析仪鉴别不同种类酱油中氨基酸的分析研究[J].中国食品添加剂,2013(5):198-205.
[19]陈智仙,张海波,张双庆,等.3种不同来源蛋白质的氨基酸组成及体外动态消化研究[J].河南工业大学学报(自然科学版),2019(2):62-68.
[20]冯伟华,常艳璐.长双歧杆菌液态发酵条件的优化及生长曲线的测定[J].中国医药导报,2012(31):115-117.
[21]马勇,图雅,陈秀莉,门中华.分光光度法测定高浓度培养液下的产油酵母菌生长曲线[J].北方园艺,2013(8):116-118.
[22]朱艳蕾.细菌生长曲线测定实验方法的研究[J].微生物学杂志,2016,36(5):108-112.
[23]李学贵,袁生.微生物转化过程中利用OD值实时监测细菌生物量变化的研究[J].南京师大学报(自然科学版),2003,26(4):90-93
[24]胡薇薇,宋辽原,付月华.丙酮酸钠提高食品细菌检出率的探讨[J].浙江预防医学,2003(6):80-81.
[25]国家计划和生育委员会,国家标准化管理委员会.GB 4789.28—2013食品安全国家标准食品微生物学检验培养基和试剂质量要求[S].北京:中国标准出版社,2013.
[26]WATANABE A,YOSHIMURA T,MIKAMI B,et al.Reaction mechanism of alanine racemase from Bacillus stearothermophilus:X-ray crystallographic studies of the enzyme bound with N-(5'-phosphopyridoxyl)alanine[J].J Biol Chem,2002,277(21):19166-19172.
[27]TANIGAWA M,SHINOHARA T,SAITO M,et al.D-amino acid dehydrogenase from Helicobacter pylori NCTC 11637[J].Amino Acids,2010,38(1):247-255.
[28]郭笑,杜信眉,程磊,等.D-丙氨酸在细菌中的功能和代谢研究进展[J].口腔疾病防治,2019,27(4):264-267.
[29]WEI Y,QIU W,ZHOU X D,et al.Alanine racemase is essential for the growth and interspecies competitiveness of Streptococcus mutans[J].Int J Oral Sci,2016,4:231-238.
[30]QIU W,ZHENG X,WEI Y,et al.d-Alanine metabolism is essential for growth and bilfilm formation of Streptococcus mutans[J].Mol Oral Microbil,2016,31(5):435-444.