山楂(Crataegus pinnatifida)含有丰富的营养物质和功能性成分,是“药食同源”的重要原料[1-2],其所富含的黄酮类成分对心血管系统疾病有明显治疗作用[3],具有较高的保健和消食健胃,行气散瘀,化浊降脂等功效[4-5]。山楂酒是以山楂为原料,接种适量酿酒酵母(Saccharomyces cerevisiae),在无氧条件下经发酵获得,其黄酮含量及风味受原料、酵母菌种类以及发酵条件影响[6-7]。胡冀太等[8-9]研究表明,发酵型山楂酒中总黄酮含量较高其受果酒酵母种类及发酵条件的影响较大,目前国外对山楂酒的研究仅局限于工艺优化和理化指标等方面的研究,所以选用山楂专用菌株优化发酵工艺成为山楂酒开发的重中之重[10]。刘秀华等[11]研究表明,用酿酒酵母所发酵山楂酒中黄酮含量会影响酒的感官及风味。目前山楂酒无酿酒专用酵母[12-14],企业主要使用市售活性葡萄酒干酵母等,使得山楂酒的同质化比较严重,产品风格单一[15]。本课题组前期从山楂自然发酵液中分离获得了多株风味独特、产酒性能稳定的酿酒用酵母[16-18],为山楂酒新品开发提供了优质菌种资源,其中库德毕赤酵母(Pichia kudriavzevii)Y1具有独特的风味,令人愉悦,在山楂酒开发利用方面具有潜能。因此,本研究以库德毕赤酵母(Pichia kudriavzevii)Y1为发酵菌株制备山楂酒,以总黄酮含量及酒精度为评价指标,采用单因素及响应面试验优化山楂酒发酵工艺,以期开发出一款风味独特,总黄酮含量高的山楂酒。为促进山楂产业深加工的同时对保健型山楂酒的深入开发具有深远意义。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
山楂:山西彤康庄园;库德毕赤酵母(Pichia kudriavzevii)Y1:山西农业大学食品科学与工程学院生物工程实验室保藏。
1.1.2 化学试剂
果胶酶(酶活30 000 U/g):河南万邦实业有限公司;芦丁标准品(纯度>98%):北京索莱宝有限公司;亚硝酸钠、硝酸铝(均为分析纯):天津市大茂化学试剂厂;氢氧化钠(分析纯):天津市大陆化学试剂厂;无水乙醇(分析纯):天津市富宇精细化工有限公司。
1.1.3 培养基
麦芽汁培养液:麦芽浸出粉20 g/L,葡萄糖20 g/L,蛋白胨10 g/L,蒸馏水1 000 mL。121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
YXQ-LS-75SLL立式压力蒸汽灭菌器、HPX-9272MB电热恒温培养箱:上海迅博实业有限公司;SW-CJ-ID型净化工作台:苏州净化设备有限公司;ZWY-1120C恒温培养振荡器:上海智城分析仪器制造有限公司;UV-1200紫外可见分光光度计;上海美谱达仪器有限公司;SC-3612低速离心机:安徽中科中佳科学仪器有限公司。
1.3 方法
1.3.1 山楂酒加工工艺流程及操作要点
山楂→分选清洗→破碎→浸提酶解→过滤→灭菌→接种→发酵→山楂酒
操作要点:
分选清洗:选用成熟饱满,表皮无褶皱,无虫害的新鲜深红色山楂。
破碎:将分选清洗后的山楂放入破壁机中破碎。
浸提酶解:破碎山楂与水按照料液比1.0∶0.8(g∶mL)加纯净水,同时加入0.2%的果胶酶,在酶解温度40 ℃条件下酶解1 h。
过滤及成分调整:用三层纱布过滤山楂酶解液,并添加白砂糖调整糖度为25°Bx。
灭菌:山楂酶解液80 ℃灭菌20 min。
接种:将扩培两次的库德毕赤酵母(Pichia kudriavzevii)Y1种子液以3%(V/V)的接种量接种至灭菌后的山楂酶解液中。
发酵:在28 ℃条件下恒温发酵一定时间,当发酵液酒精度恒定终止发酵,得到山楂酒。
1.3.2 分析检测
酒精度测定:采用国标GB 5009.225—2016《食品安全国家标准酒中乙醇浓度的测定》[18]中的酒精计法;总黄酮含量测定:采用分光光度法[19]。
感官评分[20-21]:邀请10位具有良好感官评定基础以及经过专业感官培训的评分员组成感官评定小组(5名男性和5名女性)。同时参照国标GB/T 15038—2006《葡萄酒、果酒通用分析方法》、QB/T 5476.2—2021《果酒第2部分:山楂酒》中的感官分析方法对发酵山楂酒进行感官评定,满分40分,具体感官评价标准见表1。
表1 山楂酒感官评价标准
Table 1 Sensory evaluation standards of hawthorn wine

项目 评分标准 分数/分外观(10分)香气(10分)滋味(10分)典型性(10分)色泽鲜亮,澄清透明,无沉淀及悬浮物色泽偏暗,较澄清透明,有少量沉淀及悬浮物色泽暗淡,较澄清,有少量沉淀及悬浮物暗淡浑浊,无光泽,有明显的沉淀和悬浮物果香、酒香浓郁,诸香协调果香或酒香突出,协调性差果香、酒香淡雅,不够协调无明显香味,有异味酸甜适口,纯正优雅,后味持久酸甜较协调,优雅爽口偏酸或偏甜,酒体单一,口感粗糙酒体淡薄,酸涩有异味典型明确,风格明显有典型性,风格基本符合无典型性,风格出入较大9~10 7~8 4~6 1~3 9~10 7~8 4~6 1~3 9~10 7~8 4~6 1~3 8~10 5~7 1~4
1.3.3 山楂酒发酵工艺优化
(1)单因素试验
在不同接种量(4%、7%、10%、13%、16%)、不同初始糖度(21°Bx、23°Bx、25 °Bx、27°Bx、29°Bx)、不同发酵温度(24 ℃、26 ℃、28 ℃、30 ℃、32 ℃)和不同发酵时间(1 d、4 d、7 d、10 d、13 d)条件下制备山楂酒,分别考察接种量、初始糖度、发酵温度及发酵时间对山楂酒酒精度及总黄酮含量的影响。
(2)响应面试验
在单因素试验基础上,选取发酵温度(A)、接种量(B)、初始糖度(C)和发酵时间(D)为自变量,以酒精度(Y1)和总黄酮含量(Y2)为响应值,采用Design Expert 8.0.6软件进行Box-Behnken响应面试验设计,优化山楂酒发酵工艺条件,Box-Behnken试验因素与水平见表2。
表2 发酵工艺优化Box-Behnken试验设计因素与水平
Table 2 Factors and levels of Box-Behnken experiments design for fermentation process optimization
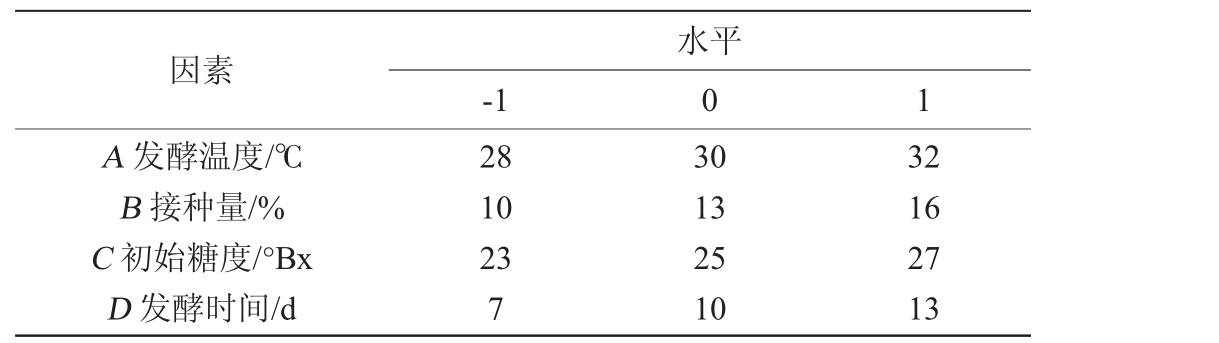
因素A 发酵温度/℃B 接种量/%C 初始糖度/°Bx D 发酵时间/d-1水平0 1 28 10 23 7 30 13 25 10 32 16 27 13
1.3.4 数据处理
利用SPSS 25.0和Origin 2021软件进行分析及绘图,采用Design Expert 8.0.6进行响应面试验数据分析。
2 结果与分析
2.1 山楂酒发酵工艺优化单因素试验
2.1.1 发酵温度对山楂酒中总黄酮含量及酒精度的影响
由图1可知,当发酵温度在24~30 ℃范围内升高,酒精度及总黄酮含量随着发酵温度的升高而增加;当发酵温度在30 ℃时,酒精度及总黄酮含量达到最大值,分别为(6.05±0.04)%vol、(6.83±0.00)mg/mL;当发酵温度>30 ℃之后,酒精度及总黄酮含量均有所降低。温度较低时,发酵前期酵母菌繁殖较慢,乙醇体积分数较低,同时溶解在乙醇中的总酮含量较少;而发酵温度过高时,酵母菌快速繁殖,大量消耗山楂发酵液中糖分,导致用于发酵产生乙醇的底物不足,还会加快黄酮物质的分解,不利于乙醇的产生也使总酮含量减少,导致品质下降[22-23]。因此,确定最佳发酵温度为30 ℃。
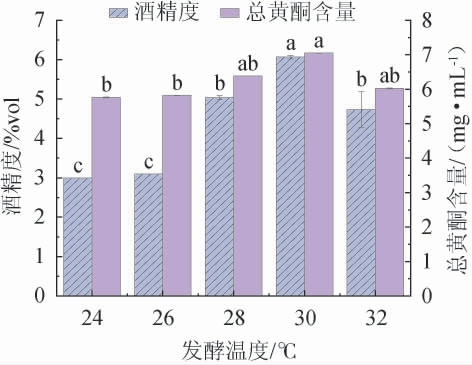
图1 发酵温度对山楂酒酒精度及总黄酮含量的影响
Fig.1 Effects of fermentation temperature on alcohol content and total flavonoids contents in hawthorn wine
不同字母表示差异显著(P<0.05)。下同。
2.1.2 接种量对山楂酒中总黄酮含量及酒精度的影响
由图2可知,当接种量在4%~13%范围内升高,酒精度及总黄酮含量均随接种量增加而升高;当接种量在13%时,酒精度及总黄酮含量达到最大值,分别为(10±0.16)%vol、(3.12±0.03)mg/mL;当酵母接种量>13%之后,酒精度及总黄酮含量均有所降低。当酵母接种量过低时,不能完全利用发酵底物,导致产乙醇能力下降,总黄酮含量也低;当酵母接种量过高时,酵母菌迅速繁殖消耗大量的糖,同时菌体也会产生很多代谢副产物,导致转化乙醇能力减弱,总黄酮含量也降低[24]。因此,确定最佳酵母接种量为13%。
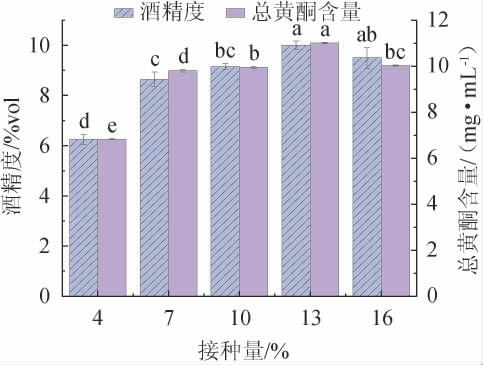
图2 接种量对山楂酒酒精度及总黄酮含量的影响
Fig.2 Effects of inoculum on alcohol content and total flavonoid contents in hawthorn wine
2.1.3 初始糖度对山楂酒中总黄酮含量及酒精度的影响
由图3可知,当初始糖度在21~25°Bx范围内增加,酒精度及总黄酮含量也随初始糖度的增加而升高;当初始糖度为25°Bx时,酒精度及总黄酮含量达到最大值,分别为(7.05±0.20)%vol和(1.65±0.00)/mL;当初始糖度>25°Bx之后,酒精度及总黄酮含量均呈下降趋势。初始糖度较低时,发酵前期酵母菌大量增殖,需要一定的糖来维持生长,在后期酒精发酵过程中糖含量不足而导致乙醇含量逐步降低;初始糖度过高时,发酵前期的酵母菌生长就会受到抑制,发酵缓慢,从而影响酒精发酵阶段,由糖转化为乙醇的含量降低,同时总黄酮含量也与乙醇含量呈正相关趋势[25-26]。因此,确定最佳初始糖度为25°Bx。
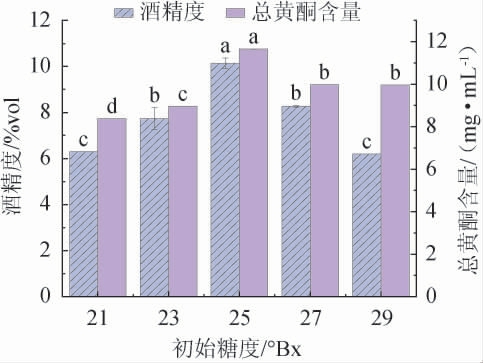
图3 初始糖度对山楂酒酒精度和总黄酮含量的影响
Fig.3 Effects of initial sugar contents on alcohol content and total flavonoid contents in hawthorn wine
2.1.4 发酵时间对山楂酒中总黄酮含量及酒精度的影响
由图4可知,当发酵时间在1~10 d范围内增加,酒精度及总黄酮含量随之增加;当发酵时间为10 d时,酒精度及总黄酮含量达到最大值,分别为(11.8±0.00)%vol和(17.19±0.00)mg/mL;当发酵时间>10 d之后,酒精度及总黄酮含量有所降低。这可能与酵母菌对乙醇的转化利用及乙醇转化成挥发性酸及酯类成分有关[27];总黄酮含量的减少可能是发酵过程中微生物产生的一些代谢产物,如丙酮酸、乙醛等与黄酮发生反应,此外,黄酮自身的不稳定性及残余发酵菌种对其的分解,如发生聚合反应生成黄酮醇配糖体,也会导致黄酮含量的降低[28-29]。因此,选择最适发酵时间为10 d。
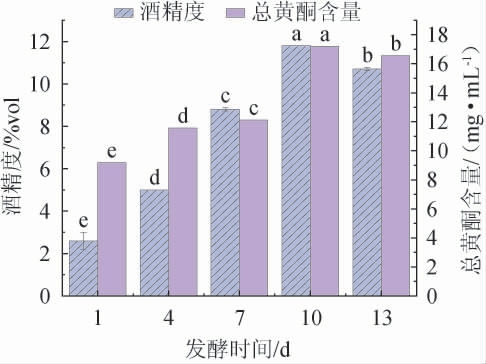
图4 发酵时间对山楂酒酒精度和总黄酮含量的影响
Fig.4 Effects of fermentation time on alcohol content and total flavonoid contents in hawthorn wine
2.2 山楂酒发酵工艺优化响应面试验
2.2.1 响应面试验结果及方差分析
在单因素试验基础上,以发酵温度(A)、接种量(B)、初始糖度(C)、发酵时间(D)为自变量,以酒精度(Y1)及总黄酮含量(Y2)作为响应值,进行Box-Behnken响应面试验,响应面试验设计结果见表3,方差分析结果见表4。
表3 发酵工艺优化Box-Behnken试验设计及结果
Table 3 Design and results of Box-Behnken experiments for fermentation process optimization
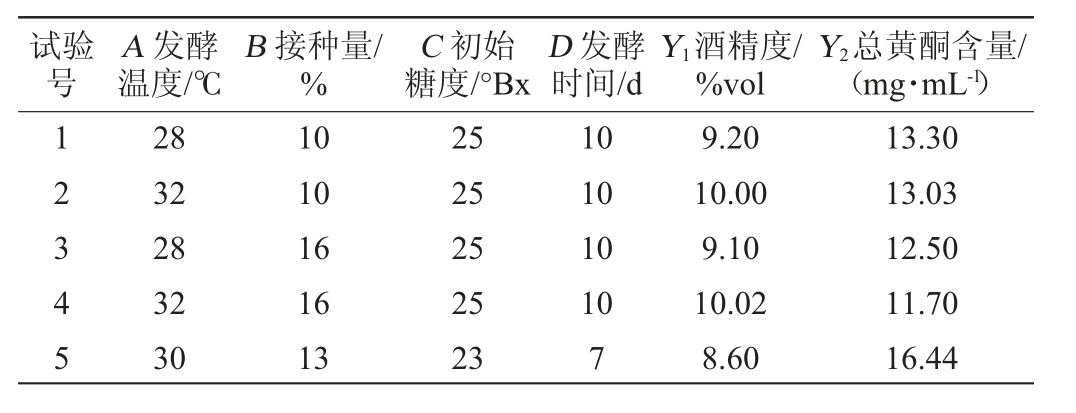
试验号A 发酵温度/℃B 接种量/%C 初始糖度/°Bx D 发酵时间/d Y1酒精度/%vol Y2总黄酮含量/(mg·mL-1)12345 28 32 28 32 30 10 10 16 16 13 25 25 25 25 23 10 10 10 10 7 9.20 10.00 9.10 10.02 8.60 13.30 13.03 12.50 11.70 16.44
续表
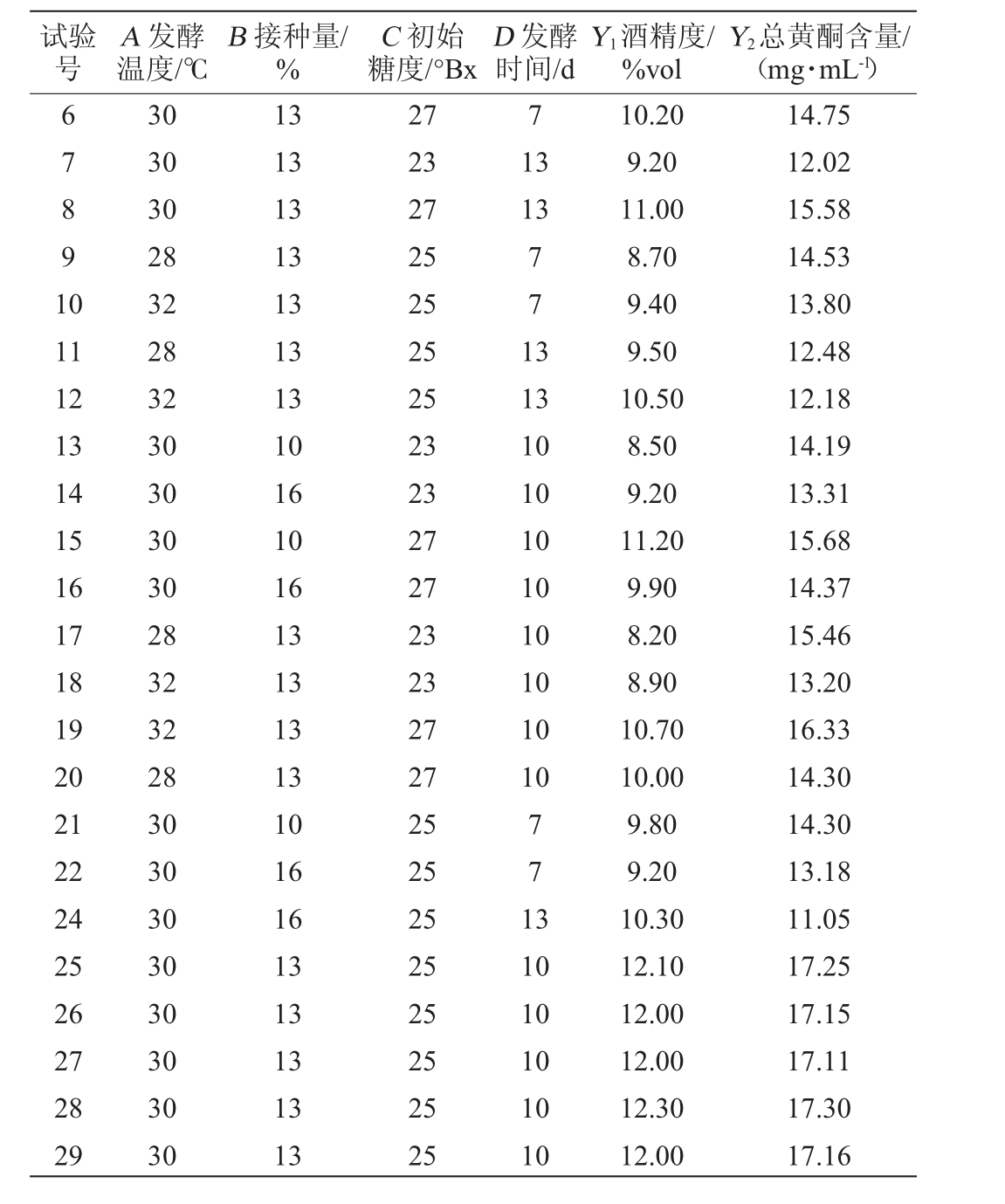
试验号A 发酵温度/℃B 接种量/%C 初始糖度/°Bx D 发酵时间/d Y1酒精度/%vol Y2总黄酮含量/(mg·mL-1)67891 0 7 13 13 11 12 13 14 15 16 17 18 19 20 21 22 24 25 26 27 28 29 30 30 30 28 32 28 32 30 30 30 30 28 32 32 28 30 30 30 30 30 30 30 30 13 13 13 13 13 13 13 10 16 10 16 13 13 13 13 10 16 16 13 13 13 13 13 27 23 27 25 25 25 25 23 23 27 27 23 23 27 27 25 25 25 25 25 25 25 25 771 3 13 10 10 10 10 10 10 10 10 771 3 10 10 10 10 10 10.20 9.20 11.00 8.70 9.40 9.50 10.50 8.50 9.20 11.20 9.90 8.20 8.90 10.70 10.00 9.80 9.20 10.30 12.10 12.00 12.00 12.30 12.00 14.75 12.02 15.58 14.53 13.80 12.48 12.18 14.19 13.31 15.68 14.37 15.46 13.20 16.33 14.30 14.30 13.18 11.05 17.25 17.15 17.11 17.30 17.16
表4 回归模型方差分析
Table 4 Variance analysis of regression model
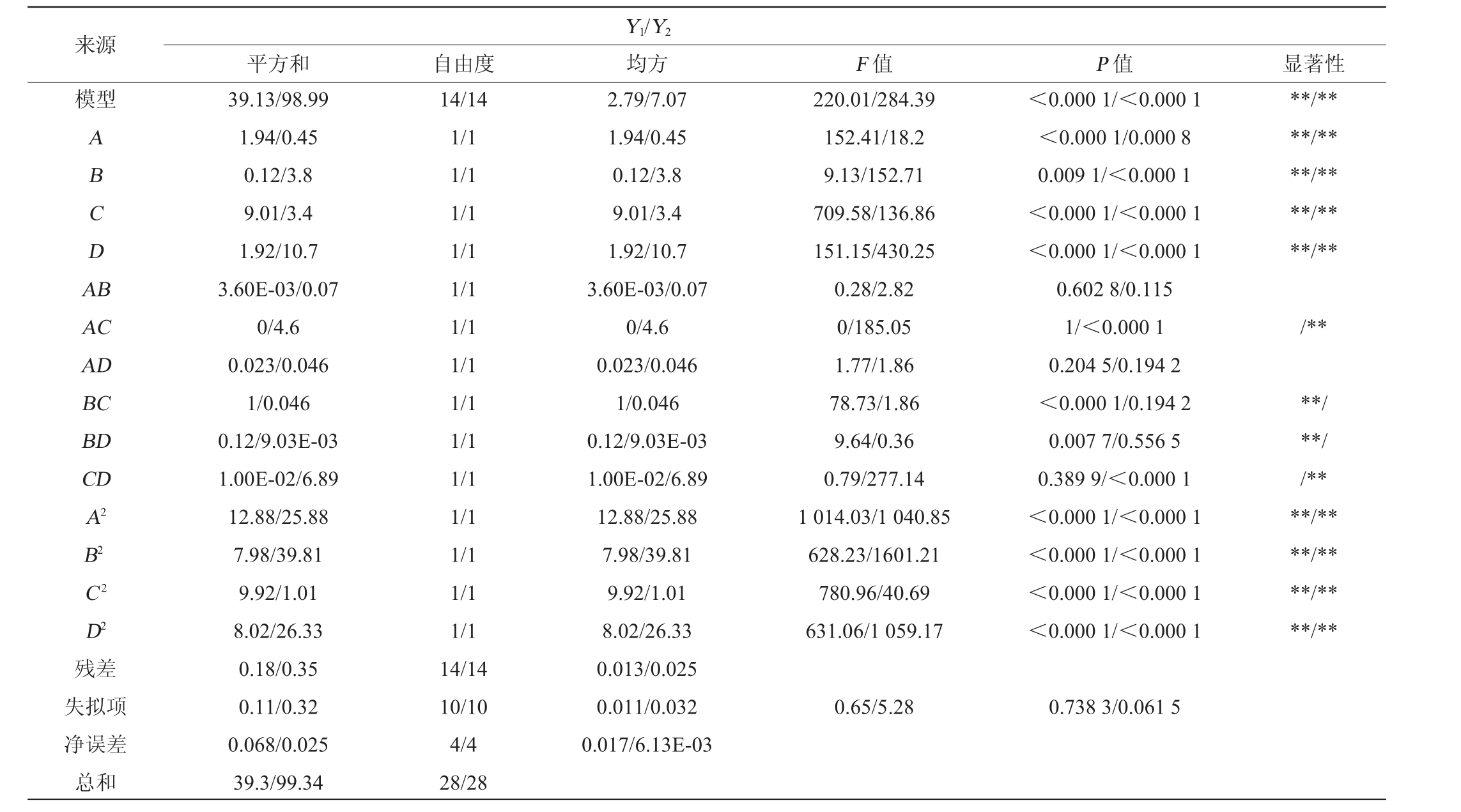
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
来源模型ABCDA B AC AD BC BD CD A2 B2 C2 D2残差失拟项净误差总和平方和 自由度39.13/98.99 1.94/0.45 0.12/3.8 9.01/3.4 1.92/10.7 3.60E-03/0.07 0/4.6 0.023/0.046 1/0.046 0.12/9.03E-03 1.00E-02/6.89 12.88/25.88 7.98/39.81 9.92/1.01 8.02/26.33 0.18/0.35 0.11/0.32 0.068/0.025 39.3/99.34 14/14 1/1 1/1 1/1 1/1 1/1 1/1 1/1 1/1 1/1 1/1 1/1 1/1 1/1 1/1 14/14 10/10 4/4 28/28 Y1/Y2均方 F 值 P 值 显著性2.79/7.07 1.94/0.45 0.12/3.8 9.01/3.4 1.92/10.7 3.60E-03/0.07 0/4.6 0.023/0.046 1/0.046 0.12/9.03E-03 1.00E-02/6.89 12.88/25.88 7.98/39.81 9.92/1.01 8.02/26.33 0.013/0.025 0.011/0.032 0.017/6.13E-03 220.01/284.39 152.41/18.2 9.13/152.71 709.58/136.86 151.15/430.25 0.28/2.82 0/185.05 1.77/1.86 78.73/1.86 9.64/0.36 0.79/277.14 1 014.03/1 040.85 628.23/1601.21 780.96/40.69 631.06/1 059.17<0.000 1/<0.000 1<0.000 1/0.000 8 0.009 1/<0.000 1<0.000 1/<0.000 1<0.000 1/<0.000 1 0.602 8/0.115 1/<0.000 1 0.204 5/0.194 2<0.000 1/0.194 2 0.007 7/0.556 5 0.389 9/<0.000 1<0.000 1/<0.000 1<0.000 1/<0.000 1<0.000 1/<0.000 1<0.000 1/<0.000 1**/****/****/****/****/**/****/**//****/****/****/****/**0.65/5.28 0.738 3/0.061 5
经过Design-Expert 8.0.6软件对表2数据进行多元回归拟合,得出山楂酒中酒精度(Y1)和总黄酮含量(Y2)对发酵温度(A)、接种量(B)、初始糖度(C)、发酵时间(D)的多元二次回归方程如下:

由表4可知,酒精度和总黄酮含量为响应值建立的模型极显著(P<0.01),酒精度为响应值建立的模型失拟项不显著(P=0.738 3>0.05),总黄酮含量为响应值建立的模型失拟项不显著(P=0.061 5>0.05),表明试验误差较小,该模型在研究区域拟合度较好。以酒精度为响应值,模型决定系数R2=0.995 5,调整决定系数R2adj=0.991 0;以总黄酮含量为响应值,模型决定系数R2=0.996 5,调整决定系数R2adj=0.993 0,说明多元回归关系显著,此试验设计可靠,因此可以利用该回归方程预测上述因素对山楂酒中总黄酮及酒精度的影响。由P值可知,一次项A、B、C、D,交互项BC、BD及二次项A2、B2、C 2和D2对山楂酒酒精度的影响极显著(P<0.01);一次项A、B、C、D,交互项AC、CD及二次项A2、B2、C2和D2均对山楂酒中总黄酮含量的影响极显著(P<0.01)。由F值可知,山楂酒中各因素对酒精度的影响顺序为初始糖度>发酵温度>发酵时间>接种量;各因素对总黄酮含量的影响顺序为发酵时间>接种量>初始糖度>发酵温度。
2.2.2 各因素对山楂酒中酒精度和总黄酮含量的响应面分析发酵温度(A)、接种量(B)、初始糖度(C)、发酵时间(D)四个因素间交互作用对山楂酒中酒精度及总黄酮含量影响的响应面及等高线见图5。
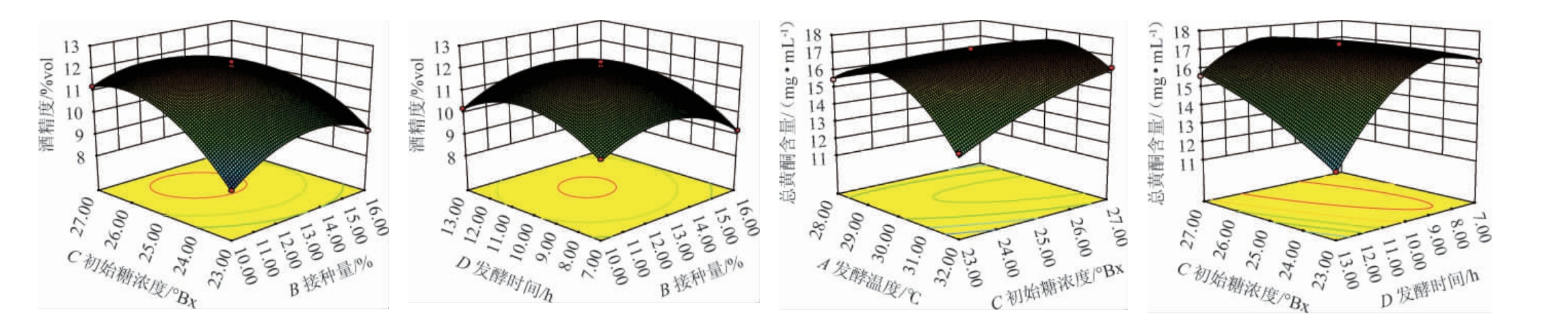
图5 各因素间交互作用对酒精度和总黄酮含量影响的响应面及等高线
Fig.5 Response surface plots and contour lines of effects of interaction between various factors on alcohol content and total flavonoids contents
响应面三维空间图形变化与等高线可反映各因素间的交互作用及其响应值的强弱[30]。由图5可知,各因素间交互作用对结果影响的响应面曲线走势较陡,等高线呈椭圆形,说明A、B、C、D之间存在交互作用。其中接种量(B)和初始糖度(C)间交互作用曲面较陡,接种量(B)和发酵时间(D)间交互作用响应面也较为陡峭,等高线均较密集且呈椭圆程度较大,表示BC和BD间交互作用对酒精度影响极显著(P<0.01);发酵温度(A)和初始糖度(C)间的交互作用曲面较陡峭,初始糖度(C)和发酵时间(D)间的交互作用曲面也较陡,等高线均较密集且呈椭圆程度较大,表示AC、CD间交互作用对总黄酮含量影响极显著(P<0.01)。这与表3方差分析结果一致。
2.2.3 响应面验证试验
以山楂酒中总黄酮含量为主要评价指标,酒精度作为参考指标,经过Design-Expert V8.0.6软件分析得到山楂酒以总黄酮含量为评价指标的最佳发酵工艺条件为发酵温度31.15 ℃,接种量12.55%,初始糖度25.18°Bx,发酵时间10.24 d。在此条件下,酒精度和总黄酮含量的预测值分别为11.98%vol和16.98 mg/mL。考虑实际操作可行性,将最佳发酵工艺参数修正为发酵温度31 ℃,接种量13%,初始糖度25°Bx,发酵时间10 d。在此优化条件下重复进行3组平行验证试验,酒精度平均实际值为(11.07±0.09)%vol,总黄酮含量平均实际值为(16.10±0.15)mg/mL,与模型预测的理论值相比误差较小,因此,利用该模型优化高总黄酮山楂酒发酵工艺条件是可行的。
3 结论
以山楂为原料,山西土著库德毕赤菌株Y1为发酵菌株制备山楂酒,通过单因素及响应面试验,确定了高产黄酮山楂酒的最佳发酵工艺为发酵温度31 ℃,接种量13%,初始糖度25°Bx,发酵时间10 d。在此最佳条件下,山楂酒中酒精度为(11.07±0.09)%vol,总黄酮含量为(16.10±0.15)mg/mL,感官评分为38分。本研究明确山楂酒中总黄酮物质的含量且优化发酵工艺为高总黄酮山楂酒的开发提供了技术支撑,同时也为功能性山楂酒的开发提供新的研究思路,推动山楂保健酒的发展和创新。
[1]ZHANG M.A study on hypolipidemic effect of hawthorn flavonoids extract[J].Medicinal Plant,2017,8(1):45-47.
[2]HOU W Z,WANG Y T,WANG W,et al.Determination and evaluation of flavonoids in hawthorn in China[J].J Biobased Materials Bioenergy,2020,14(5):664-669.
[3]崔洁,刘心悦,杨相,等.不同采收期对不同产地山楂综合品质的影响[J].西北药学杂志,2020,35(5):633-638.
[4]KURKIN V A, PRAVDIVTSEVA O E, SHAIKHUTDINOV I K, et al.Quantitative determination of total flavonoids in blood-red hawthorn fruit[J].Pharm Chem J,2020,54(1):36-39.
[5]国家药典委员会.中华人民共和国药典:四部[M].北京:中国医药科技出版社,2020:33-34.
[6]吕想,高甜甜,刘伟,等.基于GC-IMS分析非酿酒酵母与酿酒酵母混合发酵脐橙酒挥发性香气成分[J].食品工业科技,2023,44(17):139-148.
[7]陈敏.二氧化碳浸渍山楂酒酿造工艺研究[D].泰安:山东农业大学,2022.
[8]胡冀太,杜金华,何桂芬.两种制备工艺对山楂酒品质及抗氧化性的影响[J].酿酒,2012,39(3):45-50.
[9]胡冀太,杜金华,何桂芬.果酒酵母对发酵山楂酒品质及抗氧化性的影响[J].酿酒,2012,39(5):52-56.
[10]HE G F,SUI J L,DU J H,et al.Characteristics and antioxidant capacities of five hawthorn wines fermented by different wine yeasts[J].J I Brewing,2013,119(4):321-327.
[11]刘秀华,刘永杰,王玉兰,等.山楂酒色度测定及其影响因素[J].酿酒科技,2019(7):114-116.
[12]JIANG X H, LU Y Y, LIU S Q, et al.Effects of different yeasts on physicochemical and oenological properties of red dragon fruit wine fermented with Saccharomyces cerevisiae, Torulaspora delbrueckii and Lachancea thermotolerans[J].Microorganisms,2020,8(3):315.
[13]姜兴旭,张阳阳,朱静,等.红枣山楂果酒的酿造工艺优化[J].中国酿造,2021,40(4):203-206.
[14]LIANG Y,WANG C C,ZHU X H,et al.A multi-step screening approach of suitable non-Saccharomyces yeast for the fermentation of hawthorn wine[J].LWT-Food Sci Technol,2020,127:109432.
[15]LIU J J,WAN Y,CHEN Y R,et al.Effects of Torulaspora delbrueckii on physicochemical properties and volatile flavor compounds of navel orange wine[J].J Food Compos Anal,2023,121:105328.
[16]吕想,高甜甜,刘伟,等.基于GC-IMS分析非酿酒酵母与酿酒酵母混合发酵脐橙酒挥发性香气成分[J].食品工业科技,2023,44(17):139-148.
[17]贾丽艳,张丽,李惠源,等.果香风味导向的库德毕赤酵母FJZ的分离鉴定及生物学特性研究[J].中国食品学报,2021,21(1):276-282.
[18]郭晋伟.风味和功能导向的山楂酒工艺的优化及体外抗氧化特性的研究[D].晋中:山西农业大学,2022.
[19]中华人民共和国国家卫生和计划生育委员会.GB 5009.225—2016 食品安全国家标准酒中乙醇浓度的测定[S].北京:中国标准出版社,2016.
[20]中国国家标准化管理委员会.GB/T 15038—2006 葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
[21]中华人民共和国轻工业部.QB/T 5476.2—2021 果酒第2部分:山楂酒[S].北京:中国标准出版社,2021.
[22]李楠,杨春杰,邓随胜,等.富含黄酮的山楂果酒发酵条件优化[J].中国酿造,2016,35(11):112-116.
[23]TIAN X J,LIU Y,FENG X,et al.The effects of alcohol fermentation on the extraction of antioxidant compounds and flavonoids of pomelo peel[J].LWT-Food Sci Technol,2018,89:763-769.
[24]王玥,陈洪国,史玉敏,等.响应面法优化桂花发酵液及其抗氧化能力测定[J].中南农业科技,2023,44(9):51-55.
[25]陈玲,余昆,崔振华.枸杞果酒发酵过程中黄酮含量变化及其发酵条件优化[J].酿酒,2015,42(6):65-68.
[26]米兰,蒋玉梅,李霁昕,等.沙棘葡萄复配果酒的生产工艺优化[J].甘肃农业大学学报,2019,54(3):134-142,151.
[27]白永亮,林柔敏,王海燕,等.半固态发酵苦荞黄酒工艺优化及香气分析[J].酿酒科技,2022(9):75-84.
[28]徐国俊,张玉,蔡雄,等.大小曲混合发酵苦荞酒工艺研究及风味成分分析[J].食品工业科技,2015,36(6):225-229,244.
[29]唐玲.无花果果酒发酵工艺及其品质研究[D].重庆:西南大学,2018.
[30]曹蒙,周舟,靳羽慧,等.基于响应面法优化植物乳杆菌发酵酸奶制作工艺[J].信阳农林学院学报,2023,33(3):117-122.