嗜酸乳杆菌(Lactobacillus acidophilus)自1900年从粪便中分离出来,其特性、功能得到了广泛研究,在国内外极受重视,是使用频率最高的益生菌菌株之一。嗜酸乳杆菌可用于食品加工,被称为第三代酸奶发酵菌株,有助于改善食品风味、增强食品益生功效[1],嗜酸乳杆菌NCFM菌株是卫生部批准的可用于婴幼儿食品的菌种,在膳食补充剂领域应用广泛[2]。在医药领域,嗜酸乳杆菌具有治疗腹泻、降低胆固醇、辅助癌症治疗等功能[3-5],可有效提高胃溃疡患者幽门螺杆菌根除率,提升患者肠道环境健康,减轻炎症反应[6],是微生态药物制剂(处方药如思连康、益君康等)常用菌株之一[7]。
嗜酸乳杆菌生长速度较慢,营养需求复杂,对培养基及有机氮源要求高,其中有机氮源对嗜酸乳杆菌的培养效果具有决定性作用。嗜酸乳杆菌等益生菌的生产中,常用有机氮源主要有酵母源、植物源以及动物源蛋白水解物[8]。动物源蛋白水解物具有一定潜在生物安全风险,无动物源原料生产是益生菌领域的发展趋势,酵母源、植物源有机氮源是未来益生菌生产原料的主要选择[9]。
酵母粉、酵母浸粉、酵母膏等酵母有机氮源已被广泛研究和应用于生物发酵,而植物蛋白水解物仅大豆蛋白胨、豌豆蛋白胨等少数几种在嗜酸乳杆菌等益生菌生产中得到应用,小麦蛋白水解物等植物有机氮源作为益生菌生产原料还有待研究和发掘。小麦蛋白水解物以小麦蛋白为原料,经酶解、过滤、喷雾干燥等工序精制而成,当前国内外对小麦蛋白水解物研究主要集中在功能肽发掘、制备与应用[10-12],而小麦蛋白水解物作为有机氮应用于微生物发酵的研究还较少,但已有的少量研究发现,小麦蛋白水解物、大米蛋白水解物替代胰酪蛋白胨等用于嗜酸乳杆菌的培养具有较好效果[13],表明小麦蛋白水解物在生物发酵行业应用具有一定潜力。
本研究通过制备小麦蛋白水解物应用于嗜酸乳杆菌培养,考察小麦蛋白水解物及其组分对嗜酸乳杆菌生物量、菌体形态、菌体稳定性等方面的影响,为小麦蛋白水解物应用于嗜酸乳杆菌工业化生产提供一定理论基础,并为小麦蛋白水解物在生物发酵行业的广泛应用提供一定支撑。
1 材料与方法
1.1 材料与试剂
嗜酸乳杆菌(Lactobacillus acidophilus):安琪酵母股份有限公司;脱脂乳粉:内蒙古伊利实业集团股份有限公司。
葡萄糖、乙酸钠、磷酸氢二钾、柠檬酸氢二铵、硫酸镁、硫酸锰、吐温80、琼脂粉、海藻糖:国药集团化学试剂有限公司;蛋白胨、牛肉膏、酵母浸粉:安琪酵母股份有限公司。所用试剂均为分析纯或生化试剂。
MRS液体培养基:葡萄糖20 g/L、蛋白胨10 g/L、牛肉膏10 g/L、酵母浸粉5 g/L、乙酸钠5 g/L、磷酸氢二钾2 g/L、柠檬酸氢二铵2 g/L、硫酸镁0.58 g/L、硫酸锰0.25 g/L、吐温80 1 mL,调节pH 6.2~6.4,121 ℃灭菌20 min。MRS固体培养基在上述培养基上添加20 g/L琼脂粉。
1.2 仪器与设备
WTM-1812G膜过滤设备、有机膜:杭州沃滕膜工程有限公司;SW-CJ-1C双人单面超净工作台:苏州进化设备有限公司;FiveEasy Plus FP20 pH计:梅特勒-托利多国际贸易(上海)有限公司;HWS-350型生化培养箱:上海比朗仪器有限公司;Sp-750分光光度计:上海光谱仪器有限公司;GI54DWS灭菌锅:致微(厦门)仪器有限公司;CX43型生物显微镜/MII Image View4.11.19051拍照系统:奥林巴斯株式会社;BIOTECH-3JG-6离位灭菌玻璃多联发酵罐:上海保兴生物设备有限公司。
1.3 方法
1.3.1 菌株活化
从甘油管中取100 μL菌液接种到15 mL MRS液体培养基中,37 ℃静置培养12 h,以体积分数为2%的接种量将菌液接种到MRS液体培养基中,37 ℃培养12 h后得到种子液。
1.3.2 生物量与活菌数的测定
菌体密度的测定:用紫外分光光度计在波长600 nm处测定发酵液的吸光度值,若吸光度值>0.8,需要将发酵液进行稀释,使稀释后的菌液的吸光度值在0.2~0.8。
活菌数的测定:采用倾注平板计数法。
1.3.3 菌体形态分析
嗜酸乳杆菌培养后取1.5 mL发酵液于2 mL离心管中,10 000 r/min离心2 min,弃上清收集菌体,用生理盐水进行悬浮洗涤1~2次,取适量菌悬液于载玻片固定、染色,用显微镜油镜(物镜100×,目镜10×)观察,利用拍照系统进行拍照记录并统计菌体长度。
1.3.4 冻干存活率的测定
取发酵液离心,收集菌体,菌体量与冻干保护剂(10%脱脂乳+4%海藻糖)按照质量比1∶10的比例进行混合、乳化,准确称取1 mL稀释至一定的浓度进行活菌计数,同时称取1 mL样品于西林瓶中进行冻干。统计冻干前后活菌总数,计算冻干存活率,其计算公式如下:
式中:SR为冻干存活率,%;C1为每1 mL乳化液冻干前活菌数总和,CFU;C2为每1 mL乳化液冻干后活菌数总和,CFU。
1.3.5 小麦蛋白水解物的制备工艺
谷朊粉与水按质量比1∶9溶配,升温至50 ℃,调节pH至6.0,添加木瓜蛋白酶、风味蛋白酶各1%,酶解6 h;升温至90 ℃灭酶30 min;5 000 r/min离心10 min,得到上清液,即小麦蛋白水解物原液。
1.3.6 不同肽分子质量小麦水解物的制备工艺
小麦蛋白水解物溶液过膜孔径100 000 Da的有机膜,得到澄清液,依次过膜孔径50 00 Da、2 000 Da、1 000 Da、5 00 Da、300 Da的有机膜,制备截留液为>5 000 Da、2 000~5 000 Da、1 000~2 000 Da、500~1 000 Da、300~500 Da的样品,透过液为<300 Da的样品。
1.3.7 小麦蛋白水解物与菌体氨基酸组成的测定
游离氨基酸及水解氨基酸的测定:参照GB 5009.124—2016《食品安全国家标准食品中氨基酸的测定》。
1.3.8 数据统计与分析
所有实验均重复3次,实验结果表示为“平均值±标准差”,实验数据采用Origin9.0、Minitab17.0绘图。
2 结果与分析
2.1 小麦蛋白水解物对嗜酸乳杆菌的影响
2.1.1 小麦蛋白水解物对嗜酸乳杆菌生长的影响
由图1可知,不同氮源培养嗜酸乳杆菌生长曲线有明显差异。小麦蛋白水解物培养嗜酸乳杆菌的生物量最高(OD600 nm值)为6.08,高于牛骨胨、胰酪胨、酵母胨、大豆胨。由图2可知,同等条件培养嗜酸乳杆菌,小麦蛋白水解物活菌数为5.23×108 CFU/mL,高于其他蛋白胨。该结果表明,嗜酸乳杆菌对小麦蛋白水解物具有一定的偏好性,孙文敬等[14]研究发现,小麦蛋白水解物对植物乳杆菌、干酪乳杆菌生长有促进作用,结合本研究结果说明小麦蛋白水解物是一种适用于嗜酸乳杆菌的氮源。本研究结果中大豆胨培养嗜酸乳杆菌生物量和活菌数均最低,可能与大豆胨碳水化合物偏高蛋白及肽类含量偏低、嗜酸乳杆菌蛋白酶系较弱[15]相关,LI W H等[16]研究发现,大豆水解物代替MRS液体培养基部分氮源发酵嗜酸乳杆菌活菌数明显降低,与本研究结果类似。
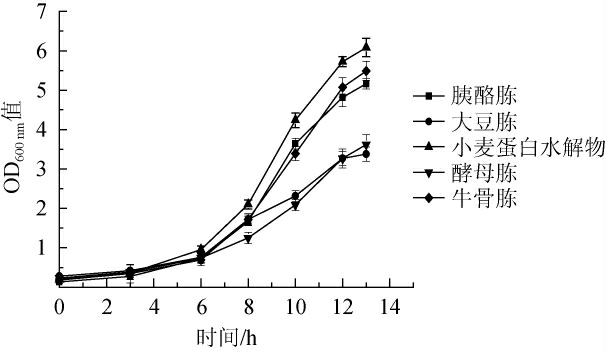
图1 不同蛋白胨及小麦蛋白水解物发酵嗜酸乳杆菌的生长曲线
Fig.1 Growth curves of Lactobacillus acidophilus with different peptones and wheat protein hydrolysate
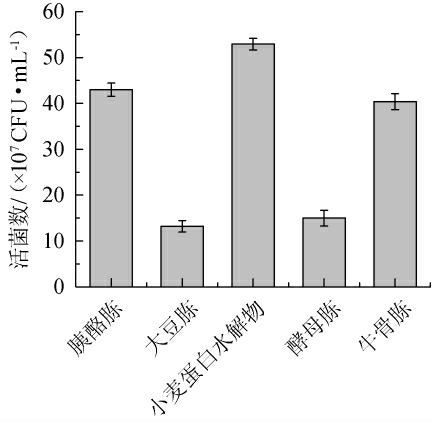
图2 不同蛋白胨及小麦蛋白水解物对活菌数的影响
Fig.2 Effect of different peptones and wheat protein hydrolysate on the viable counts
2.1.2 小麦蛋白水解物对嗜酸乳杆菌形态的影响
菌体形态是乳酸菌生产中重点关注的参数之一,本研究对不同蛋白胨与小麦蛋白水解物培养的嗜酸乳杆菌形态进行分析,结果见图3。
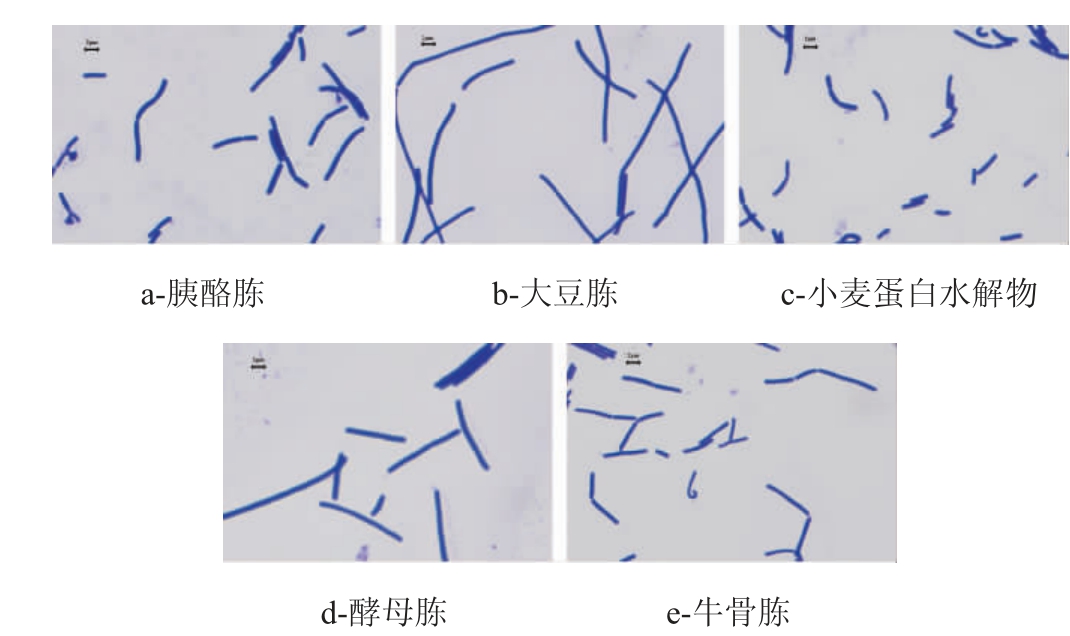
图3 不同蛋白胨及小麦蛋白水解物对嗜酸乳杆菌形态的影响
Fig.3 Effect of different peptones and wheat protein hydrolysate on the morphology of Lactobacillus acidophilus
由图3可知,菌体形态具有明显差异,菌体长度依次为小麦蛋白水解物<胰酪胨、牛骨胨<酵母胨<大豆胨。菌体的形态大小一方面受生长条件的影响,另一方面受培养基营养影响,本次实验整个培养过程中pH,初始糖含量、渗透压都维持在相当的水平,因此造成形态差异的原因可能是不同蛋白水解物的营养特性引起嗜酸乳杆菌的生理代谢改变而导致。
2.1.3 小麦蛋白水解物对嗜酸乳杆菌冻干存活率的影响
冻干存活率是益生菌生产中重要的技术指标,由图4可知,小麦蛋白水解物组的冻干存活率为64.67%,显著高于其他实验组。冻干存活率受冻干保护剂、过程控制等因素的影响,同时与微生物的生理状态密切相关[17],SENZ M等[18]研究表明,菌体形态与活菌数和稳定性相关,菌体越大乳酸菌稳定性越差,PALMFELDT J等[19]研究也发现,罗伊氏乳杆菌菌体形态越小,趋于球形,其对冻干过程中冰晶等的损害耐受力越高,存活率越高,本研究2.1.2的结果中小麦蛋白水解物培养的菌体形态较短可能是导致其冻干存活率最高的原因。
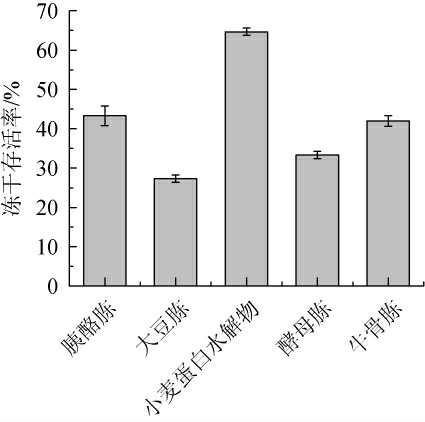
图4 不同蛋白胨及小麦蛋白水解物对冻干存活率的影响
Fig.4 Effects of different peptones and wheat protein hydrolysate on freeze-drying survival rates
2.2 不同分子质量的小麦蛋白水解物对嗜酸乳杆菌的影响
2.2.1 不同分子质量的小麦蛋白水解物对嗜酸乳杆菌生长的影响
动植物源蛋白水解物或蛋白胨作为微生物培养基原料,主要通过不同的肽、氨基酸类营养物质供给影响微生物的生长和生理状态。本研究利用不同孔径的超滤膜制备不同分子质量的小麦水解物培养嗜酸乳杆菌,结果发现嗜酸乳杆菌对特定分子质量的小麦蛋白水解物的吸收具有一定的选择性。
由图5可知,小麦蛋白水解物中分子质量>5 000 Da和<300 Da的组分难以被利用,活菌数最低;分子质量介于2 000~5 000 Da的组分对嗜酸乳杆菌的促生长最显著,活菌数最高为7.67×108 CFU/mL,嗜酸乳杆菌可能对小麦蛋白水解物中2 000~5 000 Da部分具有一定的偏好性。辛晓亚[20]在研究乳酸乳球菌中也有类似发现,乳酸乳球菌主要利用小麦蛋白胨WP-1中分子质量为180~2 000 u的肽段以及丝氨酸、谷氨酸、甲硫氨酸、异亮氨酸和赖氨酸等氨基酸实现其菌体增殖。
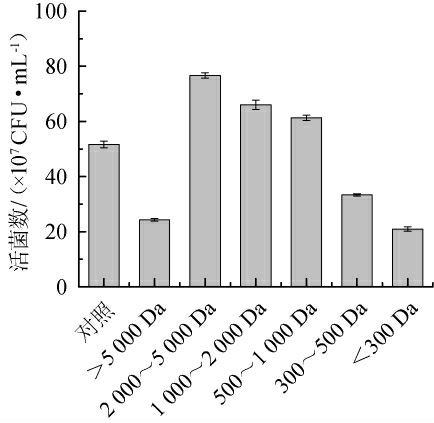
图5 不同分子质量小麦肽对活菌数的影响
Fig.5 Effect of wheat peptides with different molecular mass on the viable counts
2.2.2 不同分子质量的小麦蛋白水解物对嗜酸乳杆菌冻干存活率与菌体形态的影响
由图6可知,分子质量在2 000~5 000 Da的小麦蛋白水解物培养嗜酸乳杆菌的冻干存活率最高为82.33%,分子质量<500 Da的冻干存活率仅为30%~50%,其中以分子质量<300 Da实验组最低,2.1结果已表明嗜酸乳杆菌的冻干存活率与菌体形态具有一定关系,对小麦蛋白水解物不同分子质量组分培养嗜酸乳杆菌菌体长度统计,结果见图7。
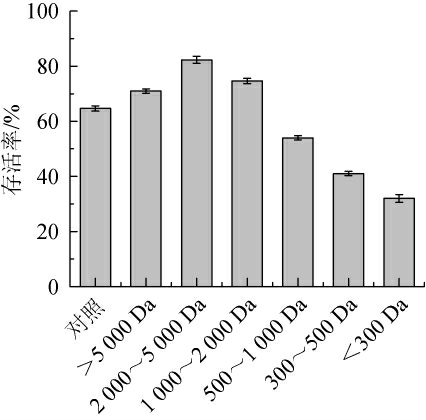
图6 不同分子质量小麦肽对冻干存活率的影响
Fig.6 Effect of wheat peptides with different molecular mass on freeze-drying survival rates
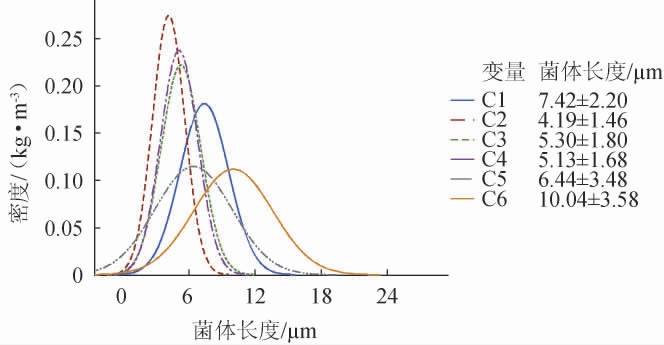
图7 嗜酸乳杆菌菌体长度的正态分布图
Fig.7 Normal distribution of length of Lactobacillus acidophilus
C1、C2、C3、C4、C5、C6分别是分子质量在>5 000 Da、2 000~5 000 Da、1 000~2 000 Da、500~1 000 Da、300~500 Da、<300 Da小麦肽
发酵的嗜酸乳杆菌。
由图7可知,不同分子质量的小麦蛋白水解物对嗜酸乳杆菌菌体长度和均一性有较大影响。分子质量2 000~5 000 Da的小麦水解物组分培养嗜酸乳杆菌的菌体长度最短,平均长度4.19 μm,且均一;分子质量1 000~2 000 Da、500~1 000 Da的小麦蛋白水解物组分培养菌体长度相对较短,菌体平均长度分别为5.13 μm和5.30 μm;而分子质量<300Da的实验组,菌体平均长度为10.04 μm,且形态不均一。该结果可能与不同分子质量组分中多肽成分相关,分子质量为2 000~5 000 Da、1 000~2 000 Da、500~1 000 Da的小麦蛋白水解物组分中的多肽,可能更利于嗜酸乳杆菌的吸收利用,使菌体的生长速度与分裂速度匹配,菌体形态呈现短且均一的状态[21]。
2.3 小麦蛋白水解物中氨基酸组成对嗜酸乳杆菌的影响
微生物对不同分子质量的偏好性,一方面与肽段的大小相关,另一方面还可能与多肽的氨基酸组成具有一定关系。
由表2 可知,分子质量>5 000 Da、2 000~5 000 Da、1 000~2 000 Da的小麦蛋白水解物中的谷氨酸、脯氨酸、胱氨酸含量显著高于分子质量<500 Da的小麦蛋白水解物(P<0.05),其中分子质量为2 000~5 000 Da 的小麦水解物中谷氨酸和脯氨酸含量分别为39.71 g/100 g、13.44 g/100 g,结合2.1和2.2的结果,表明小麦蛋白水解物中含谷氨酰胺、脯氨酸的多肽可能是促进嗜酸乳杆菌生长的重要因素。蔡露阳等[22]在分析促进嗜酸乳杆菌的大米肽氨基酸组分时,发现其含有较高的谷氨酸,李翠凤等[23]研究发现,将脯氨酸、甲硫氨酸添加到培养基,可以明显提高嗜酸乳杆菌活菌数,与本结果具有一定相似性。BRZOZOWSKI B等[24]研究表明,嗜酸乳杆菌可产生脯氨酸内肽酶,而分子质量<300 Da的小麦蛋白水解物培养嗜酸乳杆菌生物量最低,可能与其由谷氨酸或脯氨酸组成的肽含量低有关。
表2 不同分子质量小麦肽的氨基酸组分
Table 2 Amino acid components of wheat peptides with different molecular mass g/100 g
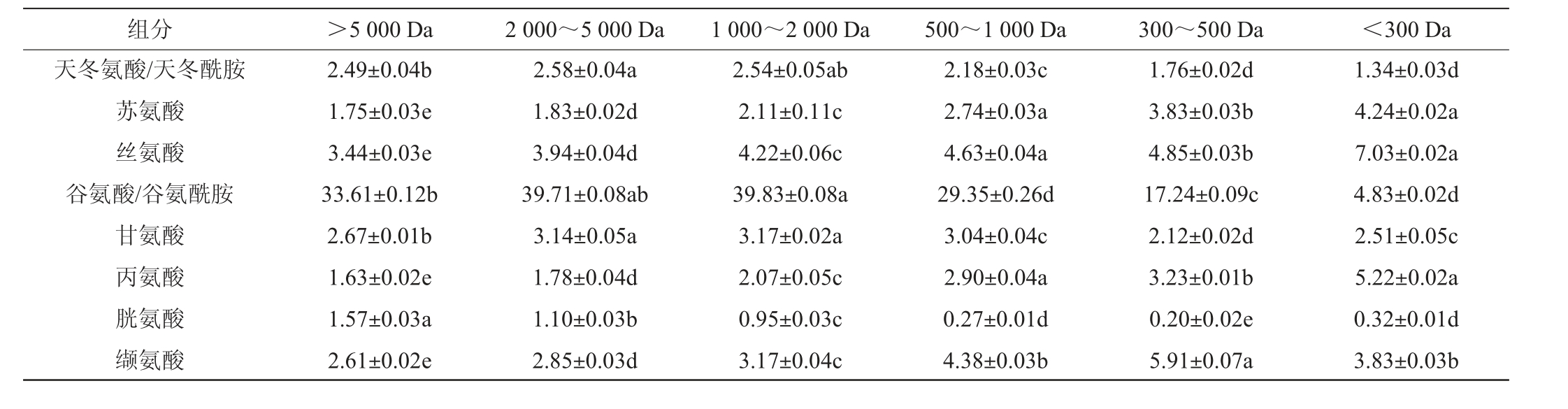
组分 >5 000 Da 2 000~5 000 Da 1 000~2 000 Da 500~1 000 Da 300~500 Da <300 Da天冬氨酸/天冬酰胺苏氨酸丝氨酸谷氨酸/谷氨酰胺甘氨酸丙氨酸胱氨酸缬氨酸2.49±0.04b 1.75±0.03e 3.44±0.03e 33.61±0.12b 2.67±0.01b 1.63±0.02e 1.57±0.03a 2.61±0.02e 2.58±0.04a 1.83±0.02d 3.94±0.04d 39.71±0.08ab 3.14±0.05a 1.78±0.04d 1.10±0.03b 2.85±0.03d 2.54±0.05ab 2.11±0.11c 4.22±0.06c 39.83±0.08a 3.17±0.02a 2.07±0.05c 0.95±0.03c 3.17±0.04c 2.18±0.03c 2.74±0.03a 4.63±0.04a 29.35±0.26d 3.04±0.04c 2.90±0.04a 0.27±0.01d 4.38±0.03b 1.76±0.02d 3.83±0.03b 4.85±0.03b 17.24±0.09c 2.12±0.02d 3.23±0.01b 0.20±0.02e 5.91±0.07a 1.34±0.03d 4.24±0.02a 7.03±0.02a 4.83±0.02d 2.51±0.05c 5.22±0.02a 0.32±0.01d 3.83±0.03b
续表
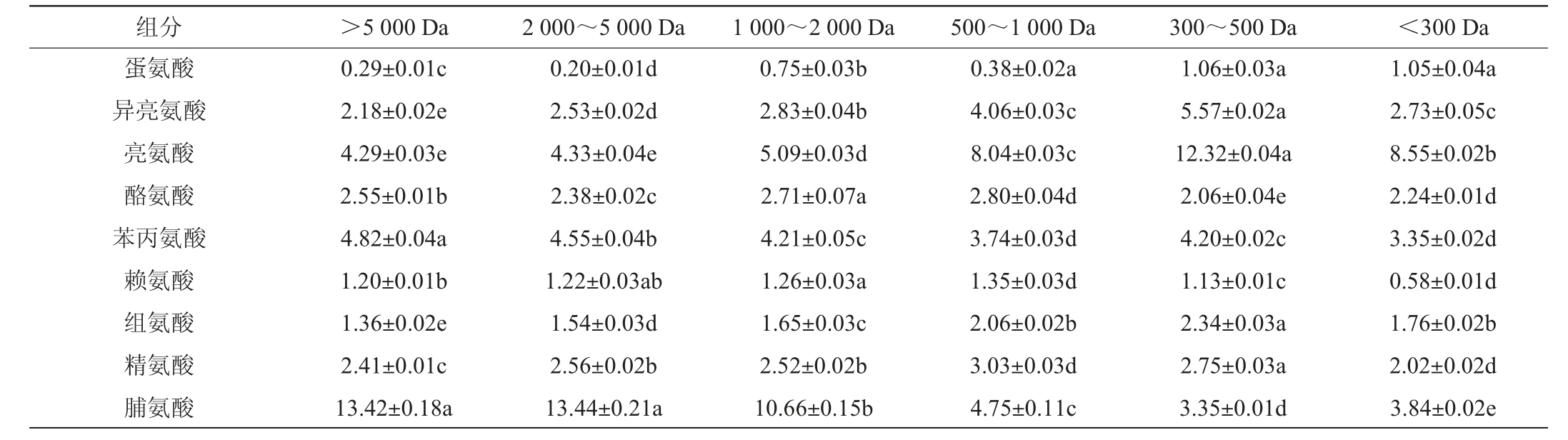
注:天冬酰胺、谷氨酰胺经酸水解为天冬氨酸、谷氨酸,测定水解氨基酸为天冬氨酸/天冬酰胺,谷氨酸/谷氨酰胺。不同小写字母表示差异显著(P<0.05)。下同。
组分 >5 000 Da 2 000~5 000 Da 1 000~2 000 Da 500~1 000 Da 300~500 Da <300 Da蛋氨酸异亮氨酸亮氨酸酪氨酸苯丙氨酸赖氨酸组氨酸精氨酸脯氨酸0.29±0.01c 2.18±0.02e 4.29±0.03e 2.55±0.01b 4.82±0.04a 1.20±0.01b 1.36±0.02e 2.41±0.01c 13.42±0.18a 0.20±0.01d 2.53±0.02d 4.33±0.04e 2.38±0.02c 4.55±0.04b 1.22±0.03ab 1.54±0.03d 2.56±0.02b 13.44±0.21a 0.75±0.03b 2.83±0.04b 5.09±0.03d 2.71±0.07a 4.21±0.05c 1.26±0.03a 1.65±0.03c 2.52±0.02b 10.66±0.15b 0.38±0.02a 4.06±0.03c 8.04±0.03c 2.80±0.04d 3.74±0.03d 1.35±0.03d 2.06±0.02b 3.03±0.03d 4.75±0.11c 1.06±0.03a 5.57±0.02a 12.32±0.04a 2.06±0.04e 4.20±0.02c 1.13±0.01c 2.34±0.03a 2.75±0.03a 3.35±0.01d 1.05±0.04a 2.73±0.05c 8.55±0.02b 2.24±0.01d 3.35±0.02d 0.58±0.01d 1.76±0.02b 2.02±0.02d 3.84±0.02e
表3中嗜酸乳杆菌菌体氨基酸组成结果显示,不同小麦蛋白水解物培养得到的菌体中谷氨酸和丙氨酸含量均较高,谷氨酸含量占菌体氨基酸的20%以上,天冬氨酸含量占10%以上,丙氨酸含量占总氨基酸的7%以上。而分子质量>500 Da的小麦蛋白水解物实验组,菌体脯氨酸、酪氨酸含量显著高于分子质量<500 Da的实验组(P<0.05)。
表3 嗜酸乳杆菌发酵不同分子质量小麦肽的氨基酸组分
Table 3 Amino acid components of wheat peptides with different molecular mass fermentated by Lactobacillus acidophilus g/100 g

注:C1、C2、C3、C4、C5、C6分别是分子质量在>5 000 Da、2 000~5 000 Da、1 000~2 000 Da、500~1 000 Da、300~500 Da、<300 Da小麦肽发酵的嗜酸乳杆菌。
组分 C1 C2 C3 C4 C5 C6 0.66±0.03f 0.96±0.03f 1.55±0.03b 5.33±0.02f 0.63±0.02f 1.93±0.03f 1.73±0.02a 1.36±0.04f 0.05±0.01a 1.34±0.03b 1.83±0.02c 0.23±0.02f 0.23±0.03e 2.52±0.01c 1.15±0.02a 2.86±0.02a 0.73±0.02e天冬氨酸/天冬酰胺苏氨酸丝氨酸谷氨酸/谷氨酰胺甘氨酸丙氨酸胱氨酸缬氨酸蛋氨酸异亮氨酸亮氨酸酪氨酸苯丙氨酸赖氨酸组氨酸精氨酸脯氨酸2.67±0.01e 1.27±0.02e 1.33±0.01d 6.14±0.01d 1.15±0.02e 2.35±0.01e 0.41±0.01c 1.43±0.03e 0.03±0.02ab 1.03±0.02e 1.84±0.03c 0.91±0.01c 1.33±0.02b 2.05±0.05f 0.54±0.01c 1.02±0.02c 1.93±0.02a 3.25±0.04c 1.53±0.02d 1.35±0.02d 6.81±0.01c 1.35±0.04c 2.73±0.02c 0.32±0.03e 1.56±0.01d 0.01±0.01b 1.14±0.02d 1.54±0.04e 0.84±0.02d 0.46±0.03d 2.45±0.03d 0.45±0.03e 1.02±0.01c 1.66±0.01b 3.74±0.01b 1.76±0.03b 1.45±0.03c 7.04±0.02b 1.43±0.01b 3.13±0.01b 0.23±0.02f 1.71±0.01c 0.01±0.01b 1.26±0.02c 1.75±0.02d 1.47±0.01a 1.15±0.01c 2.65±0.01b 0.57±0.01b 0.95±0.02d 1.56±0.03c 4.14±0.02a 1.93±0.01a 1.64±0.02a 7.35±0.02a 1.59±0.01a 3.55±0.02a 0.38±0.02d 1.77±0.03b 0.03±0.03ab 1.43±0.03a 2.06±0.04b 1.17±0.01b 0.22±0.01e 3.07±0.02a 0.57±0.01b 1.17±0.01b 1.46±0.02d 3.09±0.04d 1.62±0.02c 1.52±0.01b 5.74±0.03e 1.23±0.02d 2.57±0.03d 0.86±0.01b 1.97±0.02a 0.04±0.03ab 1.33±0.03b 2.42±0.01a 0.42±0.02e 1.63±0.04a 2.34±0.03e 0.51±0.02d 0.95±0.03d 0.24±0.04f
综合不同分子质量小麦蛋白水解物中氨基酸组成及 其对嗜酸乳杆菌生长和菌体氨基酸组成影响的结果分析,小麦蛋白水解物中含有谷氨酰胺或脯氨酸的多肽可能是影响嗜酸乳杆菌的生长和冻干存活率的关键营养。孟丽[25]研究嗜酸乳杆菌的氨基酸消耗模式发现谷氨酸+谷氨酰胺的需求率最高,占总氨基酸需求量的10.71%,一定程度上说明小麦蛋白水解物富含谷氨酰胺的特性作为嗜酸乳杆菌生产原料具有一定理论基础。
3 结论
小麦蛋白水解物较其他动物植物蛋白水解物(蛋白胨)培养嗜酸乳杆菌,生物量高、菌体形态短,对提高活菌数和稳定性具有促进作用。小麦蛋白水解物中分子质量为2 000~5 000 Da的组成部分是影响嗜酸乳杆菌生长和冻干存活率的主要成分,其中由谷氨酸/谷氨酰胺、脯氨酸组成的多肽可能是关键营养组分,对嗜酸乳杆菌的生物量和冻干存活率具有重要影响。本研究为小麦蛋白水解物作为嗜酸乳杆菌的工业生产原料和质量控制提供了数据支持,后续将进一步研究由谷氨酸、谷氨酰胺、脯氨酸等组成的相关多肽对嗜酸乳杆菌的影响。
[1]曲秀伟.双歧杆菌和嗜酸乳杆菌对干酪产生抗氧化肽及其稳定性研究[D].哈尔滨:东北农业大学,2018.
[2]GUSTAW W,KOZIOŁ J,RADZKI W,et al.The effect of addition of selected milk protein preparations on the growth of Lactobacillus acidophilus and physicochemical properties of fermented milk[J].Acta Sci Pol Technol Aliment,2015,15(1):29-36.
[3]CIFTCI G,TUNA E.Effects of cholesterol and Lactobacillus acidophilus on testicular function[J].Clin Exp Rep Med,2021,48(3):229-235.
[4]HSIEH S,LIU J,PUA X,et al.Optimization of Lactobacillus acidophilus cultivation using taro waste and evaluation of its biological activity[J].Appl Microbiol Biotechn,2016,100(6):2629-2639.
[5]王云鹏,郑文武,夏梦,等.嗜酸乳杆菌调节NO及其氧化介质对动脉粥样硬化模型大鼠的影响[J].天津医药,2019,47(1):32-37.
[6]徐昌彬.复方嗜酸乳杆菌辅助治疗Hp感染消化性溃疡疗效及对患者肠道微生态的影响[J].基层医学论坛,2022,26(23):44-53.
[7]包志贤,杜洁,马小丽,等.复方嗜酸乳杆菌补救治疗幽门螺杆菌感染作用的Meta分析[J].中国微生态学杂志,2023,35(1):1-7.
[8]杜丽红,郝亚男,陈宁,等.有机氮源及其在微生物发酵中的应用[J].发酵科技通讯,2019,48(1):1-4.
[9]SAEED A,HAYEK S A I.Current limitations and challenges with lactic acid bacteria:A review[J].Food Nutr Sci,2013(4):73-87.
[10]方磊,李诒光,陈亮,等.小麦低聚肽营养成分和特征功能肽段研究[J].食品与发酵工业,2023,49(11):178-182.
[11]SATO K,EGASHIRA Y,ONO S,et al.Identification of a hepatoprotective peptide in wheat gluten hydrolysate against D-galactosamine-induced acute hepatitis in rats[J].J Agr Food Chem,2013,61(26):6304-6310.
[12]孙含,赵晓燕.小麦蛋白肽的研究及应用进展[J].粮油食品科技,2018,26(2):11-16.
[13]张蓓蕾.谷物蛋白肽对嗜酸乳杆菌的促生长作用及其抗氧化活性研究[D].西安:陕西科技大学,2016.
[14]孙文敬,辛晓亚,郭文杰,等.小麦蛋白胨促进乳酸菌增殖的研究[J].食品与发酵工业,2017,43(3):66-72.
[15]SODINI I, LUCAS A, OLIVEIRA M N, et al.Effect of milk base and starter culture on acidification,texture,and probiotic cell counts in fermented milk processing[J].J Dairy Sci,2002,85(10):2479-2488.
[16]LI W H, ZHANG Y X, LI H, et al.Effect of soybean oligopeptide on the growth and metabolism of Lactobacillus acidophilus JCM 1132[J].RSC Adv,2020,10(28):16737-16748.
[17]HANSEN M R W, PETERSEN M A, RISBO J, et al.Implications of modifying membrane fatty acid composition on membrane oxidation,integrity, and storage viability of freeze-dried probiotic, Lactobacillus acidophilus La-5[J].Biotechnol Progr,2015,31(3):799-807.
[18]SENZ M,VAN LENGERICH B,BADER J, et al.Control of cell morphology of probiotic Lactobacillus acidophilus for enhanced cell stability during industrial processing[J].Int J Food Microbiol, 2015, 192(9):34-42.
[19]PALMFELDT J, HAHN-HAGERDAL B.Influence of culture pH on survival of Lactobacillus reuteri subjected to freeze-drying[J].Int J Food Microbiol,2000,55(1-3):235-238.
[20]辛晓亚.高品质小麦蛋白胨的制备及其作为发酵氮源的应用研究[D].镇江:江苏大学,2017.
[21]ZHANG C,ZHANG Y,LI H,et al.The potential of proteins,hydrolysates and peptides as growth factors for Lactobacillus and Bifidobacterium:current research and future perspectives[J].Food Funct, 2020, 11(3):1946-1957.
[22]蔡露阳,张蓓蕾.大米肽对嗜酸乳杆菌的促生长作用[J].食品科技,2017,42(3):10-14.
[23]李翠凤,徐显睿,张宗博,等.嗜酸乳杆菌Z-43高密度发酵配方及关键工艺条件优化[J].食品安全质量检测学报,2021,12(18):7364-7369.
[24]BRZOZOWSKI B, LEWANDOWSKA M.Prolyl endopeptidase-Optimization of medium and culture conditions for enhanced production by Lactobacillus acidophilus[J].Electron J Biotechnol,2014,17(5):204-210.
[25]孟丽.Lactobacillus acidophilus LA5的营养需求模式与其在发酵乳中的应用研究[D].哈尔滨:东北农业大学,2021.