普鲁兰酶(EC3.2.1.41)属于α-淀粉酶家族,可以特异性水解支链淀粉、糊精、普鲁兰糖中的α-1,6糖苷键。按催化机理和水解产物的差异,可分为I型普鲁兰酶和II型普鲁兰酶两类。I型是专一性水解α-1,6糖苷键,II型则可水解α-1,6和α-1,4糖苷键。淀粉是食品、酿造、洗涤剂、纺织和制药工业的重要原材料[1]。淀粉的糖化效果影响其利用率[2]。不同类型淀粉均含有α-1,4糖苷键直链淀粉和α-1,6糖苷键支链淀粉[3],淀粉酶水解α-1,4糖苷键,添加普鲁兰酶[4],可以缩短淀粉的糖化时间、提高产率和转化率[5]。普鲁兰酶在果葡糖浆、改性淀粉、乙醇燃料、啤酒等生产领域需求广泛[6],酶的稳定性对加工至关重要。
超高温普鲁兰酶主要来源于极端环境微生物[7],在工业生产中需求量大[8-9]。GOMES I等[10]从红热菌中筛选到耐热普鲁兰酶,其酶活在85 ℃时为1.97 U/mL,在85 ℃下半衰期为30 min。PARK Y U等[11]从解淀粉脱硫球菌中发现的普鲁兰酶半衰期在95 ℃时为12.7 h,在98 ℃时为27 min。提高酶的热稳定性可以减少酶的用量,拓展酶的应用。目前,通过分子改造和优化反应体系可以提高酶的稳定性[12-15]。
深海古菌Thermococcus siculi HJ21高温普鲁兰酶最早是由王淑军在太平洋深海热液口中的嗜热球菌中得到的。测序比对后发现为一新的普鲁兰酶基因,该普鲁兰酶在90 ℃条件下半衰期为5 h[16]。后续利用表达载体pET-28a在宿主大肠杆菌(Escherichia coli)BL21中实现了异源表达,得到重组普鲁兰酶最适反应温度为95 ℃,具有较好的热稳定性[17]。WU X等[18]在此基础上对该基因的C端序列进行截短。截短后的普鲁兰酶Pul-HJΔ782热稳定性进一步提升,在90 ℃条件下保温5 h后,酶活保留率仍在57%以上。尽管如此,该酶在淀粉制糖工艺中长时间高温度的条件下仍然会存在失活的情况,难以满足实际生产的需要。
本研究将深海古菌T.siculi HJ21的超嗜热普鲁兰酶Pul-HJΔ782基因克隆在冷休克启动子cspA的质粒pColdⅠ,在宿主大肠杆菌(E.coli)BL21中诱导表达,研究其酶学性质,并通过单因素和响应面试验优化该酶的热稳定性保护剂,并检测了保护剂对该酶水解马铃薯淀粉的影响。以期为超高温普鲁兰酶在淀粉糖化中的应用提供实验依据。
1 材料与方法
1.1 材料与试剂
普鲁兰酶Pul-HJΔ782基因:来自本实验室先前保存菌种;内切酶NdeⅠ和BamHⅠ:北京维百奥生物科技有限公司;pColdⅠ载体:北京宝日医生物科技有限公司;大肠杆菌(Escherichia coli)BL21(DE3)感受态细胞:上海天根生化技术有限公司;淀粉葡萄糖苷酶(100 000 U/g):上海麦克林生化科技股份有限公司;高温α-淀粉酶(40 000 U/g):北京索莱宝科技有限公司;马铃薯淀粉:天津市鸿禄食品有限公司;麦芽糖、葡萄糖、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS):阿拉丁试剂(上海)有限公司。实验所用化学试剂均为分析纯。
LB培养基:1%蛋白胨,1%氯化钠,0.5%酵母粉。121 ℃灭菌20 min。
1.2 仪器与设备
Multiskan FC酶标仪:美国ThermoFisher公司;AKTA pure蛋白纯化仪:德国艾可丽公司;T100型梯度聚合酶链式反应(polymerase chain reaction,PCR)仪、Gel Doc TMEZ凝胶成像分析系统:美国Bio-Rad公司;Innova 44R制冷式恒温摇床:英国NEW BRUNSWCCK公司;Eppendorf高速离心机:艾本德(中国)有限公司;Q5000微量分光光度计:美国Quawell公司;SPX-150B-Z生化培养箱:上海博讯实业有限公司;超声破碎仪SCIENTZ-IID:宁波新芝生物科技股份有限公司。
1.3 试验方法
1.3.1 普鲁兰酶Pul-HJΔ782的克隆与表达
对含Pul-HJΔ782基因的菌株Thermococcus siculi HJ21培养并提取质粒,用NdeⅠ和BamHⅠ对质粒及pColdⅠ载体进行双酶切,得到目的基因和载体。将其连接得到重组质粒并转化E.coli BL21(DE3)感受态细胞。将阳性克隆子接种LB培养基,37 ℃培养至菌液OD600nm值达到约0.5,将培养液置冰水中冷却到15 ℃,添加异丙基-β-D-硫代吡喃半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG)到终浓度1 mmol/L,15 ℃、150 r/min振荡培养24 h。8 000×g离心收集细胞,超声破碎后8 000×g离心,上清液用蛋白纯化仪纯化酶蛋白,得到普鲁兰酶Pul-HJΔ782。
1.3.2 普鲁兰酶活力测定
采用DNS法测定普鲁兰酶活力[19]。
麦芽糖标准曲线的绘制:分别吸取0.2%标准麦芽糖液0、10μL、20μL、40μL、60 μL、80 μL、100μL、120 μL、140μL、160 μL、180 μL、200 μL,依次加入到试管中,补加蒸馏水至200 μL,配制成相应含量的麦芽糖标准溶液。加入等体积的DNS试剂,于沸水浴中煮沸5 min,取出后立即加入蒸馏水3 mL,混匀冷却后,取样在波长540 nm条件下,利用酶标仪测定吸光度值(OD540 nm值)。以标准麦芽糖量(x)为横坐标,以对应的OD540 nm值(y)为纵坐标,绘制标准曲线,得到麦芽糖标准曲线回归方程y=2.028 71x+0.049 27,相关系数R2为0.997。
在试管中分别加入2%的普鲁兰糖和100 mmol/L的乙酸-乙酸钠缓冲液75 μL,在待测温度下预热5 min,然后加入50 μL酶液反应15 min,随后加入200 μL的DNS终止反应(对照组先加入DNS,后加酶),将试管置于沸水中煮沸5 min,加入3 mL超纯水并混匀。吸取200 μL反应液在波长540 nm条件下测定吸光度值,按照麦芽糖标准曲线回归方程计算普鲁兰酶活力,其计算公式如下:
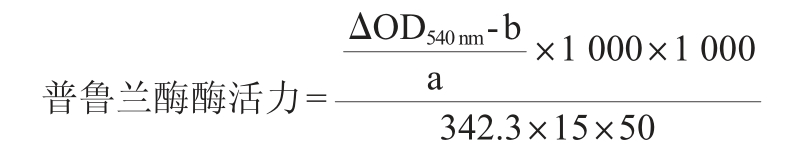
式中:a为麦芽糖标准曲线中的斜率;b为麦芽糖标准曲线中的截距;ΔOD540 nm值为样液与对照组在波长540 nm条件下吸光度值的差值。1 000为异麦芽糖浓度换算;342.3为异麦芽糖分子质量;15为反应时间,min;50为酶液体积,μL。
普鲁兰酶活定义:每分钟催化普鲁兰酶生成1 μmol/L麦芽糖所需的酶量为一个酶活单位(U/mL)。
1.3.3 普鲁兰酶的酶学性质
酶的最适温度及热稳定性:将纯化的普鲁兰酶分别在60 ℃、70 ℃、80 ℃、90 ℃、100 ℃条件下测定酶的活力,将最高酶活力计为100%,计算相对酶活,确定酶的最适温度。将酶液分别在80 ℃、90 ℃、100 ℃条件下保温5 h,每隔1 h取样测定酶的活力,将最高酶活力计为100%,计算相对酶活,考察酶的热稳定性。
酶的最适pH及pH稳定性:选用50 mmol/L的乙酸-乙酸钠缓冲液(pH 4.0~5.5)、磷酸盐缓冲液(phosphate buffer solution,PBS)(pH5.5~7.0)和Tris-HCl缓冲液(pH 7.0~9.0),缓冲液与底物1∶1(V/V)混合,在酶的最适作用温度下孵育5 min后测定酶的活力,将最高酶活力计为100%,计算相对酶活,确定酶的最适pH。将上述缓冲液与底物1∶1(V/V)混合,在酶的最适作用温度下水浴4 h后测定酶的活力,将最高酶活力计为100%,计算相对酶活,考察酶的pH稳定性。
1.3.4 普鲁兰酶稳定性保护剂种类的选择
选用金属离子(0.1 mol/L K+、Ca2+、Na+、Mg2+、Zn2+、Cu2+、Mn2+溶液)、糖或多元醇(4 g/L的葡萄糖、蔗糖、麦芽糖、木糖醇、5%(V/V)的甘油)、大分子助剂(10 g/L的明胶、黄原胶和蛋白胨)和表面活性剂(4 mL/L的Tween 20、Tween 80和TritonX-100)四种类型试剂为保护剂,对照组为超纯水,保护剂与酶液1∶1(V/V)混合后,在酶的最适温度下水浴,分别在0、6 h、12 h取样测定酶的活力,将初始酶活力计为100%,计算酶活保留率,筛选最佳保护剂。
1.3.5 普鲁兰酶稳定性保护剂配方优化
(1)单因素试验
Ca2+、甘油、明胶和Tween 20的添加量分别为0.02 mol/L、0.04 mol/L、0.08 mol/L、0.10 mol/L、0.20 mol/L;1%、5%、10%、15%、20%;0.50 g/L、0.75 g/L、1.00 g/L、4.00 g/L、10.00 g/L;及1 mL/L、2 mL/L、3 mL/L、5 mL/L、10 mL/L。在90 ℃条件下保温12 h后测定酶的活力,将初始酶活力计为100%,并计算酶活保留率。
(2)响应面试验
在单因素试验的基础上,选取Ca2+(A)、甘油(B)、Tween 20(C)、明胶(D)添加量作为自变量,以酶活保留率(R1)为响应值,参考HASSABO A A等[20]的响应面试验方法,用Design-Expert 8.0.6软件,设计Box-Behnken试验,响应面试验因素与水平见表1。
表1 响应面试验设计因素与水平
Table 1 Factors and levels of response surface experiments design
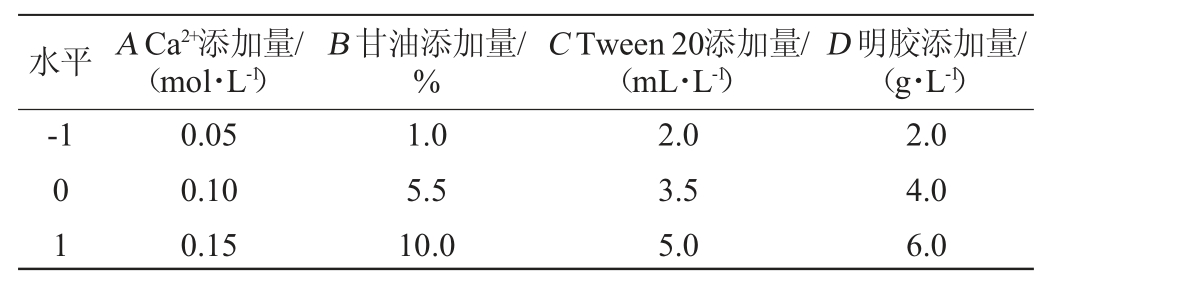
水平 A Ca2+添加量/(mol·L-1)D 明胶添加量/(g·L-1)-1 B 甘油添加量/%C Tween 20添加量/(mL·L-1)01 0.05 0.10 0.15 1.0 5.5 10.0 2.0 3.5 5.0 2.0 4.0 6.0
1.3.6 保护剂对普鲁兰酶水解马铃薯淀粉的影响
配制20%马铃薯淀粉溶液,加热使其糊化。加入16 U/g耐高温α-淀粉酶,在90 ℃水浴条件下液化30 min,将pH调至6.5后,分别加入100 U/g糖化酶和复合酶(糖化酶和普鲁兰酶的添加比例为50∶1)。每5 h取样,根据国家标准GB/T 20882.2—2021《淀粉糖质量要求第2部分:葡萄糖浆(粉)》测量葡萄糖当量(dextrose equivalent,DE)值。
1.3.7 数据处理
所有试验都设三个平行样,实验数据统计分析采用IBM SPSS Statistics 23.0,采用Origin 2018制图,响应面试验结果利用Design-Expert 8.0.6软件进行处理。
2 结果与分析
2.1 普鲁兰酶基因的克隆与表达
克隆表达结果如图1所示,Pul-HJΔ782目的基因碱基长度为2 364 bp。由图1a可知,目的条带位置与目的基因大小相符;由图1b 可知,pColdI载体为4 407 bp,对目的基因与载体进行双酶切后,琼脂糖凝胶电泳结果符合;由图1c可知,Pul-HJΔ782基因与pColdI载体重组后的质粒进行跑胶,Pul-HJΔ782基因成功在E.coli BL21中冷休克表达。由图1d可知,通过镍柱纯化酶蛋白,在SDS-PAGE电泳图中的条带与酶蛋白的分子质量90.88 kDa一致。表明普鲁兰酶Pul-HJΔ782蛋白表达成功,经测定,其酶活为2.8 U/mL。
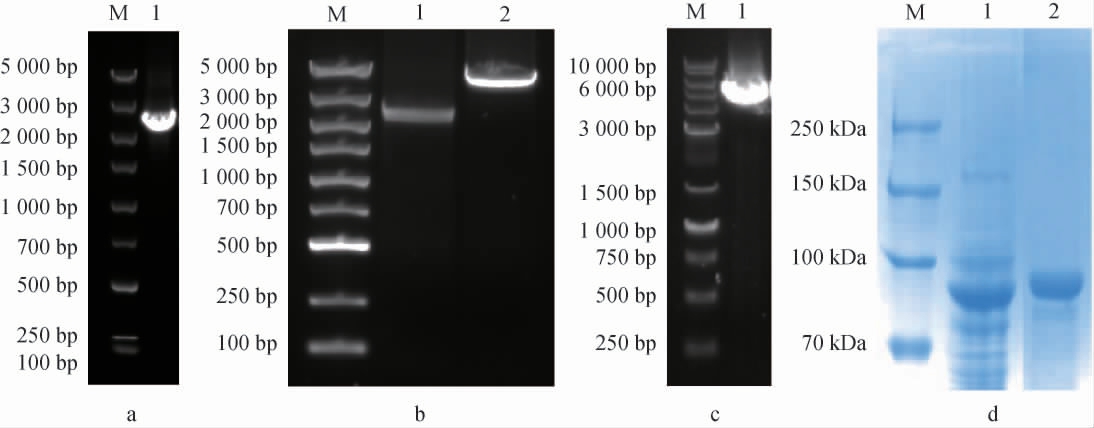
图1 普鲁兰酶基因Pul-HJΔ782的克隆表达及其蛋白纯化
Fig.1 Cloning and expression of pullulanase gene Pul-HJΔ782 and its protein purification
图1a中M为5 000 bp DNA Marker,1为目的基因聚合酶链式反应产物;图1b中M为5 000 bp DNA Marker,1为目的基因双酶切产物,
2为pCold1载体双酶切产物;图1c中M为10 000 bp DNA Marker,1为重组质粒;图1d中M为250 kDa蛋白Marker,1为粗酶,2为纯酶。
2.2 普鲁兰酶Pul-HJΔ782的酶学性质
2.2.1 普鲁兰酶的最适温度及热稳定性
普鲁兰酶的最适温度及热稳定性测定结果见图2。由图2a可知,酶的最适作用温度为90 ℃。由图2b可知,温度在100 ℃下保温5 h可保留80%以上的酶活,温度在80 ℃和90 ℃下保温5 h仍保留70%以上的酶活,100 ℃下保温4 h也保留近70%活力,表明普鲁兰酶热稳定性良好。
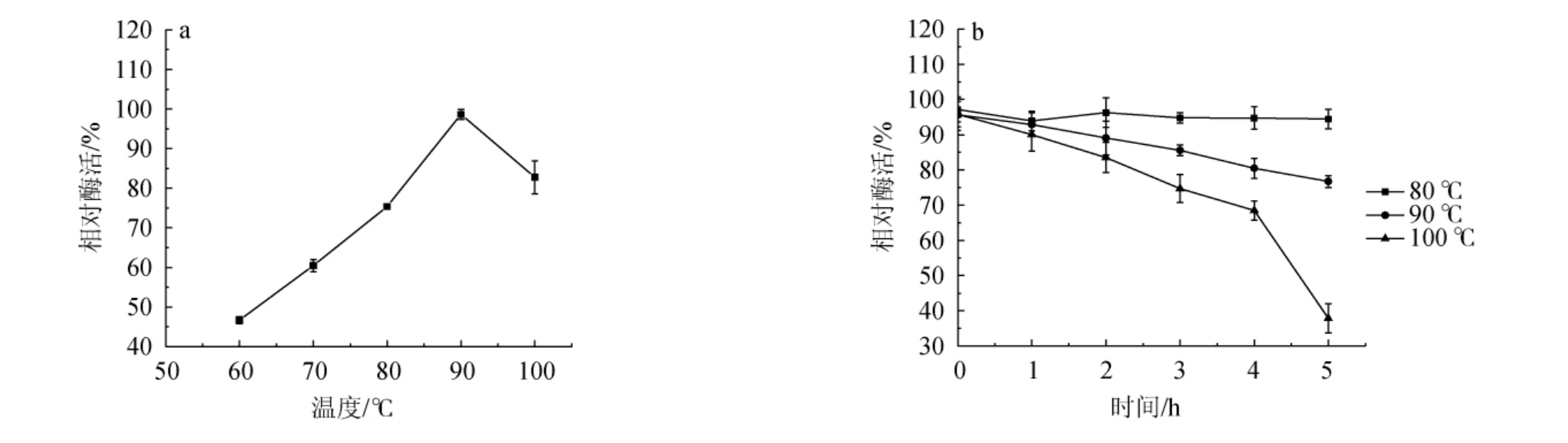
图2 普鲁兰酶的最适温度(a)及热稳定性(b)
Fig.2 Optimum temperature (a) and thermal stability (b) of pullulanase
2.2.2 普鲁兰酶的最适pH值及pH稳定性
普鲁兰酶的最适pH值及pH稳定性测定结果见图3。由图3a可知,该酶的最适pH为6.5。由图3b可知,当pH值在4.0~9.0之间酶活均可保留60%以上,表明普鲁兰酶pH稳定性良好。

图3 普鲁兰酶的最适pH值(a)及pH稳定性(b)
Fig.3 Optimum pH value (a) and pH stability (b) of pullulanase
2.3 保护剂种类对普鲁兰酶稳定性的影响
以不添加保护剂的普鲁兰酶为对照,不同保护剂对普鲁兰酶稳定性的影响结果见图4。由图4a可知,Ca2+、Mg2+和Mn2+可显著提高酶的稳定性(P<0.05),其中,Ca2+的效果最好,添加Ca2+后,12 h酶活保留率为74.32%,比对照组提高了11.83%。Zn2+和Cu2+对酶活具有抑制作用。因此,金属离子中Ca2+是普鲁兰酶稳定性的最佳保护剂。由图4b可知,添加甘油可以显著提高酶的稳定性(P<0.05),甘油处理组12 h后酶活保留率为77.61%,比对照组高15.12%。因此,糖类及多元醇中甘油是普鲁兰酶稳定性的最佳保护剂。
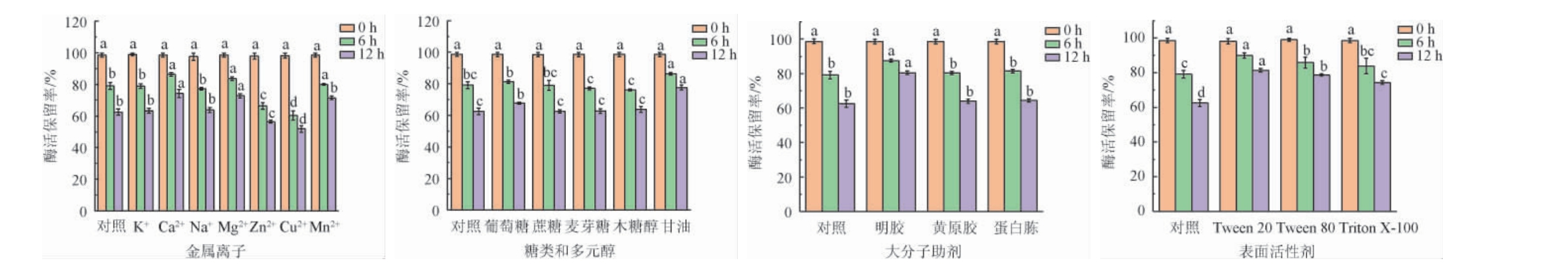
图4 不同保护剂对普鲁兰酶稳定性的影响
Fig.4 Effect of different protectants on the stability of pullulanase
由图4c可知,明胶对稳定性的作用显著高于其他稳定剂(P<0.05),12 h后酶活保留率为80.37%,比对照组高17.88%。因此,大分子助剂中明胶是普鲁兰酶稳定性的最佳保护剂。蛋白胨和黄原胶对酶稳定性无明显影响。由图4d可知,Tween 20、Tween 80和TritonX-100均可提高酶的稳定性,其中Tween 20的作用最为显著,12 h后酶活保留达到81.37%,比对照组高18.88%。因此,表面活性剂中明胶是普鲁兰酶稳定性的最佳保护剂。
2.4 保护剂添加量对普鲁兰酶稳定性的影响
Ca2+、甘油、明胶和Tween 20的浓度对酶稳定性的影响结果见图5。由图5a可知,当Ca2+浓度为0.02~0.10 mol/L时,酶活保留率随之增加;当Ca2+浓度为0.10 mol/L时,酶活保留率最大,为75.42%;当Ca2+浓度>0.10 mol/L之后,酶活保留率有所下降。因此,最佳Ca2+浓度为0.10 mol/L。由图5b可知,当甘油添加量为1%~5%时,酶活保留率随之增加;当甘油添加量为5%时,酶活保留率最大,为78.65%;当甘油添加量>5%之后,酶活保留率有所下降。因此,最佳甘油添加量为5%。由图5c可知,当明胶质量浓度为0.50~4.00 g/L时,酶活保留率随之增加;当明胶质量浓度为4.00 g/L时,酶活保留率最大,为83.43%;当明胶质量浓度>4.00 g/L之后,酶活保留率有所下降。因此,最佳明胶质量浓度为4.00 g/L。由图5d可知,当Tween 20体积分数为1~3 mL/L时,酶活保留率随之增加;当Tween 20体积分数为3 mL/L时,酶活保留率最大,为88.83%;当Tween 20体积分数>3 mL/L之后,酶活保留率有所下降。因此,最佳Tween 20体积分数为3 mL/L。
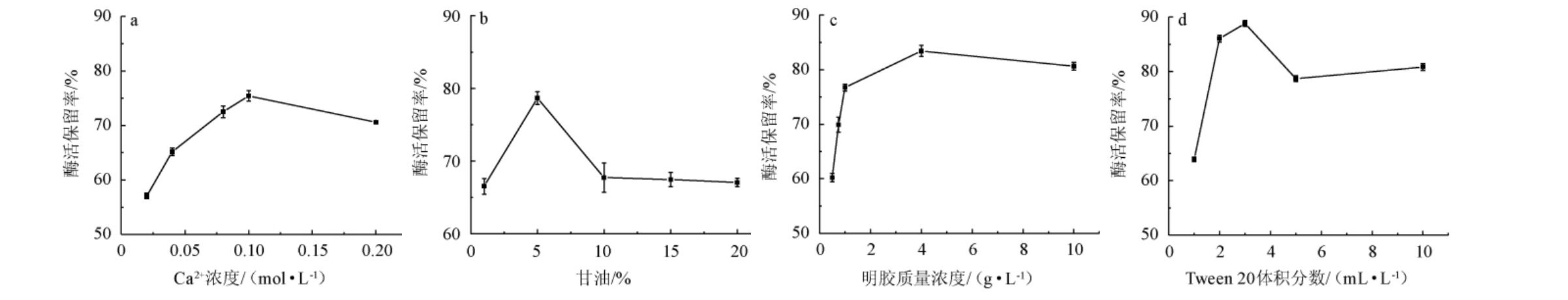
图5 不同添加量保护剂对普鲁兰酶稳定性的影响
Fig.5 Effect of different protectant addition on the stability of pullulanase
2.5 保护剂配方响应面法优化
在单因素试验的基础上,选取Ca2+(A)、甘油(B)、Tween 20(C)、明胶(D)添加量作为自变量,以酶活保留率(R1)为响应值,设计Box-Behnken试验,响应面试验设计及结果见表2,方差分析结果见表3。
表2 Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken tests
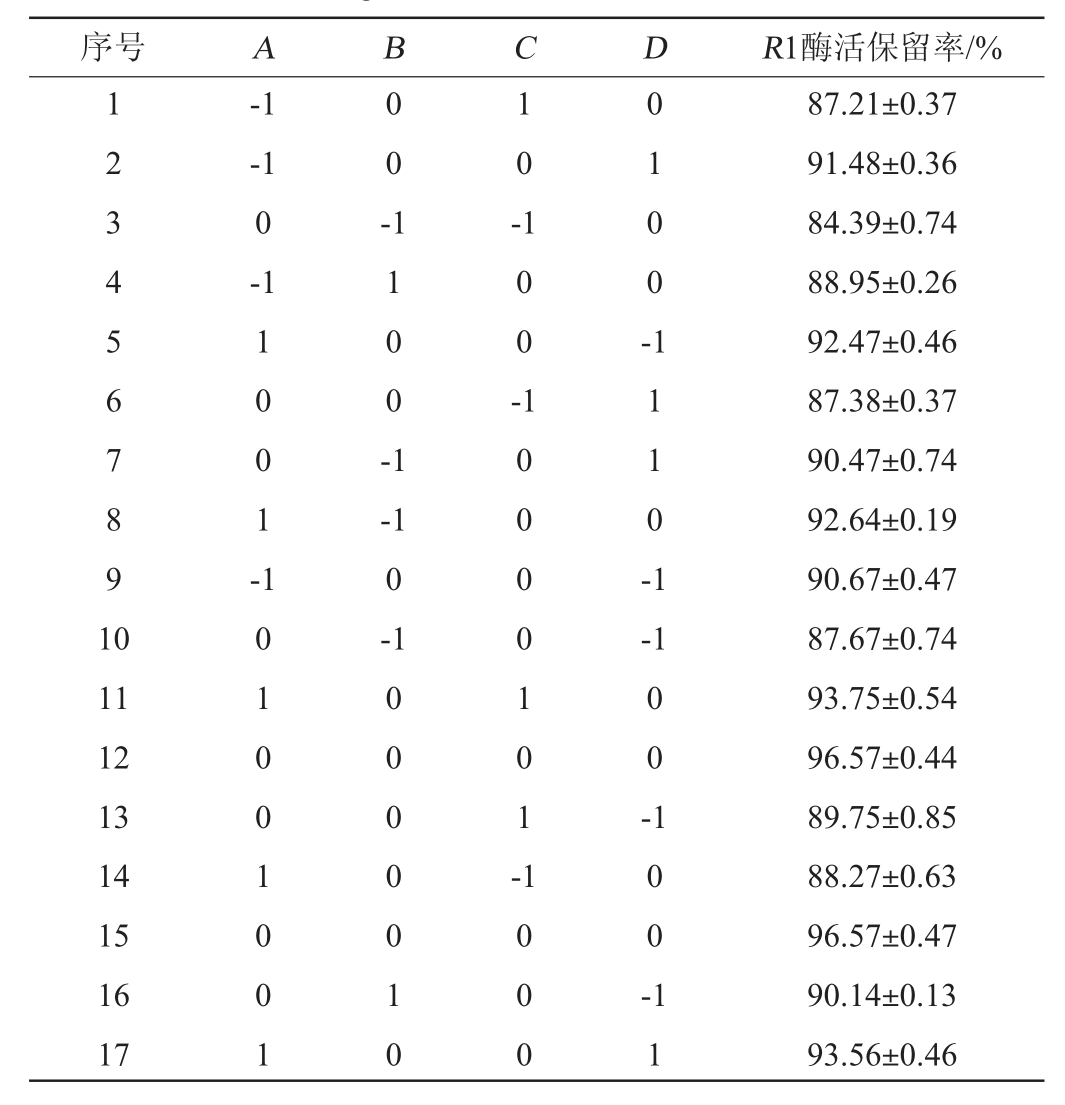
序号 A B C D R1酶活保留率/%1 2 3 4 5 6 7 8 9 1 0-1-1 0-1 0 0 -1 0 -1 0 0 1 -1 1 0 0 -1 1 0 0 -0 1 0 0 -1 1 1 0 -1-1 0-1-1 11 12 13 14 15 16 17 1 0 1 0 0 1 0 0 1 0 0 0 0 0 1 0 1 0 0 0 0 1 0 1 -0 0 -1 0 0 0 1 0 0 -1 1 87.21±0.37 91.48±0.36 84.39±0.74 88.95±0.26 92.47±0.46 87.38±0.37 90.47±0.74 92.64±0.19 90.67±0.47 87.67±0.74 93.75±0.54 96.57±0.44 89.75±0.85 88.27±0.63 96.57±0.47 90.14±0.13 93.56±0.46
续表
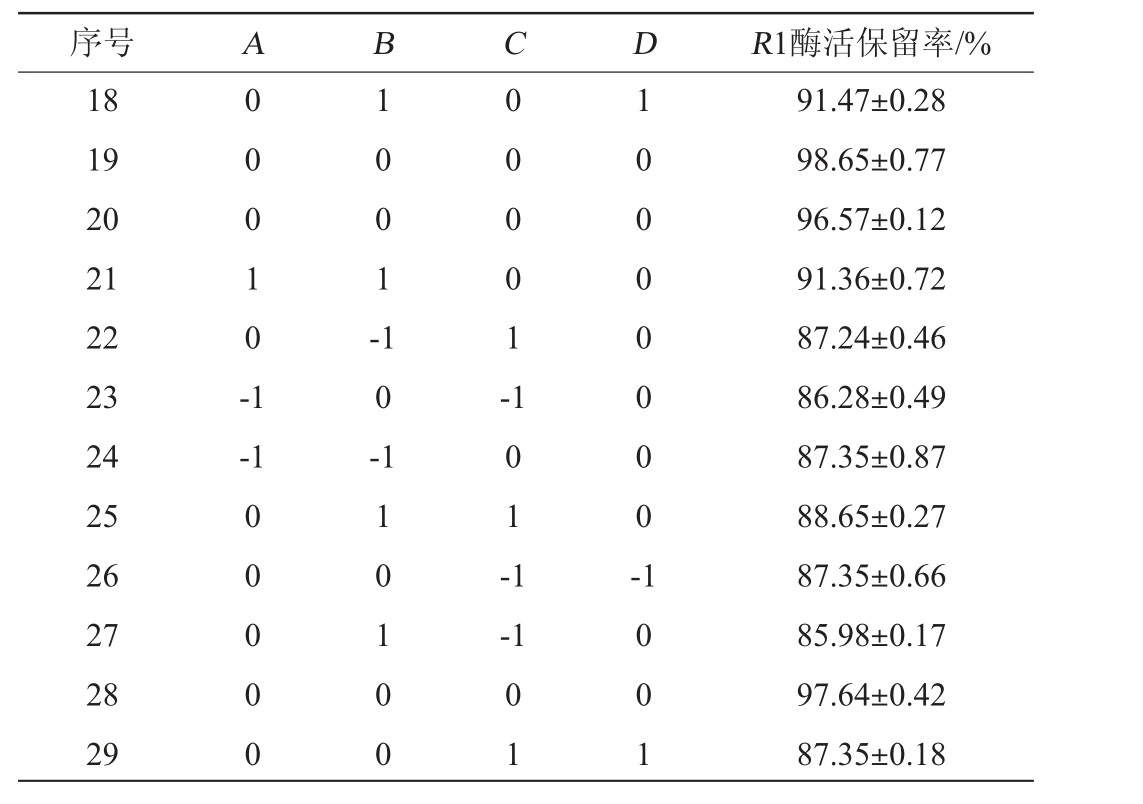
序号 A B C D R1酶活保留率/%18 19 20 21 22 23 24 25 26 27 28 29 0 0 0 1 0 -1 1 0 0 1 -0 0 0 0 1 --1 1 0 -0 0 0 0 0 1 1 0 1 0 0 1 0 1 -1 1 0 0 0 0 0 0 0 --1 0 1 1 0 0 1 91.47±0.28 98.65±0.77 96.57±0.12 91.36±0.72 87.24±0.46 86.28±0.49 87.35±0.87 88.65±0.27 87.35±0.66 85.98±0.17 97.64±0.42 87.35±0.18
表3 回归模型方差分析
Table 3 Variance analysis of regression model
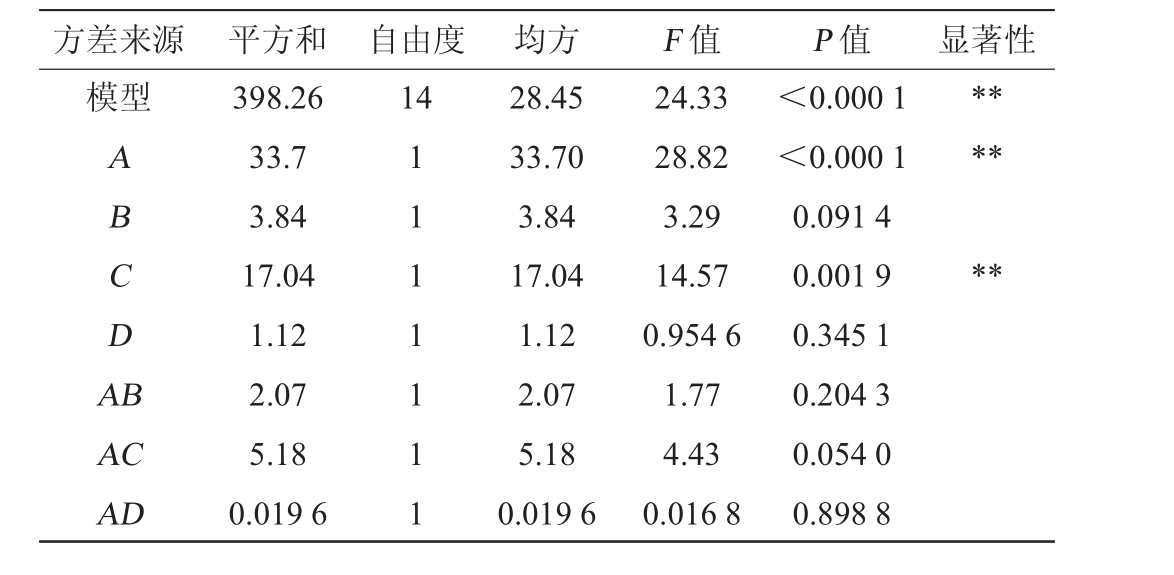
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型14 ABCDA B******AC AD 398.26 33.7 3.84 17.04 1.12 2.07 5.18 0.019 6 1 1 1 1 1 1 1 28.45 33.70 3.84 17.04 1.12 2.07 5.18 0.019 6 24.33 28.82 3.29 14.57 0.954 6 1.77 4.43 0.016 8<0.000 1<0.000 1 0.091 4 0.001 9 0.345 1 0.204 3 0.054 0 0.898 8
续表
注:“**”表示对结果影响极显著(P<0.01)。
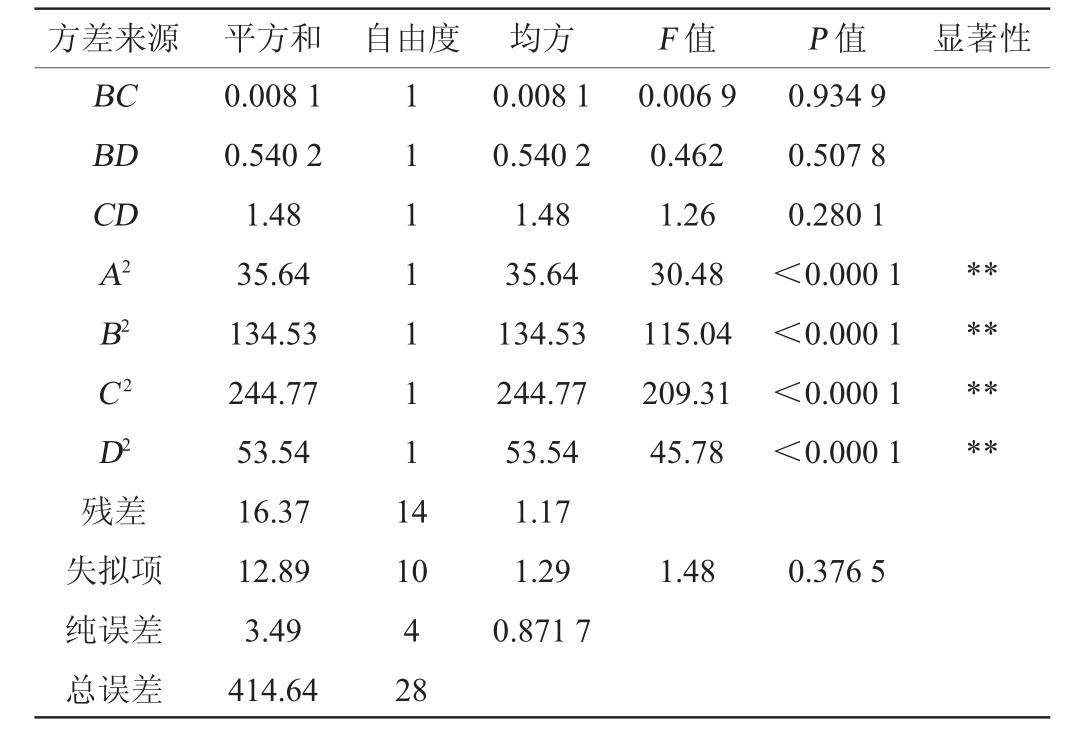
方差来源 平方和 自由度 均方 F 值 P 值 显著性BC BD CD A2 B2 C2 D2残差失拟项纯误差总误差0.008 1 0.540 2 1.48 35.64 134.53 244.77 53.54 16.37 12.89 3.49 414.64 1 1 1 1 1 1 1 1 4 0.006 9 0.462 1.26 30.48 115.04 209.31 45.78 0.934 9 0.507 8 0.280 1<0.000 1<0.000 1<0.000 1<0.000 1********10 4 28 0.008 1 0.540 2 1.48 35.64 134.53 244.77 53.54 1.17 1.29 0.871 7 1.48 0.376 5
使用Design Expert 8.0.6软件对表2试验数据进行二次多元回归拟合,得到酶活保留率(R1)与Ca2+(A)、甘油(B)、Tween 20(C)和明胶(D)添加量的二次多项式回归模型方程式如下:

由表3可知,模型的P值<0.01,极显著,失拟项P值=0.375 6>0.05,不显著,表明该模型方差分析有意义,能够进行有效预测。决定系数R2=0.9605,调整决定系数R2adj=0.9210,表明回归方程与试验拟合的效果较好。由P值可知,一次项A、C,二次项A2、B2、C 2、D2对结果影响极显著(P<0.01)。由F值可知,各因素对结果影响顺序为Ca2+添加量(A)>Tween 20添加量(C)>甘油添加量(B)>明胶添加量(D)。
各因素间交互作用对结果影响的响应面及等高线见图6。响应面坡度越陡,等高线越接近椭圆,说明两者交互作用越显著。由图6可知,各因素交互作用对结果影响均不显著(P>0.05)。这与方差分析结果一致。
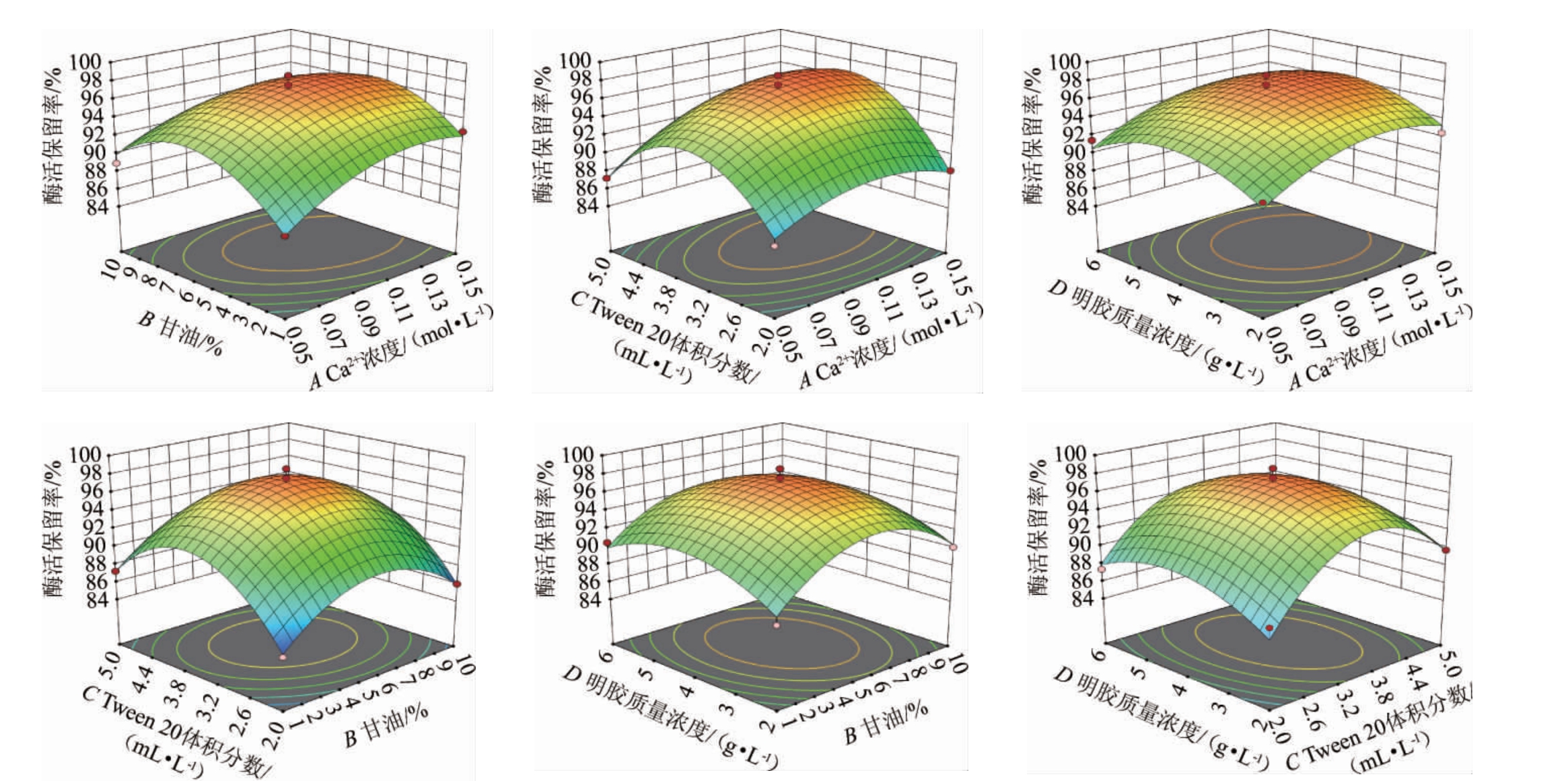
图6 各因素间交互作用对酶活保留率影响的响应面及等高线
Fig.6 Response surface plots and contour lines of effects of interaction between various factors on enzyme activity retention rates
通过Design Expert 8.0.6软件分析得到最佳保护剂配方为:Ca2+添加量0.15 mol/L、甘油添加量5.41%、Tween 20添加量3.78 ml/L、明胶添加量4.10 g/L。在此优化条件下,酶活保留率预测值为96.76%。为了实际操作的可行性,将最佳保护剂配方修正为:Ca2+添加量0.15 mol/L、甘油添加量5.4%、Tween 20添加量3.8 ml/L、明胶添加量4.0 g/L。在此优化条件下进行3次平行验证试验,酶活保留率实际值为97.43%,与预测值偏差较小,说明响应面模型构建合理,预测结果准确。
2.6 普鲁兰酶与复合保护剂对马铃薯淀粉糖化DE值的影响
不同处理的糖化酶实验组分别对马铃薯淀粉进行40 h糖化,结果见图7。由图7可知,糖化20 h时,加入普鲁兰酶及保护剂的糖化液葡萄糖当量(dextrose equivalency,DE)值达到50.72%,比未加的提高了9.61%。在糖化40 h时,仅加糖化酶的糖化液DE值仅为46.57%,添加普鲁兰酶的糖化液DE值为49.70%,提高了3.3%。进一步加入保护剂的糖化液DE值达到了58.35%,比糖化酶组提高了11.78%,也比双酶组提高了8.65%。普鲁兰酶和保护剂均可显著提高淀粉的糖化液的DE值。本实验中的糖化液DE值与高洁[21]研究70 ℃下淀粉糖化结果相似,推测长时间高温糖化导致酶保留率逐渐降低。
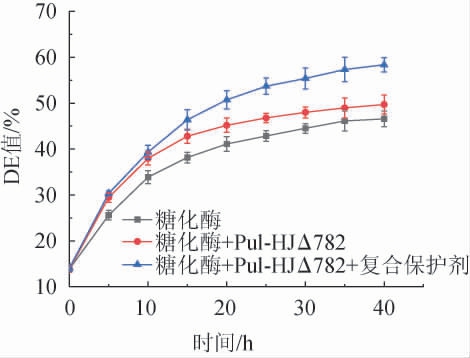
图7 保护剂对普鲁兰酶水解马铃薯淀粉的影响
Fig.7 Effect of protectant on hydrolysis of potato starch by pullulanase
2.7 讨论
Pul-HJΔ782普鲁兰酶基因来源于一株分离自深海热液口的古菌HJ21,该酶的耐高温特性具有潜在的应用价值[22]。WU X等[18]对该酶C端序列的截短并在E.coli BL21中异源表达,提高了该酶的热稳定性。本研究首次将截短的普鲁兰酶基因在E.coli中采用冷休克诱导的方式进行表达,酶活力从1.5 U/mL[18]提高到2.8 U/mL,提高了86.67%。快速降温激活冷休克启动子cspA被激活,可能提高了蛋白的表达量,分子伴侣基因也被激活,从而降低目标蛋白的细胞毒性并减少包涵体生成[23],对酶蛋白起到保护作用[24]。冷休克诱导时的低能环境,有助于提高蛋白质结构的灵活性和蛋白质的稳定性。同时,酶蛋白的稳定性和表达的可溶性得到提升[25]。在冷休克载体pColdI 中,位于cspA 5'-UTR之后的五密码子序列5'-ATGAATCACAAAGTG-3'(MNHKV)已被证明可以增强翻译起始。普鲁兰酶的高效表达结果和QING G L等[26]的研究结果相符。
在淀粉制糖中,需要普鲁兰酶具有超高的作用温度和热稳定性[27]。本研究中高效表达的超高温普鲁兰酶Pul-HJΔ782的作用温度高,热稳定性强。付巧[28]通过克隆表达得到了来自海栖热孢菌的重组普鲁兰酶,在90 ℃下保温1 h后酶活保留80%以上,本研究中Pul-HJΔ782在相同温度条件下保温4 h后仍能达到相同水平,Pul-HJΔ782显然更具优势,且相较于WU X等[18]使用的pET系列载体,冷休克表达系统对IPTG剂量的需求量低和敏感度都更低,可以有效降低发酵成本。通过单因素筛选和响应面优化确定了复合保护剂,添加复合保护剂后该酶的酶活保留率(97.43%)在90 ℃条件下保温12 h后远大于郝秋娟等[29]在β-葡聚糖酶中添加复合保护剂后60 ℃条件下处理2 h时酶活保留率57.06%。Pul-HJΔ782对糖化液DE值的提高幅度大于丛慧慧等[30]使用酸性普鲁兰酶糖化72 h后的1.51%。综上,本研究结果可为超高温普鲁兰酶Pul-HJΔ782在淀粉制糖领域中的应用提供参考。
3 结论
本研究将古菌T.siculi HJ21的普鲁兰酶Pul-HJΔ782基因克隆至宿主E.coli BL21中通过冷休克诱导实现高效表达。利用镍柱层析纯化得到纯酶并研究了其酶学性质。结果显示,普鲁兰酶Pul-HJΔ782具有较好的热稳定性。基于单因素试验结合Box-Behnken响应面试验优化重组普鲁兰酶Pul-HJΔ782的热稳定性复合保护剂配方为Ca2+0.15 mol/L、甘油5.4%、Tween 20 3.8 ml/L、明胶4.0 g/L。在该优化条件下,90 ℃保温12 h后,酶活保留率为97.43%,比对照组提高了34.94%。同时添加保护剂之后的Pul-HJΔ782对马铃薯淀粉进行糖化,40 h后糖化液DE值达到58.35%,比未添加保护剂的糖化液提高了11.78%。结果表明,普鲁兰酶Pul-HJΔ782添加复合保护剂后可以进一步提高其热稳定性,从而有效提升糖化效率。本研究为超高温普鲁兰酶在淀粉糖化工业中的应用提供参考依据。
[1]HAKI G D,RAKSHIT S K.Developments in industrially important thermostable enzymes:a review[J].Bioresource Technol,2003,89(1):17-34.
[2]MOUKAMNERD C,KINO-OKA M,SUGIYAMA M,et al.Ethanol production from biomass by repetitive solid-state fed-batch fermentation with continuous recovery of ethanol[J].Appl Microbiol Biotechnol,2010,88(1):87-94.
[3]HII S L,TAN J S,LING T C,et al.Pullulanase:role in starch hydrolysis and potential industrial applications[J].Enzyme Res,2012,2012(3):921362.
[4]KAHAR U M,CHAN K G,SANI M H,et al.Effects of single and co-immobilization on the product specificity of type I pullulanase from Anoxybacillus sp.SK3-4[J].Int J Biol Macromol,2017,104(Pt A):322-332.
[5]WANG X, NIE Y, XU Y.Industrially produced pullulanases with thermostability:Discovery,engineering,and heterologous expression[J].Bioresour Technol,2019,278(19):360-371.
[6]CRABB W D, MITCHINSON C J T I B.Enzymes involved in the processing of starch to sugars[J].Trends Biotechnol,1997,15(9):349-352.
[7]NISHA M,SATYANARAYANA T.Characteristics,protein engineering and applications of microbial thermostable pullulanases and pullulan hydrolases[J].Appl Microbiol Biotechnol,2016,100(13):5661-5679.
[8]CHEN W B,NIE Y,XU Y,et al.Enhancement of extracellular pullulanase production from recombinant Escherichia coli by combined strategy involving auto-induction and temperature control[J].Bioproc Biosyst Eng,2014,37(4):601-608.
[9]DUAN X,CHEN J,WU J.Optimization of pullulanase production in Escherichia coli by regulation of process conditions and supplement with natural osmolytes[J].Bioresource Technol,2013,146(13):379-385.
[10]GOMES I, GOMES J, STEINER W.Highly thermostable amylase and pullulanase of the extreme thermophilic eubacterium Rhodothermus marinus:production and partial characterization[J].Bioresource Technol,2003,90(2):207-214.
[11]PARK Y U,JUNG J H, SEO D H, et al.GH57 amylopullulanase from Desulfurococcus amylolyticus JCM 9188 can make highly branched cyclodextrin via its transglycosylation activity[J].Enzyme Microb Technol,2018,114(34):15-21.
[12]CHEN A,SUN Y,ZHANG W,et al.Downsizing a pullulanase to a small molecule with improved soluble expression and secretion efficiency in Escherichia coli[J].Microb Cell Fact,2016,15(36):1-10.
[13]DUAN X,WU J.Enhancing the secretion efficiency and thermostability of a Bacillus deramificans pullulanase mutant(D437H/D503Y)by N-terminal domain truncation[J].Appl Environ Microbiol,2015,81(6):1926-1931.
[14]DUAN X,ZOU C,WU J.Triton X-100 enhances the solubility and secretion ratio of aggregation-prone pullulanase produced in Escherichia coli[J].Bioresource Technol,2015,194(15):137-143.
[15]XU B,YANG Y J, HUANG Z X, et al.Cloning and overexpression of gene encoding the pullulanase from Bacillus naganoensis in Pichia pastoris[J].J Microbiol Biotechn,2006,16(8):1185-1191.
[16]王淑军,陆兆新,吕明生,等.一株深海热液口超嗜热古菌的分类鉴定及高温酶活性研究[J].南京农业大学学报,2009,32(2):130-136.
[17]王淑军,吕明生,李华钟,等.深海古菌Thermococcus siculi HJ21高温普鲁兰酶基因的克隆及表达[J].食品科学,2010,31(19):309-312.
[18]WU X,DOU B,WANG B,et al.Improved stability and hydrolysates of hyperthermophilic GH57 type II pullulanase from the deep-sea archaeon Thermococcus siculi HJ21 by truncation[J].Catalysts,2023,13(3):453.
[19]徐金利.超嗜热古菌Thermococcus siculi HJ21产高温普鲁兰酶的研究[D].无锡:江南大学,2009.
[20]HASSABO A A,SELIM M H,SAAD M M,et al.Optimization of l-methioninase and l-arginase production by newly isolated marine yeast using response surface methodology[J].Biocatal Agr Biotechnol,2022,42(3):102383.
[21]高洁.耐热糖化酶糖化条件及酶学性质的研究[D].保定:河北大学,2012.
[22]徐金利,吕明生,王淑军,等.嗜热古菌Thermococcus sp.HJ21产高温普鲁兰酶条件和酶学性质[J].食品与生物技术学报,2009,28(2):243-249.
[23]邵蔚蓝,郭星星,沙冲.大肠杆菌热休克或冷休克启动子调控的基因表达载体[J].微生物学通报,2017,44(6):1464-1470.
[24]LE Y,PENG J,WU H,et al.An approach to the production of soluble protein from a fungal gene encoding an aggregation-prone xylanase in Escherichia coli[J].PLoS One,2011,6(4):e18489.
[25]CHARLES J,MASNODDIN M,NAZAIE F,et al.Structure and function of a novel cold regulated cold shock domain containing protein from an obligate psychrophilic yeast, Glaciozyma antarctica[J].Adv Polar Sci,2020,31(31):137-145.
[26]QING G L, MA L C, KHORCHID A, et al.Cold-shock induced highyield protein production in Escherichia coli[J].Nat Biotechnol, 2004,22(34):877-882.
[27]NIU D,CONG H, ZHANG Y, et al.Pullulanase with high temperature and low pH optima improved starch saccharification efficiency[J].Sci Rep,2022,12(1):21942.
[28]付巧.Thermotoga maritima MSB8普鲁兰酶的重组表达及分子改造研究[D].武汉:中南民族大学,2024.
[29]郝秋娟,李永仙,李崎.淀粉液化芽孢杆菌产β-葡聚糖酶培养基优化以及酶稳定剂的研究[J].中国酿造,2006,25(4):18-22.
[30]丛慧慧,张亚楠,牛丹丹,等.酸性普鲁兰酶显著提升淀粉酶法制备葡萄糖的效率[J].食品与发酵工业,2022,48(17):16-20.