大曲在中国传统文化中具有至关重要的地位[1]。作为白酒酿造的起始发酵剂[2],大曲的质量直接决定白酒的品质。大曲中存在的风味物质对白酒的香气产生影响[3]。不同类型大曲的微生物群落丰度、多样性均存在差异,因此适用于生产不同香型的白酒,其中低温大曲适用于生产清香型白酒[4],中温大曲适用于生产浓香型白酒[5],高温大曲适用于酱香型白酒的生产[6]。
近年来,研究白酒微生物的方法逐渐从传统微生物分离培养法转向分子生物技术。其中,聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denatured gradient gel electrophoresis,PCR-DGGE)技术、脱氧核糖核酸(deoxyribonucleic acid,DNA)克隆文库和高通量测序等方法被广泛应用于白酒微生物研究。WANG H Y等[7]利用PCRDGGE分析多种酱香型大曲微生物种群,结果表明,不同来源的酱香大曲微生物群落组成存在显著差异。另外,陈玲等[8]运用16S rDNA克隆文库法和高通量测序法对浓香型大曲微生物群落结构进行比较分析,结果表明,高通量测序的方法能够检测到更多微生物。如张会敏等[9]采用非培养方法,构建了16S rDNA克隆文库,结果表明,高温放线菌(Thermoactinomyces sanguinis)是古井高温大曲的主要真菌种类,而中温大曲的优势菌为枝芽孢菌属(Virgibacillus)、乳杆菌属(Lactobacillus)等类群。施思等[10]利用高通量测序技术探讨了浓香型大曲在贮藏过程中微生物多样性的变化。但不同香型、工艺大曲间微生物群落结构的差异需要进一步的研究
为研究不同香型大曲微生物群落结构的差异,利用高通量测序技术探究不同大曲优势微生物菌属,利用Spearman相关性分析法分析优势菌属与4种不同香型大曲糖化力、液化力、酯化力、发酵力的相关性,以期对不同香型大曲微生物类群分析及品质提升提供依据和理论支撑,研究不同香型大曲间微生物结构的异同之处。
1 材料与方法
1.1 材料与试剂
浓香大曲(标记为HN2):采自湖北咸宁某酒厂;凤香(清浓兼香型)大曲(标记为FX1):采自陕西某酒厂;酱香大曲(标记为LJ1):采自四川某酒厂;清香大曲(标记为FQ1):采集于山西某酒厂。
1.2 仪器与设备
5430 R小型台式离心机:德国Eppendorf公司;LDZX-50KBS高压蒸汽灭菌锅:上海申安医疗器械厂;WFJ 2000分光光度计:江苏海门市麒麟医用仪器厂;GeneAmp 9700型聚合酶链式反应(PCR)仪:美国ABI公司;MiSeq测序仪:美国Illumina公司。
1.3 方法
1.3.1 样品处理
将收集的4种用于酿酒生产的曲块在无菌研磨机粉碎至过50目筛,并均匀混合后,各取300 g用于理化指标的分析,同时取出适量试样于-20 ℃冰箱中保存备用。
1.3.2 微生物多样性分析
DNA提取:使用FastDNAR Spin Kit for Soil试剂盒从0.5 g大曲样本中抽提总DNA,并采用1%琼脂凝胶电泳检验完整性。
PCR扩增:采用通用引物341F(5'-ACTCCTACGGGAGGCAGCAG-3')、806R(5'-GGACTACHVGGGTWTCTAAT-3')PCR扩增16S rRNA的V3~V4高变区,以鉴定样本中的细菌;以ITS1F(5'-TCCGTAGGTGAACCTGCGG-3')、ITS1R(5'-GCTGCGTTCTTCATC-GATGC-3')为引物进行聚合酶链式反应(PCR)扩增,用以鉴定曲样中的真菌。PCR扩增体系(50 μL):DNA 10 ng,通用引物各1 μL,PCR混合液25 μL,采用双蒸水(ddH2O)定容至50 μL。PCR扩增条件:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,35次循环;最终72 ℃延伸5 min[11]。将PCR产物纯化后用于测序。最终,文库的测序任务交由上海美吉生物医药科技有限公司完成。
1.3.3 理化指标的检测
糖化力、液化力、酯化力、发酵力的检测:分别参照QB/T 4257—2011《酿酒大曲通用分析方法》的斐林试剂滴定法、碘液褪色法、皂化回流法、发酵栓测定法[12]。
1.3.4 分析方法
将序列相似度97%的聚合在一起作为同一操作分类单元(operational taxonomic units,OTU)。“韦恩图”用以描述不同大曲间共有或独有的OTU数,椭圆交叉的区域为共有OTU,未交叉的区域为大曲独有的OTU数。“Spearman相关性分析”通常用于测量两个变量之间的非线性关系的相关性计算方法,相关性热图中红色的色块代表两变量之间具有正相关性,蓝色的色块代表负相关性越强,色块颜色越深则代表相关性越强。
2 结果与分析
2.1 大曲理化指标检测结果
大曲样品理化指标检测结果见表1。
表1 大曲样品理化指标检测结果
Table 1 Determination results of physicochemical indexes of Daqu samples
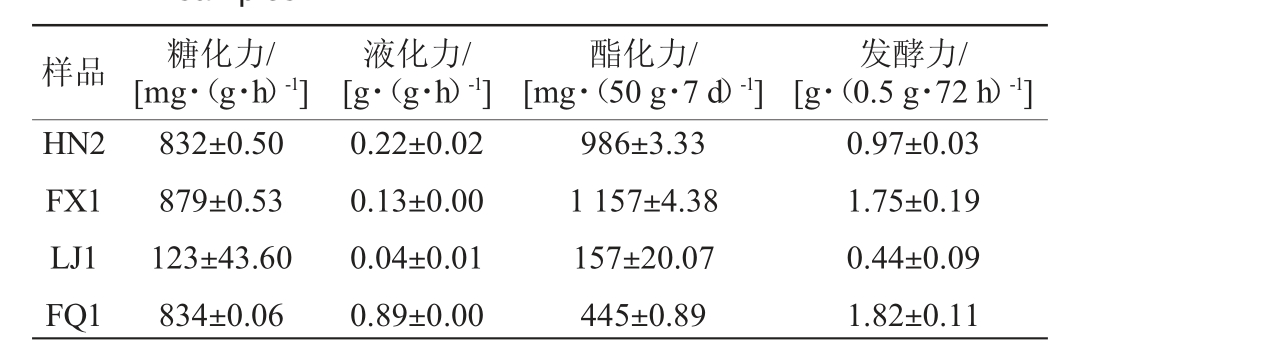
样品 糖化力/[mg·(g·h)-1]液化力/[g·(g·h)-1]酯化力/[mg·(50 g·7 d)-1]发酵力/[g·(0.5 g·72 h)-1]HN2 FX1 LJ1 FQ1 832±0.50 879±0.53 123±43.60 834±0.06 0.22±0.02 0.13±0.00 0.04±0.01 0.89±0.00 986±3.33 1 157±4.38 157±20.07 445±0.89 0.97±0.03 1.75±0.19 0.44±0.09 1.82±0.11
由表1可知,曲样LJ1的糖化力、液化力、酯化力及发酵力均最低,其中曲样FQ1液化力、发酵力最高,分别为0.89 g/(g·h)、1.82 g/(0.5 g·72 h);曲样FX1糖化力、酯化力最高,分别为879 mg/(g·h)、1 157 mg/(50 g·7 d)。凤香型曲样FX1、浓香型曲样HN2及清香型曲样FQ1糖化力差异较小;而酱香型曲样LJ1的理化指标与其他3个曲样的差异较大。
2.2 测序结果统计
2.2.1 序列统计
对曲样DNA进行测序,通过双端序列质控拼接后获得了242 866条细菌优化序列,这些序列的平均长度约为427 bp。测序长度主要分布在401~450 bp之间,占总数的99.83%。这与设计引物扩增的目标长度非常接近,表明测序结果的质量较好。此外,另取得345 465条真菌优化序列。这些序列的平均长度为266 bp,测序结果在201~300 bp范围内最为集中,与设计引物扩增序列的长度大致一致,约为264 bp左右。由此可以说明本次测序结果在合理的范围内。
2.2.2 测序有效性分析
稀释曲线可用于比较不同测序数据量的样本中的物种丰富度。当曲线趋向平缓时,增加的数据量只会产生少量新的操作分类单元(OTU);相反,如果曲线呈下降趋势,则进一步的测序可能会产生更多新的OTU[13]。Shannon(香农)指数是一种反映样本微生物多样性的指数,可以反映不同测序数量时各样本的微生物多样性情况。大曲样品细菌(a)、真菌(b)稀释曲线见图1,Shannon指数曲线见图2。由图1可知,细菌稀释曲线在25 000~30 000条范围内、真菌稀释曲线在35 000~50 000条内稀释曲线趋于平缓,增加的测序深度只会产生少量的OTU;由图2可知,各个样本的Shannon指数曲线在测序深度为0~1.287 7条范围内快速上升,而增加测序深度后呈现出先增加后趋于平缓的趋势。这说明测序数据量相对合理,测序深度能够有效呈现大曲样品中绝大多数微生物物种的信息。
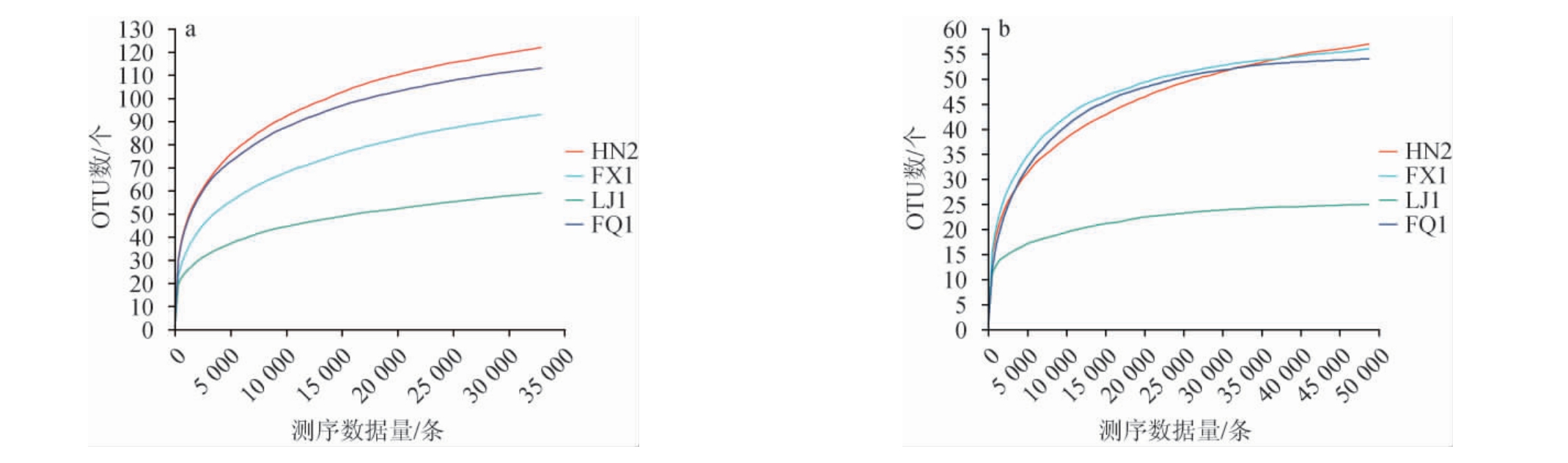
图1 大曲样品细菌(a)及真菌(b)稀释曲线
Fig.1 Rarefaction curves of bacteria (a) and fungi (b) in Daqu samples
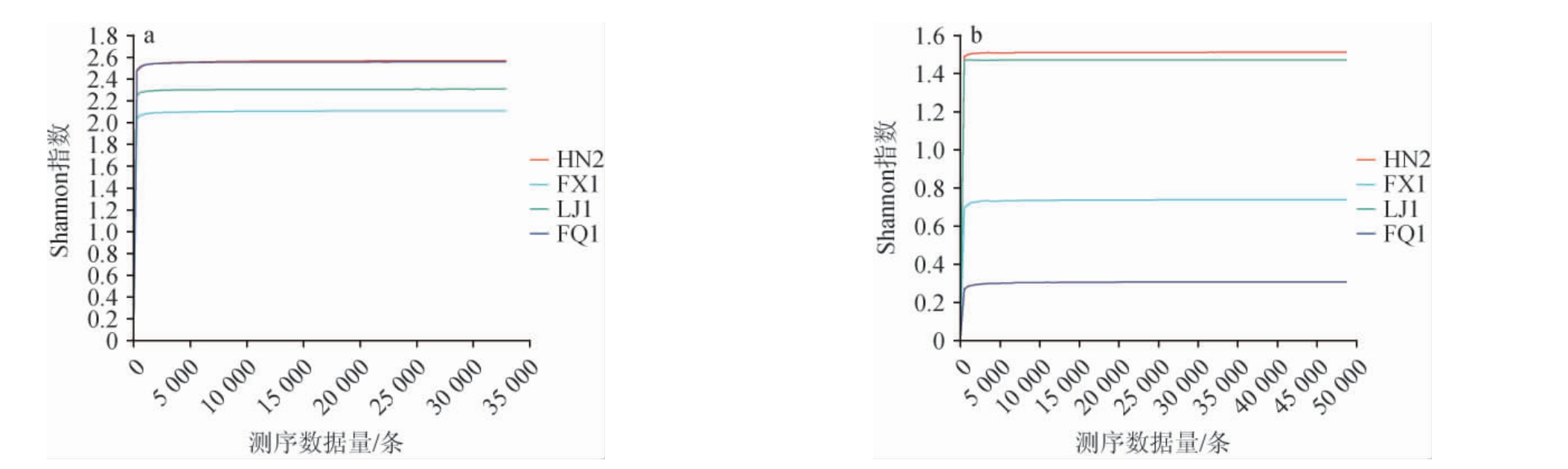
图2 大曲样品细菌(a)及真菌(b)Shannon指数曲线
Fig.2 Shannon index curves of bacteria(a)and fungi(b)in Daqu samples
2.2.3 大曲样品微生物Alpha多样性分析
由表2可知,曲样HN2的OTU数最高,为122个,其次是曲样FQ1(113个)、曲样FX1(93个),曲样LJ1最低(59个);曲样HN2、FX1、LJ1、FQ1的优化序列分别为46 527条、53 647条、86 818条、55 874条,占有效序列的比例较高;Chao1指数和ACE指数是用于计算群落丰度的指数,其数值越大表示样品中微生物的丰度越高,Shannon指数和Simpson指数可用于作为衡量微生物群落多样性的标志[14],曲样HN2微生物丰度最高,Chao1指数、ACE指数分别为164、143,其次为曲样FQ1。曲样HN2的微生物群落多样性最高,Shannon指数为2.56,Simpson指数为0.13,其次为曲样FQ1。
表2 大曲样品细菌Alpha多样性分析结果
Table 2 Alpha diversity analysis results of bacteria in Daqu samples
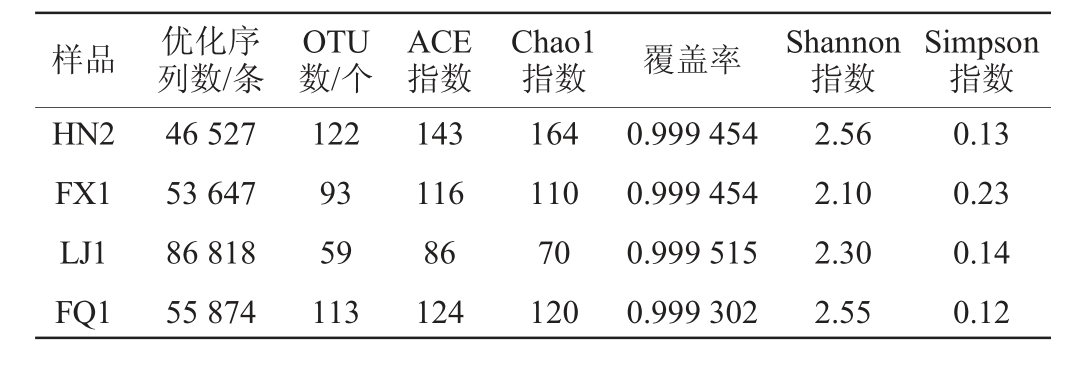
样品 优化序列数/条OTU数/个ACE指数Chao1指数 覆盖率 Shannon指数Simpson指数HN2 FX1 LJ1 FQ1 46 527 53 647 86 818 55 874 122 93 59 113 143 116 86 124 164 110 70 120 0.999 454 0.999 454 0.999 515 0.999 302 2.56 2.10 2.30 2.55 0.13 0.23 0.14 0.12
由表3可知,5个样品的优化序列数量均>54 000条。在97%相似度条件下,曲样HN2获得的OTU数目最多,为57个,其次是曲样FX1、FQ1、LJ1,分别为56个、54个、25个。曲样HN2的ACE、Chao1指数明显高于其他曲样,分别为64、65,说明其真菌群落丰富度明显高于其他4个曲样。同样,曲样HN2的Shannon指数最高,为1.51。另外,4个曲样的覆盖率均超过0.999,即表明各样本的文库覆盖率非常高,测序结果具有高度真实可靠性。此外,由表2、表3表明,细菌的微生物群落丰富度较真菌明显更高。
表3 大曲样品真菌Alpha多样性分析结果
Table 3 Alpha diversity analysis results of fungi in Daqu samples
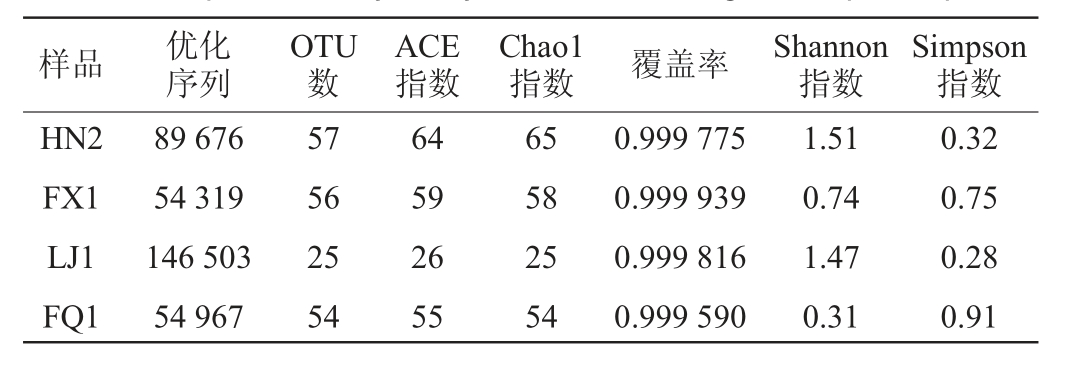
样品 优化序列OTU数ACE指数Chao1指数 覆盖率 Shannon指数Simpson指数HN2 FX1 LJ1 FQ1 89 676 54 319 146 503 54 967 57 56 25 54 64 59 26 55 65 58 25 54 0.999 775 0.999 939 0.999 816 0.999 590 1.51 0.74 1.47 0.31 0.32 0.75 0.28 0.91
2.2.4 大曲样品微生物多样性Venn图分析
不同大曲样品细菌和真菌OTU数的韦恩图见图3。由图3可知,4个大曲样品的细菌OTU总数为387个,共有的OTU数为22个,占总OTU数的5.6%。此外,曲样HN2、FX1、LJ1、FQ1分别有39、15、18、33个独特的细菌OTU,反映了这些样品之间的细菌OTU组成的相似程度和差异情况。曲样HN2和LJ1共有的OTU数为4个,曲样FQ1和FX1共有的OTU数为17个,曲样FX1和HN2共有的OTU数为18个,曲样FQ1和LJ1共有的OTU数为3个。可知曲样FX1与HN2归类相似度最高,而曲样FX1与FQ1归类相似度相对较高,这可能是与凤香型酒兼具清香型酒和浓香型酒的特点有关。
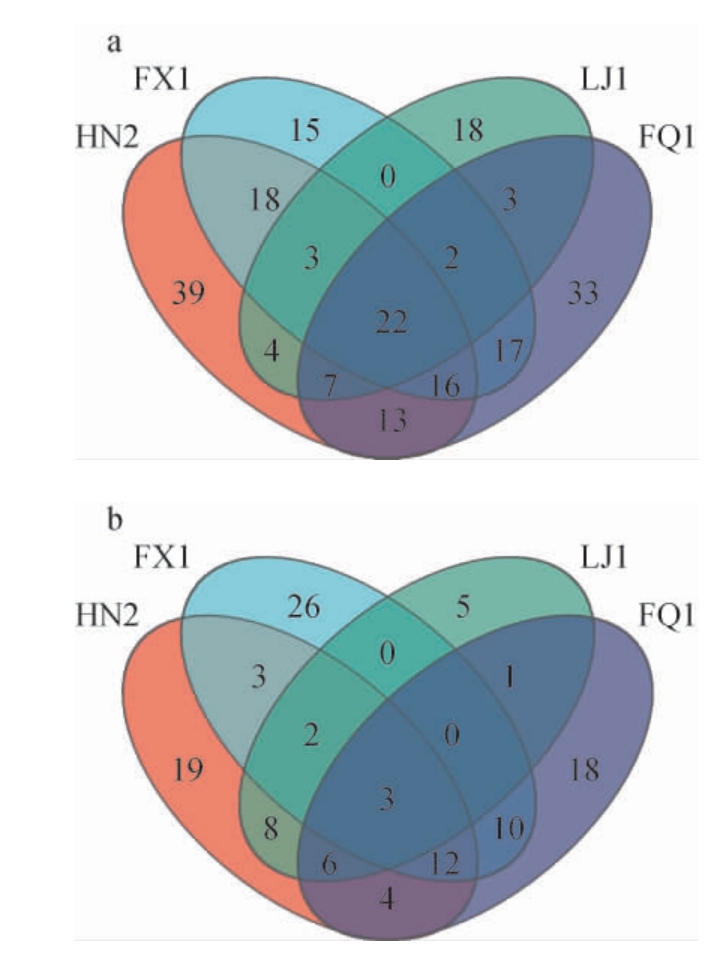
图3 不同大曲样品细菌(a)和真菌(b)操作分类单元数的韦恩图
Fig.3 Venn diagram of operational taxonomic units of bacteria (a)and fungi (b) from different Daqu samples

图4 基于门(a)、属(b)水平大曲样品细菌群落结构
Fig.4 Bacterial community structure of Daqu samples based on phyla (a) and genus (b) levels
4个大曲样品的真菌OTU总数为192个,共有OTU数为11个,占总数的1.5%。此外,曲样HN2、FX1、LJ1和FQ1各自具有独特的OTU数量分别为19、26、5、18个。曲样HN2的真菌多样性相对最高。曲样FX1与FQ1共有OTU数为10个,曲样HN2与LJ1共有的OTU数为8个。曲样FX1与FQ1在细菌、真菌的群落相似度均较高。
2.3 大曲样品细菌群落结构分析
4种曲样在门水平的群落结构上均较为类似,共检出4个平均相对丰度>1%的菌门,分别为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)、蓝藻菌门(Cyanobacteria),其中蓝藻菌门(Cyanobacteria)、厚壁菌门为曲样HN2、LJ1独有的优势细菌门,相对丰度分别为91.88%、98.21%,与陈玲等[8]对浓香型大曲中厚壁菌门丰度相对较高的结论一致。这些微生物具有很强的环境适应性,能够在相对极端的条件下维持生长和代谢的能力。放线菌门在曲样FQ1中相对丰度最高,为17.92%,在曲样HN2、LJ1中仅少量检出,放线菌广泛存在于土壤环境、海洋环境、植物体及其他极端自然生态环境中。研究表明,过量的乳酸乙酯将导致酒质酸涩感明显,而放线菌在大曲发酵过程中产生的脂肪酶、磷酸酶能够减少乳酸乙酯的产生;同时放线菌本身能够合成白酒中常见的风味成分,如己酸乙酯、苯乙醇、吡嗪类物质[15]。曲样FX1中变形菌门(Proteobacteria)的相对丰度达46.36%,其在曲样HN2、FQ1中相对丰度分别为5.07%、12.30%;此外,在曲样HN2、FX1、FQ1中检出少量蓝藻门类细菌。
4种大曲样品总共检测到88个不同的细菌属,对相对丰度排名前21的细菌属进行分析,将相对丰度<1%的菌属集合归纳为others。葡萄球菌属(Staphylococcus)在曲样HN2、FQ1中相对丰度较高,其相对丰度分别为43.08%、34.44%,泛菌属(Pantoea)在曲样FX1、FQ1中相对丰度较高,分别为43.73%、11.43%、Kroppenstedtia在曲样LJ1、FQ1中相对丰度较高,分别为18.57%、9.16%、芽孢杆菌属(Bacillus)、枝芽孢杆菌属(Virgibacillus)在曲样LJ11中相对丰度较高,为35.35%、18.98%。魏斯氏属(Weissella)在曲样HN2中较高,为14.19%。
曲样FQ1中葡萄球菌属(34.27%)、链霉菌属(Streptomyces)(15.53%)、泛菌属(Pantoea)(11.43%)、Kroppenstedtia(9.16%)、芽孢杆菌属(3.21%)相对丰度较高;曲样FX1中占主导地位的菌属是泛菌属(43.79%)、Companilactyobacillus(35.79%)、葡萄球菌属(5%),这与李艳婷等[16]得到的清香型大曲优势菌属为乳酸菌属、小球菌属、明串珠菌属、魏斯氏菌属、泛菌属的研究结果较为类似,但本研究的区别在于,曲样FQ1中存在较高丰度的葡萄球菌属,葡萄球菌广泛分布于空气土壤等自然环境中,山西汾曲历经粉碎、压曲块、卧曲、上霉期、晾霉期、潮火期、大火期、后火期、养曲等工序而成,其大曲的制作在半开放的环境中进行,受环境微生物的影响较大,从而形成汾酒大曲微生物群落中葡萄球菌属具有一定丰度的现象[14]。曲样HN2中葡萄球菌属(43.25%)、罗伊氏乳杆菌属(Limosilactobacillus)(17.74%)、魏斯氏菌属(14.34%)、芽孢杆菌属(9.95%)等为优势菌属,与王彩虹[17]研究中对浓香型大曲中的优势菌属结果较相似。曲样LJ1、FQ1中芽孢杆菌属相对丰度分别为35.35%、3.45%,有研究表明,芽孢杆菌属(Bacillus)是清香型、酱香型白酒发酵过程的共有优势细菌属[18-19],如火山渣芽孢杆菌属(Volcanicslabacillus)在酱香型曲样LJ1占一定比例(9.25%),这与酱香型白酒生产的特点相关,即采用高温大曲,高温入窖,高温流酒等特殊工艺[20],较高的温度能够抑制霉菌和酵母等的生长,形成以嗜热菌占主导地位的微生物群落结构[2,21-23]。因此,酱香型大曲LJ1细菌群落结构与清香型大曲FQ1、浓香型大曲HN2、凤香型大曲FX1具有明显差异,凤香型大曲FX1兼具浓香型大曲HN2、清香型大曲FQ1的特点,具有一定丰度的葡萄球菌属及高相对丰度的泛菌属。
2.4 大曲样品真菌群落结构分析
基于门、属水平大曲样品真菌群落组成见图5。由图5a可知,曲样HN2检出了子囊菌门(Ascomycota)和担子菌门(Basidiomycota)。其中,子囊菌门占据绝对优势,达到了93.27%,而担子菌门占比极低,为5.38%,其他3个曲样仅检出了子囊菌门。检测结果与张会敏等[9]利用ITS rDNA克隆文库法获得的中温大曲中真核生物门类的研究结果相似。这是由于清香型大曲、浓香型大曲及酱香型大曲在制曲过程中通常在较高的温度范围内操作,最高温度一般在40~50 ℃、50~60 ℃、60~70 ℃甚至更高[24],然而大多数真菌的适宜生长温度范围通常为20~30 ℃,致死温度范围通常为50~60 ℃[25],因此仅有少部分耐热和嗜热真菌在大曲样本中表现为优势菌属。
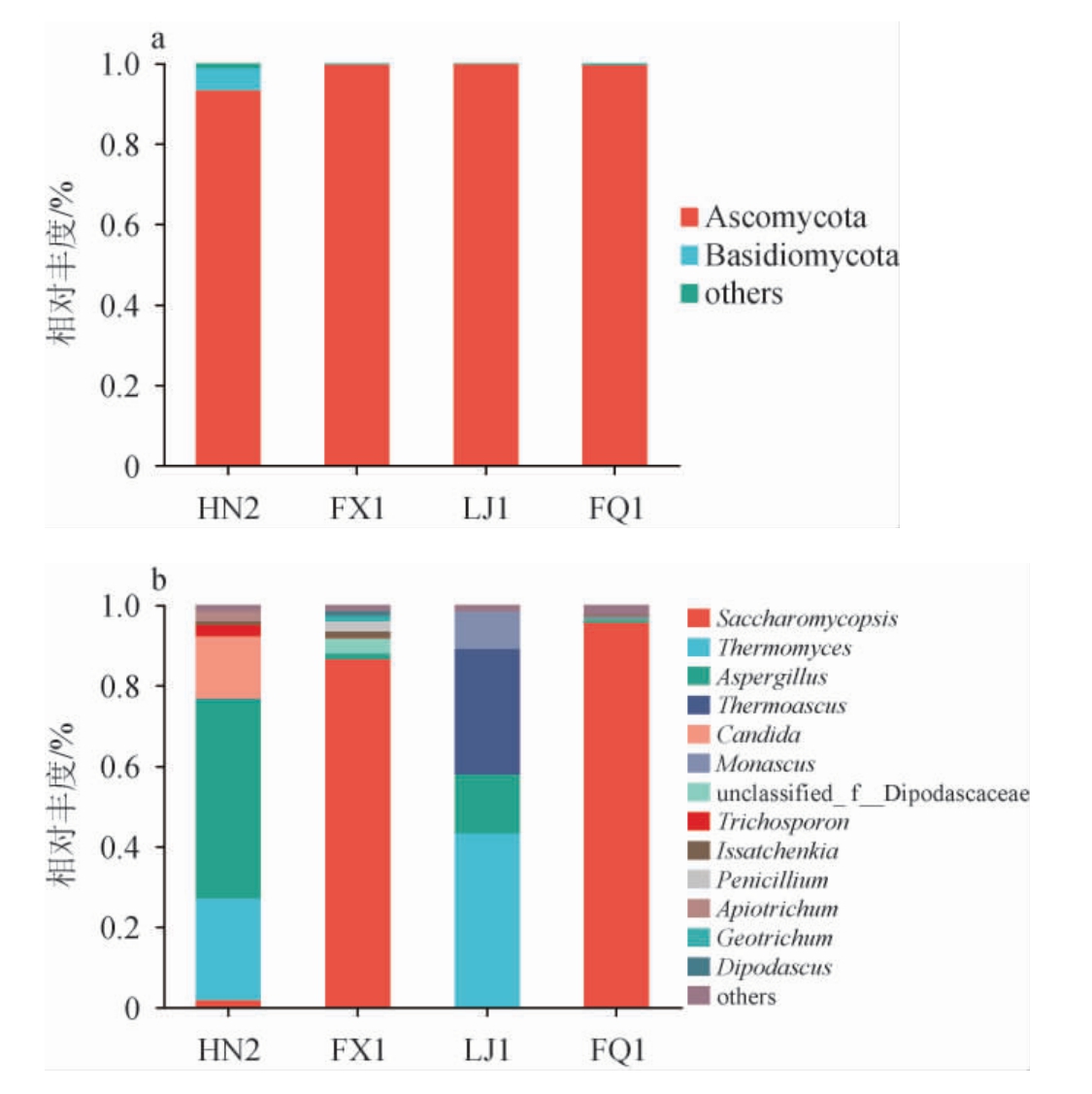
图5 基于门(a)、属(b)水平大曲样品真菌群落结构
Fig.5 Fungi community structure of Daqu samples based on phyla (a) and genus (b) levels
4种曲样总共检测到48个不同的真菌属类,对相对丰度排名前13种的细菌属进行分析,将相对丰度<1%的菌属集合归类为others。复膜孢酵母属(Saccharomycopsis)在曲样FX1、FQ1中相对丰度较高,分别为86.52%、95.61%;嗜热真菌属(Thermomyces)在曲样HN2、LJ1中相对丰度较高,分别为25.28%、41.19%;曲霉属(Aspergillus)在曲样HN2、LJ1中相对丰度较高,分别为49.55%,14.65%、嗜热子囊菌属(Thermoascus)在曲样LJ1中相对丰度较高,为31.25%;念珠菌属(Candida)在曲样HN2中相对丰度较高,为15.41%。
由图5可得出,在清香型或类清香型大曲样品,如FX1和FQ1中,复膜孢酵母属的丰度极高,而在HN2、LJ1大曲样品中丰度较低,这与王世宽等[26]的研究结果相符,即在清香型白酒对酵母菌的需求较为显著,而浓香型白酒和酱香型白酒对于酵母的需求较少。扣囊复膜孢酵母属(Saccharomycopsis fibulig),属于复膜孢酵母科(Saccharomycopsidaceae),复膜孢酵母属(Saccharomycopsis),又称拟内孢霉(Endomycopsis fibuligera),是一类能产生子囊孢子的二形态酵母[27],应用于大曲制作,能提升强化大曲的糖化力和液化力;应用于麸曲白酒、大曲白酒、小曲白酒酿造生产,提升了白酒酒体的绵柔感、醇甜感;应用于酒糟处理,可提升酒糟的附加值[28]。
真菌群落在大曲样品中的多样性相对较低,但其在出酒率和发酵产香等方面仍发挥着不可或缺的作用。由图5可知,曲样HN2、LJ1中均富含嗜热真菌属和曲霉属。此外,曲样LJ1的嗜热子囊菌属相对丰度较高。这些嗜热真菌属以及嗜热子囊菌属可产生纤维素酶、蛋白酶、淀粉酶和脂肪酶等[29],在高温条件下表现出较强的热稳定性,能在高温环境下维持稳定的催化效率,从而能够使这些酶在发酵过程中发挥重要作用;曲霉属在自然界分布广泛,也是酿酒和食品加工业的重要菌种,不仅具备强大的产淀粉酶和蛋白酶的能力,而且能够代谢有机酸,对白酒的产酒、生香有重要作用[30]。
通过分析发现,4种曲样均含有复膜孢酵母属、曲霉属。青霉菌属(Penicillium)只在曲样FX1中存在;而Apiotrichum、双足囊菌属(Dipodascus)只在曲样HN2中存在。曲样FQ1中鉴定出来的独特真菌菌属包括红曲霉属(Monascus);曲样HN2和LJ1鉴定出来的独特真菌菌属包括嗜热真菌属。因此,凤香型大曲FX1与清香型大曲FQ1在真菌群落结构上较为相似,存在较高丰度的复膜孢酵母属(相对丰度>85%);浓香型大曲HN2、酱香型大曲LJ1在在真菌群落结构上较为相似,均具有较高丰度的嗜热真菌属和曲霉属,不同之处在于,酱香型大曲LJ1具有较高丰度的热子囊菌属。
2.5 优势菌属与理化指标的相关性分析
对相对丰度>1%的细菌、真菌属和4个理化指标进行Spearman相关性分析,结果见图6。
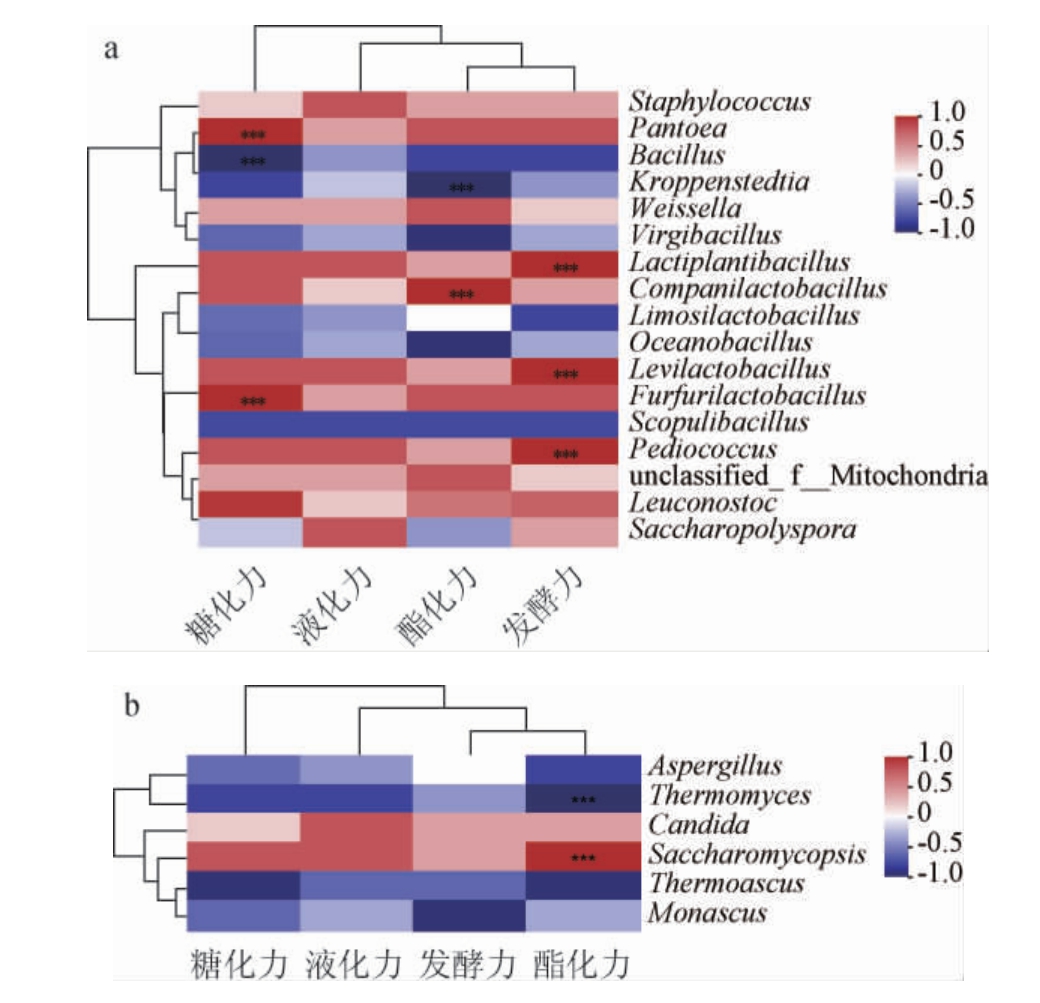
图6 大曲样品理化指标与优势细菌(a)和真菌(b)属相关性分析热图
Fig.6 Heat map of correlation analysis between physiochemical indexes and dominant bacteria (a) and fungi (b) of Daqu samples
红色色块越深代表正相关性越强,蓝色色块越深代表负相关性越强。
“***”代表相关性极显著(P<0.01)。
由图6可知,优势细菌属中泛菌属(Pantoea)、Furfurilactobacillus与大曲样品糖化力之间具有极显著正相关性(P<0.01),芽孢杆菌属(Bacillus)与大曲糖化力之间具有极显著负相关性(P<0.01),与何猛超等[31]的研究结果较为相似。此外,Companilactyobacillus与样品大曲的酯化力之间存在极显著正相关性(P<0.01),Kroppenstedtia与样品大曲的酯化力之间具有极显著负相关性(P<0.01)。
其次,优势细菌属中植物乳杆菌属(Lactiplantibacillus)、促生乳杆菌属(Levilactobacillus)、片球菌属(Pediococcus)等与样品的发酵力之间具有极显著正相关性(P<0.01),植物乳杆菌属、促生乳杆菌属为曲样FX1、FQ1独有的优势菌种,与表1中曲样FX1、FQ1发酵力指标优于曲样HN2、LJ1的结果相符合。研究表明,大曲中乳杆菌属可以产生蛋白酶、淀粉酶、纤维素酶、酒化酶等多种酶类,丰富的酶系对白酒的发酵力具有一定的奉献[32]。
另外,大曲样品中优势真菌属的种类明显少于优势细菌属的种类,但其在发酵过程仍发挥着不可或缺的作用中。嗜热真菌属(Thermomyces)与样品大曲发酵力之间具有极显著负相关性(P<0.01),在本实验中嗜热真菌属为曲样HN2、LJ1的绝对优势菌属,与这二者分别为中高温制曲、高温制曲的工艺有关,与表3中曲样HN2、LJ1发酵力实验结果相吻合。而复膜孢酵母属(Saccharomycopsis)与样品大曲发酵力之间具有极显著正相关性(P<0.01),这与冯雅芳[33]对凤香型大曲的研究结果相近,即凤香型大曲中的发酵能力主要受到酵母菌和霉菌的影响,研究表明,复膜孢酵母属下的扣囊复膜酵母(S.fibuligera)是多种白酒酿造和酒醅中的主要细菌之一,具有多种能力,包括产出有机酸、醇类、酯类和水解淀粉等[34-36]。吴健等[37]对扣囊复膜酵母(S.fibuligera)、毕赤酵母和酿酒酵母在米曲汁培养基中的发酵产酸能力进行比较结果表明,扣囊复膜酵母(S.fibuligera)表现出最强的产酸能力,达到了3.57 g/L,同时还具备一定的产生淀粉酶的潜力。
3 结论
4种不同香型大曲理化指标检测结果表明,曲样FX1糖化力、酯化力最高,曲样FQ1液化力、发酵力最高;高通量测序结果表明,厚壁菌门在曲样HN2、LJ1相对丰度较高;葡萄球菌属(Staphylococcus)、泛菌属(Pantoea)、枝芽孢杆菌属(Virgibacillus)分别在曲样HN2、FX1、LJ1中相对丰度较高,曲样FQ1中链霉菌属(Streptomyces)相对丰度较高;4个曲样中子囊菌门(Ascomycota)相对丰度较高,复膜孢酵母属(Saccharomycopsis)、嗜热真菌属(Thermomyces)、曲霉属(Aspergillus)分别在曲样FQ1、LJ1、HN2相对丰度较高。相关性分析结果表明,Pantoea、Furfurilactobacillus与糖化力之间具有极显著正相关性(P<0.01),Companilactyobacillus与酯化力存在极显著正相关性(P<0.01),植物乳杆菌属(Lactiplantibacillus)及Saccharomycopsis等与发酵力具有极显著正相关性(P<0.01)。
[1]LIU H L, SUN B G.Effect of fermentation processing on the flavor of Baijiu[J].J Agr Food Chem,2018,66(22):5425-5432.
[2]WANG Y R,CAI W C,WANG W P,et al.Analysis of microbial diversity and functional differences in different types of high-temperature Daqu[J].Food Sci Nutr,2020,9(2):1003-1016.
[3]HE G Q,HUANG J,ZHOU R Q,et al.Effect of fortified Daqu on the microbial community and flavor in Chinese Strong-flavor liquor brewing process[J].Front Microbiol,2019,10:56.
[4]凌荔,牟飞燕,袁萌,等.清香型白酒大曲研究进展[J].酿酒,2022,49(6):17-22.
[5]SAKANDAR H A,RAZA H,QAISER F K,et al.Functional microbiota in Chinese traditional Baijiu and Mijiu Qu (starters): A review[J].Food Res Int,2020,138:109830.
[6]邓剑清.酱香型白酒强化高温大曲工艺优化及比较研究[D].福州:福建师范大学,2017.
[7]WANG H Y,GAO Y B,FAN Q W,et al.Characterization and comparison of microbial community of different typical Chinese liquor Daqus by PCRDGGE[J].Lett Appl Microbiol,2011,53(2):134-140.
[8]陈玲,袁玉菊,曾丽云,等.16S rDNA克隆文库法与高通量测序法在浓香型大曲微生物群落结构分析中的对比研究[J].酿酒科技,2015(12):33-6,40.
[9]张会敏,王杰,何宏魁,等.利用非培养技术初步解析古井贡酒大曲真核微生物群落结构[J].食品工业,2014,35(6):158-162.
[10]施思,彭智辅,乔宗伟,等.浓香型大曲贮藏过程中糖化力发酵力变化及真菌多样性分析[J].食品与发酵工业,2017,43(5):76-79.
[11]CHEN C,YANG H Q,LIU J,et al.Systematic review of actinomycetes in the Baijiu fermentation microbiome[J].Foods, 2022, 11(22): 3551-3551.
[12]中华人民共和国工业和信息化部.QB/T 4257—2011 酿酒大曲通用分析方法[S].北京:中国标准出版社,2011.
[13]GUAN T W,YANG H,OU M Y,et al.Storage period affecting dynamic succession of microbiota and quality changes of strong-flavor Baijiu Daqu[J].LWT-Food Sci Technol,2021,139:110544.
[14]葛松涛,孙国昌,寿泉洪,等.不同工艺绍兴酒麦曲微生物菌群多样性分析[J].中国酿造,2023,42(8):140-146.
[15]甄攀,韩英,王军燕,等.不同时期及不同区域汾酒大曲微生物群落结构分析研究[J].中国酿造,2023,42(6):140-145.
[16]李艳婷,郭尚,郭霄飞,等.清香型白酒发酵过程中微生物群落结构变化及与理化性质的相关性[J].中国食品学报,2023,23(5):330-340.
[17]王彩虹.基于克隆文库法研究不同香型大曲微生物群落结构[D].自贡:四川理工学院,2014.
[18]左乾程.不同季节清酱香型白酒发酵微生物菌群结构多样性特征解析[D].贵阳:贵州大学,2021.
[19]JIN Y,LI D Y,AI M,et al.Correlation between volatile profiles and microbial communities: A metabonomic approach to study Jiang-flavor liquor Daqu[J].Food Res Int,2019,121:422-432.
[20]但宇超,吴昊,冯小进,等.长江中下游酱香型白酒生产的研究[J].酿酒,2022,49(6):41-43.
[21]XIE M W,LV F X,MA G X,et al.High throughput sequencing of the bacterial composition and dynamic succession in Daqu for Chinese sesame flavour liquor[J].J I Brewing,2020,126(1):98-104.
[22]YANG J G,DOU X,MA Y Y.Diversity and dynamic succession of microorganisms during Daqu preparation for Luzhou-flavour liquor using second-generation sequencing technology[J].J I Brewing,2018,124(4):498-507.
[23]GAN S H,YANG F,SAHU S K,et al.Deciphering the composition and functional profile of the microbial communities in Chinese Moutai liquor starters[J].Front Microbiol,2019,10:456693.
[24]李大和,李国红.提高浓香型白酒质量的技术措施(二)[J].酿酒科技,2020(10):52-59.
[25]邢来君,李明春,喻其林.普通真菌学(第3版)[J].生命世界,2021(3):2.
[26]王世宽,潘明,徐艳丽,等.浓香型大曲发酵过程中霉菌消长情况的研究[J].中国酿造,2010,29(1):42-45.
[27]乔婧,杨玲,段冰,等.大曲微生物在大曲酒生产中的研究现状及发展前景[J].生物技术世界,2016(3):89-90.
[28]王乃军,马美荣.扣囊复膜酵母在白酒生产中的应用研究进展[J].酿酒科技,2023(3):115-119.
[29]赵春青,李多川.嗜热子囊菌两个中国新记录种[J].菌物研究,2005(1):27-29.
[30]吴树坤,谢军,卫春会,等.四川不同地区浓香型大曲微生物群落结构比较[J].食品科学,2019,40(14):144-152.
[31]何猛超,任义平,熊林,等.茅台地区不同高温大曲微生物群落结构解析[J].中国酿造,2022,41(6):51-57.
[32]杨斌,周健,明红梅.浓香型大曲中1株高发酵力芽孢杆菌的筛选和鉴定[J].酿酒科技,2018(5):17-22,28.
[33]冯雅芳.凤香型大曲发酵力分析研究[J].酿酒科技,2022(12):70-75.
[34]王春晓,袁国亿,苏伟,等.白酒制曲环境和成品曲中产酸微生物分析[J].食品科学,2020,41(18):120-126.
[35]周阳子,边名鸿,刘文艺,等.高温大曲中一株产淀粉酶酵母的分离鉴定及其特性研究[J].食品与发酵工业,2020,46(2):79-84.
[36]王居伟,韩培杰,王雪薇,等.白酒发酵过程中常见酵母菌扣囊复膜酵母的研究进展[J].广西科学,2020,27(1):1-9.
[37]吴健,何伟,王建成,等.酿酒酵母与产香酵母发酵特性及其相互作用规律[J].食品与发酵工业,2020,46(20):78-87.