胞外多糖通常是指微生物在生长代谢过程中分泌到细胞外的一类多糖[1-2],是由多个单糖分子通过不同类型的糖苷键连接形成的相对分子质量较高的生物大分子,具有安全性高、毒性小等特点[3-5]。真菌胞外多糖因其结构的独特性,使得真菌胞外多糖具有抗氧化和免疫活性[6-7]、调节肠道菌群和改善动物机体代谢水平[8-10]以及益生功能[11]等生物活性而广泛应用于生物医药、食品添加剂、饲料添加剂等领域。近年来,研究者对真菌胞外多糖产生菌的分离[12]、发酵条件[13]、多糖分离纯化[14]等进行了广泛的研究,并获得了较好的研究结果。关于牛肝菌内生真菌的研究,岳贤琳等[15]从亚洲兰茂牛肝菌内生真菌Penicillium cinereoatrum Chalab.JSQ-15发酵液中分离出18种次级代谢产物,并探究了其细胞毒性。徐伟等[16]从黄皮疣柄牛肝菌、小美牛肝菌、双色牛肝菌的子实体中分离出4株内生真菌,获得了一株可作为生物防腐的优良菌株。岳万松[17]采用组织分离法从云南牛肝菌子实体中分离到7株内生真菌,显示了云南野生牛肝菌内生真菌的多样性特征。迄今,对牛肝菌内生真菌产胞外多糖生产工艺的研究较少,因此有必要对其展开深入研究。
该研究从小美牛肝菌(Boletus speciosus)子实体中分离筛选产胞外多糖内生真菌,通过形态学观察及分子生物学技术对筛选菌株进行鉴定。以胞外多糖产量为评价指标,采用单因素试验法研究发酵培养基和发酵条件对筛选菌株产胞外多糖产量的影响,在单因素试验结果的基础上,通过响应面试验法对胞外多糖产量影响较大的发酵条件进行优化,旨在为该菌胞外多糖的进一步研究奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品新鲜小美牛肝菌(Boletus speciosus):采集于湖南省桂东县阔叶林或混交林中。
1.1.2 主要试剂
葡萄糖、蔗糖、氯仿、苯酚、浓硫酸、MgSO4·7H2O、KH2PO4、正丁醇(均为分析纯):国药集团化学试剂有限公司;蛋白胨(生化试剂):上海盛思生化科技有限公司;豆饼粉、玉米粉:市售。其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
分离培养基采用马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:葡萄糖20 g,马铃薯200 g,琼脂15~20 g,蒸馏水1 000 mL,pH自然。
液体种子培养基:葡萄糖50 g、豆粕粉15 g、酵母提取物10 g、KH2PO4 3 g、MgSO4·7H2O 1.5 g,硫酸铵5 g,蒸馏水1 000 mL,pH自然。
基础发酵培养基:葡萄糖30 g、豆粕粉20 g、KH2PO4 2 g、CaCl2 2 g、维生素B1(vitamin B1,VB1)1 g,蒸馏水1 000 mL,pH自然。
以上培养基均在115 ℃条件下高压蒸汽灭菌30 min。
1.2 仪器与设备
LDZX-75KBS立式压力蒸汽灭菌器:上海博迅实业有限公司;CR21G高速冷冻离心机:无锡凯派克斯科技有限公司;752紫外可见分光光度计:上海光谱仪器有限公司;250B生化培养箱:常州市华普达教学仪器有限公司;QYC-2102恒温摇床:上海新苗医疗器械制造有限公司;SW-CJ-1B超净工作台:苏州净化设备有限公司;AL204电子分析天平:梅特勒-托利多仪器有限公司。
1.3 试验方法
1.3.1 菌种分离
将采集的发育完全的小美牛肝菌子实体先用无菌水洗净表面的泥土,依次用0.1%的HgCl2溶液和用体积分数95%的乙醇溶液对子实体表面进行消毒后,用无菌水连续冲洗3次,无菌条件下用灭菌手术刀剥离子菌柄基部表层,割取表层下菌柄1 cm3左右大小的组织块接种于PDA固体培养基平板表面,25 ℃恒温培养7 d后,挑取组织块边缘的菌丝,于PDA固体培养基平板表面反复纯化后,得到菌株XY,保存于PDA斜面培养基中。
1.3.2 菌种鉴定
形态学观察:将菌株接种于PDA固体培养基平板表面,28 ℃条件下培养7 d,观察菌落、菌丝形态。
分子生物学技术:使用Ezup柱式真菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒提取真菌DNA,利用真菌通用引物进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。正向引物:ITS1(5'-TCCGTAGGTGAACCTGCGG-3'),反向引物:ITS4(5'-TCCTCCGCTTATTGATATGC-3')。PCR扩增体系为:Template(基因组DNA 20~50 ng/μL)0.5 μL,10×Buffer(with Mg2+)2.5 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTPs)(各2.5 mmol/L)1.0 μL,酶0.2 μL,ITS1(10 μmol/L)0.2 μL,ITS4(10 μmol/L)0.5 μL,双蒸水(ddH2O)25 μL;PCR扩增程序为:94 ℃预变性4 min;94 ℃变性45 s,55 ℃复性45 s,72 ℃延伸1 min,30次循环;72 ℃修复延伸10 min。将纯化的PCR产物连接转化,送至生工生物上海工程股份有限公司进行测序。测序结果利用美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中的基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对,取同源性在99%以上、序列长度相当的基因序列,采用MEGA5.0生物学软件的邻接(neighbor-joining,NJ)法构建系统发育树,确定菌株种属关系。
1.3.3 培养方法
斜面培养:将保存于4 ℃的菌株XY接种于PDA斜面培养基中,25 ℃恒温培养7 d。备用。
液体种子培养:将活化的斜面菌种接种于种子液培养基中,25 ℃、170 r/min条件下振荡培养3 d,备用。
发酵培养:按照5%(V/V)的接种量将培养好的液体种子接种于基础发酵培养基中,25 ℃、170 r/min条件下振荡培养5 d,测定发酵液中胞外多糖的含量。
1.3.4 发酵培养基及发酵条件优化单因素试验
在基础发酵培养基基础上,分别考察碳源种类(葡萄糖、麦芽糖、饴糖、废糖蜜、蔗糖)、葡萄糖添加量(1.0%、2.0%、3.0%、4.0%、5.0%)、氮源种类(豆粕粉、酵母粉、蛋白胨、酵母提取物、硫酸铵、硝酸钠)、豆粕粉添加量(1.5%、2.0%、2.5%、3.0%、3.5%)、KH2PO4添加量(0.15%、0.20%、0.25%、0.30%、0.35%)、CaCl2添加量(0、0.05%、0.10%、0.15%、0.20%、0.25%、0.30%)以及发酵温度(21℃、23℃、25℃、27℃、29℃)、接种量(2.5%、5.0%、7.5%、10.0%、12.5%)、装液量(60 mL/250 mL、80 mL/250 mL、100 mL/250 mL、120 mL/250 mL、150 mL/250 mL)、摇床转速(130 r/min、150 r/min、170 r/min、190 r/min、210 r/min)、发酵时间(4 d、5 d、6 d、7 d、8 d)对筛选菌株胞外多糖产量的影响。
1.3.5 发酵条件优化响应面试验
基于单因素试验结果,选取对结果影响较为明显的发酵温度(A)、接种量(B)、装液量(C)为考察因素,多糖产量(Y)为响应值,采用Design-Expert 12.0软件设计3因素3水平的响应面试验,试验因素与水平见表1。
表1 发酵条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface experiments for fermentation conditions optimization

因素A 发酵温度/℃B 接种量/%C 装液量/(mL·250 mL-1)D 发酵时间/d-1水平0 1 21 5 80 5 23 7.5 100 6 25 10 120 7
1.3.6 胞外多糖测定
将发酵液于4 ℃、8 000 r/min条件下离心15 min,取上清液,加入三倍体积的体积分数为95%乙醇,醇沉12 h,过滤得到沉淀。将沉淀于80 ℃水浴溶解,4 ℃、8 000 r/min离心15 min。Sevage法去蛋白后,用超纯水定容至100 mL。参照赵芳娟等[18]的方法测定发酵上清液中胞外多糖含量(A),并计算胞外多糖产量(以葡萄糖计),其计算公式如下:
式中:A为多糖含量,mg/mL;V为样品总体积,mL。
1.3.7 数据分析
使用Excel 2019、SPSS26.0、GraphPad Prism等软件对数据进行数据处理分析和作图;采用Design Expert 12.0软件进行响应面分析。
2 结果与分析
2.1 菌株XY的鉴定
2.1.1 菌株XY的形态学观察
菌株XY在PDA固体培养基平板上的菌落特征及菌丝孢子扫描电镜结果见图1。

图1 菌株XY的菌落形态(A)及扫描电镜图(B)
Fig.1 Colony morphology (A) and scanning electron microscopy (B)of strain XY
由图1A可知,菌株XY在PDA培养基平板上,菌落圆形,菌丝灰白色,平伏,棉絮状,边缘规则,产生水溶性褐色色素。由图1B可知,菌株XY的分生孢子为球形,表面凹凸不平,菌丝扁平,表面皱褶。
2.1.2 菌株XY的分子生物学鉴定
以菌株XY的DNA为模板,应用真菌通用引物ITS1和ITS4进行PCR扩增,将扩增基因序列提交NCBI上进行BLAST比对,并使用MEGA 5.0软件采用邻接法制作系统发育树,结果见图2。由图2可知,菌株XY与绿黄菌寄生菌(Hypomyces chlorinigenus)有100%的序列相似性,因此,将菌株XY鉴定为Hypomyces chlorinigenus。

图2 基于ITS基因序列构建菌株XY的系统发育树
Fig.2 Phylogenetic tree of strain XY based on ITS gene sequence
2.2 发酵培养基优化单因素试验结果
2.2.1 碳源种类及碳源添加量对胞外多糖产量的影响
碳源是细胞生长代谢所需要的重要营养物质,一般来说,真菌产胞外多糖对碳源的偏好为葡萄糖[19],不同碳源种类及碳源添加量对胞外多糖产量的影响见图3。

图3 碳源种类(A)及葡萄糖添加量(B)对胞外多糖产量的影响
Fig.3 Effects of carbon source types (A) and glucose addition (B) on exopolysaccharide yield
不同字母代表差异显著(P<0.05)。下同。
由图3A可知,不同碳源对菌株XY产胞外多糖产量影响较大。当以葡萄糖为碳源时,胞外多糖产量达10.80 mg/mL,显著高于其他碳源(P<0.05),因此选择葡萄糖作为最适碳源。由图3B可知,胞外多糖产量随着葡萄糖添加量增大呈先升高后下降的变化趋势。当葡萄糖添加量为4.0%时,胞外多糖产量最高,达到15.92 mg/mL,但葡萄糖添加量>4.0%,胞外多糖产量显著下降(P<0.05)。故选择葡萄糖最适添加量为4.0%。
2.2.2 氮源种类及最佳氮源对添加量胞外多糖产量的影响
氮源可用于蛋白质等大分子物质的合成,是微生物生长和代谢产物合成不可缺少的营养元素。培养基中氮源含量太低,不利于微生物的生长,而过高的氮源含量会导致菌体生长过旺且代谢产物产生较少。在等氮条件下,分别改变培养基中的氮源种类,探究不同氮源及氮源添加量对胞外多糖产量的影响,结果见图4。

图4 氮源种类(A)及豆粕粉添加量(B)对胞外多糖产量的影响
Fig.4 Effects of nitrogen source types (A) and soybean meal addition (B) on exopolysaccharide yield
由图4A可知,当以豆粕粉为唯一氮源时,胞外多糖产量最高,为26.40 mg/mL。故选择豆饼粉为最适氮源。由图4B可知,当豆粕粉添加量为3.0%时,胞外多糖产量达最高值(26.49 mg/mL),但继续增加豆粕粉添加量,胞外多糖产量显著下降(P<0.05)。故选择豆粕粉最适添加量为3.0%。
2.2.3 KH2PO4添加量对胞外多糖产量的影响
磷是生命体系中不可或缺的元素,主要作用包括参与细胞的能量代谢、构建细胞膜和核酸以及调节细胞内信号传导等,适宜的磷酸盐浓度有利于提高真菌胞外多糖发酵水平[20],KH2PO4添加量对胞外多糖产量的影响见图5。
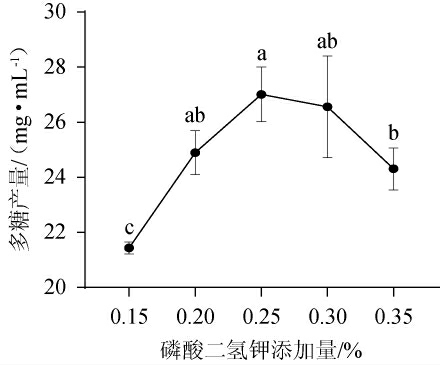
图5 KH2PO4添加量对胞外多糖产量的影响
Fig.5 Effects of KH2PO4 addition on exopolysaccharide yield
由图5可知,随着磷酸二氢钾添加量的增加,胞外多糖产量呈先上升后下降的趋势,当KH2PO4添加量为0.25%时,胞外多糖产量达到最高,为27.02 mg/mL。故选择KH2PO4最适添加量为0.25%。
2.2.4 CaCl2添加量对胞外多糖产量的影响
钙虽不是微生物细胞的构成成分,但仍是微生物代谢中不可缺少的无机元素。适当浓度的Ca2+,可以起到维持细胞渗透压和胶体状态、降低膜的通透性、调节pH值、酶激活剂等作用[21-22],CaCl2添加量对胞外多糖产量的影响见图6。由图6可知,在一定的范围内,胞外多糖产量随CaCl2添加量的增加而提高,当CaCl2添加量为0.05%时,胞外多糖产量达26.87 mg/mL,但随着CaCl2添加量增加,胞外多糖产量下降。因此,选择CaCl2最适添加量为0.05%。
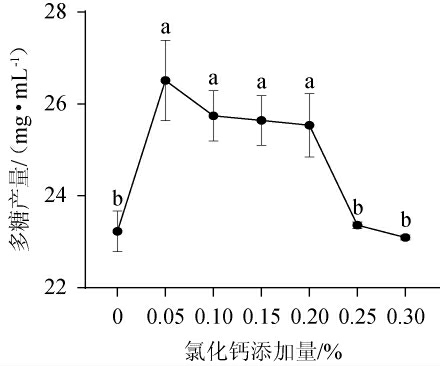
图6 CaCl2添加量对胞外多糖产量的影响
Fig.6 Effects of CaCl2 addition on exopolysaccharide yield
2.3 发酵条件优化单因素试验结果
2.3.1 发酵温度对胞外多糖产量的影响
温度主要是通过影响细胞中各种酶的反应速率、生物合成方向、改变底物的物理性质等,从而影响产物的合成和分泌,发酵温度对胞外多糖产量的影响见图7。由图7可知,在培养温度21~23 ℃范围内,随着培养温度的升高,胞外多糖产量也随之提高;当培养温度为23 ℃时,胞外多糖产量为最高值(29.84 mg/mL)。培养温度>23 ℃,胞外多糖产量显著下降(P<0.05)。故选择最适培养温度为23 ℃。

图7 发酵温度对胞外多糖产量的影响
Fig.7 Effects of fermentation temperature on exopolysaccharide yield
2.3.2 接种量对胞外多糖产量的影响
接种量也是影响微生物代谢产物产量的因素之一。接种量太小,导致培养时间延长,而接种量过大,发酵前期培养基中的营养物质消耗过快,同时也带入过多的代谢废物,均会影响代谢产物的合成。接种量对胞外多糖产量的影响见图8。由图8可知,胞外多糖产量随接种量的增加而提高,当接种量为7.5%时,胞外多糖产量达27.93 mg/mL,但随接种量增加,胞外多糖产量下降。故选择最适接种量为7.5%。
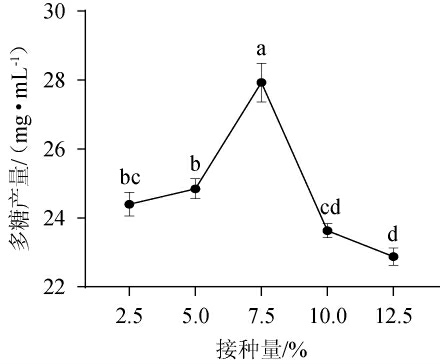
图8 接种量对胞外多糖产量的影响
Fig.8 Effects of inoculum on exopolysaccharide yield
2.3.3 装液量对胞外多糖产量的影响
在摇瓶培养中,装液量是液体发酵培养基中溶氧量的决定因素之一。装液量小,培养基中溶氧量大,导致发酵前期底物利用快;装液量大,发酵液中溶氧水平降低,限制了菌体生长和产物的合成,而真菌胞外多糖的合成和分泌需要在好氧条件下完成[23-25],装液量对胞外多糖产量的影响见图9。由图9可知,在一定的装液量范围内,随着培养基装液量的增加,胞外多糖产量也随之提高;当装液量为100 mL/250 mL三角瓶时,胞外多糖产量最高,达29.01 mg/mL,显著高于其他处理(P<0.05)。故选择最适装液量为100 mL/250 mL。
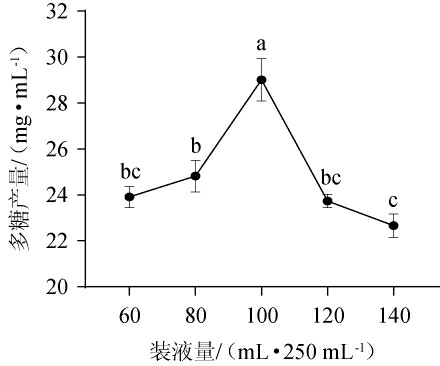
图9 装液量对胞外多糖产量的影响
Fig.9 Effects of loading volume on exopolysaccharide yield
2.3.4 转速对胞外多糖产量的影响
转速直接影响着培养基中的溶氧水平。一般而言,转速越高,培养基中溶氧水平越高,但培养液中的剪切力也增大,而转速低,培养基中溶氧下降,均会影响微生物细胞的生长、分化和代谢。转速对胞外多糖产量的影响见图10。由图10可知,随着转速的增加,胞外多糖产量也随之提高;当转速为190 r/min,多糖产量达29.69 mg/mL;但转速>190 r/min,胞外多糖产量下降。故选择最适转速为190 r/min。

图10 转速对胞外多糖产量的影响
Fig.10 Effects of rotational speed on exopolysaccharide yield
2.3.5 发酵时间对胞外多糖产量的影响
发酵时间也是影响发酵效果的重要因素之一,合适的发酵时间能够保证菌种繁殖和代谢产物的形成。发酵时间过短,代谢产物积累量少,而发酵时间过长,由于细胞死亡和内源性水解酶的释放,可能导致代谢产物的降解。发酵时间对胞外多糖产量的影响见图11。
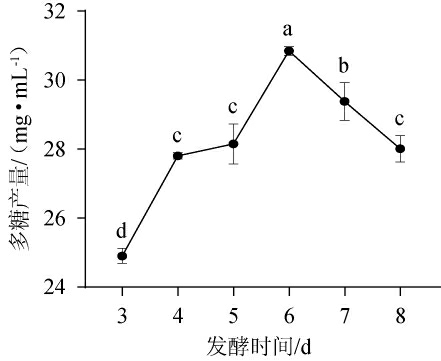
图11 发酵时间对胞外多糖产量的影响
Fig.11 Effects of fermentation time on exopolysaccharide yield
由图11可知,发酵时间为3~6 d时,胞外多糖产量随发酵时间的延长逐渐上升;当发酵时间为6 d时,胞外多糖产量最大,达30.85 mg/mL;但发酵时间>6 d,胞外多糖产量显著下降(P<0.05)。主要原因是随着发酵时间延长,培养基中的营养物质消耗殆尽,菌株以自身的产物作为营养物质而生长,导致胞外多糖产量下降。选择最适发酵时间为6 d。
2.4 发酵条件优化响应面试验结果
2.4.1 Box-Behnken试验结果
基于上述结果,选取对胞外多糖产量影响较为明显的发酵温度(A)、接种量(B)、装液量(C)、发酵时间(D)为考察因素,以胞外多糖产量(Y)为响应值,采用Design-Expert 12软件设计3因素3水平的响应面试验结果与分析见表2。
表2 菌株发酵条件优化响应面试验结果与分析
Table 2 Results and analysis of response surface experiments for fermentation conditions optimization
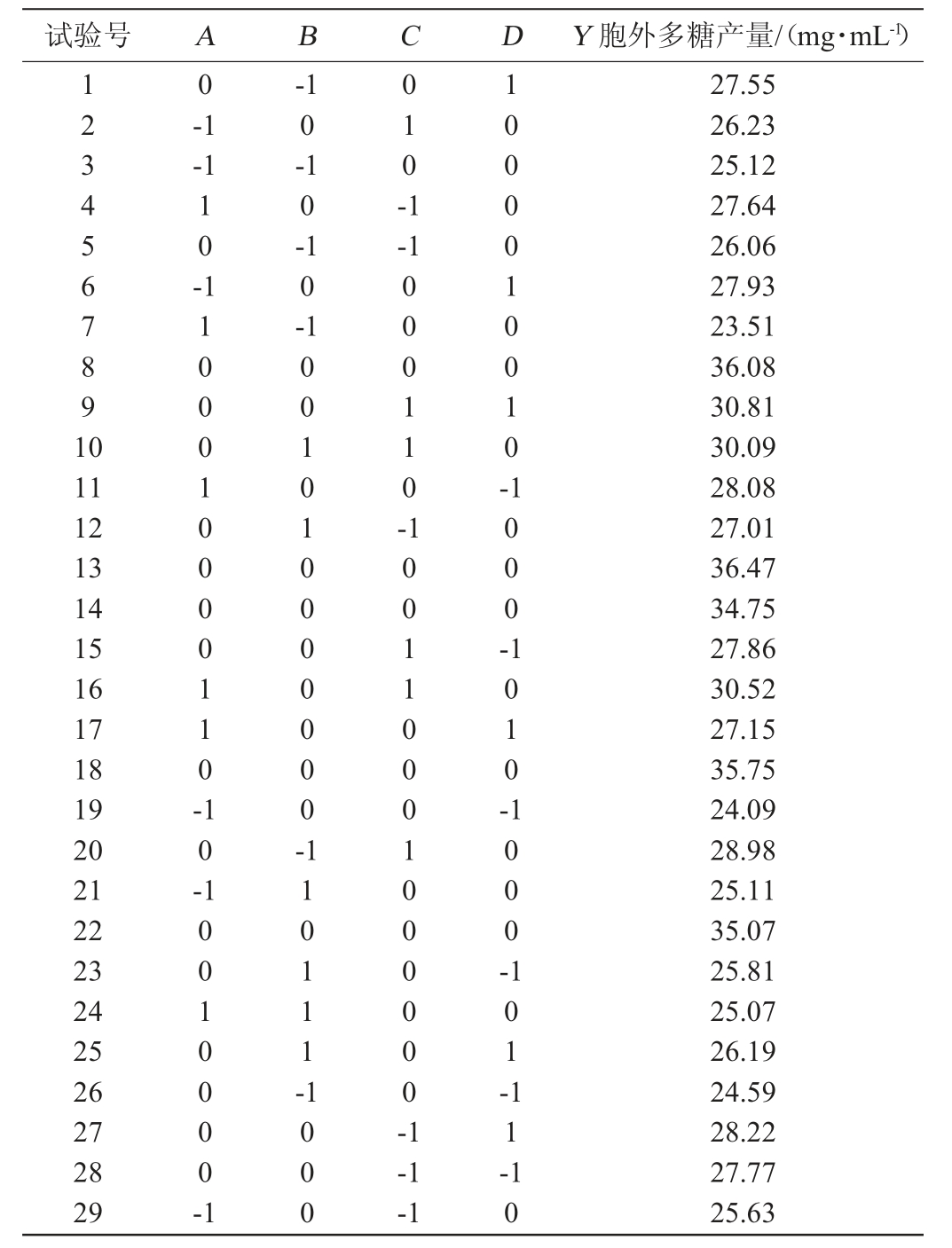
试验号 A B C D Y 胞外多糖产量/(mg·mL-1)1234567891 0 0-1-1 10--1 0-1 0-1 0-1 010-1-1 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 1100010000110-000110-1000010010-1000-10-001010000000-1010-10010000-1 110111-1000-1000 100110001000000-1 101--1-1 11-10 27.55 26.23 25.12 27.64 26.06 27.93 23.51 36.08 30.81 30.09 28.08 27.01 36.47 34.75 27.86 30.52 27.15 35.75 24.09 28.98 25.11 35.07 25.81 25.07 26.19 24.59 28.22 27.77 25.63
2.4.2 回归模型方差分析
表2数据通过Design-Expert 12.0软件分析,得到回归拟合方程:

回归模型方差分析结果见表3。
表3 回归模型方差分析
Table 3 Variance analysis of regression model

注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著
(P<0.01)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型14 ABCDA B*****AC AD BC BD CD A2** **B2 C2 D2 25.79 5.03 1.01 11.74 7.40 0.664 5 1.24 5.42 0.006 1 1.59 1.49 167.34 175.39 42.52 97.39<0.000 1 0.041 6 0.331 5 0.004 1 0.016 6 0.428 6 0.284 5 0.035 4 0.938 9 0.228 5 0.242 5<0.000 1<0.000 1<0.000 1<0.000 1******残差失拟项净误差总和378.91 5.28 1.06 12.32 7.76 0.697 2 1.30 5.69 0.006 4 1.66 1.56 175.59 184.04 44.62 102.19 14.69 12.61 2.08 393.60 111111111111111 4 10 4 28 27.06 5.28 1.06 12.32 7.76 0.697 2 1.30 5.69 0.006 4 1.66 1.56 175.59 184.04 44.62 102.19 1.05 1.26 0.521 1 2.42 0.204 6
由表3可知,模型显著(P<0.01),失拟项不显著(P>0.05),说明该模型拟合程度好,预测方案可靠。模型的决定系数R2为0.962 7,说明二次回归模型能解释96.27%胞外多糖产量的变化。由P值可知,一次项A、D与交互项AD对胞外多糖产量影响显著(P<0.05),一次项C及二次项A2、B2、C2、D2对胞外多糖产量影响极显著(P<0.01)。根据F值可知,3个因素对多糖产量影响的主次顺序为:装液量>发酵时间>发酵温度>接种量。
2.4.3 响应面分析
发酵温度(A)、接种量(B)、装液量(C)和发酵时间(D)各因素交互作用对结果影响的响应面及等高线见图12。


图12 各因素间交互作用对胞外多糖产量影响的响应面和等高线
Fig.12 Response surface plots and contour lines of effects of interaction between each factors on exopolysaccharide yield
从图12可以看出,发酵温度与发酵时间的交互作用显著(P<0.05),发酵温度与接种量、发酵温度与装液量、接种量与装液量、接种量与发酵时间、装液量与发酵时间之间的交互作用均不显著(P>0.05)。经Design-Expert 12.0软件分析后可得到最佳的发酵条件为:发酵温度24.071 ℃,接种量8.314%,装液量98.783 mL/250 mL,发酵时间6.491 d。在此条件下,胞外多糖产量理论值为35.52 mg/mL。
2.4.4 响应面优化验证
为便于实际操作,将最佳发酵条件修正为发酵温度24 ℃,接种量8%,装液量100 mL/250 mL,发酵时间6.5 d。在此条件下进行3次平行验证试验,得到胞外多糖实际产量为36.04 mg/mL,与理论值较为接近,说明该模型可靠。
3 结论
该试验采用单因素试验和响应面优化法对小美牛肝菌内生真菌产胞外多糖的发酵培养基组成及发酵条件进行了优化,确定内生真菌产胞外多糖最佳发酵培养基配方为:葡萄糖4%、豆粕粉3%、KH2PO4 0.25%、CaCl2 0.05%;最佳发酵条件为:发酵温度24 ℃、转速190 r/min、接种量8%(V/V)、装液量100 mL/250 mL、发酵时间6.5 d。在此条件下,菌株XY的胞外多糖产量达到36.04 mg/mL。研究结果为小美牛肝菌内生真菌胞外多糖的纯化和生物活性研究奠定了基础。
[1]ZHAO W,LIU W L,LI J J,et al.Preparation of animal polysaccharides nanofibers by electrospinning and their potential biomedical applications[J].J Biomed Mat Res Part A,2015,103(2):807-818.
[2]PATIL S P,SHIRSATH L P.Production of exopolysaccharide by an osmotolerant,thermostable and metal resistant Bacillus subtilis[J].Int J Curr Microbiol Appl Sci,2015,4(2):965-971.
[3]秦俊哲,陈明,陈合,等.食药用真菌多糖的研究现状与展望[J].中国食用菌,2004(2):6-9.
[4]JIN W,XIANG L,PENG D,et al.Study on the coupling progress of thermoinduced anthocyanins degradation and polysaccharides gelation[J].Food Hydrocolloids,2020,105:105822.
[5]丁孟汝,王国栋,袁平川,等.多糖调控糖脂代谢的作用及其机制研究进展[J].南方医科大学学报,2021,41(3):471-474.
[6]张彩芳,秦令祥,周靖琦,等.基于响应面法优化双酶藕合超高压提取香菇多糖工艺及抗氧化活性研究[J].中国食品添加剂,2022,33(9):69-74.
[7]HUANC X Y,DING H M,WANG Q Y,et al.Characterization and in vivo immunomodulatory effects of a heteropolysaccharide from Rhizopogon rubescens(Tul.)Tul[J].Process Biochem,2022,122(2):160-171.
[8]XUE Z H,MA Q Q,CHEN Y,et al.Structure characterization of soluble dietary fiber fractions from mushroom Lentinula edodes(Berk.)Pegler and the effects on fermentation and human gut microbiota in vitro[J].Food Res Int,2020,129:108870.
[9]LIU Y T, LI Y W, KE Y, et al. In vitro saliva-gastrointestinal digestion and fecal fermentation of Oudemansiella radicata polysaccharides reveal its digestion profile and effect on the modulation of the gut microbiota[J].Carbohyd Polm,2021,251:117041.
[10]代二朋,纪荣超,虞润杰,等.饲粮中添加不同水平的酵母多糖对热应激蛋鸭产蛋性能、蛋品质及血清生化指标的影响[J].饲料工业,2022,43(9):24-28.
[11]GONG L L,MENG F J,HOU Y C,et al.Purification,characterization,and bioactivity of two new polysaccharide fractions from Thelephora ganbajun mushroom[J].J Biochem,2020,44(1):e13092.
[12]董燕婧,程访,许小珍,等.白及内生真菌的分离鉴定及其胞外多糖的抗氧化活性分析[J].中国实验方剂学杂志,2018,24(14):24-28.
[13]乔新荣,王泽夏,叶润,等.猫爪草内生真菌胞外多糖的抗氧化活性及培养条件优化研究[J].粮食与油脂,2022,35(8):131-136.
[14]王竹,余善君,吉林佳,等.海南红树林淡紫拟青霉胞外多糖提取条件的优化[J].生物技术进展,2021,11(1):105-110.
[15]岳贤琳,杨郁,徐锐,等.亚洲兰茂牛肝菌内生真菌Penicillium cinereoatrum Chalab.JSQ-15次级代谢产物及其细胞毒活性研究[J].中国药物化学杂志,2023,33(5):367-379.
[16]徐伟,张雪,王植朔,等.野生牛肝菌内生真菌分离鉴定及其生物学特性[J].食品工业科技,2021,42(21):118-124.
[17]岳万松.云南牛肝菌的分子鉴定及其多糖抗氧化性研究[D].昆明:云南民族大学,2016.
[18]赵芳娟,邓百万,解修超,等.耐高温蜜环菌胞外多糖含量及抗氧化活性[J].陕西理工大学学报(自然科学版),2022,38(5):79-85.
[19]杨同香,吴孔阳,陈俊亮,等.真菌发酵胞外多糖的研究进展[J].食品科学,2016,37(5):265-270.
[20]MAHAPATRA S,BANERJEE D.Fungal exopolysaccharide:production,com-position and applications[J].Microbiol Insight,2013,6(1):1-16.
[21]周德庆.微生物学教程[M].北京:高等教育出版社,2020:4.
[22]樊梓豪,范丹丹,王梦梦,等.生物细胞中颗粒状多聚磷酸盐细胞器的结构与功能[J].微生物学报,2022,62(12):4713-4730.
[23]RUPEREZ P,LEAL J A.Extracellular galactosaminogalactan from Aspergillus parasiticus[J].Transact Brit Mycol Soc,1981,7(3):621-625.
[24]MIYAZAWA K,YOSHIMI A,ABE K.The mechanisms of hyphal pellet formation mediated by polysaccharides,α-1,3-glucan and galactosaminogalactan,in Aspergillus species[J].Fungal Biol Biotechnol,2020,7:10.
[25]BRIARD B,RASOLDIER V,BOMME P,et al.Dirhamnolipids secreted from Pseudomonas aeruginosa modify anjpegungal susceptibility of Aspergillus fumigatus by inhibiting β-1,3 glucan synthase activity[J].Isme J,2017,11(7):1578-1591.