大曲是白酒酿造必不可少的复合酶制剂、微生物制剂和风味物质载体,这对于白酒的酒体质量、酒香的产生和出酒率有重要的影响[1-2]。高温大曲有“黑、白、黄”一说,这是由于在发酵过程中,受到多种因素的影响从而形成了不同发酵性能、感官特性、理化指标以及微生物群落的成品曲。酱香型白酒品质与风格形成的关键工艺之一是高温大曲的制备[3-5],根据成品曲表面色泽的不同可以分为黄曲(黄褐色)、黑曲(黑褐色)和白曲(生麦色)[6-7]。黄曲皮的厚度相较于黑曲与白曲厚,曲香较为浓厚,糖化力较低,曲心呈现菊黄状;黑曲发酵品温高且常常带有焦糊味,曲心也呈现菊黄状;白曲酱香较弱,发酵品温低,有生麦味而糖化率较高[1,8]。曲坯发酵过程中热曲的时间长易形成黑曲,时间短易形成白曲,如果发酵前期温度适合,溶氧良好且在发酵后期干燥充分[9],则易形成黄曲。在成品大曲质量分析中,黄曲率通常作为分析的重要指标之一[10-11],正常情况下,高温大曲发酵过程中所产黄曲约占总产量的70%~80%,黑曲和白曲分别占10%和10%~20%[2]。通常在生产过程中会根据各类曲的实际情况以及经验将黄曲、黑曲、白曲按照一定比例搭配使用。目前,绝大多数酿酒企业主要通过控制制曲工艺提高黄曲率,以达到最佳的生产效果,但对于不同高温大曲间微生物群落结构的研究尚不明确,这不利于应用微生物技术改良酒曲。
目前,主要通过高通量测序技术解析高温大曲微生物的群落结构。王玉荣等[12]利用高通量测序技术发现长治地区的高温大曲中包含了极其丰富的真菌类群,并且真菌与风味品质存在一定的关联性。ZHOU Q F等[13]利用高通量测序研究在不同温度下高温大曲对真菌群落的影响发现,大曲加工温度对真菌群落有很重要的影响,嗜热真菌属(Thermomyces)和嗜热子囊菌属(Thermoascus)在高温大曲与中高温大曲中相对丰度分别为75%和47%,而酵母菌是低温大曲中的主要微生物,相对丰度为68%。MU Y等[14]通过高通量测序探究空间诱变和生物强化对高温大曲的生物扰动效应发现,在14种香气活性挥发物和51种差异代谢物中,吡嗪、醇、小肽和碳水化合物等物质在生物扰动后含量较高。张芸曌[15]研究表明,Thermomyces、Thermoascus、根霉属(Rhizopus)、毛霉属(Mucor)与高温大曲的糖化力、水分与等呈负相关,与液化力呈正相关;曲霉属(Aspergillus)、根霉菌属和毛霉属与酸度呈正相关;但Thermomyces和Thermoascus与酸度呈负相关。由此可见真菌对于酒的风格和品质起着极为重要的作用。
本研究通过高通量测序技术解析不同种类高温大曲(黄曲、黑曲、白曲、综合曲)中真菌多样性与群落结构,基于属水平对其真菌菌群进行聚类分析(cluster analysis,CA)及主坐标分析(principal co-ordinates analysis,PCoA),并对其进行真菌菌群进行系统发育分析。以期采用微生物技术改良酒曲,为浓香型白酒品质与风味提高提供理论依据。
1 材料与方法
1.1 材料与试剂
高温大曲样品,同一批次黄曲(A)、黑曲(B)、白曲(C)和综合曲(D)(黄曲75%、黑曲17%、白曲8%):来自金徽酒股份有限公司。
E.Z.N.ATMMag-Bind Soil 脱氧核糖核酸(deoxyribonu cleic acid,DNA)试剂盒:上海索宝生物科技有限公司;Qubit 3.0 DNA检测试剂盒:上海凌仪生物科技有限公司;2×Taq Master Mix:北京索莱宝科技有限公司;MagicPure Size Selection DNA Beads:法国Transgen公司。
1.2 仪器与设备
C1000型聚合酶链式反应(polymerase chain reaction,PCR)仪:上海领成生物科技有限公司;QIAxtractor高通量核酸提取仪:德国QIAGND公司;DYCP-31BN琼脂糖水平电泳仪:北京佳航博创科技有限公司;WD-9413A凝胶成像分析系统:北京六一生物科技有限公司;Agilent 2100 Bioanalyzer生物分析仪:上海亚晶生物科技有限公司。
1.3 方法
1.3.1 DNA提取及高通量测序
使用DNA提取试剂盒提取大曲样品的DNA,每个样品的基因组DNA进行3次扩增,混合同一样本的DNA。使用NanoDrop 2000检测总DNA浓度(检验标准为A260nm/A280nm=1.8~2.0,A260 nm/A230 nm=1.8~2.3)。使用TransGen AP221-02试剂盒,TransStart Fastpfu DNA Polymerase高保真DNA聚合酶进行PCR扩增。真菌种属引物内转录间隔区(internal transcribed spacer,ITS)PCR扩增用引物为已经融合Miseq测序平台的ITS1(5'-CCCTACACGACGCTCTTCCGATCTN(barcode)CTTGGTCATTTAGAGGAAGTAA-3')和ITS2(5'-GTGACTGGAGTTCCTTGGCACCCGAGAATTCCAGCTGCGTTCTTCATCGATGC-3')通用引物。PCR扩增体系(50.0μL):基因组DNA(20ng/μL)1.0μL、ITS1引物(10μmol/L)1.0 μL、ITS2引物(10 μmol/L)1.0 μL、10×Taq Buffer(含2.5 mmol/L Mg2+)5.0 μL、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)Mixture(10 mmol/L)1.0 μL、Taq聚合酶(2.5 U/μL)1.0 μL、双蒸水(ddH2O)40.0 μL。PCR扩增条件:94 ℃预变性3 min;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸1 min,循环次数35;72 ℃延伸10 min。通过1%琼脂糖凝胶电泳检测PCR产物条带的大小,使用Illumina MiSeq PE300测序平台对其进行测序,构建MiSeq文库。
1.3.3 生物信息学分析
采用双末端(Paired-End)测序方法,通过Illumina MiSeq测序平台获得序列数据,使用Trimmomatic和Pear进行质控。对于Trimmomatic采用滑动窗口策略,平均质量值为20,大小为50 bp,最小保留序列长度为120 bp,用Pear去除含N的序列;根据overlap,使用Flash和Pear对两端序列进行拼接,最小值设置为10 bp,错配率为0.1;根据已知数据库,通过Uchime方法去除序列的嵌合体,通过Denovo方法去除不合格的短序列,得到有效数据(Clean Data)。然后用DADA2方法进行去重,每个去重序列即为扩增子序列变体(amplicon sequence variants,ASVs)。DADA2方法比传统的操作分类单元(operational taxonomic units,OTU)方法更加敏感和特异,能够检测到OTU方法遗漏的真实生物变异,同时输出的假序列更少,它以100%相似度聚类。采用QIIME2的算法对每个ASV进行物种注释。ASVs替代OTU提高了标记基因数据分析的准确性、全面性和可重复性。
2 结果与分析
2.1 测序处理统计结果分析
使用QIIME2软件中包含的DADA2方法对序列进行去噪获得ASVs,数据处理过程中每个样品的统计结果及聚类后得到ASVs的丰度信息见表1。由表1可知,4种大曲样品共得到972 068条原始序列,平均每个样品243 017条,平均碱基长度为263 bp。序列经过拼接优化后进行聚类分析,共获得2 209个物种分类的ASVs,平均每个样品552个ASVs。ASVs的丰度信息初步说明了样品的物种丰富度,其中,黄曲的群落丰富度最高,白曲和混合曲的群落丰富度最低。
表1 测序数据结果
Table 1 Results of sequencing data

样品编号 原始序列数/条 ASVs ABCD 225 613 233 762 265 575 247 118 933 648 313 313
2.2 ASVs分析
不同高温大曲样品的ASVs分布韦恩图见图1。由图1可知,黄曲、黑曲、白曲和综合曲共检测出真菌ASVs数目分别为933个、648个、313个和313个,这说明黄曲的群落丰富度最高,白曲和综合曲的群落丰富度最低。4组特有的ASVs数目分别为790个、500个、229个和231个,共有的ASVs数目为44个。
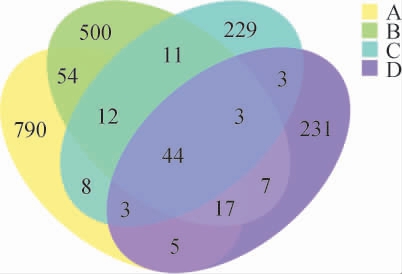
图1 不同高温大曲样品的ASVs分布韦恩图
Fig.1 Venn diagram of the ASVs distribution of different high-temperature Daqu samples
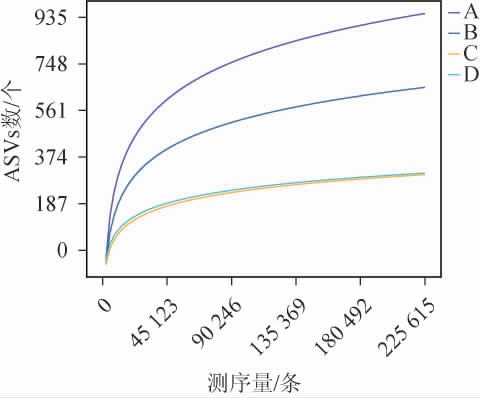
图2 高温大曲真菌菌群稀释曲线
Fig.2 Rarefaction curves of fungal community in high-temperature Daqu
2.3 高温大曲中真菌菌群的Alpha多样性分析
Alpha多样性用于测定单个样本内的微生物群落的丰富度、多样性和测序深度,采用Chao1指数、Shannon指数、Simpson指数、Goods coverage对微生物群落的物种丰富度和多样性的差异进行评估。高温大曲微生物菌群Alpha多样性分析结果见表2。
表2 高温大曲真菌菌群Alpha多样性分析结果
Table 2 Alpha diversity analysis of fungal community in high-temperature Daqu
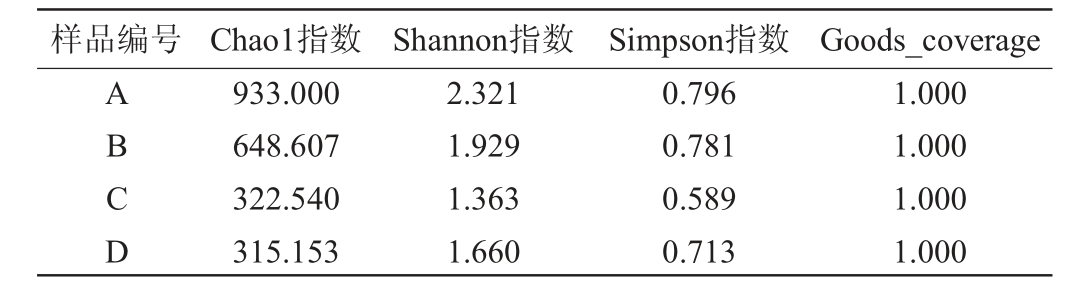
样品编号 Chao1指数 Shannon指数 Simpson指数 Goods_coverage ABCD 933.000 648.607 322.540 315.153 2.321 1.929 1.363 1.660 0.796 0.781 0.589 0.713 1.000 1.000 1.000 1.000
由表2可知,Goods-coverage的数值均为1,说明样品中的物种基本都被测出,本实验的测序结果能够代表样品中微生物的真实情况。Shannon指数和Simpson指数由高到低的样品排序为A>B>D>C,表明黄曲中的真菌群落未知因子最多、多样性最高。Chao1指由高到低的样品排序为A>B>C>D,说明黄曲中的真菌丰富度远高于其他3组。黄曲曲坯在入仓堆积处于发酵仓中层,溶氧较好,温湿度适宜,使得真菌快速繁殖,丰富度和多样性大幅度上升[16];黑曲处于发酵仓中下层,溶氧较少,水分含量高,在发酵过程中大曲处于高温环境下的时间较长,影响了一些真菌的生长;白曲处于发酵仓上层,水分挥发较快,热曲时间较短,曲温偏低,不利于真菌的大量繁殖[16]。综合来看,黄曲更符合实际生产要求。
2.4 稀释曲线分析
稀释曲线可以直观地显示样品间物种多样性的差异和测序数据的合理性,间接反映样品中物种的丰富程度[17]。当测序深度在0~45 123范围内增加时,不同高温大曲ASVs逐渐增加;随着测序深度继续增加,ASVs增加趋势逐渐平稳,新的ASVs出现的越少,且在同一测序深度下,黄曲ASVs高于其他高温大曲,说明样本测序量充足,能够反映绝大部分的微生物菌群信息以及高温大曲中真菌的多样性,所测数据能够满足后续实验分析。
2.5 高温大曲真菌群落结构分析
基于门、属水平不同高温大曲样品真菌菌群的相对丰度见图3。由图3a可知,A~D 4种高温大曲在门水平上分别鉴定出11个、11个、8个和10个,黄曲和黑曲中的微生物在门水平上的多样性最高,混合曲居中,白曲的最低,说明在大曲成熟中后期仍会产生新的菌群,一定程度上影响白酒的质量。混合曲中除子囊菌门(Ascomycota)外,其他微生物总相对丰度最低,而Ascomycota在4种大曲中均为绝对优势菌门(相对丰度>90%),这与孙羊羊等[18]的研究结果一致,说明Ascomycota在大曲形成过程中起着重要的作用。由于黑曲属于过熟曲,色泽风味等较差,因此,黄曲更适宜白酒的发酵。
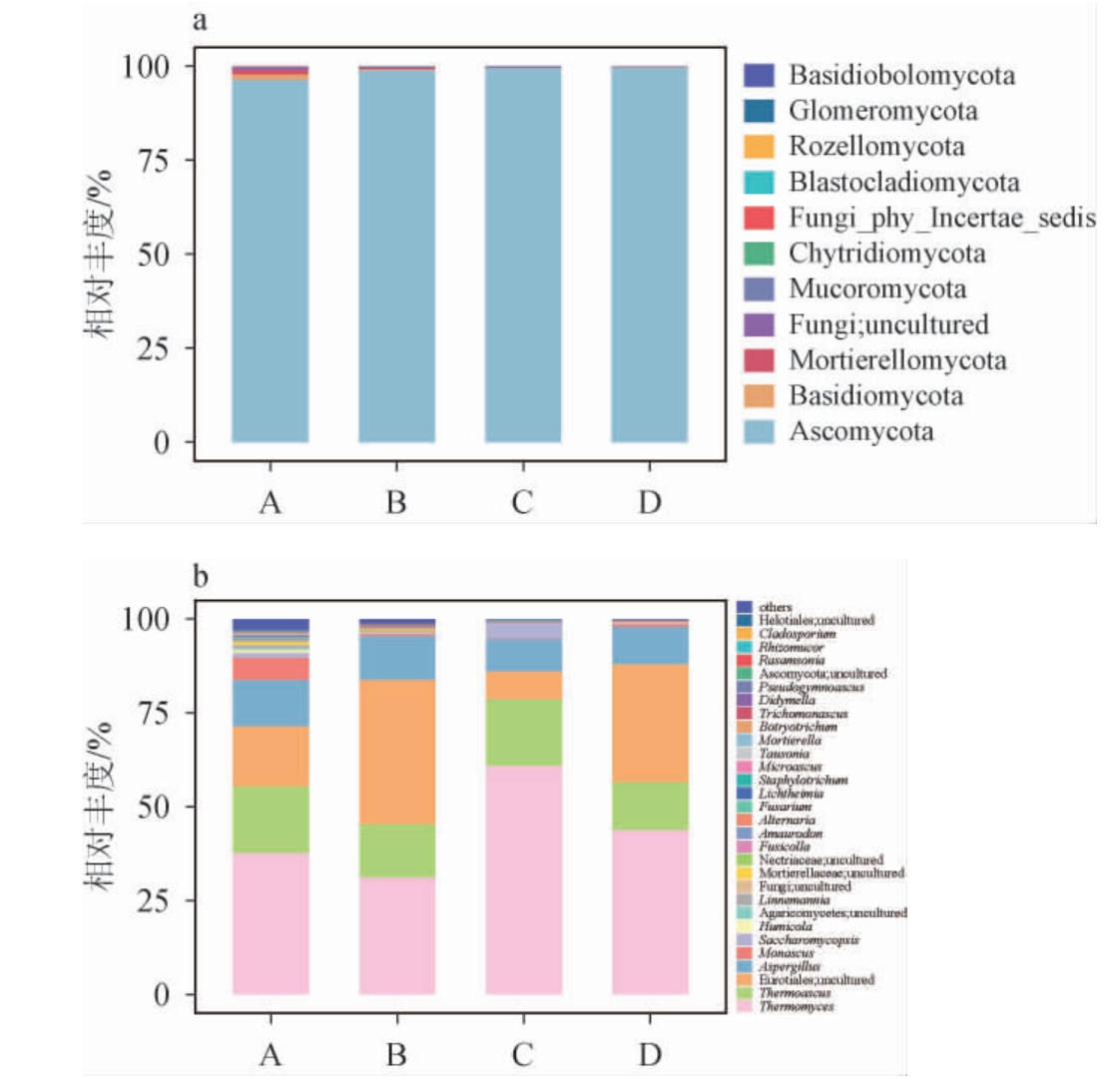
图3 基于门(a)和属(b)水平不同高温大曲样品真菌菌群的相对丰度
Fig.3 Relative abundance of fungal community of different high-temperature Daqu samples based on phylum (a)and genus (b) levels
Others指相对丰度<1%的其他真菌属。
由图3b可知,A~D 4种高温大曲在属水平上分别鉴定出306个、248个、112个和114个。Thermomyces(37.48%)、Thermoascus(17.70%)、Aspergillus(11.7%)、红曲霉属(Monascus)(5.73%)在黄曲中相对丰度较高。Thermomyces(30.89%)、Thermoascus(13.82%)、Aspergillus(11.22%)在黑曲中相对丰度较高。Thermomyces(60.79%)、Thermoascus(17.56%)、Aspergillus(8.30%)、复膜孢酵母属(Saccharomy copsis)(3.89%)、根毛霉属(1.02%)在白曲中相对丰度较高。Thermomyces(40.57%)、Thermoascus(14.82%)和Aspergillus(11.37%)在混合曲中相对丰度较高。其中,黄曲中Monascus和白曲中Saccharomycopsis相对丰度显著高于其他大曲,这表明Monascus和Saccharomycopsis对高温大曲发酵条件敏感,可能在发酵过程中影响白酒风味品质,后期需进一步进行研究。
Thermomyces是黄曲发酵过程的第一优势真菌属,在白酒的发酵过程中,提供具有热稳定性和高活力的蛋白酶、纤维素酶等重要酶类,促进蛋白质和高分子多糖的降解,使微生物能够充分利用酿酒原料进行繁殖和生长,是白酒酿造中重要的功能微生物[19]。唐佳代等[1]研究发现,黄曲的液化力最高,同时还具有产酒和生香的功能。Thermoascus是第二优势真菌属,能产生高活力和高热稳定性的蛋白酶、纤维素酶等,为高温大曲产酒生香提供所需的有机酸和醇类[15],这些是高温大曲产酒生香的前体物质[20]。此外,Thermoascus也是高温大曲中优势真菌之一,其与水分、总酸、还原糖和酯化力呈正相关[21]。Thermomyces和Thermoascus的相对丰度总和在4种高温大曲中均较高(45%~79%),与孙利林等[22]对贵州省仁怀市茅台镇酱香型白酒高温大曲主要真菌群落结构的研究结果一致,这表明酱香型高温大曲和浓香型高温大曲的优势菌属存在相似性,但是在组成比例上有差异。另外,其他微生物比如冠突散囊菌可提高高温大曲的酯化力、发酵力和糖化力,增加风味物质的种类,改善白酒品质[23]。复膜孢酵母属具有产酸类等白酒风味物质的能力[24]。其中,扣囊复膜酵母具有产酸类、醇类、醛酮类、酯类等白酒风味物质的能力,增加酒体的绵甜感,提升原酒品质[25]。微生物多样性越高,越有利于有机物的分解和风味物质的形成,所以黄曲更适合白酒生产要求。
2.6 聚类分析与主坐标分析
在属水平下,选取总相对丰度前30的菌种进行聚类分析,结果见图4。由图4可知,横向聚类结果表明,黑曲与混合曲在同一分支,说明混合曲与黑曲基于属水平下的微生物菌群相似;而黄曲与黑曲基于属水平下的微生物菌群有一定相似性,这与唐佳代等[1]的研究结果一致;白曲微生物菌群与其他3种高温大曲差异相对较大。纵向聚类结果表明,白曲 中Thermomyces、Rhizomucor、Saccharomycopsis、Rhizopus亲缘关系相对较近且相对丰度较高,黄曲中Aspergillus、Monascus、Staphylotrichum、Botryotrichum等亲缘关系较近且相对丰度较高,而黑曲中Aspergillus、Cladosporium、Trichomonascus等亲缘关系较近且相对丰度较高,综合曲中Rasamsonia、Leiothecium等亲缘关系较近且相对丰度较高。该发现可能为后期不同菌株对大曲风味品质的研究提供重要参考。综合上述结果,黄曲可能相比其他大曲更符合生产要求。
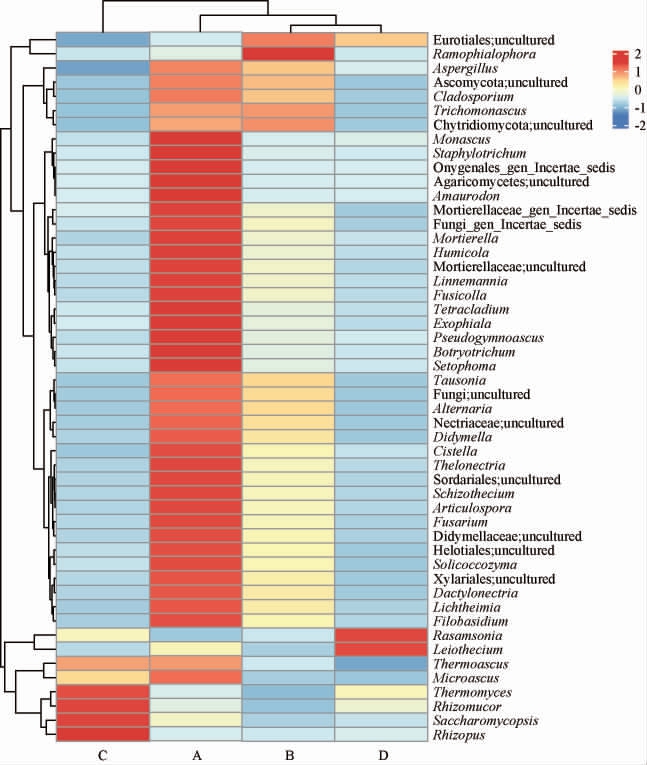
图4 基于属水平下不同高温大曲真菌聚类分析热图
Fig.4 Heat map of cluster analysis of fungi based on genus level in different high-temperature Daqu
通过主坐标分析(PCoA)不同高温大曲群落分布特征,结果见图5。由图5可知,根据加权Unifrac距离分析第一主成分和第二主成分的方差贡献率分别为60.4%和35.6%,累计方差贡献率为96%,说明该图能够解释96%的物种差异。根据样本点之间的距离判断,黄曲与黑曲样品之间真菌群落结构相似,白曲与黄曲、黑曲在PCoA1上距离较远,说明在属水平上真菌群落结构存在明显差异。
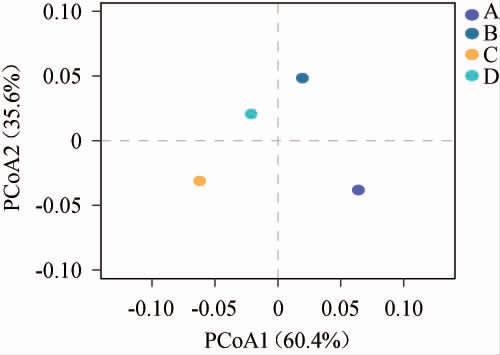
图5 基于属水平不同高温大曲中真菌群落主坐标分析结果
Fig.5 Principal coordinate analysis results of fungi based on genus level in different high-temperature Daqu
2.7 高温大曲真菌菌群系统发育分析
使用MEGAN5.0软件将测序得到的物种相对丰度信息与系统进化树相结合,从分类系统的角度更加精确地解析4种高温大曲中微生物的进化关系和相对丰度差异。高温大曲样品的真菌分类学树状图见图6。
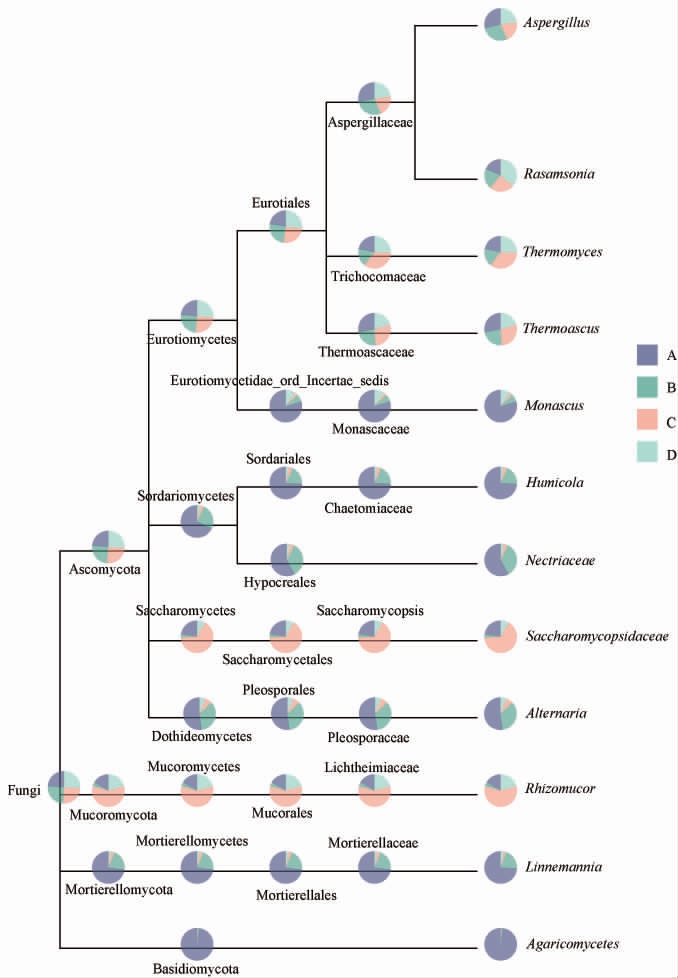
图6 基于属水平高温大曲样品中真菌分类学树状图
Fig.6 Taxonomic dendrogram of fungi in high-temperature Daqu samples based on genus level
饼状图面积越大,相对丰度越大。由图6可知,黄曲中Aspergillus的相对丰度均高于其他高温大曲;白曲中Thermomyces、Rhizomucor的相对丰度均高于其他高温大曲;黑曲Monascus的相对丰度高于其他高温大曲。此外,白曲Saccharomycopsis的相对丰度高于其他高温大曲,可能是由于白曲未发酵完全,根据JUNG M J等[26]的研究结果,随着发酵的进行,Saccharomycopsis发酵过程中数量迅速减少。因此,由于白曲未发酵完全,Saccharomycopsis还处在相对丰度较高阶段。综合以上分析,黄曲优于其他大曲。
3 结论
本研究采用高通量测序分析了金徽酒股份有限公司高温大曲的真菌群落结构,基于属水平对其真菌菌群进行聚类分析(CA)及主坐标分析(PCoA),并对其进行真菌菌群进行系统发育分析。结果表明,黄曲中真菌群落丰富度最高,其特有的扩增子序列变体(ASVs)为790个;黄曲中优势菌门为Ascomycota,优势菌属为嗜热真菌属(Thermomyces)、嗜热子囊菌属(Thermoascus)、曲霉属(Aspergillus)、红曲霉属(Monascus)等;CA及PCoA表明,在属水平下,黄曲与黑曲之间真菌群落结构相似度更高。真菌菌群系统发育分析表明,黄曲中Aspergillus的相对丰度均高于其他高温大曲。综合来看,黄曲中微生物种类多样,优势菌群明显,丰度较高,更符合实际生产要求。
基于高通量测序技术结合理化指标分析,初步探究了不同大曲中真菌多样性与群落结构的差异。因此,下一步将继续完善不同质量高温大曲中微生物与白酒风味物质之间的相关性研究,同时,获取不同高温大曲中的功能微生物,并进一步探索综合曲的比例,从而优化微生物群落的多样性,为研究功能性高温大曲中微生物对发酵性能和风味物质的影响提供了理论基础。
[1]唐佳代,刘力萍,龙亚飞,等.不同感官特性酱香大曲真菌群落结构与理化特性[J].食品科学,2022,43(14):193-198.
[2]张芮,刘文虎,张立强,等.基于宏基因组学解析高温大曲微生物群落与功能的异质性[J].酿酒科技,2023(5):70-77.
[3]WANG M Y,YANG J G,ZHAO Q S,et al.Research progress on flavor compounds and microorganisms of Maotai flavor Baijiu[J].J Food Sci,2019,84(1):6-18.
[4]张哲,郑佳,于学健,等.白酒中新菌种资源挖掘及未/难培养微生物培养策略研究[J].食品与发酵工业,2024,50(11):344-352.
[5]马叶胜,余苗,王冕,等.茅台镇8家酒企高温大曲的群落结构及其空间特征[J].轻工学报,2023,38(5):26-35.
[6]薄涛,吕娜,杨凯环,等.白酒大曲发酵过程中微生物群落及功能研究进展[J].食品科学,2023,44(19):385-393.
[7]杨阳,禄凌飞,刘光钱,等.不同发酵顶温大曲中细菌群落结构的差异性分析[J].食品与发酵工业,2023,49(13):70-77.
[8]YANG L, FAN W L, XU Y.GC×GC-TOF/MS and UPLC-Q-TOF/MS based untargeted metabolomics coupled with physicochemical properties to reveal the characteristics of different type Daqus for making soy sauce aroma and flavor type Baijiu[J].LWT-Food Sci Technol, 2021, 146:111416.
[9]GAN S H,YANG F,SAHU S K,et al.Deciphering the composition and functional profile of the microbial communities in Chinese Moutai liquor starters[J].Front Microbiol,2019,10:1-14.
[10]朱莹.酒药核心微生物解析及可控固态发酵的研究[D].无锡:江南大学,2023.
[11]郭松波.酱香型白酒风味和饮用品质特征的研究[D].天津:天津科技大学,2021.
[12]王玉荣,葛东颖,蔡文超,等.低温大曲真菌菌群结构解析及其风味品质评价[J].食品与发酵工业,2023,49(14):229-234.
[13]ZHOU Q F,MA K,SONG Y,et al.Exploring the diversity of the fungal community in Chinese traditional Baijiu Daqu starters made at low-,medium-and high-temperatures[J].LWT-Food Sci Technol,2022,162:113408.
[14]MU Y,HUANG J,ZHOU R Q,et al.Comprehensive analysis for the bioturbation effect of space mutation and biofortification on strong-flavor Daqu by high-throughput sequencing,volatile analysis and metabolomics[J].Food Chem,2023,403:134440.
[15]张芸曌.中高温大曲主发酵期微生物群落与环境因子及理化性质的关联性研究[D].自贡:四川轻化工大学,2019.
[16]印丽,邱树毅,曹文涛,等.酱香型白酒核心产区大曲的酶系分析[J].现代食品科技,2021,37(3):89-96.
[17]AMATO K R,YEOMAN C J,KENT A,et al.Habitat degradation impacts black howler monkey(Alouatta pigra)gastrointestinal microbiomes[J].ISME J,2013,7(7):1344-1353.
[18]孙羊羊,尹亚格,吴雨甍,等.基于高通量测序技术分析天津高温大曲微生物菌群多样性[J].中国酿造,2023,42(5):28-34.
[19]SHI J H,XIAO Y P,LI X R,et al.Analyses of microbial consortia in the starter of Fen liquor[J].Lett Appl Microbiol,2009,48(4):478-485.
[20]郭敏,黄永光,邱树毅,等.高通量测序在酱香白酒微生态多样性研究中的应用[J].中国酿造,2017,36(5):146-151.
[21]黄娜,张明,李子健,等.不同颜色酱香型大曲微生物群落结构及功能比较[J].食品与发酵工业,2024,50(4):260-266.
[22]孙利林,李立郎,胡萍,等.酱香型白酒大曲的微生物菌群结构及风味成分分析[J].现代食品科技,2020,36(8):299-306,193.
[23]杨凤英,秦洋,赵千慧,等.冠突散囊菌对大曲发酵性能、微生物区系以及白酒风味的影响[J].食品工业科技,2023,44(16):180-186.
[24]刘文虎,刘光钱,张芮,等.基于宏基因组解析中温大曲成熟前后的微生物群落功能差异[J].生物工程学报,2024,40(3):877-894.
[25]王乃军,马美荣.扣囊复膜酵母在白酒生产中的应用研究进展[J].酿酒科技,2023(3):115-119.
[26]JUNG M J, NAM Y D, ROH S W, et al.Unexpected convergence of fungal and bacterial communities during fermentation of traditional Korean alcoholic beverages inoculated with various natural starters[J].Food Microbiol,2012,30(1):112-123.